高一化学醛和酮PPT优秀课件
合集下载
第十一章醛和酮--精品PPT课件

NaBH4还原的特点: ①选择性强(只还原醛、酮、酰卤中的羰基,不还原其它基团。
②稳定(不受水、醇的影响,可在水或醇中使用)。
3. Meerwein-Ponndorf-Verley还原法
R
OH Al(OPr-i)3
R
O
O+
OH +
(H)R'
(H)R'
(二)还原为烃 1.吉尔聂尔-沃尔夫-黄鸣龙还原法
§11-1 结构、分类、同分异构和命名
一、结构
CO sp2 杂化
π键 σ键 CO
121.8。 H 116.5。 C O
H
近平面三角形结构
CO 电负性 C < O
π CO
π 电子云偏向氧原子
δδ CO 极性双键
二、分类
CH3CH2CH2CHO 脂肪醛
CHO
脂环醛
CHO
芳香醛
CH3CH=CHCHO 不饱和醛
R CH2 H(R') ① Kishner-Wolff-Huang Minlon 法 ② 硫代缩醛-脱硫加氢 ③ Clemmensen 法
(一)还原成醇
1.催化氢化
H
+
H2
O H + H2
O
Ni 压力
Ni
OH
H O
2. 用还原剂(金属氢化物)还原
(1)LiAlH4还原
CH3CH=CHCH2CHO
① LiAlH 4 干乙醚
O CH3 C CH2I
O
I2 快
CH3 C CHI2
O
I2 快
CH3 C CI3
O
OH-
CH3 C O- + CHI3
第十二章-醛和酮-ppt

若用KMnO4氧化,则 C=C 断开!
酮类一般不易被氧化;但工业上:
O
浓HNO3 铜钒催化剂
环己酮
CH2CH2COOH CH2CH2COOH
己二酸(尼龙-66原料)
(乙) 还原反应
(A) C=O [H] CH-OH [H]=H2/Ni、NaBH4 、LiAlH4 、[(CH3)2CHO]3Al 、 不还原双键!
2HCHO 浓NaOH HCOONa + CH3OH
甲醛
甲酸钠
甲醇
2
CHO 浓NaOH
苯甲醛
COONa +
苯甲酸钠
CH2OH
苯甲醇
若反应物之一是甲醛,则一定是甲醛被氧化,另一分子被还原:
CHO + HCHO 浓NaOH
CH2OH + HCOONa
本章重点:
①羰基上亲核加成反应; ②羟醛缩合反应、碘仿反应及Cannizarro反应; ③醛与Tollen’s及Fehlling’s的反应; ④羰基还原为羟基的反应,羰基还原为亚甲基的
(CH3)
① HCHO>CH3CHO>ArCHO>CH3COCH3>CH3COR>RCOR >ArCOAr 即: 醛的活性大于酮;脂肪族大于芳香族。
② p-NO2-C6H4-CHO>ArCHO>p-CH3-C6H4-CHO ③ 例外:C6H5COCH3>(CH3)3CCOC(CH3)3 (后者的空间位阻大) 反应范围:所有的醛、脂肪族甲基酮、八个碳以下的环酮。
(2) α-氢原子的反应
(甲) 卤化反应 (乙) 缩合反应
(3) 氧化和还原
(甲) 氧化反应 (乙) 还原反应 (丙) Cannizzaro反应(岐化
反应)
(五) 醛和酮的化学性质
醛和酮幻灯片.pptx

R
R C O + NH2 OH 羟胺 OH
[R C NH OH] -H2O R C N OH
R
R
肟
R R C O + NH2 NH2
肼
R C N NH2
R
腙
第28页/共81页
R R C O + NH2 NHC6H5
苯肼
R C N NHC6H5
R
苯腙
R R C O + NH2 NHCONH2
氨基脲
R C N NHCONH2
3-甲基丁醛 3-methylbutanal
CH3CH2CCH2CH3 O
3-戊酮 3-pentanone
第6页/共81页
CH3CHCHO
CHO
2-苯基丙醛 2-phenylpropanal
COOH
对甲酰基苯甲酸 4-formylbenzoic acid
CH3CHCH2CHO OH
3-羟基丁醛 3-hydroxylbutanal
CHO
第41页/共81页
❖用金属氢化物加氢:LiAlH4或NaBH4,可以把羰基还原为醇羟基,反 应机理是提供负氢离子对羰基进行亲核加成。
-
O
-
OAlH3
OH
H AlH3
C
C
H2O
C
H
H
LiAlH4
CH3CH CHCH2CHO orNaBH4 CH3CH CHCH2CH2OH
第42页/共81页
❖Meerwein-Ponndorf-Verley还原法:在异丙醇铝的存在下,以异丙醇 为还原剂,反应中只还原醛或酮的羰基,而不影响分子中的其他基团。
CH CHO CH2O HOCH2 CH2OH
《醛和酮的》PPT课件

通式
此方法用于制备醇
1o醇 2o醇
甲醛
醛 3o醇
酮
精选ppt
39
与有机金属锂试剂的反应
O
O H
+ (C H 3 )2 C H C C H (C H 3 )2 (C H 3 )2 C H L i H 3 O +(C H 3 )2 C H C C H (C H 3 )2
H O O H
例二:
转化
O
COC2H5 O
CH2OH
O
II: 还原C=O生成CH2
精选ppt
33
(3) 与氢氰酸加成 RHC O HCN
R OH
C H
CN
α -氰醇
(α -羟基腈)
H2O H+
H
R C COOH OH
α -羟基酸
A: 反应在酸性条件下难以进行,在碱性条件下易进行
B: α-羟基腈多官能团中间体
26
(1) 水合反应
H 3C C O + H 2O
H
H 3C O H C
H O H
平衡偏向左边
机理:
精选ppt
27
(2)与醇的缩合
A. 反应通式:
半缩醛羟基
R H C=O
HOR/
干HCl
R OH H C OR/
R/OH,H+
R OR/ H C OR/
+
H2O
半缩醛
缩酮
(不稳定)
I:
II: 反应为平衡反应,除水可使平衡向右移动
(2)乙烯催化氧化 ➢乙酸、乙酸乙酯的原料
精选ppt
15
3、丙酮
➢无色液体 ➢工业制备
❖丙烯水化 ❖异丙苯制苯酚的付产物 ❖丙烯催化氧化
3.3.2 醛、酮 课件(共23张PPT) 人教版(2019)选择性必修三

环节三:归纳整理,练习巩固
归纳整理
官能团 官能团位置
结构通式 化学 加成反应 性质 氧化反应
联系
醛
酮
醛基:—CHO 碳链末端
(最简单的醛是甲醛)
RCHO
(R为烃基或氢原子)
酮羰基:—CO— 碳链中间
(最简单的酮是丙酮)
RCOR′
(R、R′均为烃基)
均可与H2、HCN加成
能被银氨溶液、新制氢氧 不能被银氨溶液、新制氢氧化
O ‖ CH3—C—CH3
空间充填模型 球棍模型
①物理性质 常温下,丙酮是无色透明的液体,沸点56.2 ℃,易挥发,能与 水、乙醇等互溶。
环节二:微观辨析,辨识酮的微观结构
最简单的酮——丙酮
1.燃烧 2、不能被银氨溶液、新制的氢氧化铜等弱氧化剂氧化
+H2
催化剂 △
+HCN
催化剂 △
环节二:微观辨析,辨识酮的微观结构
化铜等弱氧化剂氧化
铜等弱氧化剂氧化
碳原子数相同的饱和一元脂肪醛和饱和一元脂肪酮互为同
分异构体
环节三:归纳整理,练习巩固
归纳整理
环节三:归纳整理,练习巩固
习题追踪
1.下列说法错误的是( B )
A.甲醛是一种有特殊刺激性气味的无色气体,是新装修家庭中 的主要污染物 B.福尔马林是甲醛的水溶液,具有杀菌、防腐性,可用于保鲜鱼肉等食品 C.苯甲醛属于芳香醛,是制造染料、香料及药物的重要原料 D.丙酮是一种重要的有机溶剂和化工原料。例如,钢瓶贮存乙 炔时,常用丙酮作 为溶剂溶解乙炔
HCHO +4Cu(OH)2+2NaOH
Na2CO3+2Cu2O↓+6H2O
环节一:学以致用,升华对醛的认识
醛和酮中文PPT课件

羟醛缩合反应历程
3-羟基丁醛 50%
第一步:在碱作用下,生成烯醇负离子
第二步:负离子作为亲核试剂与另一分子乙醛发生亲核加成,生成烷氧负离子
第32页/共65页
33
-羟基醛受热时容易失去一分子水,生成,-不饱和醛
巴豆醛 • 凡碳上有氢原子的-羟基醛都容易失去一分子水,生成——烯醛。 • 含有氢原子的酮也能起类似反应,生成,-不饱和酮
例1 例2
• 一卤代醛、酮往往可以继续卤化成二卤代、三卤代产物
第35页/共65页
36
• -卤代醛、酮反应的历程 碱催化(不易控制,直至同碳三卤代物,易被碱分解):
烯醇负离子
• 卤代物继续反应:
第36页/共65页
37
(B) 酸催化历程
酸催化可停 留在一卤代
• 由于卤原子是吸电子的, 碳上的氢原子在碱作用下容易离去,因此第二个 氢原子更易被取代.
• 氨衍生物对羰基的加成一般可在弱酸催化下进行,其历程和醇对羰基的加成 相类似。
• 醛酮与氨衍生物的反应,也常用来对羰基化合物的鉴定和分离: (1)生成物为具有一定熔点的固体,可利用来鉴别醛酮; (2)它们在稀酸作用下可水解成原来的醛酮,因此可利用来分离、提纯醛 酮。
第25页/共65页
鉴定和分离 m.p. 126℃
23
第23页/共65页
24
(5)与氨的衍生物反应 • 与氨的衍生物,例如:羟胺(NH2OH),肼(NH2NH2),
2,4-二硝基苯肼和氨基脲等反应.
例1:
例2:
例3: 例4:
第24页/共65页
25
• 醛酮与氨衍生物的反应历程:
第一步:羰基的亲核加成,生成不稳定的加成产物;
第二步:失去一分子水.
鲁科版高中化学有机化学基础选修醛和酮课件(1).ppt
鲁科版高中化学有机化学基础选修 醛和酮
CH3 氢
CH2 键
CH3 CH2
CH3 CH2
O H
H
O H O
H
O H O
CH2
CH2
CH3
CH3
鲁科版高中化学有机化学基础选修 醛和酮
(2)溶解性:阅读P56倒数第二段
甲醇、乙醇、丙醇均可与水以任意比例混溶, 这是因为它们与水形成了氢键。
乙二醇的沸点高于乙醇,1,2,3—丙三醇 的沸点高于1,2—丙二醇, 1,2—丙二醇的 沸点高于1—丙醇,其原因是:
[练习] 写出下列醇的名称
CH3 ① CH3—CH—CH2—OH 2 —甲基— 1 —丙醇
OH ② CH3—CH2—CH—CH3 2 —丁醇
CH3 CH3 ③ CH3—CH—C—OH
CH2—CH3 2,3 — 二甲基 — 3 —戊醇
鲁科版高中化学有机化学基础选修 醛和酮
3、醇的同分异构体 醇类的同分异构体可有: (1)碳链异构、 (2)羟基的位置异构, (3)相同碳原子数的饱和一元醇和醚是官 能团类型异构(包括芳香醇、酚、芳香醚)
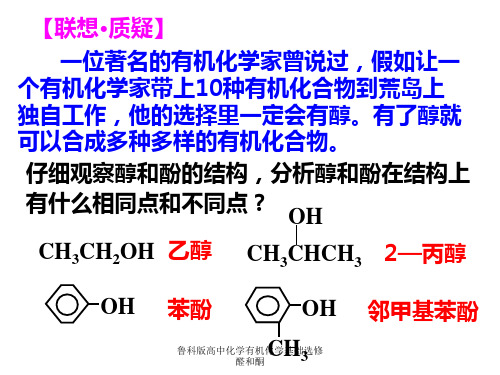
【联想·质疑】
一位著名的有机化学家曾说过,假如让一 个有机化学家带上10种有机化合物到荒岛上 独自工作,他的选择里一定会有醇。有了醇就 可以合成多种多样的有机化合物。
仔细观察醇和酚的结构,分析醇和酚在结构上 有什么相同点和不同点? OH
CH3CH2OH 乙醇 CH3CHCH3 2—丙醇
OH
苯酚
OH
CH 鲁科版高中化醛学和有酮机化学基础3选修
醛和酮
乙二醇 丙三醇
2、饱和一元醇的命名(P55) (1)选主链: 选最长碳链,且含—OH (2)编 号: 从离—OH最近的一端开始编号 (3)写名称:
CH3 氢
CH2 键
CH3 CH2
CH3 CH2
O H
H
O H O
H
O H O
CH2
CH2
CH3
CH3
鲁科版高中化学有机化学基础选修 醛和酮
(2)溶解性:阅读P56倒数第二段
甲醇、乙醇、丙醇均可与水以任意比例混溶, 这是因为它们与水形成了氢键。
乙二醇的沸点高于乙醇,1,2,3—丙三醇 的沸点高于1,2—丙二醇, 1,2—丙二醇的 沸点高于1—丙醇,其原因是:
[练习] 写出下列醇的名称
CH3 ① CH3—CH—CH2—OH 2 —甲基— 1 —丙醇
OH ② CH3—CH2—CH—CH3 2 —丁醇
CH3 CH3 ③ CH3—CH—C—OH
CH2—CH3 2,3 — 二甲基 — 3 —戊醇
鲁科版高中化学有机化学基础选修 醛和酮
3、醇的同分异构体 醇类的同分异构体可有: (1)碳链异构、 (2)羟基的位置异构, (3)相同碳原子数的饱和一元醇和醚是官 能团类型异构(包括芳香醇、酚、芳香醚)
【联想·质疑】
一位著名的有机化学家曾说过,假如让一 个有机化学家带上10种有机化合物到荒岛上 独自工作,他的选择里一定会有醇。有了醇就 可以合成多种多样的有机化合物。
仔细观察醇和酚的结构,分析醇和酚在结构上 有什么相同点和不同点? OH
CH3CH2OH 乙醇 CH3CHCH3 2—丙醇
OH
苯酚
OH
CH 鲁科版高中化醛学和有酮机化学基础3选修
醛和酮
乙二醇 丙三醇
2、饱和一元醇的命名(P55) (1)选主链: 选最长碳链,且含—OH (2)编 号: 从离—OH最近的一端开始编号 (3)写名称:
3.3 醛酮 课件(共20张PPT) 人教版(2019)选择性必修三

CH3 CH CH3
思考与讨论 丙酮是丙醛的同分异构体吗?可采用哪些方法鉴别它们? 是,二者的分子式都是C3H6O
OH H3C-CH-CN
2-羟基丙腈
加成反应
在醛基的碳氧双键中,由于氧原子的电负性较大,碳氧双键中的电子偏 向_氧__原__子___,使氧原子带部分_负__电__荷__,碳原子带部分_正__电__荷__,从而使 醛基具有较强的极性。乙醛也能和一些极性试剂发生加成反应。
δ-
O
δ+
-C-H
当极性分子与醛基发生加成反应时, 带正电荷的原子或原子团连接在_氧__原__子_上,
带负电荷的原子或原子团连接在_碳__原__子_上。
2.常见的醛类
(1)甲醛 物理性质
◆最简单的醛 ◆又称蚁醛 ◆无色、有强烈刺激性气味的气体 ◆易溶于水 ◆甲醛水溶液(又称福尔马林),具有杀菌、 防腐性能,可用于消毒和制作标本
△
HCHO+4Ag(NH3)2OH
2Ag↓+(NH4)2CO3+6NH3+2H2O
2.乙醛的结构
分子式: C2H4O O
官能团: C H (-CHO)
HO 结构式: H—C—C—H
H 结构简式: CH3CHO
吸收强度
10 8
6
4
2
0
δ
3.乙醛的化学性质
氧化反应
①可燃性
点燃
2CH3CHO+5O2
4CO2+4H2O
②催化氧化
在催化剂作用下,被空气中的氧气氧化为乙酸
2CH3CHO + O2
最简单的酮
丙酮
物理性质
用途
◆无色透明的液体 ◆沸点56.2℃,易挥发 ◆能与水、乙醇等互溶
《醛和酮教学》课件

醛和酮具有致癌性,长期接触可 能导致癌症
醛和酮具有挥发性,容易扩散到 空气中,对环境和人体健康造成 危害
醛和酮的安全操作规程
操作前必须穿戴防护服、手套和 口罩等防护用品
操作过程中保持通风,避免吸入 有害气体
避免皮肤直接接触醛和酮,如有 接触应及时清洗
操作结束后,及时清理现场,确 保安全无隐患
醛和酮的防护措施
佩戴防护眼镜和口 罩,避免直接接触
保持通风,避免长 时间接触
使用防护手套和防 护服,避免皮肤接 触
定期进行安全培训 ,提高安全意识
醛和酮的应急处理方法
立即离开事故现场,到空气新鲜的地方,保持呼吸道通畅
皮肤接触后应立即脱去污染的衣物,用肥皂水或清水彻底冲洗
眼睛接触后应立即提起眼睑,用大量流动清水或生理盐水彻底冲洗
酮的还原反应: 在催化剂作用下, 酮被还原为醇
反应条件:催化 剂、加热、加压 等
反应产物:醇
应用:合成有机 化合物、药物合 成等
氧化反应
酮的氧化反应: 酮在空气中可 以被氧化为羧
酸
氧化剂:常用 的氧化剂包括 氧气、过氧化
氢等
反应条件:通 常在加热或光 照条件下进行
产物:酮的氧 化产物为羧酸, 如丙酮氧化为
亲核加成反应
反应类型:亲核加成反应
反应条件:碱性条件下
反应产物:加成产物
反应机理:亲核试剂进攻羰基碳,形成碳负离子,然后与亲核试剂结合生成加成 产物。
醛的亲电加成反应:醛与亲电试剂 (如HCN、H2O、HBr等)发生 加成反应,生成相应的加成产物。
亲电加成反应
加成反应条件:醛的亲电加成反应 通常在碱性条件下进行,以促进羰 基碳原子的亲核性。
醛的化学性质
高中化学第二章第3节醛和酮糖类课件人教选修5.ppt

O
︱ ︱︱
–C–C–H
︱
氧化数:+2-1=+1
O
︱ ︱︱ ︱
–C–C–C–
︱︱
氧化数:+2
加成反应、氧化反应、还原反应
与乙醛的加成
试剂名称 氢氰酸
化学式及电荷分布 δ+ δH CN
氨及氨的衍生物 (以氨为例)
δ+ δH NH2
醇类 (以甲醇为例)
δ + δH OCH3
加成产物
︱OH
H C CN
CH3
知识点:
1.醛和酮的概述 2.醛、酮的化学性质:加成反
应ቤተ መጻሕፍቲ ባይዱ氧化反应、还原反应 3.糖类
一、醛、酮的概念
甲醛 HCHO
乙醛 CH3CHO
丙醛 CH3CH2CHO
丙
H OH
酮H C C C H
H
H
最简单的醛 最简单的酮
1.命名 书P69 2.同分异构体 例:C5H10O 3.常见的醛、酮 书P70
根据醛、酮的官能团预测化学性质
△
→CH3COONH4+2Ag↓+3NH3+H2O
实验步骤:将配制好的银氨溶液与乙醛混合,置于
60℃~70 ℃的水浴加热。
被氧化
NH3
CH3CHO CH3COOH CH3COONH4
被还原
Ag+
Ag
活动:1、该反应的用途 2、试管壁上附着的银镜要如何清洗?
实验后,银镜用HNO3浸泡,再用水洗
实验成功的关键 (1)试管内壁必须洁净; (2)必须水浴; (3)加热时不可振荡和摇动试管; (4)须用新配制的银氨溶液;
CnH2n+2O
3.3 醛、酮 课件(共27张PPT) 人教版(2019)选择性必修三

O H-C-H
O H-C-O-H
O H-C-O-CH3
甲醛简介
甲醛又称蚁醛,是无色、有刺激性气味的气体,有毒,易溶于 水。 甲醛用途非常广泛,是重要的有机合成原料;35%-40%的甲 醛水溶液叫福尔马林,具有杀菌、防腐性能。 在烃的含氧衍生物中,甲醛是唯一常温呈气态的物质。 甲醛毒性较高, 是主要的室内污染物,已被确定为致癌和致 畸形物质,是公认的变态反应源,也是潜在的强致突变物之一。
化学性质 氧化反应
HO
HO
2H-C-C-H
+ O2
催化剂
△
2H-C-C-O-H
H
H
乙醇
乙醛 乙酸 氧化(脱氢)
氧化(加氧)
还原(加氢)
化学性质 氧化反应
2ml 10% NaOH
2% CuSO4 4~6滴振荡
0.5 ml 乙醛
加热 煮沸
实验现象 蓝色絮状沉淀
砖红色沉淀
反应原理 Cu2++2OH-= Cu(OH)2↓ CH3CHO + 2Cu(OH)2 +NaOH △ CH3COONa + Cu2O↓+ 2H2O
有弱氧化性 Ag+表现氧化性
➢ CH3CHO + 2Ag(NH3)2OH △ CH3COONH4 +3NH3+ 2Ag↓+ H2O
乙酸与NH3·H2O 反应得到
无↑,因NH3 极易溶于水
1mol-CHO~2 molAg(NH3)2OH~ 2 mol Ag
【思考】1 mol甲醛最多可以还原得到多少 Ag? 甲酸能发生银镜反应吗? 甲酸甲酯能发生银镜反应吗?
【思考】将甲醛、乙醛混合发生上述反应,产物有多少种? 需断裂醛基的π键和α-C上的碳氢键,但甲醛无α-C。
《醛和酮》教学课件

A+, 快
R OA C
R' Nu
OH RR'C CN
OH RR'C SO3Na
OH RR'C OR
OH
RR'C OH OH
RR'C NHNH2 OMgX
RR'C R''
上页 下页 首页 18
第九章 醛和酮 第二节 化学性质 (一、亲核加成)
1. 加HCN —— a-羟腈(又叫氰醇 cyanohydrins)
4.命名脂环酮时,从羰基碳原子开始编号,在名称前加 “环”字; 不饱和醛酮,“某烯醛(酮)”
CH3
3-甲基环己酮
O
3-methylcyclohexanone 10
第九章 醛和酮 第一节 分类和命名 (二、命名)
O CH3CH2CCH2CHCH2CH3
HO-CHCH3
5-乙基-6-羟基-3-庚酮
11
H HO-CH2-CH2-CH2-C=O
OH H 89%
H
HO-CH2-CH2-CH2-CH2-C=O
OH H 94%
上页 下页 首页 27
第九章 醛和酮 第二节 化学性质 (一、亲核加成)
缩醛或缩酮对碱、氧化剂、还原剂稳定,但易被酸的水 溶液水解为原来的醛酮。因此常常用生成缩醛或缩酮的方 法来保护羰基,保护完毕再用稀酸水解脱掉保护基。
H+ -C N + R C R' O
CN
R C R' + H+
O-
CN R C R' 氰醇
OH
O CH3 C H + HCN
OH CH3 C H α-羟基丙腈
CN
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
) 2H5CHOH CN
甲 ( C 2H5CH2OH
①H2,△
C
③HCN
2H5CHO
④Cu(OH)2
C 2H5COOH
丙( )
)②O2,Cu
(1)上述反应中分子里碳链增长的反应是
(2)各物质分子中含氧的官能团是:甲
乙
丙
课后作业
• 查阅资料,调查你的生活中哪些物 质用到了醛和酮?它们有什么作用?
请以乙醇为原料(无机试剂任选)制 备乙酸乙酯,设计合成路线,完成有关 化学反应的方程式。
H2
O2或Ag(NH3)2OH 或新制Cu(OH)2
醛(-CHO)
羧酸 (-COOH)
酮( C=O)
难氧化
与HCN、NH3、CH3CHO等加成
增长碳链,引入新的官能团
醛、酮在有机合成中是非常重要的中间产物。下 面列出了乙醛和一些有机化合物的转化关系,请 将各反应产物的结构简式填入相应的括号中。
C
乙(
还原反应
• CH3CHO + H2
CH3CH2OH
CH3CCH3 + H2 O
CH3CHCH3
OH
与乙醛的加成
Oδ -
CH3Cδ-H+
试剂名称
化学式及电荷分布 加成产物
氢氰酸
氨及氨的衍生物 (以氨为例)
醛类 (以乙醛为例)
δ+ δ-
H CN
δ+ δ-
H NH2
δ+δ-
H CH2CHO
︱OH
H C CN
CH3
︱OH
H C NH2 CH3
︱OH
H C CH 2CHO CH3
练一练
• 当堂达标训练
• 1.居室空气污染的主要来源之一是人们使用的各种装饰材 料。泡沫绝缘材料、化纤地毯、油漆、内墙涂料等会释放 出一种有刺激性气味的气体,该气体是
• A. 氨气
B. 二氧化硫
C. 甲烷
D. 甲醛
• 2.下列物质中不能与氢气(有催化剂存在)反应的是
FOR WATCHING
演讲人: XXX
PPT文档·教学课件
选修5《有机化学基础》
第三章 第二节 醛和酮 (2) -------醛和酮的化学性质
甲醛是房中头号“杀手”
如何避免 甲醛的危 害?
光触媒空气净化器
• 以纳米TiO2为主的 催化剂在光的照射 下产生极强氧化作 用的氢氧自由基, 甲醛等有害物质被 氢氧自由基氧化成 二氧化碳和水。
常见的氧化剂
强氧化剂:KMnO4(H+)溶液、浓硫酸、 硝酸、氧气……
CN
与极性试剂的加成
(R, )H
d+
d-
d+ d -
C O+A B
R
(R , )H剂的加成反应过程
增长了 一个碳 原子
CH3COH+CHN 一定条件
OH
CH3CH CN
α-羟基丙腈
O CH3C H
H
一定条件
+ NH2
OH
CH3 CH NH2
α-羟基乙胺
O CH3C H
弱氧化剂:银氨溶液[Ag(NH3)2OH]、 新制Cu(OH)2……
氧化反应
比比看:谁更易氧化?
HO
乙 醛H C C H
H
丙
H OH
酮H C C C H
H
H
设计实验:你如何检验桌上 的两瓶未知液体哪瓶是乙醛? 哪瓶是丙酮?
提供试剂: KMnO4(H+)溶液、
10%的NaOH溶液,2%的CuSO4溶液
• A.乙烯
B.乙醛
C.乙醇
D.苯
• 3.下列物质中,不能发生银镜反应的是
• A.C6H5—CHO B.HCOOC2H5
C.(CH3)2CHOH D.CH2OH(CHOH)4CHO
• 4.已知丁基共有四种。不必试写,立即可断定分子式为 C5H10O的醛应有
• A.3种
B.4种
C.5种
D.6种
THANKS
空气中的氧气就能氧化醛
• 2CH3CHO + O2
HCHO + O2
2CH3COOH
CO2 + H2O
甲醛是房中头号“杀手”
甲醛是如 何使人中 毒的?
加成反应
d-
乙 醛H
H C
O
Cd+ H
d+ d-
+ H-CN
H
d-
丙
H OH
d+ d-
酮H
C
C
d
+
C
H+
H-CN
H
H
H
CH3 –C–OH
CN
CH3 CH3 –C–OH
H
OH
+ CH 2CHO 一定条件 CH3 C CH2CHO
羟醛缩合
甲醛与蛋白质反应示意图
HOH H
H H OH
CC N CC N C C N
H
HO
NH32+
H2C O CH2 O
HH
COO-
C CN C C N C
OH
O HH O
CO NH2 CH2 O NH 2 CH2
有机合成的中转站
O2
醇(R-OH)
