大学物理热学 ppt课件
大学物理热力学PPT课件

02
对应态原理
不同物质在相同的对应状态下具有相同 的热力学性质。对应态参数包括对比压 强、对比体积和对比温度。
03
范德华方程与对应态 原理的应用
预测真实气体的性质,如液化温度、临 界参数等。
真实气体行为描述
压缩因子
描述真实气体与理想气体偏差程度的物理量,定义为Z = pV/nRT。对于理想气体,Z = 1;对于真实气体,Z ≠ 1。
细管电泳等。
固体熔化与升华过程分析
固体熔化
升华过程
熔化与升华的应用
固体在加热过程中,当温度达到 熔点时开始熔化,由固态转变为 液态。熔化过程中吸收热量,温 度保持不变。
某些物质在固态时可以直接升华 为气态,而无需经过液态阶段。 升华过程中也吸收热量,但温度 同样保持不变。
熔化与升华是物质相变的重要过 程,对于理解物质的热力学性质 和相变规律具有重要意义。同时, 在实际应用中也具有广泛用途, 如金属冶炼、材料制备等领域。
阿马伽分体积定律
混合气体的总体积等于各组分气体分体积之和,即V_total = V_1 + V_2 + ... + V_n。
理想气体混合物的性质
各组分气体遵守理想气体状态方程,且相互之间无化学反应。
范德华方程与对应态原理
01
范德华方程
对真实气体行为的描述,考虑了分子体 积和分子间相互作用力,形式为(p + a/V^2)(V - b) = RT,其中a、b为与物 质特性相关的常数。
维里方程
描述真实气体行为的另一种方程形式,考虑了高阶分子间 相互作用项,形式为pV = nRT(1 + B/V + C/V^2 + ...), 其中B、C等为维里系数。
大学物理第二十四讲 热力学第一定律、摩尔热容PPT课件

U
CV ,mT
i 2
RT
3104 J
2. Qp Cp,mT Cp,m (T2 T1) Cp,m (t2 t1)
t2
t1
Qp
Cp,m
t1
2Qp
(i 2)R
36C
t1 0C
19
例:热力学系统经历如图所示过程后回到初态a。设过 程 abc 中吸热600 J;过程 cda 向外放热450J,对外做 功-150J,求系统在 abc 过程中内能的增量及对外做功。
Please Criticize And Guide The Shortcomings
讲师:XXXXXX XX年XX月XX日
R(T2
T1)
o
VV
●等容过程中系统从外界吸收的热量全部转化为
系统的内能。
10
三、等压过程
dp 0
pV RT U i RT
2 Q U A
U
i 2
R(T2T1)ppA V2 V1
pdV
p(V2
V1 )
A
R(T2 T1)
o
V1
V2 V
Qp
U
A
i 2
R(T2
T1)
R(T2
T1)
Tb 2Ta Tc , Td Ta , Vc V3 4V1
所以
U
i 2
R(Td
Ta )
0
p
p2 a
Aab p2 (V2 V1) 2 p1V1 2 RTa
Abc
RTb
ln
Vc Vb
2 RTa
ln 2
p1
o V1
Acd p1(V2 V3 ) 2 p1V1 2 RTa
b 等温线
大学物理化学经典课件-3-热力学第二定律

05 热力学第二定律在工程技 术中应用
工程技术中不可逆过程分析
不可逆过程定义
在工程技术中,不可逆过 程指的是系统与环境之间 进行的无法自发逆转的能 量转换过程。
不可逆过程分类
根据能量转换形式,不可 逆过程可分为热传导、热 辐射、摩擦生热、化学反 应等多种类型。
不可逆过程影响
不可逆过程导致能量损失 和熵增加,降低系统能量 利用效率,并对环境造成 负面影响。
06 总结与展望
热力学第二定律重要性总结
热力学第二定律是自然界普遍适用的基本规律之一,它揭示了热现象的方向性和不可逆性,为热力学 的研究和应用提供了重要的理论基础。
热力学第二定律在能源转换和利用、环境保护、生态平衡等领域具有广泛的应用价值,对于推动可持续 发展和生态文明建设具有重要意义。
热力学第二定律的研究不仅深入到了热学、力学、电磁学等物理学各个领域,还拓展到了化学、生物学、 医学等其他自然科学领域,为多学科交叉研究提供了重要的桥梁和纽带。
提供了判断热过程进行方向的标准
根据热力学第二定律,可以判断一个热过程是否能够自发进行。如果一个热过程能够自发进行,那么它必须满足热力 学第二定律的要求。
为热力学的发展奠定了基础
热力学第二定律是热力学的基本定律之一,为热力学的发展奠定了基础。它揭示了热现象的本质和规律, 为热力学的研究和应用提供了重要的理论支持。
应用举例
在化学反应中,如果反应物和生成物处于同 一温度,则自发进行的反应总是向着熵增加 的方向进行。例如,氢气和氧气在点燃条件 下可以自发反应生成水,该反应的熵变小于
零,因此是一个自发进行的反应。
熵产生原因及影响因素
要点一
熵产生原因
熵的产生与系统的不可逆性密切相关。在不可逆过程中, 系统内部的微观状态数增加,导致系统的无序程度增加, 即熵增加。
大学物理热学ppt课件

热力学函数变化特点、相变潜热的计算
临界点及超临界现象
临界点的定义及性质、超临界流体的特点及应用
05 热辐射与黑体辐 射理论
热辐射基本概念及性质
热辐射定义
01
物体由于具有温度而辐射电磁波的现象。
热辐射特点
02
不依赖介质传播,具有连续光谱,温度越高辐射越强。
热辐射与光辐射的区别
气体输运现象及粘滞性、热传导等性质
粘滞性
气体在流动时,由于分子间的动量交换,会 产生阻碍流动的粘滞力。气体的粘滞性与温 度、压强有关。
热传导
气体中热从高温部分传向低温部分的现象 称为热传导。热传导是由于分子间的碰撞传 递能量实现的。气体的热传导系数与温度、
压强有关。
04 固体、液体与相 变现象
大学物理热学ppt课件
目录
• 热学基本概念与定律 • 热力学过程与循环 • 气体动理论与分子运动论 • 固体、液体与相变现象 • 热辐射与黑体辐射理论 • 热学在生活和科技中应用
01 热学基本概念与 定律
温度与热量
温度
表示物体冷热程度的物理量, 是分子热运动平均动能的标志。
热量
在热传递过程中所传递内能的 多少。
绝热过程
系统与外界没有热交换的热力学过程。 在绝热过程中,系统的温度变化完全 由做功引起。例如,绝热膨胀和绝热 压缩是常见的绝热过程。
多方过程与准静态过程
多方过程
系统状态变化时,其压强和体积同时发生变化的过程。多方过程的特征在于压强和体积的乘积(PV)的n次方保 持恒定,其中n为多方指数。多方过程包括等温过程、等压过程和等容过程等特例。
最概然速率
在麦克斯韦速率分布曲线中,有一个峰值对应的速率称为最概然速率,表示在该速率附 近分子数最多。
大学物理热力学基础PPT课件

d Q 微小热量 :
> 0 表示系统从外界吸热; < 0 表示系统向外界放热。
等价
2
精选PPT课件
上页 下页 返回 退出
二、热力学第一定律 (The first law of thermodynamics)
某一过程,系统从外界吸热 Q,对外界做功 W,系 统内能从初始态 E1变为 E2,则由能量守恒:
循环过程
V
1. 热力学第一定律适用于任何系统(固、液、气);
2. 热力学第一定律适用于任何过程(非准静态过程亦 成立)。
6
精选PPT课件
上页 下页 返回 退出
四、 W、Q、E的计算
1.W的计算(准静态过程,体积功)
F
(1)直接计算法(由定义)
系统对外作功,
2
W=1
Fdx
=
2
1
PS
dx
V2
W = PdV
W = 1 P dV =
RT
2
1
dV V
W
RTl nV( 2 ) V1
P1V1
ln(V2 V1
)
P1V1
ln(P1 P2
)
系统吸热全部用来对外做功。
思考:CT ( 等温摩尔热容量)应为多大?
15
精选PPT课件
上页 下页 返回 退出
§7.4 理想气体的绝热过程 (Adiabatic process of the ideal gas)
吸热一部分用于对外做功,其余用于增加系统内能。
14
精选PPT课件
上页 下页 返回 退出
三.等温过程(isothermal process) P
2024版(推荐)《大学物理》ppt课件

2024/1/27
1
目
CONTENCT
录
2024/1/27
• 课程介绍与教学目标 • 力学基础 • 热学基础 • 电磁学基础 • 近代物理初步 • 实验方法与技能培养 • 课程总结与展望
2
01
课程介绍与教学目标
2024/1/27
3
《大学物理》课程简介
课程性质
大学物理是理工科学生必修的一门基础课程,旨在培 养学生掌握物理学基本概念、原理和方法。
实验操作
熟练掌握实验仪器的使用方法和操作技巧,保证 实验的顺利进行。
数据处理和分析
对实验数据进行处理和分析,提取有用信息,得 出结论。
2024/1/27
36
典型实验案例分析与讨论
01
02
03
04
案例一
牛顿第二定律的验证。通过气 垫导轨上滑块的运动,验证牛 顿第二定律,加深对力和运动 关系的理解。
案例二
角动量守恒定律 内容、条件及应用
10
功和能
功的定义和计算
恒力做功、变力做功的计算方法
动能定理
内容、表达式、意义及应用
势能的概念和计算
重力势能、弹性势能等势能的计算方法
机械能守恒定律
内容、条件及应用
2024/1/27
11
03
热学基础
2024/1/27
12
温度与热量
温度的定义和单位
温度是表示物体冷热程度的物 理量,其单位是摄氏度(°C) 或华氏度(°F)。
加深对物理概念和规律的理解
通过实验现象的观察和分析,帮助学生加深对物理概念和规律的理解,提高物理素养。
2024/1/27
大学物理热力学基础PPT课件

大学物理 I 曹颖
8
15. 3 热力学第一定律、等值过程的应用 一、等容过程 气体容积保持不变 (dV = 0 ) 等容过程中的功 A = 0 (dV = 0) 等容过程内能
i RdT dE M (微小过程) 2 i M E 2 R(T2 T1 ) (有限过程)
内能仅与始末态温度有关。
3)循环过程的功: 正 循 环 A 0 净 A净~净面积 逆 循 环 A净 0 V
2018年10月7日星期日
大学物理 I 曹颖
22
热机:利用工作物质,不断地把热转化为功的装 置。其循环为正循环。A净> 0
高温热源 Q1
系统
A
(工作原理示意图)
Q2
低温热源
水 水蒸汽 废汽 水
' ' ' Q1 E1 A1 A2 A1 0 ' ' ' Q3 E3 A3 A2 A3 0
' A1
' A2
' A3
放热过程。 吸热过程。
2018年10月7日星期日
大学物理 I 曹颖
21
15. 6 循环过程 卡诺循环
一、循环过程 (系统)从某态经历一系列变化过程又回 到初态的(周而复始的)过程。 P b P-V 图上为一闭合曲线。 1)特性: E 0 a c 2)循环过程有正、逆之分。
内
i
ki
i
pi
对于理想气体,忽略分子间的作用 ,则
m i 平衡态下气体内能: E RT M2
2018年10月7日星期日
E理 Ek=E (T )
大学物理 I 曹颖
大学物理-热力学基础-课件
Wa
CV m (T2
T1)
p1V1 p2V2
1
本题用 Wa E 计算较方便
关键用绝热方程
T2
T1
( V1 V2
)
1
先求出 T2
p
p2
2 T2
T2' T1
Q0
p2'
2'
p1
TC
T1
1
o V2 V2' V1 10 V1 V
18.
*四. 多方过程 — 实际过程( 满足 PV n C)
绝热 n = ( CPm / CVm )
等温 n = 1 等压 n = 0
W p1V1 p2V2 n 1
满足 E CV (T2 T1)
Q Cn (T2 T1)
等体 n = ∞
p
可以证明
n= n=∞
n=1
Cn
(
n
n 1
)CV
n=0
o
V
19.
13 – 5 循环过程 卡诺循环
一. 循环过程
1. 特点 E 0 W = Q ( 热功转换 )
1
2
W
(2)热一定律 dQP dE PdV
o V1
V2 V
QP
E
V2 PdV
V1
v
i 2
R(T2
T1 )
P(V2
V1 )
7.
2.摩尔定压热容 CPm
1mol
:
CPm
dQp dT
理论值:
CPm
dE pdV dT
CVm
R
i2R 2
(近似)
实验值:查表 (精确)
QP
dQP
大学物理PPT完整全套教学课件pptx(2024)

匀速圆周运动的实例分析
3
2024/1/29
13
圆周运动
2024/1/29
01
变速圆周运动
02
变速圆周运动的特点和性质
03
变速圆周运动的实例分析
14
相对运动
2024/1/29
01 02 03
参考系与坐标系 参考系的选择和建立 坐标系的种类和应用
15
相对运动
2024/1/29
相对速度与牵连速度 相对速度的定义和计算
2024/1/29
简谐振动的动力学特征
分析简谐振动的动力学特征,包括回复力、加速度 、速度、位移等物理量的变化规律。
简谐振动的能量特征
讨论简谐振动的能量特征,包括动能、势能 、总能量等的变化规律,以及能量转换的过 程。
32
振动的合成与分解
2024/1/29
同方向同频率简谐振动的合成
分析两个同方向同频率简谐振动的合成规律,介绍合振动振幅、合 振动相位等概念。
5
大学物理的研究方法
03
观察和实验
建立理想模型
数学方法
物理学是一门以实验为基础的自然科学, 观察和实验是物理学的基本研究方法,通 过实验可以验证物理假说和理论,发现新 的物理现象和规律。
理想模型是物理学中经常采用的一种研究 方法,它忽略了次要因素,突出了主要因 素,使物理问题得到简化。
数学是物理学的重要工具,通过数学方法 可以精确地描述物理现象和规律,推导物 理公式和定理。
2024/1/29
适用范围
适用于一切自然现象,包括力学、热学、电磁学 、光学等各个领域。
应用举例
热力学第一定律、机械能守恒定律、爱因斯坦的 质能方程等。
2024版大学物理热学完整ppt课件

介绍根据制冷原理和应用领域划分的不同类型制冷技术,如压缩 式制冷、吸收式制冷、热电制冷等。
新型制冷技术介绍
简要介绍一些新兴的制冷技术,如磁制冷、声制冷等,并分析其 优缺点及发展前景。
25
常见制冷设备工作原理介绍
1 2
家用冰箱
详细介绍家用冰箱的结构、工作原理及性能指标, 包括压缩式制冷系统和吸收式制冷系统等。
分析制冷技术在环境保护(如 减少温室气体排放)和可持续 发展方面的应用前景,讨论其 在实现绿色低碳发展中的重要 作用。
2024/1/30
27
06
热学实验方法与技巧分享
2024/1/30
28
温度测量方法及误差分析
接触式测温法
利用热平衡原理,使测温元件与被测物体接触,达到热平衡后测量测温元件的物理量。
2024/1/30
5
热力学第一定律
2024/1/30
内容
热量可以从一个物体传递到另一个物体,也可以与机械能或其 他能量互相转换,但是在转换过程中,能量的总值保持不变。
数学表达式
ΔU=Q+W,其中ΔU表示系统内能的增量,Q表示系统吸收的 热量,W表示外界对系统做的功。
6
热力学第二定律
内容
不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源 取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微 增量总是大于零。
大学物理热学完整ppt课件
2024/1/30
1
contents
目录
2024/1/30
• 热学基本概念与原理 • 气体动理论与统计规律 • 热传导、对流与辐射传热方式 • 相变与相平衡原理及应用 • 热力学循环与制冷技术基础 • 热学实验方法与技巧分享
大学热学第十二讲 绝热过程PPT课件

p1V1
Aa
U2
U1CV,m(T2T1)
R 1
(T2
T1)
C p,m CV ,m R C p,m CV ,m
CV ,m
R
1
C p,m
1
R
四. 绝热过程 1.特点:
Q =0 pV = C
2.图示: 3.TFL: AU
4. 理想气体准静态绝热过程方程 5.理想气体绝热过程中的功
6. 理想气体的绝热过程的热容量
凹函数
P’’>0
p0
(2) -1次和-次双曲函数的关系
V0
仅有一个交点(V0,p0)!
(2) 等温线和绝热线的关系 仅有一个交点(V0 ,p0)!
从物理上看: 由交点V0继续压缩气体,体积变化 V
p ?
等温过程:Vn,T p
p
绝热过程: Vn,T p
p S p
T
V v0
绝热过程曲线变化速 度更快,更陡峭!
说明绝热线 要比等温线 陡。
p V
T
p V
p V
T
p V
p V
s
p
V
4.理想气体准静态绝热过程方程
思考题: . 理想气体的自由膨胀过程: 初末态温度不变,是一个等温过程,又来不及与 外界交换热量,是一个绝热过程,则:
pV C1 pV C2
该热力学过程的方程?
四. 绝热过程
V2 V1
V1 dV
p1V1
1
V21
V11
p1 V1 1V11V21V11
p1V1
1
V1 V2
1
1
Aa
p1V1
1VV12Fra bibliotek1 1
大学物理热学第十三章 热力学基础 PPT

Mayer公式
•摩尔热容比
CP,m i 2
CV ,m i
泊松比
CV ,m
i 2
R
Cp,m
CV ,m
R
i
2 2
R
单原子分子理想气体 i 3 1.67
双原子分子理想气体 i 5 1.40
多原子分子理想气体 i 6 1.33
pV m RT RT
M
Q CV ,m (T2 T1)
•过程曲线: p b T2
0
a T1 V
吸收得热量全部用来内能增加;或向外界放热以内能减小为代 价;系统对外不作功。
3、理想气体定体摩尔热容 CV ,m
•定义:1mol、等体过程升高1度所需得热量
•等体过程吸热 QV CV ,m (T2 T1)
•等体过程内能得增量
E
QV
i 2
R
T2
T1 CV ,m T2
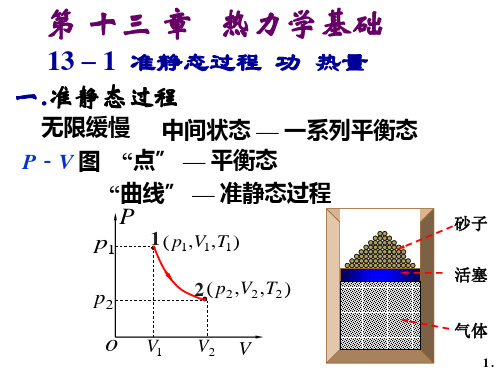
13-1 准静态过程 功 热量
一、准静态过程
可用P-V 图上得一条有
方向得曲线表示。
二、功
准静态过程系统对外界做功:
元功: dW Fdl pSdl pdV
dl
系统体积由V1变 为V2,系统对外 界作总功为:
V2
W= pdV
V1
p F S pe
光滑
注意:
V2
W= pdV
V1
1、V ,W>0 ;V ,W<0或外界对系统作功 ,V不变时W=0
V2 PdV
V1
i CV ,m 2 R
CP,m
CV ,m
CP,m CV ,m R
等容 等压
WV 0
QV CV ,m (T2 T1) E
QP Cp,m (T2 T1) CV ,m (T2 T1) P(V2 V1) WP P(V2 V1) R(T2 T1)
8大学物理 热力学第一定律PPT课件

室温下气体的 值
气体
He Ar H2 N2 O2 CO H2O CH4
理论值 (i2)/i 1.67 1.67 1.40 1.40 1.40 1.40 1.33 1.33
实验值 1.67 1.67 1.41 1.40 1.40 1.29 1.33 1.35
p
等 压
p
(p,V1,T1) (p,V2,T2)
p
A*
1
p
A*
1
2 *B
o
V
2 *B
o
V
W A 1 B Q A 1 B W A 2 B Q A 2 B W A 1 B 2 A Q A 1 B 2 A 0
理想气体内能 : 表征系统状态的单值函数 , 理想气体的内能仅是温度的函数 .
EE(T)mi RT M2
系统内能的增量只与系统起始和终了状态有 关,与系统所经历的过程无关 .
外界与系统之间不仅作功,而且传递热量,则有 Q ( E 2 E 1 ) A
Q E A E 2E 1A热力学第一定律 The first law of thermodynamics:系统在任一过程中 吸收的热量等于系统内能增量和系统对外作功之和。
第一定律的符号规定
Q
系统吸热 系统放热
E2 E1
内能增加
在此过程中系统向外界放出热量
18.3 热力学第一定律在等值过程中的应用 热容
计算各等值过程的热量、功和内能的理论基础
(1) pV m RT (理想气体的共性) M
dQdEpdV 解决过程中能
(2) QE V2 pdV 量转换的问题 V1
(3)EE(T)mi RT(理想气体的状态函数) M2
(4) 各等值过程的特性 .
大学物理热力学第二定律讲义省公开课获奖课件说课比赛一等奖课件

1
左3,右1
4
左2,右2 5 6 16
左1,右3
4
左0,右4
1
宏观状态
1
6
左4,右0
5
左3,右1
16
左2,右2
4 3
左1,右3 左0,右4
4
2
16
1
6
0
4个粒子旳分布
16
2. 等几率假设
孤立系统中 每个微观态出现旳几率相同 ˃
•分布越均匀,微观态数目越多.
1
—相应微观态数目多旳 宏观态出现旳几率大
由高温物体传向低温物体。相反过程不会自动
发生。 当然,用致冷机可把热量由
低温物体传向高温物体。但外
高温热库T1 Q1
界必须对工作物质做功,这就 A
工质
引起了其他效果。 有限温差热传导不可逆。
Q2 低温热库T2
3、气体旳绝热自由膨胀 (扩散)
膨胀:能够自动进行 压缩:不能自动进行。 气体向真空中自由膨胀旳过程是不可逆旳。
四、热力学基本方程
dS dQ T
由克劳修斯熵增旳公式有 dQ TdS
代入热力学第一定律,得
TdS dE dA
只有体积功时
TdS dE+pdV
----热力学基本方程
由热力学基本方程能够求熵
五、熵增旳计算
理想气体
1、用热力学基本方程求熵
dE n CVdT
TdS dE pdV
P n RT
V
例9.1 求n摩尔理想气体由态(T1,V1) 到
热量自动从低 温传到高温
T1
Q1
A净
Q2
T2
T1
Q2 克氏 T2
二、统计意义(微观解释 )
大学物理热力学(课件)

大学物理热力学(课件)大学物理热力学课件一、引言热力学是研究物质系统在温度、压力、体积等热力学参数变化时的宏观性质和行为的科学。
大学物理热力学课程旨在帮助学生理解热力学的基本概念、基本定律和基本方法,培养学生运用热力学知识解决实际问题的能力。
本课件将围绕热力学的基本原理、热力学第一定律、热力学第二定律、热力学第三定律和热力学状态方程等内容进行讲解。
二、热力学基本原理1.系综理论:热力学研究的是大量粒子的统计行为,系综理论是描述这些粒子行为的数学工具。
系综理论将系统划分为三个系综:微观系综、宏观系综和热力学系综。
2.状态量与过程量:热力学中,状态量是描述系统宏观状态的物理量,如温度、压力、体积等;过程量是描述系统在过程中变化的物理量,如热量、功等。
3.状态方程:状态方程是描述系统状态量之间关系的方程,常见的状态方程有理想气体状态方程、范德瓦尔斯方程等。
三、热力学第一定律1.定义:热力学第一定律是能量守恒定律在热力学领域的具体表现,表述为系统内能的增量等于热量与功的代数和。
2.表达式:ΔU=QW,其中ΔU表示系统内能的增量,Q表示系统吸收的热量,W表示系统对外做的功。
3.应用:热力学第一定律可以用于分析热力学过程中的能量转换和传递,如热机、制冷机等。
四、热力学第二定律1.定义:热力学第二定律是描述自然过程方向性的定律,表述为热量不能自发地从低温物体传递到高温物体。
2.表达式:ΔS≥0,其中ΔS表示系统熵的增量,熵是衡量系统无序程度的物理量。
3.应用:热力学第二定律可以用于分析热力学过程的可行性,如热机效率、制冷循环等。
五、热力学第三定律1.定义:热力学第三定律是描述绝对零度附近物质性质的特殊规律,表述为在绝对零度附近,完美晶体的熵趋于零。
2.表达式:S→0asT→0,其中S表示熵,T表示温度。
3.应用:热力学第三定律为低温物理学和制冷技术提供了理论依据。
六、热力学状态方程1.理想气体状态方程:pV=nRT,其中p表示压力,V表示体积,n表示物质的量,R表示理想气体常数,T表示温度。
[整理]大学物理-热学教学讲义PPT课件
![[整理]大学物理-热学教学讲义PPT课件](https://img.taocdn.com/s3/m/bd70cb5202d276a201292e13.png)
7
• 从 8 种可能性中作出判断所需信息量为 3 bit。 • 从 16 种可能性中作出判断所需信息量为 4 bit。 • 从 N 种可能性中作出判断所需信息量为 :
nlog2N
或
nKlnN
K = 1/ ln2 = 1.4427
作出判断所需 bit 数越大, 所缺信息量越多。
22
理由6-讓偶一為之的加班變得有趣
➢ 常常加班,同事之間會生膩,合作的興奮 感也全無。
➢ 如果大家平常準時下班,碰到緊急狀況或 工作時,大夥晚上一起留在辦公室;有人 從外面提了便當走進來,一邊吃飯、一邊 討論,這時候很容易顯出團隊合作的革命 情感。
8
例题 1. 13个外观相同的金币,其中一个是假的,其余均 相同,用一台无砝码天平,称几次可辩伪?
解:
可能情况
26
最大信息熵 每称一次可能情况
H lo 22 g 64 .70 bit 3
每称一次最大信息熵 需称次数
H 1lo23 g 1.58bit 4.702.973 (次) 1.58
9
例题 2. 遗传密码问题
或 SKlnN 信息熵单位:bit
玻氏熵 SklnΩ(k = 1.38 10-23 J/K)
玻氏熵单位:J/K 两者相比: K = k 1 bit = k ln2 (J/K)
14
“1 b要使计算机里信息量存储增加1bit, 则它 的熵必定减少 k ln2 = 0.95710-23(J/K),
大学物理-热学
* 熵与信息简介
一. 信息、信息价值评估 1. 信息 早年: 信息 — 消息 现代: 信息 — •人类所有的文化知识 •五官所感受的一切 2. 信息价值评估 • 量的不同 • 质的差别 例如,有名的短诗与无味的小说的比较。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
平衡态(equilibrium state):
在无外界影响的条件下,系统所有可观察的宏 观性质不随时间改变的状态。
如果与原来相同,A=A’, B=B’, C=C’, 我们称原来的三个系统处于
互相平衡(互为平衡)的状态
多个热接触系统的总热平衡 。总热平衡。 热平衡态的传递性:第零定律。
问题:两个(或多个)平衡系统热接触后,是否还能保持原来(即接触前)的平衡状态?
C物体 (平衡态C)
A物体 (平衡态A)
( 平 衡物 态体 )
,且只能描述平均行为,无法描述涨落)
▲ 统计力学(statistical mechanics)(微观方法)
对微观结构提 统计方法 出模型、假设
热现象规律
特点:可揭示本质,描述涨落,但受模型 局限。
热力学系统的各种分类 按系统与外界交换特点分: 孤立系统:与外界既无能量又无物质交换的系统 封闭系统:与外界只有能量交换而无物质交换的系统 开放系统:与外界既有能量交换又有物质交换的系统 绝热系统:与外界没有热量交换的系统
微观粒子体系的基本特征:
(1) 非常小。 (2) 微观粒子数非常巨大. (3)粒子之间存在相互作用力--分子力. (4)分子或原子都以不同的速率不停地运动(是杂乱无 章的)。
热学的研究方法
▲ 热力学(thermodynamics)(宏观方法)
宏观基本实验规律 逻辑推理 热现象规律
特点:普遍性、可靠性。(但无法给出更本质的解释
B B’
B B
A物体 (平衡态A’)
( 平Байду номын сангаас
C物体 (平衡态C’)
衡物
态体
热接触)
热平衡态的传递性:如果A与B互相平衡, B与C互相平衡,那么一 定有A与C也互相平衡。(热力学第零定律)
A与B互相平衡的意思是:虽然热接触允许它们之间作热交换,但它们间实际上 已没有热交换发生。
引入温度的目的:如何判断平衡系统A、B是否互为平衡的, 相差多远,如让
热平衡 多个系统通过热接触实现的总热平衡
问题:两个(或多个)平衡系统热接触后,是否还能保持原来(即接触前)的平衡状态?
C物体 (平衡态C)
A物体 (平衡态A)
( 平 衡物 态体 )
B B’
B B
A物体 (平衡态A’)
(
C物体
平 (平衡态C’)
衡物
态体
热接触)
有三个平衡系统 A,B,C
让它们热接触,并看作一总系统。 总系统达到平衡后,各子系统的状态 A’, B’, C’,一般与原来的不同。
它们做热接触时,热量将向何方向转移?
设有A,B两个平衡系
统。
问题:
如何方便地判断它们是
C
否还是
A物体
互相平衡的?
系统所受外界影响可以略去,宏观性质只有很 小变化(时2,)可平近衡似态看是作一是种平理衡想态概。念。
系统所受外界影响,且宏观性质不变化时,称 系统处于稳定态。
热接触:
如果两个(或多个)系统之间的器壁不 绝热,它们之间可以传热,或导热
,则称之为"热接触"。
热接触
热接触的系统之间可以有能量传递。这种能量的流动方式 称作“热量”,以区别于,比如,通过作“功”发生的机 械能传递。
平衡条件:
(1) 系统与外界在宏观上无能量和物质的交换, (2) 系统的宏观性质不随时间改变。
非平衡态: 不具备两个平衡条件之一的系统.
设一容器,用隔板将其隔开,当 隔板右移时,分子向右边扩散
在这过程中,各点密度、温度等均不相同,这就是 非平衡态。但随着时间的推移….
隔板
抽去隔板
...........................
按系统组成的化学成分分:
单元系:由一种化学成分组成的系统,如氧气 多元系:由多种化学成分组成的系统,如空气
按系统组成均匀性分:
单相系:由单一均匀成分构成的系统,如水、 多相系:由多个均匀成分组合的系统,如水与水蒸汽组合的系统
物态
热学的两部分内容: (1) 热力学:学习静止物体的不同状态、 它们的能量差别,状态发生转变的规律等。
需要保温的原因是:系统可能会以你不容易察觉的方式偷偷地通过容器壁
与外界交换着某种东西:热=一种能量流动的模式。
实验室里,绝热=保温,最常见的办法是用: 杜瓦瓶=开水瓶。 因此,“用杜瓦瓶实现绝热”的山寨版说法就是“用开水瓶保温”。
两点说明:
(1处)在平平衡衡态态是的一大种量热分动子平仍衡在;作热运动,而 且因为碰撞, 每个分子的速度经常在变 ,但是系统的宏观量不随时间 改变。
(为简单起见,忽略与物体运动,几何变形等力学课中相关的东西)。 (2) 分子运动论:学习分子运动的某些规律和描述方法, 以及它们与热力学之间的联系。
(分子:指组成物质的微观粒子。)
具体内容特点: 以气体为主,以气体为例来学习相关概念和原理。其中的一些 基本东西是普遍适用的,液体、固体等任何物体都必须遵守它 。
实际上,平衡态概念在热学中有着与惯性概念在力学中的同等重要地位。 可以说是热学中的“惯性”状态,是个安静老实的状态。
?如何实现这个平衡态,比如气体?
日常经验告诉我们,除了要把它盖严,让它安静地不受机械扰动外,还需要
(1)尽量“绝对”地保温,(2)有时还要耐心地等一段时间τ。
(系统从非平衡态过渡到平衡态所经历的时间,叫弛豫时间)
.............................. ...............................
开始
扩散 (非平衡态)
终了 (平衡态)
平衡态:孤立系统所长期维持的状态。
孤立: 不受干扰,不与系统外的其它物质发生任何关系 (发生相互作用,或交换任何东西)。
注意:“孤立=无相互作用”,“长期维持的状态”,这两个特色表明, “平衡态”概念与“惯性”运动概念非常相似。
热学
热学的研究对象及内容
▲ 对象:宏观物体(大量分子原子系统)
或物体系 — 热力学系统 。
例如汽缸中
的气体:
外界 系统
外界
外界:热力学系统以外的、与系统相关的其它物体。
▲内容:与热现象有关的性质和规律。
热现象 微 宏观 观上 上
说是与T温有度关; 说是与热运关动。有
宏观物体的微观模型: 大量微观粒子(分子、原子等)组成的宏观体系。
