气体动理论热力学基础
热学习题(答案)07-08

热 学 习 题 课 (2007.10.18)Ⅰ 教学基本要求 气体动理论及热力学1.了解气体分子热运动的图象。
理解理想气体的压强公式和温度公式。
通过推导气体压强公式,了解从提出模型、进行统计平均、建立宏观量与微观量的联系到阐明宏观量的微观本质的思想和方法。
能从宏观和统计意义上理解压强、温度、内能等概念。
了解系统的宏观性质是微观运动的统计表现。
2.了解气体分子平均碰撞频率及平均自由程。
3.了解麦克斯韦速率分布率及速率分布函数和速率分布曲线的物理意义。
了解气体分子热运动的算术平均速率、方均根速率。
了解波耳兹曼能量分布律。
4.通过理想气体的刚性分子模型,理解气体分子平均能量按自由度均分定理,并会应用该定理计算理想气体的定压热容、定体热容和内能。
5.掌握功和热量的概念。
理解准静态过程。
掌握热力学过程中的功、热量、内能改变量及卡诺循环等简单循环的效率。
6.了解可逆过程和不可逆过程。
了解热力学第二定律及其统计意义。
了解熵的玻耳兹曼表达式。
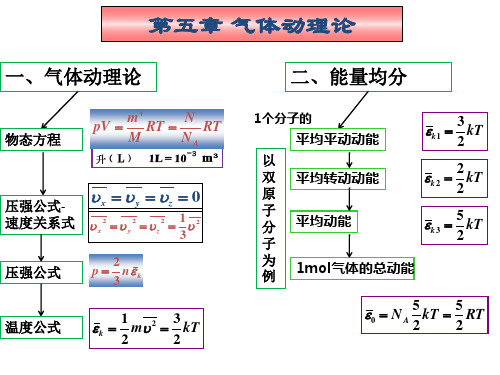
Ⅱ 内容提要一、气体动理论(主要讨论理想气体) 1.状态方程 pV =( M/M mol )RT pV /T = 常量 p=nkT2.压强公式32 3 322/ n /v /v nm p t ερ=== 3.平均平动动能与温度的关系232/2kT/v m w ==4.常温下分子的自由度 单原子 i=t=3 双原子 i=t+r =3+2=5多原子 i=t+r =3+3=6 5.能均分定理每个分子每个自由度平均分得能量 kT /2 每个分子的平均动能 ()kT i k /2=ε 理想气体的内能:E =( M/M mol ) (i /2)RT ; 6.麦克斯韦速率分律:22232)2(4d d v ekTm v N N )v (f kT mv -==ππmol2rms 33RT/MkT/m v v ===()()mol 88M RT/m kT/v ππ== mol22RT/MkT/m v p ==7.平均碰撞次数 v n d Z 22π= 8.平均自由程 ()n d 221πλ=二、热力学基础 1.准静态过程(略)2.热力学第一定律Q= (E 2-E 1)+A d Q =d E +d A 准静态过程的情况下()⎰+-=21d 12V V V p E E Q d Q=d E +p d V3.热容 C =d Q /d T定体摩尔热容 C V ,=(d Q /d T )V /ν 定压摩尔热容 C p ,=(d Q /d T )p /ν比热容比 γ=C p ,/C V, 对于理想气体:C V ,=(i /2)R C p ,=[(i /2)+1]R C p ,-C V ,=R γ=(i +2)/i4.几个等值过程的∆E 、 A 、 Q 等体过程 ∆E = (M/M mol )C V ,∆T A =0 Q=(M/M mol )C V ,∆T 等压过程 ∆E = (M/M mol )C V ,∆TA = p (V 2-V 1) Q=(M/M mol )C p ,∆T 等温过程 ∆E =0 A =(M/M mol )RT ln(V 2/V 1) Q =(M/M mol )RT ln(V 2/V 1)绝热过程 pV γ=常量Q=0 ∆E= (M/M mol )C V ,∆TA = -(M/M mol )C V ,∆T =(p 1V 1-p 2V 2)/( γ-1) 5.循环过程的效率及致冷系数:η=A /Q 1=1-Q 2/Q 1 w=Q 2/A =Q 2/(Q 1-Q 2) 卡诺循环: ηc =1-T 2/T 1 w c =T 2/(T 1-T 2) 6.可逆过程与不可逆过程(略)7.热力学第二定律两种表述及其等价性(略)8.熵 S=k ln Ω熵增原理 孤立系统中 ∆S >0Ⅲ 练习九至练习十五答案及简短解答练习九 理想气体状态方程热力学第一定律一.选择题B B A D B二.填空题1. 体积、温度和压强;分子的运动速度(或分子运动速度、分子的动量、分子的动能). 2. 166J. 3. (2),(3),(2),(3).三.计算题1. (1)由V =p a ,得p=a 2/V 2,所以A=()()⎰⎰-==21212122211d d V V VVV /V /a V V a V p (2)由状态方程p 1V 1/T 1= p 2V 2/T 2知T 1/T 2=( p 1V 1)/( p 2V 2)= (V 1a 2/V 12)/( V 2 a 2/V 22) = V 2/V 1四.证明题1.两结论均错误.(1).等容吸热过程有Q=∆E=(M/M mol )C V ∆T∆T= Q/[(M/M mol )C V ]而C V (H e )=3R /2, C V (N 2)=5R /2,C V (CO 2)=6R /2.因摩尔数相同,吸热相同,所以∆T (H e ):∆T (N 2):∆T (CO 2) = 1/[C V (H e )] :1/[C V (N 2)] :1/[C V (CO 2)] =1/3:1/5:1/6即 ∆T (H e )>∆T (N 2)>∆T (CO 2)(2)因为等容过程,有p/T =恒量,得∆p/∆T .所以 ∆p (H e )>∆p (N 2)>∆p (CO 2)练习十 等值过程 绝热过程一.选择题A D D B B二.填空题1. 在等压升温过程中,气体膨胀要对外作功,所以比等容升温过程多吸收热量.2. >0; >0.3. 2/(i +2); i /(i +2).三.计算题 1. 容器左右初始体积都为V 0,末了体积左为4V 0/3右为2V 0/3.因等温,气体对外作功为A=[p 1V 1ln(V 2/V 1)]左+[ p 1V 1ln(V 2/V 1)]右=p 0V 0ln[(4V 0/3)/V 0]+ p 0V 0ln[(2V 0/3)/V 0] = p 0V 0ln[(4/3)(2/3)]= p 0V 0ln(8/9) 外力作功为 A '= -A =p 0V 0ln(9/8)四.证明题1.过C 再作一条绝热线CM,过D 作一条等容线DM,构成一个循环.因C 在绝热线AB 的下方,依热力学第二定律,知绝热线不能相交,故M 必在绝热线AB 的下方,即M 在D 的下方.因DM 为等容线,有 T D >T A E D >E M 循环CDMC 为正循环,对外作正功,即A=A CD-A CM>0而Q CD=E D-E C+A CDQ CM=E M-E C+A CM=0所以Q CD=Q CD-Q CM =E D-E M+ A CD- A CM>0练习十一循环过程热力学第二定律卡诺定理一.选择题A B A D C二.填空题1. 33.3%; 50%; 66.7%.2. 200J.3. V2; (V1/V2)γ-1T1; (RT1/V2)(V1/V2)γ-1三.计算题1. 单原子分子i=3, C V=3R/2, C p=5R/2. ca等温T a=T cab等压V a/T a=V b/T bT b=(V b/V a)T a=(V b/V a)T c(1)ab等压过程系统吸热为Q ab=(M/M mol)C p(T b-T a)= (5R/2)(V b/V a-1) T c=-6232.5Jbc等容过程系统吸热为Q bc=(M/M mol)C V(T c-T b)= (3R/2)(1-V b/V a)T c=3739.5Jca等温过程系统吸热为Q ca=(M/M mol)RT c ln(V a/V c)= RT c ln2=3456J (2)经一循环系统所作的净功A=Q ab+ Q bc+ Q ca=963J循环的效率η=A/Q1= A/( Q bc+ Q ca)=13.4%2.(1)CA等容过程p C/T C=p A/T AT C= (p C/p A)T A=75KBC等压过程V B/T B=V C/T CT B=(V B/V C)T C=(V B/V C)(p C/p A)T A=225K (2)由γ= 1.40可知气体分子为双原子,所以i=5, C V=5R/2, C p=7R/2CA等容吸热过程A CA=0Q CA=∆E CA=(M/M mol)C V(T A-T C)=(M/M mol)( 5R/2)(T A-T C)= (5/2)(p A-p C)V C=1500JBC等压放热过程A BC=p B(V C-V B)=-400J∆E BC=(M/M mol)C V(T C-T B)=(5/2)(V C-V B)p C=-1000JQ BC=∆E BC+ A BC=-1400JAB过程A BC=(1/2)(p A+p B)(V B-V A)=1000J ∆E BC=(M/M mol)C V(T B-T A)= (5/2)(p B V B-p C V C)=-500JQ BC= A BC+∆E BC=500J练习十二热力学第二定律卡诺定理(续)熵一.选择题 D A B A C二.填空题1. 500K.2. 7.8 .3. 不能, 相交, 1.三.计算题1.(1) T1/T2=Q1/Q2T2=T1Q2/Q1=320K(2) η=1-Q2/Q1=20%2.(1)A da=p a(V a-V d)= -5.065⨯10-3J (1)∆E ab=(M/M mol)(i/2)R(T b-T a)= (i/2)(p b-p a)V a=3.039⨯104J(2)A bc=(M/M mol)RT b ln(V c/V b)=p b V b ln(V c/V b)=1.05⨯104JA=A bc+A da=5.47⨯103J(3)Q1=Q ab+Q bc=∆E ab+A bc=4.09⨯104Jη=A/Q1=13.4%练习十三物质的微观模型压强公式一.选择题C B D A B二.填空题4. 1.33×105Pa.5.210K; 240K.6.物质热现象和热运动的规律; 统计.三.计算题1. (1) 因T等,有()2O kε=()2H kε=6.21×10-21Jmvkε22==4.83m/s(2) T=2kε/(3k)=300K2.kε=3kT/2p=2nkε/3=2n(3kT/2)/3=nkT= (N/V) kT =[(M/M mol)N A/V] kT=(M/M mol)RT/V得pV =(M/M mol)RT练习十四理想气体的内能分布律自由程一.选择题A B D B C1 1 2) 1) a(T 1二.填空题1. 5/3; 10/3.2. 1.04kg/m3.3. 温度为T 时每个气体分子每个自由度平均分得的能量.三.计算题1.依状态方程:pV= (M/M mol )RT ,有M=( pV/RT ) M mol因氢气氦气的压强、体积、温度相等, 有M (H 2)/ M (H e )= M (H 2)mol /M (H e )mol =1/2 依 E=(i/2)(M/M mol )RT=(i/2)pV 注意到压强、体积相等, 有E (H 2)/ E (H e )=[(5/2) pV ]/[(3/2) pV ]= 5/32. 平均平动动能的总和E t =(3/2)(M/M mol ) RT =(3/2)(ρV /M mol )RT =7.31×106J 内能增加 ∆E=(i /2)(M/M mol ) R ∆T=(i /2)(ρV/M mol )R ∆T =4.16×104J2v 的增量 ∆(2v )=∆(mol 3M RT )=()[]T RT/Md 3d mol∆T=()[1mol 13T M R ∆T/2=0.856m/s练习十五 热学习题课一.选择题B A C B B二.填空题1. mu 2/(3k ).2. 速率区间0~v p 的分子数占总分子数的百分比; ()()⎰⎰∞∞=ppv v v v f vv vf v d d3. 1.5; 1; 3.25R .三.计算题1. (1)CA 等容过程 p C /T C =p A /T A 有T C = (p C /p A )T A =100KBC 等压过程 V C /T C =V B /T B 有T B = (V B /V C )T C = (V B /V C )(p C /p A )T A =300K (2)各过程对外作功A →B A AB = (p A +p B )( V B -V A )/2=400J B →C A BC = p B ( V C -V B )=-200J C →A A BC =0(3)因循环过程 ∆E=0 所以气体吸热为Q=∆E+A=A= A AB +A BC +A BC =200J2.(1)理想循环的p —V 图曲线如图:ab 绝热线,bc 等容线,ca (2) ab 绝热,有 V 1γ -1T 1= V 2γ -1T 2T 2=(V 1/V 2) γ -1T 1=2γ -1T 1一次循环系统吸热:bc 等容过程Q bc =(M/M mol )C V (T c -T b )=C V (T 1- T 2)= (5R /2)(1-2γ -1)T 1 =-5(1-2γ -1)T 1R /2ca 等温过程Q ca =(M/M mol )RT c ln(V a /V c )= RT 1ln2所以 Q = Q bc +Q ca =-5(1-2γ -1)T 1R /2+RT 1ln2=-5(1-20.4)T 1R /2+RT 1ln2=-240J 即一次循环系统放热 Q '=239.6J n=100次循环系统放热熔解冰的质量 m=n Q '/λ=7.15×10-2kgⅣ 课堂例题一.选择题1.在一封闭容器中盛有1 mol 氦气(视作理想气体),这时分子无规则运动的平均自由程仅决定于(A) 压强p . (B) 体积V . (C) 温度T . (D) 平均碰撞频率Z .2. 在下列说法(1) 可逆过程一定是平衡过程.(2) 平衡过程一定是可逆的. (3) 不可逆过程一定是非平衡过程.(4) 非平衡过程一定是不可逆的. 中,哪些是正确的?(A) (1)、(4). (B) (2)、(3). (C) (1)、(2)、(3)、(4). (D) (1)、(3).3.如图所示,一定量的理想气体,沿着图中直线从状态a ( 压强p 1 = 4 atm ,体积V 1 =2 L )变到状态b ( 压强p 2 =2 atm ,体积V 2 =4L ).则在此过程中:(A) 气体对外作正功,向外界放出热量.(B) 气体对外作正功,从外界吸热. (C) 气体对外作负功,向外界放出热量. (D) 气体对外作正功,内能减少.4. 下列各说法中确切的说法是: (A) 其它热机的效率都小于卡诺热机的效率.(B) 热机的效率都可表示为η = 1 – Q 2 / Q 1,式中Q 2表示热机循环中工作物向外放出的热量(绝对值),Q 1表示从各热源吸收的热量(绝对值). (C) 热机的效率都可表示为η = 1 – T 2 / T 1,式中T 2为低温热源温度,T 1为高温热源温度. (D) 其它热机在每一循环中对外作的净功一定小于卡诺热机每一循环中对外作的净功. 5.关于热功转换和热量传递过程,有下面一些叙述: (1) 功可以完全变为热量,而热量不能完全变为功; (2) 一切热机的效率都只能够小于1; (3) 热量不能从低温物体向高温物体传递; (4) 热量从高温物体向低温物体传递是不可逆的. 以上这些叙述 (A) 只有(2)、(4)正确. (B) 只有(2)、(3) 、(4)正确.(C) 只有(1)、(3) 、(4)正确. (D) 全部正确.6.设有以下一些过程: (1) 两种不同气体在等温下互相混合. (2) 理想气体在定体下降温. (3) 液体在等温下汽化. (4) 理想气体在等温下压缩. (5) 理想气体绝热自由膨胀. 在这些过程中,使系统的熵增加的过程是: (A) (1)、(2)、(3). (B) (2)、(3)、(4). (C) (3)、(4)、(5). (D) (1)、(3)、(5).p (atm )01234二.填空题1.用公式T C E V ∆=∆ν(式中V C 为定体摩尔热容量,视为常量,ν 为气体摩尔数)计算理想气体内能增量时,此式适用于过程。
基础知识气体动力学

2 可逆过程与不可逆过程
热力学基本概念与基础知识
热力学系统从一个平衡状态出发,经过一系列中间状态而变化到另一个平衡状态,它所经历的全部状态的综合称为热力过程,简称过程。 如果在过程中系统所经历的一系列状态都无限接近于平衡状态,则这种过程称为“准平衡过程”或“准静态过程”-它是一种无限缓慢的过程。 当系统完成某一过程后,如果令过程逆向进行而能使过程中所涉及的一切(系统及外界)都回复到初始状态,不留下任何变化,则此过程称为可逆过程,反之即为不可逆过程。 可逆过程是消除一切不可逆因素、具有可逆性的过程,必须满足 它是准平衡过程; 过程中不存在耗散效应。 →可逆过程是没有耗散损失的准平衡过程。
热力学中规定,系统吸热时热量为正,系统放热时热量为负。
热量既然是在传递中出现的能量,其数值就必然与传递过程有关。所以,热量也是一个过程量,而不是状态参数,其数值由系统状态和过程性质决定。
热量和功虽然同为过程量,都是系统和外界间通过边界传递的能量,但两者有着本质的差别:热量是通过紊乱的分子热运动发生相互作用而传递的能量,功则是物体间通过有规则的微观运动或宏观运动发生相互作用而传递的能量。
序 言
根据分子运动论,分子总是在不断进行无规则的热运动,不同流动区域的分子所携带的能量、动量和质量是不同的。
分子可以在不同流动区域之间运动。当某分子从一个区域运动到另一个区域时,同时也就将其能量、动量和质量携带到了该区域,这种迁移特性称为流体的输运性质。
流体的输运性质主要包括:黏性、导热性、质量扩散等,本课程只介绍前两个。
热力学基本概念与基础知识
1平衡状态、状态参数与简单热力学系统
系统的热力学状态:热力学系统在某一瞬时所呈现的宏观物理状况。热力学状态用能够测量的一些物理量来描述,这样的物理量称为状态参数。 对气体组成的系统,最基本的状态参数有3个:温度、压强、密度。 根据定义,状态参数的数值仅取决于系统所处的热力学状态本身,而与系统达到该状态所经历的途径或过程无关。 在没有外界影响的条件下,如果系统的宏观状态不随时间而改变,则系统所处的这种状态称为热力学平衡状态,简称状态。平衡状态是一个理想概念,此时,系统内必然是热平衡、力平衡、化学平衡。 实验和理论均证明,对于由气体组成的系统,其平衡状态只需要两个独立的状态参数来描述,只要确定两个独立状态参数的数值,其余的状态参数就随之确定,系统的状态即可确定。这种只需要两个独立状态参数描述的热力学系统称为简单热力学系统。 对气体组成的简单热力学系统,3个基本状态参数的关系可表示成 称为状态方程。
大学物理下册知识点总结(期末)
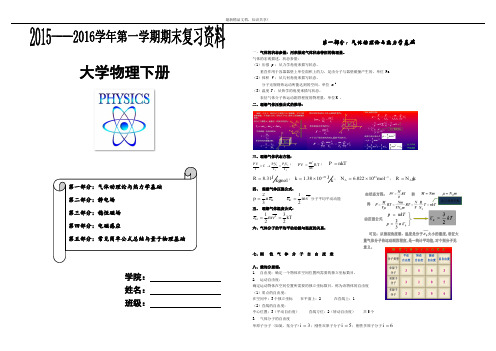
大学物理下册学院:姓名:班级:一、气体的状态参量:用来描述气体状态特征的物理量。
气体的宏观描述,状态参量:(1)压强p:从力学角度来描写状态。
垂直作用于容器器壁上单位面积上的力,是由分子与器壁碰撞产生的。
单位 Pa(2)体积V:从几何角度来描写状态。
分子无规则热运动所能达到的空间。
单位m 3(3)温度T:从热学的角度来描写状态。
表征气体分子热运动剧烈程度的物理量。
单位K。
二、理想气体压强公式的推导:三、理想气体状态方程:112212PV PV PVCT T T=→=;mPV R TM'=;P nkT=8.31JR k mol=;231.3810Jk k-=⨯;2316.02210AN mol-=⨯;AR N k=四、理想气体压强公式:23ktp nε=212ktm vε=分子平均平动动能五、理想气体温度公式:21322ktm v kTε==六、气体分子的平均平动动能与温度的关系:七、刚性气体分子自由度表八、能均分原理:1.自由度:确定一个物体在空间位置所需要的独立坐标数目。
2.运动自由度:确定运动物体在空间位置所需要的独立坐标数目,称为该物体的自由度(1)质点的自由度:在空间中:3个独立坐标在平面上:2 在直线上:1(2)直线的自由度:中心位置:3(平动自由度)直线方位:2(转动自由度)共5个3.气体分子的自由度单原子分子 (如氦、氖分子)3i=;刚性双原子分子5i=;刚性多原子分子6i=4. 能均分原理:在温度为T 的平衡状态下,气体分子每一自由度上具有的平均动都相等,其值为12kT推广:平衡态时,任何一种运动或能量都不比另一种运动或能量更占优势,在各个自由度上,运动的机会均等,且能量均分。
5.一个分子的平均动能为:2ki kT ε=五. 理想气体的内能(所有分子热运动动能之和) 1.1m ol 理想气体2i E R T =5.一定量理想气体()2i m E RT Mνν'==九、气体分子速率分布律(函数)速率分布曲线峰值对应的速率 v p 称为最可几速率,表征速率分布在 v p ~ v p + d v 中的分子数,比其它速率的都多,它可由对速率分布函数求极值而得。
5-练习册-第十二章 气体动理论

第十二章 气体动理论§12-1 平衡态 气体状态方程【基本内容】热力学:以观察和实验为基础,研究热现象的宏观规律,总结形成热力学三大定律,对热现象的本质不作解释。
统计物理学:从物质微观结构出发,按每个粒子遵循的力学规律,用统计的方法求出系统的宏观热力学规律。
分子物理学:是研究物质热现象和热运动规律的学科,它应用的基本方法是统计方法。
一、平衡态 状态参量1、热力学系统:由大量分子组成的宏观客体(气体、液体、固体等),简称系统。
外界:与系统发生相互作用的系统以外其它物体(或环境)。
从系统与外界的关系来看,热力学系统分为孤立系统、封闭系统、开放系统。
2、平衡态与平衡过程平衡态:在不受外界影响的条件下,系统的宏观热力学性质(如P 、V 、T )不随时间变化的状态。
它是一种热动平衡,起因于物质分子的热运动。
热力学过程:系统从一初状态出发,经过一系列变化到另一状态的过程。
平衡过程:热力学过程中的每一中间状态都是平衡态的热力学过程。
3、状态参量系统处于平衡态时,描述系统状态的宏观物理量,称为状态参量。
它是表征大量微观粒子集体性质的物理量(如P 、V 、T 、C 等)。
微观量:表征个别微观粒子状况的物理量(如分子的大小、质量、速度等)。
二、理想气体状态方程1、气体实验定律(1)玻意耳定律:一定质量的气体,当温度保持不变时,它的压强与体积的乘积等于恒量。
即PV =恒量,亦即在一定温度下,对一定量的气体,它的体积与压强成反比。
(2)盖.吕萨克定律: 一定质量的气体,当压强保持不变时,它的体积与热力学温度成正比。
即V T =恒量。
(3)查理定律: 一定质量的气体,当体积保持不变时,它的压强与热力学温度成正比,即P T=恒量。
气体实验定律的适用范围:只有当气体的温度不太低(与室温相比),压强不太大(与大气压相比)时,方能遵守上述三条定律。
2、理想气体的状态方程(1)理想气体的状态方程在任一平衡态下,理想气体各宏观状态参量之间的函数关系;也称为克拉伯龙方程M PV RT RT νμ==(2)气体压强与温度的关系 P nkT =玻尔兹曼常数23/ 1.3810A k R N -==⨯J/K ;气体普适常数8.31/.R J mol K = 阿伏加德罗常数236.02310/A N mol =⨯质量密度与分子数密度的关系nm ρ=分子数密度/n N V =,ρ气体质量密度,m 气体分子质量。
第7章 气体动理论

碰后折回来需用的时间:
2x vx
t vxt 2x / vx 2x
一个分子在 t 时间内碰撞器壁的总冲量:
I1
2mv
x
t
2x / v x
mv
2 x
t
x
(3) N 个分子在 t 时间内
碰撞器壁的总冲量:
IN
N
mv
2 ix
t
x i 1
m x
t
N i 1
v2 ix
y
A1
vy
m
(4) I Ft P F / s
kr
1 2
mvc2x
1 2
mvc2y
1 2
mvc2z
1 2
J yc2y
1 2
J zc2z
1 2
J x c2x
2.能量均分定理(Boltzmann 假设)
t
1 2
mv2
3 2
kT
v
2 x
v
2 y
v
2 z
1 3
v2
1 2
mv
2 x
1 2
m
v
2 y
1 2
mvz2
1 ( 1 mv2 ) 32
1 kT 2
φ
确定刚体转轴的方位: 需要二个自由度(α,β);
β P(x,y,z)
α
γo
X
确定刚体绕转轴转过的角度, Z
需要一个自由度(φ);
刚体位置的确定共需要六个自由度。
3.气体分子模型自由度 ①单原子分子: 如氦原子 He 需要三个平动自由度 i=t=3;
②刚性双原子分子: 如氧气分子
O2
质心需要三个平动自由度;两原子连线方位需要
第八、九章 热力学基础 气体动理论 南京大学出版社 习题解答

第八章 气体动理论8-6 目前,真空设备内部的压强可达101001.1-⨯Pa ,在此压强下温度为27℃时1m 3体积中有多少个气体分子?解:由 nKT p =得10103231011024510(m )13810300p n KT ---⋅⨯===⋅⨯⋅⨯⨯8-7 每秒有1023个氧分子以500m·s -1的速度沿与器壁法线成45º角的方向撞在面积为4102-⨯m 2的器壁上,问这群分子作用在器壁上的压强为多大?解:每个分子对器壁碰撞时,对器壁的作用冲量为 02cos45f t mv ∆= 每秒内全部N 个分子对器壁的作用冲量,即冲力为02cos 45F N mv =⋅根据压强定义式得:233023442cos 451023210500cos 456021021018810(Pa)F N mv p S S --===创创?=状创=状8-8 有N 个粒子,其速率分布函数为 d ()d Nf v C N v== (0<v <0v ) 0)(=v f (v >0v ) (1) 画出该粒子的速率分布曲线 (2) 由0v 求出常量C (3) 求粒子的平均速率解: (1)粒子的速率分布曲线如图2-2所示 (2) 由于0100()d d v f v v C v Cv ==⎰⎰由分布函数的归一化条件()0d 1f v v ∞=⎰,得01Cv =则1C v =(3) 粒子平均速率为0001()d d 2V v v vf v v vv v ∞===⎰⎰8-9 某些行星的温度可达到81.010K ⨯,这是发生核聚变(热核反应)所需的温度,在此温度下的恒星可视为由质子组成。
试求:(1)质子的平均动能;(2)质子的方均根速率。
(大量质子可视为由质点组成的理想气体) 解(1)将质子视为理想气体,2381533kT 1.3810110 2.0710(J)22ε--==⨯⨯⨯⨯=⨯(2)质子的方均根速率为:61.5810(m/s)===⨯8-10. 储有氧气的容器以速度s /m 100v =运动,假设该容器突然停止,全部定向运动的动能都变为气体分子热运动的动能,容器中氧气的温度将会上升多少? 解: 容器作匀速运动,由于体积和压强不变,所以容器内的温度不变。
大学物理复习-第五六章
E与(1) 相同.
W = Q E=417 J
4分
(3)
Q =0,E与(1) 同
W = E=623 J (负号表示外界作功)
3分
28
10、一定量的理想气体,由状态a经b到达c. (如图,abc为一直线)求此过程中 (1) 气体对外作的功; (2) 气体内能的增量; (3) 气体吸收的热量.(1 atm=1.013×105 Pa)
件___0 _f_(__) _d___1__,此条件的物理意义是:
分子速率处于(0~∞ )区间的分子数占总分子数
的百分比为1 .
2.若f()为气体分子速率分布函数,N为气体分子
总数,m为分子质量,则
2 1m 2Nf ( )d的物理
1 2
意义为速__率__在__速_率__间__隔___1~___2_之_内__的__分__子_平__均__动__能_之__和_。
到50%,若低温热源保持不变,则高温热源的温度应增加
___K.
500
100
8、1 mol 理想气体(设 Cp/CV为已知)的循环过程如T -V图所示,其中CA为绝热过程,A点状态参量(T1, V1)和B点的状态参量(T2,V2)为已知.试求C点的状 态参量:
Vc=____V,2
Tc=___(_V1_/ V_2_) _1 T_1 _____,
解: N22N, M1 2M2, T2 5T1
E2 E1
m
M2 m
M1
3 2
RT2
5 2
RT1
3 5
M1T2 M 2T1
6
第六章 热力学基础
一、热力学第一定律
二、四个过程
内能增量
E
m' M
大学物理热学习题课

dN m 32 4 ( ) e Ndv 2kT
v2
对于刚性分子自由度 单原子 双原子 多原子
i tr
(1)最概然速率
2kT 2 RT RT vp 1.41 m
(2)平均速率
i=t=3 i = t+r = 3+2 = 5 i = t+r = 3+3 =6
6、能均分定理
8kT 8 RT RT v 1.60 m
M V RT ln 2 M mol V1
QA
绝热过程
PV 常量
M E CV T M mol
(2)由两条等温线和两条绝热线 组成的循环叫做 卡诺循环。 •卡诺热机的效率
Q0
Q2 T2 卡诺 1 1 Q1 T1
M P1V1 P2V2 A CV T M mol 1
E 0
•热机效率
A Q1 Q2
M E CV T M mol M Q C P T M mol
A Q1 Q2 Q2 1 Q1 Q1 Q1
A=P(V2-V1) 等温过程
A
E 0
Q1 Q2 •致冷系数 e W Q1 Q2
热机效率总是小于1的, 而致冷系数e可以大于1。
定压摩尔热容
比热容比
CP ( dQ )P dT i2 i
8、平均碰撞次数 平均自由程
z
2d v n
2
CV •对于理想气体:
Cp
v z
1.热力学第一定律
1 2 2d n
二、热 力 学 基 础
Q ( E2 E1 ) A dQ dE dA
准静态过程的情况下
4. 摩尔数相同的两种理想气体 一种是氦气,一种是氢气,都从 相同的初态开始经等压膨胀为原 来体积的2倍,则两种气体( A ) (A) 对外做功相同,吸收的热量 不同. (B) 对外做功不同,吸收的热量 相同. (C) 对外做功和吸收的热量都不 同. (D) 对外做功和吸收的热量都相 同. A=P(V2-V1)
气体动理论与热力学公式知识点复习

4 TD
3
o
V
P3
绝热线
4 2
a 吸气 排气
1
o V1
V2 V
热力学第二定律
可逆过程与不可逆过程 1、开尔文表述:不能制造出单热机 2、克劳修斯表述:热量不能自动地从低温热源传到高温 热源而不引起其它的变化
有序和无序 非平衡态与平衡态 微观状态数
微观意义:一切自然过程总是向无序性增大的方向进行
统计表述:孤立系统内部所发生的过程总是从包含微观态数少
(
A
dQ T
)R
S SB SA
B dQ AT
“=”可逆过程; “ > ”不可逆过程
对于可逆过程,热力学第一定律与热力学第二定律之间的 基本关系式
TdS dE PdV
12
熵变计算
当系统由初态A通过可逆过程R到达终态B时求熵变
的方法:直接用 SB SA 来AB(计dTQ算)R
当系统由初态A通过不可逆过程到达终态B时求熵变的方 法:
的宏观态向包含微观态数多的宏观态过渡,从热力学几率小的状 态向热力学几率大的状态过渡。
10
卡诺定理
(1)卡诺机的热机效率与工作物质无关
(2)可逆卡诺机热几效率最大
熵和熵增原理
任意卡诺循环
1 Q2 Q1
可逆
1 T2 T1
统计学定义熵 S = k ln ——玻尔兹曼熵公式
•熵具有可加性。
熵增原理 ΔS≥ 0
(1)把熵作为状态参量的函数表达式推导出来,再将初、终两态 的状态参量值代入,从而算出熵变。
(2)可设计一个连接同样初终两态的任意一个可逆过程R,再利
用
SB SA
B
(
A
dQ T
大学物理气体动理论热力学基础复习题及答案详解

第12章 气体动理论一、填空题:1、一打足气的自行车内胎,若在7℃时轮胎中空气压强为×510pa .则在温度变为37℃,轮胎内空气的压强是 ;设内胎容积不变2、在湖面下50.0m 深处温度为4.0℃,有一个体积为531.010m -⨯的空气泡升到水面上来,若湖面的温度为17.0℃,则气泡到达湖面的体积是 ;取大气压强为50 1.01310p pa =⨯3、一容器内储有氧气,其压强为50 1.0110p pa =⨯,温度为27.0℃,则气体分子的数密度为 ;氧气的密度为 ;分子的平均平动动能为 ;分子间的平均距离为 ;设分子均匀等距排列4、星际空间温度可达,则氢分子的平均速率为 ,方均根速率为 ,最概然速率为 ;5、在压强为51.0110pa ⨯下,氮气分子的平均自由程为66.010cm -⨯,当温度不变时,压强为 ,则其平均自由程为1.0mm;6、若氖气分子的有效直径为82.5910cm -⨯,则在温度为600k,压强为21.3310pa ⨯时,氖分子1s 内的平均碰撞次数为 ;7、如图12-1所示两条曲线1和2,分别定性的表示一定量的某种理想气体不同温度下的速率分布曲线,对应温度高的曲线 是 .若图中两条曲线定性的表示相同温度下的氢气和氧气的速率分布曲线,则表示氧气速率分布曲线的是 .8、试说明下列各量的物理物理意义: 112kT , 232kT , 32i kT , 42i RT , 532RT , 62M i RT Mmol ; 参考答案:1、54.4310pa ⨯ 2、536.1110m -⨯ 3、25332192.4410 1.30 6.2110 3.4510m kg m J m ----⨯⋅⨯⨯ 4、2121121.6910 1.8310 1.5010m sm s m s ---⨯⋅⨯⋅⨯⋅ 图12-15、6.06pa6、613.8110s -⨯ 7、2 ,28、略二、选择题:教材习题12-1,12-2,12-3,12-4. 见课本p207~208参考答案:12-1~12-4 C, C, B, B. 第十三章热力学基础一、选择题1、有两个相同的容器,容积不变,一个盛有氦气,另一个盛有氢气均可看成刚性分子它们的压强和温度都相等,现将 5 J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氦气传递的热量是A 6 JB 5 JC 3 JD 2 J2、一定量理想气体,经历某过程后,它的温度升高了,则根据热力学定理可以断定:1该理想气体系统在此过程中作了功;2在此过程中外界对该理想气体系统作了正功;3该理想气体系统的内能增加了;4在此过程中理想气体系统既从外界吸了热,又对外作了正功;以上正确的是:A 1,3B 2,3C 3D 3,43、摩尔数相等的三种理想气体H e 、N 2和CO 2,若从同一初态,经等压加热,且在加热过程中三种气体吸收的热量相等,则体积增量最大的气体是:AH e BN 2CCO 2 D 三种气体的体积增量相同4、如图所示,一定量理想气体从体积为V 1膨胀到V 2,AB,AC为等温过程AD 为绝热过程;则吸热最多的是: A AB 过程 B AC 过程 C AD 过程 D 不能确定 5、卡诺热机的循环曲线所包围的面积从图中abcda 增大为ab’c’da ,那么循环abcda 与ab’c’da 所作的净功和热机效率的变化情况是:A 净功增大,效率提高;B 净功增大,效率降低;C 净功和效率都不变;D 净功增大,效率不变;6、根据热力学第二定律判断下列哪种说法是正确的是:A 热量能从高温物体传到低温物体,但不能从低温物体传到高温物体;B 功可以全部变为热,但热不能全部变为功;C 气体能够自由膨胀,但不能自由压缩;D 有规则运动的能量能够变为无规则运动的能量,但无规则运动的能量不能够变为有规则运动的能量;7、 理想气体向真空作绝热膨胀A 膨胀后,温度不变,压强减小.VB 膨胀后,温度降低,压强减小.C 膨胀后,温度升高,压强减小.D 膨胀后,温度不变,压强不变.8、1mol 的单原子分子理想气体从状态A 变为状态B ,如果不知是什么气体,变化过程也不知道,但A 、B两态的压强、体积和温度都知道,则可求出:A 气体所作的功.B 气体内能的变化.C 气体传给外界的热量.D 气体的质量.9、 有人设计一台卡诺热机可逆的.每循环一次可从 400 K 的高温热源吸热1800 J,向 300 K 的低温热源放热 800 J .同时对外作功1000 J,这样的设计是A 可以的,符合热力学第一定律.B 可以的,符合热力学第二定律.C 不行的,卡诺循环所作的功不能大于向低温热源放出的热量.D 不行的,这个热机的效率超过理论值.10、 一绝热容器被隔板分成两半,一半是真空,另一半是理想气体.若把隔板抽出,气体将进行自由膨胀,达到平衡后A 温度不变,熵增加.B 温度升高,熵增加.C 温度降低,熵增加.D 温度不变,熵不变.二、 填充题1、要使一热力学系统的内能变化,可以通过 或 两种方式,或者两种方式兼用来完成;热力学系统的状态发生变化时,其内能的改变量只决定于 ,而与 无关;2、将热量Q 传给一定质量的理想气体;1若体积不变,热量转化为 ;2若温度不变,热量转化为 ;3、卡诺循环是由两个 过程和两个 过程组成的循环过程;卡诺循环的效率只与 有关,卡诺循环的效率总是 大于、小于、等于1;4、一定量理想气体沿a →b →c 变化时作功abc W =615J,气体在b 、c 两状态的内能差J E E c b 500=-;那么气体循环一周,所作净功=WJ ,向外界放热为=Q J ,等温过程中气体作功=ab WJ ;5、常温常压下,一定量的某种理想气体可视为刚性双原子分子,在等压过程中吸热为Q,对外作功为W,内能增加为E ∆,则W Q =_ _,E Q∆=_________; 6、p V -图上封闭曲线所包围的面积表示 物理量,若循环过程为逆时针方向,则该物理量为 ;填正或负7、一卡诺热机低温热源的温度为27C,效率为40% ,高温热源的温度T 1 = .8、设一台电冰箱的工作循环为卡诺循环,在夏天工作,环境温度在35C,冰箱内的温度为0C,这台电冰箱的理想制冷系数为e = .9、一循环过程如图所示,该气体在循环过程中吸热和放热的情ab coVT况是a →b 过程 ,b →c 过程 ,c →a 过程 ;10、将1kg 温度为010C 的水置于020C 的恒温热源内,最后水的温度与热源的温度相同,则水的熵变为 ,热源的熵变为 ;水的比热容为34.1810ln1.03530.035J kg K ⨯⋅=,参考答案:一、1、C 2、C 3、A 4、A 5、D6、C7、A8、B9、D 10、A二、1、作功,传热,始末状态,过程 2、理想气体的内能,对外作功 3、绝热,等温, 4、115J ,500J ,615J 5、27,576、功,负7、 500K8、9、吸热,放热,吸热 10、11146.3,142.7J K J K --⋅-⋅自测题5一、选择题1、一定量某理想气体按2pV =恒量的规律膨胀,则膨胀后理想气体的温度 A 将升高 B 将降低 C 不变 D 不能确定;2、若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为 A pV m B ()pV kT C ()pV RT D ()pV mT3、如题5.1.1图所示,两个大小不同的容器用均匀的细管相连,管中有一水银作活塞,大容器装有氧气,小容器装有氢气,当温度相同时,水银滴静止于细管中央,试问此时这两种气体的密度哪个大 A 氧气的密度大; B 氢气的密度大; C 密度一样大; D 无法判断;4、若室内生起炉子后温度从015C 升高到027C ,而室内气压不变,则此时室内的分子数减少了A 0.5%B 4%C 9%D 21%5、一定量的理想气体,在容积不变的条件下,当温度升高时,分子的平均碰撞次数Z 和平均自由程λ的变化情况是 A Z 增大,λ不变; B Z 不变,λ增大; C Z 和λ都增大; D Z 和λ都不变;6、一定量的理想气体,从a 态出发经过①或②过程到达b 态,acb 为等温线如题5.1.2图所示,则①,②两过程中外界对系统传递的热量12,Q Q 是A 120,0Q Q >> B 120,0Q Q << C 120,0Q Q >< D 120,0Q Q <>7、如题5.1.3图,一定量的理想气体经历acb 过程时吸热200J ;则经历acbda 过程时,吸热为 A 1200J - B 1000J - C 700J - D 1000J8、一定量的理想气体,分别进行如题5.1.4图所示的两个卡诺循环abcda 和a b c d a ''''';若在P V -图上这两个循环曲线所围面积相等,则可以由此得知这两个循环 A 效率相等; B 由高温热源处吸收的热量相等;C 在低温热源处放出的热量相等;D 在每次循环中对外做的净功相等;9、“理想气体和单一热源接触作等温膨胀时,吸收的热量全部用来对外做功;”对此说法,有如下几种评论,哪种是正确的A 不违反热力学第一定律,但违反热力学第二定律;B 不违反热力学第二定律,但违反热力学第一定律;C 不违反热力学第一定律,也不违反热力学第二定律;D 违反热力学第一定律,也违反热力学第二定律;10、一定量的理想气体向真空作绝热自由膨胀,体积由1V 增至2V ,在此过程中气体的A 内能不变,熵增加;B 内能不变,熵减少;C 内能不变,熵不变;D 内能增加,熵增加;二、填空题:1、在推导理想气体压强公式中,体现统计意义的两条假设是1 ;2 ;2、在定压下加热一定量的理想气体;若使其温度升高1K 时,它的体积增加了倍,则气体原来的温度是 ;3、在相同的温度和压强下,各为单位体积的氢气视为刚性双原子分子气体与氦气的内能之比为 ;4、分子物理学是研究 的学科,它应用的基本方法是 方法;①②题5.1.2图 1 41 4 题5.1.3图o 题5.1.4图5、解释名词:自由度 ;准静态过程 ;6、用总分子数N ,气体分子速率v 和速率分布函数()f v 表示下列各量:1速率大于0v 的分子数= ;2速率大于0v 的那些分子的平均速率= ;3多次观察某一分子的速率,发现其速率大于0v 的概率= ;7、常温常压下,一定量的某种理想气体可视为刚性分子、自由度为i ,在等压过程中吸热为Q ,对外做功为A ,内能增加为E ∆,则A Q = ;8、有一卡诺热机,用29kg 空气为工作物质,工作在027C 的高温热源与073C -的低温热源之间,此热机的效率η= ;若在等温膨胀过程中气缸体积增大倍,则此热机每一循环所做的功为 ;空气的摩尔质量为312910kg mol--⨯⋅ 自测题5参考答案一、选择题1、B2、B3、A4、B5、A6、A7、B8、D9、C 10、A二、填空题1、1沿空间各方向运动的分子数目相等; 2222x y z v v v ==;2、200K3、53;1034、物质热现象和热运动规律; 统计;5、确定一个物体在空间的位置所需要的独立坐标的数目;系统所经历的所有中间状态都无限接近于平衡状态的过程;6、0000()()/()()v v v v Nf v dv vf v dv f v dv f v dv ∝∝∝∝⎰⎰⎰⎰ 7、2;22i i i ++ 8、533.3%;8.3110J ⨯;另外添加的题目:一、选择题:1、双原子理想气体,做等压膨胀,若气体膨胀过程从热源吸收热量J 700,则该气体对外做功为 DA J 350B J 300C J 250D J 2002、在V P -图图1中,mol 1理想气体从状态A 沿直线到达B ,B A V V =2,则此过程系统的功能和内能变化的情况为 CA 0,0>∆>E AB 0,0<∆<E AC 0,0=∆>E AD 0,0>∆<E A3、某理想气体分别经历如图2所示的两个卡诺循环:)(abcd I 和)(d c b a ''''I I ,且两条循环曲线所围面积相等;设循环I 的效率为η,每次循环在高温热源处吸收的热量为Q ,循环II 的效率为η',每次循环在高温Q ',则BA Q Q '<'<,ηη;B Q Q '>'<,ηη;C Q Q '<'>,ηη;D Q Q '>'>,ηη4、一热机在两热源12400,300T K T K ==之间工作,一循环过程吸收1800J ,放热800J ,作功1000J ,此循环可能实现吗 BA 可能;B 不可能;C 无法判断;5、有两个相同的容器,容积不变,一个盛有氦气,另一个盛有氢气均可看成刚性分子它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高相同的温度,则应向氦气传递的热量是CA 6JB 5JC 3JD 2J6、一定量理想气体,经历某过程后,它的温度升高了,则根据热力学定理可以断定:1该理想气体系统在此过程中作了功;2在此过程中外界对该理想气体系统作了功;3该理想气体系统的内能增加了;4在此过程中理想气体系统既从外界吸了热,又对外作了正功;以上正确的是 CA 1,3B 2,3C 3 D3,4 E47、对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作的功三者均为负值: DA 等容降压过程B 等温膨胀过程C 绝热膨胀过程D 等压压缩过程8、对于室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所作的功与从外界吸收的热量之比/A Q 等于: DA 1/3B 1/4C 2/5D 2/79、摩尔数相等的三种理想气体e H 、2N 和2CO ,若从同一初态,经等压加热,且在加热过程中三种气体吸收的热量相等,则体积增量最大的气体是: AA e HB 2NC 2COD 三种气体的体积增量相同10、如图所示,一定量理想气体从体积为1V 膨胀到2V ,AB 为等压过程,AC 为等温过程,AD 为绝热过程,则吸热最多的是:AA AB 过程 B AC 过程 C AD 过程 D 不能确定11、根据热力学第二定律判断下列哪种说法是正确的是:CA 热量能从高温物体传到低温物体,但不能从低温物体传到高温物体;B 功可以全部变为热,但热不能全部变为功;C 气体能够自由膨胀,但不能自由压缩;D 有规则运动的能量能够变为无规则运动的能量,但无规则运动的能量不能够变为有规则运动的能量;12、汽缸内盛有一定的理想气体,当温度不变,压强增大一倍时,该分子的平均碰撞频率和平均自由程的变化情况是:C A Z 和λ都增大一倍; B Z 和λ都减为原来的一半; C Z 增大一倍而λ减为原来的一半;D Z 减为原来的一半而λ增大一倍;13、在恒定不变的压强下,气体分子的平均碰撞频率Z 与气体的热力学温度T 的关系为CA Z 与T 无关;B Z 与T 成正比;C Z 与T 成反比;D Z 与T 成正比;14、一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且都处于平衡状态,则它们: CA 温度相同、压强相同;B 温度、压强相同;C 温度相同,但氦气的压强大于氮气的压强;D 温度相同,但氦气的压强小于氮气的压强;15、已知氢气与氧气的温度相同,请判断下列说法哪个正确A 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强;B 氧分子的质量比氢分子大,所以氧气密度一定大于氢气的密度;C 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大;D 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大;16、按2PV =恒量规律膨胀的理想气体,膨胀后的温度为: CA 升高;B 不变;C 降低;D 无法确定17、下列各式中哪一种式表示气体分子的平均平动动能式中M 为气体的质量,m 为气体分子的质量,N 为气体分子总数目,n 为气体分子密度,0N 为阿伏加德罗常数,mol M 为摩尔质量;A 32m PV M ;B 32mol M PV M ;C 32nPV ;D 032mol M N PV M18、一定量的理想气体可以:DA 保持压强和温度不变同时减小体积;B 保持体积和温度不变同时增大压强;C 保持体积不变同时增大压强降低温度;D 保持温度不变同时增大体积降低压强;19、设某理想气体体积为V ,压强为P ,温度为T ,每个分子的质量为μ,玻尔兹曼常数为k ,则该气体的分子总数可以表示为:C A PV k μ B PT V μ C PV kT D PT kV19、关于温度的意义,有下列几种说法:1气体的温度是分子平均平动动能的量度;2气体的温度是大量气体分子热运动的集体表现,具有统计意义;3温度的高低反映物质内部分子运动剧烈程度的不同;4从微观上看,气体的温度表示每个气体分子的冷热程度;上述说法中正确的是:BA1,2,4 B1,2,3 C2,3,4 D1,3,420、设某种气体的分子速率分布函数为()f v ,则速率在12v v →区间内的分子平均速率为:CA 21()v v vf v dv ⎰B 21()v v v vf v dv ⎰ C 2121()()v v v v vf v dv f v dv ⎰⎰ D 210()()v v vf v dv f v dv∝⎰⎰ 21、两容积不等的容器内分别盛有可视为理想气体的氦气和氮气,如果它们温度和压强相同,则两气体:CA 单位体积内的分子数必相同;B 单位体积内的质量必相同;C 单位体积内分子的平均动能必相同:D 单位体积内气体的内能必相同;22、在标准状态下,体积比为1:2的氧气和氦气均视为理想气体相混合,混合气体中氧气和氦气的内能之比为:CA 1:2B 5:3C 5:6D 10:3填空题:1、要使一热力学系统的内能增加,可以通过传热或作功两种方式,或者两种方式兼用来完成;热力学系统的状态发生变化时,其内能的改变量只决定于初末状态,而与过程无关;2、16g 氧气在400K 温度下等温压缩,气体放出的热量为1152J ,则被压缩后的气体的体积为原体积的12倍,而压强为原来压强的2倍;3、一热机从温度为727o C 的高温热源吸热,向温度为527oC 的低温热量放热,若热机在最大效率下工作,且每一循环吸热2000J ,则此热机每一循环作功为400J ;4、一卡诺热机在每次循环中都要从温度为400K 的高温热源吸热418J ,向低温热源放热334.4J ,低温热源的温度为320K ;5、汽缸内有单原子理想气体,若绝热压缩使体积减半,问气体分子的平均速率变为原来速率的 倍若为双原子理想气体又为 倍6、下面给出理想气体状态方程的几种微分形式,指出它们各表示什么过程; 1()mol PdV M M RdT =表示等压过程; 2()mol VdP M M RdT =表示等容或者等体过程;30PdV VdP +=表示等温过程;7、容积为10升的容器中储有10克的氧气;1600m s -=⋅,则此气体的温度T =462K ;压强P = 51.210⨯ Pa ;8、在室温27o C 下,1mol 氢气和1mol 氧气的内能比为1:1;1g 氢气和1g 氧气的内能比为16:19、理想气体的内能是温度的单值函数; 2i kT 表示分子的平均动能; 2i RT 表示1mol 气体分子的内能 2m i RT M 表示m 千克气体分子的内能 10、氮气在标准状态下的分子平均碰撞次数为311.310s -⨯,分子平均自由程为6610cm -⨯,若温度不变,气压降为0.1atm ,则分子平均碰撞次数变为211.310s -⨯;分子平均自由程变为5610cm -⨯。
大学物理温度与气体动理论

2
第一章 气体动理论
Kinetic Theory of Gases
主要内容 理想气体状态方程 压强的微观公式 温度的微观公式 理想气体的内能 麦克斯韦速率分布律
3
§1.1 平衡态 Equilibrium State
——在不受外界影响的条件下,系统的宏 观性质不随时间改变的状态
n —— 分子数密度(m3)
k =R/NA=1.381023J/K ——玻尔兹曼(Boltzmann)常量
[来历]
1
p
M
RT
V Mmol
1M
= V
M mol
N AkT
= nkT
9
§1.3 压强公式
Microscopic Expression for Pressure 推导:理想气体分子模型+统计方法
① 平衡态下,分子的空间分布均匀 ② 平衡态下,分子的速度分布各向同性
或说:分子各方向运动概率均等
vx vy vz 0 vx2 vy2 vz2 v2 3
11
⒊压强公式的推导 Y
L3
A L2
Oi
Z
L1
设总分子数:N
器壁侧面积:A
第i分子的速度的
x 分量:vix 0
X vix 0 的含义
p
2 3
nt
Note 压强是统计量
15
§1.4 温度的微观公式 Microscopic Expression of Temperature
状态方程: p = n k T
压强公式:
p
2 3
nt
t
3 2
kT
——温度是分子平均平动动能的标志 (温度的统计解释)
气体动理论

率最大.
2020/9Leabharlann 2218气体动理论
五、平均自由程
1
kT
2 π d 2n
2 πd2p
平均碰撞频率
Z 2d 2n
六、气体内的迁移现象
粘滞现象 扩散现象 热传导现象
动量迁移 质量迁移 能量迁移
Z
2020/9/22
19
气体动理论
例1 (理想气体物态方程)容器中有密封的某种理
想气体,分别经历两次加热过程,获得两条过程 曲线,如图(a)(b)所示。试分析(1)图a中气体 的压强如何变化;(2)图b中气体的V体积如何变 化。
v
0
v
f
v
dv
v 8kT 8RT m M
平方平均速率
v2 v2 f v dv 0
方均根速率
vrms
v2
3kT m
3RT M
3.麦氏分布函数
f
v
4
m 2kT
3/2
mv2
e 2kT
v2
f (v)
fmax
o vp
v
4.三种统计速率
最概然速率 v p
2kT m
2RT M
2020/9/22
2
分子的平均平动动能
—— 3 kT
2
理想气体的内能——
i
RT
2
分子 单原子 双原子 多原子
自由度i
3
56
分子的平均 3
3
3
平动动能
kT kT
2
2
kT 2
分子的平均 转动动能
0
2 kT 3 kT
2
2
分子的 平均动能
3 kT 2
第13章气体动理论及热力学

第13章⽓体动理论及热⼒学第13章⽓体动理论及热⼒学习题13.1 在⽔银⽓压计中,从⽔银池表⾯到封闭管管顶的距离为Lmm ,在标准⽓压计的读数为Hmm Hg和温度t 1℃的情况下,有⼀空⽓泡进⼊管中,因此⽔银柱的⾼减少到h 1mm ,求该⽓压计⽓压修正量ΔP 的表⽰式,并对任何温度t ℃时的任何⽓压计读数h 进⾏修正。
13.2 轮胎的计⽰压强(轮胎内压强与⼤⽓压之差)是1.65×105Pa ,轮胎的内体积为V0。
问在标准⼤⽓压下打⽓时要充⼊多⼤体积的同温度空⽓?13.3 ⼀氦氖激光器,⼯作温度为27℃,管内⽓体压强为2.4mm Hg,氖⽓与氦⽓的压强⽐是1:7。
求管内氦⽓和氖⽓的分⼦数密度各是多少?13.4 ⼀热⽓球的容积为2200m 3,⽓球本⾝和负载质量共725kg ,若其外部空⽓温度为20℃,要想使⽓球上升,其内部空⽓最低要加热到多少度?13.5 ⼀⽓缸内储有理想⽓体,⽓体的压强、摩尔体积和温度分别为P 1,V 1和T 1。
现将⽓缸加热,使⽓体的压强和体积同⽐例地增⼤,即在初态和末态,⽓体的压强P和摩尔体积V都满⾜下列关系式P=CV其中C为常数。
(1)求常数C (⽤P1,T 1和普适常数R 表⽰)。
(2)设T 1=200K ,当摩尔体积增⼤到2V 1时,⽓体的温度是多少?13.6 (1)试⽤范德⽡尔斯⽅程计算密闭于容器内的质量为2.2kg 的CO 2的压强。
设容器的容积V =30×10-3m 3,温度t =27℃。
将这结果与在同⼀情况下的理想⽓体的压强相⽐较。
(2)试计算密度为100kg ·m -3、压强为100atm 的O 2的温度,并与理想⽓体作⽐较。
CO 2的a=3.6×10-6m 6·atm ·mol -2,b =4.3×10-5m 3·mol -1。
O2的a=1.36×10-6m 6·atm ·mol -2,b =3.2×10-5m 3·mol -1。
(完整版)大学物理习题集(气体动力论热力学基础)

气体的动理论 姓名学号一. 选择题1.关于温度的意义,有下列几种说法: [ ](1)气体的温度是分子平均平动动能的量度。
(2)气体的温度是大量气体分子热运动的集体表现,具有统计意义。
(3)温度的高低反映物质内部分子运动剧烈程度的不同。
(4)从微观上看,气体的温度表示每个气体分子的冷热程度。
上述说法中正确的是(A )(1)、(2)、(4); (B )(1)、(2)、(3); (C )(2)、(3)、(4); (D )(1)、(3)、(4);2.若室内生起炉子后温度从15︒C 升高到27︒C ,而室内气压不变,则此时室内的分子数减少了[ ]。
(A )0.5% (B )4% (C )9% (D )21%3.一容器内装有N 1个单原子理想气体分子和N 2个刚性双原子理想气体分子,当该系统处在温度为T 的平衡态时,其内能为 [ ] )2523)(( (A)21kT kT N N ++ )2523)(( 21(B)21kT kT N N ++ kT N kT N 2523 (C)21+ kT N kT N 2325 (D)21+ 4.水蒸气分解成同温度的氢气和氧气,内能增加了百分之几?(不计振动自由度)(A )66.7% (B )50% (C )25% (D )0 [ ]5.在标准状态下,体积比为1:2的的氧气和氦气(均视为刚性分子理想气体)相混合,混合气体中氧气和氦气的内能之比为 [ ]2:1 (A) 3:5 (B) 6:5 (C) 3:10 (D) 6.温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系(A )ε和w 都相等。
(B )ε相等,而w 不相等。
[ ](C )w 相等,而ε不相等。
(D )ε和w 都不相等。
7.1mol 刚性双原子分子理想气体,当温度为T 时,其内能为 [ ] RT 23 (A) kT 23 (B) RT 25 (C) kT 25 (D) 8.在一容积不变的封闭容器内,理想气体分子的平均速率若提高为原来的2倍,则[ ](A )温度和压强都提高为原来的2倍。
气体动理论热力学基础求解气体动理论和热力学问题的基本

第四篇 气体动理论 热力学基础求解气体动理论和热力学问题的基本思路和方法热运动包含气体动理论和热力学基础两部分.气体动理论从物质的微观结构出发,运用统计方法研究气体的热现象,通过寻求宏观量与微观量之间的关系,阐明气体的一些宏观性质和规律.而热力学基础是从宏观角度通过实验现象研究热运动规律.在求解这两章习题时要注意它们处理问题方法的差异.气体动理论主要研究对象是理想气体,求解这部分习题主要围绕以下三个方面:(1) 理想气体物态方程和能量均分定理的应用;(2) 麦克斯韦速率分布率的应用;(3)有关分子碰撞平均自由程和平均碰撞频率.热力学基础方面的习题则是围绕第一定律对理想气体的四个特殊过程(三个等值过程和一个绝热过程)和循环过程的应用,以及计算热力学过程的熵变,并用熵增定理判别过程的方向.1.近似计算的应用一般气体在温度不太低、压强不太大时,可近似当作理想气体,故理想气体也是一个理想模型.气体动理论是以理想气体为模型建立起来的,因此,气体动理论所述的定律、定理和公式只能在一定条件下使用.我们在求解气体动理论中有关问题时必须明确这一点.然而,这种从理想模型得出的结果在理论和实践上是有意义的.例如理想气体的内能公式以及由此得出的理想气体的摩尔定容热容2/m V,iR C =和摩尔定压热容()2/2m P,R i C +=都是近似公式,它们与在通常温度下的实验值相差不大,因此,除了在低温情况下以外,它们还都是可以使用的.在实际工作时如果要求精度较高,摩尔定容热容和摩尔定压热容应采用实验值.本书习题中有少数题给出了在某种条件下m V,C 和m P,C 的实验值就是这个道理.如习题中不给出实验值,可以采用近似的理论公式计算.2.热力学第一定律解题过程及注意事项热力学第一定律E W Q Δ+=,其中功⎰=21d V V V ρW ,内能增量T R i M m E Δ2Δ⋅=.本章习题主要是第一定律对理想气体的四个特殊过程(等体、等压、等温、绝热)以及由它们组成的循环过程的应用.解题的主要过程:(1) 明确研究对象是什么气体(单原子还是双原子),气体的质量或物质的量是多少? (2) 弄清系统经历的是些什么过程,并掌握这些过程的特征.(3) 画出各过程相应的p -V 图.应当知道准确作出热力学过程的p -V 图,可以给出一个比较清晰的物理图像.(4) 根据各过程的方程和状态方程确定各状态的参量,由各过程的特点和热力学第一定律就可计算出理想气体在各过程中的功、内能增量和吸放热了.在计算中要注意Q 和W 的正、负取法.3.关于内能的计算理想气体的内能是温度的单值函数,是状态量,与过程无关,而功和热量是过程量,在两个确定的初、末状态之间经历不同的过程,功和热量一般是不一样的,但内能的变化是相同的,且均等于()12m V,ΔT T C Mm E -=.因此,对理想气体来说,不论其经历什么过程都可用上述公式计算内能的增量.同样,我们在计算某一系统熵变的时候,由于熵是状态量,以无论在始、末状态之间系统经历了什么过程,始、末两个状态间的熵变是相同的.所以,要计算始末两状态之间经历的不可逆过程的熵变,就可通过计算两状态之间可逆过程熵变来求得,就是这个道理.4.麦克斯韦速率分布律的应用和分子碰撞的有关讨论深刻理解麦克斯韦速率分布律的物理意义,掌握速率分布函数f (v )和三种统计速率公式及物理意义是求解这部分习题的关键.三种速率为M RT /2P =v ,M RT π/8=v ,M RT /32=v .注意它们的共同点都正比于M T /,而在物理意义上和用途上又有区别.P v 用于讨论分子速率分布图.v 用于讨论分子的碰撞;2v 用于讨论分子的平均平动动能.解题中只要抓住这些特点就比较方便.根据教学基本要求,有关分子碰撞内容的习题求解比较简单,往往只要记住平均碰撞频率公式v n d Z 22=和平均自由程n d Z λ2π2/1/==v ,甚至只要知道n Z ⋅∝v ,n /1∝λ及M T /∝v 这种比值关系就可求解许多有关习题.第十二章 气体动理论12 -1 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们( )(A) 温度,压强均不相同 (B) 温度相同,但氦气压强大于氮气的压强(C) 温度,压强都相同 (D) 温度相同,但氦气压强小于氮气的压强分析与解 理想气体分子的平均平动动能23k /kT =ε,仅与温度有关.因此当氦气和氮气的平均平动动能相同时,温度也相同.又由物态方程nkT p =,当两者分子数密度n 相同时,它们压强也相同.故选(C).12 -2 三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,方均根速率之比()()()4:2:1::2/12C 2/12B 2/12A =v v v ,则其压强之比C B A ::p p p 为( )(A) 1∶2∶4 (B) 1∶4∶8(C) 1∶4∶16 (D) 4∶2∶1分析与解 分子的方均根速率为M RT /3=2v ,因此对同种理想气体有3212C 2B 2A ::::T T T =v v v ,又由物态方程nkT ρ,当三个容器中分子数密度n 相同时,得16:4:1::::321321==T T T p p p .故选(C).12 -3 在一个体积不变的容器中,储有一定量的某种理想气体,温度为0T 时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ ,当气体温度升高为04T 时,气体分子的平均速率v 、平均碰撞频率Z 和平均自由程λ分别为( ) (A) 004,4,4λλZ Z ===0v v (B) 0022λλ===,,Z Z 0v v (C) 00422λλ===,,Z Z 0v v (D) 0042λλ===,,Z Z 0v v分析与解 理想气体分子的平均速率M RT π/8=v ,温度由0T 升至04T ,则平均速率变为0v 2;又平均碰撞频率v n d Z 2π2=,由于容器体积不变,即分子数密度n 不变,则平均碰撞频率变为0Z 2;而平均自由程n d λ2π2/1=,n 不变,则珔λ也不变.因此正确答案为(B).12 -4 已知n 为单位体积的分子数,()v f 为麦克斯韦速率分布函数,则()v v d nf 表示( )(A) 速率v 附近,dv 区间内的分子数(B) 单位体积内速率在v v v d +~区间内的分子数(C) 速率v 附近,dv 区间内分子数占总分子数的比率(D) 单位时间内碰到单位器壁上,速率在v v v d ~+ 区间内的分子数分析与解 麦克斯韦速率分布函数()()v v d /d N N f =,而v /N n =,则有()V N nf /d d =v v .即表示单位体积内速率在v v v d ~+ 区间内的分子数.正确答案为(B). 12 -5 一打足气的自行车内胎,在C 07o 1.=t 时,轮胎中空气的压强为Pa 100451⨯=.p ,则当温度变为C 037o 2.=t 时,轮胎内空气的压强2p 2p 为多少?(设内胎容积不变)分析 胎内空气可视为一定量的理想气体,其始末状态均为平衡态,由于气体的体积不变,由理想气体物态方程RT Mm pV =可知,压强p 与温度T 成正比.由此即可求出末态的压强.解 由分析可知,当K 15310037152732...=+=T ,轮胎内空气压强为Pa 1043451122⨯==./T p T p可见当温度升高时,轮胎内气体压强变大,因此,夏季外出时自行车的车胎不宜充气太足,以免爆胎.12 -6 有一个体积为35m 1001⨯.的空气泡由水面下m 050.深的湖底处(温度为C 4o)升到湖面上来.若湖面的温度为C 017o .,求气泡到达湖面的体积.(取大气压强为Pa 10013150⨯=.p )分析 将气泡看成是一定量的理想气体,它位于湖底和上升至湖面代表两个不同的平衡状态.利用理想气体物态方程即可求解本题.位于湖底时,气泡内的压强可用公式gh p p ρ+=0求出, 其中ρ为水的密度( 常取33m kg 1001⋅⨯=.ρ).解 设气泡在湖底和湖面的状态参量分别为(p 1 ,V 1 ,T 1 )和(p 2 ,V 2 ,T 2 ).由分析知湖底处压强为gh ρp gh ρp p +=+=021,利用理想气体的物态方程222111T V p T V p = 可得空气泡到达湖面的体积为()3510120121212m 1011.6//-⨯=+==T p V T gh ρp T p V T p V12 -7 氧气瓶的容积为32m 1023-⨯.,其中氧气的压强为Pa 10317⨯.,氧气厂规定压强降到Pa 10016⨯.时,就应重新充气,以免经常洗瓶.某小型吹玻璃车间,平均每天用去3m 400.压强为Pa 100115⨯.的氧气,问一瓶氧气能用多少天? (设使用过程中温度不变) 分析 由于使用条件的限制,瓶中氧气不可能完全被使用.为此,可通过两条不同的思路进行分析和求解:(1) 从氧气质量的角度来分析.利用理想气体物态方程RT M m pV =可以分别计算出每天使用氧气的质量3m 和可供使用的氧气总质量(即原瓶中氧气的总质量1m 和需充气时瓶中剩余氧气的质量2m 之差),从而可求得使用天数()321m m m n /-=.(2) 从容积角度来分析.利用等温膨胀条件将原瓶中氧气由初态(Pa 1030171⨯=.p , 321m 1023-⨯=.V )膨胀到需充气条件下的终态(Pa 1000162⨯=.p ,2V 待求),比较可得2p 状态下实际使用掉的氧气的体积为12V V -.同样将每天使用的氧气由初态(Pa 1001153⨯=.p ,33m 400.=V )等温压缩到压强为p 2 的终态,并算出此时的体积V′2 ,由此可得使用天数应为()212V V V n '-=/.解1 根据分析有RT V Mp m RT V Mp m RT V Mp m /;/;/333222111===则一瓶氧气可用天数()()5.9//33121321===-=V p V p p m m m n解2 根据分析中所述,由理想气体物态方程得等温膨胀后瓶内氧气在压强为Pa 1000162⨯=.p 时的体积为2112p V p V /=每天用去相同状态的氧气容积2332p V p V /='则瓶内氧气可用天数为()()5.9//33121212=-='-=V p V p p V V V n12 -8 设想太阳是由氢原子组成的理想气体,其密度可当作是均匀的.若此理想气体的压强为Pa 1035114⨯..试估计太阳的温度.(已知氢原子的质量Pa 1067127H -⨯=.m ,太阳半径kg 1067127H -⨯=.m ,太阳质量kg 1099130S ⨯=.m )分析 本题可直接运用物态方程nkT p =进行计算.解 氢原子的数密度可表示为()⎥⎦⎤⎢⎣⎡⋅==3S H S H S π34//R m m V m m n S 根据题给条件,由nkT p = 可得太阳的温度为()K 1016.13/π4/7S 3S H ⨯===k m R pm nk p T说明 实际上太阳结构并非本题中所设想的理想化模型,因此,计算所得的太阳温度与实际的温度相差较大.估算太阳(或星体)表面温度的几种较实用的方法在教材第十五章有所介绍.12 -9 一容器内储有氧气,其压强为Pa 100115⨯.,温度为27 ℃,求:(1)气体分子的数密度;(2) 氧气的密度;(3) 分子的平均平动动能;(4) 分子间的平均距离.(设分子间均匀等距排列)分析 在题中压强和温度的条件下,氧气可视为理想气体.因此,可由理想气体的物态方程、密度的定义以及分子的平均平动动能与温度的关系等求解.又因可将分子看成是均匀等距排列的,故每个分子占有的体积为30d V =,由数密度的含意可知n V /10=,d 即可求出. 解 (1) 单位体积分子数 325m 10442⨯==./kT p n(2) 氧气的密度-3m kg 301⋅===.//RT pM V m ρ(3) 氧气分子的平均平动动能J 102162321k -⨯==./kT ε(4) 氧气分子的平均距离m 10453193-⨯==./n d通过对本题的求解,我们可以对通常状态下理想气体的分子数密度、平均平动动能、分子间平均距离等物理量的数量级有所了解.12 -10 2.0×10-2 kg 氢气装在4.0×10-3 m 3 的容器内,当容器内的压强为3.90×105Pa 时,氢气分子的平均平动动能为多大?分析 理想气体的温度是由分子的平均平动动能决定的,即23k /kT =ε.因此,根据题中给出的条件,通过物态方程pV =m/MRT ,求出容器内氢气的温度即可得k ε. 解 由分析知氢气的温度mRMPV T =,则氢气分子的平均平动动能为 ()8932323k ./===mR pVMk kT ε12 -11 温度为0 ℃和100 ℃时理想气体分子的平均平动动能各为多少?欲使分子的平均平动动能等于1eV ,气体的温度需多高?解 分子在0℃和100 ℃时平均平动动能分别为J 10655232111-⨯==./kT εJ 10727232122-⨯==./kT ε由于1eV =1.6×10-19 J ,因此,分子具有1eV 平均平动动能时,气体温度为K 10737323k ⨯==./k T ε这个温度约为7.5 ×103 ℃.12 -12 某些恒星的温度可达到约1.0 ×108K ,这是发生聚变反应(也称热核反应)所需的温度.通常在此温度下恒星可视为由质子组成.求:(1) 质子的平均动能是多少? (2) 质子的方均根速率为多大?分析 将组成恒星的大量质子视为理想气体,质子可作为质点,其自由度 i =3,因此,质子的平均动能就等于平均平动动能.此外,由平均平动动能与温度的关系2/32/2kT m =v ,可得方均根速率2v .解 (1) 由分析可得质子的平均动能为J 1007.22/32/3152k -⨯===kT m εv(2) 质子的方均根速率为1-62s m 1058.132⋅⨯==mkT v 12 -13 试求温度为300.0 K 和2.7 K(星际空间温度)的氢分子的平均速率、方均根速率及最概然速率.分析 分清平均速率v 、方均根速率2v 及最概然速率p v 的物理意义,并利用三种速率相应的公式即可求解.解 氢气的摩尔质量M =2 ×10-3kg·mol -1 ,气体温度T 1 =300.0K ,则有 1-31s m 1078.18⋅⨯==MπRT v 1-312s m 1093.13⋅⨯==MRT v 1-31p s m 1058.12⋅⨯==M RT v 气体温度T 2=2.7K 时,有1-31s m 1069.18⋅⨯==MπRT v 1-322s m 1083.13⋅⨯==MRT v 1-31p s m 1050.12⋅⨯==M RT v 12 -14 如图所示,Ⅰ、Ⅱ两条曲线分别是氢气和氧气在同一温度下的麦克斯韦分子速率分布曲线.试由图中数据求:(1)氢气分子和氧气分子的最概然速率;(2) 两种气体所处的温度;(3) 若图中Ⅰ、Ⅱ分别表示氢气在不同温度下的麦克斯韦分子速率分布曲线.则哪条曲线的气体温度较高?分析 由MRT 1p 2=v 可知,在相同温度下,由于不同气体的摩尔质量不同,它们的最概然速率v p 也就不同.因22O H M M <,故氢气比氧气的v p 要大,由此可判定图中曲线Ⅱ所标v p=2.0 ×103 m·s -1 应是对应于氢气分子的最概然速率.从而可求出该曲线所对应的温度.又因曲线Ⅰ、Ⅱ所处的温度相同,故曲线Ⅰ中氧气的最概然速率也可按上式求得.同样,由M RT2p =v 可知,如果是同种气体,当温度不同时,最概然速率v p 也不同.温度越高,v p 越大.而曲线Ⅱ对应的v p 较大,因而代表气体温度较高状态.解 (1) 由分析知氢气分子的最概然速率为()13H p s m 100.222H 2-⋅⨯==M RT v 利用M O2 /M H2 =16 可得氧气分子最概然速率为 ()()12H p O p s m 100.54/22-⋅⨯==v v (2) 由M RT2p =v 得气体温度K 1081.42/22p⨯==R M T v (3) Ⅱ代表气体温度较高状态.12 -15 日冕的温度为2.0 ×106K ,所喷出的电子气可视为理想气体.试求其中电子的方均根速率和热运动平均动能.解 方均根速率16e2s m 105.93-⋅⨯==m kT v 平均动能J 10142317k -⨯==./kT ε12 -16 在容积为2.0 ×10-3m 3 的容器中,有内能为6.75 ×102J 的刚性双原子分子某理想气体.(1) 求气体的压强;(2) 设分子总数为5.4×1022 个,求分子的平均平动动能及气体的温度. 分析 (1) 一定量理想气体的内能RT i M m E 2=,对刚性双原子分子而言,i =5.由上述内能公式和理想气体物态方程pV =mM RT 可解出气体的压强.(2)求得压强后,再依据题给数据可求得分子数密度,则由公式p =nkT 可求气体温度.气体分子的平均平动动能可由23k /kT ε=求出.解 (1) 由RT i M m E 2=和pV =mM RT 可得气体压强 ()Pa 1035125⨯==./iV E p(2) 分子数密度n =N/V ,则该气体的温度()()Pa 106235⨯===.//nk pV nk p T气体分子的平均平动动能为J 104972321k -⨯==./kT ε12 -17温度相同的氢气和氧气,若氢气分子的平均平动动能为6.21×10-21J ,试求(1) 氧气分子的平均平动动能及温度;(2) 氧气分子的最概然速率.分析 (1) 理想气体分子的平均平动动能23k /kT ε=,是温度的单值函数,与气体种类无关.因此,氧气和氢气在相同温度下具有相同的平均平动动能,从而可以求出氧气的温度.(2) 知道温度后再由最概然速率公式M RT2p =v 即可求解v p .解 (1) 由分析知氧气分子的平均平动动能为J 102162321k -⨯==./kT ε,则氧气的温度为: K 30032k ==k εT /(2) 氧气的摩尔质量M =3.2 ×10-2 kg·mol -1 ,则有12p s m 1095.32-⋅⨯==MRT v12 -18 声波在理想气体中传播的速率正比于气体分子的方均根速率.问声波通过氧气的速率与通过氢气的速率之比为多少? 设这两种气体都是理想气体并具有相同的温度. 分析 由题意声波速率u 与气体分子的方均根速率成正比,即2v ∝u ;而在一定温度下,气体分子的方均根速率M /12∝v ,式中M 为气体的摩尔质量.因此,在一定温度下声波速率M u /1∝.解 依据分析可设声速M A u /1=,式中A 为比例常量.则声波通过氧气与氢气的速率之比为2502222O H O H .==M M u u12 -19 已知质点离开地球引力作用所需的逃逸速率为gr v 2=,其中r 为地球半径.(1)若使氢气分子和氧气分子的平均速率分别与逃逸速率相等,它们各自应有多高的温度;(2) 说明大气层中为什么氢气比氧气要少.(取r =6.40 ×106 m) 分析 气体分子热运动的平均速率MπRT8=v ,对于摩尔质量M 不同的气体分子,为使v 等于逃逸速率v ,所需的温度是不同的;如果环境温度相同,则摩尔质量M 较小的就容易达到逃逸速率.解 (1) 由题意逃逸速率gr 2=v ,而分子热运动的平均速率MπRT8=v .当v v = 时,有RMrgπT 4=由于氢气的摩尔质量13H molkg 10022--⋅⨯=.M ,氧气的摩尔质量12O mol kg 10232--⋅⨯=.M ,则它们达到逃逸速率时所需的温度分别为K 10891K,101815O 4H 22⨯=⨯=..T T(2) 根据上述分析,当温度相同时,氢气的平均速率比氧气的要大(约为4倍),因此达到逃逸速率的氢气分子比氧气分子多.按大爆炸理论,宇宙在形成过程中经历了一个极高温过程.在地球形成的初期,虽然温度已大大降低,但温度值还是很高.因而,在气体分子产生过程中就开始有分子逃逸地球,其中氢气分子比氧气分子更易逃逸.另外,虽然目前的大气层温度不可能达到上述计算结果中逃逸速率所需的温度,但由麦克斯韦分子速率分布曲线可知,在任一温度下,总有一些气体分子的运动速率大于逃逸速率.从分布曲线也可知道在相同温度下氢气分子能达到逃逸速率的可能性大于氧气分子.故大气层中氢气比氧气要少.12 -20 容积为1m 3 的容器储有1mol 氧气,以v =10m·s -1 的速度运动,设容器突然停止,其中氧气的80%的机械运动动能转化为气体分子热运动动能.试求气体的温度及压强各升高了多少.分析 容器作匀速直线运动时,容器内分子除了相对容器作杂乱无章的热运动外,还和容器一起作定向运动.其定向运动动能(即机械能)为m v 2/2.按照题意,当容器突然停止后,80%定向运动动能转为系统的内能.对一定量理想气体内能是温度的单值函数,则有关系式:()T R M m mv E Δ25%80Δ2⋅=⋅=成立,从而可求ΔT .再利用理想气体物态方程,可求压强的增量.解 由分析知T R M m m E Δ252/8.0Δ2⋅==v ,其中m 为容器内氧气质量.又氧气的摩尔质量为12mol kg 1023--⋅⨯=.M ,解得ΔT =6.16 ×10-2 K当容器体积不变时,由pV =mRT/M 得Pa 51.0ΔΔ==T VRM m p 12 -21 有N 个质量均为m 的同种气体分子,它们的速率分布如图所示.(1) 说明曲线与横坐标所包围的面积的含义;(2) 由N 和0v 求a 值;(3) 求在速率0v /2到30v /2 间隔内的分子数;(4) 求分子的平均平动动能.分析 处理与气体分子速率分布曲线有关的问题时,关键要理解分布函数()v f 的物理意义.()v v d /d N N f =,题中纵坐标()v v d /d N Nf =,即处于速率v 附近单位速率区间内的分子数.同时要掌握()v f 的归一化条件,即()1d 0=⎰∞v v f .在此基础上,根据分布函数并运用数学方法(如函数求平均值或极值等),即可求解本题.解 (1) 由于分子所允许的速率在0 到20v 的范围内,由归一化条件可知图中曲线下的面积()1d 0=⎰∞v v f即曲线下面积表示系统分子总数N .(2 ) 从图中可知, 在0 到0v 区间内,()0/v v v a Nf ;而在0 到20v 区间,()αNf =v .则利用归一化条件有v v v vv ⎰⎰+=0020d d v v a a N(3) 速率在0v /2到30v /2间隔内的分子数为0003/2/20Δd d 7/12v a N a N =+=⎰⎰v v v vv v v (4) 分子速率平方的平均值按定义为()v v f v v v d /d 02022⎰⎰∞∞==N N故分子的平均平动动能为20220302K 3631d d 2121000v v v v v v v v v v m N a N a m m ε=⎥⎦⎤⎢⎣⎡+==⎰⎰ 12 -22 试用麦克斯韦分子速率分布定律导出方均根速率和最概然速率. 分析 麦克斯韦分子速率分布函数为()⎪⎪⎭⎫ ⎝⎛-⎪⎭⎫⎝⎛=kT m kT m f 2exp π2π4222/3v v v采用数学中对连续函数求自变量平均值的方法,求解分子速率平方的平均值,即⎰⎰=NNd d 22v v , 从而得出方均根速率.由于分布函数较复杂,在积分过程中需作适当的数学代换.另外,最概然速率是指麦克斯韦分子速率分布函数极大值所对应的速率,因而可采用求函数极值的方法求得.解 (1) 根据分析可得分子的方均根速率为2/1242/302/1022d 2exp π2π4/d ⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛=⎰⎰∞v v v v v kT m kT m N N N令222/x kT m =v ,则有2/12/12/104273.13d 2π42⎪⎭⎫⎝⎛=⎪⎭⎫⎝⎛=⎥⎦⎤⎢⎣⎡=⎰∞-m RT m kT x e x m kT x v(2) 令()0d d =v v f ,即02exp 222exp 2π2π42222/3=⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛--⎪⎪⎭⎫ ⎝⎛-⎪⎭⎫⎝⎛kT m kT m kT m T k m v vv v v得 2/12/141.12⎪⎭⎫⎝⎛≈⎪⎭⎫⎝⎛==m RT m kT P v v12 -23 导体中自由电子的运动可看作类似于气体分子的运动(故称电子气).设导体中共有N 个自由电子,其中电子的最大速率为v F (称为费米速率).电子在速率v v v d ~+之间的概率为()()⎪⎩⎪⎨⎧>>>=v v v v v v0,0 d π4d F 2A NA N N (1)画出分布函数图;(2) 用N 、v F 定出常数A ;(3) 证明电子气中电子的平均动能53F /εε=,其中22F F /mv =ε.分析 理解速率分布函数的物理意义,就不难求解本题.速率分布函数()vv d d 1NN f =,表示在v 附近单位速率区间的粒子数占总粒子数的百分比.它应满足归一化条件()()⎰⎰=∞Fd d v v v v v f f , 因此根据题给条件可得()v v ~f 的函数关系,由此可作出解析图和求出A .在()v v ~f 函数关系确定的情况下,由()v v v v d 22f ⎰=可以求出v2 ,从而求出2/2v m ε=.解 (1) 由题设可知,电子的速率分布函数()()()⎪⎩⎪⎨⎧>>>=F F 200 π4v v v v v v NA f ,其分布函数图如图所示.(2) 利用分析中所述归一化条件,有1d π4F2=⎰v v v NA 得 3Fπ4/3v N A = (3) ()53d N 4ππd 2F2022Fv v v v v v v v ===⎰⎰∞f 5/32/F 2εm ε==v12 -24 一飞机在地面时,机舱中的压力计指示为Pa 100115⨯.,到高空后压强降为Pa 101184⨯..设大气的温度均为27.0 ℃.问此时飞机距地面的高度为多少?(设空气的摩尔质量为2.89 ×10-2 kg·mol -1 )分析 当温度不变时,大气压强随高度的变化主要是因为分子数密度的改变而造成.气体分子在重力场中的分布满足玻耳兹曼分布.利用地球表面附近气压公式()kT mgh p p /exp 0-=,即可求得飞机的高度h .式中p 0 是地面的大气压强.解 飞机高度为()()m 1093.1/ln /ln 300⨯===p p MgRT p p mg kT h 12 -25 在压强为Pa 1001.15⨯下,氮气分子的平均自由程为6.0×10-6cm,当温度不变时,在多大压强下,其平均自由程为1.0mm 。
气体分子运动和热力学基础(精)

第二篇气体分子运动和热力学基础热学是研究与热现象有关的物质运动规律的科学。
表示物体冷热程度的物理量是温度,把与温度有关的物理性质及状态的变化称为热现象,热现象是物质中大量分子无规则运动的集体表现。
物体是由大量分子、原子组成的,这些微观粒子的不停的、无规则的运动称为分子热运动。
热学发展简史18世纪初,资本主义发展的初期,社会生产已有很大发展,生产中遇到的热现象增多了,因而提供不少关于热现象的知识,当时生产上需要动力,因而产生了利用热来获得机械功的企图,这样一来,开始了对热现象进行比较广泛的研究。
1714年,华伦海脱改良了水银温度计并制定了华氏温标,热学的研究从此走上实验科学的道路。
18世纪中期,瓦特制成了蒸汽机,人们多年来想利用热来获得机械功的愿望实现了。
随着蒸汽机在生产上被广泛地利用,提高效率便成为首要任务,同时也促使人们对热的本质进行深入的研究。
关于热的本质问题,有两种对立的学说:热质说——热是一种元素,它可以透入任何物体中,不生不灭,较热物体含较多的热质。
热是物质运动的一种表现,热是一种能量,能够与机械能互相转化。
热力学第一定律确立了热和机械功相互转化的数量关系,热力学第二定律告诉人们如何提高热机效率,热力学的两个基本定律都是从研究热和功的相互转化问题总结出来的,然而,热力学理论的应用远远地超出了这一问题的范围。
在热力学发展的同时,即19世纪中期,分子运动论也开始飞速地发展,为了改进热机的设计,对热机的工作物质——气体——的性质进行了广泛的研究,气体动理论便是围绕着气体性质的研究发展起来的。
克劳修斯首先从分子运动论的观点导出了玻意耳定律。
麦克斯韦最初应用统计概念研究分子的运动,得到了分子运动的速度分布定律。
玻耳兹曼认识到统计概念有原则性的意义,他给热力学第二定律以统计解释。
后来,吉布斯进一步发展了麦克斯韦和玻耳兹曼的理论,建立了系统的统计法,统计物理学至此发展成为完整的理论。
热学的研究方法:1.宏观法Macroscopic method最基本的实验规律 逻辑推理(运用数学)——称为热力学优点:具有高度的可靠性和普遍性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
v
2 x
v
2 y
v
2 z
1 v2 3
2021/4/14
3.3 理想气体的压强公式
1. 从气体分子运动看气体压强的形成
气体的压强是由大量分子在和器壁碰撞中不断
给
器壁以力的作用所引起的.
气体的压强
在数值上等于单
位时间内与器壁
相碰撞的所有分
子作用于器壁单
位面积上的总冲
量.
2021/4/14
y
2. 理想气体的压强公式
(3) 混合理想气体的状态方程为:
其中 p pi
i
2021/4/14
pV m RT M
m mi
i
M m
i
i
设质量为m的气体的分子数为N, 分子的质量为μ,
1mol气体的分子数为NA , 1mol气体的质量为M.
有:
m= μ N
M= μ NA
理想气体物态方程:
pV m RT M
p 1 N RT N R T
2021/4/14
2. 热平衡
A、B两系统用绝热板隔开各自达到平衡态
A
B
A、B两系统用传热板隔开两系统各自的
平衡态被破坏, 最后达到共同的新的平衡
A
状态——热平衡
B
3. 热力学第零定律
设 A 和 B、A 和 C 分别达到
A
A
热平衡,则 B 和 C 一定达到 B C
BC
热平衡.
2021/4/14
4. 温度与温标 温度: 表征热平衡状态下系统的宏观性质. 温度计——用来测量系统温度 温标——温度的数值表示法 摄氏温标:t ℃ 热力学(开氏)温标: T K 理想气体温标: 水的三相点作为一个定标点
气体动理论
内容提要
1 热力学系统 平衡态 状态参量 2 理想气体状态方程 3 理想气体的压强 4 理想气体的温度公式 5 能量均分定理 理想气体内能 6 麦克斯韦速率分布率 8 气体分子的平均自由程和碰撞频率
2021/4/14
1 热力学系统 平衡态 状态参量
1.1 热力学系统 1. 系统和外界 热力学系统 热力学所研究的具体对象,简称系统. (工作物质) 系统是由大量分子组成,如气缸中的气体.
一个分子与器壁A1碰撞一次 分子动量的改变为:
-2μvx 两次碰撞所需时间为:
2l1/vx
zA2
vy
vz l1
v
vx
A1 l2
l3 x
单位时间内,一个分子与器壁A1 碰撞次数为: vx/2l1 .
单位时间内一个分子的多次碰撞给予器壁A1的冲量为:
2021/4/14
2vx
vx 2l1
vx 2
l1
由压强定义:
V NA
V NA
k R 1.381023 J K1 ——玻耳兹曼常量
NA N n ——分子数密度
即: p nkT
V
理想气体的压强与分子数
2021/4/14
密度和温度的乘积成正比.
例: 一柴油的汽缸容积为 0.827×10-3 m3 . 压缩前汽缸 的空气温度为320 K, 压强为8.4×104 Pa ,当活塞
T 273.16K
t = T - 273.15
2021/4/14
2 理想气体状态方程
对于处于平衡态的一定量的气体,其宏观参量p、 V、T之间满足下方程:
气体物态方程: T f ( p,V )
理想气体物态方程:
pV
m
RT
RT(克拉珀龙方程)
M
其中:
m为气体的质量;
M为1mol气体分子的质量, 简称摩尔质量;
急速推进时可将空气压缩到原体积的 1/17 , 使压 强增大到 4.2×106 Pa .
求: 这时空气的温度.
解:
p1V1 p2V2
T1
T2
T2
p2V2 p1V1
T1
T2
4.2 106 8.4 1041 17320941K
T2 > 柴油的燃点 若在这时将柴油喷入汽缸,柴油将立即燃烧, 发生爆炸,推动活塞作功,这就是柴油机点火的原理.
m 为气体的物质的量;
M
R为一常量,称为摩尔气体常量. R=8.31(J·mol-1·K-1)
2021/4/14
说明 (1) 理想气体的宏观定义:在任何条件下都严格遵
守 (2克) 实拉际珀气龙体方在程压的强气不体太;高,温度不太低的条件下,
可当作理想气体处理. 且温度越高、压强越低, 精确度越高.
2021/4/14
3 理想气体的压强
3.1 理想气体的微观模型 ① 分子本身的大小与分子间平均距离相比可以忽略
不计,分子间的平均距离很大,分子可以看作是质点. ② 除碰撞的瞬间外, 分子间的相互作用力可忽略不计.
因此在两次碰撞之间, 分子的运动可当作匀速直线 运动. ③ 气体分子间的碰撞以及气体分子与器壁间的碰撞 可看作是完全弹性碰撞. 理想气体分子的微观模型:
说明
(1) 不受外界影响是指系统与外界不通过做功或传热的 方式交换能量,如:
两头处于冰水、沸水中的金属棒 是一种稳定态,而不是平衡态. 高温T1
低温T2
(2) 平衡态是一种理想状态, 是热动平衡状态. (3) 平衡态可用p-V图上的一个点来表示. p
2021/4/14
O
V
1.3 状态参量 1. 状态参量:描写系统平衡态的变量. 压强(p) 作用于容器器壁上单位面积的正压力(大量分子
与器壁及分子之间不断碰撞而产生的宏观效果) 体积(V) 气体分子可能到达的整个空间的体积 温度(T) 物体冷热程度的量度(大量分子热运动的剧烈程度)
压强(p)的单位: 帕斯卡 符号: Pa
1Pa=1N/m2 , 1atm=1.01325 105Pa=760mmHg 体积(V)的单位:立方米 符号: m3 热力学温度(T)的单位:开尔文 符号: K
外界 系统以外的物体. 2. 系统的分类
系统
开放系统 系统与外界之间,既有物质交换,又有能量交换. 封闭系统 系统与外界之间,没有物质交换,只有能量交换. 孤立系统 系统与外界之间,既无物质交换,又无能量交换.
2021/4/14
1.2 平衡态 在不受外界影响的情况下,系统的宏观性质不
随时间改变的状态.
自由地无规则地运动着的弹性质点群.
2021/4/14
3.2 平衡状态气体的统计假设 ① 没有一个分子比其他分子占有优势. ② 任一位置单位体积内的分子数不比其它位置占优势
分子均匀分布. ③ 分子沿任一方向的运动不比沿其它方向的运动占优
势 分子速度在各个方向上的分量的各种平均值都 相等,特别地:
v2 v2 x v2 y v2 z
p F
l2l3
l1l2l3
N
vi2x
i 1
l1l2l3
(v12x
v22x
vN2
x)
N (v12x v22x vN2 x )
l1l2l3
