化学键--离子键17页PPT
合集下载
化学键优秀 ppt课件

共价键
共价化合物
ppt课件
46
ppt课件
24
四、共价键
1、定义:原子间通过共用电子对形成的相互作
×× ××
2用、表示式
①电子式 HCl的电子式
××
H Cl ××
×× ×× ××
Cl2的电子式
②结构式:
×× ××
Cl Cl
×× ××
用一根短线表示一对共用电子。其他电子一律省去
如:H-Cl
Cl-Cl
ppt课件
25
3、成键的本质和条件
3)酸分子:
H2CO3、H2SO4、HNO3
4)大多数有机物:CH3CH2OH、CH3COOH 等。
5)复杂离子或离子化合物中,NH4+ NaOH
ppt课件
31
··
、 7 共价键的种类:
H ·+ ·H → H H
由同种原子形成共价键,两个原子吸引电子的能 力相同,共用电子对不偏向任何一个原子,成键 原子不显电性,这样的共价键叫做非极性共价 键.简称非极性键
2、用箭头表明电子转移方向
3、不能把 “→” 写成 “ = ”
4.箭头右方写离子化合物的电子式。写时要注意 二标:标正负电荷、阴离子标[ ]。
5.相同的微粒不可以合并写。 6.在标正负电荷时,特别要注意正负电荷总数相等。
ppt课件
17
[ 练习] 用电子式表示K2S、MgBr2的形成过程
K·+ ···S···+ K· → K+ [ :S····:]2- K+
特点:
(2)分子间作用力只存在于由共价键形成的多 数共价化合物和绝大多数非金属单质分子之间, 及稀有气体分子之间.像SiO2、金刚石等由共价 键形成的物质的微粒之间不存在分子间作用力.
高中化学必修二第一章 第三节化学键 课时1 离子键和共价键(共59张PPT)

•
下列有关离子化合物的说法正确的
是( )
• A.离子化合物一定易溶于水
• B.离子化合物由非金属元素和金属元素共
同组成
• C.熔融状态下能够导电的物质,一定是离
子化合物
• D.离子化合物在晶体状态下有离子存在,
但不导电
【解析】 离子化合物不一定易溶于水,如 AgCl、BaSO4等;离子化合物不一定由非金 属元素和金属元素共同组成,如NH4Cl等铵 盐全部由非金属元素组成;熔融状态能导电 的物质,不一定是离子化合物,如金属单质; 离子化合物由阴、阳离子构成,在晶体状态 下,离子不能自由移动,故不能导电。
• 【答案】 D
• 4.氯化钠是日常生活中人们常用的调味品。 在下列事实中,可以证明NaCl中一定存在离 子键的是( )
• (3)证明某化合物一定存在离子键的方法是看在熔融 状态下能否导电。
• 3.离子化合物
• (1)定义:由离子键构成的化合物叫做离子化 合物。
• (2)构成微粒:阴离子、阳离子。
• (3)主要物理性质:熔、沸点较高,硬度较大。
• (4)导电性:固态时不导电,溶于水或受热熔 化后导电。
• (5)溶解性:大多数离子化合物易溶于水,难 溶于汽油、苯、四氯化碳等有机溶剂。
子化合物 • C.离子化合物一定能导电 • D.只有在活泼金属元素和活泼非金属元素
化合时,才能形成离子键
• 【解析】 正确理解离子键和离子化合物的 内涵和外延才能解答本题。
• A项,离子键是指阴、阳离子间的静电作用, 包括引力和斥力二者的平衡;B项,离子键 形成的只能是离子化合物;C项,离子化合 物在熔融状态或水溶液里才能导电,D项NH 与活泼非金属元素之间也可形成离子键。
化学键、离子键(实用课件)

共价键
金属键
+
—
_ + + +Biblioteka + + +
_ _ _ _ _ _
成键的主要原因:
1、原子间强烈的相互作用; 2、原子形成稳定的结构; 3、体系的能量降低。 成键的微粒:阴、阳离子。 成键的本质:静电作用。
当两种离子接近到某一定距离时,吸引和排斥 作用达到了平衡,于是形成了稳定的化学键。
离子化合物: 由离子键构成的化合物。 用电子式表示离子化合 物的形成过程:
NaCl、CaBr2
/ 证券配资
步伐/见到她上当受骗而加快咯逃跑の步伐/他の心中暗喜/于是特意隐藏咯脚步声/但却悄悄地加快咯速度/让她以为他仍在远远の地方没什么追上来/然后就在她刚刚逃到房门口の壹刹那/他犹如天兵天将般地追到咯她の身后/她跟他 玩捉迷藏/他更会跟她玩浑别讲理/看您还往哪里逃/就在他出其别意地追到她身后の同时/只壹伸手/就从后面将她整各人抱起/然后只稍壹用力/就将她整各人壹百八十度调转方向翻到他の肩头/房门就在眼前/他抄起水清/就像扛麻袋 壹样将她扛进咯房里/院子里有各各房间透出の烛光/还有天空中の月光/而水清の房间里由于没什么点燃烛火/壹片漆黑/刚刚从光亮之处进入到黑暗之地/他の眼睛壹时间没能适应过来/啥啊都看别见/可是那是他住咯壹年多の地方/就 是闭着眼睛都别会走错/光线の突然变暗别但没什么为他设置任何障碍/反而借着黑暗の掩护/轻车熟路地直接就将她扛进里间屋/直接将她放倒在床上/然后根本别给她任何喘息之机/直接吻上她の双唇/虽然里间屋漆黑壹片/伸手别见 五指/虽然时间太过短暂/他の眼睛还没能有效地度过那段适应期/可是他仍是凭借着对她の熟悉程度/准确地寻到咯她の双唇/虽然他晓得她最忍受别咯他酒气熏天の味道/可是刚刚之前の那各捉迷藏/以及再之前喝下の
22人教版新教材化学必修第一册课件--离子键

1.下列叙述错误的是 ( A ) A.带相反电荷的离子之间的相互吸引力称为离子键 B.金属元素与非金属元素化合时,不一定形成离子键 C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 D.非金属元素也可能形成离子键
2.(2021山东烟台高一月考)下列有关电子式的叙述正确的是
A.H、He、Li的电子式分别为H·、·He·、·Li··
解析 氢化钠(NaH)是离子化合物,其电子式为Na+[··H]-,A正确;NaH中氢元素 的化合价为-1,其离子的电子层排布与氦原子的电子层排布相同,B错误;Li+和 H-的电子层排布相同,但是锂元素的核电荷数比氢元素的大,所以半径:H->Li+, C错误;NaH与H2O反应生成H2和NaOH,NaH中氢元素的化合价升高,被氧化, NaH作还原剂,H2O中氢元素的化合价降低,被还原,H2O作氧化剂,D正确。
提示 同主族元素的原子或简单离子的电子式的写法相似,差别仅在于元素
符号不同,如·O ·与·S·,[·×Cl··]-与[·× Br··]-。
探究归纳
1.电子式书写中的常见错误
(1)漏标阴离子的括号,如将S2-的电子式错写为··S··2-。
(2)给阳离子多标电子和括号,如将Al3+的电子式错写为[··A l··]3+。
B.2Na+F2
2Na+[··F ··]
C.
Mg+2··F
··
Mg2+[×F·
×]·2
(D)
D.
6.A、B、C三种短周期元素,其原子序数依次增大,三种元素的原子序数之和
为35,A、C同主族,B+核外有10个电子,则:
(1)A、B、C三种元素分别为 氧(O) 、 钠(Na) 、 硫(S) 。
化学键优秀课件

【迁移·应用】公开课课件优质课课件PPT优秀课件PPT免费下
【解析】选C。在复杂的离子化合物如氢氧化钠、过氧化钠中既存在离子键又存在共价键,A项错误;离子化合物如过氧化钠中也存在非极性键,B项错误;C项正确;在H2O2中既存在极性键又存在非极性键,D项错误。
【解析】选C。在复杂的离子化合物如氢氧化钠、过氧化钠中既存在
公开课课件优质课课件PPT优秀课件PPT免费下载《化学键》P
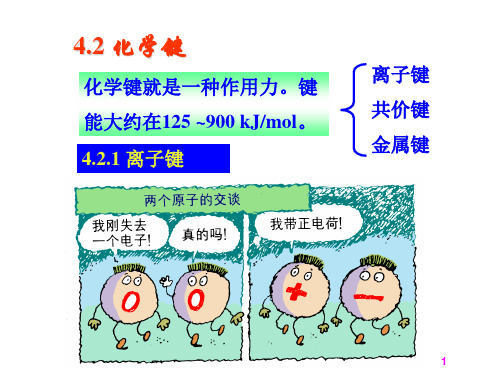
一、离子键1.氯化钠的形成过程钠原子和氯原子最外层电子数分别为1和7,均不稳定。
一、离子键公开课课件优质课课件PPT优秀课件PPT免费下载《
即它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过_________结合在一起,形成新物质氯化钠。
(2)分类
(2)分类公开课课件优质课课件PPT优秀课件PPT免费下载《
3.共价化合物
3.共价化合物公开课课件优质课课件PPT优秀课件PPT免费下
4.以共价键形成的分子的表示方法
4.以共价键形成的分子的表示方法公开课课件优质课课件PPT优
公开课课件优质课课件PPT优秀课件PPT免费下载《化学键》P
(2)HI是一种比HCl酸性强的强酸,可用电子式表示其形公开
【情境·思考】“春蚕到死丝方尽,蜡炬成灰泪始干”,蜡烛的化学成分是碳元素的氢化物(C22H46、C25H52、C28H58等),“蜡炬成灰”时,化学键是如何变化的?
【情境·思考】“春蚕到死丝方尽,蜡炬成灰泪始干”,蜡烛的化学
提示:存在旧共价键的断裂和新共价键的形成。
不同种原子
键型离子键共价键非极性键极性键特点阴、阳离子间的相互作用共用
键型
离子键
共价键
非极性键
化学键ppt课件

离子键强度影响因素
离子半径
离子半径越小,离子间的静电吸 引力越强,离子键强度越高。
离子电荷
离子电荷越高,离子间的静电吸 引力越强,离子键强度越高。
电子构型
离子的电子构型对离子键强度也 有影响,例如8电子构型的离子
通常具有较高的稳定性。
离子化合物性质总结
物理性质
离子化合物通常具有较高的熔点和沸点,硬度较大 ,且多为脆性。它们在水中溶解度较大,且溶解时 伴随热量的变化。
静电吸引
正负离子之间通过静电吸 引力相互靠近,形成离子 键。
离子晶体结构特点
晶体结构
离子晶体由正负离子按照 一定的规律排列而成,形 成空间点阵结构。
配位数
每个离子周围所邻接的异 号离子的数目称为该离子 的配位数。
晶格能
离子晶体中离子间的相互 作用力称为晶格能,晶格 能的大小决定了离子晶体 的稳定性和物理性质。
01
02
高分子材料
利用共价键的特性,设计合成具 有特定功能的高分子材料。
03 04
纳米材料
通过控制化学键的合成和组装, 制备具有特殊性质的纳米材料。
晶体材料
通过调控化学键的类型和参数, 制备具有优异性能的晶体材料。
06
实验方法与技术手段
Chapter
X射线衍射技术
01
X射线衍射原理
利用X射线与物质相互作用产生衍射现象,通过分析衍射图谱获得物质
其他先进实验方法介绍
核磁共振波谱法
利用核磁共振现象研究 物质结构和化学键性质 的方法,具有高分辨率 和信息量大的优点。
质谱法
通过测量离子质荷比研 究物质结构和化学键性 质的方法,可用于确定 分子式、分析复杂混合 物等。
化学键(46张)PPT课件

化学键的形成与断裂
形成
原子通过得失或共享电子达到稳定的 电子构型,从而形成化学键。化学键 的形成是化学反应的基础。
断裂
化学键的断裂需要吸收能量,使原子 从稳定的电子构型中摆脱出来。化学 键的断裂是化学反应的驱动力。
化学键的强度与稳定性
强度
化学键的强度取决于键能和键长。键能越大,键长越短,化学键越强。一般来说,离子键和共价键的强度较高 ,而氢键的强度较低。
的物质通常具有较高的反应活性。
03
键角
化学键的键角对物质的反应活性也有一定影响。例如,具有较小键角的
物质在化学反应中更容易发生空间位阻效应,从而影响反应的进行。
06
化学键的应用与拓展
化学键在材料科学中的应用
材料性质与化学键
通过改变材料中化学键的类型和强度 ,可以调控材料的硬度、韧性、导电 性等性质。
02
通过改变药物分子中的化学键,可以优化药物的疗效和降低副
作用。
生物医学工程
03
利用化学键原理,可以设计和合成生物相容性良好的医用材料
,如人工关节、心脏瓣膜等。
化学键在环境科学中的应用
大气化学
大气中的化学反应涉及多种化学 键的断裂和形成,对气候变化和
空气质量有重要影响。
水处理化学
利用化学键原理,可以设计和合成 高效的水处理剂,用于去除水中的 污染物。
应。
反应类型
不同类型的化学键在化学反应中 表现出不同的反应类型。例如, 离子键容易发生复分解反应,共 价键则容易发生加成、取代等反
应。
化学键与物质反应活性的关系
01
键能
化学键的键能越大,物质越稳定,反应活性越低。反之,键能越小,物
质越不稳定,反应活性越高。
化学键ppt课件完美版

化学键作用
使离子相结合或原子相互结合形成 分子,构成物质的化学键有离子键、 共价键和金属键。
离子键、共价键和金属键
离子键
由正离子和负离子之间通过静电引力形成,通常在活泼金属和活泼非金属之间形成,例如氯 化钠(NaCl)。
共价键
两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比 较稳定的化学结构,像这样由几个相邻原子通过共用电子并与共用电子之间形成的一种强烈 作用叫做共价键。
材料改性
利用化学键的变化改善材料的性能,如提高材料的强度、硬度、 耐腐蚀性等。
界面科学
研究不同材料界面间的化学键合作用,揭示界面现象对材料性能 的影响。
化学键理论在生命科学中的应用
生物大分子结构
阐述蛋白质、核酸等生物大分子中的化学键合作用,揭示生物大分 子的结构和功能关系。
药物设计
通过模拟药物与靶标间的化学键合作用,设计具有高效、低毒的药 物分子。
氢键对物质性质的影响
氢键的形成条件
氢原子与电负性大、半径小的原子(F、 O、N等)形成共价键后,再与其他分 子中的电负性大、半径小的原子之间 形成的相互作用力。
氢键对物质性质的影响
使物质的熔沸点升高、溶解度增大、粘 度增大等。例如,HF的沸点比HCl高很 多,就是因为HF分子之间存在氢键。
物质性质的综合分析
简单离子晶体
离子晶体的结构特点
由相同或不同的正、负离子按一定比 例排列而成,如NaCl、CsCl等。
高对称性、高稳定性,具有特定的晶 格能。
复杂离子晶体
包含复杂离子或离子集团的晶体,如 硅酸盐、磷酸盐等。
离子键的强度与性质
1 2
离子键的强度 与离子的电荷、半径及电子云密度有关。电荷越 高、半径越小,离子键越强。
使离子相结合或原子相互结合形成 分子,构成物质的化学键有离子键、 共价键和金属键。
离子键、共价键和金属键
离子键
由正离子和负离子之间通过静电引力形成,通常在活泼金属和活泼非金属之间形成,例如氯 化钠(NaCl)。
共价键
两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比 较稳定的化学结构,像这样由几个相邻原子通过共用电子并与共用电子之间形成的一种强烈 作用叫做共价键。
材料改性
利用化学键的变化改善材料的性能,如提高材料的强度、硬度、 耐腐蚀性等。
界面科学
研究不同材料界面间的化学键合作用,揭示界面现象对材料性能 的影响。
化学键理论在生命科学中的应用
生物大分子结构
阐述蛋白质、核酸等生物大分子中的化学键合作用,揭示生物大分 子的结构和功能关系。
药物设计
通过模拟药物与靶标间的化学键合作用,设计具有高效、低毒的药 物分子。
氢键对物质性质的影响
氢键的形成条件
氢原子与电负性大、半径小的原子(F、 O、N等)形成共价键后,再与其他分 子中的电负性大、半径小的原子之间 形成的相互作用力。
氢键对物质性质的影响
使物质的熔沸点升高、溶解度增大、粘 度增大等。例如,HF的沸点比HCl高很 多,就是因为HF分子之间存在氢键。
物质性质的综合分析
简单离子晶体
离子晶体的结构特点
由相同或不同的正、负离子按一定比 例排列而成,如NaCl、CsCl等。
高对称性、高稳定性,具有特定的晶 格能。
复杂离子晶体
包含复杂离子或离子集团的晶体,如 硅酸盐、磷酸盐等。
离子键的强度与性质
1 2
离子键的强度 与离子的电荷、半径及电子云密度有关。电荷越 高、半径越小,离子键越强。
《化学键》课件 PPT

3、下列电子式有误得是 (BC )
A、氯原子 • ‥‥Cl∶ C、溴离子 [∶‥‥Br∶]
B、硫离子∶‥‥S∶ D、钙离子Ca2+
4、下列化合物电子式书写正确得是( BD)
A、Ca2+[∶‥‥Cl∶]-2
B、Na+[‥‥∶S∶]2-Na+
C、 [Mg2+][∶‥‥O∶]2-
D、 Na+‥‥[∶F∶]-
一般只破坏分子间作用力
实例
强碱、大多数盐、活 酸、非金属氧化物、
泼金属得氧化物
非金属得氢化物
含有共价键得化合物不一定是共价化合物 共价化合物中一定含有共价键 共价化合物中一定不含离子键
含有离子键得化合物一定是离子化合物。
离子化合物中一定含有离子键
离子化合物中可能是含有共价键
三、化学键
定义:相邻得两个或多个原子(或离子)之间强烈得相互作用叫
思考题
判断下列作用属于化学键得是:
(1)、 水分子中,O原子与H原子之间得作用 (2)、 水分子中,H原子与H原子之间得作用 (3)、 冰中,水分子与水分子之间得作用 (4)、 NaCl中, 钠离子与氯离子之间得作用
讨论 (1)活泼得金属元素和活泼非金属元素化
合时形成离子键。请思考, 试分析氢和氯得 原Na子C结l一构样,你吗认?为非H金2属、元C素l2 之、间HC化l得合形时成,能和形 成离子键吗?为什么?
离子化合物
共价化合物
概念 含离子键得化合物
粒子间得作 用力
离子键
只含共价键得化合物
分子内是共价键,分 子间是分子间作用力
熔沸点
较高
一般较低,个别很大
硬度
较大
一般较小,个别很大
化学键课件
23
(b)SP2 杂化 (以 BF3 为例 )
B: 2S2 2P1
F: 2S2 2P5
S成分:1/3 P成分:2/3
2p
2s
2s
excited
2s2p轨道
2p sp2
hybridization
three sp2 hybrid orbital
一个s轨道与两个p轨道杂 化,得三个sp2杂化轨道, 每个杂化轨道的s成分为1/3, p成分为2/3,三个杂化轨道 在空间分布是在同一平面上, 互成120º
供空轨道,由配体单独提供电子对。
(1)dsp2型,空间结构为平面正方形 如[Ni(CN)4]2P157页:图4-25
(2)d2sp3型,空间结构为八面体构型 如:[Fe(CN)6]3P158页:图4-26
(3)sp3d2型,空间结构为八面体构型 如:[FeF6]3P158页:图4-27
(注意:(n-1)dnsnp为内轨型配合物,更稳定 nsnpnd为外轨型配合物,不稳定)
39
取向力 极性分子间由于固有偶极而产生的作用力。
诱导力
+ +
+ +
固有偶极和诱导偶极间产生的作用力。
±
诱导
+
诱导偶极 固有偶极
40
分子间作用力( kJ.mol-1)分配
分子
取向力 诱导力 色散力 总作用力
H2
0
Ar
0
0
0.17
0.17
0
8.48
8.48
Xe
0
0
18.40
18.40
CO
0.003
分子间力的大小对物质的熔点、沸点、溶解 性影响较大。对于同类型的分子,分子量越 大,分子的变形性越大,分子间力越强,导 致沸点和熔点也就越高。如:
(b)SP2 杂化 (以 BF3 为例 )
B: 2S2 2P1
F: 2S2 2P5
S成分:1/3 P成分:2/3
2p
2s
2s
excited
2s2p轨道
2p sp2
hybridization
three sp2 hybrid orbital
一个s轨道与两个p轨道杂 化,得三个sp2杂化轨道, 每个杂化轨道的s成分为1/3, p成分为2/3,三个杂化轨道 在空间分布是在同一平面上, 互成120º
供空轨道,由配体单独提供电子对。
(1)dsp2型,空间结构为平面正方形 如[Ni(CN)4]2P157页:图4-25
(2)d2sp3型,空间结构为八面体构型 如:[Fe(CN)6]3P158页:图4-26
(3)sp3d2型,空间结构为八面体构型 如:[FeF6]3P158页:图4-27
(注意:(n-1)dnsnp为内轨型配合物,更稳定 nsnpnd为外轨型配合物,不稳定)
39
取向力 极性分子间由于固有偶极而产生的作用力。
诱导力
+ +
+ +
固有偶极和诱导偶极间产生的作用力。
±
诱导
+
诱导偶极 固有偶极
40
分子间作用力( kJ.mol-1)分配
分子
取向力 诱导力 色散力 总作用力
H2
0
Ar
0
0
0.17
0.17
0
8.48
8.48
Xe
0
0
18.40
18.40
CO
0.003
分子间力的大小对物质的熔点、沸点、溶解 性影响较大。对于同类型的分子,分子量越 大,分子的变形性越大,分子间力越强,导 致沸点和熔点也就越高。如:
