(完整word版)必修二元素周期表知识点
(完整word版)高中化学必修二第一章知识点和习题(含答案),推荐文档

第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。
元素周期表(word高清打印版)--拼音注释元素读音--原周期表规律总结

一、元素周期表基本排列规律1、原子半径由左到右依次减小,上到下依次增大。
2、元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。
3、同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
4、同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
二、电子排布规律最外层电子数为1或2的原子可以是IA族、ⅡA族或副族元素的原子;最外层电子数是3~8的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。
序数差规律(1)同周期相邻主族元素的“序数差”规律①除第ⅡA族和第ⅢA族外,其余同周期相邻元素序数差为1。
②同周期第ⅡA族和第ⅢA族为相邻元素,其原子序数差为:第二、第三周期相差1,第四、第五周期相差11,第六、第七周期相差25。
(2)同主族相邻元素的“序数差”规律①第二、第三周期的同族元素原子序数相差8。
②第三、第四周期的同族元素原子序数相差有两种情况:第IA族和第ⅡA族相差8,其它族相差18。
③第四、第五周期的同族元素原子序数相差18。
④第五、第六周期的同族元素原子序数镧系之前相差18,镧系之后相差32。
⑤第六、第七周期的同族元素原子序数相差32。
三、奇偶差规律元素的原子序数与该元素在周期表中的族序数和该元素的主要化合价的奇偶性一致。
若原子序数为奇数时,主族族序数、元素的主要化合价均为奇数,反之则均为偶数(但要除去N元素,它有多种价态,Cl元素也有ClO2)。
零族元素的原子序数为偶数,其化合价视为0。
四、元素金属性、非金属性的强弱规律(1)金属性(原子失电子)强弱比较①在金属活动性顺序中位置越靠前,金属性越强。
(完整word版)化学元素周期表 超清 可打印
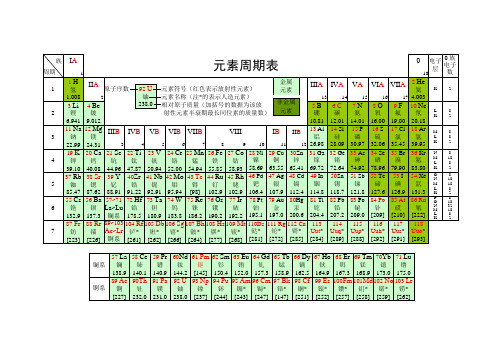
150.4
63Eu
铕
152.0
64Gd
钆
157.3
65Tb
铽
158.9
66Dy
镝
162.5
67Ho
钬
164.9
68Er
铒
167.3
69Tm
铥
168.9
70Yb
镱
173.0
71Lu
镥
175.0
锕系
89Ac
锕
[227]
90Th
钍
232.0
91Pa
镤
231.0
92U
铀
238.0
93Np
镎
[237]
94Pu
4.003
K
2
2
3Li
锂
6.941
4Be
铍
9.012
5B
硼
10.81
6C
碳
12.01
7N
氮
14.01
8O
氧
16.00
9F
氟
19.00
10Ne
氖
20.18
L
K
8
2
3
11Na
钠
22.99
12Mg
镁
24.31
IIIB
3
IVB
4
VB
5
VIB
6
VIIB
7
VIII
89 10
IB
11
IIB
12
13Al
铝
26.98
锝
[98]
44Ru
钌
102.9
45Rh
铑
102.9
46Pd
钯
(完整word版)化学元素周期表超清可打印
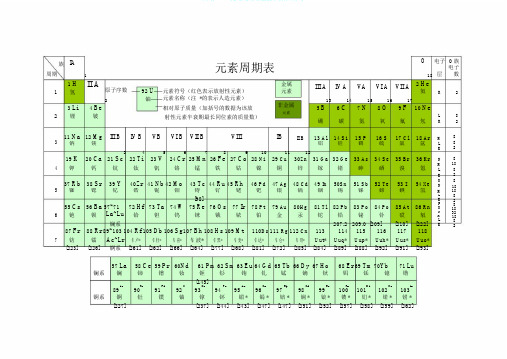
族 IA周期111 H II A原子序数氢2 23 Li4 Be锂 铍元素周期表92 U 元素符号(红色表示放射性元素) 金属 元素 铀 元素名称(注 *的表示人造元素) 非金属相对原子质量(加括号的数据为该放元素射性元素半衰期最长同位素的质量数)电子 0 族层电子18 数 III A IV AVAVI A VII A 2 HeK2氦13 14 15 16 175 B6 C7 N8 O9 F 10 Ne L 8 硼 碳 氮 氧 氟 氖 K2311 Na 12 MgIII BIV BVBVI B VII BVIIIIBII B13 Al 14 Si15 P16 S17 Cl18 ArM 钠镁铝硅磷硫氯氩L3 45 6 7 89 101112K19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr N 4钾 钙 钪 钛 钒 铬锰铁钴镍铜 锌 镓 锗砷硒溴氪M LK37 Rb 38 Sr 39 Y 40Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50Sn 51 Sb 52 Te 53 I 54 Xe ON 5 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙M[98]LK55 Cs 56 Ba 57~71 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80Hg 81 Tl 82 Pb 83 Po 84 Po 85 At 86 Rn P O 6铯 钡 La ~Lu 铪 钽 钨 铼 锇 铱 铂 金 汞 铊 铅 铋 钋 砹 氡 N M镧系207.2 209.0 [209] [210] [222] LK87 Fr 88 Rr 89~103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110Ds 111 Rg 112 Cn113114 115 116 117 118 7钫 镭 Ac ~Lr钅卢* 钅杜* 钅喜*钅波* 钅黑* 钅麦*钅达*钅仑*钅哥*Uut*Uuq* Uup* Uuh* Uus* Uuo*[223][226]锕系 [261] [262] [266] [264][277] [268] [281] [272][285] [284] [289][288] [292] [291][293]8 828 18 8 2 818 18 8 2 8 18 32 18 8 2镧系 57 La 58 Ce 59 Pr 60Nd61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70Yb 71 Lu 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥[145]89 Ac Th 91 Pa 92 U 93 Np 94 Pu 95 Am 96 Cm 97 Bk 98 Cf 99 Es Fm 101 Md102 No103 Lr90 100 锕系 锕钍 镤 铀 镎 钚 镅 * 锔 * 锫 * 锎 * 锿 * 镄 * 钔 * 锘 * 铹 *[227][237][244][243][247][147][251][252][257][258][259][262]。
元素周期表(word全面版)

______________________________________________________________________________________________________________三、元素周期表有关背诵口诀(1)元素周期表族背诵口诀氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动(2)元素周期表原子序数背诵口诀从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。
这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
在来把这个故事浓缩一下:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)(那美女归你)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑(tī) ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧系铪(hā)----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂(bó)金汞铊铅 ---- 一白巾供它牵铋钋(pō)砹氡 ---- 必不爱冬(天)第七周期:钫(fāng)镭锕系 ---- 防雷啊!(3)化合价背诵口诀1. 一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见2. 正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷3. 正一氢银和钾钠正二钙镁钡锌汞和铜铝正三硅正四亚铁正二铁正三氯在最后负一价氧硫最后负二价四、元素周期表规律以下规律不适用于稀有气体。
(完整word版)元素周期表口诀【超好背】

第一周期:氢氦—-——侵害第二周期: 锂铍硼碳氮氧氟氖 -—-- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---—那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰 ---—嫁给康太反革命铁钴镍铜锌镓锗——-—铁姑捏痛新嫁者砷硒溴氪————生气休克第五周期:铷锶钇锆铌 -———如此一告你钼锝钌—--—不得了铑钯银镉铟锡锑 -——- 老爸银哥印西提碲碘氙—-—- 地点仙第六周期:铯钡镧铪 -—--(彩)色贝(壳)蓝(色)河钽钨铼锇 --——但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 -——- 一白巾供它牵铋钋砹氡—--- 必不爱冬(天)第七周期: 钫镭锕—-—- 防雷啊!下面是竖着按族背: 氢锂钠钾铷铯钫请李娜加入私访铍镁钙锶钡镭媲美盖茨被累硼铝镓铟铊碰女嫁音他碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱氦氖氩氪氙氡害耐亚克先动化合价可以这样记忆:一家请驴脚拿银,(一价氢氯钾钠银)二家羊盖美背心. (二价氧钙镁钡锌)一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷元素周期表中各种元素名称的读音第 01 号元素: 氢 [化学符号]H,读“轻”,[英文名称]Hydrogen第 02 号元素: 氦[化学符号]He, 读“亥", [英文名称]Helium第 03 号元素: 锂 [化学符号]Li,读“里”,[英文名称]Lithium第 04 号元素: 铍 [化学符号]Be, 读“皮", [英文名称]Beryllium第 05 号元素: 硼 [化学符号]B,读“朋”, [英文名称]Boron第 06 号元素:碳[化学符号]C, 读“炭”,[英文名称]Carbon第 07 号元素:氮[化学符号]N, 读“淡”, [英文名称]Nitrogen第 08 号元素: 氧 [化学符号]O, 读“养", [英文名称]Oxygen第 09 号元素:氟[化学符号]F,读“弗", [英文名称]Fluorine第 10 号元素: 氖[化学符号]Ne, 读“乃”, [英文名称]Neon第 11 号元素:钠 [化学符号]Na, 读“纳”, [英文名称]Sodium第 12 号元素: 镁[化学符号]Mg, 读“美”,[英文名称]Magnesium第 13 号元素: 铝[化学符号]Al, 读“吕”, [英文名称]Aluminum第 14 号元素:硅[化学符号]Si,读“归”, [英文名称]Silicon第 15 号元素: 磷[化学符号]P,读“邻”, [英文名称]Phosphorus第 16 号元素: 硫 [化学符号]S, 读“流", [英文名称]Sulfur第 17 号元素:氯[化学符号]Cl, 读“绿”,[英文名称]Chlorine第 18 号元素: 氩[化学符号]Ar,A, 读“亚”, [英文名称]Argon第 19 号元素:钾 [化学符号]K, 读“甲”, [英文名称]Potassium第 20 号元素: 钙 [化学符号]Ca, 读“丐”, [英文名称]Calcium第 21 号元素:钪 [化学符号]Sc,读“亢”, [英文名称]Scandium第 22 号元素:钛 [化学符号]Ti, 读“太”, [英文名称]Titanium第 23 号元素: 钒 [化学符号]V,读“凡”, [英文名称]Vanadium第 24 号元素: 铬 [化学符号]Cr,读“各”, [英文名称]Chromium第 25 号元素: 锰 [化学符号]Mn, 读“猛”, [英文名称]Manganese第 26 号元素: 铁 [化学符号]Fe,读“铁”, [英文名称]Iron第 27 号元素:钴[化学符号]Co, 读“古", [英文名称]Cobalt第 28 号元素:镍[化学符号]Ni, 读“臬”, [英文名称]Nickel第 29 号元素:铜 [化学符号]Cu, 读“同”, [英文名称]Copper第 30 号元素: 锌 [化学符号]Zn, 读“辛”,[英文名称]Zinc第 31 号元素: 镓[化学符号]Ga,读“家”, [英文名称]Gallium第 32 号元素: 锗 [化学符号]Ge, 读“者", [英文名称]Germanium第 33 号元素: 砷[化学符号]As, 读“申”, [英文名称]Arsenic第 34 号元素:硒 [化学符号]Se,读“西”, [英文名称]Selenium第 35 号元素:溴[化学符号]Br,读“秀", [英文名称]Bromine第 36 号元素: 氪 [化学符号]Kr, 读“克”, [英文名称]Krypton第 37 号元素:铷[化学符号]Rb, 读“如”,[英文名称]Rubidium第 38 号元素: 锶 [化学符号]Sr,读“思”,[英文名称]Strontium第 39 号元素:钇 [化学符号]Y, 读“乙”, [英文名称]Yttrium第 40 号元素:锆[化学符号]Zr,读“告”, [英文名称]Zirconium第 41 号元素: 铌 [化学符号]Nb, 读“尼”,[英文名称]Niobium第 42 号元素: 钼 [化学符号]Mo,读“目”,[英文名称]Molybdenum第 43 号元素: 碍 [化学符号]Tc, 读“得”,[英文名称]Technetium第 44 号元素:钌[化学符号]Ru,读“了", [英文名称]Ruthenium第 45 号元素:铑[化学符号]Rh, 读“老",[英文名称]Rhodium第 46 号元素: 钯[化学符号]Pd, 读“巴”,[英文名称]Palladium第 47 号元素: 银 [化学符号]Ag, 读“银", [英文名称]Silver第 48 号元素:镉[化学符号]Cd, 读“隔”, [英文名称]Cadmium第 49 号元素: 铟[化学符号]In,读“因", [英文名称]Indium第 50 号元素: 锡[化学符号]Sn,读“西", [英文名称]Tin第 51 号元素: 锑[化学符号]Sb,读“梯”,[英文名称]Antimony第 52 号元素:碲[化学符号]Te, 读“帝”,[英文名称]Tellurium 第 53 号元素:碘[化学符号]I,读“典”, [英文名称]Iodine第 54 号元素:氙[化学符号]Xe,读“仙”,[英文名称]Xenon第 55 号元素: 铯 [化学符号]Cs, 读“色”, [英文名称]Cesium第 56 号元素:钡[化学符号]Ba,读“贝”, [英文名称]Barium第 58 号元素:铈 [化学符号]Ce, 读“市”, [英文名称]Cerium第 59 号元素:镨 [化学符号]Pr, 读“普”,[英文名称]Praseodymium 第 60 号元素:钕[化学符号]Nd,读“女”,[英文名称]Neodymium第 61 号元素:钷 [化学符号]Pm,读“颇", [英文名称]Promethium第 62 号元素: 钐 [化学符号]Sm,读“衫”,[英文名称]Samarium第 63 号元素: 铕[化学符号]Eu, 读“有", [英文名称]Europium第 64 号元素: 钆[化学符号]Gd, 读“轧", [英文名称]Gadolinium第 65 号元素: 铽[化学符号]Tb,读“忒", [英文名称]Terbium第 66 号元素: 镝[化学符号]Dy, 读“滴", [英文名称]Dysprosium第 67 号元素:钬[化学符号]Ho,读“火”, [英文名称]Holmium第 68 号元素: 铒[化学符号]Er, 读“耳", [英文名称]Erbium第 69 号元素: 铥[化学符号]Tm,读“丢”, [英文名称]Thulium第 70 号元素:镱[化学符号]Yb,读“意”, [英文名称]Ytterbium第 71 号元素:镥 [化学符号]Lu,读“鲁", [英文名称]Lutetium第 72 号元素: 铪 [化学符号]Hf, 读“哈", [英文名称]Hafnium第 73 号元素:钽[化学符号]Ta,读“坦”, [英文名称]Tantalum第 74 号元素: 钨[化学符号]W,读“乌”, [英文名称]Tungsten第 75 号元素:镧 [化学符号]La, 读“兰”,[英文名称]Lanthanum第 75 号元素:铼 [化学符号]Re, 读“来”, [英文名称]Rhenium第 76 号元素:锇[化学符号]Os, 读“鹅", [英文名称]Osmium第 77 号元素:铱[化学符号]Ir, 读“衣", [英文名称]Iridium第 78 号元素: 铂 [化学符号]Pt,读““, [英文名称]Platinum第 79 号元素:金 [化学符号]Au, 读“今”,[英文名称]Gold第 80 号元素: 汞[化学符号]Hg,读“拱", [英文名称]Mercury第 81 号元素: 铊 [化学符号]Tl, 读“他", [英文名称]Thallium第 82 号元素: 铅 [化学符号]Pb, 读“千”,[英文名称]Lead第 83 号元素:铋[化学符号]Bi, 读“必", [英文名称]Bismuth第 84 号元素:钋 [化学符号]Po, 读“泼”,[英文名称]Polonium第 85 号元素: 砹[化学符号]At, 读“艾”, [英文名称]Astatine第 86 号元素: 氡 [化学符号]Rn, 读“冬”, [英文名称]Radon第 87 号元素: 钫[化学符号]Fr, 读“方”, [英文名称]Francium第 88 号元素:镭 [化学符号]Ra, 读“雷”,[英文名称]Radium第 89 号元素:锕 [化学符号]Ac,读“阿”,[英文名称]Actinium第 90 号元素:钍 [化学符号]Th,读“土”, [英文名称]Thorium第 91 号元素: 镤[化学符号]Pa,读“仆”, [英文名称]Protactinium第 92 号元素: 铀 [化学符号]U,读“由”, [英文名称]Uranium第 93 号元素:镎 [化学符号]Np, 读“拿”, [英文名称]Neptunium第 94 号元素:钚[化学符号]Pu,读“不”, [英文名称]Plutonium第 95 号元素: 镅[化学符号]Am,读“眉”, [英文名称]Americium第 96 号元素: 锔 [化学符号]Cm,读“局”, [英文名称]Curium第 97 号元素:锫 [化学符号]Bk,读“陪”,[英文名称]Berkelium第 98 号元素: 锎 [化学符号]Cf,读“开”,[英文名称]Californium第 99 号元素: 锿 [化学符号]Es, 读“哀", [英文名称]Einsteinium第 100 号元素:镄[化学符号]Fm,读“费”, [英文名称]Fermium第 101 号元素: 钔 [化学符号]Md, 读“门",[英文名称]Mendelevium第 102 号元素: 锘[化学符号]No, 读“诺", [英文名称]Nobelium第 103 号元素:铹[化学符号]Lw,读“劳", [英文名称]Lawrencium第 104 号元素: 鐪[化学符号]Rf, 读“卢”, [英文名称]unnilquadium 第 105 号元素: [化学符号]Db,读“杜”, [英文名称]dubnium第 106 号元素: 钅喜 [化学符号]Sg , 读"喜“,[英文名称]第 107 号元素:钅波[化学符号]Bh, 读”波“, [英文名称]Bohrium第 108 号元素: 钅黑[化学符号]Hs, 读”黑“, [英文名称]第 109 号元素:钅麦[化学符号]Mt, 读"麦”,[英文名称]第 110 号元素:鐽[化学符号]Ds,读”达“, [英文名称]Darmstadtium 第 111 号元素:钅仑 [化学符号]Rg, , 读"伦“, [英文名称]Roentgenium。
元素周期表(word全面版)
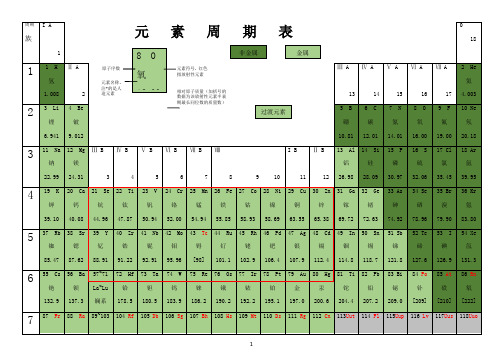
“-”表示那种物质不存在或遇水就分解了。
3第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)(那美女归你)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑(tī) ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧系铪(hā)----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂(bó)金汞铊铅 ---- 一白巾供它牵铋钋(pō)砹氡 ---- 必不爱冬(天)第七周期:钫(fāng)镭锕系 ---- 防雷啊!(3)化合价背诵口诀1. 一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见2. 正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷3. 正一氢银和钾钠正二钙镁钡锌汞和铜铝正三硅正四亚铁正二铁正三氯在最后负一价氧硫最后负二价4四、元素周期表规律以下规律不适用于稀有气体。
一、原子半径同一周期,从左到右,随着原子序数的递增,元素原子半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
二、主要化合价(最高正化合价和最低负化合价)同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
元素最高价的绝对值与最低价的绝对值的和为8三、元素的金属性和非金属性同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减;四、单质及简单离子的氧化性与还原性同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。
高中化学必修二 第一章 物质结构 元素周期律知识点(超全面)

第一章 物质结构 元素周期律第一节 元素周期表一、原子结构....1. 原子核得构成原子 A Z X核电荷数(Z) = 核内质子数 = 核外电子数 = 原子序数2、质量数将原子核内所有得质子与中子得相对质量取近似整数值加起来,所得得数值,叫质量数。
XA Z ——元素符号质量数——核电荷数——(核内质子数)表示原子组成的一种方法a ——代表质量数;b ——代表质子数既核电荷数;c ——代表离子的所带电荷数;d ——代表化合价e ——代表原子个数请看下列表示a b+dXc+e质量数(A)= 质子数(Z)+ 中子数(N)阳离子 a W m+ :核电荷数=质子数>核外电子数,核外电子数=a -m阴离子 b Y n -:核电荷数=质子数<核外电子数,核外电子数=b +n补充:1、原子就是化学变化中得最小粒子;2、分子就是保持物质得化学性质中得最小粒子;3、元素就是具有相同核电荷数即核内质子数得一类原子得总称二、核素、同位素......1、定义:核素:人们把具有一定数目质子与一定数目中子得一种原子称为核素。
同位素:质子数相同而中子数不同得同一元素得不同核素(原子)互为同位素。
2、同位素得特点 ①化学性质几乎完全相同原子核核外电子 Z 个中子 (A -Z)个质子 Z 个②天然存在得某种元素,不论就是游离态还就是化合态,其各种同位素所占得原子个数百分比(即丰度)一般就是不变得。
练习:1、法国里昂得科学家最近发现一种只由四个中子构成得粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。
下列有关“四中子”粒子得说法不正确得就是( )A.该粒子不显电性B.该粒子质量数为4C.与氢元素得质子数相同D.该粒子质量比氢原子大2、已知A2-、B-、C+、D2+、E3+五种简单离子得核外电子数相等,与它们对应得原子得核电荷数由大到小得顺序就是___________ 。
3、现有b X n-与aY m+两种离子,它们得电子数相同,则 a 与下列式子有相等关系得就是( )(A)b-m-n (B) b+m+n(C)b-m+n (D) b+m-n4、某元素得阳离子R n+,核外共用x个电子,原子得质量数为A,则该元素原子里得中子数为( )(A)A-x-n (B)A-x+n (C)A+x-n (D)A+x+n三、元素周期表得结构........1、编排原则:①按原子序数递增得顺序从左到右排列②将电子层数相同......得各元素从左到右排成一横行..。
(完整版)高一化学必修二知识点总结

高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、如何精确表示元素在周期表中的位置:周期序数=电子层数;主族序数=最外层电子数口诀:三短三长一不全;七主七副零八族熟记:三个短周期,第一和第七主族和零族的元素符号和名称3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数==质子数+中子数:A == Z + N②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数= 8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
同周期:左→右,核电荷数——→逐渐增多,最外层电子数——→逐渐增多原子半径——→逐渐减小,得电子能力——→逐渐增强,失电子能力——→逐渐减弱氧化性——→逐渐增强,还原性——→逐渐减弱,气态氢化物稳定性——→逐渐增强最高价氧化物对应水化物酸性——→逐渐增强,碱性——→逐渐减弱三、化学键含有离子键的化合物就是离子化合物;只含有共价键的化合物才是共价化合物。
(完整word版)元素周期表(word全面版)

三、元素周期表有关背诵口诀(1)元素周期表族背诵口诀氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动(2)元素周期表原子序数背诵口诀从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。
这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
在来把这个故事浓缩一下:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)(那美女归你)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑(tī) ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧系铪(hā)----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂(bó)金汞铊铅 ---- 一白巾供它牵铋钋(pō)砹氡 ---- 必不爱冬(天)第七周期:钫(fāng)镭锕系 ---- 防雷啊!(3)化合价背诵口诀1. 一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见2. 正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷3. 正一氢银和钾钠正二钙镁钡锌汞和铜铝正三硅正四亚铁正二铁正三氯在最后负一价氧硫最后负二价四、元素周期表规律以下规律不适用于稀有气体。
(完整word版)高中化学元素周期表必记内容

元素周期表必记内容螺旋式元素周期表短周期元素主族元素和0族元素各元素正确读音前20位元素快速记忆H He Li Be B (氢氦锂铍硼)C N O F Ne (碳氮氧氟氖)Na Mg Al Si P (钠镁铝硅磷)S Cl Ar K Ca (硫氯氩钾钙)五个五个背,比较顺口。
元素周期巧记侵害从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,那家有个很美丽的女儿,叫桂林,不过她留有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,很痛。
新娘一生气,当时就休克了。
如此一番,他妈妈告诉你:这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个地点,听说有仙人住的。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾提供机会让它牵来一只鹅,毕竟因为它们不爱冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
一、按周期记忆第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老把银哥印西堤碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 毕不爱冬(天)第七周期:钫镭锕---- 防雷啊!二、按族记忆氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动。
新教材课件第2课时 元素周期表(可编辑word)

第2课时元素周期表基础过关练题组一元素周期表的结构1.(原创)“中国紫”——硅酸铜钡(BaCuSi2O6)被认为是人工制造的。
这种紫色颜料在自然界中还未被发现,而秦始皇陵兵马俑是已知的有确切出土地点和年代的最早使用它的实物。
其中不属于短周期元素的是( )A.Ba和CuB.Ba和SiC.Cu和OD.Si和O2.(2020北京西城高一期末)下列元素中,属于第三周期的是( )A.氢B.碳C.氧D.氯3.(2019天津静海一中高一下月考)下列说法中正确的是( )A.元素周期表中元素排序的依据是元素的相对原子质量B.元素周期表中元素排序的依据是原子的质量数C.元素周期表有十六个纵列,也就是十六个族D.在元素周期表中,从ⅢB族到ⅡB族的10个纵列中,所有的元素都是金属元素4.(2019河北辛集中学高一下第一次阶段考试)“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于短周期元素的有( )A.5种B.7种C.8种D.9种5.下列各图若为元素周期表的一部分(表中数字代表原子序数),其中合理的是( )6.下列关于元素周期表的叙述,错误的是( )A.镁是第ⅡA族元素B.第ⅠA族元素全部是金属元素C.氧族中含金属元素D.第三周期中既有金属元素又有非金属元素7.(2019河北邯郸高一下月考)无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。
按此规定,下列说法中错误的是( )A.第15列元素的最高价氧化物的化学式是R2O3B.第17列元素自上而下单质熔、沸点逐渐升高C.第11列中肯定没有非金属元素D.在18列元素中,第3列的元素种类最多题组二元素周期表在元素推断中的应用8.元素X的原子有3个电子层,最外电子层上有4个电子。
则X元素位于周期表的( )A.第四周期ⅢA族B.第四周期ⅦA族C.第三周期ⅣB族D.第三周期ⅣA族9.A、B、C、D为短周期元素,在周期表中所处的位置如下图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(完整)高中化学必修二第一章物质结构元素周期律知识总结-推荐文档

元素周期表 元素周期律 知识总结一. 原子结构与元素的性质1. 元素性质的范畴元素的性质⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧元素的电负性元素的第一电离能元素的主要化合价判断非金属性方法判断金属性的方法原子半径2.元素周期表和元素周期律随着原子序数(核电荷数)的递增: 元素的性质呈现周期性变化①、原子最外层电子的周期性变化(元素周期律的本质)元素周期律 ②、原子半径的周期性变化③、元素主要化合价的周期性变化④、元素的金属性与非金属性的周期性变化① 、按原子序数递增的顺序从左到右排列;排列原则 ②、将电子层数相同的元素排成一个横行; ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短(一、二、三周期)周期(7个横行) ②、长(四、五、六周期)周期表结构 ③、不完全(第七周期)①、主族(ⅠA ~ⅦA 共7个)元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体)同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径性质递变 ③、主要化合价④、金属性与非金属性 ⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性同周期: 从左到右(1)元素原子结构: 电子层数相同, 核电荷数增多(2)元素性质:元素的金属性减弱, 非金属性增强;编排依据七主七副零和八三长三短一不全原子半径减小;金属单质的还原性减弱, 非金属单质的氧化性增强; 金属阳离子的氧化性增强, 非金属阴离子的还原性减弱。
同主族: 从上到下(1)原子结构 (2)元素性质最外层电子 原子半径增大 金属性增强 金属阳离子的氧化性减弱 数相同, 非金属性减弱电子层数增多。
金属单质的还原性增强 非金属阴离子的还原性增强 非金属单质的氧化性减弱元素周期表中的规律(1)“三角形”规律所谓“三角形”, 即A.B 处于同周期, A.C 处于同主族的位置 (2)“对角线”规律 有些元素在周期表中虽然既非同周期, 又非同主族, 但其单质与同类化合物的化学性质却很相似, 如Li 和Mg, B 和Si 等。
化学必修二元素周期表

本节要点
A
了解族与周期,掌握原子序数 与原子结构关系
掌握碱金属、卤素的结构特点、
B
化学性质、物理性质相似性、
递变性、特殊性
C
掌握原子的结构
D
熟练计算A、Z、N
E
熟练掌握同位素、元素、核素 的区别与联系
F
熟练掌握10电子、18电子微 粒
通式:2R + 2 H2O = 2 ROH + H2↑
板书
递变性(Li-Cs):
1
2
3
4
5
失e-能力增强
与氧气反应越来 越剧烈,产物越
来越复杂
与水或酸反应剧 烈程度增强
碱性增强:
LiOH<NaOH< 还原性(金属性)
KOH<RbOH<
增强
CsOH
6
板书
小试牛刀
C 下列关于铯及其化合物的说法中,不正确的是( )
第一章 物质结构 元 素周期律
单击此处添加副标题
第一节 元素周 期表
汇报日期
元素周期表
A
元素周期表
B
元素周期表的编制
C
发明人:俄国化学家——门捷列夫 (按相对原子质量从小到大)
D
现行:按核电荷数从小到大(原 子核所带正电荷数)
原子序数与原子结构关系:
E
原子序数=核电荷数=质子数=核
F
外电子数
板书
1. 氢氧化铯是一种强碱,易溶于水 2. 铯与水反应十分剧烈,甚至发生爆炸 3. 碳酸铯用酒精灯加热可以生成氧化铯和CO2 4. 硫酸铯、碳酸铯、硝酸铯都是易溶于水
卤族元素——F Cl Br I (第VIIA族)
+9 2 7
人教版高中化学必修二《元素周期表》

元素周期表知识点一.元素周期表的结构1.世界上第一张元素周期表是在1869年由俄国化学家门捷列夫绘制完成的,随着科学的不断发展,已逐渐演变为现在的常用形式。
2.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
3.编排原则(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
4.元素周期表的结构5.元素周期表中的特殊位置(1).分区①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
②各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
(2).过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。
(3).镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
(4).锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
(5).超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
结构巧记口诀:横行叫周期,现有一至七,四长三个短,第七尚不满。
纵列称为族,共有十六族,一八依次现①,一零再一遍②。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
知识点二.元素的性质与原子结构1 .碱金属元素:周期表中第IA族的元素(除H元素外)。
(1).碱金属的原子结构①.相同点:碱金属元素原子结构的最外层电子数相同,都为1。
②.递变性:从Li到Cs,碱金属元素的原子结构中,电子层数依次增多,原子半径依次增大。
(完整版)化学必修二第一章知识点总结

第一章 物质结构 元素周期表第一节 元素周期表一、周期表原子序数 = 核电荷数 = 质子数 = 核外电子数 1、依据横行:电子层数相同元素按原子序数递增从左到右排列 纵行:最外层电子数相同的元素按电子层数递增从上向下排列 2、结构周期序数=核外电子层数 主族序数=最外层电子数短周期(第1、2、3周期)周期:7个(共七个横行)周期表 长周期(第4、5、6、7周期) 主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3 零族(1个)稀有气体元素 二.元素的性质和原子结构(一)碱金属元素:1、原子结构 相似性:最外层电子数相同,都为1个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2、物理性质的相似性和递变性:(1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K 反常) ②熔点、沸点逐渐降低 结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质(1)相似性:(金属锂只有一种氧化物)4Li + O 2 Li 2O 2Na + O 2 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有1个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈点燃 点燃结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
注:金属性强弱的判断依据:①与水或酸反应越容易,金属性越强;②最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
③置换反应,金属性强的金属置换金属性弱的金属④离子的氧化性越弱对应金属的金属性越强总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
(完整版)高中化学必修二知识点总结

高中化学必修二知识点总结第一单元1——原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2——元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3) 所有单质都显零价3——单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增4——元素的金属性与非金属性(及其判断)(1)同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
判断金属性强弱金属性(还原性)1,单质从水或酸中置换出氢气越容易越强2,最高价氧化物的水化物的碱性越强非金属性(氧化性)1,单质越容易与氢气反应形成气态氢化物2,氢化物越稳定3,最高价氧化物的水化物的酸性越强(1—20号,F最强;最体一样)5——单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数。
阴阳离子的半径大小辨别规律由于阴离子是电子最外层得到了电子而阳离子是失去了电子6——周期与主族周期:短周期(1—3);长周期(4—6,6周期中存在镧系);不完全周期(7)。
主族:ⅠA—ⅦA为主族元素;ⅠB—ⅦB为副族元素(中间包括Ⅷ);0族(即惰性气体)所以, 总的说来(1) 阳离子半径<原子半径(2) 阴离子半径>原子半径(3) 阴离子半径>阳离子半径(4 对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一讲 元素周期表【展示目标 聚焦学习】 1、原子结构 2、元素周期表 3、碱金属元素及其性质 4、卤族元素及其性质 【知识精讲 深化思维】要点一:原子结构1、元素周期表的诞生及其发展诞生:1869年,俄国化学家门捷列夫编制出第一张元素周期表;依据:将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行;意义:揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑; 发展:随着化学科学的不断发展,元素周期表中为未知元素留下空位先后被排满; 成熟:当原子结构的奥秘被发现后,元素周期表中的元素的排列依据由相对原子质量改为原子的原子序数,形成现行的元素周期表。
2、元素周期表的编排原则 (1)原子与元素的关系 ①原子的结构原子的结构在一个原子中:核电荷数 = 质子数 = 核外电子数 =原子序数 ①元素的定义:质子数相同的一类原子的总称;关系:元素将原子分类,按照质子数是否相同分类,对应的一类原子就是一种元素。
原子序数与元素的原子结构之间的关系: 原子序数=核外电子数=质子数=核电荷数。
(2)原子核外电子排布的规律核外电子遵循“2n 2”的规律:其中“2n 2”指的是每一层最多容纳的电子数;“n”指的是电子层数。
每一层排满是最稳定的结构,每当排下那一层电子的时候,首先要看看能不能排满,如果不能排满,则以上一层为标准来排,然后依次类推。
(3)编排原则⎪⎪⎪⎩⎪⎪⎪⎨⎧⎩⎨⎧一个单位的负电荷)核外电子(一个电子带中子(不带电)电荷)个质子带一个单位的正质子(原子核(带正电)11.元素周期表的结构(1)周期(七横七周期,三短四长)(3)族(十八纵行十六族,七主七副一①一0)①由上表可知在元素周期表中,对应的第几列就是第几族,其中8、9、10为第①族;①稀有气体元素因为性质稳定,有稳定的电子层结构,化合价为0,因此称为0族元素;①过渡元素:元素周期表中从第IIIB族到第IIB共有10个纵行,包括了第①族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
①由于镧系和锕系位于第3列,所以元素种类最多的族的是第IIIB族。
(4)某些族元素的别称典型例题1.已知A、B是元素周期表中第①A族相邻元素,A、B所在周期分别有m、n种元素.若A的原子序数为x,则B的原子序数可能为()①x+m;①x﹣m;①x+n;①x﹣n.A.①①B.①①C.①①D.全部【解答】VIIA族中元素分别为F、Cl、Br、I、At,它们的原子序数分别为:9、17、35、53、85,所在周期元素种数为:8、8、18、18、32,如9号氟,9+8=17号氯,即①x+m 正确;如果17号氯,17﹣8=9号氟,即①x﹣m正确;同理35号和53的碘,得到;①x+n;①x﹣n都正确,故选D。
2.结合元素周期表,回答下列问题:(1)表中的实线是元素周期表的部分边界,请在图1中用实线补全元素周期表的边界.(2)表中所列元素,属于短周期元素的有;属于主族元素的有;g元素位于第周期族;i元素位于第周期族.(3)元素f是第周期、第族元素,请在如图3所示的方框中按氦元素(图2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量.【解答】(1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图:,故答案为:;(2)H、C、Na、Mg、Al、S、Ar;H、C、Na、Mg、Al、S;三;零;四;IIB;(3)略变式训练1.下列各表中的数字代表的是元素的原子序数.表中数字所对应的元素与它们在周期表中的位置相符的是()A.B.C.D.2. A、B、C、D为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数.(1)写出A元素的名称:.(2)B位于元素周期表中第周期,第族.(3)C的原子结构示意图为.(4)D的单质与水反应的化学方程式为.要点二:碱金属元素1、碱金属的元素的原子结构2、碱金属的主要物理性质3、碱金属的化学性质(相似性和递变性)(1)相似性与O2反应生成氧化物或过氧化物;与Cl2生成氯化物;与H2O反应生成碱和氢气;与非氧化性酸反应。
(2)递变性①与O2反应从Li→Cs,与O2反应越来越剧烈,产物越来越复杂;①与H2O(或酸)的反应从Li→Cs,与H2O(或酸)反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb、Cs遇水发生剧烈爆炸。
①最高价氧化物对应的水化物的碱性碱性:LiOH<NaOH<KOH<RbOH<CsOH(3)特殊性①Na、K通常保存在煤油或石蜡油中,Li通常用石蜡密封;①碱金属中还原性最强的是Cs,还原性最弱的是Li;①碱金属元素中只有Li与O2反应的产物为Li2O一种,其他元素与O反应的产物至少有两种。
典型例题1、下列对碱金属性质的叙述中,正确的是()A、单质都是银白色的柔软金属,密度都比较小。
B、单质在空气中燃烧生成的都是过氧化物C、碱金属单质与水反应生成碱和氢气D、单质的熔、沸点随着原子序数的增加而升高。
【解析】:铯单质略带金属光泽,A项不对;锂在空气中燃烧主要生成Li2O,B项错误。
碱金属单质均能与水反应生成碱和氢气,C项正确;碱金属单质的熔、沸点随着院子增加而降低,D项不正确2.IIA族元素从第二周期到到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡).下列关于①A族元素预言可能正确的是()①常温下,单质铍能与水剧烈反应放出H2,①常温下,单质钡能与水剧烈反应放出H2①Be(OH)2易溶于水①Ba(OH)2易溶于水①SrCO3易溶于水.A.①①①B.①①C.①①D.①①①①①【解答】:①第二周期到到第六周期的元素从上往下金属性增强,与水反应越容易,常温下镁与冷水缓慢的反应,所以单质铍很难与冷水反应,故错误;②常温下镁与冷水缓慢的反应,所以常温下,单质钡能与水剧烈反应放出H2,故正确;③氢氧化镁难溶于水,所以Be(OH)2不溶于水,故错误;④氢氧化钙微溶于水,所以Ba(OH)2易溶于水,故正确;⑤碳酸盐都不易溶于水,所以SrCO3难溶于水,故错误;故选:C。
变式训练1.下列叙述中错误的是()A.随着电子层数增多,碱金属的原子半径逐渐增大B.碱金属单质都具有强还原性,它们的离子都具有强氧化性C.碱金属单质的熔沸点随着核电荷数的增大而降低D.碱金属元素在自然界里都是以化合态存在的2.下列关于碱金属某些性质的排列中,正确的是()A. 原子半径:Li<Na<K<Rb<CsB. 密度:Li <Na<K< Rb<CsC. 熔点、沸点:Li<Na<K<Rb<CsD. 还原性:Li>Na>K>Rb>Cs要点三:卤族元素1、卤族元素的原子结构2、卤素元素单质的物理性质卤素单质颜色和状态密度熔点(①)沸点(①)F2淡黄绿色气体 1.69g.L-1(15①)-219.6-188.1Cl2黄绿色气体 3.124g.L-1(0①)-101-34.6Br2深红棕色液体 3.119g.cm-3(20①)-7.258.78I2紫黑色固体 4.93g.cm-3113.5118.4 3、卤族元素单质的化学性质(1)与H2反应单质化学方程式反应条件与现象结论相同点递变性F2H2+F2=2HF 在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定均与H2反应生成HX从F2到I2,与H2化合的剧烈程度逐渐减小(即越来越不稳定),HX的稳定性逐渐减小Cl2Cl2+H22HCl光照或点燃发生反应,生成的氯化氢较稳定Br2Br2+H22HBr加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定I2I2+H22HI不断的加热才能缓慢反应,生成的碘化氢不稳定,易分解要点诠释:随着核电荷数的增多,卤素单质(F2、Cl2、Br2、I2)与氢气反应的剧烈程度逐渐减弱,生成的氢化物的稳定性逐渐减弱:HF>HCl >HBr >HI;元素的非金属性逐渐减弱:F>Cl>Br>I。
(2)实验探究卤素单质间的置换反应实验内容将少量氯水分别加入盛有NaBr溶液和KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置。
将少量溴水加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置。
现象静置后,液体均分为两层。
上层液体均呈无色,下层液体分别呈橙色、紫色。
静置后,液体分为两层。
上层液体呈无色,下层液体呈紫色。
方程式①2NaBr+Cl2==2NaCl+Br2②2KI+Cl2==2KCl+I2③2KI+Br2==2KBr+I2结论随着核电荷数的增加,卤素单质的氧化性逐渐减弱:Cl2>Br2>I2(3)卤素的特殊性①氟无正价,无含氧酸;氟的化学性质特别活泼,遇水生成HF和O2,能与稀有气体反应,氢氟酸能腐蚀玻璃,氟化银易溶于水,无感光性。
①氯气易液化,次氯酸具有漂白作用,且能杀菌消毒。
△①溴是常温下唯一液态非金属单质,溴易挥发,少量溴保存要加水液封,溴对橡胶有较强腐蚀作用。
①碘为紫黑色固体,易升华,碘单质遇淀粉变蓝。
典型例题1.按氟、氯、溴、碘四种元素的顺序,下列性质的递变规律不正确的是()A.单质的密度依次增大B.单质的熔、沸点依次升高C.Cl2可从KBr溶液中还原出Br2D.单质都能与H2化合,且逐渐变难【解析】卤素单质按F2、Cl2、Br2、I2的顺序,其密度依次增大,熔沸点依次升高,所以A、B都正确;卤素单质都能与H2化合生成对应的氢化物,但按F2、Cl2、Br2、I2顺序依次变难;单质的氧化性顺序为F2>Cl2>Br2>I2,所以Cl2可将KBr溶液中的Br-氧化成Br2。
答案为C2.下列关于卤族元素叙述中正确的是()A.原子的最外层电子数都是7,次外层电子数都是8B.单质的化学性质活泼,易得电子发生还原反应C.单质都有颜色,且颜色逐渐变浅D.都难溶于水,且不与水反应【解答】:A、氟次外层只有2个电子,而不是8个电子,故A错误;B、单质化学性质活泼,易得电子,发生还原反应,故B正确;C、卤族元素从上到下,单质的颜色逐渐加深,而不是变浅,故C错误;D、氯气和氟气都与水反应,氯气与水反应生成次氯酸和盐酸,故D错误;故选:B。
变式训练1.下列关于卤化氢的说法中不正确的是()A.卤素原子半径越大,氢化物越稳定B.卤素原子半径越大,氢化物越不稳定C.卤化氢的稳定性为:HF>HCl>HBr>HID.卤素单质与氢气越难反应,生成物越不稳定2.借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是()A.已知Ca是第4周期、第ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱B.已知As是第4周期、第VA族的元素,故AsH3的稳定性比NH3的稳定性强C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半比F的原子半径大3.随着卤素原子半径的增大,下列递变规律正确的是()A. 单质的熔沸点逐渐降低B. 卤素离子的还原性逐渐增强C. 气态氢化物稳定性逐渐增强D. 单质的氧化性逐渐增强要点四:核素1、质量数定义:原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
