第二章: 愈伤组织培养
植物愈伤组织培养的关键技术

植物愈伤组织培养的关键技术在现代农业中,植物愈伤组织培养技术广泛应用于种植业和植物育种中。
该技术通过培养和再生植物愈伤组织,可以实现快速繁殖、基因转化和育种改良等目的。
以下是植物愈伤组织培养中的关键技术:1. 材料准备:选择适宜的植物组织(如茎尖、叶片等)作为外植体,确保其健康和无病虫害。
外植体的选择对成功培养愈伤组织至关重要。
2. 外植体的消毒:使用适当的消毒方法,如漂白剂或酒精处理,以杀灭外植体表面的微生物。
3. 媒体配制:选择适宜的基础培养基,并添加必要的植物生长调节剂(如激素)和营养物质,以提供愈伤组织生长和分化所需的条件。
4. 培养条件控制:为愈伤组织提供适宜的光照、温度和湿度条件,以促进其生长和分化。
光照和温度的合理控制对于植物愈伤组织的培养成功至关重要。
5. 组织诱导和增殖:通过添加适当的激素和营养物质,诱导外植体形成愈伤组织,并通过继代培养,实现愈伤组织的快速增殖。
6. 分化和再生:通过调整培养基的成分和激素的添加量,促进愈伤组织分化为根、茎和叶等不同的组织器官,并进一步培养和培育出整株植物。
7. 病害防治:在愈伤组织培养过程中,要注意病害的防治,如消毒外植体、灭菌培养器具等,以避免病原微生物的侵染。
8. 营养调控:根据不同植物的营养需求和生长阶段的需要,合理调节培养基中的营养物质的含量和比例,以促进愈伤组织的生长和发育。
植物愈伤组织培养技术的成功与否,往往取决于以上关键技术的合理应用和控制。
这些技术的正确操作和调控,能够为植物育种和种植业的发展提供有力支持。
以上是关于植物愈伤组织培养的关键技术的简要介绍。
希望对您有所帮助!。
愈伤组织培养(共70张PPT)

第五章 愈伤组织的培养
1 愈伤组响---重要因素。 转移到新鲜培养基:定期地将它们分成小块,接种到新鲜的培养基上,可以长期保持旺盛的生长。
脱分化:细胞由静止期进入分裂期,恢复分裂机能 影响培养的难易:一般生理状态年轻,来源于生长活跃或生长潜力大的组织和器官的细胞容易培养。
1 愈伤组织 形态 发 生方式
通过体细胞胚胎/胚状 体途径再生植株
愈伤组织器官发生
2 愈伤组织器官发生
先不定芽,在茎基部长根 先长根 后长芽
在不同部位分别形成根和芽
影响愈伤组织器官发生的因素:
无机盐混合物类
营养条件 有机物类 植物激素类
植物激素的作用
天然复合物类
外因
渗透压
酸碱度
影响因子
环境条件 湿度
From embryo culture
From root
2 愈伤组织的形成
从外植体脱分化形成典 型的愈伤组织大致可 分为三个时期:
愈伤组织形成
起始期
分裂期
形成期
2. 1 起始期:
细胞准备进行分裂的时期。 外植体的细胞处在静止状态。 一些刺激因素(如机械损伤、改变光照强度、增加氧等)和
各种生长素对黄瓜各外植体愈伤组织诱导的效应 (各种生长素浓度为10μmol/L)
生长素
种子
愈伤组织形成 下胚轴
果皮
IBA
无愈伤组织形成 愈伤组织增殖强
IBA浓度为1μmol/L时愈 伤组织生长良好
NAA
无愈伤组织形成 所有外植体均产生 愈伤组织
愈伤组织增殖强
2,4-D
所有外植体均产 2,4-D浓度为1μmol/L时
4)其他培养条件对胚状体发生的影响 液体培养 适宜pH5-6 光照:不需要光或半天光照时间 温度25 ℃左右
愈伤组织培养 (1)

胡萝卜愈伤组织
愈伤组织培养
第一节 愈伤组织的诱导与分化 一、愈伤组织的诱导
在进行愈伤组织培养中,应根据不同的培养目的,获取不同的 外植体。 外源激素是植物愈伤组织诱导过程中不可缺少的组成成分。
第一节 愈伤组织的诱导与分化 二、愈伤组织细胞的分化
从单个细胞或外植体上形成典型的愈伤组织,大致要经历 三个时期:
愈伤组织培养
第一节 愈伤组织的诱导与分化
二、愈伤组织细胞的分化
质地不同的两种愈伤组织有时是可互变的,有时是不可逆 ห้องสมุดไป่ตู้。脆性愈伤组织由松散排列的细胞组成,而坚实愈伤组织则 由紧密排列的细胞组成。
加入高浓度的生长物质,可使坚实的愈伤组织变为松脆; 反之,减低或除去生长物质,则松脆愈伤组织可转变为坚实。
素而异。 菊芋1d,胡萝卜几天, 不同的光照条件,诱导情况不同,一般弱光易于诱导 ,且
分裂频率高。
愈伤组织培养
第一节 愈伤组织的诱导与分化
二、愈伤组织细胞的分化
外源激素是愈伤组织诱导过程中不可缺少的组成成分,是一 种诱导剂,能诱导细胞开始分裂,外源生长物质往往是通过调 整它的种类和浓度来诱导细胞开始分裂的。最常用的有2,4- D、NAA、IAA和细胞分裂素等。2,4-D处理静止状态的组织 时,细胞的RNA含量明显增加,而且2,4-D可积累在分裂细胞 的核仁中。
愈伤组织培养
第一节 愈伤组织的诱导与分化
二、愈伤组织细胞的分化
(3)细胞的体积不再减小 愈伤组织分化时外植体细胞的大小发生十分明显的变化, 生长的愈伤组织的细胞平均大小不再减小,至此以后,保持相 对不变。 (4)出现各种类型的细胞 如薄壁细胞、分生细胞、管胞、石细胞、纤维细胞、色素细 胞、毛状细胞以及细胞丝状体等。 (5)出现一定的形态特征 生长旺盛的愈伤组织一般呈奶黄色或白色,有光泽,也有淡 绿色或绿色的,老化的愈伤组织多转变为黄色甚至褐色。
CHAPTER,愈伤组织培养

分生组织结节可以成为愈伤组织的生长中心,或者进一步分化为维管组织结 节——由分生组织结节外围的细胞作平周分裂成为形成层状细胞,并形成了 部分维管组织如管胞、纤维细胞等,但不形成维管系统。由于此期细胞分裂 已基本停止,细胞内发生生理代谢等的变化而开始形成一些不同形态和功能
的细胞,因此有人又将此期称为分化期。
分生状态:细胞变小、细胞质稠密、液泡变小、核和核仁变 大并趋向细胞中央
小麦花粉分化和脱分化第一次有丝分裂的差异
分化
脱分化
1、分裂前细 胞
核的位置 2、分裂前、
中的细 胞质
3、纺缍体
4、新细胞壁
必定在萌发孔对面紧靠 在花粉粒中无确定的位
胞壁
置
除一部分靠胞壁外,大 部分集中在核对着 萌发孔的一侧
在核的周围分布比较均 匀
(3)愈伤组织形成期:
愈伤进一步发育,其周缘近表面部分细胞分裂较多,(垂周分裂)形成 愈伤形成层,而愈伤深层细胞显著增大,细胞质变稀薄,液泡变大,核和 核仁变小并移到细胞边缘,RNA含量下降,在外植体切口处明显可见一团 团有一定生长型式的愈伤组织。
三个发育时期各有其主要特征,但并不专一,有时会交叉混杂发生。 形成期是指外植体经过诱导期和分裂期后形成了无序结构的愈伤组织的时期。
分化是在失去极性的状态下进行的分裂
陆文樑(1982)
脱分化后的愈伤组织其薄壁细胞是非匀质的:愈伤组织虽然未分化出 其它特化组织(如维管束等),其薄壁细胞在组成上仍是有差异的
在脱分化过程中,伴随着细胞形态结构的变化
通过脱分化形成的愈伤组织在培养过程中保持具分生能力的薄壁细胞或肉 眼观察不出的分化程度较低的状态(内部已形成一定的形态组织或细胞), 因此习惯上称愈伤组织是处在“没有分化”、“脱分化”状态的细胞
愈伤组织培养
•
第三节 愈伤组织形态的发生
愈伤组织培养物在某些条件下,可以再分
化产生不定芽或根的分生组织甚至是胚状
体,继之,由这些有结构的组织而发育成
苗或完整小植株。
一、愈伤组织通过再分化形成再生植株的 方式:主要有三种(1)先产生芽,后在茎的
外植体的细胞数目多,获得愈伤组织的机会也多。
如果目的仅在于得到愈伤组织,那末将茎的切
段、叶、根、花、果实或种子,或其中的某种 组织切成一片片或一块块放到培养基上就可以 了。
如果要定量地研究愈伤组织的发生,那末外植体
的大小必须一致,形状和组成也要基本相同。进 行这类研究常选用组织块较大的材料,例如胡萝 卜的贮藏根、马铃薯的块茎、菊芋、荷兰防风草
成的能力,因此表面积越大,产生分泌物数量也
越多,愈伤组织的得率也越高。
外植体的体积应尽可能小,从而得到较大数量的
外植体。外植体最小的限度由其亲本组织细胞的
平均大小来决定。细胞数目。
例如菊芋的细胞比胡萝卜根次生韧皮部的细胞 大三倍,一个3.8毫克的胡萝卜外植体大约包含
25,000个细胞,这样一个外植体是能够成活的。
• 理论上愈伤组织是可以无限制继代,但 愈伤组织继代次数增加,形态发生能力 逐渐丧失。 • 原因:遗传因素即继代培养中通常出现 染色体紊乱。
REASONS
遗传上表现不稳定:染色体出现多倍 体和非整倍体
• 四、培养条件
• 1、光照:愈伤组织的诱导需弱光或不需 光,分化需光。继代培养一般需光。此 时光对器官的作用是一种诱导反应。 • 2、温度:一般采用24~28℃的恒温条件 进行。 • 3、湿度:较大,以免引起培养基干缩。
有好几种化学试剂都能起到表面消毒的作
用,试剂的选择及处理时间的长短要根据 材料对试剂的敏感性来决定。
愈伤组织培养

• ②胚状体的维管组织与外植体的维管组 织无解剖结构上的联系。
• ③胚状体维管组织的分布是独立的“Y” 字形。
第三节 愈伤组织的形态发生
体细胞胚发生与器官发生
第三节 愈伤组织的形态发生
胚状体方式比不定芽方式有更多的优点:
• 胚状体产生的数量比不定芽多; • 胚状体可以制成人工种子,便于运输和保
第二节愈伤组织的继代培养
4.培养方式:
固体培养 液体培养
第二节愈伤组织的继代培养
(三)培养条 件
光照
光强、光照时间、光质
温度
24-28℃
第2章 愈伤组织培养
第三节 愈伤组织的形态发生
• 形态建成:外植体细胞在适宜的培养 条件下发生脱分化、再分化,产生芽 和根,或者形成胚状体,发育成苗或 完整植株。
Wound callus on the stem of an Erythrina tree 刺桐树
二.愈伤组织的分化
• 从外植体脱分化形成 愈伤组织分化 典型的愈伤组织大致
可分为三个时期:
诱导期
分裂期
分化期
Stage 1. Induction(诱导期 ):
细胞准备进行分裂的时期,是愈伤组织形成起点。
Callus arising from vascular tissue
From root
From embryo culture
Callus arising from leaf tissue
Photo indicating where the callus (c) arises from
第一节愈伤组织的诱导和分化
第三节 愈伤组织的形态发生
注意:体细胞 胚
《愈伤组织培养》复习题及参考答案

第2章《愈伤组织培养》复习题参考答案一、填空:1、绝大多数培养植物再生植株时都先经过愈伤组织阶段。
2、愈伤组织形成大致经历诱导期、分裂期和分化期三个时期。
3、使用植物生长调节物质时要注意:种类和浓度生长素和细胞分裂素的比值。
4、愈伤组织的形态发生方式主要有不定芽方式和胚状体方式。
二、名词解释:1、愈伤组织培养(callus culture):是指将母体植株上的外植体,接种到无菌的培养基上,进行愈伤组织诱导、生长和发育的一门技术。
2、继代培养(subculture):愈伤组织在培养基上生长一段时间以后,由于营养物质枯竭,水分散失,以及代谢产物的积累,必须转移到新鲜培养基上培养。
这个过程叫做继代培养3、形态建成(organogenesis):外植体在适宜的培养条件下经脱分化、再分化形成不定根(adventitious roots)、不定芽(adventitious shoots)或直接发育成形态完整的植物体的过程。
4、体细胞胚(somatic embryo)又称胚状体(embryoid):指在组织培养中,由一个非合子细胞(体细胞),经过胚胎发生和胚胎发育过程(经过原胚、球形胚、心形胚、鱼雷胚和子叶胚5个时期),形成的具有双极性的胚状结构。
三、问答题1、愈伤组织细胞的分化一般分几个时期?各有何特点?(1)诱导期:①气体交换增加,如氧气的吸收增加②RNA含量增加(增加到300%)③蛋白质量增加(每个细胞的总增加量为200%)d酶活性增强(2)分裂期:①细胞的数目迅速增加②每个细胞平均鲜重下降③细胞体积小,内无液泡d细胞的核和核仁增大到最大e细胞中RNA含量减少,而DNA含量保持不变f随着细胞不断分裂和生长,细胞的总干重、蛋白质和核酸含量大大增加,新细胞壁的合成极快。
(3)分化期:①细胞分裂部位和方向发生改变②形成瘤状或片状的分生组织结节和维管组织结节③细胞的体积相对稳定,不再减少d出现了各种类型的细胞e生长旺盛的愈伤组织呈乳白色、白色或浅绿色,老化的多转化为黄色或褐色2、分裂期愈伤组织的共同特征是什么?细胞分裂快,结构疏松,缺少有组织的结构,维持其不分化的状态,颜色浅而透明。
《愈伤组织培养》课件

激素与生长调节剂
激素:植物激 素如生长素、 细胞分裂素等 对愈伤组织培 养有重要影响
生长调节剂:人 工合成的生长调 节剂如2,4-D、 NAA等可以促 进愈伤组织的形
成和生长
激素与生长调节 剂的相互作用: 激素和生长调节 剂共同作用,影 响愈伤组织的形
成和生长
激素与生长调节剂 的浓度:激素和生 长调节剂的浓度对 愈伤组织的形成和 生长有重要影响, 过高或过低都会影
主要应用于植物育 种、基因工程、植 物病理学等领域
愈伤组织培养可以 快速繁殖植物,提 高植物产量和质量
愈伤组织培养的原理
外植体:从植物体上切取下 来的组织或器官
植物细胞全能性:植物细胞 具有发育成完整植株的能力
培养基:提供植物细胞生长 所需的营养物质和环境条件
愈伤组织:植物细胞在培养 基上生长形成的无定形组织
愈伤组织培养的应用
植物育种:通过愈伤组织培养,可以快速繁殖优良品种,提高育种效率
植物基因工程:利用愈伤组织培养,可以方便地进行基因转化和基因编辑,实现 植物基因工程的目标
植物细胞工程:通过愈伤组织培养,可以实现植物细胞的融合和重组,为植物细 胞工程提供技术支持
植物生物反应器:利用愈伤组织培养,可以构建植物生物反应器,生产生物活性 物质,如药物、酶等
营养成分:包 括糖类、氨基 酸、维生素、
无机盐等
生长调节剂: 如生长素、细 胞分裂素、赤
霉素等
植物激素:如 生长素、细胞 分裂素、赤霉
素等
琼脂:作为培 养基的凝固剂
和支撑物
水:作为培养 基的溶剂和营 养物质的载体
培养基的pH 值:影响植物 细胞的生长和
分化
环境因素与培养条件
光照:光照强度和光照时间对愈伤组织的生长有重要影响 温度:温度过高或过低都会影响愈伤组织的生长 湿度:湿度过高或过低都会影响愈伤组织的生长 培养基:培养基的成分和浓度对愈伤组织的生长有重要影响
植物愈伤组织培养

03
植物愈伤组织培养的成功应用案例包括生产次生代谢产物、新品种的快速繁殖 、基因工程研究和重造植物等。
展望植物愈伤组织培养的发展趋势和应用前景
植物愈伤组织培养的发展趋势包括深 入研究其生理生化机制、优化培养条 件和寻找更高效的诱导和增殖方法。
随着生物技术的不断发展,植物愈伤 组织培养将与基因工程、细胞工程和 代谢工程等技术结合,实现更高效的 植物繁殖和次生代谢产物的生产。
基本培养基
指具有共性特点的基础培养基,如MS、1/2MS等。
特殊培养基
指在基本培养基上添加特殊成分或调整某些成分而形成的新型培养基,如B5、N6等。
优化培养基
指根据不同植物或不同生理阶段的特点,对外植体、激素、盐分等成分进行调整而形成的 培养基,如分化培养基、生根培养基等。
03
愈伤组织培养的产业化应用
植物激素与信号转导途径的研究
研究植物激素在愈伤组织形成和分化过程中的作用及其信号转导途径,解析激素调控网络 。
比较基因组学和功能基因组学研究
通过比较不同植物愈伤组织形成的基因表达模式,挖掘关键基因和调控网络,为改良植物 品种提供理论依据。
创新愈伤组织培养技术及其在植物生产中的运用
01
创新愈伤组织培养技术
05
结论与展望
总结植物愈伤组织培养的研究成果
01
植物愈伤组织培养是一种有效的植物繁殖方式,能够快速繁殖和保存植物种质 资源,同时还可以生产次生代谢产物和进行基因工程研究。
02
植物愈伤组织培养的研究已经取得了许多成果,包括建立高效的愈伤组织诱导 和增殖培养基、探索不同因素对愈伤组织诱导和增殖的影响、研究愈伤组织分 化成根和芽的规律和机制等。
植物愈伤组织培养在农业、林业、园 艺和中药等领域具有广泛的应用前景 ,未来将会有更多的应用案例和研究 成果出现。
愈伤组织培养步骤

愈伤组织培养步骤
愈伤组织培养是生物科学研究中的重要技术,它能够让细胞在体外环境下生长和分化。
以下是愈伤组织培养的详细步骤:
1、准备培养基:愈伤组织培养需要特殊的培养基,其中包含细胞生长所需的各种营养成分。
按照培养基的说明书进行配制,确保准确无误。
2、灭菌:在培养之前,所有的培养器具和培养基都需要经过高温高压灭菌,以确保无菌环境。
这是细胞生长的关键,因为任何污染都可能导致实验失败。
3、细胞分离:从植物中分离出细胞是培养愈伤组织的第一步。
通常采用酶解法,即用纤维素酶和果胶酶分解细胞壁,使细胞分离成单个。
这一步要特别小心,因为酶的作用会影响后续的细胞生长。
4、接种:将分离出的单个细胞接种到培养基上。
这一步骤需要使用显微操作技术,确保每个细胞都准确地放置在培养基上。
5、培养:将接种了细胞的的培养基放入恒温箱中,设定适宜的温度和湿度。
在培养期间,要定期检查细胞的生长情况,确保没有污染。
6、观察与记录:每天使用显微镜观察细胞的生长情况,记录生长速度、形态变化等数据。
这些数据对于后续的研究非常重要。
7、换液与传代:随着细胞的生长,营养物质会被消耗。
因此,需要定期更换新鲜的培养基,以保证细胞的正常生长。
当细胞数量足够多时,可以进行传代,即将一部分细胞重新接种到新的培养基上。
8、实验结束后的处理:实验结束后,对使用过的器具和培养基进行消毒处理,避免对环境造成污染。
以上是愈伤组织培养的基本步骤,但实际操作中可能还需要根据具体的实验需求进行调整。
在进行实验时,一定要注意遵守实验室规则,保证实验安全。
愈伤组织培养PPT.

具体的操作过程:
无菌的块茎或块根,用钻孔器钻出一批同一类薄壁 组织圆柱形的组织,平行排列好。多把刀片等距离地固 定在一组金属片之间,一次切下去得到许多个长短一致 的圆柱形的外植体。
2.愈伤组织的起源
我们首先要对车辆的展示进行规范的管理。规范的管理可用八个字概括,就是整理、整顿、清理、清洁。这是来自于5S的。我们对车 辆的展示也要有这样规范的管理。
不要让被面试者久等,也不要把面试时间拖得太长,因为他们是请假来参加面试的,时间太长,可能不太方便。
第小六提课 示时72:晕心理厥愈测的试急伤应救作为从其他增测试殖的辅的助,组不应织单独细对待胞。 中产生,在组织培养状态下
由一系列内部(植物的种类、生理状况)和外部(光照、 外源激素)因素决定。
例如菊芋的诱导期有时还不需要1天,胡萝卜则要好几 天,而菊芋块茎贮藏时间的改变,诱导期也发生改变。从11 月到次年4月取菊芋块茎进行培养,则诱导期从22小时逐渐 延长到40小时。
故可以从内外因两方面着手,改变诱导期长短,主要外 因方面是添加一些生长物质。
Steward等(1964)用2, 4-D及其类似的生长调节物质处理 处于静止状态的组织,看到RNA的含量很快明显地增加。 并且2、4-D积累在分裂细胞的核仁中。 Yeoman 和 Mitchell (1970) 指出了核仁是生长物质的作用部 位。
Brown(1972)认为静止细胞是具有分裂能力的,只 是被存在的一类抑制物质所阻止,而使其分裂能力不能 表现,如果除去抑制物质,就可恢复分裂能力。若加入 抵消抑制物质影响的外源物质(激素),细胞就立即进 行DNA复制,全部细胞进入S期,并发生同步分裂。
愈伤组织培养 -回复

愈伤组织培养-回复标题:愈伤组织培养:理论与实践一、引言愈伤组织培养是植物组织培养技术中的一个重要环节,它是指在无菌条件下,通过切割、磨碎或酶解等方式处理植物体的一部分,使其形成一种无定形、高度液泡化的、具有分生能力的细胞团,即愈伤组织。
愈伤组织培养在植物繁殖、基因工程、次生代谢产物生产等方面具有广泛应用。
二、愈伤组织的形成1. 初始阶段:当植物组织受到损伤后,周围的活细胞会启动防御反应,产生大量的酚类物质和蛋白酶,以防止病原微生物的入侵。
同时,这些细胞开始进行分裂和脱分化,形成愈伤组织的初始细胞。
2. 扩增阶段:随着细胞的不断分裂和生长,愈伤组织逐渐扩大。
在这个过程中,细胞会失去原有的形态和功能特性,转变为具有高度分生能力的未分化细胞。
3. 分化阶段:在适宜的培养条件下,愈伤组织可以通过调控某些内源性或外源性的信号分子,诱导其分化为特定类型的细胞或组织,如根、芽、叶等。
三、愈伤组织培养的步骤1. 植物材料的准备:选择健康、无病虫害的植物材料,通常采用幼嫩的茎尖、叶片、花瓣、种子等部位。
2. 材料的消毒:使用70的酒精和0.1的升汞溶液对植物材料进行表面消毒,以杀死表面的微生物。
3. 培养基的制备:根据不同的实验目的和植物种类,选择合适的培养基配方,一般包括基础培养基、激素、维生素、氨基酸、糖类等成分。
4. 材料的接种:将消毒后的植物材料切成小块,放入装有培养基的培养皿中,然后密封并在无菌条件下培养。
5. 培养条件的控制:愈伤组织的生长和分化受光照、温度、湿度、气体环境等多种因素的影响,需要根据实验需求进行精细调控。
6. 愈伤组织的观察和鉴定:定期观察愈伤组织的形态、颜色、质地等变化,并通过显微镜、生物化学、分子生物学等方法进行鉴定和分析。
四、愈伤组织培养的应用1. 植物繁殖:通过诱导愈伤组织分化为芽和根,可以实现无性繁殖和快速繁殖,提高种苗质量和生产效率。
2. 基因工程:愈伤组织具有容易转化和筛选的优点,可以作为基因转移和表达的载体,用于植物遗传改良和功能基因的研究。
愈伤组织培养

愈伤组织培养一、外植体的选择愈伤组织培养的第一步是选择适当的外植体。
外植体可以是植物的根、茎、叶、花、果实等任何部分,但必须具有分生能力。
通常,选择新鲜、健康的幼嫩组织作为外植体,因为这些组织分生能力强,容易诱导出愈伤组织。
同时,外植体的选择还必须考虑其遗传背景、生理状态以及是否容易进行消毒等。
二、愈伤组织的诱导外植体在适当的培养基和条件下,能够被诱导形成愈伤组织。
这个过程涉及到细胞的脱分化,即细胞从特定的组织类型转变成未分化的状态。
为了成功诱导出愈伤组织,需要使用含有足够营养物质和植物生长调节物质的特殊培养基。
例如,高浓度的生长素和细胞分裂素可以促进细胞分裂和组织形成。
三、愈伤组织的增殖诱导出的愈伤组织需要在适合的培养基中进一步增殖。
这个过程需要持续监控并调整培养基的成分,以确保愈伤组织能够快速、健康地生长。
同时,还需要控制培养条件,如温度、光照、湿度等,以提供最佳的生长环境。
四、细胞分化的诱导增殖后的愈伤组织可以进行进一步的分化。
这个过程可以通过改变培养基的成分或添加特定的生长调节物质来实现。
例如,某些激素可以诱导愈伤组织分化成特定的组织或器官。
五、遗传稳定性的维持为了保持愈伤组织的遗传稳定性,通常需要进行长期的培养和多代的筛选。
这个过程可以通过定期检查染色体数目和结构来实现,以确保细胞的遗传稳定性。
同时,通过定期进行克隆繁殖,可以进一步维持细胞的遗传稳定性。
六、培养基的选择与优化愈伤组织培养的成功与否,很大程度上取决于培养基的选择和优化。
培养基是愈伤组织获取营养的来源,必须含有细胞生长所需的各类营养物质,如碳源、氮源、维生素、矿物质等。
同时,还需要添加植物生长调节物质,如生长素、细胞分裂素等,以调节细胞的生长和分化。
对于不同的外植体和实验目的,可能需要选择不同的培养基。
例如,MS、N6、B5等都是常用的培养基配方。
此外,培养基的pH值、渗透压等也需要进行适当的调整。
为了优化培养基,通常需要进行一系列的试验和筛选,以找到最适合特定组织或细胞的培养基配方。
愈伤组织与组织培养

愈伤组织与组织培养
愈伤组织与组织培养是一种诊治外科创伤的特殊技术,又被称为“愈合系统性治疗”。
它是一种旨在促进创伤愈合的技术,以减轻对
病人术后恢复阶段带来的各种不佳影响,比如减少肿胀、减少纤维化、改善肌肉功能和减少运动康复期间的疼痛。
愈伤组织与组织培养的本质是将细胞的分子调节功能最大化,以
减少损伤因子的作用。
当细胞受到结构损伤或内部问题时,通常会导
致细胞代谢和功能受损,同时也会降低免疫力和自愈能力,甚至可能
会在伤口重叠。
因此,组织培养的目的是通过强制细胞重新分泌代谢,从而促进伤口的快速愈合。
愈伤组织与组织培养通常由三大步骤组成:细胞源收集、细胞活
化和细胞植入。
首先,需要从伤口处收集细胞样本,例如脂肪细胞或
血液细胞,以分析培养基的成分和避免潜在的感染病原体。
然后,上
述细胞样本需要进行活化处理,这有助于增强细胞的代谢过程和细胞
再生能力,以促进伤口愈合。
最后,细胞样本需要植入伤口,以提供
充足的氧合作用,加速伤口的愈合。
另外,还有几种特殊方法可以提升愈伤组织与组织培养的治疗效果,例如使用激素、可见光或激光来增强细胞活化;使用免疫疗法,
即将有剂量的免疫系统激素、血清因子注入伤口;使用局部药物,例
如抗炎药或抗感染药物,以改善伤口组织的形态和功能等。
总之,愈
伤组织与组织培养是一种有效的治疗创伤的方法,可以帮助病人减少
创伤带来的不良影响,从而实现快速愈合。
愈伤组织培养ppt课件

18
分化期的主要表现:
细胞分裂部位和方向发生改变。 分化组织瘤状结构和维管组织的形成。 体积不再减小。 出现各种类型的细胞。
可编辑课件PPT
19
二、愈伤组织的继代培养
愈伤组织在培养基上生长一段时间以后,由于营 养物质枯竭,水分散失,以及代谢产物的积累, 必须转移到新鲜培养基上培养,即继代培养。
一般情况下,植物组织均能诱发形成愈伤组织。 由外植体形成愈伤组织,标志着组织培养的开始。
可编辑课件PPT
4
愈伤组织的形成条件
一个成熟的植物细胞经历了脱分化之后, 之所以还能再分化而形成完整的植株,是 因为这些细胞具有全能性。
可编辑课件PPT
5
外植体的选择与灭菌 植株茎的切段、叶、根、花和种子,或把其中的某些组
30
(一)外植体本身
1.遗传型 材料的基因型对愈伤组织的器官 分化有决定性的影响。
2.器官和部位 对有些植物而言,不同的器 官或组织所形成的愈伤组织,在生理上或形态 上存在明显差异。
3.年龄 年龄较幼的外植体,不仅易于诱导 形成愈伤组织,而且也容易诱导分化成植株。
可编辑课件PPT
31
(二)培养基
可编辑课件PPT
26
可编辑课件PPT
27
形态发生方式(二)
胚状体方式 指由培养细胞诱导分化出的 胚芽、胚根、胚轴的胚状结构,进而长成 完整植株。
可编辑课件PPT
28
可编辑课件PPT
29
四、愈伤组织形态发生的调控
影响因子: (一)外植体本身 (二)培养基 (三)培养环境
可编辑课件PPT
可编辑课件PPT
10
可以从内外因两方面着手,改变诱导期长 短
外因:添加生长激素如2,4-D来刺激处于 静止状态的组织。
植物愈伤组织培养

针对不同植物,选择适宜的基因型和生理状态进 行愈伤组织培养,以提高成功率。
3
采取抗污染和抗褐化措施
在愈伤组织培养过程中,采取抗污染和抗褐化措 施,如定期更换培养基、添加抗氧化剂等。
加强愈伤组织培养研究的建议与展望
加强基础研究
深入研究植物愈伤组织培养的机理和调控机制,为实际应用提供 理论支持。
遗传改良
愈伤组织培养可用于植物的遗传改良,通过细胞工程和基 因工程技术将优良性状导入到其他植物中,培育出抗逆性 更强、产量更高、品质更优的新品种。
生物技术研究
愈伤组织培养是植物生物技术研究的重要基础,可以用于 研究植物生长发育规律、细胞分化与形态发生、基因表达 与调控等生物学问题。
愈伤组织培养的历史与发展
将已经形成的愈伤组织进行继代培养,通过不断 的切割和重新接种,实现愈伤组织的快速增殖。
悬浮培养法
将已经形成的愈伤组织进行悬浮培养,通过细胞 分裂和增殖,实现愈伤组织的快速增殖。
添加激素法
在培养基中添加适当的激素,如生长素和细胞分 裂素,促进愈伤组织的增殖。
愈伤组织的分化技术
器官分化法
将愈伤组织进行器官分化 培养,通过特定的培养条 件诱导产生根、茎、叶等 器官。
基的营养成分和激素水平也需要精确控制。
基因型和生理状态的影响
02
不同基因型和生理状态的植物在愈伤组织培养中的表现差异较
大,需要针对不同情况进行调整。
污染和褐化问题
03
愈伤组织培养过程中易出现污染和褐化现象,影响培养效果。
提高愈伤组织培养效率的方法与策略
1 2
优化培养条件
根据不同植物的特点,调整温度、光照、湿度等 环境条件,以及培养基的营养成分和激素水平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一)、 愈伤组织形成
1 、器官的形成 一般愈伤组织开始分化时,由大小不等的细
胞开始逐渐形成大小均匀的细胞,保持相对稳定 状态。
在分化时,愈伤组织的表层和内部都可形成 分生中心。芽多发生在愈伤组织的表层,属外起 源。
根发生在组织的深处,与整体植株发生类似, 是内起源。
愈伤组织的外部形态也随分化而改变,一般 由疏松转向紧密。
• 无论在MS还是在H或B5培养基中,不附加激素2, 4-D均不能诱导 扁桃花药愈伤组织的形成,
• 扁桃花药在H+1.0mg/L 2,4-D的培养基上诱导率最高为47%;在 MS+1.0mg/L 2,4-D培养基上诱导率为67.0%;在B5+0.5~ 1.0mg/L2,4-D,出愈率都在84.0%以上,其中以2,4-D为0.5mg/L时, 出愈率高达100%.。说明在扁桃花药诱导过程中,最适基本培养 基是B5,最佳 2,4-D浓度为0.5mg/L。
分裂期:
外植体(explant)中已分 化的活细胞在外源激素的作 用下,外植体外层细胞出现 了分裂,由于外层细胞的迅 速分裂使得这些细胞的体积 缩小,逐渐回复到分生组织 状态,该时期细胞通过脱分 化的起动期而进入分裂,并 开始形成愈伤组织。
分裂期特征:
生理生化上分裂期的一个明显特征 是外层细胞进行分裂,而中间的细胞不 分裂。另外还有细胞数目增加,体积变 小;细胞核和核仁增到最大,RNA含量 达到最高等。
• 此时期的愈伤组织:细胞分裂快, 结构疏散,缺少组织的结构,颜色浅 而透明。
分裂期愈伤组织
形成期:
• 细胞分裂从分裂期的周缘细胞分 裂为主逐渐转向内部的组织细胞, 愈伤组织表层细胞分裂减缓或停 止,内部深层细胞分裂并形成像 维管束或类似于分生组织组成的 鸟巢状结构的次生组织。
• 此时期中细胞的伸展和分裂处于 平衡,故细胞的平均大小趋于稳 定。
* 表中数据取材于杨宁等人的《当归愈伤组织的增殖与分化培养》
三、愈伤组织的形态发生
• 愈伤组织培养物在某些条件下,可以再分 化产生不定芽或根的分生组织甚至是胚状体, 继之,由这些有结构的组织而发育成苗或完整 小植株。
• 愈伤组织通过再分化形成再生植株的方式 主要有三种:1)、先产生芽,后在茎的基部长 根;2)先长根,再长芽;3)愈伤组织的不同部位 分别形成根和芽。
• 程林梅等(2001)的研究表明,利用不同基 因型大豆品种的下胚轴作外植体进行组培时, 培养基对愈伤组织的影响不明显;细胞分裂素 (KT)和NAA的配比浓度对其愈伤组织的分 化影响显著;不同基因型大豆植株再生作用差 异明显;外植体取材时间和取材部位对再生植 株的形成也具有较大的影响,再生能力最强的 取材部位时从子叶节到下胚轴6mm区段,当下胚 轴长到2~3cm时取材最佳(见表3-6)
芦荟愈伤组织形态发生的人为调控
1、先用MS培养附加不同浓度的6BA,促进不定 芽的生成。
不同浓度6-BA对库拉索芦荟增殖的影响
芦荟愈伤组织形态发生的人为调控
2、然后将抽枝的小植株转移到MS附加不同浓度 NAA培养基上培养,诱导根的发生与生长 。
不同浓度NAA对库拉索芦荟生根的影响
影响愈伤组织分化的其他因素
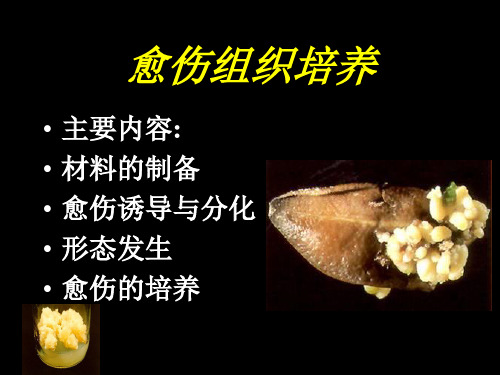
第二章: 愈伤组织培养
主讲教师: 联系方式:
蔡建秀
主要内容:
• 基本概念 • 愈伤组织的诱导与分化 • 愈伤组织的形态发生 • 愈伤组织的培养
一、基本概念
• 脱分化 : 具有特定结构与功能的植物组织,在一定条件下,
细胞改变原来的分化状态,失去原有的结构与功能, 转变为具有分生能力的细胞的过程 。
影响愈伤组织分化的其他因素
物理性状方面均有明显的差异。有的愈伤组织呈
淡黄色或白色,有的愈伤组织呈绿色或红色。
•
一般来说,来源于相同组织的愈伤组织含有
的色素大致相同, 但经过反复继代培养后会失去
色素。
植物愈伤组织类型举例:
根尖愈伤组织 (无色透明)
茎尖愈伤组织 (淡绿色)
锁阳愈伤组织(红色) 香茶菜愈伤组织
当归茎段愈伤组织(绿色)
杨宁[2]等人用MS培养基作为基本培养继进行当归愈伤组织增 殖培养的研究表明,单独使用一种生长素时,愈伤组织增殖很不 明显;若只使用一种细胞分裂素时,愈伤组织均不见增殖,并且 生长状况也不佳;但将二者合理搭配使用时,愈伤组织不仅增殖 较明显,而且生长状况较佳。可见,兼用生长素和6-BA增效作用 较明显
在外源植物激素的作用下,处于静止状态的植物细胞经过复 杂的脱分化过程恢复分裂能力转化为分生细胞。此过程有人称之 为:细胞的诱导活化过程。
有人认为损伤是诱导细胞分裂的重要因素。受伤细胞释放出 的物质与外ቤተ መጻሕፍቲ ባይዱ激素共同诱导细胞发生分裂,是诱导植物愈伤组织 形成的主要原因。
Brown(1972)认为静止细胞是具有分裂能力的,只是被存 在的一类抑制物质所阻止,而使其分裂能力不能表现,如果除去 抑制物质,就可恢复分裂能力。若加入抵消抑制物质影响的外源 物质(激素),细胞就立即进行DNA复制,全部细胞进入S期, 并发生同步分裂。
特点:
• 在诱导期,代谢活化了,细胞内的合 成代谢迅速进行,但是细胞的大小仍 然和外植体时一样,没有多大改变。
处于起始 期外植体
诱导期的长短
• 由一系列内部(植物的种类、生理状况) 和外部(光照、外源激素)因素决定。 例如:菊芋的诱导期有时还不需要1天, 胡萝卜则要好几天,而菊芋块茎贮藏时 间的改变,诱导期也发生改变。从11月 到次年4月取菊芋块茎进行培养,则诱导 期从22小时逐渐延长到40小时。
不同基因型、激素浓度对大豆植株再生的影响
木本植物愈伤组织形态发生的人为调控
• 第一步:利用分化培养基(含有6BA、CPPU、KT)使愈伤组织形成不定 芽,增加繁殖系数。
• 第二步:当不定芽长大出现叶片后, 再将伸长的苗从基部切下转入含生长素 类(如IAA、NAA)的生根培养基上培 养诱导根的生成。
杨宁[1]等人的研究表明, 植物扁桃(‘Naporeil’ 品种)的茎段、花药在适宜的培养基上能比较容易的诱 导出愈伤组织, 而叶肉组织则不能或难以诱导形成愈 伤组织。
影响植物愈伤组织形成的因素:
2、选择适宜基本培养基不仅影响愈伤组织的诱导,而且影响伤组 织的生长。
于树宏和李玲(1999)用浅绿色野葛叶片愈伤组织进行继代 培养,用MS+1mg/L NAA, 愈伤组织呈浅绿色,新鲜健壮;在 培养基中同时加入3mg/L 6-BA 和1mg/L NAA,愈伤组织生长迅速, 若培养时间较长,形成的愈伤组织呈白、硬颗粒状, 部分会发生 褐变死亡;但若将愈伤组织置于含相同浓度6-BA和NAA的 B5 培 养基上生长,愈伤组织可以始终保持新鲜健壮的外观, 而且不断 生长。
案例1:MS培养基含有不同浓度2,4-D时斑茅幼叶形成愈伤组织的诱导率(%)
不同浓度的2,4-D对愈伤组织的诱导率是不同的。一般情况下,2,4-D的 浓度过低(低于10-9mg/L)时,愈伤组织生长缓慢;浓度过高(高于10 mg/L) 时,就会抑制愈伤组织的生长。
• 案例2. 不同培养基及激素浓度对诱导扁桃花药愈伤组织的影响
条件,其中激素的成分和浓度是最重要的因素。
1、 常用激素与浓度
激素类型
激素浓度
生长素类(2,4-D,
0.01~10 mg/L
IAA , NAA)
细胞分裂素类(玉米素, 0.1~10 mg /L
6-BA )
2、影响愈伤组织诱导的因素:
• 1)、激素: 多数情况下,单独使用2,4-D可以成功诱导愈伤组织的发生
影响植物愈伤组织形成的因素:
1、 同一植株不同器官形成愈伤组织的能力不同。例如: 君子兰 用MS+2mg/L 6-BA +2mg/L NAA +1mg/L 2,4-D 固体培养基培养,茎尖、茎切块和叶片形成愈伤组织的 诱导率分别为85%、13%和72%;若用MS+5mg/L 6-BA +0.5mg/L NAA +1mg/L 2,4-D 固体培养基培养,三种外植 体形成愈伤组织的诱导率分别为82% 、9%和70%。这 说明培养基中植物生长物质组成的比例不同,直接影响 着愈伤组织的形成。
• 愈伤组织: 植物各种器官的外植体在离体的条件下,细胞经脱
分化等一系列过程,转变为分生细胞,进而转变形成 一种能够迅速增殖的无特定结构和功能的细胞团
一般低,植物各器官、组织都有被诱发产生愈伤 组织的潜在可能性。
自然条件下的植物愈伤组织
刺桐树
二、愈伤组织的诱导与分化
一)、愈伤组织的诱导
诱导愈伤组织的成败关键主要不是实验材料,而是培养
形成期愈伤组织的特点:
• 生长旺盛的愈伤组织一般呈乳黄色或白色, 有光泽;也有浅绿色或绿色;而老化的愈伤组织 多转变为黄色甚至褐色。
提醒:
根据形态变化列出三个时期,实际上 它们的界限并不分严格,特别是分裂期 和分化期。一块培养组织的细胞既有分 裂的又有分化的。
愈伤组织的类型:
•
不同植物来源的愈伤组织,在质地、形态和
2、体细胞胚的发生
• 愈伤组织 体细胞胚 植株
二)、激素对愈伤组织分化的影响
• 植物生长调节物质在分化过程中的 作用是极为明显的,合适的植物生长物 质配比在器官分化中起着重要的作用。 如仙人掌科的金牛掌茎段培养中, 当6-BA的浓度是NAA的50~100倍时,茎 段的愈伤组织可以再分化出仔球,而6BA浓度过高(150倍)或过低(10倍)则无仔 球形成。
研究表明:
• 生长素与细胞分裂素对保持愈伤组织的 快速生长是必要的,特别是二者搭配使 用时更能强烈刺激愈伤组织的形成。
• 在愈伤组织的诱导时,植物材料不同所 用的植物生长调节物质不同,使用的浓 度也不同。
2).培养基
不同的培养基成分对植物不同器官的愈伤 组织诱导存在着影响
