植物叶绿素类胡萝卜素测定办法
木薯组培苗中叶绿素和类胡萝卜素含量分析

木薯组培苗中叶绿素和类胡萝卜素含量分析木薯是世界上主要的粮食作物之一,被广泛种植和消费。
木薯组培苗是一种种植木薯的重要前期材料,在木薯生长的过程中,叶绿素和类胡萝卜素是主要的叶片色素,对木薯的生长和发育有重要的影响。
对木薯组培苗中叶绿素和类胡萝卜素含量进行分析,有助于了解木薯的生长和发育情况,为木薯的高产高效种植提供科学依据。
一、叶绿素和类胡萝卜素的功能和含量分析方法(一)叶绿素的功能:叶绿素是一种植物叶片中最为常见的绿色色素,是进行光合作用的必需色素,具有吸收光能和光能转化为化学能的功能。
叶绿素的含量足够多,则能够促进植物进行光合作用,从而加速植物的生长和发育。
(二)类胡萝卜素的功能:类胡萝卜素是一种植物中重要的营养成分,是植物的主要抗氧化剂。
类胡萝卜素还能够帮助植物克服干旱胁迫、低温、光照强度大等逆境,对植物的生长有积极促进作用。
类胡萝卜素的含量也是衡量植物生长状况的重要指标。
(三)叶绿素和类胡萝卜素的含量分析方法:叶绿素和类胡萝卜素的含量通常采用乙醇提取-乙醇溶解法与分光光度法进行测定。
乙醇提取-乙醇溶解法是通过将植物组织用乙醇提取,然后利用乙醇溶解叶绿素和类胡萝卜素,最后通过测定溶液的吸光值来得到叶绿素和类胡萝卜素的含量。
而分光光度法则是利用不同波长下植物组织中叶绿素和类胡萝卜素的吸光特性进行测定。
通过这两种方法可以准确快速地测定叶绿素和类胡萝卜素的含量。
二、木薯组培苗中叶绿素和类胡萝卜素含量的分析(一)叶绿素含量分析:对木薯组培苗中叶绿素含量进行测定,首先需将木薯组培苗中的叶片样品取出,使用乙醇提取-乙醇溶解法进行提取,然后通过分光光度法测定其吸光值。
根据吸光值的测定结果,结合标准曲线,可以得到木薯组培苗中叶绿素的含量。
实验结果显示,木薯组培苗中叶绿素的含量随着生长期的延长而逐渐增加,表明木薯组培苗的光合作用能力随着生长期的延长而逐渐增强。
(二)类胡萝卜素含量分析:通过乙醇提取-乙醇溶解法与分光光度法测定木薯组培苗中类胡萝卜素的含量,结果表明木薯组培苗中类胡萝卜素的含量也随着生长期的延长而逐渐增加。
植物叶绿素类胡萝卜素测定方法

叶绿素、类胡萝卜素含量的测定一、原理根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量;根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C 和液层厚度L成正比,即A=αCL式中:α比例常数;当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物质的吸光系数;各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得;如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和;这就是吸光度的加和性;今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b及类胡萝卜素在该波长下的吸光系数即可求出其浓度;在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰;二、材料、仪器设备及试剂一材料:新鲜或烘干的植物叶片;二仪器设备:1分光光度计;2电子顶载天平感量;3研钵;4棕色容量瓶; 5小漏斗;6定量滤纸;7吸水纸; 8擦境纸;9滴管;三试剂:195%乙醇或80%丙酮v丙酮:v乙醇=2:1的95%水溶液;2石英砂;3碳酸钙粉; 暗中2h,,25ml三、实验步骤1取新鲜植物叶片或其它绿色组织或干材料,擦净组织表面污物,剪碎去掉中脉,混匀;2将取好的样品放入25ml容量瓶中,加混合浸提液无水乙醇:丙酮=5:520ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用;3把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度;选择波长663 646 和470nm;四、实验结果计算叶绿素a 的浓度 = OD 633 – OD 646叶绿素b 的浓度 = OD 646– OD 663类胡萝卜素浓度=÷229 单位 mg/L Cmg/L 提取液总量ml叶绿体色素含量mg/g= ____________________________ 烟叶重量g1000注意事项:操作避光研磨时间短些。
一种检测农作物叶片中叶绿素a和类胡萝卜素含量的方法[发明专利]
![一种检测农作物叶片中叶绿素a和类胡萝卜素含量的方法[发明专利]](https://img.taocdn.com/s3/m/9bd7fbf36bd97f192379e9c2.png)
专利名称:一种检测农作物叶片中叶绿素a和类胡萝卜素含量的方法
专利类型:发明专利
发明人:崔海瑞,王伟博,舒庆尧
申请号:CN201110426195.2
申请日:20111219
公开号:CN102519886A
公开日:
20120627
专利内容由知识产权出版社提供
摘要:本发明公开了一种检测农作物叶片中叶绿素a和类胡萝卜素含量的方法,包括:选取一组叶色深浅明显不同的叶片,通过扫描和图像分析处理获得该组叶片样品的图像亮度值,再结合分光光度法准确测定的该组叶片的叶绿素a和类胡萝卜素含量,分别建立叶绿素a与叶片的图像亮度值的函数关系,以及类胡萝卜素与叶片的图像亮度值的函数关系;再通过扫描和图像分析处理获得待测叶片的图像亮度值,并根据所述的函数关系分别计算出待测叶片中叶绿素a和类胡萝卜素含量。
本发明所用设备简单,操作简便、成本低、速度快,无需化学试剂和提取,检测不受时间和外部环境的影响,测定结果稳定,可实现随时随地快速检测农作物叶片中叶绿素a和类胡萝卜素含量。
申请人:浙江大学
地址:310027 浙江省杭州市西湖区浙大路38号
国籍:CN
代理机构:杭州天勤知识产权代理有限公司
代理人:胡红娟
更多信息请下载全文后查看。
实验二蔬菜中胡罗卜素的测定(纸层析法)营养与食品卫生

营养与食品卫生学
(三)样品的采集和处理
(1)粮食:样品用水洗三次,置60℃烤箱 中烤干,磨粉,储于塑料瓶内,放一小包 樟脑精,盖紧瓶塞保存,备用。
(2)蔬菜与其他植物性食物:取可食部用 水冲洗三次后,用纱布吸去水滴,切碎, 用匀浆器制成匀浆,贮于塑料瓶内,冰箱 内保存备用。
首都医科大学
点样:准确吸取待检液40μl在滤纸下端基线上A、B两 点之间或C、D两点之间迅速来回进行带状点样一次点 完(见图1)。每个样品点2带作为平行样。
首都医科大学
营养与食品卫生学
展开:
待纸上所点样液自然挥发干后,将滤纸卷成圆筒状,用定 书机固定两边,置于预先用石油醚饱和的层析缸中(见图 2),进行上行展开。(注意纸纹方向与展开方向一致; 缸内石油醚深度约1cm即可,样斑不能直接接触石油醚。
首都医科大学
营养与食品卫生学
四、操作步骤
(5)将石油醚提取液通过盛有10g无水硫酸钠固 体的小漏斗,滤入瓷蒸发皿。用少量石油醚分数 次洗净分液漏斗和无水硫酸钠层内的色素,洗涤 液合并瓷蒸发皿中。 (6)将瓷蒸发皿置于低温电热板上蒸发至约1ml 时,取下,待其自然挥干。冷却后置于冰裕上, 立即用石油醚2ml沿蒸发皿壁将色素洗下,混匀立 即点样。 (7)层析
首都医科大学
营养与食品卫生学
五、计算
式中:X2——样品中胡萝卜素的含量,以β -胡萝卜素计,mg/100g; c——在标准曲线上所查得的胡萝卜素 的含量,μg; V1——点样体积,ml; V2——加入瓷蒸发皿内的样品石油醚 提取液浓缩后的定容体积,ml; m——样品质量,g。
首都医科大学
营养与食品卫生学
首都医科大学
营养与食品卫生学
植物生理学实验-叶绿体色素的定量测定

植物生理学实验
整理课件
2、测定光密度
以96%乙醇为空白,比色测定3份样品的光密度;
波长665nm、649nm和470nm
B126室:分光光度计 型号:22PC
整理课件
分光光度计的使用:?
功能键
显示屏
样品室
整理课件
波长调节旋钮
整理课件
测定溶液加到 比色杯的2/3初
空白对准光路
整理课件
整理课件
整理课件
植物生理学实验
叶绿体色素在不同溶剂中的吸收光 谱有差异。在使用不同溶剂提取色素时, 计算公式有所不同。
本实验以 96%乙醇为例。
整理课件
96%乙醇提取
已知叶绿素a、b的96%乙醇提取液在红光 区的最大吸收峰:a=665nm;b=649nm
根据有色物质的加和性,建立方程组: D665=Kaλ665 Ca+ Kbλ665 Cb D649=Kaλ649 Ca+ Kbλ649 Cb
Ka645= 16.75 Kb645= 45.60
整理课件
植物生理学实验
根据加和性原则列出以下关系式: D663 = 82.04Ca+9.27Cb D645 = 16.75Ca+45.60Cb
解方程组得:
Ca (mg/L)= 12.72D663 – 2.59D645 Cb (mg/L)= 22.88D645 – 4.67D663 Ca与Cb相加即得叶绿素总量(CT): CT (mg/L)= Ca + C整b理课=件20.29D645 + 8.05D663
Enter 输入键,接受当前的状 态或进行测定;
Mode 功能键,按该键显示不 同的功能菜单;
2、测定
实验三十四植物叶绿体色素的提取、分离、表征及含量测定

实验三十四植物叶绿体色素的提取、分离、表征及含量测定摘自王尊本主编,综合化学实验(第二版),第226-244页,北京:科学出版社,2007年9月。
实验三十四植物叶绿体色素的提取、分离、表征及含量测定[1-27]一、叶绿体色素的提取(一) 实验目的1)掌握有机溶剂提取叶绿体色素等天然化合物的原理和实验方法。
2)了解皂化-萃取提取胡萝卜素的原理。
3)了解1,4-二氧六环沉淀法提取叶绿素的原理。
(二) 实验原理植物光合作用是自然界最重要的现象,它是人类所利用能量的主要来源。
在把光能转化为化学能的光合作用过程中,叶绿体色素起着重要的作用。
高等植物体内的叶绿体色素有叶绿素和类胡萝卜素两类,主要包括叶绿素a、叶绿素b、胡萝卜素和叶黄素四种。
它们所呈现的颜色和在叶绿体中含量大约比例见表34.1。
表34.1 高等植物体内叶绿体色素的种类、颜色及含量项目叶绿素类胡萝卜素叶绿素a 叶绿素b 胡萝卜素叶黄素颜色蓝绿色黄绿色橙黄色黄色在叶绿体内各色素含量比例 3 1 2 13 1 叶绿素chlorophylls是叶绿酸的酯,它在植物进行光合作用中吸收可见光,并将光能转变为化学能。
叶绿素是植物进行光合作用所必需的催化剂。
在绿色植物中叶绿素主要以叶绿素a(C55H72O5N4Mg)和叶绿素b(C55H70O6N4Mg)两种结构相似的形式存在,其差别仅是叶绿素a中一个甲基被叶绿素b中的甲酰基所取代。
叶绿素的基本结构见图34.1。
在叶绿素分子结构中含有四个吡咯环,它们由四个甲烯基联结成卟啉环,在卟啉环中央有一个镁原子,它以两个共价键和两个配位键与4个吡咯环的氮原子结合成内配盐,形成镁卟啉。
在叶绿素分子中还有两个羧基,其中一个与甲醇酯化成COOCH3,另一个与叶绿醇酯化成COOC20H39长链。
类胡萝卜素carotenoids是一类不饱和的四萜类碳氢化合物(例如胡萝卜素,carotenes,或它们的氧化衍生物(例如叶黄素类,xanthophylls。
植物体叶绿素含量的测定实验报告

实验报告植物体叶绿素含量的测定摘要:本实验采用分光光度法,利用95%乙醇提取菠菜叶片中和番茄叶片中叶绿体色素,叶绿素a ,叶绿素b 和类胡萝卜素最大吸收峰的波长分别是665nm 、649nm 和470nm 。
根据分光光度计测定的吸光度值,从而计算出乙醇提取液中叶绿体色素含量。
实验原理:利用95%乙醇提取叶绿体色素,叶绿素a ,叶绿素b 和类胡萝卜素最大吸收峰的波长分别是665nm 、649nm 和470nm 。
根据分光光度计测定的吸光度值,可以计算出乙醇提取液中叶绿体色素含量。
实验目的:掌握分光光度计法对叶绿素a 、叶绿素b 、叶绿素总浓度和类胡萝卜素总浓度测定和计算的方法。
实验材料:生物材料:菠菜叶片0.25g ,自己培养的全素番茄苗叶片0.2g ,缺磷番茄苗叶片0.2g ;试剂:95%乙醇、石英砂、碳酸钙;仪器:分光光度计、电子天平、研钵、漏斗、玻璃棒、小烧杯、10ml量筒、50ml 容量瓶、剪刀、滤纸、滴管。
实验步骤:1.叶绿体色素的提取取新鲜菠菜叶片0.25g ,擦干,去中脉,剪碎放入研钵,加入少许石英砂和CaCO 3,再加入95%乙醇3ml,研磨成匀浆,再加95%乙醇10ml ,静置10min ,用漏斗滤去残渣,用乙醇反复冲洗研钵、残渣至无色;用容量瓶定容至50ml 。
2.吸光度的测定取光径1cm 比色杯,注入上述叶绿素提取液,以95%乙醇注入另一同样的比色杯内作为空白对照,在波长665、649、和470nm 下测定吸光度。
3.结果计算依据下列计算公式,分别计算出叶绿素a 、B 的浓度及其叶绿素总浓度和类胡萝卜素的浓度。
C a (叶绿素a )=13.95A 665 – 6.8A 649C b (叶绿素b )=24.96A 649 – 7.32A 665C T (叶绿素)=C a +C b =18.16A 649 + 6.63A 665C x.c (类胡萝卜素)=(1000A 470 – 2.05C a -114.8C b )/248叶绿体色素含量 = )样品鲜重(稀释倍数)提取液体积()色素浓度(g /mg ⨯⨯L L实验结果:菠菜叶片提取液吸光值:1、测定叶绿素ab为什么选用红光波长?叶绿素吸收红光和蓝紫光,故有两个吸收峰,光合色素还有类胡萝卜素,只吸收蓝紫光,所以不能选蓝紫光区测定,否则被类胡萝卜素干扰,只能用红光。
高效液相色谱法同时测定叶绿素和类胡萝卜素

高效液相色谱法同时测定叶绿素和类胡萝卜素一、实验目的1、了解高效液相色谱在叶绿体色素全分析的应用。
2、掌握生物样品的高效液相色谱实验技术。
3、初步掌握梯度洗脱实验技术。
二、测定意义植物光合色素的分析方法有许多种,经典的方法有纸层析和薄层层析,薄层层析又根据吸附剂不同而分成几种类型。
吸附剂的类型有:硅胶、硅藻土、糖类、纤维素和聚酰胺等。
层析后的各个色素斑点剪下并用相应的溶剂溶解后测定其吸收光谱,对照文献资料再确定色素的种类。
上述方法较简便,但准确性不高。
近几年随着高效液相色谱技术的发展,有人已将它应用于植物色素的分析中。
从植物提取液分离出来的叶绿素和胡萝卜素已发现有多种异构体,而且常常是同时存在的。
因此对叶绿素和胡萝卜素的深入研究较为困难。
高效液相色谱既能对单一组分进行定量,又能对混合物中的多组分在分离的基础上进行定量。
既能用于主要成分的含量测定,又能用于微量和痕量组分的测定。
高效液相色谱是一种准确度好和精密度高的分析技术。
因此,尽管难以得到所有的植物色素标准品,但高效液相色谱技术仍被认为是研究叶绿素和胡萝卜素的一种最有效手段。
三、基本原理叶绿体色素提取液可以采用正相或反相高效液相色谱法分析,实验表明,反相高效液相色谱法更加方便。
但由于色素提取液各组分的极性差别较大,等度洗脱可能使某些组分的分离不够完全。
因此,对植物色素提取液的全分析应采用梯度洗脱方式以改善分离和缩短分析时间。
本实验采用高效液相色谱法可对绿色植物叶片提取液中的色素进行较全面的分离,并直接测定叶绿素a、叶绿素b和β-胡萝卜素的含量。
四、仪器与试剂1. 岛津LC-20 高效液相色谱仪,色谱工作站,微量进样器(100 μl),Hypersil BDS C18( 4.0mm×200 mm,5μm)。
2. 叶绿素a、叶绿素b和β-胡萝卜素纯品为Sigma公司产品,甲醇、二氯甲烷和乙腈为液相色谱淋洗剂,实验用水为二次去离子水(娃哈哈纯净水),经玻璃系统重蒸馏。
实验二蔬菜中胡罗卜素的测定(纸层析法)营养与食品卫生

营养与食品卫生学
四、操作步骤
(5)将石油醚提取液通过盛有10g无水硫酸钠固 体的小漏斗,滤入瓷蒸发皿。用少量石油醚分数 次洗净分液漏斗和无水硫酸钠层内的色素,洗涤 液合并瓷蒸发皿中。 (6)将瓷蒸发皿置于低温电热板上蒸发至约1ml 时,取下,待其自然挥干。冷却后置于冰裕上, 立即用石油醚2ml沿蒸发皿壁将色素洗下,混匀立 即点样。 (7)层析
首都医科大学
营养与食品卫生学
七、实验报告应包括以下内容
1.实验目的。 2.实验原理。
3.实验方法。
4.实验操作步骤。 5.结果的计算。 6.实验注意事项。 7.结果的评价和小结。
首都医科大学
营养与食品卫生学
首都医科大学
首都医科大学
营养与食品卫生学
五、计算
式中:X2——样品中胡萝卜素的含量,以β -胡萝卜素计,mg/100g; c——在标准曲线上所查得的胡萝卜素 的含量,μg; V1——点样体积,ml; V2——加入瓷蒸发皿内的样品石油醚 提取液浓缩后的定容体积,ml; m——样品质量,g。
首都医科大学
营养与食品卫生学
(10)标准曲线绘制:取浓度为50μg/ml的β-胡萝卜素 应用液2ml放入100ml具塞锥形瓶中,以下操作步骤与样品 1-9项相同,但点样体积分别为20μl、40μl、60μl、 80μl和100μl,相当于含胡萝卜素1、2、3、4、5μg。 比色后,以胡萝卜素含量为横坐标,以吸光度为纵坐标绘 制标准曲线。
点样:准确吸取待检液40μl在滤纸下端基线上A、B两 点之间或C、D两点之间迅速来回进行带状点样一次点 完(见图1)。每个样品点2带作为平行样。
首都医科大学
营养与食品卫生学
烟叶中叶绿素和类胡萝卜素的测定
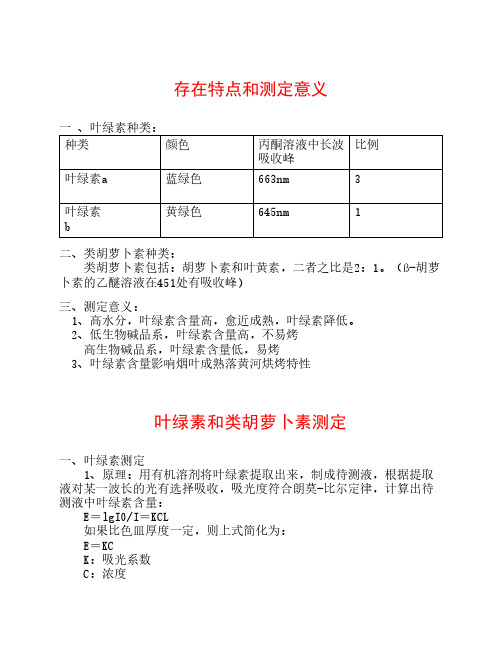
存在特点和测定意义一 、叶绿素种类:比例种类颜色丙酮溶液中长波吸收峰叶绿素a蓝绿色663nm3黄绿色645nm1叶绿素b二、类胡萝卜素种类: 类胡萝卜素包括:胡萝卜素和叶黄素,二者之比是2:1。
(ß-胡萝卜素的乙醚溶液在451处有吸收峰)三、测定意义: 1、高水分,叶绿素含量高,愈近成熟,叶绿素降低。
2、低生物碱品系,叶绿素含量高,不易烤 高生物碱品系,叶绿素含量低,易烤 3、叶绿素含量影响烟叶成熟落黄河烘烤特性叶绿素和类胡萝卜素测定一、叶绿素测定 1、原理:用有机溶剂将叶绿素提取出来,制成待测液,根据提取液对某一波长的光有选择吸收,吸光度符合朗莫-比尔定律,计算出待测液中叶绿素含量: E=lgI0/I=KCL 如果比色皿厚度一定,则上式简化为: E=KC K:吸光系数 C:浓度 如果待测液中含有2种以上有色物质,其吸光度也符合朗莫-比尔定律 溶液中含有2种有色物质时,有下式成立: Eλ1=Ka1 Ca+Kb1 Cb (1) Eλ2=Ka2 Ca+Kb2 Cb (2) 在叶绿素的待测液中含叶绿素a和b ,则有: E663=82.04Ca+9.27Cb (1)E645=16.75Ca+45.6Cb (2) E663=82.04Ca+9.27Cb (1)E645=16.75Ca+45.6Cb (2) 解联立方程式(1)和(2)得到: Ca=0.0127 E663-0.00259 E645 Cb=0.0229 E645-0.00467 E663 Ca+b=0.00805E663+0.0203E6452、测定步骤 ①待测液制备:0.5-2g样品于乳钵(研钵)内,加4倍体积的丙酮和约10mL 80%的丙酮,乳棒研磨。
用吸管仔细吸取抽出液转移到50mL容量瓶内,重向乳钵内加入10mL 80%的丙酮,继续研磨,合并抽出液,如此反复,直至研磨看不出有色素浸出为止,最后用80%丙酮定容到50mL,充分混匀,放冷暗处,使瓶内溶液澄清。
丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较

Abstract Chlorophyll and carotenoids m easurement by dim ethyl sulfoxide (DM SO ) and acetone extractions are two typ ical and popular methods used in p lant ecophysiological research. However, few studies on the compara2 bility between these two methods have been carried out. To answer this question, the contents of p igments in leaves and young branches of 19 woody species were measured in this study and we found the follow ing conclu2 sions. Firstly, chlorophyll a (Chla) , Chlb and total chlorophyll contents measured by the DM SO method were much higher than those measured by the acetone m ethod, however, the result of Chla / b ratio was slightly affect2 ed. Contrarily, carotenoids contents m easured by the acetone method were m uch higher than those m easured by DM SO m ethod. D irect comparison of these data w ill make serious bias; Secondly, both chlorophyll data and ca2 rotenoids data measured by these two methods were significantly linearly correlated. Thus, it is possible to use these linear relations to make data correction in comparative studies; Thirdly, unit differences also affect the data correlations of these two methods. W hen using the unit of fresh mass, the correlation was much higher than that unit of surface area; Fourthly, the influences of these two methods on the data p recision differed between leaves and branches. In the case of branches ( low chlorophylls) , two m ethods give slightly difference. However, the
实验4 叶绿体色素的吸收光谱曲线及含量的测定

实验二叶绿体色素吸收光谱曲线及含量的测定一、实验目的掌握分光光度计的使用方法,学会绘制叶绿体色素的吸收光谱曲线。
了解叶绿体色素含量测定的原理,掌握叶绿体色素含量测定的方法。
二、实验原理叶绿素与类胡萝卜素都具有光学活性,表现出一定的吸收光谱,可用分光光度计精确测定。
叶绿素吸收光谱最强的吸收区有两个:一个在波长640~660nm的红光部分,另一个在波长430~450nm的蓝紫光部分。
在光谱的橙光、黄光和绿光部分只有不明显的吸收带,其中尤以对绿光的吸收最少。
胡萝卜素和叶黄素的最大吸收带在蓝紫光部分,不吸收红光等长波的光。
根据朗伯一比尔定律,某有色溶液的吸光度D与其中溶液浓度C和液层厚度L成正比,即:D=KCLD:吸光度,即吸收光的量,C:溶液浓度,K:为比吸收系数(吸光系数),L:液层厚度,通常为1cm。
95 %乙醇提取液中叶绿素a 和b 及类胡萝卜素分别在在665nm 、649nm 和470nm 波长下具有最大吸收峰,据此所测得的吸光度值代人不同的经验公式(见结果计算),计算出叶绿体色素乙醇提取液中叶绿素 a 和 b 的浓度及其叶绿素总浓度和类胡萝卜素的总浓度,并依据所使用的单位植物组织(鲜重、干重或面积),求算出色素的含量。
三、实验材料及器材仪器及试剂:研钵、量筒、滴定管、烧杯、比色杯、滤纸、脱脂棉、分光光度计、95%乙醇材料:菠菜叶片四、实验步骤1、提取称取1g菠菜叶片,加入少许95%乙醇,研磨,用量筒定容至25ml。
2、吸收光谱去1ml提取液,加3ml95%乙醇,置于比色杯中,用95%乙醇作为对照,在400~700nm 之间每隔20nm测一次光,记录波长和吸光度D于下表中,并在标准绘图纸上绘出叶绿体色素的吸收光谱曲线。
λ(nm)400 420 440 460 480 500 …... 600 620 640 660 680 700 A3、将色素提取液充分混匀后,取光径1cm 的比色杯,注入提取液,以95%乙醇作为空白对照,在波长665nm 、649nm 和470nm 下测定吸光度(、和)。
丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较

logical findings m ay p rovide a basis for p igments comparison in physiological field. Key words leaves; branches; chlorophylls; carotenoids; methodological comparison
室温室种植生长良好的薇甘菊幼嫩分枝 ,从枝的
顶端开始 ,第一片成熟叶到第二片成熟叶之间的
茎 、第二片成熟叶以及薇甘菊成熟花 、根进行含
量测定 。
1. 2 实验方法
1. 2. 1 丙酮法
此法是基于 D ere et al[ 3 ]的方法用 100%丙酮
(分析纯 )室温避光浸提 36 小时 ,上清液待测 ,使
叶绿素含量的测定

植物叶绿体色素的提取、分离、及含量测定(一)叶绿体色素的提取一、实验目的1.掌握有机溶剂提取叶绿体色素等天然化合物的原理和实验方法。
2.了解皂化-萃取提取β−胡萝卜素原理。
3. 了解1,4-二氧六环沉淀法提取叶绿素原理。
二、实验原理植物光合作用是自然界最重要的现象,它是人类所利用能量的主要来源。
在把光能转化为化学能的光合作用过程中,叶绿体色素起着重要的作用。
高等植物体内的叶绿体色素有叶绿素和类胡萝卜素两类,主要包括叶绿素a、叶绿素b、β−胡萝卜素和叶黄素四种。
它们所呈现的颜色和在叶绿体中含量大约比例见表12.1。
叶绿素(chlorophylls)是叶绿酸的酯,它在植物进行光合作用中吸收可见光,并将光能转变为化学能。
叶绿素是植物进行光合作用所必需的催化剂。
在绿色植物中叶绿素主要以叶绿素a(C55H72O5N4Mg)和叶绿素b(C55H70O6N4Mg)两种结构相似的形式存在,其差别仅是叶绿素a中一个甲基被叶绿素b中的甲酰基所取代。
叶绿素的基本结构见图47.1。
在叶绿素分子结构中含有四个吡咯环,它们由四个甲烯基联结成卟啉环,在卟啉环中央有一个镁原子,它以两个共价键和两个配位键与四个吡咯环的氮原子结合成内配盐,形成镁卟啉。
在叶绿素分子中还有两个羧基,其中一个与甲醇酯化成COOCH3,另一个与叶绿醇酯化成COOC20H39长链。
类胡萝卜素(carotenoids)是一类不饱和的四萜类碳氢化合物(例如胡萝卜素,carotenes),或它们的氧化衍生物(例如叶黄素类,xanthophylls)。
所有的类胡萝卜素均源于非环状的C40H56结构。
类胡萝卜素在强光下可防止叶绿素的光氧化;在弱光下,可作为辅助色素吸收光能并传递给叶绿素分子。
胡萝卜素有三种异构体,即α−、β−和γ−胡萝卜素,其中β−胡萝卜素含量最多,也最为重要。
β−胡萝卜素还具有维生素A的生理活性,其结构是由两分子维生素A 在端链失去两分子水结合而成。
叶绿素等的测定方法

叶绿素等的测定方法叶绿素是存在于植物和藻类细胞中的一种绿色色素,它在光合作用中起着关键作用。
因此,测定叶绿素及其相关的测定方法对于研究植物生理学、光合作用机理以及环境生态学等方面具有重要意义。
下面将介绍几种常用的叶绿素测定方法。
1.全光谱扫描法全光谱扫描法可以用于测定叶绿素a、叶绿素b以及类胡萝卜素的含量。
该方法基于不同波长下叶绿素和类胡萝卜素的吸光度差异,通过测量样品在300-800nm范围内的吸光度来确定其含量。
全光谱扫描法准确度较高,但需要较贵的设备。
2.分光光度法分光光度法是一种常用的测定叶绿素含量的方法。
该方法基于叶绿素和类胡萝卜素在不同波长下的吸光度差异,通过选择波长进行测定。
常用的波长包括470nm、645nm和663nm等。
该方法简单、快速,并且可以用于高通量样品测定。
3.乙醇提取法乙醇提取法是一种常用的叶绿素提取和测定方法。
该方法将叶样品放入乙醇等有机溶剂中,通过溶剂提取叶绿素并使其溶于溶剂中,然后使用分光光度法或高效液相色谱法等测定溶液中叶绿素的含量。
乙醇提取法可以快速提取样品中的叶绿素,适用于大量样品的测定。
4.高效液相色谱法高效液相色谱法是一种高精度的叶绿素测定方法。
该方法基于叶绿素在特定条件下在高效液相色谱柱中的分离和检测,通过测定样品中叶绿素的峰面积或峰高来确定其含量。
高效液相色谱法准确度高,但需要较为复杂的仪器和操作技术。
除了以上介绍的常用方法外,还有一些新兴的测定方法不断涌现,例如荧光光谱法、激光诱导荧光法、红外反射法等。
这些新方法在提高测定精度、扩展测定范围和降低测定成本方面具有优势,正在逐渐得到广泛应用。
综上所述,叶绿素测定方法多种多样,每一种方法都有其特点和适用范围。
在选择合适的测定方法时,需要考虑实验目的、样品种类、所需精度、设备条件和实验操作难易程度等因素,以确定最适合的测定方法。
(完整word版)类胡萝卜素的分离与测定

类胡萝卜植物色素的分离与测定一,实验目的1、学会类胡萝卜素的分离测定的方法。
二,实验基本原理β-胡萝卜素分子中的碳骨架是由8个异戊二烯单位连接而成的,它们是四萜类化合物。
它们的分子中都有一个较长的π-π共轭体系,能吸收不同波长的可见光,因而,它们都呈现一定的绿色,β-胡萝卜素是黄色物质,所以,又把它们叫做多烯色素。
(β-胡萝卜素)胡萝卜素是最早发现的一种多烯色素。
后来,又发现了许多在结构上与胡萝卜素类似的色素,于是就把这类物质叫做胡萝卜素类化合物,或者叫做类胡萝卜素。
这类化合物大都难溶于水,易溶于弱极性或非极性的有机溶剂,因此又把这类化合物叫做脂溶性色素。
胡萝卜素广泛存在于植物的叶、花、果实中,尤以胡萝卜中含量最高。
胡萝卜素有α、β、γ三种异构体,在生物体中以β-异构体含量最多,生理活性最强。
在动物体中,胡萝卜素在酶的作用下可转化为维生素A,因此,胡萝卜素又被叫做维生素A原。
胡萝卜素在人和高等动物体内就有重要的生理功能,是人和高等动物生存不可缺少的营养物质。
三,实验仪器与试剂仪器:三角瓶(50ml)、分液漏斗(150ml)、蒸馏瓶(50ml)、普通蒸馏装置(或减压蒸馏装置)、色谱柱、硅胶薄层板、量筒、烧杯、试管、721分光光度计、层析缸。
试剂:番茄(或番茄酱)或胡萝卜、食盐、丙酮、乙酸乙酯、石油醚(60~90℃)、乙醇、污水硫酸镁、氧化铝(层析用,100~200目)、硅胶(层析用,200~300目)、无水硫酸钠、石油醚(60~90℃):乙醇(2:1,V/V)、石油醚:丙酮(3:2,V/V)。
四,实验内容与步骤1、类胡萝卜素的柱色谱分离:选一支1.5*20cm 的色谱柱,用适量层析用氧化铝(100~200目)作吸附剂干法装柱,高度约10cm ,要求紧密匀实。
分离方式为梯度洗脱,第一步用石油醚(60~90℃)洗脱。
先沿色谱柱管壁滴加5~8ml 石油醚至柱体(各方向要均匀),待溶剂表面降至氧化铝柱面顶端时,用滴管迅速地小心滴加5~10滴样品至柱子中,待样品液面即将在柱面上消失时,沿管壁小心滴加石油醚3~5滴,冲洗粘在管壁上的有色物质。
植物叶绿体色素含量的测定

6
将上式整理,可以得到下式:
Ca=13.95A665- 6.88A649 Cb=24.96A649 – 7.32 A665 CT= Ca + Cb =18.08A649-6.63 A665 CX.C=(1000A470-2.05Ca-114Cb)/245
植物叶绿体色素含量的测定
植物生理生化实验室
1
高
等 植
叶绿素
物
叶绿素b---C55H70O6N4Mg 叶绿素a---C55H72O5N4Mg
叶
绿 体 类胡萝卜 色 素
胡萝卜素---C40H56 叶黄素---C40H56O2Leabharlann 叶绿素吸收光谱:3
类胡萝卜素吸收光谱:
最大吸收区域在蓝 紫光部分(400-500nm), 基本上不吸收黄光,
1、叶绿素a、b在蓝光区也有吸收峰,能否 用这一吸收峰波长进行叶绿素a、b的定 量分析?为什么?
2、为什么提取叶绿素时干材料一定要用80 %的丙酮或乙醇,而新鲜的材料可以用无 水丙酮或乙醇提取?
16
7
叶绿体色素的提取
叶绿体色素,不溶于水,易溶
于乙醇、丙酮等有机溶剂。同时,叶
绿体色素在植物细胞内是以色素蛋白 复合体的结构存在的。故通常用80% 的丙酮或95%乙醇提取叶绿素。
8
为什么要用含有水的有机溶剂提取叶片 中的叶绿素?
这是因为叶绿素 分子结构的“头部” 是亲水的,与蛋白质 结合很牢,需要经过 水 溶解作用才可被 提取出来。
从而呈现黄色。
4
蓝光区
红光区
5
叶绿体色素提取液中各色素的吸收光谱虽有 不同,但又存在着明显的重叠,在不分离的情况 下同时测定叶绿素a、叶绿素b和类胡萝卜素的浓 度 , 可 分 别 测 定 在 663nm 、 645nm ( 分 别 是 叶绿素a和叶绿素b在红光区的吸收峰)和 475nm的光吸收,然后根据Lambert-Beer定 律,计算出提取液中叶绿素a、叶绿素b和类胡萝 卜素的浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
叶绿素、类胡萝卜素含量的测定 ??? 一、原理
??? 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用式计算出提取液中各色素的含量。
根据朗伯—比尔定律,某有色溶液的吸光度A 与其中溶质浓度C 和液层厚L 成正比,即A =αCL 式中:α比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物的吸光系数。
各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度总和。
这就是吸光度的加和性。
今欲测定叶绿体色素混合提取液中叶绿素a 、b 和类胡萝卜素的含量,只需定该提取液在三个特定波长下的吸光度A ,并根据叶绿素a 、b 及类胡萝卜素在该波长下的吸光系数即可求其浓度。
在测定叶绿素a 、b 时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大
收峰。
???? 二、材料、仪器设备及试剂
??? (一)材料:新鲜(或烘干)的植物叶片。
??? (二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g );3)研钵;4)棕色容量瓶;? 5)漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。
??? (三)试剂:1)95%乙醇(或80%丙酮)(v 丙酮:v 乙醇=2:1的95%水溶液);2)石英砂;3)碳酸粉。
暗中2h ,0.5g ,25ml
??? 三、实验步骤
??1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。
??2)将取好的样品放入25ml 容量瓶中,加混合浸提液(无水乙醇:丙酮=5:5)20ml ,放在黑暗条件下,浸泡叶片发白,用浸提试剂定容至25ml ,摇匀备用。
3)把叶绿体色素提取液倒入1cm 光径的比色皿内,以浸提试剂为空白测定吸光度。
选择波长663 646 和470nm 。
??? 四、实验结果计算
叶绿素a 的浓度 = 12.21 ? OD 633 – 2.81 ? OD 646
叶绿素b 的浓度 = 20.13 ? OD 646– 5.03? OD 663
类胡萝卜素浓度=(1000A 470-3.27C a -104C b )÷229 单位 mg/L
C(mg/L)*提取液总量(ml)
叶绿体色素含量(mg/g)= ____________________________
烟叶重量(g)*1000
注意事项:操作避光研磨时间短些。
