优选同济大学普通化学第三章电化学PPT演示ppt
合集下载
电化学原理PPT课件

(saturated calomel electrode,SCE) 6.导线;7. Hg;8.纤维
以标准氢电极的电极电势为标准,
可以测得SCE的电势为0.2415V。
.
21
对电极(辅助电极)
对电极一般使用惰性贵金属材料如铂丝等, 以免在此表面发生化学反应,用于与工作 电极形成回路。
.
22
电化学工作站
.
17
电化学三电极系统
• 工作电极(Working electrode) • 参比电极(Reference electrode) • 对电极(Auxiliary electrode)
.
18
工作电极
滴汞电极(极谱法) 铂电极 金电极 碳电极 热解石墨(PG)
玻碳(GC) 碳糊 碳纤维
.
19
参比电极
.
9
电分析成为独立的方法学
• 三大定量关系的建立 1833年法拉第定律Q=nFM 1889年能斯特W.Nernst提出能斯特方程
1934年尤考维奇D.Ilkovic提出扩散电流方程 Id = kC
.
10
近代电分析方法
(1) 电极的发展:化学修饰电极、超微电极 (2) 多学科参与:生物电化学传感器 (3)与其他方法联用:光谱-电化学、HPLC-EC、
1753年,俄国著名电学家利赫曼为了验证
富兰克林的实验,不幸被雷电击死,这是
做电实验的第一个牺. 牲者。
4
电化学的发展史
1791年, 意大利伽伐尼的青蛙实验 (电化学的起1799年, 伏特堆 (伏特电池/原电池的雏形)
.
6
电化学的发展史
1807年, 戴维电解木灰(potash)和苏打(soda), 分别得到钾(potassium)和钠(sodium)元素
电化学基础-PPT课件

35
3. 氢镍电池是近年开发出来的可充电电池,
它可以取代会产生镉污染的镉镍电池。氢镍
电池的总反应式是:
1/2H2+NiO(OH)
Ni(OH)2
CD
据此反应判断,下列叙述中正确的是( )
A. 电池放电时,负极周围溶液的pH不
断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
Ag
电解质溶液Y是__A_g_N__O_3_溶__液_;
(2)银电极为电池的___正_____极,CuSO4溶液 Y
发生的电极反应为__A_g_+__+__e_-__=_A__g___
X电极上发生的电极反应为
__C_u___-2__e_-___=__C__u_2_+__________;
(3)外电路中的电子是从__负__(_C_u_电) 极流向
14
6. 双液原电池的工作原理(有关概念)
(1)盐桥中装有饱和的KCl溶液和琼脂制成的 胶冻,胶冻的作用是防止管中溶液流出
(2)盐桥的作用是什么?
可提供定向移动的阴阳离子,
使由它连接的两溶液保持电
中性,盐桥保障了电子通过
外电路从锌到铜的不断转移
,使锌的溶解和铜的析出过 程得以继续进行。
盐桥的作用: (1)形成闭合回路。
?思考
1、银器皿日久表面逐渐变黑色,这是由于生成硫
化银,有人设计用原电池原理加以除去,其处理方 法为:将一定浓度的食盐溶液放入一铝制容器中, 再将变黑的银器浸入溶液中,放置一段时间后,黑 色会褪去而银不会损失。 试回答:在此原电池反应中,负极发生的反应
为 Al -3e- = Al3+ ; 正极发生的反应为 Ag2S+2e- = 2Ag;+S2-
3. 氢镍电池是近年开发出来的可充电电池,
它可以取代会产生镉污染的镉镍电池。氢镍
电池的总反应式是:
1/2H2+NiO(OH)
Ni(OH)2
CD
据此反应判断,下列叙述中正确的是( )
A. 电池放电时,负极周围溶液的pH不
断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被还原
D. 电池放电时,H2是负极
Ag
电解质溶液Y是__A_g_N__O_3_溶__液_;
(2)银电极为电池的___正_____极,CuSO4溶液 Y
发生的电极反应为__A_g_+__+__e_-__=_A__g___
X电极上发生的电极反应为
__C_u___-2__e_-___=__C__u_2_+__________;
(3)外电路中的电子是从__负__(_C_u_电) 极流向
14
6. 双液原电池的工作原理(有关概念)
(1)盐桥中装有饱和的KCl溶液和琼脂制成的 胶冻,胶冻的作用是防止管中溶液流出
(2)盐桥的作用是什么?
可提供定向移动的阴阳离子,
使由它连接的两溶液保持电
中性,盐桥保障了电子通过
外电路从锌到铜的不断转移
,使锌的溶解和铜的析出过 程得以继续进行。
盐桥的作用: (1)形成闭合回路。
?思考
1、银器皿日久表面逐渐变黑色,这是由于生成硫
化银,有人设计用原电池原理加以除去,其处理方 法为:将一定浓度的食盐溶液放入一铝制容器中, 再将变黑的银器浸入溶液中,放置一段时间后,黑 色会褪去而银不会损失。 试回答:在此原电池反应中,负极发生的反应
为 Al -3e- = Al3+ ; 正极发生的反应为 Ag2S+2e- = 2Ag;+S2-
电化学反应过程ppt课件

生。
发展历程:有机电化学合成始于1949年的“柯尔贝反应”。
由于种种原因,直到20世纪60年代中期,有机电化合成才有了新的进展; 20世纪80年代以来,由于新技术、新工艺的不断研究和开发,使得电化学 过程的工业应用不断扩展,反应器设计更合理,能耗进一步降低。
图9-1 几种典型的电有机合成反应示意图
流程简单、设备投资少、能耗低,其相对成本可减少40%左右,故发展前景 是非常美好的。
天然碱的加工精制方法最常用的是一水碱法,倍半碳酸钠法次之,此外还有一 些其他加工方法。
烧碱的工业生产简介
工业生产方法主要是通过电解食盐水溶液来制取,同时副产氯气和氢气。
电解方法有三种:
第一种是隔膜法(Diaphragm Proess,简称D法);
2.生产方法
①目前纯碱的工业生产方法主要有氨碱法和联碱法两种; ②烧碱的工业生产方法主要是食盐水溶液电解法,其中包括水银电解法、隔
膜电解法和离子膜电解法三种。
纯碱工业生产过程简介
1.发展过程: 纯碱的工业生产始于1787年,法国人路布兰首先由硫酸钠和石灰石制得碳酸
钠; 1861年比利时人索尔维提出了以食盐、石灰石等为原料制纯碱的氨碱法 优点:原料来源方便、生产连续、产量大、成本低,曾被广泛采用; 缺点:食盐利用率低(<30%)、副产氯化钙废渣,造成一定的环境污染。 1942年我国的化学家侯德榜提出了联合制碱法,在生产纯碱的同时,副产氯
分为直接电有机合成和间接电有机合成两大类。
直接电有机合成:指有机合成反应直接在电极表面上完成,这一类反应居多 数,包括氧化、还原反应、裂解、偶联、缩合、卤代等;
间接电解合成:指有机物的氧化还原反应仍采用氧化剂或还原剂,使用化学 方法进行,反应后的氧化剂或还原剂通过电解氧化或还原方法使之再生, 反复使用。
发展历程:有机电化学合成始于1949年的“柯尔贝反应”。
由于种种原因,直到20世纪60年代中期,有机电化合成才有了新的进展; 20世纪80年代以来,由于新技术、新工艺的不断研究和开发,使得电化学 过程的工业应用不断扩展,反应器设计更合理,能耗进一步降低。
图9-1 几种典型的电有机合成反应示意图
流程简单、设备投资少、能耗低,其相对成本可减少40%左右,故发展前景 是非常美好的。
天然碱的加工精制方法最常用的是一水碱法,倍半碳酸钠法次之,此外还有一 些其他加工方法。
烧碱的工业生产简介
工业生产方法主要是通过电解食盐水溶液来制取,同时副产氯气和氢气。
电解方法有三种:
第一种是隔膜法(Diaphragm Proess,简称D法);
2.生产方法
①目前纯碱的工业生产方法主要有氨碱法和联碱法两种; ②烧碱的工业生产方法主要是食盐水溶液电解法,其中包括水银电解法、隔
膜电解法和离子膜电解法三种。
纯碱工业生产过程简介
1.发展过程: 纯碱的工业生产始于1787年,法国人路布兰首先由硫酸钠和石灰石制得碳酸
钠; 1861年比利时人索尔维提出了以食盐、石灰石等为原料制纯碱的氨碱法 优点:原料来源方便、生产连续、产量大、成本低,曾被广泛采用; 缺点:食盐利用率低(<30%)、副产氯化钙废渣,造成一定的环境污染。 1942年我国的化学家侯德榜提出了联合制碱法,在生产纯碱的同时,副产氯
分为直接电有机合成和间接电有机合成两大类。
直接电有机合成:指有机合成反应直接在电极表面上完成,这一类反应居多 数,包括氧化、还原反应、裂解、偶联、缩合、卤代等;
间接电解合成:指有机物的氧化还原反应仍采用氧化剂或还原剂,使用化学 方法进行,反应后的氧化剂或还原剂通过电解氧化或还原方法使之再生, 反复使用。
《电化学极化》课件

05
电化学极化的未来发展
新材料的应用
总结词
随着科技的发展,新型电化学材料不断涌现 ,为电化学极化技术的发展提供了更多可能 性。
详细描述
目前,科研人员正在研究新型的电极材料、 电解质材料和隔膜材料等,以提高电化学极 化的效率和稳定性。这些新材料具有更高的 电化学活性、更好的导电性和更强的耐腐蚀 性等特点,能够显著提升电化学极化的性能
。
新型电极的设计
要点一
总结词
新型电极的设计是电化学极化技术发展的关键,能够提高 电极的效率和寿命。
要点二
详细描述
科研人员正在探索新型电极的结构和组成,以优化电极表 面的反应动力学和电荷传递过程。通过改变电极的形貌、 组成和孔隙结构等参数,可以显著提高电极的电化学性能 和稳定性,进一步推动电化学极化技术的发展。
注意事项
由于电极电位进行周期性的扫描,因此适用于可 逆和半可逆体系,避免极化对实验结果的影响。 同时需要注意扫描速度和扫描路径的选择,以获 得准确的实验结果。
04
电化学极化的实际应用
电池技术
电池性能优化
通过研究电化学极化现象,可以深入 了解电池内部的反应机制,从而优化 电池的充放电性能、能量密度和循环 寿命。
电化学极化的影响因素
金属的性质
不同金属在电解质溶液中的电化学极化程度 不同,这主要取决于金属的电子结构和表面 特性。
电解质溶液的组成和性质
电解质溶液的组成和性质对电化学极化有重要影响 ,例如离子种类、浓度、溶液的酸碱度等。
电极电位
电极电位是影响电化学极化的一个重要因素 。在一定的电极电位下,金属的电化学极化 程度会有所不同。
电化学极化的动力学模型
01
建立电化学极化动力学模型需要 考虑金属表面电荷分布的变化速 率以及界面反应速率等因素。
电化学基本概念ppt课件
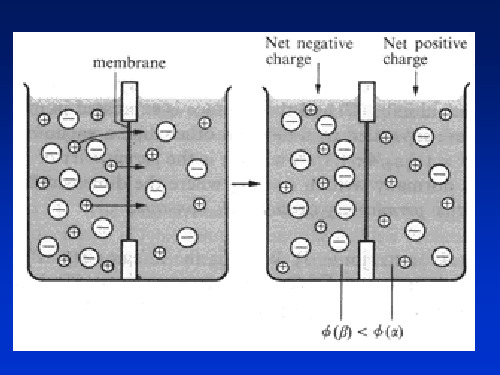
i i
两相间建立平衡电势
电极(Electrode)
电极材料/电解质
Zn|Zn2+, SO42Pt|H2,H+ Fe|Fe3O4|Fe2O3|水溶液
电极(Electrode)
电极材料/电解质 •传递电荷
Zn|Zn2+,SO42-,
•氧化或还原反应
Pt|H2,H+
的地点
•“半电池”
Fe|Fe3O4|Fe2O3|水溶液
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联)
e-
i
H2
Cl2
Na+
Cl-
Ag
Ag+
ei
Ag+
Ag+
H+
OH-
阴极
阳极
H+
NO3-
银阴极 银阳极
法拉弟定律的几个要点
1. 电和化学反应相互作用的定量关系 2. 不受电极、外界条件的影响 3. 适用于多个电化学装置的多个反应(串联) 4. 适用于单个电化学装置的多个反应(并联)
I
负极 e
e 正极
-2e Pb
Pb2+ PbSO4
H2O H+
SO4= SO4= H+
硫酸
+2e PbO2
Pb2+ PbSO4
铅酸蓄电池 (1860年--)
充电
(吸收电能)
负极 e
e 正极
Pb2+ PbSO4
+2e
Pb
Pb2+
H2O
PbSO4
普通化学简明教程精品课件 第3章 电化学

如果电极有个类似于生成焓的电势就好了
3.3 电极电势
一、标准电极电势
1. 电极电势:原电池能够产生电流,表明原电池两 极间存在电势差,即每个电极都有一个电势,称为 电极电势。用符号: E(氧化态/还原态)表示。 如: E(Zn2+/Zn); E(Cu2+/Cu); E(O2/OHˉ); E(MnO4ˉ/Mn2+); E(Cl2/Clˉ)等。 两电极的E值大小(高低)不同,其差值即为电池的电 动势E。
c 0.05917 E (Cl2 /Cl ) E (Cl 2 /Cl ) lg 2 pCl2 / p
-
Cl2 (g) 2e
2Cl (aq)
2 Cl-
Mn (aq) 4H2O cMn 2+ 0.05917 2+ E E (MnO4 /Mn ) lg 8 5 cMnO- cH+ 4 1.51 0.0946pH
第
3章
电 化 学
3.1 氧化还原反应相关的基本概念
1. 氧化与还原
得失氧化合价升降得失电子 氧化型 ne还原型 氧化还原反应电子传递反应; Ox n e Red 氧化半反应与还原半反应
2. 氧化还原电对:氧化态/还原态、Ox/Red
如:Cu2+/Cu、MnO4-/Mn2+、MnO4-/MnO2 MnO2/Mn2+、Fe3+/Fe2+、Fe2+/Fe
Cl2(p) + 2e ⇌ 2Cl-(c-) AgCl(s) + e ⇌ Ag(s) + Cl-(c-)
Sn4+(c1) + 2e ⇌ Sn2 +(c1)
Pt(s) | Sn4+(c1) ,Sn2+(c2)
优选电化学PPT演示ppt

4、在生物学和医学中的应用 比如,心电图、脑电图等都有电化学有关。
第四页,共142页。
§2.2 电化学的基本概念
一、基本概念
1、导体:又称导电体(electrical conductor),能够导电的物质
分类 问题
1)靠什么因素导电
电子导体
靠自由电子定向移动而导电
2)常见的导体举例 金属,石墨,某些金属的化合物
第三十七页,共142页。
表8-6列出了298K时一些离子的无限稀释摩尔电导率的值。
【问题1】:为什么H+ 和OH-的无限稀释摩尔电
导率比其他离子大得多 ?
【问题2】:
m
,Ba
2
?
第三十八页,共142页。
3、弱电解质 m 的求法:
方法一:利用离子独立移动定律,从离子的 m(查表)求得。
离子导体
靠离子作定向运动(即离子 的定向迁移)而导电
电解质溶液、熔融电解质等
3)导电过程中导体是 否发生化学变化 导电过程中导体本身不发生变化
4)导电能力与温度的 温度升高,电阻升高,导电能
关系
力减弱
导电过程中有化学反应发生
温度升高,离子运动速率 加快,导电能力增强
第五页,共142页。
2、关于电极的一些基本规定
2)如果正离子的迁移速率为负 离子的三倍,则正离子导3mol 电量,负离子导1mol电量,在 AA 平面(或BB 平面)上分别有3 mol正离子和1 mol 的负离子逆向
通过。
通电后离子迁移的结果:中部溶液的浓度仍保持不变,阴、阳两极部 溶液浓度不同,且两极部的浓度比原溶液相比都有所下降,但降低的 程度不同。(阳极部减少3mol ,阴极部减少1mol )
第三十页,共142页。
第四页,共142页。
§2.2 电化学的基本概念
一、基本概念
1、导体:又称导电体(electrical conductor),能够导电的物质
分类 问题
1)靠什么因素导电
电子导体
靠自由电子定向移动而导电
2)常见的导体举例 金属,石墨,某些金属的化合物
第三十七页,共142页。
表8-6列出了298K时一些离子的无限稀释摩尔电导率的值。
【问题1】:为什么H+ 和OH-的无限稀释摩尔电
导率比其他离子大得多 ?
【问题2】:
m
,Ba
2
?
第三十八页,共142页。
3、弱电解质 m 的求法:
方法一:利用离子独立移动定律,从离子的 m(查表)求得。
离子导体
靠离子作定向运动(即离子 的定向迁移)而导电
电解质溶液、熔融电解质等
3)导电过程中导体是 否发生化学变化 导电过程中导体本身不发生变化
4)导电能力与温度的 温度升高,电阻升高,导电能
关系
力减弱
导电过程中有化学反应发生
温度升高,离子运动速率 加快,导电能力增强
第五页,共142页。
2、关于电极的一些基本规定
2)如果正离子的迁移速率为负 离子的三倍,则正离子导3mol 电量,负离子导1mol电量,在 AA 平面(或BB 平面)上分别有3 mol正离子和1 mol 的负离子逆向
通过。
通电后离子迁移的结果:中部溶液的浓度仍保持不变,阴、阳两极部 溶液浓度不同,且两极部的浓度比原溶液相比都有所下降,但降低的 程度不同。(阳极部减少3mol ,阴极部减少1mol )
第三十页,共142页。
课件电化学.pptx

• 而 E MF = E ( 右极 , 还原 ) - E( 左极 , 还原) • EΘMF= E Θ ( 右极 , 还原 ) - EΘ ( 左极 , 还原 ) • 由标准平衡常数的定义式
反应( 电极反应及电池反应 ) 应是 EMF < Eex 时反应的逆反应。 • ( i i ) 从热力学上看 , 除要求 EMF< Eex 时的变化与 EMF> Eex 时
的变化相反之外 , 还要求变化的推动力 ( 即 EMF 与 Eex 之差 ) 只需发生无限小的改变便可使变化的方向倒转过来。
➢常考知识点精讲
➢常考知识点精讲
• 1. 电解质及其分类★ • 电解质是指溶于溶剂或熔化时能形成带相反电荷的离子 ,
从而具有导电能力的物质。电解质在溶剂(如 H2O) 中解离 成正、 负离子的现象叫电离。根据电解质电离度的大小 , 电解质分为强电解质和弱电解质 , 强电解质在溶液中几乎 全部解离成正、负离子。弱电解质的分子在溶液中部分地 解 离为正、负离子 , 在一定条件下 , 正、负离子与未解离 的电解质分子间存在电离平衡。
➢常考知识点精讲
• 6. 离子独立运动定律★★★ • 无论是强电解质还是弱电解质溶液 , 在无限稀薄时 , 离子间
的相互作用可以忽略不计 , 离子彼此独立运动 , 互不影响。 每种 离子的摩尔电导率不受其他离子的影响 , 它们对电解 质的摩尔电导率都有独立的贡献。因而无限稀薄时电解质 溶液摩尔电导率为正、 负离子无限稀薄摩尔电导率之和。 即
专业课命题规律分析及考点精讲
电化学系统的热力学及动力学
➢常考知识点精讲
• Ⅰ、本章框架及考情分析 • 出题形式为判断、选择、填空、计算,这一章难度不大,
掌握基本做题方法加上注意细节即可很好的应付考试。
电化学原理第三章.ppt

六、电池可逆性所具备的条件: (1)电池中的化学变化是可逆的,即物质的 变化是可逆的。 (2)电池中的能量的转化是可逆的。
七、能斯特方程:
v a RT E E0 ln 生成物 v nF Πa反应物 v Π a RT E E0 ln 反应物 v nF a生成物
(2.24)
八、原电池和电解池、腐蚀电池的区别与联系
2 H
对于标准氢电极已规定 :
0 H2 / H
0 且 H / H
2
0 H2 / H
RT a ln 0 2F pH2
2 H
所以: E (
0 2 Zn / Zn
RT aZn2 ln ) Zn/Zn2 2F aZn
一般情况下,可用下式表示一个电极反应 O + ne → R 可将上式写成通式,即
从上面的讨论可知,尽管第二类可逆电极本质上是
对阳离子可逆的,但因为阳离子的活度受到阴离子活 度的制约,所以该类电极的平衡电位仍然依赖于阴离 子的活度。 第二类可逆电极由于可逆性好,平衡电位稳定, 电极制备比较简单,因而常被当作参比电极使用。
3.第三类可逆电极
第三类可逆电极是由铂或其他惰性金属插入同一元素的两种
一、电极的可逆性
按照电池的结构,每个电池都可以分成两半,即 由两个半电池所组成。每个半电池实际就是一个 电极体系。 电池总反应也是由两个电极的电极反应所组成的。 因此,要使整个电池成为可逆电池,两个电极或 半电池必须是可逆的。
什么样的电极才是可逆电极呢?
可逆电极必须具备下面两个条件: 1、电极反应是可逆的。 如Zn|ZnCl电极,其电极反应为: Zn≒Zn2++2e 只有正向反应和逆向反应的速度相等时,电极反 应中物质的交换和电荷的交换才是平衡的。 即在任一瞬间,氧化溶解的锌原子数等于还原的 锌离子数;正向反应得电子数等于逆向反应失电 子数。 这样的电极反应称为可逆的电极反应。
电化学基本知识ppt课件

电池过程
阴极
阳极
ZnSO4
CuSO4
Zn
Cu
盐桥
1.1 V
典型电化学过程
e
电化学过程的特点
Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s) 半反应: Zn(s) Zn2+ + 2e- 阳极反应 Cu2+ + 2e- Cu(s) 阴极反应 电子不能在离子导体中运动 离子不能在电子导体中运动 即:电子与离子间必定在界面处发生了转化,这个转化就发生在离子导体和电子导体的界面处。
高频区为电极反应动力学(电荷传递过程)控制,低频区由电极反应的反应物或产物的扩散控制。
从图可得体系R、Rct、Cd以及参数,与扩散系数有关,利用它可以估算扩散系数D。由Rct可计算i0和k0。
扩散阻抗的直线可能偏离45,原因:
电极表面很粗糙,以致扩散过程部分相当于球面扩散; 除了电极电势外,还有另外一个状态变量,这个变量在测量的过程中引起感抗。
盐桥
1. 可以同时测量极化电流和极化电位; 2. 三电极两回路具有足够的测量精度。
三电极的优点
1.2.5.1 辅助电极的作用 实现WE导电并使WE电力线分布均匀。 1.2.5.2 辅助电极的要求 ①辅助电极面积大; 为使参比电极等势面,应使辅助电极面积增大,以保证满足研究电极表面电位分布均匀,如是平板电极: ; ②辅助电极形状应与研究电极相同,以实现均匀电场作用。
参比电极
常见的参比电极 ①甘汞电极; Hg|Hg2Cl2|Cl- 由于Hg+→Hg2+ (亚汞不稳定,高温时易变成Hg2+,受温度影响大。<70℃,另外,[Cl-]要饱和,防止 发生变化)。
电化学应用ppt课件

电镀技术原理及应用领域
电镀技术原理
电镀是利用电解原理在某些金属表面 上镀上一薄层其它金属或合金的过程, 利用电解作用使金属或其它材料制件 的表面附着一层金属膜的工艺。
电镀技术应用领域
电镀技术广泛应用于机械制造、轻工、 电子等行业,如提高零件的耐磨性、 导电性、抗腐蚀性及增进美观等作用。
电化学沉积技术制备薄膜材料
应用
金属元素测定,有机物分析等。
库仑分析法
原理
通过测量电解过程中所消耗的电量进行定量 分析。
特点
准确度高,重现性好,但仪器价格较高。
分类
恒电流库仑法和恒电位库仑法。
应用
痕量物质测定,环境监测等。
伏安法与极谱法
原理
通过测量电解过程中电流-电压曲线 进行定量分析。
分类
线性扫描伏安法、循环伏安法、方波 伏安法等;经典极谱法和现代极谱法 (如示波极谱法)。
电化学合成纳米材料是利用电化学方法在 电极表面或溶液中合成纳米材料的过程, 通过控制电位、电流、温度等参数,可以 制备出不同形貌和尺寸的纳米材料。
VS
纳米材料制备方法
电化学合成纳米材料的方法包括模板法、 脉冲电沉积法、循环伏安法等,这些方法 具有操作简单、反应条件温和、易于控制 等优点。
其他新型电化学合成技术介绍
通过电场作用,驱动土壤中的污染物向电极移动并富集,实现土 壤修复的效果。
电热修复技术
利用电加热原理,提高土壤温度并促进污染物挥发或降解,达到 土壤修复的目的。
电化学淋洗技术
通过电化学反应产生的淋洗液对土壤进行淋洗,去除土壤中的污 染物并实现土壤修复。
感谢您的观看
THANKS
电解质
含有自由离子的导体,可以是固体、 液体或气体。
电化学(课件PPT)
通电
==
Cl2↑+Cu
一.电解原理
1.电解:
电流通过电解质溶液而在阴阳两极上发 生氧化还原反应的过程叫电解。
2、电解池
借助电流引起氧化还原反应的装置即把电 能转化为化学能的装置叫电解池或电解槽。
3、构成电解池的条件:
①电源 ②电极 ③闭合回路
4.电极
-
+
阳极: 与电源正极相连
阴极
阳极
阴极: 与电源负极相连
8.离子的放电顺序
(1)阳极:
若为活性电极,则是电极本身失电子变成离子进入溶液 若为惰性电极,则是溶液中的阴离子在阳极上放电
阴离子在阳极上的放电顺序(失e- )
S 2->I ->Br ->Cl ->OH -> 等含氧酸根离子(NO3-、SO42- ) >F-
(2)阴极:无论是活或惰性电极都是溶液的阳离子放电
11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
电化学
复习:
1、请每位同学自己设计一组原电池装置图,注
明电极名称、所用材料、电子流动方向,写出
电极反应式. 2、下列装置是原电池的是,实验会产生什么现象? 构成原电池的条件是什么?能量如何转化?
形成条件
①活性不同的两极
条 件
大学化学之电化学基础PPT讲稿

20
5.2.2 原电池的符号表示
1.书写要求 (1) 负极写在左边,正极写在右边; (2)正负极之间用盐桥“‖”相接; (3)电极固体标志用一竖线“│”表示; (4)同相之不同物质间用“,”间隔; (5)若为离子时应注明其活度(浓度亦可); (6)若电对不含金属导体,则需加一惰性导体; (7)纯气体、液体或固体与惰性电极名称之间以
17
5.2.1 原电池的概念
1.定义 原电池是利用氧化还原 反应产生电流的装置。
2.原电池的构成 ⑴电势不同的两个电极; ⑵盐桥; ⑶外电路(检流计)。
18
3.Daniell电池
e
—
+
图1 Daniell电池
电子由Zn极流向Cu极: Zn极电势低,为负极;Cu极电势高,为正极。
19
4.特征 正极:氧化剂(Cu2+)被还原,半电池反应为: Cu2+ + 2e → Cu 负极:还原剂(Zn)被氧化,半电池反应为: Zn → Zn 2+ + 2e 电池反应为: Cu2+ + Zn → Cu + Zn 2+
22
(2)电极组成:
正极:Pt│MnO4- (c1),Mn2+(c2),H+ (c3) 负极:Pt, O2 (p)│ H2O2 (c4), H+ (c3)
(3)电池符号:
(-)Pt, O2 (p)│ H2O2 (c4), H+ (c3)‖ MnO4- (c1),Mn2+(c2),H+ (c3) │ Pt(+)
①×5 + ② 得:
6Cl2(g)+ 12OH- = 10Cl- + 2ClO3-+ 6H2O 化简得:
3Cl2(g)+ 6OH- = 5Cl- + ClO3-+ 3H2O 3Cl2(g)+ 6NaOH = 5NaCl + NaClO3+ 3H2O
5.2.2 原电池的符号表示
1.书写要求 (1) 负极写在左边,正极写在右边; (2)正负极之间用盐桥“‖”相接; (3)电极固体标志用一竖线“│”表示; (4)同相之不同物质间用“,”间隔; (5)若为离子时应注明其活度(浓度亦可); (6)若电对不含金属导体,则需加一惰性导体; (7)纯气体、液体或固体与惰性电极名称之间以
17
5.2.1 原电池的概念
1.定义 原电池是利用氧化还原 反应产生电流的装置。
2.原电池的构成 ⑴电势不同的两个电极; ⑵盐桥; ⑶外电路(检流计)。
18
3.Daniell电池
e
—
+
图1 Daniell电池
电子由Zn极流向Cu极: Zn极电势低,为负极;Cu极电势高,为正极。
19
4.特征 正极:氧化剂(Cu2+)被还原,半电池反应为: Cu2+ + 2e → Cu 负极:还原剂(Zn)被氧化,半电池反应为: Zn → Zn 2+ + 2e 电池反应为: Cu2+ + Zn → Cu + Zn 2+
22
(2)电极组成:
正极:Pt│MnO4- (c1),Mn2+(c2),H+ (c3) 负极:Pt, O2 (p)│ H2O2 (c4), H+ (c3)
(3)电池符号:
(-)Pt, O2 (p)│ H2O2 (c4), H+ (c3)‖ MnO4- (c1),Mn2+(c2),H+ (c3) │ Pt(+)
①×5 + ② 得:
6Cl2(g)+ 12OH- = 10Cl- + 2ClO3-+ 6H2O 化简得:
3Cl2(g)+ 6OH- = 5Cl- + ClO3-+ 3H2O 3Cl2(g)+ 6NaOH = 5NaCl + NaClO3+ 3H2O
同济大学普通化学 第三章电化学

22
亚历山德罗· 朱塞佩· 安东尼奥· 安纳塔西欧· 伏 特 伯 爵 ( Count Alessandro Giuseppe Antonio Anastasio Volta,1745年2月18日-1827 年3月5日),意大利物理学家,因在1800年发明伏达电堆而著名。后 来他受封为伯爵。
为了纪念伏打的功绩,1881 年,在国际电力学代表大会上决定将电动势\
数比较大,配平这类方程式需按一定的步骤。
8
氧化数法
遵循原则:氧化剂中元素氧化数降低的总数等于还原剂中氧化数升高的总数。 步骤: 0-(-2) = 2 ×5
1) KMnO4 + H2S + H2SO4
+7
-2
MnSO4 + S + K2SO4 + H2O
+2
0
2-7 = -5
×2
2) 2KMnO4 + 5H2S + H2SO4
§3-4 溶液中的电化学平衡及其应用
电化学是研究化学能与电能转换及其转化规律的学科
化学能 电能
电能:原电池 化学能:电解池
主要应用有电池、电解、金属的电化学加工及金属防护等。
1
本节内容
原电池----化学电源:干电池、蓄电池、镍氢电池、锂电池等, 随着火箭、宇宙飞船、导弹、人造卫星及大规模集成电路等高
铜-锌原电池 Daniell Cell 英国科学家 ,1836年发明
20
化学史-原电池的发明
放电之争与伏打电池的发明
人物1:伽伐尼博士,著名的意大利生理学家,解剖学教授 人物2:伏打教授,意大利物理学家,伽伐尼的好友
伽伐尼即伽尔瓦尼。
21
生物电与化学电之争
亚历山德罗· 朱塞佩· 安东尼奥· 安纳塔西欧· 伏 特 伯 爵 ( Count Alessandro Giuseppe Antonio Anastasio Volta,1745年2月18日-1827 年3月5日),意大利物理学家,因在1800年发明伏达电堆而著名。后 来他受封为伯爵。
为了纪念伏打的功绩,1881 年,在国际电力学代表大会上决定将电动势\
数比较大,配平这类方程式需按一定的步骤。
8
氧化数法
遵循原则:氧化剂中元素氧化数降低的总数等于还原剂中氧化数升高的总数。 步骤: 0-(-2) = 2 ×5
1) KMnO4 + H2S + H2SO4
+7
-2
MnSO4 + S + K2SO4 + H2O
+2
0
2-7 = -5
×2
2) 2KMnO4 + 5H2S + H2SO4
§3-4 溶液中的电化学平衡及其应用
电化学是研究化学能与电能转换及其转化规律的学科
化学能 电能
电能:原电池 化学能:电解池
主要应用有电池、电解、金属的电化学加工及金属防护等。
1
本节内容
原电池----化学电源:干电池、蓄电池、镍氢电池、锂电池等, 随着火箭、宇宙飞船、导弹、人造卫星及大规模集成电路等高
铜-锌原电池 Daniell Cell 英国科学家 ,1836年发明
20
化学史-原电池的发明
放电之争与伏打电池的发明
人物1:伽伐尼博士,著名的意大利生理学家,解剖学教授 人物2:伏打教授,意大利物理学家,伽伐尼的好友
伽伐尼即伽尔瓦尼。
21
生物电与化学电之争
