卵巢癌输卵管癌腹膜癌手术分期标准FIGO
FIGO卵巢癌,输卵管癌

2012 FIGO 卵巢癌,输卵管癌1.1原发病灶:卵巢癌、输卵管癌和腹膜癌本章所用分期采用2006年FIGO分期。
目前,FIGO妇科肿瘤委员会正在修订卵巢癌、输卵管癌和原发性腹膜癌分期。
新分期需要相关领域的所有国际组织达成一致意见,2012年在罗马召开的FIGO大会中公布(实际上没有公布——译者注)。
如有可能,肿瘤的原发部位将被明确指出(如卵巢、输卵管或腹膜)。
某些情况下,可能无法确定肿瘤的原发位置,这种情况将列为“不明确的”[1,2]。
以前,我们常以为输卵管癌罕见[2]。
近年来病理学、分子学以及遗传学证据显示,许多被诊断为低分化浆液性卵巢癌和腹膜癌可能来源于输卵管伞端[3–8]。
因此,可能严重低估了输卵管癌的发病率。
当无法判断肿瘤原发部位时,以往通常认为肿瘤起源于卵巢,最新的研究结果支持将低分化浆液性卵巢癌、腹膜癌和输卵管癌看做一类疾病。
有建议采用更准确的术语“盆腔浆液性癌”(定义为肿瘤病理类型为浆液性且肿瘤源于卵巢、输卵管或腹膜)[9]。
目前尚无针对腹膜癌的分期,可参照FIGO分期标准;根据该标准不存在I 期腹膜癌。
1.1.1原发位置上皮性卵巢癌可来源于子宫内膜异位症或卵巢皮质包涵囊肿。
(卵巢癌二元论)它包括高分化子宫内膜样腺癌、透明细胞癌、交界性和高分化浆液性癌以及粘液性癌。
这类肿瘤可能由低级别前驱病变缓慢发展而来(内膜异位囊肿或囊腺瘤等),它们可归类为I类肿瘤[5]。
输卵管癌来源于输卵管远端,多数为低分化浆液性癌。
它们可由更隐蔽的前驱病变迅速发展而来,可归类为II类肿瘤[5,6],这类疾病还包括低分化子宫内膜样腺癌和癌肉瘤,所有低分化恶性肿瘤都与TP53基因突变密切相关[5]。
(I型起病缓慢,II型起病迅速,侵袭能力强,高级别的卵巢浆液性癌起源于输卵管。
)1.1.2淋巴引流卵巢和输卵管的淋巴引流是通过子宫--卵巢骨盆漏斗韧带和圆韧带淋巴干和髂外的一分支引流到如下区域淋巴结:髂外、髂总、髂内、骶骨外侧和主动脉旁淋巴结,偶尔会引流入腹股沟淋巴结[1,10–12]。
卵巢癌、输卵管癌、腹膜癌诊治指南要点解读主要内容

卵巢癌、输卵管癌、腹膜癌诊治指南要点解读主要内容美国女性终生患卵巢癌的风险大约是1/70。
卵巢癌约占所有女性生殖道肿瘤的23%,但其死亡率却占47%。
上皮性肿瘤总发病率在(9~17)/105。
未生育女性罹患上皮性卵巢癌的风险是已生育女性的2倍。
生育年龄早、早绝经和使用口服避孕药则可降低发生卵巢癌的风险。
这些因素与输卵管癌之间的关系尚不明确。
以往常认为输卵管癌罕见,近年来病理学、分子学以及遗传学证据显示,40%~60%被诊断为高级别浆液性卵巢癌和腹膜癌可能来源于输卵管伞端。
这些证据支持将卵巢癌、输卵管癌和腹膜癌归为一类。
以往,当无法确定肿瘤的原发部位时通常将所有浆液性癌都认为原发于卵巢的做法,今后不应继续采用。
上皮性卵巢癌可来源于子宫内膜异位症或卵巢皮质包涵囊肿。
这类疾病包括低级别子宫内膜样腺癌、透明细胞癌、交界性和低级别浆液性癌以及黏液性癌。
这类肿瘤可能由低级别的前驱病变缓慢发展而来(内膜异位囊肿或囊腺瘤等),可归类为Ⅰ型肿瘤。
输卵管癌来源于输卵管远端,多数为高级别浆液性癌,它们可由较隐匿的前驱病变迅速发展而来,可归类为Ⅱ型肿瘤,这类疾病还包括高级别子宫内膜样腺癌和癌肉瘤,所有高级别恶性肿瘤都与TP53基因突变密切相关。
腹膜、大网膜和盆腔、腹腔脏器以及横膈和肝脏表面是卵巢输卵管癌常见的转移部位。
胸膜受累也可见到。
腹腔外和胸腔外转移比较少见。
经过全面病理学评估排除了输卵管或卵巢肿瘤,应考虑为原发腹膜癌,其转移方式与卵巢、输卵管恶性肿瘤相同,并常累及卵巢和输卵管。
1 组织学分类卵巢癌大多为上皮组织来源,国际妇产科联盟(FIGO)认同WHO 公布的关于卵巢肿瘤组织学分类,并推荐所有的卵巢上皮性肿瘤按照以下亚型进一步分型:浆液性肿瘤、黏液性肿瘤、子宫内膜样肿瘤、透明细胞肿瘤、Brenner肿瘤、未分化癌(肿瘤具有上皮结构,但分化太差无法确定为哪一类型)、混合性上皮肿瘤(肿瘤由5种主要类型的上皮肿瘤细胞中的2种或2种以上构成,所包含的组织类型通常应明确)。
卵巢癌figo分期 具体分期系统是什么(健康前行,医路护航)

本文极具参考价值,如若有用请打赏支持,谢谢!
卵巢癌figo分期具体分期系统是什么(健康前行,医路护航)
1973年FIGO首次发布卵巢癌、卵管癌和腹膜癌的分期,1988年有过一次修订。
本次为第三个版本。
卵巢癌不是一种单纯的疾病,包括数种临床和病理特点迥异的肿瘤。
大约90%为恶性上皮性癌(carcinomas)。
根据组织学、免疫组化和分子遗传学分析,至少有5种主要类型:高级别浆液性癌(70%),内膜样癌(10%),透明细胞癌(10%),粘液性癌(3%)和低级别浆液性癌(不足5%)。
上述类型占据约98%的卵巢癌类型。
恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)约占3%,恶性潜能的性索间质肿瘤(主要是颗粒细胞瘤)约占1-2%。
原发性卵管癌和原发性腹膜癌比较罕见,和HGSC有很多相似的临床及形态特点,且主要发生在BRCA1/2遗传变异的女性中。
大量证据发现这些肿瘤主要为卵管起源。
而散发的HGSC则有多种来源可能。
既往“苗勒氏管新生化生(mullerianneometaplasia)”的概念得到更多证据支持。
而绝大部分ECs和CCCs 则可能来源于内异症。
新的FIGO分期在2012年10月12日提交至FIGO执行委员会,2周后通过。
表1至表3是建议的具体分期系统。
准确的组织病理诊断对于卵巢癌成功分类及治疗至关重要,不同组织学类型对治疗的反应是不同的。
FIGO委员会选择的这种分类系统,将所有肿瘤类型共享的最相关的预后因素考虑在内。
但是,在诊断和分期的时候,仍应清楚说明具体卵巢癌的组织类型。
目前达成一致的组织学类型包括:。
卵巢癌新版分期解读及NCCN指引

I期
? 手术导致的肿瘤破裂和肿瘤在手术前已 自发穿破,两者处于肿瘤不同的发展阶 段,后者的预后明显较差。多因素分析 发现,包膜破裂和腹腔冲洗液阳性是提 示无瘤生存期缩短的独立预后因素。对 于腹腔冲洗液阳性是否比包膜破裂更严 重?或相同?显然目前尚无足够的证据区 分。
? 一些报道还认为,透明细胞癌破裂风险
复发化疗
? 铂类敏感:初始化疗后6个月或更长时间 复发的患者属于“铂类敏感型复发”。 首次复发的铂类敏感型患者,首选含铂 类药物的联合方案进行化疗(1类)。推 荐使用以铂类为基础的联合化疗(1类) 。化疗方案包括:卡铂/紫杉醇(1类)、 卡铂/脂质体多柔比星(1类)、卡铂/紫 杉醇周疗、卡铂/多西他赛、卡铂/吉西他 滨(已证明可延长PFS)或顺铂/吉西他 滨。
II期
? 取消了旧分期中的ⅡC,以及ⅡA、ⅡB 中的腹水或腹腔冲洗液中未找到恶性细 胞。
? 乙状结肠位于盆腔,如果只有乙状结肠( 表面)受累,分期仍为Ⅱ期;如果肿瘤 通过肠壁侵袭至肠道粘膜,则应升级至 ⅣB 期。
III期
? Ⅲ期的变化最大,新分期将基于单纯腹膜后 淋巴结转移由旧分期的ⅢC期改为ⅢA1期。 即新分期ⅢA1仅限于腹膜后淋巴结转移, 同时根据转移淋巴结的大小分为两个亚期: ⅢA1(ⅰ)转移淋巴结最大直径≤1cm;ⅢA1 (ⅱ)转移淋巴结最大直径>1cm。新ⅢA2为 显微镜下盆腔外腹膜受累,伴或不伴腹膜后 淋巴结转移。以2cm为界,病灶最大直径 ≤2cm 为新ⅢB期,>2cm新Ⅲc期,而这种 划分方式并无循证依据证明其合理性
化疗
? 辅助化疗 Ⅱ~Ⅳ期患者术后接受紫杉醇/卡 铂方案
化疗,疗程数由原来的6~8疗程改为6疗程。 (2016版更新)
1.全面分期手术后的ⅠA或ⅠB期G 1 或低级别 癌患者,术后可仅观察随访。
第27章 卵巢肿瘤、输卵管肿瘤及原发性腹膜癌

妇产科学(第9版)
病理
侧别 质地 囊壁
囊内液 镜下
良性 多为单侧
浆液性肿瘤
交界性 双侧多见
单房或多房,囊性
多房囊性为主
单房:光滑, 多房:乳头(粗大, 不脆,以内生为主) 淡黄色浆液
乳头丰富,较细, 多数为外生性
浆液
单层立方或柱状上皮
①细胞轻、中度异型 ②复层上皮 ③无间质浸润
恶性 多为双侧 多房囊性,半实质性 大量乳头,分支细, 质脆,易脱落-恶性乳头
• 恶性肿瘤的鉴别诊断 – 子宫内膜异位症 – 盆腔结缔组织炎 – 结核性腹膜炎 – 生殖道以外的肿瘤
妇产科学(第9版)
治疗
卵巢肿瘤一经发现,应行手术。手术目的: ①明确诊断 ②切除肿瘤 ③恶性肿瘤进行手术病理分期 ④解除并发症
妇产科学(第9版)
治疗
• 术中应剖检肿瘤,必要时作冰冻切片组织学检查以明确诊 断
妇产科学(第9版)
组织学分类
• 分类方法多,最常用的是世界卫生组织的卵巢肿瘤组织 学分类(2014版)
分类 上皮性肿瘤
比例 50%~70%
生殖细胞肿瘤
20%~40%
性索-间质肿瘤 恶性转移性肿瘤
5%~8% 5%~10%
妇产科学(第9版)
组织学分类
一、上皮性肿瘤
1.浆液性肿瘤 2.黏液性肿瘤 3.子宫内膜样肿瘤 4.透明细胞肿瘤 5.移行细胞肿瘤 6.鳞状细胞肿瘤 7.混合性上皮性肿瘤 8.未分化和未分化类肿瘤
妇产科学(第9版)
恶性肿瘤随访
卵巢癌易于复发,需长期接受监测和随访。 随访时间:术后1年内,每3月随访1次;术后第2年后,每4-6个月 随访1次;第5年后每年1次。随访内容包括询问病史,体格检查 ,肿瘤标志物检测,影像学检查。CA125、AFP、HCG等肿瘤标志 物根据组织学类型选择。 超声检查异常再选择CT、MRT或PET-CT 检查。
卵巢癌病例分期、临床指南之欧阳法创编

注1:包括肿瘤蔓延至肝脏和脾脏包膜,但不包括脏器实质的受累。
注2:脏器实质转移属于IVB期。
表1.卵巢癌、卵管癌和腹膜癌的FIGO分期(2014)《2014 NCCN卵巢癌临床实践指南(第二版)》。
一、2014年指南(第二版)与临床处理密切相关的主要更新(一)手术治疗原则更新1. 大多数患者采用开腹手术,微创手术也可用于在选择的患者进行手术分期和减瘤术,用于评估是否能够进行满意的减瘤术,评估复发病灶能否切除等,但必须由有经验的妇科肿瘤医生施行;2. 儿童/年轻患者的手术原则与成人有所不同,保留生育功能者需进行全面的分期手术,但儿童期和青春期的早期生殖细胞肿瘤可不切除淋巴结;3. 交界性肿瘤是否切除淋巴结不影响总生存率,但大网膜仍需切除并进行腹膜多点活检;4. 复发患者二次减瘤术需满足下列条件:化疗结束一年以上、孤立病灶可以完整切除、无腹水。
(二)化疗原则和方案更新1. 对化疗方案进行重新排序和归类为“腹腔化疗/静脉化疗方案”和“静脉化疗方案”;2. 腹腔化疗方案中紫杉醇静脉点滴的用法可选择超过3小时或24小时静滴;3小时输注方案更方便、更容易耐受且毒性较少,但目前没有证据证实它跟24小时输注方案疗效相当。
3. 新辅助化疗可以考虑用静脉化疗方案;4. 儿童/年轻患者的IA期和IB期未成熟畸胎瘤、IA 期胚胎性肿瘤或IA期卵黄囊瘤可考虑观察或化疗;5. 静脉或腹腔化疗并不能使低度恶性潜能肿瘤(交界性上皮性卵巢肿瘤)获益。
二、上皮性卵巢癌/输卵管癌/原发性腹膜癌手术原则(一)总原则1.选择下腹正中直切口,术中冰冻病理检查有助于选择手术方案;2.有经验的手术医生可以选择微创手术方式完成手术分期和肿瘤切除,微创手术方式有助于评估初治和复发病人能否达到最大程度减瘤术;3. 手术医生必须在手术记录详细记录初发和复发病灶累及的范围;4.推荐由妇科肿瘤医生完成手术。
(二)初治浸润性上皮性卵巢癌局限于卵巢或盆腔的手术步骤1.进入腹腔后,抽吸腹水或腹腔冲洗液行细胞学检查;2.对腹膜表面进行全面诊视,可能潜在转移的腹膜组织或粘连组织都要切除或病理活检;如果没有可疑病灶,则需进行腹膜随机活检并至少包括双侧盆腔、双侧结肠旁沟、膈下(也可使用细胞刮片进行膈下细胞学取样和病理学检查);3.切除子宫和双附件,手术过程必须尽力完整切除肿瘤并避免肿瘤破裂;4.需要保留生育功能的患者,在符合适应症的前提下可考虑行单侧附件切除术;5.切除大网膜;6.行主动脉旁淋巴结切除术时,需将位于下腔静脉和腹主动脉表面及两侧的淋巴脂肪组织全部切除,上界至少达到肠系膜下动脉水平,最好达到肾血管水平;7.盆腔淋巴结切除术包括髂内外血管表面和内侧的淋巴脂肪组织、闭孔神经前方的闭孔窝淋巴脂肪组织,最好一起切除髂总血管周围的淋巴脂肪组织。
卵巢癌分期

FIGO IGCS 妇科恶性肿瘤分期及临床实践指南之七:卵巢癌(2006-10-11 19:21:44)转载分类:卵巢肿瘤及卵巢疾病标签:健康卵巢癌腹膜ca125美国卵巢癌6.1 分期6.1.1 卵巢癌部位6.1.1.1 原发部位卵巢是一对实性的卵圆形器官,直径2-4cm,由腹膜与阔韧带相连接,通过骨盆漏斗韧带与骨盆外侧壁相连。
6.1.1.2. 淋巴引流淋巴引流是通过子宫—卵巢,骨盆漏斗韧带和圆韧带淋巴干和髂外的一分支引流到如下区域淋巴结:髂外、髂总、髂内、骶骨外侧和主动脉旁淋巴结,偶尔会引流入腹股沟淋巴结。
6.1.1.3. 转移部位腹膜,包括网膜和盆腔、腹腔脏器是常见的转移部位,也包括横隔和肝表面。
胸膜受累也很常见。
其他腹膜外和胸膜外部位转移比较少见,但可以发生。
6.1.2. 分期原则虽然CT扫描可以大致明确腹腔内疾病的播散范围,但是卵巢癌应该采用手术分期。
应该有明确的组织学证据。
肿瘤切除前手术所见决定疾病的分期和预后。
胸部X 线检查可以发现胸膜转移。
由于肺外转移和腹膜外转移比较少见,因此,除非有症状,否则不要求行其他影像学检查。
虽然血清CA125水平对肿瘤分期没有帮助,但可以帮助观察肿瘤对化疗的反应。
6.1.2.1. 手术分期评估如果手术前怀疑为恶性,剖腹探查应该采用直切口。
充分的分期应该包括以下:l 仔细评估观察全部腹膜表面l 腹腔冲洗4个部位:横隔,左侧腹部,右侧腹部,盆腔l 结肠下网膜切除l 选择性盆腔和腹主动脉旁淋巴结切除l 活检和/或切除任何可疑病变、包块和粘连部位l 正常腹膜处随机盲检,包括右半横隔下面,膀胱反折,道格拉斯陷凹,左侧、右侧结肠旁隐窝,两侧盆壁l 全子宫切除,两侧输卵管卵巢切除l 粘液性肿瘤行阑尾切除6.1.2.2 术后处理—病理分期上述活检结果是分期的基础。
然而,任何其他可疑部位,例如胸膜渗出,其他少见而明显的累及部位如肺外转移,胸膜和腹膜转移,都应该取活检。
6.1.2.3 FIGO分期最常采用的分期系统是1988年修订的FIGO分期标准。
6.FIGO_IGCS妇科恶性肿瘤分期及临床实践指南_六_卵巢癌

液性肿瘤行阑尾切除。
目 前 卵 巢 癌 最 常 采 用 的 分 期 是 1988 年 修 订 的 国 际 妇 产
科协会(FIGO)分期,见表 1。 表 1 卵巢癌分期
FIGO
TNM
0 Ⅰ
ⅠA
ⅠB
ⅠC
Ⅱ ⅡA
ⅡB
ⅡC
Ⅲ
ⅢA ⅢB ⅢC
Ⅳ
原发肿瘤无法评价
TX
无原发肿瘤证据
T0
肿瘤局限于卵巢
T1
肿 瘤 局 限 于 一 侧 卵 巢 ,包 膜 完 整 ,卵 巢 表 面 T1a
如果患者初次手术不理想, 可以在全身化疗 3 个周期后 行中间性减瘤术。 这同样适用于因身体原因而不能立即手术 的患者,即先化疗,再行细胞减灭术。
患者行细胞减灭术后应该接受辅助化疗。 全身化疗首选 泰素(paclitxel)或多西泰素(docetaxel)联合卡铂。 选择多西泰素是 因为其神经毒性较小。化疗 6 个周期以后,用泰素维持化疗已 经表明可以延长患者的无瘤时间,但不能改善总生存率。
重要的是, 要让患者明白对化疗药物的反应并不意味着 可以延长生存期。 通常,提高生活质量,改善功能变成治疗的 主要目标。任何与此矛盾的治疗都是不恰当的。在这困难的时 候,让患者的朋友、家庭以及爱人参与制定治疗决策非常重。
六、 低度恶性潜能上皮性癌(交界性肿瘤)的处理 交界性肿瘤倾向于波及年轻人群。 占所有 EOC 的 15%, 诊断必须基于原发肿瘤,必须对肿瘤进行多切片检查,确实排 除浸润。接近 75%的患者诊断时处于临床Ⅰ期。交界性肿瘤预 后相当好,进展缓慢,腹膜种植偶然可自发消退,10 年生 存 率 约 95%。 早期、浆液性肿瘤、年轻患者,预后通常更好,虽然初 次手术后残存大的病灶预后通常不好, 但是死于肿瘤并不常 见。 死亡的原因主要是良性疾病的并发症(如小肠梗阻)和治 疗并发症,极少数死于恶性肿瘤转移。交界性肿瘤最重要的治 疗是初次手术分期及细胞减灭术。 临床Ⅰ期、希望保留生育功 能者,经仔细检查腹膜和对侧卵巢以排除肿瘤后,可以考虑进 行单侧卵巢切除的保守性手术。 患者若只有一侧卵巢或者两 侧卵巢都有囊性病变, 可以切除肿瘤保留部分卵巢以保留生 育功能。 对于其他所有的患者,推荐行全子宫切除、两侧输卵 管卵巢切除,有转移者进行最大限度的细胞减灭术。 所有期别的患者,如果转移病灶也是交界性肿瘤,在进行 理想的细胞减灭术之后,术后不需要辅助化疗。腹膜或网膜表 面有种植病灶的少数患者,化疗可能有好处。短期内腹腔内复 发的患者需要化疗,这些患者可能有未被发现的浸润癌。 缓慢复发特别是有长的无病间隔的复发患者, 只需进行 再次细胞减灭术。只有在组织学发现为浸润癌时,术后才需要 化疗。 七、 颗粒细胞瘤的处理 颗粒细 胞 瘤 大 约 占 性 索 间 质 肿 瘤 的 70%,占 所 有 卵 巢 肿 瘤的 3%~5%。颗粒细胞瘤分两种类型:幼稚型和成人型。由于 雌激素较高,幼稚型患者常伴有性早熟,成人型患者常伴有绝 经后出血。 由于肿瘤的症状明显,且生长缓慢,大多数患者诊 断时处于临床Ⅰ期。 发病高峰是绝经后第一个 10 年。 和交界 性肿瘤一样,这些肿瘤通常生长缓慢,复发晚。 诊断时的临床 分期是影响预后的最重要因素。其他影响预后的因素包括:患 者的年龄、肿瘤大小、组织学特征。如果有转移,彻底的细胞减 灭术是治疗的主要方法。 如果患者年轻, 病灶局限于一侧卵 巢,可以进行保守性手术。由于本病少见,且病程长,所以缺少 这方面的前瞻性研究。 对于Ⅰ期患者,如果已经进行满意的手 术,没有证据表明术后辅助化疗或放疗可以改善预后。 然而, 有些临床医生提倡对临床Ⅱ期和Ⅲ期患者采用辅助化疗。 需 进行临床随访。 血浆抑制素是一种有用的肿瘤标志物。 八、生殖细胞瘤的处理 生殖细胞瘤最多见于 20~30 岁的女性, 恶性生殖细胞肿
2024卵巢癌的基本介绍及病理分型

2024卵巢癌的基本介绍及病理分型在我国,卵巢癌年发病率居女性生殖系统肿瘤第3位,位于子宫颈癌和子宫体恶性肿瘤之后,呈逐年上升的趋势,而病死率位于女性生殖道恶性肿瘤之首。
卵巢恶性肿瘤包括多种病理类型,其中最常见的是上皮性癌,约占卵巢恶性肿瘤的80%,其次是恶性生殖细胞肿瘤和性索间质肿瘤,各约占10%和5%,本指南主要针对卵巢上皮性癌和恶性生殖细胞肿瘤。
卵巢深处盆腔,卵巢病变处于早期时常无特异临床症状,因出现症状就诊时,70%的患者已处于晚期。
卵巢癌具有一定的遗传性和家族聚集特征,目前已知与卵巢癌相关的遗传易感基因中以乳腺癌易感基因(BRCA影响最为显著。
BR约有20个,其CAl和BRCA2胚系突变携带者在一生之中发生卵巢癌的累积风险分别达54%和23%,是卵巢癌的高危人群。
对于BRCA1/2胚系突变携带者,推荐从30-35岁起开始定期行盆腔检查、血CA125和经阴道超声的联合筛查。
止匕外,还有林奇综合征、利-弗劳梅尼综合征家族的女性都是卵巢恶性肿瘤的高危人群,需要检测的基因还包括ATM、RAD51C x RAD51D、MLH1、MSH2、MSH6、PSM2、EPCAM x STK11等。
卵巢上皮癌多见于绝经后女性。
由于卵巢深居盆腔,卵巢上皮性癌早期症状不明显,往往是非特异性症状,难以早期诊断,约2/3的卵巢上皮性癌患者诊断时已是晚期。
晚期时主要因肿块增大或盆腹腔积液而出现相应症状,表现为下腹不适、腹胀、食欲下降等,部分患者表现为短期内腹围迅速增大,伴有乏力、消瘦等症状。
也可因肿块压迫出现大小便次数增多的症状。
出现胸腔积液者可有气短.难以平卧等表现。
卵巢恶性生殖细胞肿瘤常见于年轻女性,临床表现与上皮癌有所不同,早期即出现症状,除腹部包块腹胀外,常可因肿瘤内出血或坏死感染而出现发热,或因肿瘤扭转.肿瘤破裂等而出现急腹症的症状。
约60%~70%的患者就诊时属早期。
组织病理组织学检查是卵巢癌诊断的金标准。
输卵管癌分期
M0
N0
M0
N0
M0
N0
M0
N0
M0
N0
M0
N0
M0
N0
M0
N0
M0
N0
M0
N1
M0
任何N M1
O分期不再包括0期(Tis)
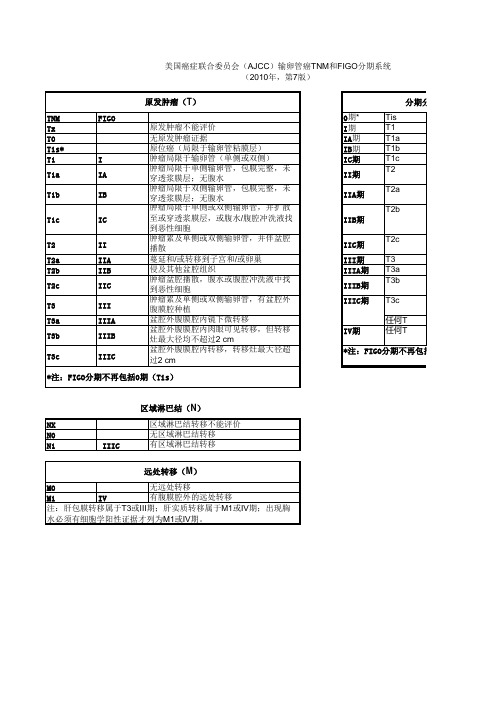
区域淋巴结(N)
NX
区域淋巴结转移不能评价
N0
无区域淋巴结转移
N1
IIIC
有区域淋巴结转移
远处转移(M)
M0
无远处转移
M1
IV
有腹膜腔外的远处转移
注:肝包膜转移属于T3或III期;肝实质转移属于M1或IV期;出现胸
水必须有细胞学阳性证据才列为M1或IV期。
系统
分期分组:
N0
M0
N0
M0
N0
M0
N0
美国癌症联合委员会(AJCC)输卵管癌TNM和FIGO分期系统 (2010年,第7版)
原发肿瘤(T)
TNM Tx T0 Tis* T1 T1a
T1b
T1c
T2 T2a T2b T2c
T3 T3a T3b
T3c
FIGO
I IA IB
IC
II IIA IIB IIC III IIIA IIIB IIIC
原发肿瘤不能评价 无原发肿瘤证据 原位癌(局限于输卵管粘膜层) 肿瘤局限于输卵管(单侧或双侧) 肿瘤局限于单侧输卵管,包膜完整,未 穿透浆膜层;无腹水 肿瘤局限于双侧输卵管,包膜完整,未 穿透浆膜层;无腹水 肿瘤局限于单侧或双侧输卵管,并扩散 至或穿透浆膜层,或腹水/腹腔冲洗液找 到性细胞 肿瘤累及单侧或双侧输卵管,并伴盆腔 播散 蔓延和/或转移到子宫和/或卵巢 侵及其他盆腔组织 肿瘤盆腔播散,腹水或腹腔冲洗液中找 到恶性细胞 肿瘤累及单侧或双侧输卵管,有盆腔外 腹膜腔种植 盆腔外腹膜腔内镜下微转移 盆腔外腹膜腔内肉眼可见转移,但转移 灶最大径均不超过2 cm 盆腔外腹膜腔内转移,转移灶最大径超 过2 cm
2024NCCN卵巢癌指南解读

2024NCCN卵巢癌指南解读
NCCN卵巢癌指南主要包含诊断、分期、术后治疗、复发和转移的治
疗等方面的建议。
首先,对于卵巢肿块的发现,指南建议通过内部超声检查、血液标志物和影像学等方法进行初步评估,以确定其为卵巢癌的可能性。
对于患者的进一步治疗,需要采取手术探查和取材进行病理学检查。
在卵巢癌的分期方面,NCCN指南采用了FIGO(国际妇产科学联合会)分期系统,分为Ⅰ期到Ⅳ期。
分期有助于确定患者的疾病程度和选择合适
的治疗方案。
对于术后治疗,指南建议对于早期卵巢癌的患者,根据肿瘤的性质和
患者的状况,进行手术治疗和辅助治疗的选择。
手术治疗包括卵巢切除术、子宫切除术、盆腔淋巴结清扫术等。
术后辅助治疗则是在手术后进行的药
物治疗,通常采用白蛋白结合型紫杉醇与顺铂的化疗方案。
在复发和转移的治疗中,指南提出了不同情况下的建议。
对于复发的
局部再发,局部复发和全身复发等,可以采取手术切除、放疗和化疗等综
合治疗方案。
在转移性卵巢癌的治疗中,可以考虑手术切除肿瘤和异位病灶,以及放疗和化疗等综合治疗方案。
此外,NCCN指南还强调了对卵巢癌患者的全面护理,包括正常的饮食、锻炼和心理支持等。
指南还提醒患者注意监测治疗的效果和副作用,
并及时调整治疗方案。
总的来说,NCCN卵巢癌指南为医生和患者提供了诊断和治疗卵巢癌
的重要参考。
但需要注意的是,指南并非绝对规定,在实际治疗中还应结
合患者的具体情况,制订个体化的治疗方案。
因此,患者应与医生充分沟通,共同制定合理的治疗计划,以提高治疗效果和患者的生活质量。
卵巢癌新版分期解读及NCCN指南ppt课件

靶向药物
• 贝伐单抗:2016年指南将贝伐单抗的使用
推荐由原来的3类改为2B类。
• GOG-218和ICON-7随机对照试验显示,化
疗加贝伐单抗可提高PFS但是两组OS无统计 学意义。
• 铂类耐药:非铂类单药(多西他赛、口服
依托泊苷、吉西他滨、脂质体多柔比星、
新辅助化疗
• 1)常用的静脉方案均可以用于间歇性减瘤
术(IDS)前的新辅助化疗,也可以用于 IDS后的辅助治疗。
• (2)在IDS前使用包含贝伐单抗的方案必
须慎重,因为可能会影响术后切口愈合。
• (3)新辅助化疗和IDS后使用腹腔化疗方
IV期
• 胸腔积液中发现癌细胞定为ⅣA期;将腹腔
外器官实质转移(包括肝实质转移和腹股沟 淋巴结和腹腔外淋巴结转移)定为ⅣB期。
• 争议:肾血管水平以上的阳性淋巴结应归
于Ⅲ期还是Ⅳ期?
NCCN指南更 新要点
基于 《2016.V1卵 巢癌、输卵 管癌和原发 性腹膜癌临 床实践指南》 和《2017.V1 卵巢癌、输 卵管癌和原 发性腹膜癌
II期
• 取消了旧分期中的ⅡC,以及ⅡA、ⅡB中的
腹水或腹腔冲洗液中未找到恶性细胞。
• 乙状结肠位于盆腔,如果只有乙状结肠(表
面)受累,分期仍为Ⅱ期;如果肿瘤通过 肠壁侵袭至肠道粘膜,则应升级至ⅣB 期。
III期
• Ⅲ期的变化最大,新分期将基于单纯腹膜后淋
巴结转移由旧分期的ⅢC期改为ⅢA1期。即新 分期ⅢA1仅限于腹膜后淋巴结转移,同时根据 转移淋巴结的大小分为两个亚期:ⅢA1(ⅰ)转 移淋巴结最大直径≤1cm;ⅢA1 (ⅱ)转移淋巴 结最大直径>1cm。新ⅢA2为显微镜下盆腔外 腹膜受累,伴或不伴腹膜后淋巴结转移。以 2cm为界,病灶最大直径≤2cm 为新ⅢB期, >2cm新Ⅲc期,而这种划分方式并无循证依 据证明其合理性
妇癌手术病理分期

一、子宫内膜癌手术病理分期(FIGO,2009)Ⅰ期:癌局限于宫体Ⅰa无或<1/2肌层浸润Ⅰb≥1/2肌层浸润Ⅱ期:肿瘤累及宫颈间质,未超出子宫Ⅲ期:肿瘤局部播散Ⅲa肿瘤累及子宫浆膜和(或)附件Ⅲb阴道和(或)宫旁受累ⅢC盆腔和(或)腹主动脉旁淋巴结转移Ⅲc1盆腔淋巴结Ⅲc2腹主动脉旁淋巴结转移Ⅳ期:膀胱和(或)直肠转移,和(或)远处转移Ⅳa膀胱和(或)直肠转移Ⅳb远处转移包括腹腔外和(或)腹股沟淋巴结二、子宫肉瘤的临床分期I期癌肿局限于宫体Ⅱ期癌肿已累及宫颈Ⅲ期癌肿已超出子宫,侵犯盆腔其他脏器及组织,但仍限于盆腔Ⅳ期癌肿超出盆腔范围,侵犯上腹腔或已有远处转移三、外阴癌2009 FIGO分期•I期肿瘤局限于外阴,淋巴结未转移•IA期肿瘤局限于外阴或外阴和会阴,最大径线≤2cm,间质浸润≤1.0mm,•IB期肿瘤最大径线>2cm或局限于外阴或会阴,间质浸润>1.0mm•II期肿瘤侵犯下列任何部位:下1/3尿道、下1/3阴道、肛门、淋巴结转移•III期肿瘤有或无侵犯下列任何部位:下1/3尿道、下1/3阴道、肛门,有腹股沟-股淋巴结转移•IIIA期(i)1个淋巴结(≥5mm),或1-2个淋巴结转移(<5mm)•IIIB期(i)≥2个淋巴结(≥5mm),或≥3个淋巴结转移(<5mm)•IIIC期阳性淋巴结伴囊外扩散•IV期肿瘤侵犯其他区域(上2/3尿道,上2/3阴道)或远处转移•IVA期(i)肿瘤侵犯一下任何部位:上尿道和(或)阴道粘膜、膀胱粘膜、直肠粘膜或固定在骨盆壁,或(ii)腹股沟-股淋巴结出现固定或溃疡形成。
•IVB期任何部位(包括盆腔淋巴结)的远处转移•注:肿瘤浸润深度指肿瘤从接近最表层乳头上皮-间质连接处至最深浸润点的距离。
四、宫颈癌2009 FIGO分期I期肿瘤严格局限于子宫颈(扩展至宫体将被忽略)IA镜下浸润癌,间质浸润深度≤5mm,水平扩散≤7mmIA1 间质浸润深度≤3mm,水平扩散≤7mmIA2 间质浸润深度>3mm,且5≤mm,水平扩散≤7mmIB 肉眼可见病灶局限于宫颈,或者临床前病灶>IA2期IB1 肉眼可见病灶最大径线≤4cmIB2 肉眼可见病灶最大径线>4cmII期肿瘤超越子宫颈,但未达骨盆壁或未达阴道下1/3 IIA 无宫旁浸润IIA1 肉眼可见病灶最大径线≤4cmIIA2 肉眼所见病灶最大径线>4cmIIB 有宫旁浸润III期肿瘤扩展到骨盆壁和(或)累及阴道下1/3和(或)引起肾盂积水或肾无能IIIA 肿瘤累及阴道下1/3,没有扩展到骨盆壁IIIB 肿瘤扩散至骨盆壁和(或)引起肾盂积水或肾无能IV期肿瘤播散超出真骨盆或(活检证实)侵犯膀胱粘膜或者直肠粘膜。
卵巢恶性肿瘤(原发)手术病理分期

Ⅰ期 肿瘤局限于卵巢 ⅠA 肿瘤局限于一侧卵巢,包膜完整,卵巢表面无肿瘤; 腹腔积液(腹水或腹腔冲洗液)中未找到恶性细胞 ⅠB 肿瘤局限于双侧卵巢,包膜完整,卵巢表面无肿瘤; 腹腔积液(腹水或腹腔冲洗液)中未找到恶性细胞 ⅠC 肿瘤局限于单侧卵巢或双侧卵巢并伴如下任何一项:包膜破裂;卵巢表面有肿瘤;腹腔积液或 腹腔液中有恶性细胞 Ⅱ期 肿瘤累及一侧或双侧卵巢肿瘤,伴盆腔内扩散 ⅡA 蔓延和(或)转移到子宫和(或)输卵管
ⅡB 蔓延到其他盆腔器官
ⅡC ⅡA或ⅡB肿瘤,伴有卵巢表面有肿瘤,或包膜破裂或腹腔积液或腹腔液中有恶性细胞 III期 肿瘤侵犯一侧或双侧卵巢肿瘤,并有组织学证实的盆腔外腹腔种植和(或)局部淋巴结转移; 肝表面转移;肿瘤局限于真骨盆,但组织学证骨盆,淋巴结阴性,但组织学证实腹腔腹膜表面存在镜下转移,或组织学 证实肿瘤细胞已经扩散到小肠或大网膜
IIIB 一侧或双侧卵巢肿瘤,并有组织学证实的腹腔腹膜表面肿瘤种植,但直径≤2cm,淋巴结阴性 IIIC 腹腔转移灶直径>2cm 和(或)区域淋巴结转移
Ⅳ期
肿瘤侵犯一侧或双侧卵巢,远处转移。有胸腔积液且胸腔肿瘤细胞阳性为IV期;肝实质转移为 IV期。
FIGO卵巢癌-输卵管癌-原发性腹膜癌分期标准

Ⅰ期
肿瘤局限于卵巢或输卵管
ⅠA
肿瘤局限于一侧卵巢(包膜完整)或输卵管,卵巢和输卵管表面无肿瘤;腹水或腹腔冲洗液未找到癌细胞
ⅠB
肿瘤局限于双侧卵巢(包膜完整)或输卵管,卵巢和输卵管表面无肿瘤;腹水或腹腔冲洗液未找到癌细胞
ⅠC
肿瘤局限于单或双侧卵巢或输卵管,并伴有如下任何一项:
腔积液细胞学检查发现癌细胞
ⅣB
肝、脾实质受累,腹腔外器官转移(包括腹股沟淋巴结转移或腹腔外淋巴结转移)
注:肝包膜转移为Ⅲ期,肝实质转移为ⅣB期;胸水必须找到恶性细胞才能分为ⅣA期;ⅠC3:如果细胞学检查阳性,应注明是腹水还是腹腔冲洗液
ⅢA
ⅢA1:仅有腹膜后淋巴结阳性(细胞学或组织学证实)
ⅢA1(i)期:淋巴结转移灶最大直径≤10mm;ⅢA1(ii)期:淋巴结转移灶最大直径>10mm
ⅢA2:显微镜下盆腔外腹膜受累,伴或不伴腹膜后阳性淋巴结
ⅢB
肉眼可见盆腔外腹膜转移,病灶最大直径≤2cm,伴或不伴腹膜后阳性淋巴结
ⅢC
肉眼可见盆腔外腹膜转移,病灶最大直径>2cm,伴或不伴腹膜后阳性淋巴结(包括肝、脾表面受累,但无脏器实质转移)
ⅠC1:术中肿瘤包膜破裂
ⅠC2:术前肿瘤包膜已破裂或卵巢、输卵管表面有肿瘤
ⅠC3:腹水或腹腔冲洗液中找到癌细胞
Ⅱ期
肿瘤累及一侧或双侧卵巢或输卵管伴盆腔扩散(在骨盆入口平面以下)或原发性腹膜癌
ⅡA
肿瘤扩散至或种植到子宫和(或)输卵管和(或)卵巢
ⅡB
肿瘤扩散至其他盆腔内组织
Ⅲ期
肿瘤累及单侧或双侧卵巢、输卵管或原发性腹膜癌,伴有细胞学或组织学证实的盆腔外腹膜转移,或腹膜后淋巴结转移
卵巢癌分期

卵巢癌、卵管癌和腹膜癌的FIGO分期(2014)分享|发布时间:2014年06月04日点击数:3141 次字体:小大1973年FIGO首次发布卵巢癌、卵管癌和腹膜癌的分期,1988年有过一次修订。
本次为第三个版本。
卵巢癌不是一种单纯的疾病,包括数种临床和病理特点迥异的肿瘤。
大约90%为恶性上皮性癌(carcinomas)。
根据组织学、免疫组化和分子遗传学分析,至少有5种主要类型:高级别浆液性癌(70%),内膜样癌(10%),透明细胞癌(10%),粘液性癌(3%)和低级别浆液性癌(不足5%)。
上述类型占据约98%的卵巢癌类型。
恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)约占3%,恶性潜能的性索间质肿瘤(主要是颗粒细胞瘤)约占1-2%。
原发性卵管癌和原发性腹膜癌比较罕见,和HGSC有很多相似的临床及形态特点,且主要发生在BRCA1/2遗传变异的女性中。
大量证据发现这些肿瘤主要为卵管起源。
而散发的HGSC则有多种来源可能。
既往“苗勒氏管新生化生(mullerian neometaplasia)”的概念得到更多证据支持。
而绝大部分ECs和CCCs则可能来源于内异症。
新的FIGO分期在2012年10月12日提交至FIGO执行委员会,2周后通过。
表1至表3是建议的具体分期系统。
准确的组织病理诊断对于卵巢癌成功分类及治疗至关重要,不同组织学类型对治疗的反应是不同的。
FIGO委员会选择的这种分类系统,将所有肿瘤类型共享的最相关的预后因素考虑在内。
但是,在诊断和分期的时候,仍应清楚说明具体卵巢癌的组织类型。
目前达成一致的组织学类型包括:1.上皮性癌(按频率顺序排列):高级别浆液性癌(HGSC),内膜样癌(EC),透明细胞癌(CCC),粘液性癌(MC),低级别浆液性癌(LGSC)。
注:移行细胞癌目前认为是HGSC 的一种变异形态;恶性Brenner瘤则被认为是极端罕见的低级别癌。
2.恶性生殖细胞肿瘤(无性细胞瘤,卵黄囊瘤,未成熟畸胎瘤)。
FIGO2021妇癌报告:卵巢癌、输卵管癌、腹膜癌诊治指南解读(全文)

FIGO2021妇癌报告:卵巢癌、输卵管癌、腹膜癌诊治指南解读(全文)卵巢癌的三种类型一、概述卵巢恶性肿瘤可以发生于任何年龄。
20岁以下女性中生殖细胞肿瘤最常 见。
交界性W 瘤常好发于30余岁到40余岁的女性,发病年龄较上皮性浸 润癌患者早10岁以上。
卵巢上皮性癌绝大多数发生于50岁以后。
卵巢上皮性癌较确定的致病危险因素为生育因素。
未生育女性罹患卵巢上皮性癌的风险是已生育女性的2倍。
以往认为输卵管癌罕见,但已有证据显示,不少高级别浆液性卵巢癌和腹 膜癌源于输卵管伞端。
二、组织学分类特异性性索间质细胞肿瘤约10%上皮性肿瘤约为 卵巣癌的50%~70% 生殖细胞 瘤约10%大多数卵巢癌为上皮来源,国际妇产科联盟(FIGO )采用世界卫生组织(WHO )卵巢上皮性癌组织学分类方法。
分为:(1 )浆液性肿瘤。
(2 )黏液性肿瘤。
(3 )内膜样肿瘤。
(4 )透明细胞肿瘤。
(5 )伯纳勒肿瘤。
(6)未分化癌(属于恶性上皮结构肿瘤,但它们分化极差,无法分入任何一组)。
(7 )混合型上皮性«瘤(肿瘤由5种常见上皮性肿瘤中的2种或以上组成,具体种类通常会明确说明)。
(8)腹膜癌或原发部位不明确的浆液性癌:病理为高级别浆液性癌,外观上卵巢和输卵管被附带累及且它们并非原发部位。
其中浆液性癌是最常见的类型。
90%以上输卵管癌是浆液性癌或高级别子宫内膜癌。
三、遗传学约20%卵巢癌、输卵管癌和腹膜癌与遗传因素有关:(1 )多数遗传性卵巢癌是BRCA1或BRCA2发生有害突变导致的。
在非黏液性高级别卵巢癌患者中,至少15%存在胚系BRCA1/2突变,这些患者中40%没有乳腺癌/卵巢癌家族史。
推荐所有非黏液性高级别卵巢癌患者都应接受基因检测,即便她们没有乳腺癌/卵巢癌家族史。
(2 )BRCA1和BRCA2遗传性有害突变是最主要的遗传风险因素O BRCA1 突变携带者癌变的发生率为20%~50% ,而BRCA2突变携带者癌变发生率为10%~20%。
卵巢癌病理figo分级i级

卵巢癌病理FIGO分级I级,指的是肿瘤局限在卵巢或输卵管内,没有或者很少有淋巴结转移。
根据FIGO(国际妇产科联盟)的定义,I级卵巢癌包括以下三个亚类:
1. IA类:肿瘤局限在单个卵巢或输卵管内,没有肿瘤破裂。
2. IB类:肿瘤局限在两个卵巢或输卵管内,没有肿瘤破裂。
3. IC类:肿瘤局限在一个或两个卵巢或输卵管内,有肿瘤破裂。
需要注意的是,FIGO分级只是对卵巢癌的病理严重程度进行了分类,具体的治疗方案还需要根据患者的个体情况(如年龄、身体状况等)和肿瘤的具体特征(如大小、生长速度、病理类型等)来制定。
卵巢癌、卵管癌和腹膜癌的FIGO分期(2014)

ClinicalCommentary2014FIGO staging for ovarian,fallopian tube and peritoneal cancerCancer staging is a core principle in understanding the severity of pa-tients'clinical condition,predicting the outcome,and planning ade-quate treatment.Staging is necessary for explaining epidemiologic changes,de fining the disease at presentation,and evaluating the overall impact of new therapies.In essence,it assigns patients to prognostic groups that require speci fic treatments.The steps of staging typically begin by establishing the histopathologic diagnosis,according to the tumor cell type,and assessing prognosis based on extent of disease and other known prognostic parameters.Recently,the presence of var-ious molecular genetic alterations has been used in the establishment of prognosis and even staging classi fication in some tumors but gyneco-logic cancers have continued to rely on physical,radiographic and surgi-cal findings.This editorial is written to make the readership aware of the recent changes that have been made by the International Federation of Gyne-cology and Obstetrics (FIGO)in the staging classi fication of ovarian can-cer and the reasoning behind those changes [1].Even if the FIGO Committee on Gynecologic Oncology utilized the best evidence current-ly available,this is always a somewhat subjective process.Furthermore,one needs to be aware that FIGO is an international organization that must take into account the needs of women with gynecologic cancers throughout the world,and not just those from countries that are re-source rich.The first FIGO ovarian cancer staging was published in 1973in Volume 15of the FIGO Annual Report.Since that time there have been two other changes including this one in 1988and 2013.Ovarian cancer is not one disease.Several distinct tumors with unique clinical and pathological features may arise in the ovary.Approx-imately 90%of ovarian cancers are carcinomas (malignant epithelial tu-mors)and,based on histopathology,immunohistochemistry,and molecular genetic analysis,at least 5main types are currently distin-guished:high-grade serous carcinoma (HGSC [70%]);endometrioid car-cinoma (EC [10%]);clear-cell carcinoma (CCC [10%]);mucinous carcinoma (MC [3%]);and low-grade serous carcinoma (LGSC [less than 5%][2]).These tumor types (which account for 98%of ovarian car-cinomas)can be reproducibly diagnosed by light microscopy and are es-sentially different diseases,as indicated by differences in epidemiologic and genetic risk factors;precursor lesions;ways of spread;and molecu-lar changes during oncogenesis,response to chemotherapy,and out-come [3]Much less frequent are malignant germ cell tumors (dysgerminomas,yolk sac tumors,and immature teratomas [3%of ovar-ian cancers])and potentially malignant sex cord-stromal tumors (1%–2%,mainly granulosa cell tumors).The biomarker expression pro file within a given histotype is consistent across stages.In short,ovarian cancers differ primarily based on histotype.Primary fallopian tube cancer and primary peritoneal cancer are rare malignancies but share many clinical and morphologic similarities with HGSC;i.e.,the most common type of ovarian cancer (in the past,re-ferred to as “papillary serous carcinoma ”)and the prototype tumor oc-curring in women with BRCA1or BRCA2germline mutations.In these patients,compelling evidence for a tubal derivation of their tumors,mainly those encountered at early stage,has accumulated over the past decade [4–6].Evidence of a tubal origin is weaker in the far more common sporadic HGSCs,and a multicentric origin of these tumors (i.e.arising from ovarian surface mesothelial invaginations or cortical inclusion cysts,implantation of tubal-type epithelium into the ovary [endosalpingiosis],or the pelvic peritoneum [the so-called secondary müllerian system ])cannot be ruled out.Recently,it has been hypothe-sized that cytokeratin7-positive embryonic/stem cells would be capable of mullerian differentiation in cortical inclusion cysts resulting from ovarian surface epithelium (mesothelium)invaginations.Thus,embry-onic progenitors would give rise to immunophenotypically distinct neo-plastic progeny [7]which would support the old concept of “mullerian neometaplasia ”.On the other hand,it has been demonstrated that the vast majority of ECs and CCCs arise in the ovary from endometriosis.Based on the putative tubal or peritoneal origin of a number of BRCA +HGSCs,and the fact that they are managed clinically in a similar manner regardless their ovarian,tubal,or peritoneal derivation,most FIGO Committee members felt that FIGO staging of ovarian,peritoneal,and fallopian tube cancers should be considered collectively [8].The pri-mary site (i.e.ovary,fallopian tube,or peritoneum)should be designat-ed where possible.In some cases,it might not be possible to delineate the primary site clearly;such cases should be listed as “undesignated.”The process of updating the staging classi fication of ovarian,fallopian tube,and primary peritoneal cancer started 4years ago with a proposal that was sent to all relevant gynecology oncology organiza-tions and societies throughout the world and input was collated,evalu-ated,and formulated into the staging that is presented below.All suggestions are based on the best available evidence.The committee ac-knowledged that there are areas that are not supported by strong evi-dence and has been careful to ensure that changes are not made without quality evidence when available.The new staging below was reached by consensus of all participating in the FIGO meeting held in Rome,Italy,on October 7th,2012,some of whom were representatives of their organizations.The new staging was presented to the FIGO Exec-utive Board on October 12,2012,and approved two weeks later.Ovarian cancer remains largely a surgically staged disease.The prog-nosis is based on histologic type,radiographic,and operative extent of the disease.The proposed staging system is noted below (Table 1).(See Tables 2and 3).Precise histopathologic diagnosis is mandatory for successful catego-rization and treatment of ovarian cancers,as different histologic types respond differently to treatment.To be practical,the FIGO committeeGynecologic Oncology 133(2014)401–404/10.1016/j.ygyno.2014.04.0130090-8258/©2014Elsevier Inc.All rightsreserved.Contents lists available at ScienceDirectGynecologic Oncologyj o u r na l h om e p a g e :w w w.e l s e v i e r.c o m /l o c a t e /y g y n ochose a staging classi fication system that takes into account the mostrelevant prognostic parameters shared by all tumor types.However,it was agreed on by all that histologic type should be designated at the time of diagnosis and staging.The five agreed upon epithelial histologic types,as well as much less common malignant germ cell and potentially malignant sex cord-stromal tumors,are listed below.Histologic types:Carcinomas (by order of frequency)High-grade serous carcinoma (HGSC)Endometrioid carcinoma (EC)Clear-cell carcinoma (CCC)Mucinous carcinoma (MC)Low-grade serous carcinoma (LGSC).Note:Transitional cell carcinoma is currently interpreted as a mor-phologic variant of HGSC;malignant Brenner tumor is considered a low-grade carcinoma which is extremely rare.Malignant germ cell tumors (dysgerminomas,yolk sac tumors,and immature teratomas)Potentially malignant sex cord-stromal tumors (mainly rare cases of granulosa cell tumors and Sertoli –Leydig cell tu-mors with heterologous sarcomatous elements).The issues discussed and concluded by the FIGO committee will be taken one stage at a time,controversial issues raised,and the available data cited as appropriate.Staging should be considered fluid.As more prognostic features be-come available these should be used to further predict outcomes and determine treatment.The world is getting smaller in the sense that staging systems must be applicable universally and including resource rich as well as resource poor regions.Toward this end,three members of FIGO will now be on the AJCC staging committee and there is repre-sentation of the UICC on the AJCC.The International Gynecologic Cancer Society and the Society of Gynecologic Oncology now have nonvoting representation on the FIGO committee as well.We need to continue to gain consensus internationally by having cross representation on ourTable 12014FIGO ovarian,fallopian tube,and peritoneal cancer staging system and corresponding TNM.I Tumor con fined to ovaries or fallopian tube(s)T1IA Tumor limited to one ovary (capsule intact)or fallopian tube,No tumor on ovarian or fallopian tube surface No malignant cells in the ascites or peritoneal washingsT1a IBTumor limited to both ovaries (capsules intact)or fallopian tubesNo tumor on ovarian or fallopian tube surfaceNo malignant cells in the ascites or peritoneal washingsT1b ICTumor limited to one or both ovaries or fallopian tubes,with any of the following:IC1Surgical spill intraoperativelyIC2Capsule ruptured before surgery or tumor on ovarian or fallopian tube surface IC3Malignant cells present in the ascites or peritoneal washingsT1c II Tumor involves one or both ovaries or fallopian tubes with pelvic extension (below pelvic brim)or peritoneal cancer (Tp)T2IIA Extension and/or implants on the uterus and/or fallopian tubes/and/or ovaries T2a IIB Extension to other pelvic intraperitoneal tissuesT2bIIITumor involves one or both ovaries,or fallopian tubes,or primary peritoneal cancer,with cytologically or histologically con firmed spread to the peritoneum outside the pelvis and/or metastasis to the retroperitoneal lymph nodesT3IIIA Metastasis to the retroperitoneal lymph nodes with or without microscopic peritoneal involvement beyond the pelvis T1,T2,T3aN1IIIA1Positive retroperitoneal lymph nodes only (cytologically or histologically proven)IIIA1(i)Metastasis ≤10mm in greatest dimension (note this is tumor dimension and not lymph node dimension)T3a/T3aN1IIIA1(ii)Metastasis N 10mm in greatest dimension IIIA 2Microscopic extrapelvic (above the pelvic brim)peritoneal involvement with or without positive retroperitoneal lymph nodes T3a/T3aN1IIIB Macroscopic peritoneal metastases beyond the pelvic brim ≤2cm in greatest dimension,with or without metastasis to the retroperitoneal lymph nodes T3b/T3bN1III C Macroscopic peritoneal metastases beyond the pelvic brim N 2cm in greatest dimension,with or without metastases to the retroperitoneal nodes (Note 1)T3c/T3cN1IVDistant metastasis excluding peritoneal metastasesStage IV A:Pleural effusion with positive cytologyStage IV B:Metastases to extra-abdominal organs (including inguinal lymph nodes and lymph nodes outside of abdominal cavity)(Note 2)Any T,Any N,M1(Note 1:includes extension of tumor to capsule of liver and spleen without parenchymal involvement of either organ)(Note 2:Parenchymal metastases are Stage IV B)T3c/T3cN1)Notes:1.Includes extension of tumor to capsule of liver and spleen without parenchymal involvement of either organ.2.Parenchymal metastases are Stage IV B.Table 2Carcinoma of the ovary –fallopian tube –peritoneum —stage grouping.FIGOUICC(Designate primary:Tov,Tft,Tp or Tx)Stage T N M IA T1a N0M0IB T1b N0M0IC T1c N0M0IIA T2a N0M0IIB T2b N0M0IIIA T3a N0M0T3a N1M0IIIB T3b N0M0T3b N1M0IIIC T3c N0–1M0T3c N1M0IV Any T Any N M1Regional nodes (N)Nx Regional lymph nodes cannot be assessed N0No regional lymph node metastasis N1Regional lymph node metastasis Distant metastasis (M)Mx Distant metastasis cannot be assessed M0No distant metastasis M1Distant metastasis (excluding peritoneal metastasis)Notes:1.The primary site –i.e.ovary,fallopian tube or peritoneum –should be designated where possible.In some cases,it may not be possible to clearly delineate the primary site,and these should be listed as ‘undesignated ’.2.The histologic type of should be recorded.3.The staging includes a revision of the stage III patients and allotment to stage IIIA1is based on spread to the retroperitoneal lymph nodes without intraperitoneal dissemina-tion,because an analysis of these patients indicates that their survival is signi ficantly bet-ter than those who have intraperitoneal dissemination.4.Involvement of retroperitoneal lymph nodes must be proven cytologically or histologically.5.Extension of tumor from omentum to spleen or liver (Stage III C)should be differentiat-ed from isolated parenchymal splenic or liver metastases (Stage IVB).402Clinical Commentaryentire representative staging committees.This will help us standardize care and staging systems throughout the world.In the future it is hoped that organizations such as UICC,AJCC,and FIGO will continue to work together to achieve this goal.Conflict of interest statementThe authors declare that there are no conflicts of interest.References[1]Prat J.Staging classification for cancer of the ovary,fallopian tube,and peritoneum.Int J Gynecol Obstet2014;124:1–5.[2]Lee KR,Tavassoli FA,Prat J,Dietel M,Gersell DJ,Karseladze AI,et al.Surface epithelialstromal tumours:tumours of the ovary and peritoneum.In:Tavassoli FA,Devilee P,ed-itors.World Health Organization Classification of Tumours:pathology and genetics of tumours of the breast and female genital organs.Lyon:IARC Press;2003.p.117–45.[3]Prat J.Ovarian carcinomas:five distinct diseases with different origins,genetic alter-ations,and clinicopathological features.Virchows Arch2012;460(3):237–49.[4]Piek JM,van Diest PJ,Zweemer RP,Jansen JW,Poort-Keesom RJ,Menko FH,et al.Dysplastic changes in prophylactically removed Fallopian tubes of women predisposed to developing ovarian cancer.J Pathol2001;195(4):451–6.[5]Callahan MJ,Crum CP,Medeiros F,Kindelberger DW,Elvin JA,Garber JE,et al.Prima-ry fallopian tube malignancies in BRCA-positive women undergoing surgery for ovarian cancer risk reduction.J Clin Oncol2007;25(25):3985–90.[6]Kindelberger DW,Lee Y,Miron A,Hirsch MS,Feltmate C,Medeiros F,et al.Intraepithelial carcinoma of thefimbria and pelvic serous carcinoma:Evidence fora causal relationship.Am J Surg Pathol2007;31(2):161–9.[7]Crum CP,Herfs M,Ning G,Bijron JG,Howitt BE,Jimenez CA,Hanamornroongruang S,McKeon FD,Xian W.Through the glass darkly:intraepithelial neoplasia,top-down differentiation,and the road to ovarian cancer.J Pathol2013;231(4):402–12. [8]Cannistra SA,Gershenson DM,Recht A.Ovarian cancer,fallopian tube carcinoma,and peritoneal carcinoma.In:De Vita VT,Lawrence TS,Rosenberg SA,editors.De Vita,Hellman,and Rosenberg's cancer:principles and practice of oncology.9th ed.Philadelphia:Lippincott,Williams,Wilkins;2011.p.1368–91.[9]Yemelyanova AV,Cosin JA,Bidus MA,Boice CR,Seidman JD.Pathology of stage I ver-sus stage III ovarian carcinoma with implications for pathogenesis and screening.Int J Gynecol Cancer2008;18(3):465–9.[10]Seidman JD,Yemelyanova AV,Khedmati F,Bidus MA,Dainty L,Boice CR,et al.Prog-nostic factors for stage I ovarian carcinoma.Int J Gynecol Pathol2010;29(1):1–7.Table3Explantation of the Staging ChangesStage IDisease confined to the ovary after comprehensive staging T1–N0–M0 Stages IA and IB are unchanged from the1988staging.T1a–N0–M0 IA remains tumor limited to one ovary(capsule intact)or fallopian tube.There can be no disease on the ovary or fallopian tube surface.There are no malignant cells inthe ascites or peritoneal washings.Primary peritoneal has no Stage IA.1B is unchanged and remains tumor limited to both ovaries with capsule intact or fallopian tubes;and there can be no malignant cells on ovarian or fallopian tubesurfaces.There are no malignant cells in the ascites or peritoneal washings.T1b–N0–M0 IC represents a change for the1988staging system.It still designates positive cytology but,if possible,must designate the reason for malignant cells being present;hence,this substage is divided into three groups.T1c–N0–M01C1represents disease confined to one or both ovaries with capsule rupture during surgery1C2represents rupture before surgery or tumor excrescences on the surface of the tube or ovary.1C3represents malignant cells in the peritoneal cavity regardless of cause.CommentsSpecific issues surrounding stage I tumors need to be considered when evaluating Stage I patients surgically and pathologically.Bilateral tumors that are large on oneside and multiple or small on the other could represent metastases up to one third of the time[9,10].The significance of positive cytology is poorly understood andis one of the reasons that the committee elected to divide it into three categories.Some studies have found that intraoperative rupture portends a worse prognosisthan if the capsule is unruptured.In one multivariate analysis,both capsule rupture and positive cytology were independent predictors of worse disease freesurvival[11].Surface involvement of the ovary or fallopian tube should be considered present only when excrescences have cancer cells in direct contact with theperitoneal cavity,breaking through the surface of the ovarian capsule.Tumors with a smooth surface usually don't show an exposed layer of neoplastic cells.Histologic grade influences survival and is given with the histotype except for endometrioid carcinoma and mucinous cancers which should be graded.Practicallyall clear cell carcinomas are high grade.Stage IIStage II ovarian cancer includes disease confined to the pelvis(below the pelvic brim).It involves one or both ovaries or fallopian tubes with pelvic extension orprimary peritoneal cancer.T2–N0–M0IIA Extension and/or implants on the uterus and/or fallopian tubes and/or ovaries T2a–N0–M0 IIB Extension to other pelvic intraperitoneal tissues/organs T2b–N0–M0 Comments:Stage II ovarian cancer remains controversial and ill defined.It comprises a small group of ovarian cancer patients that have direct extension of their tumors to otherpelvic organs without evidence of metastatic disease.However,it also includes a group of patients that has metastases to the pelvic peritoneum.In this secondgroup of patients,disease is similar to that of stage III patients.Disease invading through the bowel wall and into the mucosa increases the stage to IVB.Stage IIIStage III Cancer involves1or both ovaries,fallopian tubes,or is primarily from the peritoneum with histologically confirmed spread outside of the pelvis and/ormetastases to the retroperitoneal nodes.T1/T2–N1–MO IIIA1Positive retroperitoneal nodes only.This can be confirmed histologically or cytologically.lllA(i)Metastases up to and including10mm in greatest dimensionIIIA(ii)Metastases more than10mm in greatest dimensionStage IIIA2:Microscopic extrapelvic(above the boney pelvic brim)peritoneal involvement with or without metastases to the retroperitoneal lymph nodes T3a2–N0/N1–M0IIIB:Macroscopic peritoneal metastases beyond the pelvis up to and including2cm in greatest dimension,with or without metastases to the retroperitoneal lymph nodes.T3b–N0/N1–M0IIIC:Macroscopic peritoneal disease beyond the pelvis more than2cm in greatest diameter,with or without metastases to the retroperitoneal lymph nodes(includes tumor extension to the capsule of the liver and spleen but no parenchymal metastases).CommentsApproximately,85%of ovarian cancers present as stage III tumors and the vast majority are high-grade serous carcinomas[12].A little less than10%of patients with ovarian cancer that appear to have stage I disease will have isolated lymph node metastases.The likelihood of having nodal metastasis in other stages are:III,55% and IV,88%[13].There is some evidence that exclusive retroperitoneal disease portends a better prognosis and for this reason the new staging system addresses this issue in the IIIA category[14–19].It should be noted that the size separating the IIIA tumors applies to the tumor size and not the lymph node size.Stage IV:Distant metastases excluding peritoneal or retroperitoneal nodal disease below the diaphragm.IVA:Pleural effusion with positive cytologyIVB:Metastases to extra abdominal sites including inguinal lymph nodes and parenchymal involvement of visceral organs including liver and spleen.Transmural involvement of a visceral structure also represents stage IVB disease.403Clinical Commentary[11]Bakkum-Gamez JN,Richardson DL,Seamon LG,Aletti GD,Powless CA,Keeney GL,et al.Influence of intraoperative capsule rupture on outcomes in stage I epithelial ovarian cancer.Obstet Gynecol2009;113(1):11–7.[12]Heintz AP,Odicino F,Maisonneuve P,Quinn MA,Benedet JL,Creasman WT,et al.Carcinoma of the ovary.FIGO26th annual report on the results of treatment in gy-necologic cancer.Int J Gynecol Obstet2006(95Suppl.1):S161-92.[13]Ayhan A,Gultekin M,Dursun P,Dogan NU,Aksan G,Guven S,et al.Metastaticlymphnode number in epithelial ovarian carcinoma:does it have any clinical signif-icance?Gynecol Oncol2008;108(2):428–32.[14]Onda T,Yokishikawa H,Yasugi T,Mishima M,Nakagawa S,Yamada M,et al.Patientswith ovarian carcinoma upstaged to stage III after systemic lymphadenectomy have similar survival to Stage I/II patients and superior survival to other stage III patients.Cancer1998;83(8):1555–60.[15]Kanazawa K,Suzuki T,Tokashika M.The validity and significance of substage IIIC bynode involvement in ovarian cancer:impact of nodal metastasis on patient survival.Gynecol Oncol1999;73(2):237–41.[16]Panici PB,Maggioni A,Hacker N,Landoni F,Ackerman S,Campagnutta E,et al.Sys-tematic aortic and pelvic lymphadenectomy versus resection of bulky nodes only in optimally debulked advanced ovarian cancer:a randomized clinical trial.J Natl Can-cer Inst2005;97(8):560–6.[17]Cliby WA,Aletti GD,Wilson TO,Podratz KC.Is it justified to classify patients to stageIIIC epithelial ovarian cancer based on nodal involvement only?Gynecol Oncol 2006;103(3):797–801.[18]Ferrandina G,Scambia G,Legge F,Petrillo M,Salutari V.Ovarian cancer patients with“node positive-only”Stage IIIC disease have a more favorable outcome than Sage IIIA/B.Gynecol Oncol2007;107(1):154–6.[19]Baek SJ,Park JY,Kim DY,Kim JH,Kim YM,Kim YT,et al.Stage IIIC epithelial ovariancancer classified soley by lymph node metastasis has a more favorable prognosis than other types of stage IIIC epithelial ovarian cancer.J Gynecol Oncol 2008;19(4):223–8.David G.Mutch Department of Obstetrics and Gynecology,Washington University School of Medicine,4911Barnes Hospital Plaza,St.Louis,MO63110,United StatesJaime Prat Department of Pathology,Hospital de la Santa Creu i Sant Pau,Autonomous University of Barcelona,Sant Quinti,87-89,08041Barcelona,Spain404Clinical Commentary。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卵巢癌输卵管癌腹膜癌手术分期标准F I G O 标准化管理部编码-[99968T-6889628-J68568-1689N]
F I
G O2014年卵巢癌、输卵管癌、腹膜癌手术分期标准
下,可能无法确定肿瘤的原发位置,这种情况将列为“原发部位不明确”。
(2)应当记录肿瘤的组织学类型。
(3)新分期对Ⅲ期进行了修改,肿瘤扩散至腹膜后淋巴结但无腹腔内转移的患者,分期被调整为ⅢA1期,这样调整的原因在于这些患者的预后显着优于发生腹腔内播散的患者。
(4)腹膜后淋巴结转移应当使用细胞学或组织学进行证实。
(5)肿瘤从大网膜扩散至脾或肝脏(ⅢC)应当与孤立性脾或肝实质转移相区别。
