第十一章分子重排
10第十章 分子重排反应

亲核重排反应:
重排现象:亲电加成,芳环上亲电取代,亲核取代 (SN1)反应中见到: 首先形成一个缺电子体系(叔碳正离子 、 烷氧基正离子 、卡宾 、氮 宾 )
迁移基团带一对成键电子转移到缺电子中心
碳原子间迁移的重排
瓦格纳尔—梅尔外英(Wagneer-Meerwein) 重排(碳正离子重排) ROH+H+→R++H2O
(CH 3 ) 3 CC H 2 N H 2 H NO 2 -N 2 + (C H 3 ) 3 C C H 2 甲 基 迁 移 重 排 (CH 3 ) 2 C(O H )C H 2 C H 3 H 2O -H +
瓦-梅重排的一种
(C H 3 ) 2 C C H 2 C H 3 +
脂环伯胺则为扩环产物
苄基正离子比叔碳正离子稳定,
+ (C H 3) 3C C H Ph
不发生重排生成
+ 因为生成 C 为 p - π共 轭 可 分 散 正 电 荷 , 很 稳 定
+ (CH 3 ) 2CCH(CH 3)Ph
β-碳原子上迁移基团的活性
在环状化合物中,环张力大小也是发生重排的一 个因素。
捷米杨诺夫(Demjanov)重排 脂肪伯胺反应生成醇中的重排
Baeyer-Villiger重排历程
不对称酮的重排中,基团亲核性趋大,迁移的倾向趋 大 迁移倾向: 烃基:H>Ph>3°>2°>1°>甲基 芳基:p-CH3Ph>Ph->p-NO2Ph
亲电重排反应
迁移基团(不带成键电子对)迁移到富电子
中心 也称为碳(或其它元素)负离子重排 此类反应较少 反应过程:
物化第十一章动力学(一)教案

第十一章 化学动力学基础(一)教学目标:1.使学生理解一些动力学基本概念2.掌握简单级数反应以及典型复杂反应的动力学特点。
3.理解并应用阿仑尼乌斯公式。
4.能用稳态近似、平衡假设等处理方法推导一些复杂反应的速率方程教学要求:1.掌握等容反应速率的表示法及基元反应、反应级数等基本概念。
2.对于简单级数反应,要掌握其速率公式的各种特征并能由实验数据确定简单反应的反应级数。
3.对三种典型的复杂反应,要掌握其各自的特点及其比较简单的反应的速率方程。
4.明确温度、活化能对反应速率的影响,理解阿仑尼乌斯公式中各项的含义。
5.掌握链反应的特点,会用稳态近似、平衡假设等处理方法。
教学重难点:反应的级数与反应的分子数,基元反应与非基元反应以及反应的速率的描述方法等;简单级数反应的动力学特征,几种典型复杂反应的动力学特征,温度对反应速率的影响(反应的活化能的概念),链反应的动力学特征以及动动学方程的推导方法。
11.1 化学动力学的任务和目的一、化学动力学与热力学的关系热力学:研究反应进行的方向和最大限度以及外界条件对平衡的影响,即研究物质变化的可能性。
动力学:研究反应进行的速率和反应的历程(机理),即研究如何把这种可能性变为现实性。
二、化学动力学的任务和目的1. 研究各种因素,包括浓度、温度、催化剂、溶剂、光照等对化学反应速率的影响; 2. 揭示化学反应如何进行的机理,研究物质的结构与反应性能的关系,了解反应历程可帮助了解有关物质结构的知识;3. 目的是为了能控制反应的进行,使反应按人们所希望的速率进行并得到所希望的产品。
三、化学动力学的发展简史11.2 化学反应速率表示法一、反应速率(描述化学反应进展情况)P R β→α β-=α--=ξ)0(n )t (n )0(n )t (n P P R Rdt )t (dn 1dt )t (dn 1dt d P R β=α-=ξdt d V 1r ξ=定容反应 dt dc 1r B B ν= 量纲:浓度·时间-1对于任意反应 eE + fF = gG + hHdt d[B]1dt d[H]h 1dt d[G]g 1dt d[F]f 1-dt d[E]e 1-r B ν=====(1)对气相反应)RT (r 'r dt dp RT 11r dtdp 1'r =⇒⎪⎪⎭⎪⎪⎬⎫⋅⋅ν=⋅ν=量纲:压力·时间-1(2)对多相催化反应二、反应速率的测定c~t1、化学方法:骤冷、冲稀、加阻化剂或除去催化剂2、物理方法:利用与物质浓度有关的物理量(如旋光度、电导、折射率、电动势、V、P、光谱等)进行连续监测,获得一些原位反应的数据。
分子重排反应

分子重排反应合作者:缪文文(20082823)江会剑(20082824)1.亲核重排1.Wagner-Meerwein重排属于分子内的亲核碳重排反应,实例:其结果是正常产物(I)仅有3%,而两种重排产物(II)和(III)共有92%。
原因是反应过程中,反应中间体碳正碳子发生了重排:脂肪族或脂环族伯胺与HNO2作用时,亦可发生此亲核碳重排反应。
2 .片呐醇重排(Pinacol重排)在无机酸作用下,连有羟基的碳原子上的烃基带着一对电子转移到失去羟基的正碳离子上,生成不对称酮的反应,称片呐醇重排:例如:正碳离子的形成和基团的迁移系经由一个正碳离子桥式过渡状态,迁移基团和离去基团处于反式位置。
迁移基团可以是烷基,也可以是芳基。
对于R1R2C(OH)-C(OH)R3R4取代基不同的片呐醇,其重排方向取决于下列两个因素:(1)失去-OH的难易;(2)迁移基团的性质和迁移倾向。
3. Beckmann重排醛肟及酮肟在酸性催化剂(如H2SO4、HCl、P2O5、POCl3、SO2Cl2等)作用下,发生重排转变为酰胺,称Beckmann重排。
其立体化学特征:不对称酮肟的重排为反式重排,例如:在迁移过程中,迁移基团原有的结构(如碳架、构型等)保持不变,例如:4 . Baeyer-Villiger重排酮类经过氧酸氧化,发生重排生成酯,称Baeyer-Villege重排。
常用的过氧酸有:H2SO5、MeCO3H、PhCO3H、HCO3和CF3CO3H等。
机理:对不对称酮而言,各种烃基迁移难易大致顺序如下:叔烷基>仲烷基~环烷基>苄基~苯基>伯烷基>环丙基>甲基(易)(难)例如:本反应是由酮合成酚的一种方法,如:5. 苯偶酰(Benzil)重排苯偶酰重排,又称苯甲酰重排:苯偶酰类化合物(即α-二酮类)在强碱作用下,发生分子内重排生成α-羟基酸的反应。
最著名的是二苯基乙二酮(苯偶酰)的重排如以代替,则产物为酯,如:2 亲核氮重排反应1 . Hofmann重排酰胺在碱性介质中用Cl2或Br2(NaOCl或NaOBr)处理,放出CO2变为减少一个碳原子的伯胺,此反应成为Hofmann降解重排。
分子重排WORD

1 Pinacol-Pinacolone Rearrangement 重排当片呐醇类在稀H2SO4存在下加热脱水时发生特殊的分子内部的重排反应生成片呐酮。
如用盐酸、草酸、I2/CH3COOH、CH3COOH等脱水-转位剂以代替H2SO4可得相同的结局:反应机理反应的关键是生成碳正离子:反应实例2 Wagner-Meerwein 重排当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱2 Wagner-Meerwein 重排当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱水反应中,常常会发生重排反应,得到重排产物:反应机理反应实例3 Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4 Hofmann 重排(降解)酰胺用溴(或氯)在碱性条件下处理转变为少一个碳原子的伯胺反应机理反应实例5 Baeyer-Villiger 反应酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的机理:过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
《分子重排反应》课件

III. 分子重排反应的机理
• 分子重排反应的机理涉及分子内、分子间的结构变化以及化学键的重组。 • 这类反应通常包括断裂原始键、形成新的共价键、转移原子或基团等
步骤。 • 具体反应机理的理解对于控制反应路径和提高反应效率至关重要。
IV. 分子重排反应的影响因素
1 1. 温度
温度对分子重排反应速率和选择性起着重要 作用,通常较高的温度会促进分子重排反应 的进行。
II. 分子重排反应的分类
1. 根据反应类型
分子重排反应可以根据不同 的反应类型进行分类,如醇 酯互变异构、氧杂环化、羰 基互变异构等。
2. 根据反应条件
分子重排反应也可以根据不 同的反应条件进行分类,如 酸催化、碱催化、高温条件 下发生的分子重排反应等。
3. 根据反应底物
分子重排反应还可以根据不 同的反应底物进行分类,如 环状化合物的分子重排反应、 链状化合物的分子重排反应 等。
VII. 分子重排反应与有机合成的关系
分子重排反应是有机合成中的重要环节,可以用于构建复杂分子结构和控制化学反应的选择性。
2
2. 药物合成
分子重排反应在药物合成中发挥着重要作用,可用于合成药物前体和改进药物性 能。
3
3. 新型材料制备
分子重排反应可用于制备新型材料,例如高分子材料、金属配合物等。
VI. 分子重排反应的实验方法
为了研究和实施分子重排反应,可以使用各种实验方法,如核磁共振(NMR)、质谱(MS)和红外光谱(IR) 等。
2 2. 反应物浓度
反应物浓度越高,分子重排反应的速率通常 会增加。
3 3. 催化剂
催化剂可以显著提高分子重排反应的速率, 并且可以排反应的进行和产物 选择性有重要影响。
高等有机化学——11、分子重排
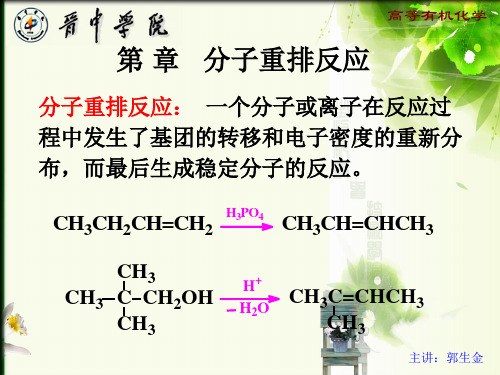
2. 负离子重排
3. 卡宾Carbene 、氮宾Nitrene重排 4. 周环重排反应 5. 自由基重排
主讲:郭生金
高等有机化学
缺电子重排:
CH3CH2CH2CH2OH
H CH3CH2CHCH2
CH3CH2CHCH3
H+
H+
CH3CH2CH2CH2OH2
H2O
CH3CH=CHCH3
富电子重排:
Ph CH2 O CH3
CH3 - + Ph CH O Li
PhLi C6H6
+ Ph CH O CH3 Li
H2O
CH3 Ph CH OH
主讲:郭生金
高等有机化学
自由基重排:
Cl Cl C CH=CH2 Cl Br
Cl Cl C CH CH2Br Cl
Cl Cl C CH CH2Br Cl
Br2
Br Cl Cl C CH CH2Br Cl
CH3 CH3 C CHCH3 CH3 OH
CH3 C CHCH3 CH3
ClH+
H+
CH3
CH3 -H2O C CHCH3 CH3 OH2
CH3 CHCH3
CH3
CH3 C CH3
CH3 C CH3
CH3 CHCH3
CH3
Cl CH3 C CHCH3 CH3
CH3C=C(CH3)2 CH3
主讲:郭生金
主讲:郭生金
高等有机化学
常用贝克曼重排来检验肟的构型。
Ph C N OH mp147℃
UV light Ph C N HO mp 117℃ C6H4OCH3
PCl5 Et2O, -10℃
第十一章_化学动力学基础(二)

第十一章化学动力学基础(二)通过本章学习理解碰撞、过渡态和单分子反应理论,了解一些特殊反应的动力学规律。
(一)基本要求和基本内容:基本要求1.了解化学反应动力学的碰撞、过渡态和单分子反应理论的基本内容,弄清几个能量的不同物理意义及相互关系。
2.了解溶液中反应的特点和溶剂对反应的影响。
3.了解快速反应所常用的测定方法及弛豫时间4.了解光化学反应和催化反应的特点。
重点和难点:过渡态理论中E c、E b、E0、ϑmrH#∆、ϑmrS#∆与Ea之间的关系:基本内容一、碰撞理论1.双分子的互碰频率2.硬球碰撞模型3.微观反应和宏观反应之间的关系4.反应阈能与实际活化能的关系5.概率因子二、过渡态理论1.势能面2.由过渡态理论计算反应速率3.E c、E b、E0、θmrH∆、θmrS∆与Ea和指前因子A之间的关系三、单分子反应理论四、在溶液中进行的反应1.溶剂对反应速率的影响2.原盐效应3.扩散控制反应五、快速反应的测试1.弛豫法2.闪光光解六、光化学反应1.光化学基本定律2.量子产率3.分子的能态4.光化反应动力学5.光化平衡和温度对光化学反应的影响6.感光反应、化学发光七、催化反应动力学1.催化剂与催化作用2.均相酸碱催化3.络合催化(配位催化)4.酶催化反应(二) 基本理论及公式1. 碰撞理论 ⑴ 要点① 反应物分子必须经过碰撞过程才有可能变成产物 ② 只有能量较大的活化分子的碰撞才能发生化学反映⑵ 计算公式① 不同种物质分子间的碰撞次数 [][]B A RTLdB dA Z ABπμπ222⎪⎭⎫ ⎝⎛+=② 同种物质分子间的碰撞次数 []2222A RTLd Z AA AA πμπ=③ 有效碰撞分数)e x p (RTE q C -= E C 为临界能,是基元反应所必需的能量。
④ 不同种分子间碰撞反应的速率常数⎪⎭⎫⎝⎛-=RT E M RTLd k C AB exp 82ππ ⑤ 同种分子间碰撞反应的速率常数⎪⎭⎫⎝⎛-=RT E M RTLd k C AA exp 22ππ ⑶ 解决的问题① 揭示了反应究竟是如何进行的一个简明﹑清晰的物理现象 ② 解释了简单反应速率公式及阿累尼乌斯公式成立的依据③ 解决了反应速率常数的求算问题 ④ 说明了Ea 与T 间的关系RT E E C a 21+=2. 过渡状态理论 ⑴ 要点反应物先形成不稳定的活化络合物,活化络合物与反应物之间迅速达成化学平衡,另一方面活化络合物转化为产物[]C B A C B A C B A +-→⋅⋅⋅⋅⋅⋅⇔-+≠⑵ 计算公式① 用统计热力学方法计算速率常数⎪⎭⎫ ⎝⎛-⋅⋅=∏≠RT E f f hT k k BBB 0'exp② 用热力学方法计算速率常数 (ⅰ) ()()⎪⎪⎭⎫ ⎝⎛∆-⋅⋅=≠-ΘRT G Ch T k k l nB exp 1 或,≠⋅=C B K h Tk k 或,()⎪⎪⎭⎫⎝⎛∆-⋅⎪⎪⎭⎫⎝⎛∆-⋅⋅=Θ≠-ΘRT H R S ChT k k m r mr nB exp exp 1 (ⅱ) ⎪⎪⎭⎫⎝⎛∆-⋅⎪⎭⎫⎝⎛⋅=≠-RTG RT P h T k k PnB exp 1 或 ⎪⎪⎭⎫⎝⎛∆-⋅⎪⎪⎭⎫⎝⎛∆-⋅⎪⎭⎫⎝⎛⋅=Θ≠-RT H RS RT P h T k k P r Pr nB exp exp 1 ③ 几个能量及其关系 (ⅰ) RT E EC a 21+=Ea 活化能,Ec 分子发生有效反应所必须超过的临界能 (ⅱ)mRT E E a +=0E 0 活化络合物的零点能与反应物零点能之差式中m 包括了普适常数项中及配分函数项中所有与T 有关的因子,对一定的反应体系,m 有定值。
分子内重排

分子内重排摘要:一、引言二、分子内重排的定义与分类三、分子内重排的反应机制1.亲核重排2.自由基重排四、分子内重排的应用1.有机合成2.材料科学3.生物医学五、分子内重排的发展趋势与挑战六、总结正文:一、引言分子内重排是一种在分子内部发生的化学反应,通过原子、离子或自由基的重新排列,形成新的化学键或化学键断裂,从而改变分子的结构。
分子内重排广泛存在于有机化合物、生物大分子和材料科学中,对于许多化学反应和生物过程具有重要意义。
二、分子内重排的定义与分类分子内重排是指分子内部发生的重排反应,通常涉及原子、离子或自由基的重新排列。
根据反应中涉及的化学键的类型,分子内重排可分为亲核重排和自由基重排。
三、分子内重排的反应机制1.亲核重排亲核重排是指分子内部的一个亲核试剂攻击另一个分子部分,导致原子或离子的重新排列。
在此过程中,亲核试剂与目标分子部分形成新的化学键,同时原有化学键断裂。
亲核重排通常发生在具有不稳定结构的分子中,例如亚胺、腈和叠氮化合物等。
2.自由基重排自由基重排是指分子内部的一个自由基中间体通过自身重排,形成新的化学键或化学键断裂。
自由基重排通常发生在具有较高活性的分子中,例如卤代烃、醇和羧酸等。
四、分子内重排的应用1.有机合成分子内重排在有机合成中具有广泛应用,例如通过分子内重排可以实现醇的转化、卤代烃的官能团化以及环化反应等。
2.材料科学分子内重排可以影响材料的结构和性能,因此在材料科学中具有重要意义。
例如,分子内重排可以用于制备具有特定性能的聚合物材料和功能化材料。
3.生物医学分子内重排与生物医学领域的许多过程密切相关。
例如,酶促反应中的分子内重排可以调节生物体内的代谢途径;药物分子中的分子内重排可以影响药物的生物活性、稳定性和药代动力学性质。
五、分子内重排的发展趋势与挑战随着研究的深入,分子内重排的反应机制、应用和调控策略不断得到拓展。
未来,研究人员将继续探索新的反应方法、催化剂体系和调控策略,以实现对分子内重排的高效、可控和可持续应用。
分子重排

亲核重排反应
重排过程,Z带着一对电子从原子C迁移到另一个缺 少一对电子的原子A上。 多数亲核重排是1,2-重排,即 基团的迁移发生于相邻的两个原子间。上式中,A为C、 N、O等原子,而Z为X、O、S、N、C、H等原子。 重排后的分子与反应体系的负性部分结合生成重排取代 产物或失去质子生成重排消除产物。
反应机理
反应实例
Cope(考普)重排反应
1,5二烯类化合物受热时发生类似于 O-烯丙基重排为 C-烯丙基的重排反应 (Claisen 重排)反应称为Cope重排。这个反应30多年来引起人们的广泛注意。1,5二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
反应机理:Cope重排是[3,3]σ-迁移反应,反应过程是经过一个环状过渡 态进行的协同反应. 在立体化学上,表现为经过椅式环状过渡态:
分子重排分类
按分子内及分子间重排分类 分子内重排 分子间重排
按反应历程分类 亲核重排、亲电重排、游离基重排和σ键的迁移重排
按迁移基团的相对位置分类 1,2—迁移重排、1,3—迁移重排、1,5—迁移重排 以及3,3—迁移重排等
按不同元素间的迁移分类 C→C、C→O、O→C、N→O重排
将羧酸制成不稳定的酰基叠氮,后者在惰性溶剂中加热 发生脱氮重排析离出中间体异氰酸酯,再经水解得到伯胺, 此反应称Curtius重排反应,过程:
反应机理:
反应实例
Schmidt(施米特)重排
羧酸、醛或酮分别与等摩尔的叠氮酸(HN3)在强酸(硫酸、 聚磷酸、三氯乙酸等)存在下发生分子内重排分别得到胺、 腈及酰胺
③亲核性强的那个基团优先发生迁移。
④Pinacol (频哪醇)重排,其立体特征是迁移基团在连 接离去基团的键完全断裂之前从离去基团的背面连 接到迁移末端,因此优先迁移的基团应与反应基质 分子的离去基团处于反式共平面,而且迁移终点 (具有手性中心的)构型往往发生反转。
第十一章-自由基和光化学反应

> CH3CH2 > CH3 >
乙基自由基 甲基自由基 苯基自由基
•影响自由基稳定性的因素是很多的,如: 电子离域,空间阻 碍,螯合作用和邻位原子的性质等;
11.1.2 自由基的产生
热均裂产生
O
O
CH3CO OCCH3
55 - 85oC
C6H6
O CH3CO
辐射均裂产生
Br
Br
光
25oC
2Br
单电子转移的氧化还原反应产生
在吸收光子后,被激发到 空轨道上的电子,如果仍保 持自旋反平行状态,则重度 未变,按其能量高低可相应 表示为S1态S2态……。
当处于S0态的一对电子吸收光子受激后,产生了 在两个轨道中自旋方向平行的电子,这时S=1,M=3, 这种状态称为三重态或三线态。
因为在磁场中,电子 的总自旋角动量在磁场 方向可以有三个不同值 的分量,是三度简并的 状态,用T表示。按能 量高低可表示为 T1,T2……激发态。
应
N2+
-N2
机
-苯基肉桂酸的重氮盐
COOH
COOH
理
-H.
H
11.3.2 自由基加成反应
烯烃受自由基进攻而发生的加成反应称为自由基加 成反应。
CH3CH=CH2 + HBr 过氧化物 或 光照 CH3CH2CH2Br
反应机理
引发:
OO C6H5COOCC6H5
O 2C6H5CO
O
O
放热
C6H5CO + HBr
链引发 链增长
链终止
hv Cl2
CH4 + Cl
2Cl
CH3 + HCl
H= 7. 5kJ/mol Ea=16.7 kJ/mol
有机化学分子重排
(2)重排方向及产物
A.羟基脱去的难易取决于碳正离子的稳定性
Ph CH3
Ph CH 3 C6H5 C C CH3 OH OH
C6H5
H
C OH
C CH3
+
+
Ⅰ
-H2O
Ph CH3 C6H5 C
+
C CH3 OH
Ⅱ
碳正离子稳定性Ⅱ>Ⅰ 所以首先生成Ⅱ。
B.基团迁移的活性取决于基团的亲核性
一般规律:
H
+ N2
+
R H H O H
H
反式迁移
H R H H OH NH2 HNO2 R H H
H R C O
H
+ OH
N2
- N2
H R H H
+
C O H
-H+
(二)迁移到缺电子的氮原子
1.贝克曼(Beckmann)重排
OH
O R C R′ NH2OH
OH H R C N OH R′
2
N R
N R C R′
H
+
H3C
CH3 CH3 C C CH3
CH3 C CH3
OH OH
-H2O
OH +OH H
重 排
H3C C
+
+
: OH CH3
-H
+
H3C
CH3 C C CH3 CH3 O
注意:
• R:脂肪烃基、脂环烃基、芳基; 可各不相同,也可部分相同或全同。 问题: 如果R为4个不同的基团时: ① 哪个羟基先被H+进攻,再失水生成C+? ② 与C+相邻的基团中哪个基团先转移? ③ 反应的立体化学要求。
西药一第十一章第一节知识梳理
西药一第十一章:常用药物结构特征与作用第一节:精神与中枢神经系统疾病用药镇静与催眠药苯二氮卓结构苯二氮卓构效关系A环:苯二氮卓A环上7位引入吸电子取代基时,药物活性增强,吸电子越强,作用越强;N O2>Br>CF3>Cl硝西泮、氯硝西泮强于地西泮B环:地西泮体内代谢时3位上引入羟基可增强其分子的极性,易于葡萄糖醛酸结合排出体外。
3位羟基的药物奥沙西泮C环:5位上环苯取代时产生药效的重要基团之一,无苯基则无镇静催眠活性5位苯环上的2位引入体积小的吸电子基团,如F、Cl可增强活性氟西泮氟地西泮代表药物硝西泮结构性质:1,2位,4、5位可水解开环,不稳定代谢:1位去甲基3位羟基化作用靶点G ABA受体(r-氨基丁酸)地西泮奥沙西泮氟西泮1,2位并入三氮唑三唑仑1,2位并上三氮唑环按第一类神经药品管理艾司唑仑阿普唑仑非苯二氮卓类咪唑并吡啶类唑吡坦吡咯酮类佐匹克隆右旋异构体:艾司佐匹克隆抗癫痫药物巴比妥类结构巴比妥酸结构构效巴比妥酸本身无治疗作用,当5位上的两个氢原子被烃基取代呈现活性苯巴比妥弱酸性,PKa为7.4;与液体相当酰脲结构,易水解,苯巴比妥钠制成粉针剂环丙二酰脲(又称巴比妥酸)的衍生物苯妥英钠精I,需TDM,大发作水溶液呈碱性,吸收CO2,浑浊酰胺结构易水解,粉针剂具有“饱和动力学”特点二苯并氮卓类卡马西平经CYP3A4代谢成活性产物卡马西平-10,11-环氧化物作用:癫痫大发作奥卡西平活性代谢物:10-羟基奥卡西平抗精神病药构效关系结构式吩噻嗪类药物基本结构构效关系吩噻嗪类药物的2位引入吸电子基团时可增强活性三氟丙嗪的作用活性为氯丙嗪的4倍;氯丙嗪2位氯被吸电子作用更强的三氯甲基取代,抗精神病活性增强2位乙酰基取代可降低药物的毒性和副作用乙酰丙嗪作用弱于氯丙嗪,但毒性也较低吩噻嗪母核的氮原子{10位}的取代基对活性影响很大,10位氮原子为叔胺,也可为氮杂环;以噻嗪取代侧链作用最强奋乃静,氟奋乃静酚噻嗪环上10位氮原子用碳原子取代得到噻吨类又称:硫杂蒽类药物分类吩噻嗪类盐酸氯丙嗪又称“冬眠灵”用于精神分裂症、躁狂症;镇吐、强化麻醉机制;阻断脑内多巴胺受体吩噻嗪环易被氧化,产生光过敏;奋乃静哌嗪取代侧链其他三环类氯氮平二苯并二氮卓类主要代谢产物去甲基氯氮平氯氮平-N—氧化物氯普噻吨噻吨类又称硫杂蒽类药物顺式异构体活性大于反式异构体利培酮利用骈合原理设计的非经典抗精神病药高选择性5-HT2/DA2受体拮抗剂,椎体外系副作用小适应与各种精神分裂症,对焦虑和抑郁症有效口服吸收完全,代谢物有活性代谢产物帕利哌痛N-去羟基衍生物两者均具有抗精神病活性抗抑郁药去甲肾上腺素重摄取抑制剂二苯并氮卓类丙米嗪利用生物电子等排原理体内代谢产物是地昔帕明去甲上腺素重摄取抑制剂氯米帕明丙米嗪2位引入氯原子,具有起效快的特点,同时还能抗焦虑代谢:生成活性的代谢产物去甲氯米帕明二苯并环庚二烯类多赛平E型和Z型异构体的混合物给药Z型抑制5-羟色胺重摄取的活性强E型抑制去甲肾上腺素重摄取的活性优盐酸阿米替米去甲基代谢产物去甲替林,有活性对日光敏感,易被氧化5-羟色胺重摄取抑制剂氟西汀选择性的中枢5-HT重摄取抑制剂口服吸收完全代谢产物去甲氟西汀,有活性排泄缓慢,肝肾疾病患者慎用舍曲林两个手性中心口服生物利用度低,食物能促进其吸收,提高生物利用度代谢产物N-去甲舍曲林有活性文拉法辛去甲基代谢产物,有活性5-羟色胺-去甲肾上腺素重摄取抑制剂西酞普兰去甲代谢产物,有活性西酞普兰的S对映体艾司西酞普兰盐酸帕罗西汀两个手性中心生物利用度不受抗酸药物或食物的影响镇痛药作用于阿片受体的镇痛药天然生物碱盐酸吗啡5个环,5个手性中心有效的吗啡构型左旋吗啡酸碱两性光照变质生成伪吗啡和N-氧化吗啡毒性增大酸性脱水并分子重排生成阿扑吗啡催吐作用6位羟基发生葡醛酸结合,结合物活性高3位葡萄糖醛酸结合广泛,因此口服生物利用度低,制成注射剂或缓释剂N-脱甲基反应去甲吗啡镇痛作用强,还有镇静作用吗啡类似物可待因吗啡3位羟基甲基化作用镇痛活性为吗啡的1/10,具有较强的镇咳作用盐酸纳洛酮N-甲基被烯丙基取代阿片受体的纯洁抗剂吗啡过量的解毒剂合成镇痛药哌啶类(4-苯基哌啶)盐酸哌替啶4-苯基哌啶类u受体激动剂代谢产物去甲哌替啶代谢慢,蓄积,引发癫痫,不推荐用于慢性疼痛枸橼酸芬太尼氨基酮类亲脂性高,易透过血-脑屏障氨基酮类盐酸美沙酮氨基酮结构u受体激动剂作为海洛因等成瘾造成的戒断症状治疗其他合成镇痛药盐酸布桂嗪盐酸曲马多微弱的u受体激动剂两个手性中心临床用外消旋体第二节:解热。
化学生物学 第十一章 生物代谢

糖原合成的途径
2,糖异生作用
糖异生作用是指从非糖物质转化为葡萄糖和糖原 的过程。糖异生作用由肾上腺皮质激素促进,主 要是在肝脏中进行,其途径基本上是糖酵解途径 的逆过程。
在糖酵解中有三个酶催化的反应是不可逆的,因 此,这三个逆反应需要由不同的酶催化进行。由 己糖激酶和磷酸果糖激酶所催化的两个反应的逆 反应,是由两个特异性的磷酸酶(磷酸酯酶)水 解磷酸酯键完成的。而由丙酮酸激酶催化的反应, 其逆反应包括两个反应,分别由丙酮酸羧化酶和 磷酸烯醇式丙酮酸激酶催化。
反应(6)
3-磷酸甘油醛在磷酸甘油醛脱氢酶催化下脱氢 氧化生成1,3-二磷酸甘油酸。此反应是在NAD+ 和磷酸存在下进行的,NAD+是脱氢反应的氢受 体,磷酸起分解硫酯键和形成新高能磷酸酯键作 用。
反应(7)
1,3-二磷酸甘油酸与ADP作用生成3-磷酸 甘油酸和ATP
反应(8)
3-磷酸甘油酸的变位反应,催化这一反应 的酶是磷酸甘油酸变位酶,变位的产物为 2-磷酸甘油酸。
然后,以糖原为引物,在糖原合成酶催化下,UDP-葡萄 糖中的葡萄糖以-1,4-糖苷键与引物相连,生成比引物糖 原多一个葡萄糖残基的多糖。通过不断的循环,即可得到 大分子量的糖原。
此过程合成的-1,4-葡萄糖多聚体再在分枝酶作用下,发 生4 6 糖苷键转移,形成具有1, 6-糖苷键的有分枝的糖 原。
1.糖酵解
糖酵解在细胞胞液中 进行(无氧条件), 是葡萄糖经过酶催化 作用降解成丙酮酸, 并伴随生成ATP的过 程。 它是动物、植物和微 生物细胞中葡萄糖分 解的共同代谢途径。
糖原的磷酸化
• 细胞内糖原在磷酸化酶和脱枝酶催化下形 成1-磷酸葡萄糖
反应(1)
催化该反应的酶为磷酸己糖激酶。凡是能够催化 ATP的磷酰化反应的酶称为激酶。激酶一般需要 Mg2+或其它二价金属离子激活。
第十章 分子重排反应

反应特点:与羟基处于反位的烃基迁移至N 上。
立体化学:迁移基含手性碳时,产物构型保持。
四、由碳原子迁移至氧原子的重排 Baeryer – Villiger (拜依尔-维利格) 重排(氧化) 酮 + 过氧酸 → 酯 常用过氧酸: CF3CO3H , C6H5 CO 3H , C6H5 CH2 CO3H
脂肪族重氮盐分解放氮发生重排生成醇,该 重排叫Demjanov(捷米杨诺夫重排),也可看作 瓦-梅重排的一种。
不同基团的迁移倾向:
CH3O > R3C > R2CH > >CH3 > Cl >H
O C H 3 O C H 3 C H 3 C H 3 C l
> CH2
CH
迁移倾向:500
15.7
1.95
1
0.7
0.3
●芳基中:对位及间位有供电基,迁移倾向增大; 邻位有供电基,迁移倾向降低; 凡有吸电基,则迁移倾向减小
苄基正离子比叔碳正离子稳定,不发生重排
环张力大小也是发生重排的推动力(如: 三、四元环重排为五元环、六元环)
2、频哪醇(Pinacol)重排 三或四取代的(1,2-二醇),频哪醇 邻二叔醇(Pinacol) →
①形成缺电子体系(C +, C : , - N: ….) ②迁移基团带一对电子与缺电中心结合 ③迁移始点与亲核试剂结合 有时只是两步或三步同时进行。
一、碳正离子重排 1、碳正离子的形成 ①碳碳双键的加成:
R2C=C R2 + H+ →R2 CH – C+R2
②SN 1 , E 1 :
R3C- L →R3 C + + LROH + H+ →RO+ H2→ R+ + H2O
第十一章 有机反应中间体

2)反应中心的立体化学得以保留
3)可生成分子重排产物
可发生邻基参与的几种情况: 1)σ-参与作用 外型和内型降冰片醇的对溴苯磺酸酯(2-OBs) 的醋酸解速度比为350倍。
HOAc OBs
外型
HOAc OAc OBs 内型
1,6- σ键的协助作用
2)n-参与作用
离去基团的邻位或更远位带有未共用电 子对的原子(团)时,所体现的参与作用, 有立体构型保留现象。
空的 p 轨道 易于溶剂化
C
CH3
溶剂
2、碳正离子的生成 1) 直接离子化 通过化学键的异裂而产生。
RX
Ph CH Cl Ph
R
X
Ph2CH Cl
R OH
H
ROH2
R
H2O
2) 对不饱和键的加成
C Z H C ZH
Z: O,C,S,N
C C
HCl
H
C C
Cl
C O
C OH
C OH
3) 由其它正离子转化而生成
NaNO3 2 NH2 NaNO
HCl
N2
N2
4) 在超酸中制备碳正离子溶液 比100%的H2SO4的酸性更强的酸-超酸 (Super acid)
常见的超酸 HSO3F (氟硫酸) HSO3F - SbF5 (魔酸) HF-SbF5
与100%H2SO4的酸性比较 1000倍 103倍 1016倍
叔丁醇在下列条件下完全转变成叔丁基正离子:
3、卡宾的反应 单线态卡宾同时具孤电子对和空轨道,具有 碳负离子和碳正离子的特征; 三线态卡宾相当于一个双自由基
按参与的反应特征将卡宾分为三种类型: (1)亲电性卡宾:
(2)亲核性卡宾:
分子重排

分子重排反应
X -X Y Y
当 R基 是 吸 引 电 子 基 时 反 应 速 度 加 快 ,
§1 反应机理及相关问题
在化学反应过程中,原子或官能
团从碳链的一个位置转移到另外一个
位置的过程称为分子重排。分子重排
前后化合物的分子结构发生了变化, 但是分子组成不一定有变化。
§1 反应机理及相关问题
4.联苯胺重排
联苯胺重排
H N H N H N H N
H
H
4.联苯胺重排
没有发现交叉产物,分子没有断裂成两 个离子,只发生分子内重排。
CH 3 NH H 3C NH H 3C H2 N CH 3 NH 2
Et NH NH
Et H2 N
Et
Et NH 2
CH 3 NH NH
Et
x
4.联苯胺重排
机理:
C C O
R
C H
OH OH
碳正离子重排机理
(1)形成碳正离子
R C OH R H C OH R
-
H C OH
H H 2O C OH 2
H C
C OH
碳正离子重排机理
(2)基团发生迁移
R C OH H C C OH H C R
碳正离子重排机理
(3)通过消除形成羰基
H C OH C R -H C O H C R
XCH 2 H -X H 2C H H H OH OH
H CH 2 X -X OH H CH 2 H H OH H
H
5.基团迁移的距离 多数情况下是1,2位迁移。 在特殊化学结构中可发生“远距离”迁移。
OT S Ph Ph
-
Ph
Ph
Ph Ph
生物化学(第三版)第十一章 维生素与辅酶课后习题详细解答_ 复习重点

第十一章维生素与辅酶提要维生素是维持生物体正常生长发育和代谢所必需的异类微量有机物质,不能由机体合成,或合成量不足,必须靠食物供给。
由于维生素缺乏而引起的疾病称为维生素缺乏症。
维生素都是小分子有机化合物,在结构上无共同性。
通常根据其溶解性质分为脂溶性维生素和水溶性维生素两大类。
脂溶性维生素由维生素A、D、E、K等,水溶性维生素有维生素B1、B2、B6、B12、烟酸、烟酰胺、泛酸、生物素、叶酸、硫辛酸和维生素C等。
现已知绝大多数维生素作为酶的辅酶或辅基的组成成分,在物质代谢中起重要作用。
维生素A的活性形式是11-顺视磺醛,参与视紫红质的合成,与暗视觉有关。
此外维生素A还参与糖蛋白的合成,在刺激组织生长分化中也起重要作用。
维生素D为类淄醇衍生物,1,25-二羟维生素D3是其活性形式,用以调节钙磷代谢,促进新骨的生成与钙化。
维生素E是体内最重要的抗氧化剂,可保护生物膜的结构和功能,维生素E还可促进血红素的合成。
维生素K与肝脏合成凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ有关,作为谷氨酰羧化酶的辅助因子参与凝血因子前体转变活性凝血因子所必须的。
除维生素C外,水溶性维生素主要为B族维生素,以辅酶和辅基的形式存在,参与物质代谢。
硫胺素的辅酶形式为硫胺素焦磷酸(TPP),是α-酮酸脱羧酶、转酮酶及磷酸酮酶的辅酶,在α-裂解反应、α-缩合反应及α-酮转移反应中起重要作用。
核黄素和烟酰胺是氧化还原酶类的重要辅酶,核黄素以FMN和FAD是形式作为黄素蛋白酶的辅基;而烟酰胺以NAD+和NADP+形式作为许多脱氢酶的辅酶,至少催化6种不同类型的反应。
泛酸是构成CoA和ACP的成分,CoA起传递酰基的作用,是各种酰化反应的辅酶,而ACP与脂肪酸的合成关系密切。
磷酸吡哆醛是氨基酸代谢种多种酶的辅酶,参加催化涉及氨基酸的转氨作用,α-和β-脱羧作用,β-和γ-消除作用,消旋作用和醛醇裂解反应。
生物素是几种羧化酶的辅酶,包括乙酰CoA羧化酶和丙酮酸羧化酶,参与CO2的固定作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+ +
OH2 O
OH2 O
OH
OH
发生反应的位置
质子先进攻哪个羟基?
H
H
C OH
C OH
CH3
H
C O
C
CH3
推电子基所在的碳原子上的羟基。
发生反应的位置
不对称的取代乙二醇中,两个羟基中电子云密度大 的那个首先质子化。
C CH2OH
H+
_
_
H+
C CHO H 主要
H+
R' C N
O C N R
R' H
R
Ph C N
CH3 OH
PCl5 ethyl ether
O C N Ph
CH3
H
The group opposite to hydroxy will shift
Beckmann Rearrangement(反应实例)
§2 几个典型的重排反应
1、碳正离子重排
应。同位素标记发现,支链上双键位置发生了变化。
1 1 O 2 2 O * H+
OH *
3 *3 △
O
1 1 * 2 2 3 H
O H+ *
OH
3
*
克莱森重排
经历了六元环中间体,发生分子内重排。
O C C C* O C C C* HO C C C*
同位素标记发现,支链上双键位置发生了变化。
克莱森重排
OCH3
基团迁移的顺序——亲核性强者优先
OCH3 CH3 CH3 Cl OCH3
>
>
>
>
>
芳香基的相对迁移倾向 500 15.7 1.95 1.00 0.7 0.3
迁移倾向:芳基 >烷基>氢
§2 几个典型的重排反应
1、碳正离子重排
(2)Beckman重排
R
C N
CH3 OH
O R
C N
CH3 H
(3).瓦格纳—梅尔外因重排 首先是在双环萜类化合物的化学
反应过程中发生的,价键从碳链的一
个位置转移到另外一个位置形成新的
环状结构。后来在脂肪族醇中也发现
类似重排反应。
瓦格纳—梅尔外因重排
OH
-- OH
莰醇
+ OH
OH
- H2O
莰烯
1、经过正离子重排
瓦格奈尔-梅尔外英(Wagner-Meerwein)重排 在这些经过碳正离子的重排中,一般为反式迁移, 基团迁移的活泼性顺序大致为:
[3,3]-σ 迁 移
2、σ-迁移反应 • ——库伯(Cope)重排 :1,5-二烯烃经过六元
环过渡态的骨架重排
• 当1,5-己二烯的3,3’位上有取代基时,重排反应将 导致从单取代双键转化为多取代双键
HO HO O H
§2 几个典型的重排反应
2、δ键迁移重排-Claisen重排
烯丙基芳基醚受热转变成为邻(对)烯丙基酚类的反
§2 几个典型的重排反应
4、经过乃春的重排 • 经过Nitrene的重排
• ——
Hoffmann重排:酰胺重排成胺
O R C NHBr O R C NBr
O R C NH2
NaOH Br2
OH
-Br
O R C N
R N C O
H2O
R NH COOH
CO2
+
RNH2
Hofmann 降解反应(霍夫曼重排) 酰胺
CH3
重排
H+
CH3 CH3 CH3 C C CH3 H2O OH
CH3 CH3 CH3 C C CH3 CH3OH
H2O
CH3 CH3 CH3 C C CH3 OH
CH3 C
C
CH3OH CH3
CH3 C
H+
C
CH3
CH3O
碳正离子重排机理
CH3 C CH2OH CH3 H
+
CH3
CH3
CH3 C CH2OH2 CH3
类似的重排也发生在脂肪族化合物上,称为
cope重排,也称为3,3` σ 迁移。
1 2 3 1 2 3
CH2 CH2 , 1
CH CH , 2
CH2 CH2 , 3
CH2 CH2 , 1
CH CH , 2
CH2 CH2 , 3
同位素标记发现,双键位置发生了变化。
3.联苯胺重排
联苯胺重排
H N H N H N H N
C CH2OH OH
H2O
_
C CH2
H+
OH
C CH2 O 次要
基团迁移的顺序
R C OH
H C
哪个基团先迁移?C6H5还是R?
基团迁移的顺序——反应事例 1
CH3 CH3 H C OH C OH
CH3 CH3 C O C
基团迁移的顺序——反应事例 2
OCH3 OCH3 OCH3
H C OH C OH C O C
O R C N H Br
OH
O R C N Br
-Br
O C
N
R
第三步:异氰酸酯碱催化下水解
R N C O
H2O
OH
H R
O
R N C OH
NH2 + CO3 + H2O
脱去CO2,生成伯胺 该反应需N上未取代的酰胺作底物
Hofmann 降解反应(霍夫曼重排)
反应实例
OCH3 NH2
没有
NH
3.重排的方式 判断方法
(1)加入其他化合物,看产物变化 (2)观察产物的种类,看有否交叉产物
(3)立体化学的研究,看手性碳变化
4.重排的动力与方向
从不稳定结构趋向稳定结构!
4.重排的动力与方向 (1)伯碳
CH3CH2CH2CH2 F
仲碳
-F
叔碳
CH3CH2CH2CH2 (CH3)3C
第十 一章
分子重排反应
X -X Y Y
当R基是吸引电子基时反应速度加快,
§1 反应机理及相关问题
在化学反应过程中,原子或官能
团从碳链的一个位置转移到另外一个
位置的过程称为分子重排。分子重排
前后化合物的分子结构发生了变化, 但是分子组成不一定有变化。
§1 反应机理及相关问题
X C C H C H C C X C 1,2位重排
酮肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化
磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下重排成 为酰胺。R的手性保持,证实是分子内重排。
Beckmann Rearrangement
迁移基团如果是手性碳原子,则迁移前后手性构型不变
Beckmann Rearrangement
R C N OH R'
HO
- AgBr
H C C OH H C C OH H C C OH
H C R H C R H C R
C O H C R
C
OH H C NH2 H C Br
C OH
1、经过正离子重排-片呐醇(Pinacol)重排
反应经过了一个邻基参与的三元环状碳正离子,因 此重排基团和离去的质子化羟基处于反式位置。
3.重排的方式
分子间重排 —— 连氮化合物重排
N N NH HCl N2 + NH2
OH
N
N OH
有此产物
N
N
NH2
3.重排的方式
分子内重排 —— 联苯胺重排
OEt NH EtO NH H EtO H2N OEt NH2
OCH3 NH
CH3O NH
OEt
H
CH3O H2N
CH3O NH
Cl
-
H2O
Cl C CH2CH3 CH3
CH3
CH3 C CH2 CH3
CH3
CH3 C CH2CH3 CH3
H+
CH3C=CHCH3 CH3
3、重排反应方式
按照分子内或分子间进行分为: 分子内重排——发生重排的原子或原子团始终没有 脱离原来的分子 分子间重排——迁移的原子或原子团在没有重排到 新的位置前,就完全与原来的分子脱离 以上两种历程可以通过不同底物的交叉实验得以判 别
+
CH3 CH3 C C CH3 +OH CH3
H+
CH3
支持本机理的反应现象
碳链上有+I和+C基团时可以加速反应 类似结构能够生成同样产物——因为 生成同样的碳正离子中间体。
用四氢噻酚捕捉到碳正离子中间体。
R C OH R C OH R C OH
H C
-
R H H2O OH R HNO2 C OH R Ag
CH3CH2CHCH3
4.重排的动力与方向 (2)最稳定构像中的合适位置
R R R C C X -X R R R C C R R C C R
4.重排的动力与方向 (3)形成非经典碳正离子
C C C C C C
5.基团迁移的距离 多数情况下是1,2位迁移。 在特殊化学结构中可发生“远距离”迁移。
OOCR
H2O
OH
[H]
O
羧酸异龙脑酯
异龙脑(冰片)
樟脑
§2 几个典型的重排反应
2、δ键迁移重排-Claisen重排、Cope重排
σ 键迁移反应叫σ 重排反应。是指共轭体系: σ 键从一端迁移 到另一端
Y 1
1 2 2 3 3
