不同标准溶液不同浓度温度补正值
不同温度下标准滴定液的体积补正值培训内容

不同温度下标准滴定液的体积补正值培训内容篇一《不同温度下标准滴定液体积补正值,这事儿得弄明白》嘿,咱今儿来唠唠这不同温度下标准滴定液的体积补正值。
这事儿啊,听起来有点绕,其实呢,就跟咱日常生活里有些事儿挺像的。
我就给你们讲讲我亲身经历的一件事儿,你们就明白了。
有一回,我跟着师傅在实验室做实验,那实验啊,就得用到标准滴定液。
当时我们忙得那叫一个热火朝天,可谁知道这温度啊,就跟个调皮的小鬼似的,一会儿高一会儿低。
咱一开始也没太当回事儿,就按照平常的量加那滴定液。
结果呢,出问题啦!那实验数据啊,跟平时差得可不是一星半点。
我们几个就跟丈二和尚摸不着头脑似的,反复检查步骤,觉得哪都没错啊。
后来师傅一拍脑袋,说:“哎呀,忘了这温度对标准滴定液体积有影响啦!”原来啊,这标准滴定液就跟人似的,温度一变化,它那“体积脾气”也跟着变。
就好比夏天的时候,人穿得少,活动范围感觉就大一些;冬天穿得多,就觉得哪儿哪儿都紧巴巴的。
这滴定液啊,温度高的时候体积会变大一点,温度低的时候呢,体积就会变小一点。
所以啊,咱就得根据不同温度来给它算一个体积补正值,就跟给它量身定制一套衣服似的,得让它在各种温度下都待得舒服,这样咱的实验结果才准呐。
比如说,当时我们那个实验,温度比平常高了好几度,如果不把这体积补正值算进去,那加的滴定液就多啦,这数据肯定就不准啊。
从那以后,我算是深深地记住了这不同温度下标准滴定液体积补正值的重要性。
每次做实验前,我都先瞅瞅那温度计,心里默默算一下这补正值该咋加,可不敢再粗心大意啦,不然啊,又得被实验数据给“坑”一回咯。
篇二《掌握不同温度下标准滴定液体积补正值,不再“踩坑”》咱接着说说这不同温度下标准滴定液体积补正值的事儿。
我再给你们讲一个小插曲。
有次啊,新来的一个同事负责做一个滴定实验。
这小伙儿啊,那是干劲十足,一副信心满满的样子。
可等他把实验数据拿出来的时候,我们都愣住了,这数据怎么跟预期差那么多呢?我们就凑过去看他的操作过程,发现他在加标准滴定液的时候,根本就没考虑温度的影响,也没算那体积补正值。
标准溶液温度补正值

标准溶液温度补正值
标准溶液温度补正值是指在实验室中,为了校正溶液温度对化学反应和物质性质的影响,需要将标准溶液的温度调整到室温(一般为25℃)。
这是因为许多化学反应和物质性质会随温度变化而变化,因此需要在同一温度下进行比较。
标准溶液温度补正值的大小取决于溶液的性质和温度变化的大小。
一般来说,标准溶液温度补正值可以通过以下步骤获得:
1.选择一个标准溶液,例如NaOH、KOH、HCl等。
2.测量溶液的温度,并记录下来。
3.根据溶液的性质和温度变化的大小,计算出标准溶液温度补正值。
4.将计算出的标准溶液温度补正值与室温下的标准值进行比较,得到校正后
的值。
标准溶液温度补正值对于实验室工作非常重要,因为它可以帮助研究人员在校准仪器、测定化学反应速率、比较不同实验数据等方面获得更准确的结果。
同时,它也是实验室质量保证和质量控制的重要环节之一。
在实验室中,一般会使用专门的温度计来测量溶液的温度,并使用在线计算软件或表格来计算标准溶液温度补正值。
这些软件或表格通常会根据不同的溶液和温度范围提供不同的补正值,以确保结果的准确性。
总之,标准溶液温度补正值是实验室中非常重要的一个环节,它可以帮助研究人员获得更准确的结果,提高实验的可比性和可重复性。
标准溶液

目录一、配制标准溶液用试剂的技术要求二、标定用基准试剂的技术要求三、标定标准溶液的原则四、标定标准溶液的误差要求五、标准溶液的浓度表示规定六、标准溶液的贮存、保管规定七、不同标准溶液浓度的温度补正值八、几种标准溶液的制备一、配制标准溶液用试剂的技术要求:1.配制标准溶液所用的水,在没有注明其它要求时,应符合GB6682中三级水的规格。
2.配制标准溶液所用试剂应在分析纯以上,工作中所用天平砝码、滴定管容量瓶及移液管需定期校正。
3.配制标准溶液所用试剂应易溶于水,配成的溶液也应是稳定,如保存时挥发和起其他付反应的试剂就不能用来配制标准溶液。
二、标定用基准试剂的技术要求:1.作为基准物质的纯度必需符合要求,一般含量要求在99.9%以上。
2.基准试剂无论是固体还是液体,其保存时应稳定,易挥发和风化的物质不能做基准试剂。
3.基准物质应溶于水,与被测物溶液之间的反应必须是迅速而且是定量进行,发生可逆反应的不能作为基准试剂。
4.基准物的分子量越大越好,因分子量大要求称样量也大,可减少称样引起的误差。
三、标定标准溶液的原则:1.标定标准溶液所用水应该是去离子蒸馏水和去二氧化碳的纯水。
2.标定标准溶液后浓度应以基准物标定为准,用基准物标定后得出的结果和比较所得出结果,两者相对偏差不得大于0.2%。
3.滴定成品或原料用标准溶液的标定,采用双人复标法,平行标定试验不得少于八次,两人各作四平行,每人四平行测定结果的极差与平均值之比不得大于0.1%,两人测定结果平均值之差不得大于0.1%,结果取最终平均值,浓度值取四位有效数字。
4.用于生产中控的标准溶液可采用标定一种方法,但必须测定四次以上,取其中三个以上结果在允许误差范围内的结果之平均值作为标定的最后结果。
5.制备的标准溶液的浓度与规定浓度相对误差不得大于5%。
6.配制浓度低于或等于0.02mol/L标准溶液时,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。
不同温度下标准滴定溶液的体积的补正值

+1.1
+4.2
+0.50 +0.6 +0.6
+0.6
+0.7
+0.8
+0.8
+3.1
+0.34 0.4 +0.4
+0.4
+0.5
+0.6
+0.6
+2.1
+0.18 +0.2 +0.2
+0.2
+0.2
+0.3
+0.3
+1.0
0.00
0.00 0.00
0.0
0.0
0.0
0.0
0.0
-0.18 -0.2 -0.2
-2.6
-2.8
-3.2
-3.1
-10.6
31
-2.58 -2.7 -2.7
32
-2.86 -3.0 -3.0
33
-3.04 -3.2 -3.3
34
-3.47 -3.7 -3.6
35
-3.78 -4.0 -4.0
36
-4.10 -4.3 -4.3
-2.9
-3.1
-3.5
-3.2
-3.4
-3.9
-3.5
+1.38
0.1mol/l 和
0.2mol/l 以下的 各种水 溶液
+1.7
盐酸溶液 c(HCl)=0.5mol /l
+1.9
盐酸溶液 c(HCl)=1m ol/l
+2.3
硫酸溶液 硫 酸 溶 液
c(1/2H2SO4 c(1/2H2SO4)=1 )=0.5mol/l, mol/l,氢氧化钠
标准滴定溶液体积校正值的运算及应用

2022年 6月下 世界有色金属175标准滴定溶液体积校正值的运算及应用赖晓芳,刘芳美,邓明华,胡梅花,廖彬玲(紫金铜业有限公司,福建 上杭 364204)摘 要:GB/T 601-2016《化学试剂 标准滴定溶液的制备》中规定,在标准滴定溶液标定、直接制备和使用时若温度不为20℃时,应对标准滴定溶液体积进行补正,所用分析天平、滴定管、单标线容量瓶和单标线吸量管等按相关检定规程定期进行检定或校准。
在实际应用中,对不同温度下、不同滴定管及不同标准溶液滴定进行体积校正运算非常繁杂,本文通过内插法进行数据运算,并制成体积校正表,从而对标准滴定溶液体积的校正更加方便、快捷、准确。
关键词:标准滴定溶液;体积校正;温度校正;滴定管中图分类号:TQ421.3 文献标识码:A 文章编号:1002-5065(2022)12-0175-4Calculation and application of volume correction value of standard titrimetric solutionLAI Xiao-fang, LIU Fang-mei, DENG Ming-hua, HU Mei-hua, LIAO Bin-ling(Zijin Copper Co., Ltd, Shanghang 364204 China)Abstract: GB/T 601-2016 Chemical reagent-Preparation of reference titration solutionS,If the temperature is not 20℃for the calibration, direct preparation and use of the standard titrating solution, the volume of the standard titrating solution should be corrected,The Analytical Balance, Burette, single-line volumetric flask and single-line pipette are regularly calibrated or calibrated according to the relevant verification regulations.In practical application,It is very complicated to calibrate the volume of titrations at different temperatures, with different burets and with different standard solutions,In this paper, data operation is carried out by interpolation method, and the volume correction table is made,Therefore, the calibration of the volume of the standard titrated solution is more convenient, fast and accurate.Keywords: Standard titrimetric solution;Volume Correction;Temperature correction;Burette收稿日期:2022-04基金项目:国家质量基础的共性技术研究与应用(2019YFF0217100)。
常用标准溶液的配制

容量标准溶液的配制凡制备的标准溶液的浓度均指20℃时的浓度。
在标定和使用时,如温度有差异,应按附表[不同标准溶液浓度的温度补正值(以ml/L计)]补正。
“标定”或“比较”标准溶液浓度时,平行试验不得少于八次,两人各作四平行,每人四平行测定结果的极差与平均值之比不得大于0.1%,两人测定结果平均值之差不得大于0.1%,结果取平均值.浓度值取四位有效数字.凡规定用”标定”和”比较”两种方法测定浓度时,不得略去其中任何一种,且两种方法测得的浓度值之差不得大于0.2%,以标定结果为准.制备的标准溶液浓度与规定浓度相对误差不得大于5%.配制浓度等于或低于0.02mol/L标准溶液时,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定.碘量法反应时,溶液的温度不能过高,一般在15--20℃之间进行滴定.滴定分析(容量分析)用标准溶液在常温(15--20℃)下,保存时间一般不得超过两个月.1.氢氧化钠标准滴定溶液[c(NaOH)=1mol/L、0.5mol/L、及0.1mol/L](1)配制称取100g氢氧化钠,溶于100ml水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮,使用前以塑料管虹吸上层清液(饱和氢氧化钠溶液).氢氧化钠标准滴定溶液[c(NaOH)=1mol/L]:量取52ml饱和氢氧化钠溶液,注于1000ml新经煮沸并冷却的水中,摇匀.氢氧化钠标准滴定溶液[c(NaOH)=0.5mol/L]:量取26ml饱和氢氧化钠溶液,注于1000ml新经煮沸并冷却的水中,摇匀.氢氧化钠标准滴定溶液[c(NaOH)=0.25mol/L]:量取13ml饱和氢氧化钠溶液,注于1000ml新经煮沸并冷却的水中,摇匀.氢氧化钠标准滴定溶液[c(NaOH)=0.1mol/L]:量取5ml饱和氢氧化钠溶液,注于1000ml新经煮沸并冷却的水中,摇匀.(2)标定(i)测定方法:氢氧化钠标准滴定溶液[c(NaOH)=1mol/L]:称取6g于105--110℃烘至恒重的基准邻苯二甲酸氢钾(精确至0.0001g).溶于80ml新经煮沸并冷却的水中,加2滴酚酞指示液(10g/L),用氢氧化钠标准滴定溶液[c(NaOH)=1mol/L]滴定至溶液呈粉红色,同时作空白试验.氢氧化钠标准滴定溶液[c(NaOH)=0.5mol/L]:称取3g于105--110℃烘至恒重的基准邻苯二甲酸氢钾(精确至0.0001g).溶于80ml新经煮沸并冷却的水中,加2滴酚酞指示液(10g/L),用氢氧化钠标准滴定溶液[c(NaOH)=0.5mol/L]滴定至溶液呈粉红色,同时作空白试验.氢氧化钠标准滴定溶液[c(NaOH)=0.25mol/L]:称取1.5g于105--110℃烘至恒重的基准邻苯二甲酸氢钾(精确至0.0001g).溶于60mL新经煮沸并冷却的水中,加2滴酚酞指示液(10g/L),用氢氧化钠标准滴定溶液[c(NaOH)=0.25mol/L]滴定至溶液呈粉红色,同时作空白试验.氢氧化钠标准滴定溶液[c(NaOH)=0.1mol/L]:称取0.6g于105--110℃烘至恒重的基准邻苯二甲酸氢钾(精确至0.0001g).溶于50ml新经煮沸并冷却的水中,加2滴酚酞指示液(10g/L),用氢氧化钠标准滴定溶液[c(NaOH)=0.1mol/L]滴定至溶液呈粉红色,同时作空白试验.(ii)计算:mc(NaOH)=(V1-V2)×0.2042式中V1—滴定邻荐二甲酸氢钾耗用氢氧化钠标准滴定溶液的体积,ml;V2—空白试验耗用氢氧化钠标准滴定溶液的体积,ml;m---邻苯二甲酸氢钾质量,g;c(NaOH)--氢氧化钠标准滴定溶液之物质的量浓度,mol/L;0.2042—与1.00ml氢氧化钠标准滴定溶液[c(NaOH)=1000mol/L]相当的以克表示的邻苯二甲酸氢钾的质量。
(完整word版)不同温度下标准滴定溶液的体积的补正值.doc
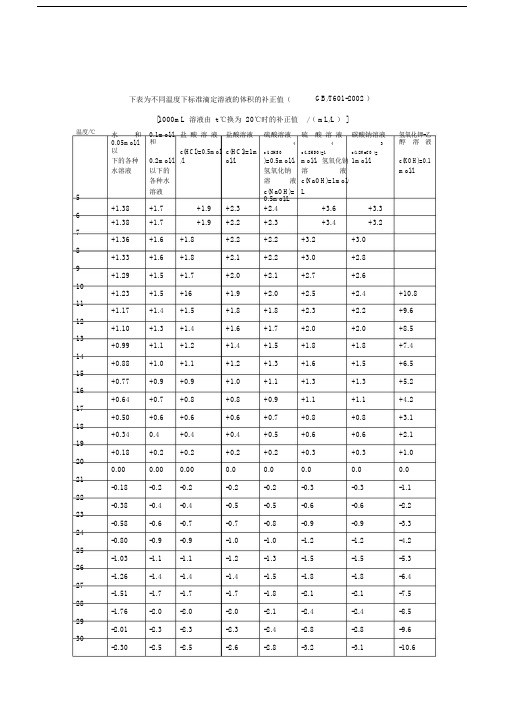
温度/℃56789101112131415161718192021222324252627282930下表为不同温度下标准滴定溶液的体积的补正值(GB/T601-2002 )[1000mL 溶液由 t ℃换为 20℃时的补正值/( mL/L ) ]水和0.1mol/l 盐酸溶液盐酸溶液硫酸溶液硫酸溶液碳酸钠溶液氢氧化钾-乙0.05mol/l以和c(HCl)=0.5mol c(HCl)=1m4 4 3 醇溶液c(1/2HSO c(1/2HSO)=1 c(1/2NaCO )=下的各种0.2mol/l /l ol/l )=0.5mol/l,mol/l,氢氧化钠1mol/l c(KOH)=0.1 水溶液以下的氢氧化钠溶液mol/l 各种水溶液c(NaOH)=1mol/溶液c(NaOH)= L+1.38 +1.7 +1.9 +2.30.5mol/L+3.6 +3.3+2.4+1.38 +1.7 +1.9 +2.2 +2.3 +3.4 +3.2+1.36 +1.6 +1.8 +2.2 +2.2 +3.2 +3.0+1.33 +1.6 +1.8 +2.1 +2.2 +3.0 +2.8+1.29 +1.5 +1.7 +2.0 +2.1 +2.7 +2.6+1.23 +1.5 +16 +1.9 +2.0 +2.5 +2.4 +10.8+1.17 +1.4 +1.5 +1.8 +1.8 +2.3 +2.2 +9.6+1.10 +1.3 +1.4 +1.6 +1.7 +2.0 +2.0 +8.5+0.99 +1.1 +1.2 +1.4 +1.5 +1.8 +1.8 +7.4+0.88 +1.0 +1.1 +1.2 +1.3 +1.6 +1.5 +6.5+0.77 +0.9 +0.9 +1.0 +1.1 +1.3 +1.3 +5.2+0.64 +0.7 +0.8 +0.8 +0.9 +1.1 +1.1 +4.2+0.50 +0.6 +0.6 +0.6 +0.7 +0.8 +0.8 +3.1+0.34 0.4 +0.4 +0.4 +0.5 +0.6 +0.6 +2.1+0.18 +0.2 +0.2 +0.2 +0.2 +0.3 +0.3 +1.00.00 0.00 0.00 0.0 0.0 0.0 0.0 0.0-0.18 -0.2 -0.2 -0.2 -0.2 -0.3 -0.3 -1.1-0.38 -0.4 -0.4 -0.5 -0.5 -0.6 -0.6 -2.2-0.58 -0.6 -0.7 -0.7 -0.8 -0.9 -0.9 -3.3-0.80 -0.9 -0.9 -1.0 -1.0 -1.2 -1.2 -4.2-1.03 -1.1 -1.1 -1.2 -1.3 -1.5 -1.5 -5.3-1.26 -1.4 -1.4 -1.4 -1.5 -1.8 -1.8 -6.4-1.51 -1.7 -1.7 -1.7 -1.8 -2.1 -2.1 -7.5-1.76 -2.0 -2.0 -2.0 -2.1 -2.4 -2.4 -8.5-2.01 -2.3 -2.3 -2.3 -2.4 -2.8 -2.8 -9.6-2.30 -2.5 -2.5 -2.6 -2.8 -3.2 -3.1 -10.631 -2.58 -2.7 -2.7 -2.9 -3.1 -3.5 -11.632 -2.86 -3.0 -3.0 -3.2 -3.4 -3.9 -12.633 -3.04 -3.2 -3.3 -3.5 -3.7 -4.2 -13.734 -3.47 -3.7 -3.6 -3.8 -4.1 -4.6 -14.835 -3.78 -4.0 -4.0 -4.1 -4.4 -5.0 -16.036 -4.10 -4.3 -4.3 -4.4 -4.7 -5.3 -17.0注: 1 .本表数值是以20 ℃为标准温度以实测法测出。
(完整word版)不同温度下标准滴定溶液的体积的补正值
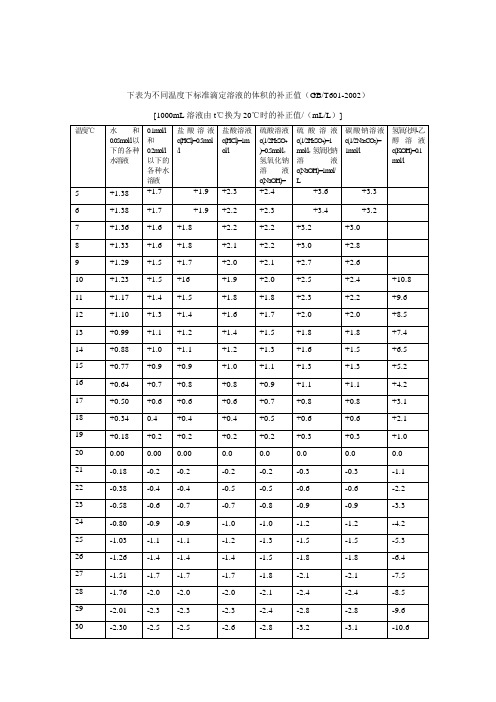
+1.36
+1.6
+1.8
+2.2
+2.2
+3.2
+3.0
8
+1.33
+1.6
+1.8
+2.1
+2.2
+3.0
+2.8
9
+1.29
+1.5
+1.7
+2.0
+2.1
+2.7
+2.6
10
+1.23
+1.5
+16
+1.9
+2.0
+2.5
+2.4
+10.8
11
+1.17
+1.4
+1.5
+1.8
+1.8
+2.3
+2.2
+9.6
12
+1.10
+1.3
+1.4
+1.6
+1.7
+2.0
+2.0
+8.5
13
+0.99
+1.1
+1.2
+1.4
+1.5
+1.8
+1.8
+7.4
14
+0.88
+1.0
+1.1
+1.2
+1.3
+1.6
+1.5
+6.5
温度补正值对标准滴定溶液浓度的影响
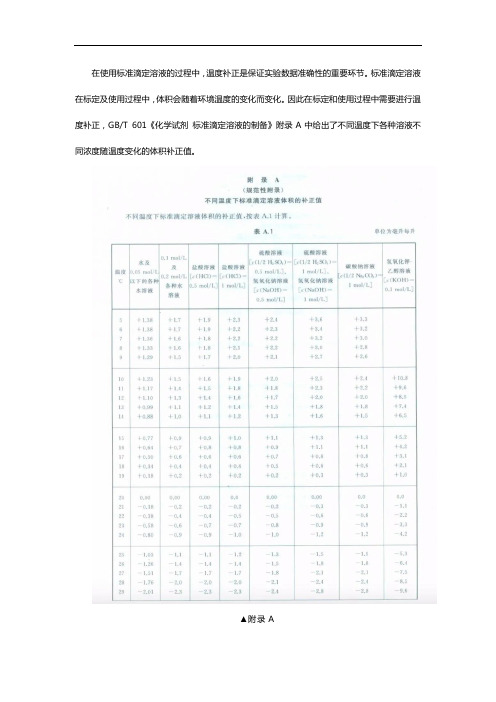
在使用标准滴定溶液的过程中,温度补正是保证实验数据准确性的重要环节。
标准滴定溶液在标定及使用过程中,体积会随着环境温度的变化而变化。
因此在标定和使用过程中需要进行温度补正,GB/T 601《化学试剂标准滴定溶液的制备》附录A中给出了不同温度下各种溶液不同浓度随温度变化的体积补正值。
▲附录A
参照补正值表,设计了0.1mol/L氢氧化钾标准滴定溶液和0.1mol/L氢氧化钾滴定溶液标准物质,乙醇基质验证滴定实验规定温度下,温度补正值对标准滴定溶液浓度的影响实验。
表两种溶液温度补正值对溶液浓度的影响实验数据
通过实验结果可以看出,随着温度的变化,两种标准滴定溶液浓度均有所变化,其中有机溶剂的标准滴定溶液(氢氧化钾滴定溶液标准物质,乙醇基质)体积受温度影响大,未补正浓度与补正浓度相差较大。
同时通过补正值也可以看出,0.1mol/L氢氧化钾-乙醇溶液每差1℃的体积补正值大约为0.1mol/L各种水溶液的体积补正值的5倍。
并且温度补正值是要带入标准滴定溶液浓度值中参与计算的,对标定和使用都会产生较大的影响,所以在使用标准滴定溶液的过程中,温度补正是不可忽略的最要一步。
上海安谱实验科技股份有限公司,于1997年组建成立,总部位于上海,目前拥有500多位员工,2018年销售额超过5亿人民币;是中国领先的实验用品供应链管理服务商;目前公司已是集研发、生产与销售以及客户供应链管理为一体的综合性企业;主要产品包括化学试剂、标准品、气相色谱相关耗材、液相色谱相关耗材、样品前处理产品、实验室通用耗材、小型仪器等。
溶液温度校正值计算公式

溶液温度校正值计算公式引言:在科学实验中,溶液温度校正是一项重要的工作。
溶液的物理性质通常会随着温度的变化而发生变化,因此,为了准确测量和记录溶液的浓度、pH值等参数,我们需要进行温度校正。
本文将介绍溶液温度校正值的计算公式及其应用。
一、溶液温度校正的必要性溶液中的物质在不同温度下的溶解度、电离度、反应速率等性质会发生变化,因此,如果不进行温度校正,测量结果可能会出现偏差。
温度校正可以消除温度对测量结果的影响,使得实验数据更加准确可靠。
二、温度校正公式溶液温度校正值的计算通常采用温度系数公式。
温度系数是描述溶液性质随温度变化的变化率,通常用温度系数α表示。
温度校正值ΔC可以通过以下公式计算得到:ΔC = C * α * ΔT其中,ΔC表示温度校正值;C表示原始测量值;α表示温度系数;ΔT表示温度变化量。
三、温度系数的确定温度系数是一个与溶液种类和温度相关的参数,需要通过实验来确定。
通常情况下,温度系数可以通过以下公式计算:α = (C2 - C1) / (C1 * (T2 - T1))其中,C1和C2分别表示在温度T1和T2下的测量值。
四、温度校正值的应用温度校正值可以用于纠正实验数据,使其与标准温度下的数据相比更加准确可靠。
在实际应用中,温度校正值可以应用于各种溶液浓度、pH值、反应速率等参数的测量中。
例如,在测量溶液的浓度时,我们可以先测量溶液在不同温度下的浓度,并计算出温度系数。
然后,在实际测量时,通过测量得到的浓度值和温度校正值,可以得到在标准温度下的准确浓度值。
同样的道理,温度校正值也可以用于测量溶液的pH值。
由于温度的变化会影响溶液中的电离平衡,因此,在不同温度下测量的pH值需要进行温度校正,以得到准确的pH值。
温度校正值还可以用于反应速率的测量。
在化学反应中,温度的变化会对反应速率产生影响。
通过测量反应速率在不同温度下的变化,并计算出温度系数,可以对实际反应速率进行温度校正,得到在标准温度下的准确反应速率。
