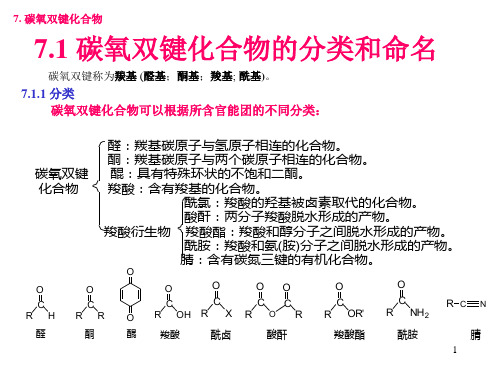
有机化学课 图文课件ppt7章
合集下载
有机化学课件第07章碳氧双键化合物
二元羧酸都是晶体,极性比一元酸强,它们的熔点比一元酸高,在水中的溶 解度也比一元酸大。
二元羧酸的顺反异构体的熔点和溶解度与它们的结构有关。反式丁烯二酸的 对称性比顺式丁烯二酸好,极性较小,同时,顺式丁烯二酸能形成分子内氢键。 因此,反式丁烯二酸的熔点(287℃)比顺式(130℃)高,但顺式丁烯二酸的溶解度大。
乙酸
乙酰氯
乙酐
乙酰胺
乙腈 乙酸甲酯
O
O
O
O
CH3C O CCH 2CH3
COOCH 3
O
CH 3
CH 3C
N CH 3
O 马来酐
乙丙酐
环己(基)甲酸甲酯 N,N-二甲基乙酰胺
O
C N CH 3
C O
OC 2H5 H C OC2H5
OC 2H5
CO
O C
O
NH
N-甲基邻苯二甲酰亚胺
原甲酸三乙酯
己内酯
己内酰胺
随着碳氧双键化合物结构的变化(例如,形成共轭体系),反应性能发生变化!
14
7. 碳氧双键化合物
7.3 碳氧双键化合物的化学性质
7.3.1 羰基化合物的酸性
化合物的酸性,是指化合物分子中的氢原子以质子形式离去的能力。
RCOOH
RCOO + H
R'COCHR 2 7.3.1.1 羧酸的酸性
R'COC R 2 + H
碳原子的位置也可用希腊字母表示。
H
O
δ
β
O
γ
α
β
γ
α
β'
α'
γ'
4
7. 碳氧双键化合物
7.2 碳氧双键化合物的结构特征和物理性质
二元羧酸的顺反异构体的熔点和溶解度与它们的结构有关。反式丁烯二酸的 对称性比顺式丁烯二酸好,极性较小,同时,顺式丁烯二酸能形成分子内氢键。 因此,反式丁烯二酸的熔点(287℃)比顺式(130℃)高,但顺式丁烯二酸的溶解度大。
乙酸
乙酰氯
乙酐
乙酰胺
乙腈 乙酸甲酯
O
O
O
O
CH3C O CCH 2CH3
COOCH 3
O
CH 3
CH 3C
N CH 3
O 马来酐
乙丙酐
环己(基)甲酸甲酯 N,N-二甲基乙酰胺
O
C N CH 3
C O
OC 2H5 H C OC2H5
OC 2H5
CO
O C
O
NH
N-甲基邻苯二甲酰亚胺
原甲酸三乙酯
己内酯
己内酰胺
随着碳氧双键化合物结构的变化(例如,形成共轭体系),反应性能发生变化!
14
7. 碳氧双键化合物
7.3 碳氧双键化合物的化学性质
7.3.1 羰基化合物的酸性
化合物的酸性,是指化合物分子中的氢原子以质子形式离去的能力。
RCOOH
RCOO + H
R'COCHR 2 7.3.1.1 羧酸的酸性
R'COC R 2 + H
碳原子的位置也可用希腊字母表示。
H
O
δ
β
O
γ
α
β
γ
α
β'
α'
γ'
4
7. 碳氧双键化合物
7.2 碳氧双键化合物的结构特征和物理性质
有机化学第7章,ppt课件

7.4.1 反应类型及反应机理
1. 亲电取代反应概述
+
+ E
HEsp3杂E化sp2杂化
+
E
+
+ -H
+H+
亲电试剂 π络合物 σ络合物 取代苯
+H E H E+
讨论:1.当过渡态 + 比 + 稳定时,中间体 σ
络合物较难形成,一旦形成后很快转化成产物。
+H E
H E+
2.当过渡态 + 比 + 能量相近时,
ψ3
无节面
ψ1 苯的π 电子分子轨道重叠情况
7.3 单环芳香烃的物理性质
物理性质 苯和其同系物的芳烃一般都溶剂,如 乙醚、CCl4 、石油醚等非极性溶剂。具有一定 的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
4. 6电子体系有中性分子、碳正离子和碳负离子。 —
苯
环 戊 二 烯 负 离 子
3. 10 π电子体系( n=2)
环辛四烯双负离子
126°46 ' 0.1334nm2K, THF
K
=
= 2K+
0.1462nm
K
成环C不在同一平面 无
π 电子=8
芳
不能形成环状共轭体系 性
成环C在同一平面 有芳 π 电子=10 n=2 性
三苯甲烷
萘
7.1.2 按4n+2规则的n分类
1. 2 π电子体系( n=0)
2.
具两个电子的环状结构是稳定的,有芳香
Ph性。
Ph
Ph Ph
+
有机化学第七章 芳烃

119.5 119.5
239.0 231.6
358.5 208.2
原因:存在共轭体系,π电子高度离域使苯环特别稳定。
离域能:358.5-208.2 = 150.3 kJ·mol-1
6
Kekulè用迅速互变异构解释苯的邻位二元取代物只有一种。
Br
Br
Br
Br
但无法解释难发生加成、氧化反应;并把这些异常的性质 称为芳香性,原因归结为环状交替单双键结构。
15
1-丁烯的共振式:
-+
C H 2 C HC H 2 C H 3 C H 2 C HC H 2 C H 3
+
CH2
-
CH CH2CH3
×
-
CH2
CH2
+
CHCH3
碳酸根的共振式:
原子排列不同
· ·
O· ·
· · · O · · · -
· · · O · · · -
- · · · · O · ·C · · O · · · · -
C · · · O ·
· · O · · · · -
- · · · · O · ·C · O · · ·
16
(3) 对共振杂化体中不同经典结构式的贡献 越稳定的经典结构式在共振杂化体中占的分量越大。 经典结构式稳定性的确定: 共价键数目最多的经典结构式最稳定; 经典结构式的正负电荷越分散越稳定,即电荷分离的经 典结构式稳定性差; 经典结构式中所有原子都具有完整的价电子层的较稳定; 负电荷在电负性大的原子上的经典结构式较稳定。
B r 相同
Br
Br
Br
苯为高度不饱和的分子,却不容易发生加成反应而容易 发生取代反应;
(有机化学课件)第七章 卤代烃

(2) 烯丙型和苄基型卤代烃 卤原子与碳碳重键或苯环相隔一 个饱和碳原子。 特点:C–X键活性高,易发生异 裂,产生烯丙型(苄型)正离子 活性中间体,具有p,π–共轭效应。
(3) 隔离型卤代烃
卤原子与碳碳重键或苯环相 隔两个或多个饱和碳原子,与 一般卤代烷性质接近。
7.2 卤代烃的命名
普通命名法
简单卤代烃的命名,一般是由烃基的名称加上卤原子的名称而成。
反应
Cl CH2 CH2 OH
Ca(OH)2
CH2 CH2 O
机理
Cl CH2 CH2 OH
HO– – H2O
Cl CH2 CH2 O-
分子内类SN2
CH2 CH2 O
邻基参与 例2
H2O
CH3CH2 S CH2CH2Cl k
CH3CH2 S CH2CH2OH
H2O
CH3CH2 CH2 CH2CH2Cl
亲核试剂的进攻与离去基团的离去同时发生; Nu从L的背后沿着C-L键轴线进攻中心C原子; 中心C原子为手性时,发生Walden 转化,即构型反转。
SN2反应的立体化学特征
SN2反应的立体化学特征为中心C原子的构型反转。
(S)–2–碘辛烷
(R)–2–碘(128I)辛烷
7.6.2 单分子亲核取代反应(SN1)机理
亲核取代反应 (II)
(3) 与氰化钠作用
(4) 与氨作用
C2H5OH (CH3)2CHCH2Cl + 2 NH3
110 oC, 3 h, 84%
(5) 卤离子的交换反应
(CH3)2CHCH2NH2 + NH4Cl 异丁胺
CH3CH CH3 + NaI Br
丙酮 室温
CH3CH CH3 + NaBr I 63%
(3) 隔离型卤代烃
卤原子与碳碳重键或苯环相 隔两个或多个饱和碳原子,与 一般卤代烷性质接近。
7.2 卤代烃的命名
普通命名法
简单卤代烃的命名,一般是由烃基的名称加上卤原子的名称而成。
反应
Cl CH2 CH2 OH
Ca(OH)2
CH2 CH2 O
机理
Cl CH2 CH2 OH
HO– – H2O
Cl CH2 CH2 O-
分子内类SN2
CH2 CH2 O
邻基参与 例2
H2O
CH3CH2 S CH2CH2Cl k
CH3CH2 S CH2CH2OH
H2O
CH3CH2 CH2 CH2CH2Cl
亲核试剂的进攻与离去基团的离去同时发生; Nu从L的背后沿着C-L键轴线进攻中心C原子; 中心C原子为手性时,发生Walden 转化,即构型反转。
SN2反应的立体化学特征
SN2反应的立体化学特征为中心C原子的构型反转。
(S)–2–碘辛烷
(R)–2–碘(128I)辛烷
7.6.2 单分子亲核取代反应(SN1)机理
亲核取代反应 (II)
(3) 与氰化钠作用
(4) 与氨作用
C2H5OH (CH3)2CHCH2Cl + 2 NH3
110 oC, 3 h, 84%
(5) 卤离子的交换反应
(CH3)2CHCH2NH2 + NH4Cl 异丁胺
CH3CH CH3 + NaI Br
丙酮 室温
CH3CH CH3 + NaBr I 63%
有机化学课件——Chapter 07 醇、酚、醚

有机化学课件
32
第七章 醇、酚、醚
3. 醇的脱水反应
在浓硫酸催化下,醇通常发生脱水反应得到烯烃或醚. 反应涉及碳正离子中间体. 如果产物为烯烃则遵从Saytzeff规则. 较低温度下反应主要发生分子间脱水成醚, 通常低于140oC . 较高温度下主要发生分子内脱水成烯烃的反应, 通常高于 180oC.
有机化学课件 26 第七章 醇、酚、醚
醇和氢卤酸反应的局限性在于: 所期待的卤代烃不是总能 高收率地得到, 具体表现为四个方面. ① 大多数醇不能和HI反应得到碘代烷烃; ② 1o和2o醇制备氯代烷收率很低; ③ 总是有消除反应产物(烯烃)生成; ④ 碳正离子中间体经常发生重排,得到重排产物.
有机化学课件
OH CH2CH2CH2COOH
有机化学课件 5 第七章 醇、酚、醚
三、醇的物理性质
Unusually high boiling points due to hydrogen bonding between molecules. Small alcohols are miscible in water, but solubility decreases as the size of the alkyl group increases.
有机化学课件
17
第七章 醇、酚、醚
1º, 2º, 3º碳的氧化还原程度
氧化: 分子中C-H 变成C-O. 还原: 分子中C-O 变成C-H.
有机化学课件
18
第七章 醇、酚、醚
1) 仲醇的氧化
许多氧化剂都可以将2o醇氧化为酮. 常用氧化剂如: Na2Cr2O7/H2SO4 H2CrO4 可能是氧化反应的活性物种. 氧化反应伴随明显的颜色变化: 反应溶液由橙色(Cr6+) 变为深蓝色(Cr3+).
有机化学课件第七章醚

18
第八章 醚和环氧化合物
第一节 醚 (三、醚的化学性质)
(三) 过氧化物的生成
烷基醚在空气中久置,α-碳上 的氢可被氧化, 生成醚的过氧化物。
CH3CH2 O CH2CH3 + O2 CH3CH2 O CHCH3 O O H
乙醚
过氧化乙醚
过氧化醚受热易分解爆炸,蒸馏醚时应避免蒸干 过氧化醚的检验:酸性碘化钾-淀粉试纸 过氧化醚的除去:还原剂硫酸亚铁或亚硫酸钠
C C O
H3C H3C O
OCH3
+
Nu
O OCH3
Nu C C O
OH
H3C H3C
H OCH3 H3C H3C
+ CH3O OCH3
27
第八章 醚和环氧化合物
第二节 环氧化合物 (三、开环反应机制)
不对称环氧化物开环, 当用酸催化时, 亲核试剂有 利于进攻连有较多取代基的环碳原子;用碱催化时, 亲核试剂主要进攻连有较少取代基的环碳原子。
11
第八章 醚和环氧化合物
第一节 醚 (一、结构和命名)
苯甲醚
甲醚 (methyl ether) Methyl phenyl ether 在醚的分子中, 与氧原子相连的两个烃基相同 时为单醚;两个烃基不同时为混醚;两个烃基中有 一个或两个是芳香烃基的为芳香醚。氧原子和碳原 子结合成的环状化合物,通常称为环醚。
CH3CH2MgBr 25℃
H2C CH2 OH OH H2C CH2 OH NH2
乙二醇 2-氨基乙醇
H2C CH2 2-甲氧基乙醇 OH OCH3
-
O
CH2-CH2
CH3CH2CH2CH2O 烃氧负离子中间体
H2O
有机化学第七章芳香烃

苯的分子式为:C6H6,其C / H 为 1∶1,类 似于乙炔。可见它具有高度的不饱和性,因而,
应发生下面的反应:
KMn4O
,煮 沸
Br2 ( 加 成)
芳香烃比较容易进行取代,而不容易进行加 成和氧化的化学特性,称为芳香性。
1、芳烃的分类
芳烃按其结构可分类如下:
2019/12/15
4
单环芳烃 苯
CH2CH3
CH3
3, 3-二 甲 基 -4-苯 基 己 烷
苯 乙 烯 2019/12/15
8
B、二元取代苯:有三种异构体
CH3 邻二甲苯
CH3
H3C CH3 间二甲苯
1,2-二甲苯 1,3-二甲苯
o-甲苯 m-甲苯
H3C
对二甲苯 1,4-二甲苯
CH3
p-甲苯
C、三元取代苯:有三种异构体用连、偏、均表示
CH3
A、一元取代苯
一元取代苯只有一种结构,无异构体。命名
时当苯环上连的是烷基(R-),-NO2,-X等基 团时,则以苯环为母体 ,把烃基等作为取代基,
称为“某烃基苯”。例如
2019/12/15
6
C2H5 CH3
CH=CH2
甲(基)苯
乙(基)苯 乙烯苯(苯乙烯)
当苯环上连有 -COOH,-SO3H,-NH2, -OH,-CHO,-CH=CH2或R较复杂时,则把苯环 作为取代基。例如:
C、甲基苯:甲苯分子中去掉一个H原子后
的基团CH3C6H4-,用Tolyl-。 D、苄基:甲苯分子的甲基去掉一个H原子
后的基团C6H5CH2-,用Benzyl-。2019/12/15 Nhomakorabea12
苯基, 用Phф或 表示
有机化学ppt课件完整版

卤代烃多为无色或浅色液体,具有特殊的气味。它们的密度一般比水大,难溶于水,易溶 于有机溶剂。
卤代烃的化学性质
卤代烃在碱性条件下可发生水解反应,生成相应的醇和卤化氢。此外,卤代烃还可发生消 去反应、取代反应等。
17
醇、酚、醚
2024/1/27
醇
醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物。根据羟基所连碳原子的类型不同,醇可分为 伯醇、仲醇和叔醇。醇具有亲水性,能与水形成氢键,因此易溶于水。醇可发生氧化反应、酯化反应等。
酚
酚是芳香烃环上的氢原子被羟基取代而成的化合物。酚具有弱酸性,能与碱反应生成盐和水。酚还可发生氧化反应、 取代反应等。
醚
醚是由醇或酚的羟基中的氢被烷基或芳基取代而成的化合物。醚具有较好的化学稳定性,不易被氧化。 醚可发生开环反应、取代反应等。
18
醛、酮、醌
醛
醛是羰基碳与两个氢和另一个烃 基相连的化合物。醛具有较强的 还原性,易被氧化为羧酸。醛可 发生银镜反应、斐林反应等特征 反应。
IUPAC命名法
国际纯粹与应用化学联合 会制定的有机化合物命名 规则,具有通用性和规范 性。
10
03
烃类化合物
2024/1/27
11
烷烃
烷烃的通式与命名
介绍烷烃的通式、命名原则及常 见烷烃的名称。
烷烃的结构与性质
阐述烷烃的结构特点,包括碳原 子的杂化方式、分子构型等,以 及烷烃的物理性质和化学性质, 如熔沸点、密度、溶解性、稳定
炔烃的来源与制备
介绍炔烃在自然界中的存在形式、工业制备方法及实验室 合成方法。
14
芳香烃
芳香烃的通式与命名
介绍芳香烃的通式、命名原则及常见芳香烃的名称。
卤代烃的化学性质
卤代烃在碱性条件下可发生水解反应,生成相应的醇和卤化氢。此外,卤代烃还可发生消 去反应、取代反应等。
17
醇、酚、醚
2024/1/27
醇
醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物。根据羟基所连碳原子的类型不同,醇可分为 伯醇、仲醇和叔醇。醇具有亲水性,能与水形成氢键,因此易溶于水。醇可发生氧化反应、酯化反应等。
酚
酚是芳香烃环上的氢原子被羟基取代而成的化合物。酚具有弱酸性,能与碱反应生成盐和水。酚还可发生氧化反应、 取代反应等。
醚
醚是由醇或酚的羟基中的氢被烷基或芳基取代而成的化合物。醚具有较好的化学稳定性,不易被氧化。 醚可发生开环反应、取代反应等。
18
醛、酮、醌
醛
醛是羰基碳与两个氢和另一个烃 基相连的化合物。醛具有较强的 还原性,易被氧化为羧酸。醛可 发生银镜反应、斐林反应等特征 反应。
IUPAC命名法
国际纯粹与应用化学联合 会制定的有机化合物命名 规则,具有通用性和规范 性。
10
03
烃类化合物
2024/1/27
11
烷烃
烷烃的通式与命名
介绍烷烃的通式、命名原则及常 见烷烃的名称。
烷烃的结构与性质
阐述烷烃的结构特点,包括碳原 子的杂化方式、分子构型等,以 及烷烃的物理性质和化学性质, 如熔沸点、密度、溶解性、稳定
炔烃的来源与制备
介绍炔烃在自然界中的存在形式、工业制备方法及实验室 合成方法。
14
芳香烃
芳香烃的通式与命名
介绍芳香烃的通式、命名原则及常见芳香烃的名称。
高等有机化学PPT课件

CH3CONHNH2 HNO2 CH3CON3
CH3NCO
X
O
C=NOH
CH3NCO
X
O
O
C N O C NHCH3
乃春在芳环邻位是不饱和支链时,极易环化成五元环,这一 性质对杂环的合成具有重要意义:
AX B
H N:
A BX
N
H
第三节:自由基
自由基是共价键发生均裂,每个碎片各保留一个电子,是带 单电子的三价碳的化合物。
2004年1版 6、洪琳编《有机反应活性中间体》高等教育出版社1999.6第一版 7、斯图尔特.沃伦著《有机合成――切断法探讨》丁新腾译,上海科学
技术文献出版社1986年1月第一版 8、黄宪、吴世晖、徐汉生《有机合成》(上、下)
第一章 有机反应活泼中间体及在合成上的应用
在有机反应中,经常出现的活泼中间体是卡宾、乃春、自由基、碳正离子、 碳负离子(包括苯炔、叶立德)
第一章 有机反应活泼中间体 及在合成上的应用
第一节:卡宾(碳烯)(Carbene) 第二节: 乃春 第三节:自由基 第四节:碳正离子 第五节、碳负离子(Carbenion)(活泼亚甲基
化合物)和叶立德
第二章 官能团的选择性互变
第一节 还原反应 第二节 氧化反应
第三章 官能团的保护
第一节: 羟基的保护(醇、酚羟基的保护) 第二节:烯键的保护 第三节:羰基的保护(用醇保护) 第四节:羧基的保护-酯化 第五节:胺基的保护-酰化或成盐
(六)生物有机化学( Bioorganic Chemistry) (七)元素和金属有机化学(Element and Metal Organic Compounds Chemistry) (八)有机化学中的一些重要应用研究
人教版高中化学必修第二册精品课件 第7章 有机化合物 第1节 认识有机化合物

分子式。题给的两种有机化合物分子式相同,因此不互为同
系物。
典例剖析
有下列各组物质:
A. H
和 H
C.红磷和白磷
E.
F.
B.甲烷和己烷
D.丁烷和新戊烷
和
和
其中,属于同分异构体的是
;属于烷烃的是
属于同位素的是
;属于同素异形体的是
属于同一种物质的是
;属于同系物的是
答案:F B、D、E、F A C E B、D
球棍模型
小球表示原子,短棍表示化学键
空间填
充模型
用不同体积的小球表示不同大小的原
子
天然气、农用沼气的主要成分都是甲烷,甲烷是最简单的有
机化合物。
沼气生产及利用流程图
(1)甲烷的结构是怎样的?
提示:甲烷的空间结构为
,为正四面体结构。
(2)甲烷的所有原子共平面吗?
提示:甲烷为正四面体结构,所有原子不能共平面。
解析:烷烃的沸点随着分子中碳原子数的增加而升高;碳原
子数相同的烷烃,支链越多,沸点越低。
2.烷烃的化学性质。
通常情况下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强
氧化剂不发生反应。但在特定条件下,烷烃也会发生某些反
应。烷烃可以在空气中完全燃烧,发生氧化反应;烷烃在较高
温度下会发生分解;烷烃在一定条件下,能与氯气等发生取代
结构不同
物理性质不
性质 同,化学性质
相同
同素异形体
单质
同系物
化合物
同分异构体
化合物
单质的组成
或结构不同
相似
不同
物理性质不 物理性质不 物理性质不同,
同,化学性质 同,化学性质 化学性质不一
系物。
典例剖析
有下列各组物质:
A. H
和 H
C.红磷和白磷
E.
F.
B.甲烷和己烷
D.丁烷和新戊烷
和
和
其中,属于同分异构体的是
;属于烷烃的是
属于同位素的是
;属于同素异形体的是
属于同一种物质的是
;属于同系物的是
答案:F B、D、E、F A C E B、D
球棍模型
小球表示原子,短棍表示化学键
空间填
充模型
用不同体积的小球表示不同大小的原
子
天然气、农用沼气的主要成分都是甲烷,甲烷是最简单的有
机化合物。
沼气生产及利用流程图
(1)甲烷的结构是怎样的?
提示:甲烷的空间结构为
,为正四面体结构。
(2)甲烷的所有原子共平面吗?
提示:甲烷为正四面体结构,所有原子不能共平面。
解析:烷烃的沸点随着分子中碳原子数的增加而升高;碳原
子数相同的烷烃,支链越多,沸点越低。
2.烷烃的化学性质。
通常情况下,烷烃比较稳定,与强酸、强碱或高锰酸钾等强
氧化剂不发生反应。但在特定条件下,烷烃也会发生某些反
应。烷烃可以在空气中完全燃烧,发生氧化反应;烷烃在较高
温度下会发生分解;烷烃在一定条件下,能与氯气等发生取代
结构不同
物理性质不
性质 同,化学性质
相同
同素异形体
单质
同系物
化合物
同分异构体
化合物
单质的组成
或结构不同
相似
不同
物理性质不 物理性质不 物理性质不同,
同,化学性质 同,化学性质 化学性质不一
有机化学PPT完整全套教学课件

特点
有机化合物种类繁多,结构复杂 ,具有独特的物理和化学性质。
有机化学的历史与发展
01
02
03
早期历史
有机化学的起源可以追溯 到古代,但真正的发展始 于18世纪。
近代发展
19世纪以后,随着化学理 论的不断完善和实验技术 的进步,有机化学得到了 迅速发展。
现代有机化学
20世纪以来,有机化学在 理论、实验方法和应用领 域等方面都取得了巨大进 展。
通过有机合成制备具有特定功能的材料, 如光电材料、催化剂等。
合成具有生物活性的化合物,如酶抑制剂、 受体配体等,并进行生物活性评价。
05
有机化合物的鉴定与分析
Chapter
有机化合物的分离与纯化技术
蒸馏法
利用物质沸点的差异进行分离, 包括简单蒸馏、分馏、减压蒸馏
等。
萃取法
利用物质在两种不互溶溶剂中的 溶解度差异进行分离,包括液-
有机化合物的化学性质
• 取代反应:有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应,如卤代烃的水解反应、 酯的水解反应等。
• 加成反应:有机化合物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新的化合 物的反应,如烯烃与氢气的加成反应、炔烃与卤素的加成反应等。
对已知化合物进行结构修饰和改造, 优化其性能,满足特定需求。
有机合成的基本策略与方法
逆合成分析
从目标分子出发,逆向分析其结 构,设计合理的合成路线。
保护与去保护策略
在合成过程中,对某些官能团进 行保护,以避免不必要的副反应 ,合成完成后再进行去保护。
01 02 03 04
合成子的选择与连接
选择合适的合成子,通过化学键 的连接形成目标分子。
有机化合物种类繁多,结构复杂 ,具有独特的物理和化学性质。
有机化学的历史与发展
01
02
03
早期历史
有机化学的起源可以追溯 到古代,但真正的发展始 于18世纪。
近代发展
19世纪以后,随着化学理 论的不断完善和实验技术 的进步,有机化学得到了 迅速发展。
现代有机化学
20世纪以来,有机化学在 理论、实验方法和应用领 域等方面都取得了巨大进 展。
通过有机合成制备具有特定功能的材料, 如光电材料、催化剂等。
合成具有生物活性的化合物,如酶抑制剂、 受体配体等,并进行生物活性评价。
05
有机化合物的鉴定与分析
Chapter
有机化合物的分离与纯化技术
蒸馏法
利用物质沸点的差异进行分离, 包括简单蒸馏、分馏、减压蒸馏
等。
萃取法
利用物质在两种不互溶溶剂中的 溶解度差异进行分离,包括液-
有机化合物的化学性质
• 取代反应:有机化合物分子中的某些原子或原子团被其他原子或原子团所代替的反应,如卤代烃的水解反应、 酯的水解反应等。
• 加成反应:有机化合物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新的化合 物的反应,如烯烃与氢气的加成反应、炔烃与卤素的加成反应等。
对已知化合物进行结构修饰和改造, 优化其性能,满足特定需求。
有机合成的基本策略与方法
逆合成分析
从目标分子出发,逆向分析其结 构,设计合理的合成路线。
保护与去保护策略
在合成过程中,对某些官能团进 行保护,以避免不必要的副反应 ,合成完成后再进行去保护。
01 02 03 04
合成子的选择与连接
选择合适的合成子,通过化学键 的连接形成目标分子。
有机化学第7章ppt课件

手性分子与非手性分子
手性分子的定义
不能与其镜像重合的分子。
手性中心的判断
连有四个不同基团的碳原子。
手性分子的性质
具有旋光性,即能使偏振光的 平面发生旋转。
非手性分子的定义
能与其镜像重合的分子,无旋 光性。
对称性与不对称性
对称性的定义
物体或图形在某种变换下保持不变的性质。
对称性的判断方法
根据对称元素和对称操作判断分子的对称性 。
结构特点与性质
结构特点
芳香族化合物的分子结构中含有苯环或其衍生物,具有共轭体系和稳定的芳香性 。
性质
芳香族化合物通常具有较高的熔点和沸点,定性,但同时也表现出一定的 反应活性,如亲电取代反应、氧化反应等。
04
立体化学基础
分析天平
正确使用分析天平,确保称量准确 。
04
实验数据处理和结果分析
数据记录
详细记录实验过程中的数据,包括原料用量、反 应条件、产品性状等。
熟悉实验室内安全设施,如紧急洗眼 器、灭火器等。
注意实验过程中的异常情况,如遇火 灾、泄漏等事故,应立即采取相应措 施并报告老师。
常用仪器设备及操作规范
01
玻璃仪器
正确使用烧杯、试管、滴管等玻璃 仪器,避免破裂或划伤。
分离设备
了解分液漏斗、蒸馏装置等分离设 备的原理及操作规范。
03
02
加热设备
掌握酒精灯、电加热套等加热设备 的使用方法,注意火源安全。
命名方法与规则
普通命名法
对于简单的脂肪族化合物,可以采用普通命名法,即根据化合物的来源或性质 来命名。
系统命名法
对于复杂的脂肪族化合物,需要采用系统命名法,即根据化合物的结构特征, 按照一定的规则进行命名。包括选取主链、编号、写出取代基名称等步骤。
新教材高中化学第七章有机化合物第二节第2课时有机高分子材料课件新人教版必修2

课堂合作探究
探究任务一
几种常见塑料的结构和性能
【生活情境】
有机高分子材料在生活生产的各个领域都有极为广泛的应用。
“三大合成材料”是指塑料、合成纤维、合成橡胶。你能列举有关“三大合
成材料”的应用吗?
【问题探究】
由聚氯乙烯制造的塑料包装袋能不能盛装食品?
提示:不能,聚氯乙烯有毒。
【探究总结】
【探究训练】
提示:实验室中盛放KMnO4溶液、浓硝酸、液溴、汽油、苯、四氯化碳等药品
的试剂瓶的瓶塞不能用橡胶塞。
3.合成纤维
(1)分类
(2)合成纤维的性质和用途
强度高
弹性好
耐磨
①性质:合成纤维具有_______、_______、_____、耐化学腐蚀、不易虫蛀等
优良性能。
②用途:制作衣物、绳索、渔网、滤布和飞机、船舶的结构材料等。
高性能陶瓷时代。在生活中你都用到过哪些高分子材料?你知道它们都有怎样
的性质?
1.塑料
(1)塑料的分类:根据塑料加热时的表现可把塑料分为热塑性塑料和热固性塑
料两大类。
(2)常见合成塑料
①聚乙烯(PE)
②聚氯乙烯(PVC)
③聚苯乙烯(PS)
④聚四氟乙烯(PTFE)
⑤聚丙烯(PP)
⑥聚甲基丙烯酸甲酯(PMMA)
第2课时
有机高分子材料
课前自主学习
学习任务
有机高分子材料
任务驱动:
材料被视为人类社会发展的里程碑,满足社会发展的需求是材料不断创新与发
展的源动力。历史上,对材料的认识和利用的能力,决定着社会的形态和人类
生活的质量,历史学家也把材料及其器具作为划分时代的标志:如从旧石器时
代开始,经过新石器时代、青铜器时代、铁器时代、钢铁时代、高分子时代、
2020版新教材高中化学第七章有机化合物第三节第1课时乙醇课件新人教版必修第二册

铜丝灼烧时变黑,插入乙醇后变红,反 复几次可闻到刺激性气味
知识铺垫
新知预习
自主测试
2.乙醇与钠反应的化学方程式:
2Na+2CH3CH2OH→2CH3CH2ONa+H2↑。 3.乙醇的氧化反应。
知识铺垫
新知预习
自主测试
五、乙醇的用途 1.用作燃料。 2.是重要的有机化工原料和溶剂,用于生产医药、香料、化妆品、 涂料等。 3.医疗上常用体积分数为75%的乙醇溶液作消毒剂。
任务一
任务二
素养脉络
随堂检测
4.关于乙醇的说法中正确的是( )
A.乙醇结构中含有—OH,所以乙醇溶于水,可以电离出OH-而显碱
性
B.乙醇燃烧生成二氧化碳和水,说明乙醇具有氧化性
C.乙醇与钠反应可以产生氢气,所以乙醇显酸性
D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水分子中
的氢原子活泼
答案:D
提示不对。钠能与乙醇反应,故钠不能保存在乙醇中,钠可以保 存在煤油中。
2.钠与乙醇反应置换乙醇中的哪种氢原子?1 mol C2H5OH完全反 应生成多少摩尔H2?
提示羟基上的氢原子。0.5 mol H2。
任务一
任务二
素养脉络
随堂检测
知识拓展 水中氢原子、乙醇中羟基氢原子的活泼性比较
水与钠反应
乙醇与钠反应
任务一
任务二
素养脉络
随堂检测
3.醇的催化氧化反应规律
醇在有催化剂(铜或银)存在的条件下,可以发生催化氧化反应生
成醛,但并不是所有的醇都能被氧化生成醛。
(1)凡是含有R—CH2OH(R代表烃基)结构的醇,在一定条件下都 能被氧化成醛:
2R—CH2OH+O2
有机化学第7章羰基的反应市公开课获奖课件省名师示范课获奖课件

二、羰基旳亲核加成
2. 含O, S亲核试剂
涉及H2O, ROH, RSH, 和NaHSO3 (1) H2O
水合物
酸碱催化,加紧平衡旳到达,但不影响平衡移动。
二、羰基旳亲核加成
(1) H2O
O +
H3C CH3 99.8%
O +
H3C H 42%
O +
HH 0.1%
O +
Cl3C H
H2O H2O
H2O
OH
R
R
O R MgBr Y
其中:Y=X or OR
OMgBr Y
R
-YMgBr
O
R MgBr H2O
R
CN
R MgBr
NMgBr
H2O
R
OH R
R
O R
格氏试剂旳应用
R CH2OH
1°醇
1.HCHO 2.H3O
R COOH 羧酸
1.CO2 2.H2O
O
O
OH
HCOR'
R CH 醛
RMgX
R CH R
二、羰基旳亲核加成
1. Summary 2. (1) Nucleophiles
负离子亲核试剂(碱性条件): ¯OH、 ¯OR、 ¯SR、 ¯H、 ¯C≡N、 ¯C≡CR、 ¯CR3、(M-R) 中性分子亲核试剂(中性或酸性条件): HOH、HOR、HSR、NH3、H2NR、HNR2
二、羰基旳亲核加成
neutral tetrahedral intermediate
二、羰基旳亲核加成
3. 含N亲核试剂
(2) R2NH 反应可逆,经酸水解可得回醛酮。
N
+ H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图7-1 苯的凯库勒式
7.2 单环芳烃的结构、同分异构与命名
但是苯的凯库勒式不能解释下面两个问题: ①苯分子结构中含有三个双键,但是却不能起类似烯 烃的加成反应; ②根据凯库勒式,苯的邻二元取代物应该为下列两种 化合物:
7.2 单环芳烃的结构、同分异构与命名
由于苯的凯库勒式存在上 述问题,因此人们一直致力于 对苯的结构的研究。现代物理 实验方法表明苯分子的六个碳 原子和六个氢原子都在同一个 平面上,六个碳原子组成一个 正六边形。苯分子中的所有 C—C键的键长和C—H键的键 长都相等,C—C键的键[JP2]
三硝基苯也有如下三种异构体:
7.2 单环芳烃的结构、同分异构与命名
思考题7-1
写出分子式为C10H14的芳烃的所有同分异构体的构 造式。
7.2 单环芳烃的结构、同分异构与命名
7.2.3 单环芳烃的命名 1. 以苯环为母体
苯环上所连支链比较简单的单环芳烃,将苯环作为母体, 取代基的名称放在苯环前面,称为“某基苯”,例如:
二元取代苯命名时,在取代基名称前加邻、间、对来表示 两个取代基在苯环上的相对位置,例如:
7.2 单环芳烃的结构、同分异构与命名
三元取代苯则要在取代基名称前加连、偏、均来表示三个取 代基在苯环上的相对位置。例如:
7.2 单环芳烃的结构、同分异构与命名
2. 以苯环为取代基
苯环上所连支链比较复杂,则以苯为取代基,支链为母体, 称为“苯(基)某”,例如:
7.4 单环芳烃的化学性质
7.4 单环芳烃的化学性质
硝基苯在过量的混酸存在下,可继续硝化生成间二硝基苯。 但是苯的第二次硝化要比第一次难,需要在高温的条件下才能进 行,三硝基苯更难获得。
烷基苯比苯容易硝化。甲苯在30℃就可以与混酸反应,生成 邻硝基甲苯和对硝基甲苯。
7.4 单环芳烃的化学性质
2. 卤化反应
有机化合物分子中的氢被卤素原子(-X)取代的反应称为卤化 反应。苯在氯(或溴)化铁或铁粉的催化下,苯环上的氢原子能 被卤原子所取代生成卤苯。例如:
苯是最简单且比较重要的单环芳烃,苯系芳烃中都含苯 环,因此可以通过苯的结构来了解其他芳烃的结构。
苯的分子式为C6H6,是一个很稳定的化合物,在起反应 时,六个碳原子是作为一个整体参与反应的。苯的一元取代 物只有一种,说明苯分子中的六个氢原子是等同的,每个碳 原子上连有一个氢原子,六个碳原子首尾相连形成一个环。
0.140nm,C—H键的 键长为0.108nm,所有的键角 都是120°,如图7-2所示。
图7-2 苯的结构
7.2 单环芳烃的结构、同分异构与命名
苯分子中碳原子均为sp2杂化,成键 时,每个碳原子各以两个sp2杂化轨道与 相邻两个碳原子的sp2杂化轨道“头碰头 ”成σ键,每个碳原子又各以另外一个 sp2杂化轨道与氢原子的s轨道成σ键。这 样就形成了苯分子的基本骨架结构,所有 的成键原子都在同一个平面上,所有的键 角都为120°。另外,每个碳原子还剩余 一个未参与杂化且垂直于苯分子平面的p 轨道,这些p轨道相互平行,从侧面“肩 并肩”相互重叠成一个闭合的环状六原子 六电子大π键,如图7-3所示。
7.3 单环芳烃的物理性质
表7-1 单环芳烃的物理常数பைடு நூலகம்
7.4 单环芳烃的化学性质
7.4.1 苯环上的反应 1. 硝化反应
有机化合物分子中的氢被硝基(-NO2)取代的反应称为硝化 反应。在50~60℃,苯在浓硝酸和浓硫酸(常[JP]称为混酸)的 作用下,发生硝化反应,苯环上的氢被硝基取代,生成硝基苯。
图7-3 苯分子中的π键
7.2 单环芳烃的结构、同分异构与命名
7.2.2 单环芳烃的同分异构
苯的一元取代物没有同分异构体,而其二元取代物就有同 分异构体。例如,二硝基苯有三种同分异构体,这三种异构体是 由于两个硝基在苯环上的相对位置不同所引起的。
7.2 单环芳烃的结构、同分异构与命名
邻位是指苯环上的两个取代基位于相邻的位置,也可用“o -” 表示;间位是指两个取代基在苯环上的位置间隔了一个碳原子,也 可用“m -”表示;而对位是指两个取代基在苯环上的位置间隔了 两个碳原子,也可用“p -”表示。
多苯代脂肪烃是指链烃分子中的氢被两个或多个 苯基取代的化合物。例如:
7.1 芳香烃的分类
(2)联苯
联苯是指苯环之间通过环上的一个碳原子直接相 连的芳烃。例如:
7.1 芳香烃的分类
(3)稠环芳烃
稠环芳烃是指两个或多个苯环共用两个相邻碳原 子的化合物。例如:
7.2 单环芳烃的结构、同分异构与命名
7.2.1 单环芳烃的结构
7.2 单环芳烃的结构、同分异构与命名
思考题7-2
试命名下列化合物:
7.3 单环芳烃的物理性质
1. 状态
常温常压下,苯及 其同系物多数为无色 液体,有些具有特殊 的芳香气味。
7.3 单环芳烃的物理性质
2. 溶解性
苯及其同系物一般不溶于水,可 以溶于有机溶剂,如乙醚、四氯化碳 等,液态的芳烃是许多有机化合物的 良好溶剂。
7.3 单环芳烃的物理性质
3. 密度
一般苯及苯 的同系物都比水轻 ,相对密度在 0.86~0.93之间。
7.3 单环芳烃的物理性质
4. 熔、沸点
苯及苯的同系物的沸点随着相对分子量的增加而增 高;熔点主要由相对分子量决定,还与分子结构有关,通 常对称性越高,相应的熔点也越高。
芳香烃燃烧时常伴有较浓的黑烟,具有一定的毒性。 表7-1列出了一些单环芳烃的物理常数。
无机化学
第7章 芳 香 烃
芳香烃的分类 单环芳烃的结构、同分异构与命名
单环芳烃的物理性质 单环芳烃的化学性质
第7章 芳 香 烃
苯环上亲电取代定位规律 稠环芳烃 重要的芳烃
7.1 芳香烃的分类
1. 单环芳烃
分子结构中只含有一个苯环的芳烃称为单环芳烃。 例如:
7.1 芳香烃的分类
2. 单环芳烃
(1)多苯代脂肪烃
7.2 单环芳烃的结构、同分异构与命名
苯的环状结构是德国化学家凯库勒首先提出来的,为了 保证碳的四价,凯库勒在苯环内加上三个双键,这就是苯的 凯库勒式,如图7-1所示。这样,既可以说明苯在反应中六 个碳原子作为一个整体参与反应,又可以说明苯的二元取代 物只有三种,同时取代基相同的三元取代物也是三种。
7.2 单环芳烃的结构、同分异构与命名
但是苯的凯库勒式不能解释下面两个问题: ①苯分子结构中含有三个双键,但是却不能起类似烯 烃的加成反应; ②根据凯库勒式,苯的邻二元取代物应该为下列两种 化合物:
7.2 单环芳烃的结构、同分异构与命名
由于苯的凯库勒式存在上 述问题,因此人们一直致力于 对苯的结构的研究。现代物理 实验方法表明苯分子的六个碳 原子和六个氢原子都在同一个 平面上,六个碳原子组成一个 正六边形。苯分子中的所有 C—C键的键长和C—H键的键 长都相等,C—C键的键[JP2]
三硝基苯也有如下三种异构体:
7.2 单环芳烃的结构、同分异构与命名
思考题7-1
写出分子式为C10H14的芳烃的所有同分异构体的构 造式。
7.2 单环芳烃的结构、同分异构与命名
7.2.3 单环芳烃的命名 1. 以苯环为母体
苯环上所连支链比较简单的单环芳烃,将苯环作为母体, 取代基的名称放在苯环前面,称为“某基苯”,例如:
二元取代苯命名时,在取代基名称前加邻、间、对来表示 两个取代基在苯环上的相对位置,例如:
7.2 单环芳烃的结构、同分异构与命名
三元取代苯则要在取代基名称前加连、偏、均来表示三个取 代基在苯环上的相对位置。例如:
7.2 单环芳烃的结构、同分异构与命名
2. 以苯环为取代基
苯环上所连支链比较复杂,则以苯为取代基,支链为母体, 称为“苯(基)某”,例如:
7.4 单环芳烃的化学性质
7.4 单环芳烃的化学性质
硝基苯在过量的混酸存在下,可继续硝化生成间二硝基苯。 但是苯的第二次硝化要比第一次难,需要在高温的条件下才能进 行,三硝基苯更难获得。
烷基苯比苯容易硝化。甲苯在30℃就可以与混酸反应,生成 邻硝基甲苯和对硝基甲苯。
7.4 单环芳烃的化学性质
2. 卤化反应
有机化合物分子中的氢被卤素原子(-X)取代的反应称为卤化 反应。苯在氯(或溴)化铁或铁粉的催化下,苯环上的氢原子能 被卤原子所取代生成卤苯。例如:
苯是最简单且比较重要的单环芳烃,苯系芳烃中都含苯 环,因此可以通过苯的结构来了解其他芳烃的结构。
苯的分子式为C6H6,是一个很稳定的化合物,在起反应 时,六个碳原子是作为一个整体参与反应的。苯的一元取代 物只有一种,说明苯分子中的六个氢原子是等同的,每个碳 原子上连有一个氢原子,六个碳原子首尾相连形成一个环。
0.140nm,C—H键的 键长为0.108nm,所有的键角 都是120°,如图7-2所示。
图7-2 苯的结构
7.2 单环芳烃的结构、同分异构与命名
苯分子中碳原子均为sp2杂化,成键 时,每个碳原子各以两个sp2杂化轨道与 相邻两个碳原子的sp2杂化轨道“头碰头 ”成σ键,每个碳原子又各以另外一个 sp2杂化轨道与氢原子的s轨道成σ键。这 样就形成了苯分子的基本骨架结构,所有 的成键原子都在同一个平面上,所有的键 角都为120°。另外,每个碳原子还剩余 一个未参与杂化且垂直于苯分子平面的p 轨道,这些p轨道相互平行,从侧面“肩 并肩”相互重叠成一个闭合的环状六原子 六电子大π键,如图7-3所示。
7.3 单环芳烃的物理性质
表7-1 单环芳烃的物理常数பைடு நூலகம்
7.4 单环芳烃的化学性质
7.4.1 苯环上的反应 1. 硝化反应
有机化合物分子中的氢被硝基(-NO2)取代的反应称为硝化 反应。在50~60℃,苯在浓硝酸和浓硫酸(常[JP]称为混酸)的 作用下,发生硝化反应,苯环上的氢被硝基取代,生成硝基苯。
图7-3 苯分子中的π键
7.2 单环芳烃的结构、同分异构与命名
7.2.2 单环芳烃的同分异构
苯的一元取代物没有同分异构体,而其二元取代物就有同 分异构体。例如,二硝基苯有三种同分异构体,这三种异构体是 由于两个硝基在苯环上的相对位置不同所引起的。
7.2 单环芳烃的结构、同分异构与命名
邻位是指苯环上的两个取代基位于相邻的位置,也可用“o -” 表示;间位是指两个取代基在苯环上的位置间隔了一个碳原子,也 可用“m -”表示;而对位是指两个取代基在苯环上的位置间隔了 两个碳原子,也可用“p -”表示。
多苯代脂肪烃是指链烃分子中的氢被两个或多个 苯基取代的化合物。例如:
7.1 芳香烃的分类
(2)联苯
联苯是指苯环之间通过环上的一个碳原子直接相 连的芳烃。例如:
7.1 芳香烃的分类
(3)稠环芳烃
稠环芳烃是指两个或多个苯环共用两个相邻碳原 子的化合物。例如:
7.2 单环芳烃的结构、同分异构与命名
7.2.1 单环芳烃的结构
7.2 单环芳烃的结构、同分异构与命名
思考题7-2
试命名下列化合物:
7.3 单环芳烃的物理性质
1. 状态
常温常压下,苯及 其同系物多数为无色 液体,有些具有特殊 的芳香气味。
7.3 单环芳烃的物理性质
2. 溶解性
苯及其同系物一般不溶于水,可 以溶于有机溶剂,如乙醚、四氯化碳 等,液态的芳烃是许多有机化合物的 良好溶剂。
7.3 单环芳烃的物理性质
3. 密度
一般苯及苯 的同系物都比水轻 ,相对密度在 0.86~0.93之间。
7.3 单环芳烃的物理性质
4. 熔、沸点
苯及苯的同系物的沸点随着相对分子量的增加而增 高;熔点主要由相对分子量决定,还与分子结构有关,通 常对称性越高,相应的熔点也越高。
芳香烃燃烧时常伴有较浓的黑烟,具有一定的毒性。 表7-1列出了一些单环芳烃的物理常数。
无机化学
第7章 芳 香 烃
芳香烃的分类 单环芳烃的结构、同分异构与命名
单环芳烃的物理性质 单环芳烃的化学性质
第7章 芳 香 烃
苯环上亲电取代定位规律 稠环芳烃 重要的芳烃
7.1 芳香烃的分类
1. 单环芳烃
分子结构中只含有一个苯环的芳烃称为单环芳烃。 例如:
7.1 芳香烃的分类
2. 单环芳烃
(1)多苯代脂肪烃
7.2 单环芳烃的结构、同分异构与命名
苯的环状结构是德国化学家凯库勒首先提出来的,为了 保证碳的四价,凯库勒在苯环内加上三个双键,这就是苯的 凯库勒式,如图7-1所示。这样,既可以说明苯在反应中六 个碳原子作为一个整体参与反应,又可以说明苯的二元取代 物只有三种,同时取代基相同的三元取代物也是三种。
