2019 晚期结直肠癌寡转移的治疗策略
晚期结直肠癌寡转移的治疗策略ppt课件

• 转化缩瘤:推荐A1a – A1h • 减状缩瘤:推荐A2a – A2d • 疾病控制:推荐B1a – B1e
2016 ESMO新分类:mCRC
• 身体状况分类:
– Fit vs Unfit – 临床决策时先行
• 疾病本质分类:
• mCRC寡转移的生物学行为筛选
寡转移(OMD) 局部治疗与全身治疗的布局
mCRC寡转移(OMD)的处理
ESMO 2016指1南4
mCRC以NED及局部治疗为核心的策略也适用于OMD
以治疗目标为导向的临床治疗策略
初始可NED
初 始 不 可 NED
组0
围术 患者
初始可切
目标
治愈
期
手术
组1
转化 潜在可切 优先 最大程度缩小肿瘤
– 局限性mCRC (寡转移) vs 广泛性mCRC – 制定具体治疗方法的核心
2016 ESMO mCRC主要改变
• 分类替代传统分组
– 患者状况分类:fit 、unfit – 疾病状态分类:寡转移、广泛转移
• 强调局部治疗在寡转移性疾病中的价值
– 局部毁损性治疗“(Local Ablative Treatment,LAT)
• 手术 • 非手术LATs
• 治疗目标的调整
– 治愈:R0、NED – 缩瘤:转化、减状 – 疾病控制
“寡转移”Oligometastasis
• 概念提出:1995年 – 芝加哥大学:生物科学系前主任Samuel Hellman和医学中心放射和分子治疗科主 任Ralph Weichselbaum提出
– 全身治疗与局部治疗的布局
结肠癌的化疗方案

结肠癌的化疗方案结肠癌的化疗方案引言结肠癌是一种常见的恶性肿瘤,多发生于结肠的粘膜、黏膜下和肌层。
化疗是结肠癌治疗的重要手段之一,可以通过药物的方式来杀灭癌细胞或者抑制其生长。
本文将介绍常用的结肠癌化疗方案。
1. CAF方案CAF方案是一种较常见的结肠癌化疗方案,由环磷酰胺(Cyclophosphamide)、阿霉素(Adriamycin)和氟尿嘧啶(Fluorouracil)组成。
这三种药物可以协同作用,通过不同的作用机制来抑制肿瘤生长。
1.1 药物作用机制- 环磷酰胺:环磷酰胺能够阻断DNA链的连接,从而抑制肿瘤细胞的分裂与增殖。
- 阿霉素:阿霉素可通过插入DNA链中而破坏DNA的修复和融合能力,从而使肿瘤细胞无法生存。
- 氟尿嘧啶:氟尿嘧啶可以干扰DNA和RNA的合成,从而阻断肿瘤细胞的生长。
1.2 使用方法CAF方案通常采用静脉注射的方式给药。
治疗周期通常为21天,每个周期内在前3天同时给予三种药物,其后休息18天。
根据患者的具体情况,可能需要进行多个周期的化疗。
2. FOLFOX方案FOLFOX方案是一种常用的结肠癌化疗方案,由氟尿嘧啶(Fluorouracil)、氧铂(Oxaliplatin)和钙泛泛酸(Leucovorin)组成。
这三种药物具有不同的药理作用,能够有效地抑制肿瘤生长。
2.1 药物作用机制- 氟尿嘧啶、氧铂:氟尿嘧啶和氧铂可以干扰DNA和RNA的合成,从而抑制肿瘤细胞的增殖。
- 钙泛泛酸:钙泛泛酸能够增强氟尿嘧啶的药效,从而提高化疗效果。
2.2 使用方法FOLFOX方案一般通过静脉输注给药。
氟尿嘧啶和氧铂通常在输液前以静脉注射的方式给予,而钙泛泛酸则通过静脉滴注给药。
治疗周期通常为14天,每个周期内在前2天给予氟尿嘧啶、氧铂和钙泛泛酸,其后休息12天。
根据患者的具体情况,可能需要进行多个周期的化疗。
3. FOLFIRI方案FOLFIRI方案是另一种常用的结肠癌化疗方案,由氟尿嘧啶(Fluorouracil)、伊立替康(Irinotecan)和钙泛泛酸(Leucovorin)组成。
结肠癌术后转移肺部的治疗方案

一、引言结肠癌是我国常见的恶性肿瘤之一,其发病率逐年上升。
术后转移至肺部的结肠癌患者预后较差,治疗难度较大。
本文将对结肠癌术后转移肺部的治疗方案进行详细阐述。
二、治疗方案1. 个体化治疗针对结肠癌术后转移肺部的患者,治疗方案应个体化,根据患者的具体情况(如年龄、身体状况、肿瘤分期、转移灶数目等)制定。
以下为常见的治疗方案:(1)手术切除对于部分转移灶较少、身体状况较好的患者,可行手术切除转移肺病灶。
手术切除后,患者需接受化疗、放疗等辅助治疗,以提高生存率。
(2)化疗化疗是治疗转移性结肠癌的主要手段,常用的化疗药物有奥沙利铂、伊立替康、5-氟尿嘧啶等。
化疗方案可根据患者的具体情况选择,如FOLFOX、FOLFIRI、FLOX等。
(3)靶向治疗针对部分转移性结肠癌患者,可使用靶向治疗。
目前常用的靶向药物有贝伐珠单抗、西妥昔单抗、帕尼单抗等。
靶向治疗联合化疗可提高疗效。
(4)放疗放疗在治疗转移性结肠癌中具有重要意义,可减轻症状、控制病情。
放疗可分为外照射放疗和近距离放疗。
外照射放疗适用于转移灶较大的患者,近距离放疗适用于转移灶较小的患者。
2. 综合治疗对于转移性结肠癌患者,综合治疗是提高生存率的关键。
以下为常见的综合治疗方案:(1)化疗+放疗化疗和放疗联合应用可提高疗效,减轻症状。
化疗可杀伤肿瘤细胞,放疗可缩小肿瘤体积,减轻肿瘤对周围组织的压迫。
(2)化疗+靶向治疗化疗联合靶向治疗可提高疗效,减轻化疗副作用。
靶向治疗可针对肿瘤细胞特异性受体,降低化疗药物的毒副作用。
(3)化疗+免疫治疗免疫治疗是一种新兴的治疗手段,通过激活患者自身的免疫系统,杀伤肿瘤细胞。
化疗联合免疫治疗可提高疗效,减轻化疗副作用。
3. 支持治疗(1)营养支持转移性结肠癌患者往往存在营养不良的情况,营养支持有助于提高患者的生活质量。
营养支持包括高蛋白、高热量、高维生素饮食,必要时可给予肠内或肠外营养。
(2)对症治疗针对转移性结肠癌患者出现的症状,如疼痛、咳嗽、呼吸困难等,需给予对症治疗。
结肠癌三线治疗方案

结肠癌三线治疗方案
首先,在手术治疗后,患者需要进行化疗。
化疗是通过使用抗肿瘤药物来杀死
癌细胞的治疗方法。
对于结肠癌患者来说,化疗可以帮助消灭残留的癌细胞,减少复发的可能性。
同时,化疗也可以通过缩小肿瘤的体积,使手术更容易进行。
其次,靶向治疗是结肠癌三线治疗的重要组成部分。
靶向治疗是指利用药物干
扰肿瘤细胞的生长信号通路,从而抑制肿瘤的生长和扩散。
对于具有KRAS突变
的结肠癌患者来说,靶向治疗是非常有效的治疗方法。
靶向药物可以选择性地杀死癌细胞,减少对正常细胞的伤害,从而提高治疗效果。
另外,免疫治疗也是结肠癌三线治疗方案中的重要内容。
免疫治疗是通过激活
患者自身的免疫系统来攻击肿瘤细胞。
目前,一些免疫检查点抑制剂已经被证实可以显著改善晚期结肠癌患者的生存率。
免疫治疗不仅可以减少肿瘤的体积,还可以提高患者的生活质量。
此外,放疗在结肠癌三线治疗中也扮演着重要的角色。
放疗可以通过高能射线
照射肿瘤部位,杀死癌细胞,从而达到治疗的目的。
对于一些无法手术切除的晚期结肠癌患者来说,放疗可以帮助控制肿瘤的生长,缓解症状,延长患者的生存时间。
总的来说,结肠癌三线治疗方案是一个综合性的治疗方案,包括化疗、靶向治疗、免疫治疗和放疗等多种治疗手段。
这些治疗方法可以相互配合,提高治疗效果,延长患者的生存时间。
当然,针对不同患者的具体情况,医生会根据病情和患者的身体状况来制定个性化的治疗方案。
希望结肠癌患者能够早日康复,重返健康的生活。
直肠癌术后化疗方案

直肠癌术后化疗方案直肠癌手术是治疗直肠癌的主要方式之一。
术后化疗是为了杀死癌细胞、减少复发和转移的风险而进行的辅助治疗。
下面是常用的直肠癌术后化疗方案。
1. FOLFOX 方案:FOLFOX 方案是一种常用的直肠癌术后化疗方案。
该方案由氟尿嘧啶(5-FU)、亚叶酸(leucovorin)和奥沙利铂(oxaliplatin)组成。
这些药物通过不同的机制杀死癌细胞,并可增强彼此的抗肿瘤作用。
FOLFOX 方案通常每两周给药一次,连续进行6个疗程。
2. XELOX 方案:XELOX 方案也是一种常用的直肠癌术后化疗方案。
该方案由氟尿嘧啶(5-FU)和奥沙利铂(oxaliplatin)组成。
与FOLFOX 方案相比,XELOX 方案中的亚叶酸(leucovorin)被替换为协同药物咪唑脱氧核苷(capecitabine)。
XELOX 方案通常每三周给药一次,连续进行8个疗程。
3. CAPOX 方案:CAPOX 方案与 XELOX 方案相似,也由氟尿嘧啶(5-FU)和奥沙利铂(oxaliplatin)组成。
与 XELOX方案不同的是,CAPFOX 方案中的药物给药方式有所调整。
在 CAPOX 方案中,患者口服的是咪唑脱氧核苷(capecitabine),而不是注射药物。
CAPOX 方案通常每三周给药一次,连续进行8个疗程。
4. XELIRI 方案:XELIRI 方案是由氟尿嘧啶(5-FU)和伊立替康(irinotecan)组成的直肠癌术后化疗方案。
伊立替康是一种拓扑异构酶Ⅰ抑制剂,可阻断 DNA 复制和转录,起到杀死癌细胞的作用。
XELIRI 方案通常每两周给药一次,连续进行8个疗程。
5. 氟尿嘧啶单药化疗方案:对于某些高龄、并发症较多或身体状况较差的患者,氟尿嘧啶(5-FU)单药化疗是一种选择。
该方案每两周给药一次,连续进行6个疗程。
以上是常用的直肠癌术后化疗方案,具体的方案选择应根据患者的个体情况、术后病理结果和治疗效果来决定,需在医生的指导下进行。
直肠癌术后化疗方案

直肠癌术后化疗方案直肠癌是一种严重的消化系统疾病,常见于中老年人群。
手术是治疗直肠癌的主要方式,但手术后的化疗也是治疗直肠癌的必要手段之一。
本文将介绍直肠癌术后化疗方案。
1. 化疗的目的和适应症直肠癌术后化疗的主要目的是减少复发和远处转移的风险,提高患者的生存率。
化疗的适应症一般为手术后恶性肿瘤分期为Ⅲ期或Ⅳ期,以及术中发现肿瘤侵犯淋巴结的患者。
2. 化疗药物直肠癌术后化疗的药物可以单独使用或者联合用药。
常见的单独药物包括5-氟尿嘧啶(5-Fu)、卡铂、伊立替康等。
联合用药可以采用FOLFOX(5-Fu+卡铂+亚叶酸)或者FOLFIRI(5-Fu+伊立替康+亚叶酸)等方案。
3. 化疗方案直肠癌术后化疗方案根据患者的具体情况来制定,主要包括化疗的时间、用药量、药物的剂量和疗程等。
常见的化疗方案有以下几种:(1)FOLFOX方案:使用5-Fu 400mg/m2 + 卡铂85mg/m2,每三周为一个疗程,共进行6-8个疗程。
(2)FOLFIRI方案:使用5-Fu 400mg/m2 + 伊立替康180mg/m2,每两周为一个疗程,共进行6-8个疗程。
(3)CAPOX方案:使用卡铂130mg/m2 d1 + 口服药物奥沙利铂1000mg/d d1-14,每三周为一个疗程,共进行6-8个疗程。
(4)XELODA方案:使用口服药物5-Fu,每日1250-2000mg/m2,每两周为一个疗程,共进行6-8个疗程。
4. 化疗的不良反应化疗是一种强有力的治疗手段,但也会带来一定的不良反应。
常见的化疗不良反应包括恶心、呕吐、食欲减退、腹泻、便秘、脱发、口腔溃疡、手足综合征等。
在化疗期间,患者需要密切观察自身症状并及时向医生反馈,以便及时处理。
5. 结语直肠癌术后化疗方案应该针对患者的具体情况进行制定,治疗过程中应密切关注患者的不良反应,并及时进行处理。
在化疗期间,患者应注意饮食和休息,保持身体健康。
通过严格的化疗方案和科学的治疗方法,可以提高直肠癌患者的治愈率和生存质量。
结直肠癌最新化疗方案及靶向治疗
晚期/转移
「伊立替康
200mg/m2,静滴30或90分钟
FOLFIRI
伊立替康
180mg/m2,静滴0.5-2小时
第1天
晚期/转移
LV
400mg/m2,静滴0.5-2小时,1天或分
2天给予
第1天土
第2天
5-FU
400mg/m2,静推,然后给予
2400mg/m2,持续静滴46-48小时
第1、2天
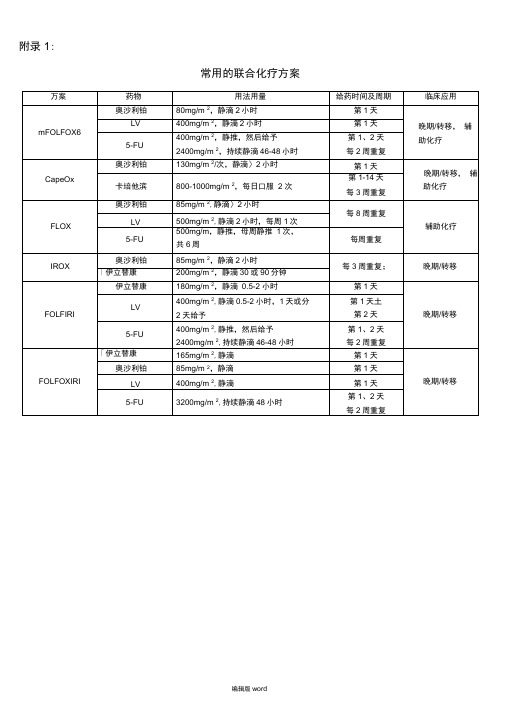
附录
常用的联合化疗方案
万案
药物
用法用量
给药时间及周期
临床应用
mFOLFOX6
奥沙利铂
80mg/m2,静滴2小时
第1天
晚期/转移, 辅助化疗
LV
400mg/m2,静滴2小时
第1天
5-FU
400mg/mLeabharlann ,静推,然后给予2400mg/m2,持续静滴46-48小时
第1、2天
每2周重复
CapeOx
奥沙利铂
130mg/m2/次,静滴〉2小时
与奥沙利铂与卡培他滨合用
7.5mg/kg,静滴30-90分钟,每3周重复。
主要不良反应为咼血压、蛋白尿;胃
肠道反应,甚至可出现穿孔、出血; 动脉血栓栓塞;乏力。
对本品、中国仓鼠卵巢细胞产物或其 它重组人类或人源化抗体过敏者禁 用。
如出现以下情况应停用:胃肠道穿 孔,涉及到内脏痿形成;需要干预的 伤口并发症;严重出血或动脉血栓事 件;高血压危象和高血压脑病;可逆
性后脑蛋白质脑病综合征; 肾病综合 症。
如出现以下情况需暂停使用:择期手
术前4周;药物控制不良的严重高血 压;中到重度的蛋白尿; 严重输液反 应。
孕妇不应使用,用药后至少六个月内 都要避孕。哺乳妇女用药期间应停止 哺乳,并在用药后至少6个月内不要 母乳喂养。
肠癌肝转移不再是晚期,癌转移最佳治疗方法告诉你

肠癌肝转移不再是晚期,癌转移最佳治疗方法告诉你肝脏是结直肠癌血行转移最主要的器官,在所有结直肠癌患者中发生率高达30%~50%,其中15%~25%的患者在确诊肠癌时即合并有肝转移,另有15%~25%的患者在肠癌原发灶根治性切除后发生肝转移。
如果这些病人没有接受治疗,中位生存期仅为6.9个月,5年存活率接近于0,肝转移是结直肠癌病人的主要死亡原因之一。
转移是恶性肿瘤的基本特征,但并不是说转移就一定是恶性肿瘤的晚期。
在所有的消化道肿瘤转移中,肠癌肝转移有其特殊性,被医学界认为可治,或者说是疾病的特殊状态。
与其他的消化道肿瘤不同,肠癌的转移灶很大可能仅局限于肝脏,不伴有其他地方转移。
通俗地说:出现了肝转移,并不意味着一定会有其他地方的转移,只要手术能切除肝脏的转移,可以获得和没有肝脏转移类似的治疗效果。
手术切除肝转移病灶仍是目前治疗结直肠癌肝转移的最佳方法,经手术切除后,肝转移灶完全切除的患者中位生存期为35-45个月,肠癌肝转移术后患者5年的生存率达到将近50%,要优于一些没有转移的恶性程度很高的三期肠癌。
对于一些有肝转移的肠癌患者,以前需要通过2次手术切除肠癌原发灶和肝转移灶,两者之间间隔2-3个月,对于患者的创伤巨大。
随着腹腔镜和机器人的使用,我们率先在国际上提出了一次手术同时切除肝转移灶和结直肠癌原发灶的治疗理念,经过经10年的实践,证明一次手术能大大降低手术对患者的打击,有效降低了手术创伤和手术费用,且不增加手术并发症。
另外,部分肠癌肝转移患者在就诊时已经失去了肝脏病灶手术机会,或者只能肝脏病灶部分切除,我们可以采用综合治疗的手段,包括化疗、分子靶向治疗、消融治疗以及中药治疗,把肿瘤控制在长期不发展的状态。
我国药学家研究的水溶性人参皂苷Rg3是近些年来最为重要的中药辅助治疗,在治疗过程中除了可以辅助西医治疗缓解副作用的同时还可以辅助肿瘤既不会迅速变大,也不会很快转移,也不会对其肝脏功能造成很大影响,既把病情控制在可控的范围内,也保留患者的生活质量,其药理作用在于研究发现rg3可切断肿瘤新生血管具有抑制肿瘤生长,诱导肿瘤细胞凋亡的作用,同时还可以修复受损干细胞,提高免疫力,水溶性更有利于身体的吸收,具有实际延长患者生存期的作用。
无法治愈的晚期结直肠癌肝转移患者的临床病理特征与姑息性治疗预

无法治愈的晚期结直肠癌肝转移患者的临床病理特征与姑息性
治疗预
晚期结直肠癌肝转移患者的临床病理特征包括严重的身体虚弱、严重的肝功能损害、持续的胃肠道症状、浸润性肝癌、失重、贫血、乏力、食欲不佳等。
此外,约50%的结直肠癌患者在
诊断时已有肝转移。
对于无法治愈的晚期结直肠癌肝转移患者,姑息性治疗是非常重要的治疗选择。
姑息性治疗主要包括控制症状、缓解疼痛、维持营养支持、保持患者的生命质量,并耐受化疗等。
晚期结直肠癌肝转移患者的姑息性治疗需要采取综合治疗措施,包括分别采取药物、康复治疗、心理干预、膳食支持等多个方面的治疗措施。
药物治疗:姑息性治疗的药物选择应根据患者情况量身定做,主要是以对症处理为主,姑息性放疗可以减轻患者的疼痛,特别是对于由于骨骼疾病引起的疼痛,姑息性放疗往往能够缓解症状。
康复治疗:应开展健康教育、康复训练、氧气导入等以促进恢复和维持健康,让患者尽可能地减轻痛苦,提高生活质量,增强抵抗力。
心理干预:晚期肝转移患者需要集中注意力,调整心态,克服或者减轻意识形态的压力,增强抵抗力,提高生活质量。
膳食支持:要适当的开展对患者的膳食指导,建立患者的膳食上的饮食方案,包括高能量,高蛋白等。
对于晚期结直肠癌肝
转移患者而言,姑息性治疗不仅可以减轻病情,提高生活质量,还可以降低疼痛和其他相关症状的发生,增强免疫力,缓解患者痛苦和就医费用,对于晚期肝转移患者而言更是选择中的首选。
结直肠癌四期治疗方案

摘要:结直肠癌四期,也称为晚期结直肠癌,是指癌细胞已经扩散到身体其他部位的结直肠癌。
由于病情的严重性,治疗策略需要综合多种方法,包括手术、化疗、放疗、靶向治疗和免疫治疗等。
本文将详细介绍结直肠癌四期的治疗方案,旨在为患者和家属提供参考。
一、概述结直肠癌四期治疗的目标是控制病情进展,减轻症状,提高生活质量,延长生存期。
治疗方案应根据患者的具体情况、肿瘤的生物学特性以及患者的整体状况进行个体化制定。
二、治疗方案1. 手术治疗(1)原发肿瘤切除:对于局部可切除的结直肠癌四期患者,手术切除原发肿瘤是首选治疗方法。
手术方式包括开腹手术和腹腔镜手术。
(2)区域性淋巴结清扫:如果肿瘤侵犯邻近淋巴结,手术中可能需要进行区域性淋巴结清扫。
(3)肝转移灶切除:对于肝转移灶数量有限且位于肝脏表面、周围无重要血管侵犯的患者,可行肝转移灶切除。
2. 化疗化疗是结直肠癌四期治疗的重要手段,旨在抑制肿瘤细胞的生长和扩散。
化疗方案包括:(1)FOLFOX方案:5-氟尿嘧啶(5-FU)、亚叶酸钙(FA)和奥沙利铂(Ox)组成的联合化疗方案。
(2)FOLFIRI方案:5-FU、亚叶酸钙和伊立替康(I)组成的联合化疗方案。
(3)CAPOX方案:5-FU、奥沙利铂和卡培他滨(CaP)组成的联合化疗方案。
(4)FOLFIRI+贝伐珠单抗(Bev)方案:FOLFIRI方案联合贝伐珠单抗治疗。
3. 放疗放疗主要用于控制局部肿瘤和缓解症状。
放疗方式包括:(1)外照射放疗:针对局部肿瘤进行放疗。
(2)近距离放疗:通过插入放射源直接作用于肿瘤。
(3)立体定向放射治疗:利用计算机技术对肿瘤进行精确照射。
4. 靶向治疗靶向治疗针对肿瘤细胞特异性分子靶点,抑制肿瘤生长和扩散。
常用靶向药物包括:(1)贝伐珠单抗(Bev):抑制血管内皮生长因子(VEGF)信号通路。
(2)西妥昔单抗(Cet):针对表皮生长因子受体(EGFR)。
(3)帕尼单抗(Pan):针对VEGF受体2。
结肠癌转移肝的治疗方案

一、引言结肠癌是我国常见的恶性肿瘤之一,近年来其发病率逐年上升。
结肠癌转移至肝脏是晚期结肠癌常见的转移部位,肝脏转移的结肠癌患者预后较差。
针对结肠癌转移肝的治疗,目前尚无统一方案,本文将介绍结肠癌转移肝的治疗方案。
二、治疗方案1. 手术治疗(1)肝转移灶切除术:对于肝脏转移灶数目较少、病灶较局限、无严重并发症的患者,可考虑行肝转移灶切除术。
手术方式包括根治性肝切除术、扩大根治性肝切除术等。
(2)原发灶切除术:在行肝转移灶切除术前,应先进行原发灶的切除,以降低肿瘤负荷,提高手术成功率。
2. 放射治疗(1)局部放射治疗:适用于肝脏转移灶数目较少、病灶较局限的患者。
局部放射治疗可减轻肿瘤负荷,缓解症状,提高生活质量。
(2)立体定向放射治疗(SRT):适用于肝脏转移灶数目较多、病灶较大、患者身体状况较差的患者。
SRT具有精准度高、损伤小、疗效好的特点。
3. 化学治疗(1)全身化疗:适用于多数结肠癌转移肝患者。
常用的化疗方案包括FOLFOX、FOLFIRI、FOLFIRI-XELOX等。
化疗期间需密切观察患者的肝功能、肾功能、血常规等指标,及时调整化疗方案。
(2)靶向治疗:针对结肠癌患者中常见基因突变,如K-RAS、BRAF、EGFR等,可选用相应的靶向药物进行治疗。
如针对K-RAS突变,可选用奥沙利铂;针对BRAF 突变,可选用达拉非尼;针对EGFR突变,可选用吉非替尼等。
4. 免疫治疗免疫治疗是近年来新兴的治疗方法,针对结肠癌患者中的肿瘤微环境,提高机体对肿瘤的免疫力。
目前常用的免疫治疗药物包括PD-1抑制剂、CTLA-4抑制剂等。
5. 综合治疗对于晚期结肠癌转移肝患者,可根据患者具体情况,采用手术、放疗、化疗、靶向治疗、免疫治疗等多种方法进行综合治疗。
三、治疗方案的选择与注意事项1. 治疗方案的选择应根据患者的具体情况,包括肿瘤分期、转移灶数目、病灶大小、患者年龄、身体状况、经济状况等因素综合考虑。
肠癌有什么治疗方法

肠癌有什么治疗方法
肠癌的治疗方法主要包括手术治疗、化学药物治疗、放射治疗、内镜下治疗和靶向治疗。
手术治疗:手术治疗是肠癌的主要治疗手段,通过手术切除病变部位区域的肠系膜和淋巴结,以降低肿瘤复发的概率。
对于早期肠癌,手术切除后可能治愈;对于晚期肠癌,手术可以缓解症状,延长生存期。
化学药物治疗:化学药物治疗是肠癌不可切除性患者的常用手段,可提高患者生存率。
常用的化疗药物包括氟尿嘧啶、亚叶酸钙等,可以单独使用或联合使用。
放射治疗:放射治疗适用于病灶发生在相对固定的直肠和下段乙状结肠的肠癌患者。
术前进行放射治疗有利于手术过程中将肿瘤组织剥离、切除干净,术后放射治疗有助于降低肠癌复发的概率。
内镜下治疗:对于局限于黏膜层的早期肠癌,可以对病变部位采取内镜下电凝切除或剥离切除。
靶向治疗:对于肠癌比较轻微的患者,可以在医生的指导下服用靶向药物来进行治疗,比较常见的药物有呋喹替尼胶囊、瑞戈非尼片等,可以抑制肿瘤增生、切断肿瘤营养供应,从而起到治疗作用。
在治疗期间,患者需要保持良好的心态,同时也要避免食用辛辣的食物,避免影响治疗效果。
肿瘤的转移的治疗方法

肿瘤的转移的治疗方法
肿瘤的转移治疗方法主要包括手术切除、放疗、化疗、靶向治疗和免疫治疗等。
1. 手术切除:对于局部转移或具有手术指征的转移肿瘤,可通过手术切除直接去除转移病灶,以减轻症状和延长生存时间。
2. 放疗(放射疗法):通过使用高能X射线或其他射线来破坏转移病灶的细胞结构和功能,从而抑制肿瘤细胞的生长和扩散。
3. 化疗(化学疗法):使用化学药物通过静脉注射、口服或局部注射等方式,针对全身或局部治疗,以杀死或阻止肿瘤细胞的增殖。
4. 靶向治疗:利用特定的靶向药物,针对肿瘤细胞上的特定分子靶点进行治疗,比如抑制血管生成、抑制特定的信号通路等,以达到控制肿瘤生长和扩散的目的。
5. 免疫治疗:通过激活和增强患者自身的免疫系统,以识别和攻击肿瘤细胞,包括使用免疫检查点抑制剂、细胞免疫治疗(如CAR-T细胞疗法)等。
在实际应用中,不同的转移肿瘤治疗方案可能会结合使用,根据肿瘤类型、转移部位、患者身体状况等因素进行个体化的治疗方案设计。
结直肠癌晚期怎么治疗最好的方法

结直肠癌晚期怎么治疗最好的方法
结直肠癌晚期的治疗方案通常是多学科综合治疗,包括手术、放疗和化疗等:
1. 手术:对于可行的患者,手术是首选治疗方法。
根据病情,可能进行结肠切除术、直肠切除术、术中淋巴结清扫等。
手术可以有效去除肿瘤和转移灶。
2. 放疗:放疗可以通过高能射线杀死癌细胞或减小肿瘤体积,减轻相关症状。
可以采用外部放疗或内部放疗。
3. 化疗:化疗可以通过药物杀灭癌细胞,抑制癌细胞生长和扩散。
多种抗癌药物可以用于结直肠癌的化疗,常见的方案包括FOLFOX、FOLFIRI等。
4. 靶向治疗:对于具有特定变异的结直肠癌患者,靶向治疗可能会更有效。
一些药物可以针对特定的癌细胞生长信号途径进行干扰,如抗VEGF药物(如贝伐单抗)、抗EGFR药物(如西妥昔单抗)等。
5. 免疫治疗:免疫治疗是近年来的新兴治疗方法,可以增强机体的免疫力,促进自身免疫系统攻击癌细胞。
如PD-1或PD-L1抑制剂等。
最好的治疗方法应该是根据患者的具体情况综合考虑,与医生充分沟通后确定的个体化治疗方案。
每个人的情况不同,需要进行全面评估,包括年龄、身体状况、
病理学特征、分期等因素。
直肠癌术后化疗方案

直肠癌术后化疗方案直肠癌是一种常见的消化系统恶性肿瘤,手术切除是主要的治疗方式。
然而,手术后的化疗在预防癌细胞复发和提高生存率方面起着重要的作用。
本文将介绍直肠癌术后化疗方案。
一、术后化疗的目的术后化疗的目的是清除手术后残留的癌细胞,预防肿瘤复发和转移,提高患者的生存率和生活质量。
化疗通过药物杀灭癌细胞,消除微转移病灶,避免癌细胞复发和转移。
二、化疗药物的选择化疗药物的选择通常基于患者的个体情况、肿瘤分期和手术病理结果。
常用的化疗药物包括氟尿嘧啶、奥沙利铂、卡培他滨等。
具体的化疗方案应由医生根据患者情况综合考虑。
三、化疗方案1. FOLFOX方案:FOLFOX方案是指联合使用氟尿嘧啶、亚叶酸和奥沙利铂进行化疗。
具体方案如下:氟尿嘧啶:静脉滴注,每两周一次,剂量根据患者体表面积进行调整。
亚叶酸:口服,每日一次。
奥沙利铂:静脉注射,每两周一次,剂量根据患者体表面积进行调整。
2. CAPOX方案:CAPOX方案是指联合使用卡培他滨和奥沙利铂进行化疗。
具体方案如下:卡培他滨:口服,每日两次,连续14天。
奥沙利铂:静脉注射,每两周一次,剂量根据患者体表面积进行调整。
3. XELOX方案:XELOX方案是指联合使用氟尿嘧啶和奥沙利铂进行化疗。
具体方案如下:氟尿嘧啶:口服,每日两次,连续14天。
奥沙利铂:静脉注射,每两周一次,剂量根据患者体表面积进行调整。
四、化疗方案的副作用和管理化疗方案可能会引起一系列的副作用,包括恶心、呕吐、腹泻、脱发、骨髓抑制等。
医生会根据患者的具体情况进行副作用的管理和治疗,以提高患者的耐受性和生活质量。
五、化疗方案的疗效评估和调整化疗期间,医生会定期对患者进行检查和评估疗效。
如果治疗效果良好,化疗方案可以继续进行;如果治疗效果不理想,医生会考虑调整方案或采取其他治疗措施。
六、其他治疗辅助手段除了化疗,还可以考虑联合放疗、靶向治疗和免疫治疗等辅助手段,以进一步提高治疗效果。
具体的治疗方案应根据患者的情况进行个体化制定。
结直肠癌常用化疗方案

结直肠癌常用化疗方案(一)伊立替康+亚叶酸钙+5-FU (FOLFIRI) 方案适用于:1.局部进展期、局部复发或转移性结直肠腺癌,手术或放疗不能治愈者的一线治疗2.作为上述患者的二线治疗,曾接受以奥沙利铂为基础的一线治疗后3. ECOG的PSp≤24.足够的骨髓储备(ANC≥1.5×109/L,血小板>100×109/L)5.正常的肾功能(肌酐≤1.5×ULN)与肝功能(胆红素≤26;谷草转氨酶/碱性磷酸酶≤5×ULN)6.以下病人慎用:⑴有盆腔放疗史⑵近期心肌梗塞病史⑶不可控制的心绞痛,高血压,心率失常,充血性心衰或其他严重的疾病7.每天基础排便>3次稀便的病人慎用(没有结肠与回肠造漏术者)化疗前预处理:1.按中高度致吐性的化疗,进行抗呕吐的预防用药2.可考虑用阿托品预防腹泻每14天重复1次,最多可用24个周期。
如果病人仅有2级或2级以下毒性,静注的5-FU剂量可以在第3周期增加到3000mg/m2*伊立替康与亚叶酸钙可以通过末端相连的Y型三通实现在两小时内同时输入。
奥沙利铂与亚叶酸钙不能加在同一个输液瓶(袋)中,奥沙利铂与生理盐水不兼容,所以不能用生理盐水溶解、稀释或冲管所有病人应备易蒙停,并指导病人在腹泻出现时怎样服用。
注意事项:1.腹泻:可以危及生命,需要立刻进行积极治疗。
1)早期腹泻或腹痛性痉挛是指24小时内发生的。
用阿托品治疗 0.3-1.2mg IV或SC。
在以后的治疗中应预防性应用阿托品。
2)迟发性腹泻开始出现在用药后5~11天,一般持续3~7天,必须给予洛哌丁胺治疗。
让病人备用洛哌丁胺,在第1次出现不成形大便或稀便或次数较平时增多时开始服用。
3)首次4mg4)然后2mg/2h直到最后一次腹泻后12h5)推荐患者饮用大量含电解质的饮料来代替液体与生理盐水6)足量的洛哌丁胺治疗后仍持续性腹泻的病人或者患者在腹泻同时伴有发热,即便是没有中性粒细胞的减少都应考虑口服氟喹诺酮类抗生素(如环丙沙星)。
直肠癌发生肝转移还能治吗,治疗方法

直肠癌发生肝转移还能治吗,治疗方法直肠癌发生肝转移是直肠癌晚期的表现之一,治疗难度较大。
但如果早期发现并及时治疗,仍有治疗的可能性。
治疗方法包括手术切除、放疗、化疗、介入治疗等,此外还需要注意的事项有营养支持、减轻疼痛、心理疏导等方面。
一、治疗方法1.手术切除对于肝转移比较单发而且结节较小的患者,可以考虑手术切除。
手术切除对于局限于肝脏的转移效果较好,可以获得比较长的生存时间。
手术切除的情况下,要求患者身体状况较好,手术前需要进行全面的评估。
2.放疗对于不能手术切除的患者,可以考虑单独的放疗。
放疗主要是利用辐射破坏癌细胞的生长,控制癌细胞的扩散。
放疗可以联合化疗并使用,但这种方法对于治疗晚期癌症效果较差。
3.化疗化疗是以药物为主要手段进行的治疗方法。
可以选择一种或多种药物进行治疗,以达到控制肿瘤、缓解症状、延长生存时间的目的。
4.介入治疗介入治疗是通过导管将化疗药物或放射性物质直接注入肝脏的肿瘤内或肝动脉进行治疗。
这种治疗方法可以最大限度地减少化疗药物对正常组织的破坏,同时又能够保持治疗的疗效。
介入治疗一般需要经过专家评估之后才能选择。
二、注意事项1. 营养支持患者在治疗期间需要保持良好的营养状况,以增强身体抵抗力。
可以采用口服营养补充剂、静脉输液等方式来满足患者的营养需求。
同时也需要注意控制食物的热量摄入,以防止体重过度增加。
2. 心理疏导患者在治疗期间可能会面临很多心理压力,如恐惧、焦虑、抑郁等。
朋友、家人、医生的支持和理解对患者的恢复非常重要。
可以寻求心理医生的帮助,进行心理疏导。
3. 减轻疼痛治疗期间可能会出现疼痛,如肝脏内的钝痛、神经痛等。
可以使用镇痛药物来缓解疼痛,同时定期进行疼痛评估,以适当调整药物剂量。
4. 健康生活方式治疗期间需要尽量保持健康的生活方式。
可以适当增加运动量,保持良好的睡眠和饮食习惯,以提高身体免疫力,并改善治疗效果。
5. 定期随访治疗期间需要定期到医院进行随访,以及时了解治疗的效果,调整治疗方案,避免治疗的延误。
肿瘤转移的机制与治疗策略

肿瘤转移的机制与治疗策略肿瘤转移是癌症治疗中的一个重要挑战,它导致了许多患者的死亡。
了解肿瘤转移的机制并探索相应的治疗策略对于提高癌症患者的生存率和生活质量至关重要。
本文将讨论肿瘤转移的机制以及相关的治疗策略。
一、肿瘤转移的机制肿瘤转移是指癌细胞从原发肿瘤转移到其他身体部位的过程。
肿瘤细胞转移到其他部位的能力是癌症的一个关键特征,它使得癌症变得更加恶性并导致病情恶化。
1.入侵与侵袭肿瘤细胞通过附着于正常细胞表面并破坏其细胞骨架来进行侵袭。
它们通过产生特定的分子来调节细胞粘附和迁移,进而通过血管内皮细胞进入血液循环或淋巴系统。
2.血液循环转移肿瘤细胞进入血液循环后,要面对许多障碍,包括机械和免疫防御。
只有少数肿瘤细胞能够逃过这些障碍,并在远离原发肿瘤的器官定居。
3.远处定居与细胞适应远处定居是肿瘤细胞成功生长形成转移肿瘤的关键步骤。
在新的微环境中,肿瘤细胞必须适应不同的生长要求并与周围组织相互作用。
二、肿瘤转移的治疗策略1.手术治疗手术是治疗肿瘤转移的常见方法,尤其适用于早期转移的患者。
通过手术切除转移灶,可以降低肿瘤负荷,减少转移风险。
2.放射治疗放射治疗利用高能辐射杀死肿瘤细胞,可以控制转移灶的生长和扩散。
它可以作为手术前后的辅助治疗手段,以提高治疗效果。
3.化学疗法化学疗法通过使用毒性药物杀死癌细胞,可以控制转移灶的生长和扩散。
它可以用于系统性治疗,降低全身肿瘤负荷。
4.靶向治疗靶向治疗是指通过干扰癌细胞特定的信号通路或分子靶点来抑制肿瘤的生长和转移。
针对不同类型的癌症,可选择不同的靶点和药物来进行治疗。
5.免疫治疗免疫治疗通过激活机体免疫系统来攻击癌细胞,可以提高机体的免疫应答,抑制肿瘤的生长和转移。
这包括使用免疫检查点抑制剂和CAR-T细胞疗法等。
6.综合治疗策略肿瘤转移是一个复杂的过程,涉及多个细胞和分子的相互作用。
综合治疗策略是指综合应用多种治疗手段,包括手术、放疗、化疗、靶向治疗和免疫治疗等,以达到最佳的治疗效果。
结肠癌化疗标准方案

结肠癌化疗标准方案结肠癌是一种常见的恶性肿瘤,化疗是结肠癌治疗的重要手段之一。
针对不同阶段的结肠癌患者,化疗标准方案也有所不同。
下面将介绍结肠癌化疗的标准方案。
一、早期结肠癌患者的化疗标准方案。
对于早期结肠癌患者,手术是主要的治疗手段。
术后化疗主要是为了预防癌细胞的转移和复发。
常用的化疗药物包括氟尿嘧啶、卡培他滨等。
化疗周期一般为6个月左右,具体剂量和方案需根据患者具体情况而定。
二、晚期结肠癌患者的化疗标准方案。
对于晚期结肠癌患者,化疗是主要的治疗手段之一。
常用的化疗方案包括FOLFOX方案和FOLFIRI方案。
FOLFOX方案包括氟尿嘧啶、奥沙利铂和亚叶酸钙,通常每两周进行一次化疗。
FOLFIRI方案包括氟尿嘧啶、伊立替康和亚叶酸钙,通常每两周进行一次化疗。
此外,靶向治疗也是晚期结肠癌的重要治疗手段,常用的靶向药物包括贝伐珠单抗和西妥昔单抗等。
三、转移性结肠癌患者的化疗标准方案。
对于转移性结肠癌患者,化疗是延长生存期和提高生活质量的重要手段。
常用的化疗方案包括FOLFOXIRI方案和FOLFIRINOX方案。
FOLFOXIRI方案包括氟尿嘧啶、奥沙利铂、伊立替康和亚叶酸钙,通常每两周进行一次化疗。
FOLFIRINOX方案包括氟尿嘧啶、奥沙利铂、伊立替康和伊立替康,通常每两周进行一次化疗。
总之,结肠癌化疗的标准方案需要根据患者的具体情况而定,包括肿瘤的分期、患者的年龄、身体状况等。
化疗过程中需要密切关注患者的身体反应,及时调整治疗方案,以达到最佳的治疗效果。
希望结肠癌患者能够早日康复,重返健康的生活。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初始可NED的mCRC寡转移:围手术期治疗策略
初始可NED
围术 患者
组0
初始可切
目标
期治愈
手术
组1
潜在可切 最大程度缩小肿瘤
治疗强度
组2
疾病恶化伴有症状
快速缩小肿瘤/ 疾病控制
组3
无症状
疾病控制/ 低毒
CRC初始可NED寡转移的处理策略
可NED
手术/ 局部治疗
新辅助 化疗
安全性: • 术前治疗疗程与手术并发症相关; • 使用含Bev的方案时,需要特别关注外科相关安全性问题。
内容概要
• 寡转移概念及其对mCRC治疗策略的影响 • mCRC寡转移的治疗思路
– 全身治疗与局部治疗的布局
• 围手术期策略 • 转化治疗策略
– 挑选合适的局部治疗方式
• mCRC寡转移的生物学行为筛选
• 定义: – 寡转移指肿瘤转移过程中的一种中间状态,它是介于局限性原发瘤及广泛性转移瘤 之间生物侵袭性较温和的阶段,在这个阶段中,原发性肿瘤只引起少数局部的继 发性肿瘤,通常≤5个。 – 代表潜在可治疗的状态,治疗的关键是手术、放疗和射频消融等局部治疗,同时 应用全身化疗兼顾预防进一步的远处转移。 – 目前肺癌、乳腺癌、前列腺癌……..
mCRC患者局部治疗筛选/预后评估
肿瘤部位 的影响
复发风险 评分
• 预后评估就是筛选生物学 行为的过程;
肿瘤生物学 行为
(瘤品)
基因状态
• 全身治疗的疗效和持续时 间是观察生物学行为的最 佳手段;
• 筛选好的患者进行积极的 局部治疗;
对治疗的 反应
• 筛选差的患者避免过度的 积极治疗(尤其是手术)
– 全身治疗与局部治疗的布局
• 围手术期策略 • 转化治疗策略
– 挑选合适的局部治疗方式
• mCRC寡转移的生物学行为筛选
2014 ESMO指南:目标导向的治疗策略
患者 目标
组0
初始可切
治愈
组1
潜在可切
组2
疾病恶化伴有症状
最大程度缩小肿瘤
快速缩小肿瘤/ 疾病控制
组3
无症状
疾病控制/ 低毒
手术
FOLFOX 围术期化疗
• 结直肠癌寡转移定义: – 结直肠癌寡转移: ESMO在2015年首先提出、2016系统阐述 – 2016 ESMO定义: ≦2个部位,≦ 5个病灶
• 概念延伸: – 寡复发:oligo-recurrence – 同时性寡转移:sync-oligometastasis – 寡进展:oligo-propression
• 手术 • 非手术LATs
• 治疗目标的调整
– 治愈:R0、NED – 缩瘤:转化、减状 – 疾病控制
“寡转移”Oligometastasis
• 概念提出:1995年 – 芝加哥大学:生物科学系前主任Samuel Hellman和医学中心放射和分子治疗科主 任Ralph Weichselbaum提出
• 围手术期策略 • 转化治疗策略
– 挑选合适的局部治疗方式
• mCRC寡转移的生物学行为筛选
“mCRC转化治疗”新内涵
• 转化治疗:
– 技术性转化治疗:technical conversion therapy • 转化成功的预期概率相对较高
– 寡转移:初始不可NED转化为可NED
– 生物学行为转化治疗:biological conversion therapy • 转化成功多为意外偶得 • 预后更差者主张按此类别处理
mCRC可切除性
Resectability
≠
• 肿瘤学因素:远期疗效
– 切除后的复发、转移风险 (数目、大小、LNM、间隔)
mCRC可治愈性
Curability
影响mCRC转移瘤切除术后预后的因素
• 肿瘤临床病理参数:CRS(复发风险评分) • 原发瘤的部位 • 基因层面:RAS、BRAF。。。。 • 新兴标志物:CTCs、ctDNA • 肿瘤倍增时间 • 对治疗的反应 • 治疗后的肿瘤病理退缩(TRG) • 治疗模式的影响:
尤其适用于转化后OMD的治疗决策
mCRC寡转移治疗策略 结语
• 如何优化结直肠癌寡转移的治疗?
– 仔细评估预后及生物学行为 – 合理布局全身治疗与局部治疗的顺序 – 使用积极、有效的全身治疗方案(化疗、靶向) – 选择合理的局部治疗手段(手术、其他)
“有效的全身治疗+积极的局部治疗”缺一不可
寡转移:以NED为目标 非寡转移:想尽办法变为寡转移
– 右半、BRAF突变、MSI-H
• 寡转移:“非寡转移”转化为“寡转移”
转化治疗决策:需要考量的因素
• 患者的因素:
– 身体状况:仅Fit患者适合
转化治•疗具–体最全佳身模治式疗:方化案疗+的靶影向响药因物素(VEGF、
– 疾病状况:技术性 vs 生物学转化
EGFR)
• 转––化手 手后术 术局+为➢部局主治部需毁➢疗要损手需好段要的的好倾方向的案性身::体高:的能有耐效––受率影 方 济强,响 案烈因 要化素 求治疗: :疗预高+靶后效、、向预低测毒、安全、经
mCRC寡转移的整体治疗策略
内容概要
• 寡转移概念及其对mCRC治疗策略的影响 • mCRC寡转移的治疗思路
– 全身治疗与局部治疗的布局
• 围手术期策略 • 转化治疗策略
– 挑选合适的局部治疗方式
• mCRC寡转移的生物学行为筛选
内容概要
• 寡转移概念及其对mCRC治疗策略的影响 • mCRC寡转移的治疗思路
– 挑选合适的局部治疗方式
• mCRC寡转移的生物学行为筛选
寡转移(OMD) 局部治疗与全身治疗的布局
mCRC寡转移(OMD)的处理
ESMO 2016指1南4
mCRC以NED及局部治疗为核心的策略也适用于OMD
可NED
手术/ 局部治疗
新辅助 化疗
辅助化疗
手术/ 局部治疗
辅助化疗
初始不可 NED
mCRC寡转移的三种类型
• 同时性寡转移 • 异时性寡转移 • 广泛转移全身系统治疗后诱导形成寡转移(生物学转化?)
• 转移部位以肝、肺、非区域淋巴结为主
– 仅肝转移:30%~60% – 仅肺转移:5%~10% – 肝肺双脏器转移:~10%
Lancet Oncol 2013; 14: e28–37
辅助化疗
手术/ 局部治疗
辅助化疗
➢ 治疗目标:NED →治愈 1. 局部治疗后疗效更好,减少复发,长期生存 2. 甄别快速进展者,避免过度/不必要的手术/局部治疗
新辅助化疗:给予一个时间窗-“生物学等待窗”
初始可切除mCRC: ESMO 2015
预后信息
不适用于NEW EPOC结论
差 (或FO最LF好O的X生围全手物身术学治期疗转化方疗化案)
多
辅
转化性
学
科
可切除
手术/
助
局部治疗
化
化疗
评
不可切除
疗
估
以治疗目标为导向的临床治疗策略
初始可NED
初 始 不 可 NED
组0
围术 患者
初始可切
目标
治愈
期
手术
组1
转化 潜在可切
最大程度缩小肿瘤
优先 治疗强度
组2
组3
姑息治疗 疾病恶化伴有症状
无症状Biblioteka 快速缩小肿瘤/疾病控制/
全程管理 疾病控制
低毒
以NED及局部治疗为核心的OMD治疗策略 mCRC
– 局限性mCRC (寡转移) vs 广泛性mCRC – 制定具体治疗方法的核心
2016 ESMO mCRC主要改变
• 分类替代传统分组
– 患者状况分类:fit 、unfit – 疾病状态分类:寡转移、广泛转移
• 强调局部治疗在寡转移性疾病中的价值
– 局部毁损性治疗“(Local Ablative Treatment,LAT)
✓ 常用的非手术局部治疗手段包括:各种消融术(射频、微波、冷冻 等)、立体定向放疗(SBRT)、高剂量近距离放疗、放射性栓塞 治疗等。
mCRC治疗新理念
可切除mCRC 可局部治疗mCRC
内容概要
• 寡转移概念及其对mCRC治疗策略的影响 • mCRC寡转移的治疗思路
– 全身治疗与局部治疗的布局
• 围手术期策略 • 转化治疗策略
mCRC寡转移的重要性
• 寡转移的治疗终点:NED(无瘤状态) • 寡转移的治疗原则:全身治疗+局部治疗(包括手术) • 寡转移的治疗核心:最佳的围手术期治疗方案
✓ 对于所有的OMD患者,除了手术以外,均应考虑积极的局部治疗, 可以和手术联合使用;如因伴发病、估计残余器官功能不足或其他 因素而无法手术的OMD,更应积极应用各种局部治疗手段来配合 全身化疗。
容易
困难 技术
标准
2012 ESMO结直肠癌处理专家共识指南 Schmoll, et al. Ann Oncol 2012; 23: 2479-2516
D Arnold, et al. WCGIC 2015
内容概要
• 寡转移概念及其对mCRC治疗策略的影响 • mCRC寡转移的治疗思路
– 全身治疗与局部治疗的布局
➢ RAS/BRAF野生型需要考虑原发瘤 部位
➢ 突变型可不考虑
mCRC转化治疗的决策新思路
患者群体
RAS/BRAF野生型 --左半原发瘤 --右半原发瘤
RAS或BRAF突变型
首选方案
两药+Cet 三药+/-Bev 三药+/-Bev
可选方案
两药+Bev, 三药+/-Cet/Bev 两药+Bev 两药/三药+Cet(慎选,需要充分的基因检测)
