两种基因敲除小鼠的培育
基因敲除模式小鼠的饲养与交配

基因敲除模式小鼠的饲养与交配
首先,基因敲除小鼠的饲养需要提供适当的饲养环境。
小鼠的饲养箱
应设有合适的温度、湿度和光照条件,并保持干净卫生。
此外,提供干燥
而适宜的饮水和高质量的饲料也非常重要。
饲养箱内应使用吸水床或纸巾
等材料作为底材,以提供一定的保暖和舒适性。
其次,基因敲除小鼠的饮食需要特殊考虑。
一些基因敲除小鼠可能会
出现食欲不振或消化问题,因此饲养者应根据实际情况提供适合的饮食。
常用的饮食成分包括高能量饲料、高蛋白饲料等,以满足小鼠的营养需求。
基因敲除小鼠的交配需要注意遵守一定的原则以确保实验的有效性和
数据的可靠性。
一般来说,为了保持基因突变的稳定性,最好采用同基因
型的小鼠进行交配。
如果希望获得特定基因型的后代,可以选择雄性和雌
性基因敲除小鼠进行杂交。
交配时间和交配比例也需要根据具体实验设计
确定,通常可采用经典的一雄多雌的交配模式。
交配后,及时观察并记录
孕鼠的妊娠情况以及出生幼鼠的数量和基因型。
此外,基因敲除小鼠的饲养和交配还需要注意一些伦理和法律规定。
例如,需要合法获得该基因敲除小鼠的授权,并遵守实验动物的使用和保
护规定。
总而言之,基因敲除小鼠的饲养和交配需要提供良好的饲养环境和适
宜的饮食,遵守适当的饲养和交配原则,以及遵守相关的伦理和法律规定。
这些措施的实施将有助于保证实验的有效性和数据的可靠性。
《Bdh2基因敲除的小鼠胚胎干细胞的生物特性研究》范文

《Bdh2基因敲除的小鼠胚胎干细胞的生物特性研究》篇一摘要:本研究关注于Bdh2基因敲除的小鼠胚胎干细胞(ESCs)的生物特性研究。
通过基因编辑技术,我们成功构建了Bdh2基因敲除的ESCs模型,并对其细胞增殖、分化潜能、基因表达谱等方面进行了深入分析。
本文旨在解析Bdh2基因在小鼠ESCs中的作用,并进一步揭示其在生物医学研究中的应用潜力。
一、引言Bdh2基因,作为细胞内脂肪酸β-氧化途径的重要一环,其在生物体内具有至关重要的功能。
然而,Bdh2基因在小鼠胚胎干细胞中的具体作用尚未完全明确。
本研究旨在探讨Bdh2基因敲除对小鼠胚胎干细胞生物特性的影响,为研究其生物学功能提供理论基础。
二、材料与方法1. 材料实验选用的小鼠胚胎干细胞来自实验室前期培养的野生型和Bdh2基因敲除型ESCs。
2. 方法(1)通过CRISPR-Cas9技术,成功构建Bdh2基因敲除的小鼠胚胎干细胞模型;(2)运用细胞增殖实验、细胞周期检测、克隆形成实验等手段,研究Bdh2基因敲除对细胞增殖的影响;(3)采用实时定量PCR、免疫荧光等实验技术,探讨Bdh2基因敲除对小鼠胚胎干细胞分化潜能及基因表达谱的影响;(4)运用生物学信息分析方法,分析数据并绘制相关图表。
三、实验结果1. Bdh2基因敲除对小鼠胚胎干细胞增殖的影响实验结果显示,Bdh2基因敲除后,小鼠胚胎干细胞的增殖能力显著降低。
通过细胞周期检测发现,Bdh2基因敲除导致细胞周期停滞在G1期,S期细胞数量减少。
此外,克隆形成实验也证实了Bdh2基因敲除对细胞增殖的抑制作用。
2. Bdh2基因敲除对小鼠胚胎干细胞分化潜能的影响实时定量PCR和免疫荧光实验表明,Bdh2基因敲除后,小鼠胚胎干细胞的分化潜能发生改变。
在特定诱导条件下,Bdh2基因敲除的ESCs在向特定细胞类型分化的过程中出现障碍。
这表明Bdh2基因在小鼠胚胎干细胞的分化过程中发挥重要作用。
3. Bdh2基因敲除对小鼠胚胎干细胞基因表达谱的影响通过对Bdh2基因敲除前后小鼠胚胎干细胞的基因表达谱进行分析,我们发现一系列与细胞增殖、分化及代谢相关的基因表达发生改变。
基因敲除小鼠的实验流程

基因敲除小鼠的实验流程
一、前期准备
1、检索标记基因:采用全基因组测序技术或大规模基因组关联分析法筛选出敲除对研究有重要作用的基因;
2、设计敲除构建:根据筛选出的基因特异性序列,对基因进行深入分析,结合已有研究成果,根据基因的功能和结构确定可有效敲除的基因结构模型;
3、制备修饰质粒:根据设计模型,制备适当的质粒,使其具有足够的重组能力和具有全套的特异性对象;
4、选择载体:选择合适的载体(含有敲除的质粒),使敲除的基因更容易被载入小鼠细胞中进行修饰;
二、基因敲除实验
1、小鼠胚胎动物模型:小鼠胚胎是敲除小鼠研究的传统动物模型,采用小鼠母体体外受精,利用载体质粒将敲除基因引入胚胎,敲除的基因将被遗传给后代小鼠;
2、小鼠嵌合体模型:采用基因修饰技术将敲除基因嵌入小鼠细胞的质粒,多功能的抗体定位蛋白可以用来将质粒载入小鼠细胞,利用抗体定位系统,将修饰的嵌入小鼠胚胎,诱导而成嵌合体,使敲除的基因能够传递给后代;
3、选择敲除后的小鼠:将敲除实验的小鼠孵化。
H2-Eb1+H2-Ab1双基因敲除小鼠的鉴定及繁育

H2-Eb1+H2-Ab1双基因敲除小鼠的鉴定及繁育唐志元;王燕;吕靓;李林格;张华【摘要】目的饲养、繁殖和鉴定H2-Eb1+H2-Ab1双基因敲除小鼠,获得双纯合子H2-Eb1-/-+H2-Ab1-/-及双野生型H2-Eb1+/++H2-Ab1+/+小鼠,为深入研究H2-Eb1、H2-Ab1的基因功能奠定基础.方法基因敲除小鼠经适应性饲养2 w 后,分别将雌性杂合子和雄性杂合子小鼠合笼饲养并繁殖,提取鼠尾DNA,利用PCR 法鉴定其基因型.生产后代中的野生型和纯合子小鼠用于后续的生物学功能研究,杂合子小鼠用于繁殖及保种.结果小鼠成功繁殖,其中双纯合子H2-Eb1-/-+H2-Ab1-/-20只(20%),双野生型H2-Eb1+/++H2-Ab1+/+26只(26%),未鉴定出基因型54只(54%).成功获得H2-Eb1+H2-Ab1双基因敲除纯合子小鼠,并建立了饲养、繁殖和鉴定方法.结论采用雌性和雄性H2-Eb1+H2-Ab1双基因敲除杂合子小鼠交配,不仅可以获H2-Eb1+H2-Ab1双基因敲除纯合子小鼠,而且有利于长期饲养与繁殖.%Objective To feed,breed and identify the H2-Eb1+H2-Ab1 double gene knockout mice,in or-der to get the double homozygote type of H2-Eb1 -/- + H2-Ab1 -/- mice and double wild type of H2-Eb1 +/+ +H2-Ab1 +/+ mice,thereby laying the foundation for the study of the H2-Eb1and the H2-Ab1. Methods After the adaptive feeding of the knockout mice for 2 weeks,the female heterozygote type mice and the male heterozygous type mice were mated.The DNA of rat tail was extracted;the genotyping was determined using PCR method.The wild type mice and the homozygous type will be used for the following biological function research;the heterozygous type mice will be used for reproduction and survive.Results After successful reproduction,There were 20 doublehomozygote type of H2-Eb1 -/- + H2-Ab1 -/- (20%), 26 double wild type of H2-Eb1 +/+ +H2-Ab1 +/+ (26%),54 of unidentified the genes (54%).the homozy-gous type double knockout mice of H2-Eb1+H2-Ab1 were successfully established,and the breeding,re-production and appraisal method were done expectedly.Conclusion Mating of the male and female of het-erozygous type of double knockout mice of H2-Eb1 + H2-Ab1,not only can give birth to he homozygous type double knockout mice of H2-Eb1 + H2-Ab1,but also good for the reproduction and breeding long-term.【期刊名称】《新疆医科大学学报》【年(卷),期】2017(040)010【总页数】4页(P1261-1264)【关键词】双基因敲除;小鼠;基因鉴定;繁育方法【作者】唐志元;王燕;吕靓;李林格;张华【作者单位】新疆医科大学第一附属医院耳鼻咽喉科,乌鲁木齐 830054;新疆医科大学第一附属医院耳鼻咽喉科,乌鲁木齐 830054;新疆医科大学第一附属医院耳鼻咽喉科,乌鲁木齐 830054;新疆医科大学第一附属医院耳鼻咽喉科,乌鲁木齐830054;新疆医科大学第一附属医院耳鼻咽喉科,乌鲁木齐 830054【正文语种】中文【中图分类】Q784Abstract: Objective To feed, breed and identify the H2-Eb1+H2-Ab1 double gene knockout mice, in order to get the double homozygote typeof H2-Eb1-/-+H2-Ab1-/- mice and double wild type of H2-Eb1+/++H2-Ab1+/+ mice, thereby laying the foundation for the study of the H2-Eb1and the H2-Ab1. Methods After the adaptive feeding of the knockout mice for 2 weeks, the female heterozygote type mice and the male heterozygous type mice were mated. The DNA of rat tail was extracted; the genotyping was determined using PCR method. The wild type mice and the homozygous type will be used for the following biological function research; the heterozygous type mice will be used for reproduction and survive. Results After successful reproduction, There were 20 double homozygote type of H2-Eb1-/-+H2-Ab1-/- (20%), 26 double wild type of H2-Eb1+/++H2-Ab1+/+(26%), 54 of unidentified the genes (54%). the homozygous type double knockout mice of H2-Eb1+H2-Ab1 were successfully established, and the breeding, reproduction and appraisal method were done expectedly. Conclusion Mating of the male and female of heterozygous type of double knockout mice of H2-Eb1+H2-Ab1,not only can give birth to he homozygous type double knockout mice of H2-Eb1+H2-Ab1, but also good for the reproduction and breeding long-term. Keywords: double knockout; mice; gene identification; reproduction; mating基因敲除小鼠是建立在胚胎干细胞技术与基因同源重组等技术上的一种定向改变生物活体遗传信息的转基因动物,是研究疾病的发病机制、分子基础及寻找合适药物靶标的重要工具[1-2]。
两种基因敲除小鼠的生长与繁殖性能测定
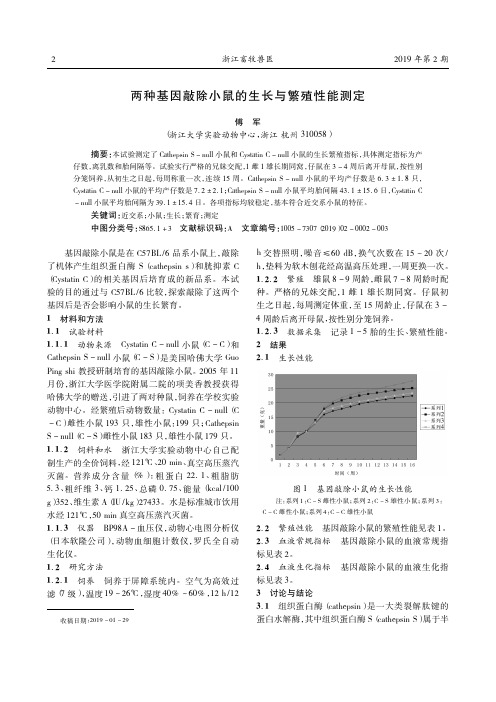
浙江畜牧兽医2019年第2期收稿日期:2019-01-29两种基因敲除小鼠的生长与繁殖性能测定傅军(浙江大学实验动物中心,浙江杭州310058)摘要:本试验测定了Cathepsin S-null小鼠和Cystatin C-null小鼠的生长繁殖指标,具体测定指标为产仔数,离乳数和胎间隔等。
试验实行严格的兄妹交配,1雌1雄长期同窝,仔鼠在3-4周后离开母鼠,按性别分笼饲养,从初生之日起,每周称重一次,连续15周。
Cathepsin S-null小鼠的平均产仔数是6.3ʃ1.8只,Cystatin C-null小鼠的平均产仔数是7.2ʃ2.1;Cathepsin S-null小鼠平均胎间隔43.1ʃ15.6日,Cystatin C -null小鼠平均胎间隔为39.1ʃ15.4日。
各项指标均较稳定,基本符合近交系小鼠的特征。
关键词:近交系;小鼠;生长;繁育;测定中图分类号:S865.1+3文献标识码:A文章编号:1005-7307(2019)02-0002-003基因敲除小鼠是在C57BL/6品系小鼠上,敲除了机体产生组织蛋白酶S(cathepsin s)和胱抑素C (Cystatin C)的相关基因后培育成的新品系。
本试验的目的通过与C57BL/6比较,探索敲除了这两个基因后是否会影响小鼠的生长繁育。
1材料和方法1.1试验材料1.1.1动物来源Cystatin C-null小鼠(C-C)和Cathepsin S-null小鼠(C-S)是美国哈佛大学Guo Ping shi教授研制培育的基因敲除小鼠。
2005年11月份,浙江大学医学院附属二院的项美香教授获得哈佛大学的赠送,引进了两对种鼠,饲养在学校实验动物中心。
经繁殖后动物数量:Cystatin C-null(C -C)雌性小鼠193只,雄性小鼠:199只;Cathepsin S-null(C-S)雌性小鼠183只,雄性小鼠179只。
1.1.2饲料和水浙江大学实验动物中心自己配制生产的全价饲料,经121ħ、20min、真空高压蒸汽灭菌。
基因敲除小鼠

基因敲除小鼠摘要基因敲除小鼠是一种常用的实验动物模型,可以帮助科学家研究基因在生物体发育和功能中的作用。
本文将介绍基因敲除小鼠的定义、用途以及常用的敲除方法,帮助读者了解基因敲除小鼠在生物学研究中的重要性和应用。
引言基因敲除小鼠是指通过干扰或删除特定基因,使小鼠体内该基因表达受到抑制或消失的实验模型。
这种模型被广泛应用于基因功能研究、疾病机制研究以及药物开发等领域。
基因敲除方法基因敲除小鼠的制备有多种方法,其中最常用的是胚胎干细胞敲除和CRISPR/Cas9系统。
胚胎干细胞敲除胚胎干细胞敲除是一种传统的基因敲除方法。
首先,从小鼠胚胎中获得胚胎干细胞,然后通过基因转染或基因突变等方式,使目标基因发生敲除突变。
最后,将敲除的胚胎干细胞注入到早期小鼠胚胎中,形成敲除小鼠。
CRISPR/Cas9系统CRISPR/Cas9系统是一种新兴的基因编辑技术,已经在基因敲除小鼠制备中得到广泛应用。
该系统利用Cas9核酸酶和特定的引导RNA来定向切割目标基因的DNA链,从而导致基因发生敲除或突变。
基因敲除小鼠的应用基因敲除小鼠在生物学研究中有着广泛的应用,以下是其中几个重要的应用领域:基因功能研究通过敲除特定基因,科学家可以观察与该基因相关的表型变化,从而揭示该基因在生物体发育和功能中的作用。
这对于揭示基因调控网络、疾病机制的研究具有重要意义。
疾病模型研究基因敲除小鼠常被用来构建各种疾病模型,如癌症、心血管疾病等。
这些模型可以模拟人类疾病的发生和发展过程,为相关疾病的研究提供了有力的工具。
药物开发基因敲除小鼠在药物开发中也起着重要的作用。
通过敲除特定基因可以观察药物对目标基因的影响,从而评估药物的疗效和安全性。
结论基因敲除小鼠是一种重要的实验动物模型,被广泛应用于基因功能研究、疾病模型研究以及药物开发等领域。
不同的敲除方法可根据具体实验需求选择使用。
基因敲除小鼠在解析基因功能、揭示疾病机制和评估药物疗效方面发挥着重要的作用,为生物学研究提供了强大的工具。
基因敲除小鼠

neo、tk基因均被保留 对G418有抗性,对GANC敏感
2.基因敲除技术步骤
2.4 基因敲除小鼠的产生 2.4.1 将中靶的ES细胞注入到BALB/c小鼠囊胚,接种到新的培养皿中进行培养。 2.4.2 将正常发育含ES细胞的囊胚移植入受体小鼠子宫内 2.4.3 嵌合体小鼠的鉴别:通过观察小鼠被毛的颜色就可确定嵌合体小鼠。 2.4.4 基因敲除小鼠的制备:因为在同源重组过程中,ES细胞的2条染色体中一般只有1条进行重组,得到嵌合 体小鼠后,还要经过至
甚至发现有健康不良者或逃出笼外 , 其它鼠也最好淘汰 , 这种动物不宜用于繁殖。
---
谢谢观赏
少2代的繁育过程才能得到基因敲除小鼠。
二、
基因敲除小鼠的基因型鉴定
1.利用PCR和琼脂糖凝胶电泳鉴定
1.1 提取小鼠尾部DNA组织 1.2 PCR扩增与琼脂糖凝胶电泳鉴定基因型
1.2.1 针对不同的Fam172a+/-,Fam172a-/-,WT设计不同的引物 1.2.2 采用PCR仪进行扩增:变性→退火→延伸 1.2.3 取PCR扩增产物进行琼脂糖凝胶电泳 1.2.4 根据凝胶成像仪中的条带鉴别基因型 可能的结果分析 Fam172a+/-出现两条带,Fam172a-/-只出现一条带,WT出现一条带,但Fam172a-/-和WT出现的位置不 同。
细胞筛选出来, 目前常用的筛选方法有正负双向选择法。
正负双向选择法
neo基因保留,tk基因被切除 对G418和GANC都有抗性
筛选出中靶ES
靶向载体
neo:正向选择基因。具有新霉 素(G418)抗性,其在发生随机 组合和同源重组的细胞中都可 以表达。 HSV-tk:负向选择基因。在发 生同源重组时别剪切掉,发生 随机组合时被保留。tk基因可 使无毒的丙氧鸟苷(GANC) 转化为毒性核苷酸而杀死细胞。
Nrf2基因敲除小鼠的繁育及生长发育的生物学特性

o rP<0.5 ;teraeaew ihso 0 ) h i vrg eg t f 5~2 ekod mi r l erae i icnl P <0 0 ) o cuin T e 5 w e —l c weeas d cesd s nf at e o gi y( . 1 .C nlso h
【 btat O jci T td er r uteaddvl m n lete fNf.ncot C i . tos A s c】 bet e os yt e o cv n ee p et a r o r koku IR mc Me d r v u h pd i o af us 2 e h
Co mpaigwi h id tp c rn t te w l y emie,te rp o u t n id x so 2 par fNr2 k o ko tI h h e rd ci n e e f1 iso f- n c u CR c o mie,s c sbrh d r to u h a it u ain,br ih t a d we n d n mbes n a e u r ,we e rc r e r e o d d.T i o y weg ta iee twe k fa e wee as x mie herb d ih tdf rn e so g r lo e a n d.Re ut I o a io sl s n c mp rsn
用CRISPR Cas9方案构建双基因敲除鼠, 获得双基因敲除纯合子小鼠的交配方案

双基因敲除小鼠繁殖工作:CRISPR/Cas9方案构建双基因敲除鼠,得到F0杂合子之后,如何建系才能获得双基因敲除纯合子小鼠?这是经常被问到的问题,下面就简单回答一下。
假设我们的目的基因为A和B,通常用CRISPR/Cas9方法得到的基因敲除鼠为杂合子,双杂合子小鼠基因型为AaBb,大写字母代表野生型(dominant),小写字母代表突变型(recessive)。
得到F0杂合子(AaBb)之后,可以用以下方案之一来获得双基因敲除纯合子小鼠:方案一:1.将双杂合子小鼠(AaBb)与野生鼠(AABB)交配,理论上将得到25%的野生型(AABB),25%基因A单杂合子(AaBB),25%基因B单杂合子(AABb)及25%双杂合子小鼠(AaBb)。
2.将所得到的双杂合子小鼠(AaBb)互交(inter-cross),理论上6.25%的后代将会是双基因敲除纯合子小鼠(aabb),见下图。
3.由于双基因敲除实验中一般都需要单基因敲除动物作为对照,所以在进行上面小鼠breeding的同时可以将基因A单杂合子(AaBB)互交,在后代中鉴定出基因A纯合子(aaBB),同样将基因B单杂合子(AABb)互交,在后代中鉴定出基因B纯合子(AAbb)。
方案二:将双杂合子小鼠(AaBb)与单基因纯合子(如aaBB)交配,所生小鼠中约25%为基因A纯合子而基因B杂合子(aaBb,见下图左)。
然后将aaBb小鼠互交,理论上后代小鼠中25%为双基因敲除纯合子小鼠(aabb),见下图右。
需要特别注意的几个问题:1)上面所讲的方法适用于位于不同的染色体两个基因的基因敲除,如果两个基因位于同一条染色体上,要通过上述方法得到双基因敲除纯合子小鼠很难;2)上述方法有赖于基因特异性的Genotyping PCR assays。
在开始setup breeding之前必须将两个目的基因特异性的Genotyping PCRassays 准备好;3)要事先研究一下目的基因敲除后有无胚胎致死性,是否影响其生长发育等。
基因敲除小鼠饲养繁殖技巧

基因敲除⼩⿏饲养繁殖技巧科研狗但凡要做动物实验的,哪个不需要伺候⼩⿏?每天好吃的好喝地伺候着,定期更换垫料,还要操⼼它们的⼈⽣⼤事,给它分配对象,⽣了娃还要给帮它们做“亲⼦鉴定”,看见⼩⿏脱发了,要想办法,母⿏不⽣了,要想办法。
回头再看看⾃⼰,没头发,还没对象,天天愁⽂章,担⼼毕不了业,全指望⼩⿏们加油,让⾃⼰早⽇出成果,所以可不得好吃好喝的伺候它们嘛!尤其是基因敲除⼩⿏,⾝价昂贵,从接到它的那⼀刻起,整个⼈都⼜兴奋⼜紧张,⽣怕怠慢了这些⼩家伙,那么收到基因敲除⼩⿏后要如何制定计划进⾏扩群繁殖以满⾜实验需要呢?除了了解所选品系的⽣活习性外,我们还要考虑⾃⼰需要的基因编辑⿏可能出现哪些问题,有没有解决或者是改善的⽅法,这些我们可以通过查阅⽂献看有没有关于该基因敲除⼩⿏的相关信息并作出⼀个初步判断。
1.背景品系的特点这个不⽤多说,需要做动物实验的同学,谁还没养过⼏只⼩⿏呀,养之前肯定已经把它的⽣活习性、繁殖特点、饲养要求等了解的很清楚了,举个栗⼦,⽐如说C57BL/6J,该品系的雄⿏好⽃,尤其是刚断奶后不同窝的雄⿏不宜放⼀笼饲养。
2.饲养环境的要求应尽可能地给⼩⿏提供适宜的⽣活环境和营养,这⽅⾯可以参照国家标准来进⾏饲养管理。
⽐如,⼩⿏对于噪⾳、光照⽐较敏感,所以我们应给⼩⿏提供安静的环境,尽量选在⼈员⾛动少的地⽅,也不要频繁查看⼩⿏情况,这样⼩⿏会有压⼒的。
母⿏有筑巢的天性,可以向笼中放柔软的棉垫,⿎励其筑巢,有助于提⾼产量。
3.基因敲除⼩⿏饲养管理应注意哪些问题⼤多数基因敲除⼩⿏相对野⽣型⼩⿏⽽⾔,在某些⽅⾯会存在或⼤或⼩的问题,所以我们需要查阅相关的⽂献,看看有没有该基因敲除⼩⿏的⽂献报道,该基因被修饰后会出现哪些问题?这些问题有没有解决或者是改善的⽅法。
如果是某种基因被修饰后会导致⼩⿏不能合成某种物质,那么可以给⼩⿏额外补充该物质;若是基因敲除⼩⿏的成活率低,问题有可能出现在着床期⾄成年期的任意时间段,通过代乳和改善饲养条件也许能得以解决;如果基因敲除⼩⿏的⽣殖⼒低。
基因敲除小鼠的方法

基因敲除小鼠的方法
1. CRISPR/Cas9基因编辑技术,CRISPR/Cas9技术是一种高效的基因编辑工具,可以用来精确地敲除小鼠基因。
首先,科学家设计合成一段RNA序列,使其与目标基因序列相匹配,然后将这段RNA和Cas9蛋白复合体导入小鼠胚胎内。
复合体会通过识别并切割目标基因,导致基因敲除。
2. 胚胎干细胞技术,另一种常见的基因敲除小鼠方法是利用胚胎干细胞。
科学家可以将设计好的基因敲除载体导入小鼠胚胎干细胞中,使其发生基因敲除。
然后,这些修改过的干细胞可以被植入小鼠胚胎内,从而产生基因敲除小鼠。
3. 遗传改造小鼠技术,除了CRISPR/Cas9和胚胎干细胞技术,科学家还可以利用遗传改造技术来实现基因敲除。
这种方法涉及到选择性育种和杂交,通过选择性地交配和繁殖,最终得到具有特定基因敲除的小鼠品系。
总的来说,基因敲除小鼠的方法主要包括CRISPR/Cas9基因编辑技术、胚胎干细胞技术和遗传改造小鼠技术。
这些方法都是在实验室条件下进行的,需要经过严格的实验设计和操作流程,以确保
基因敲除的准确性和有效性。
同时,这些方法也为科学家提供了强大的工具,用于研究基因在生物体内的功能和作用机制。
基因敲除小鼠的方法

基因敲除小鼠的方法基因敲除小鼠模型是生物医学研究领域中常用的实验动物模型之一。
通过对特定基因进行敲除,科研人员可以研究该基因在生物体内的功能和影响,从而深入了解该基因对生物体的生理和病理过程的调控作用,为人类疾病治疗和药物研发提供重要的实验基础。
下面我们将介绍关于基因敲除小鼠的方法。
一、基因敲除小鼠的原理和意义1.1 基因敲除原理基因敲除是指通过人工手段破坏特定基因的DNA序列,使其失去功能。
在小鼠模型中,通常利用基因敲除技术将目标基因进行突变或删除,从而观察小鼠在不同生理状态下的表型变化,探索目标基因在生物体内的功能和作用机制。
1.2 基因敲除的意义基因敲除小鼠模型可以帮助科研人员研究特定基因的生物学功能,了解其在生物体内的作用机制。
基因敲除小鼠模型也能够为疾病研究和药物开发提供重要的实验依据,有助于发现新的治疗靶点和疾病治疗方法。
二、基因敲除小鼠的制备方法2.1 基因敲除小鼠的选择在进行基因敲除小鼠实验前,首先需要选择合适的小鼠品系和基因靶向。
常用的小鼠品系包括C57BL/6、BALB/c等,而基因敲除的选择通常基于目标基因在疾病或生理过程中的重要性。
2.2 敲除载体的构建和筛选制备基因敲除小鼠需要先构建敲除载体,通常采用基因工程技术将靶向基因进行突变或删除,然后将这些构建好的载体导入至小鼠胚胎干细胞中,进行筛选和培养。
2.3 胚胎干细胞的培养与筛选在培养和筛选过程中,科研人员需要将导入敲除载体的胚胎干细胞引入小鼠胚胎中,然后进行体外培养和筛选,以筛选出正常的敲除基因小鼠。
2.4 敲除小鼠的鉴定和繁殖成功培育出的敲除小鼠需要进行PCR鉴定和繁殖,以得到稳定传代的敲除小鼠品系。
对敲除小鼠进行系统的表型观察和分析,以确定目标基因敲除后的表型变化。
三、基因敲除小鼠的应用和前景3.1 基因敲除小鼠在生物学研究中的应用基因敲除小鼠模型广泛应用于生物学研究领域,包括生理学、免疫学、神经科学、遗传学等各个领域。
基因敲除小鼠的实验流程

基因敲除小鼠的实验流程1.设计基因敲除小鼠实验方案在开始实验之前,需要明确研究目的,确定需要敲除的基因,并设计相应的实验方案。
一般可以使用 CRISPR-Cas9 系统来实现基因敲除,在设计基因敲除实验方案时,需要选择合适的 sgRNA 序列,以及设计恰当的引物用于检测突变。
2.获得基因敲除小鼠的胚胎干细胞为了实现基因敲除,需要获得基因敲除小鼠的胚胎干细胞。
一种常用的方法是利用胚胎干细胞对外源DNA的高度易感性,将敲除基因的质粒DNA转染到小鼠胚胎干细胞中。
3.筛选敲除基因的胚胎干细胞株系将转染了敲除基因的胚胎干细胞以悬浮培养的方式进行培养,培养一段时间后,利用一定的筛选条件来筛选出含有敲除基因的胚胎干细胞株系。
筛选条件可包括对抗生素的使用或筛选标记基因的表达。
4.制备敲除基因小鼠的固定胚胎干细胞系通过体外培养,将敲除基因的胚胎干细胞系定植在培养皿上,培养数代以后,将其冻存,以备后续的实验使用。
5.实施敲除基因小鼠的胚胎干细胞基因改造将固定的胚胎干细胞系重新激活,转染 Cas9 和 sgRNA,利用CRISPR-Cas9 系统使这些细胞具有敲除基因的突变。
6.识别敲除基因的胚胎干细胞阳性克隆株对转染了 Cas9 和 sgRNA 的胚胎干细胞进行筛选,通过 PCR、Western blot、Southern blot等技术方法识别出敲除了目标基因的阳性克隆株。
7.将敲除基因的胚胎干细胞注入小鼠的早期胚胎取出已受精的小鼠卵母细胞,利用显微操作将敲除基因的胚胎干细胞注入到小鼠的早期胚胎中。
利用体外受精或者通过体内或体外的胚胎移植方式将基因敲除干细胞注入受体小鼠。
8.制备基因敲除小鼠的嵌合小鼠将已注入敲除基因的胚胎干细胞的受体小鼠进行嵌合以产生基因敲除小鼠。
嵌合可以通过体内或体外的胚胎移植方式进行。
9.筛选识别基因敲除小鼠对产生的嵌合小鼠进行筛选,确认敲除基因是否成功。
可以通过 PCR、Western blot、Southern blot等技术方法对小鼠体细胞或组织进行分析。
基因敲除小鼠原理

基因敲除小鼠原理基因敲除是一种常用的遗传工程技术,它通过人为地改变生物体的基因组,使得某个特定基因在生物体中失去功能。
基因敲除技术在动物模型研究中得到了广泛的应用,特别是在小鼠模型的构建中发挥着重要作用。
下面将介绍基因敲除小鼠的原理及其应用。
基因敲除小鼠原理。
基因敲除小鼠是指通过基因工程技术,将小鼠的某个特定基因进行改变,使得该基因在小鼠体内失去功能。
基因敲除小鼠的构建通常分为以下几个步骤:1. 选择目标基因,首先需要选择需要敲除的目标基因,通常选择与某种疾病或生理过程相关的基因作为目标。
2. 构建敲除载体,将目标基因的敲除载体导入到小鼠的胚胎干细胞中,使得目标基因在胚胎干细胞中发生敲除。
3. 胚胎干细胞筛选,经过敲除载体导入后,对胚胎干细胞进行筛选,筛选出发生了基因敲除的干细胞。
4. 小鼠胚胎的移植,将发生了基因敲除的胚胎干细胞移植到受精小鼠卵母细胞内,通过体外培育和移植到母体小鼠子宫内,使得基因敲除小鼠的胚胎发育成熟。
5. 基因敲除小鼠的鉴定,对出生的小鼠进行基因型分析,确认是否成功构建了基因敲除小鼠模型。
基因敲除小鼠的应用。
基因敲除小鼠模型在生物医学研究中有着广泛的应用,主要包括以下几个方面:1. 功能基因研究,通过敲除特定基因,可以研究该基因在生物体内的功能及其对生物体生理过程的影响,为相关疾病的研究提供重要的实验模型。
2. 疾病模型构建,基因敲除小鼠模型可用于构建各种疾病模型,如肿瘤模型、免疫缺陷病模型等,用于研究疾病的发病机制及寻找治疗方法。
3. 药物筛选,基因敲除小鼠模型可用于药物的筛选和评价,通过观察敲除某个基因后对药物疗效的影响,为新药的研发提供重要参考。
4. 基因治疗研究,基因敲除小鼠模型可用于基因治疗的研究,通过敲除某个致病基因或导入正常基因,探索基因治疗的可行性及疗效。
总结。
基因敲除小鼠模型是一种重要的生物医学研究工具,通过对特定基因的敲除,可以研究该基因在生物体内的功能及其对生理过程的影响,为相关疾病的研究提供重要的实验模型。
基因敲除鼠 方法

基因敲除鼠方法
基因敲除鼠是一种利用基因编辑技术实现的实验动物模型。
它是通过对小鼠胚胎干细胞进行基因编辑,使其基因组中的目标基因发生永久性的敲除,从而实现对该基因功能的研究。
以下是基因敲除鼠的具体方法:
1.设计合适的基因编辑工具:选择合适的RNA引物或合成具有特定剪切酶活性的酶,如CRISPR/Cas9系统。
2.制备适当的DNA和RNA(或Cas9/sgRNA复合物):将DNA或RNA分别转染到小鼠胚胎干细胞中,使其与靶基因发生靶向切割或插入。
3.筛选和鉴定:筛选和鉴定敲除细胞,将敲除细胞移植到小鼠胚胎中,培育出敲除小鼠。
4.对敲除小鼠进行验证:通过PCR或转录组分析等技术,确认敲除小鼠已经成功实现,从而得到目标基因敲除的实验动物模型。
需要注意的是,敲除基因会对小鼠的生理和行为表现造成影响,因此需要进行更加详尽的生理和行为分析,确保研究结果的可靠性。
基因敲除小鼠概念及原理

基因敲除小鼠概念及原理
基因敲除小鼠是一种通过基因敲除技术创造出来的实验动物模型。
基因敲除技术是一种新的分子生物学技术,建立在基因同源重组技术基础以及胚胎干细胞技术基础上。
基因敲除就是通过同源重组将外源基因定点整合入靶细胞基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术。
基因敲除小鼠的原理是利用基因同源重组进行基因敲除。
具体来说,通过同源重组将外源基因定点整合入小鼠的基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的。
这种技术克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。
基因敲除小鼠具有广泛的应用前景和商业价值,特别是在发育生物学、分子遗传学、免疫学及医学等学科的研究和治疗中。
这种技术的出现为这些学科提供了一个全新的、强有力的研究、治疗手段,具有重要的意义。
基因敲除小鼠的实验流程

基因敲除小鼠的实验流程
基因敲除是一种常用的功能基因研究方法,通过使特定基因失去功能,从而研究该基因在生物体发育、生理功能、疾病机理等方面的作用。
在此,我将详细介绍基因敲除小鼠的实验流程。
1.设计敲除基因的策略:
2.构建敲除载体:
根据设计好的敲除策略,研究者需要构建敲除载体。
敲除载体一般包
括两个主要部分:敲除目标基因的DNA序列和荧光蛋白报告基因的DNA序列。
为了实现高效的基因敲除,敲除目标基因的DNA序列应当与目标细胞
染色体上的同源序列高度相似。
荧光蛋白报告基因的DNA序列可以用来监
测基因敲除的效果。
研究者可以使用聚合酶链式反应(PCR)等技术来合成
敲除载体的DNA序列。
3.DNA传递和胚胎干细胞培养:
4.敲除载体导入胚胎干细胞并筛选:
将构建好的敲除载体导入胚胎干细胞,可以使用电穿孔、转染等方法
将外源DNA转入胚胎干细胞。
导入后,筛选出带有敲除载体的胚胎干细胞。
研究者可以利用荧光蛋白报告基因来筛选出携带敲除基因的胚胎干细胞。
5.胚胎干细胞的胚胎注射和小鼠的获取:
将携带了敲除载体的胚胎干细胞通过微注射的方式注入小鼠早期胚胎
的内腔。
这些胚胎随后继续发育,最终产生带有敲除基因的小鼠。
6.培养和分析经过敲除的小鼠:
获得敲除基因的小鼠之后,研究者可以将其培养至成年,然后对其进行各种生理、行为等方面的分析。
通过与野生型小鼠进行比较,可以了解基因敲除对小鼠的影响和功能。
基因敲除小鼠制备的流程

基因敲除小鼠的制备流程基因敲除小鼠已经成为现代生命科学基础研究和药物研发领域不可或缺的实验动物模型,在生命科学、人类医药和健康研究领域中发挥着重要的作用。
基于胚胎干细胞的基因打靶技术、EGE技术(基于Crispr cas9技术)是当下比较火热的基因敲除小鼠制备技术。
利用这两种技术制备基因敲除小鼠的流程是什么样的?一、基于胚胎干细胞的基因打靶技术制备基因敲除小鼠的流程:1.课题设计,订购课题BAC菌;2.按照课题设计,完成打靶载体设计和构建;3.将重组载体电转到胚胎干细胞中,用G418筛选转染后的胚胎干细胞,得到阳性克隆;4.进一步通过PCR和southern blot杂交技术(基因敲除小鼠检测金标准)对上一步得到的阳性克隆进行筛选,得到稳定整合外源基因的胚胎干细胞阳性克隆;5.将胚胎干细胞阳性克隆注射到小鼠囊胚中,并植入到假孕小鼠的子宫内;6.得到嵌合鼠,并获得F1阳性杂合子小鼠。
基于胚胎干细胞的基因打靶技术制备基因敲除小鼠是目前为止唯一一个可以满足几乎所有基因组修饰要求的打靶技术,但目前只应用在小鼠的基因敲除上,而且其周期长工作量大。
二、利用EGE技术(基于Crispr cas9技术)制备基因敲除小鼠的流程1.设计构建识别靶序列的sgRNA;2.设计构建致靶基因切割的EGE系统载体质粒;3.利用百奥赛图自主开发的UCA试剂盒对sgRNA/Cas9进行活性检测;4.设计构建打靶载体;5.体外转录sgRNA/Cas9 mRNA;6.小鼠受精卵原核注射sgRNA/Cas9 mRNA和打靶载体;7.获得Fo代小鼠,利用PCR对Fo代小鼠进行基因型鉴定;8.获得F1代小鼠,利用PCR和southern blot杂交技术(基因敲除小鼠检测金标准)对F1代小鼠进行基因型鉴定。
虽然EGE技术(基于Crispr cas9技术)制备基因敲除小鼠看似比基于胚胎干细胞的基因打靶技术制备基因敲除小鼠流程繁琐,其实不然,EGE技术(基于Crispr cas9技术)系统构建简单,基因敲除/敲入效率高,速度快,可实现多基因、多物种基因敲除/敲入,最快2个月即可得到F0代阳性鼠,5个月得到F1F1代杂合子小鼠。
条件性基因敲除小鼠的繁育策略

条件性基因敲除⼩⿏的繁育策略
要获得条件性基因敲除⼩⿏⾄少需要两步遗传杂交。
第⼀步,将GeneX-Cre杂合⼦⼩⿏与GeneY-flox杂合或纯合⼦⼩⿏交配,获得的Cre与flox双阳性(GeneX Cre/wt; GeneY lox/wt)⼦代⼩⿏。
第⼆步,将Cre与flox双阳性(GeneX Cre/wt;GeneY lox/wt)⼦代⼩⿏再与GeneY-flox 杂合或纯合⼦⼩⿏交配,获得所需的GeneX Cre/wt; GeneY lox/lox⼩⿏为实验组。
⼀般对照组为同窝GeneX wt/wt; GeneY lox/lox⼩⿏。
如果Cre的整合破坏内源基因,那么应选择GeneX Cre/wt;GeneY wt/wt⼩⿏作为对照。
条件性基因敲除的常规育种策略。
在进⾏基因型鉴定的时候,不仅要对⼩⿏⿏尾进⾏基因鉴定,对特异性⽬标组织也需要进⾏基因型检测。
这时需要设计PCR引物⽅便区分野⽣型等位基因、flox等位基因和重组后的KO等位基因。
在⿏尾鉴定时,如果发现重组后的KO产物,那么需要考虑该组织特异性Cre⼩⿏的⽣殖系表达问题。
条件性基因敲除的基因型鉴定引物设计⽰意图。
之后需要检测重组后靶基因的mRNA和蛋⽩表达,来验证Cre-lox系统的⼯作效果。
根据靶基因与lox位点的位置,可以设计qPCR模板或者探针来检测重组后的靶基因转录情况。
进⼀步可以通过免疫组化检测条件性基因敲除后靶基因蛋⽩翻译是否缺失或异常。
不过这很⼤程度上依赖于探针或抗体的灵敏度和特异性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
七周重
黑鼠 灰鼠
八周重
黑鼠 灰鼠
九周重
黑鼠 灰鼠
十周重
黑鼠 灰鼠
十一周重
黑鼠 灰鼠
十二周重
黑鼠
3
心电图
4
生理指标
HR
SBP
DBP
MBP
心率
收缩压
舒张压
平均动脉压
C-S
547.1
104.3
67.0
79.2
C-C
448.3
98.4
68.5
78.8
5
项目
血液常规
单位 C-S C-C C57BL/6
WBC
两种基因敲除小鼠的培育
摘要
从美国哈佛大学引进了两种基因敲除小鼠。
这两种品系小鼠的体内分别缺少Cystatin C (胱抑素C )和 Cathepsin S(组织蛋白 酶 ),简称C-C 和 C-S。在三年的培育过程 中,我们对其生长繁殖、生理生化等一系列 指标作了测定,现将结果汇报如下。
一、材料和方法
#LUC %NEUT %LYMPH
白细胞计数
大未染色细胞计数 中性细胞比率 淋巴细胞比率
10^9/L
10^9/L % %
4.54
0 5.8 .4 76.2
5.89
14.2 81.2
%MONO
%EOS %BASO %LUC RBC HGB HCT MCV MCH MCHC
项目名称 血清总蛋白 血清白蛋白 血清球蛋白
项目代码 TP ALB GLOB
单位 g/L g/L g/L
C-S 50.4 35.1 15.4
C-C 50.8 34.1 16.6
血清白球比
血清丙氨酸氨基转移酶 血清天门冬氨酸氨基转移酶 血清总胆红素 血清碱性磷酸酶 血清甘油三酯 血清总胆固醇 血清肌酸激酶 血清肌酐 尿素 钠
谢 谢!
灰鼠
一周重(g) 黑鼠 灰鼠 二周重 黑鼠 灰鼠 三周重 黑鼠 灰鼠
100
100 100 100 100 100 100
1.5061
4.1209 4.1283 8.1034 8.9003 9.9448 10.086
0.119501448
0.488258284 0.468962007 0.793080199 5.431822518 0.834169859 0.914429778
二、结果
1、 Cystatin C-null小鼠和 Cathepsin S-null
小鼠的生长
Cystatin C-null小鼠(♂)
Cystatin C-null小鼠(♀)
Cathepsin S-null小鼠(♀)
Cathepsin S-null小鼠(♂)
各品系雌雄小鼠生长曲线 30 25 20 15 10 5 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 时间(周) 系列1 系列2 系列3 系列4
单核细胞比率
嗜酸细胞比率 嗜碱细胞比率 大未染色细胞比率 红细胞计数 血红蛋白 红细胞积压 平均红细胞体积 平均血红蛋白含量 平均血红蛋白浓度
%
% % % 10^12/L g/dL % fL Pg g/dL
0.3
4.8 0.18 0.24 10.05 16.1 5.1 50.76 16.15 31.86
重量(克)
2、Cystatin C-null小鼠(C-C)和 Cathepsin S-null小鼠(C-S)的繁育
胎次 品系 1 2 3 4 5 C57BL/6 C-S
分娩间隔(天) C-C 27.3±9.8 35.8±13.4 40.6±15.5 42.7±14.7 49.3±23.8 C-S 6.5±2.3 7.1±2.1 6.7±1.8 6.9±1.9 4.2±1.1
小鼠的生长发育跟周围的环境条件,如温度、
湿度、光照、噪音等和饲养,饮水的关系十 分大,甚至饲养员的喂养习惯都会影响到它 们的生长。因此,世界上各地方,各实验室 饲养的小鼠情况是不一样的。即使同一种品 系,也会随着环境的不同而生长的不同。所 以该两个品系小鼠的生长情况与来源于网上 C57BL/6数据的可比性教差,只能参考。
产仔数 C-C 7.2±2.2 7.5±1.7 7.3±1.9 7.1±2.1 6.9±2.5 C-S 91.6 93.5 94.7 92.3 91.8
成活率(%) C-C 93.4 95.6 92.8 91.7 92.5 87~93%
29.5±7.8 43.5±17.2 45.8±14.5 44.7±15.4 51.6±22.9 28~36天
0.011950145
0.048825828 0.046896201 0.07930802 0.543182252 0.083416986 0.091442978
四周重
黑鼠
灰鼠
100
100
13.3974
13.4348
1.377563814
1.117567235
0.137756381
0.111756724
1.75018146 1.461944188 1.891622923 1.668771432 1.989326395 1.773938889 1.968843097 1.824729815 1.966599886 1.841133555 1.921727663 1.860193799 1.922308532
A/G
ALT AST T-BIL ALP TG TCHOL CK Crea UREA Na U/L U/L ū mol/L U/L mmol/L mmol/L U/L ū mol/L mmol/L mmol/L
2.3
66.7 184.5 0.8 112.4 7.0 2.9 8.7 9.7 21.2 147.0
2.53
3.61 0.04 7.22 9.59 13.53 4.87 50.78 14.29 28.18
6.72
1.1
9.28 14.1
51.11 16.2 29.8
6 血液生化指标
Group Statistics 品系 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 黑鼠 灰鼠 N 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 11 17 Mean 50.4364 50.7706 35.0636 34.1294 15.3727 16.6412 2.3364 2.1882 66.7273 49.7059 184.2727 122.8824 .8364 1.3353 112.3636 78.7059 7.0136 .8076 2.8555 2.4065 5080.0909 1230.6471 8.7273 19.1765 9.7273 9.6471 147.0000 153.6471 Std. Deviation 2.08148 4.77857 2.09870 3.98133 2.27820 4.11644 .45667 .61531 20.60627 14.68743 57.33078 37.02682 .22482 .69995 28.36643 45.17434 20.56027 .38982 .59774 .58100 3475.17302 595.14714 5.84963 24.43163 1.93085 5.06250 2.52982 4.37237 Std. Error Mean .62759 1.15897 .63278 .96561 .68690 .99838 .13769 .14923 6.21302 3.56222 17.28588 8.98032 .06779 .16976 8.55280 10.95639 6.19915 .09454 .18022 .14091 1047.804 144.34438 1.76373 5.92554 .58217 1.22784 .76277 1.06046 血 清总 蛋 白 血 清白 蛋 白 血 清球 蛋 白 血 清白 球 比 血 清丙 氨 酸 氨基 转 移 酶 血 清天 门 冬 氨酸 氨 基 转 移酶 血 清总 胆 红 素 血 清碱 性 磷 酸酶 血 清甘 油 三 酯 血 清总 胆 固 醇 血 清肌 酸 激 酶 血 清肌 酐 尿素 钠
六周重
黑鼠 灰鼠
100 100 100 100 100 100 100 100 100 100 100 100 100
18.4461 19.388 19.4197 20.4483 20.2587 21.3429 21.0823 22.0643 21.6702 22.7236 22.1954 23.3232 22.6631
2.2
49.7 122.9 1.3 78.7 0.8 2.4 1230.6 19.2 9.6 153.6
三、讨论与结论
组织蛋白酶(cathepsin)是一大类裂解肽键的蛋白水
解酶,其中组织蛋白酶 S(cathepsin s) 属于半胱氨 酸蛋白酶,其作用非常广泛,参与机体多种生理、病 理过程。它不但可敛细胞的炎性坏死,还参与细胞 凋亡的调控 ,在多种疾病的发生发展过程中发挥重 要的作用。 Cystatin C(Cys C) 又称半胱氨酸蛋白酶抑制蛋白C , 中译名为胱抑素C 是半胱氨酸蛋白酶的细胞外抑制 剂,在cystatin 中含量最为丰富,并对细胞内蛋白的转 换起作用。它广泛存在于脊椎动物的组织中,参与 炎症过程及一些神经性疾病。因此,这两类物质成 为近来医学研究的热点.
0.175018146 0.146194419 0.189162292 0.166877143 0.198932639 0.177393889 0.19688431 0.182472982 0.196659989 0.184113356 0.192172766 0.18601938 0.192230853
