氧族元素课件
合集下载
《氧族元素》课件

硫单质
总结词
化学性质不活泼,常温下稳定,加热 易燃烧
详细描述
硫单质包括硫磺和硫化物,它们在常 温下比较稳定,加热时易燃烧,发出 蓝紫色火焰。硫单质在自然界中广泛 存在,是重要的化工原料,可用于生 产硫酸、染料、橡胶等。
硒单质
总结词
化学性质与硫相似,有毒性
详细描述
硒单质包括硒粉、硒化物等,其化学性质与硫相似,在常温下比较稳定,加热时易燃烧。硒单质有毒性,对人和 动物有害,但也是一种重要的微量元素,对生物体具有保护作用。
麻醉剂
氧族元素中的一些化合物具有麻醉 作用,如氧化亚氮、氟代烃等,可 用于手术麻醉和牙科治疗。
在环保领域的应用
大气污染治理
氧族元素中的一些化合物可用于 大气污染治理,如二氧化硫、三 氧化硫等可用于脱硫脱硝处理, 减少燃煤烟气中的硫化物和氮氧
化物含量。
水处理
氧族元素中的一些化合物可用于 水处理,如臭氧、二氧化氯等可 用于消毒和杀菌,三氯化铁等可 用于混凝沉淀,去除水中的悬浮
催化剂பைடு நூலகம்
氧族元素在工业催化领域也有广泛应 用,如二氧化硫、三氧化硫等可用于 石油裂化催化剂,三氧化二砷可用于 合成氨催化剂等。
在农业上的应用
01
02
03
肥料
氧族元素中的磷是植物生 长必需的元素之一,磷肥 的施用能够提高农作物的 产量和品质。
杀虫剂
氧族元素中的硫和硒等具 有杀虫作用,可用于防治 农作物病虫害,如硫磺粉 、亚砷酸等。
硫化物合成
硫化物性质
具有不同的化学性质,如离子型硫化物、共 价型硫化物和配位型硫化物等。
可以通过热分解、硫化还原反应等方法合成 。
02
01
硫化物应用
氧族元素 ppt课件

碲 5s25p4
127.60
84 209 Po 210 钋 6s26p4
(210)
5
第16章 氧族元素
概述
元素符号 O
S
Se Te
第一电离能 (kJ·mol-1) 1314 1000 941 869
非金属
半金属
金属
OS
Se Te
Po
6
第16章 氧族元素
2. 价电子层结构及氧化态
概述
氧 O 2s22p4
+2,+6
晶体
分子 晶体
分子 晶体
红硒 (分子晶体)
灰硒 (链状晶体)
链状 晶体
金属 晶体
11
第16章 氧族元素
16.1 氧及其化合物
16.1 氧及其化合物
16.1.1 氧的成键特征
1、一般键型:离子键和共价键。
离子键:形成O2-阴离子,如M2O、MO等离子型 氧化物。
共价键:呈0、+2、-2、-1等氧化态,如O2、OF2、 H2O、H2O2等
O16、O17、O18
O18稳定同位素常作为示踪原子。
氧在自然界中的分布: O2 O3 (同素异形体)
14
第16章 氧族元素
1、氧气 氧的制备和空气液化 结构
分子轨道电子排布式:
16.1 氧及其化合物
( σ 1 s ) 2 ( σ 1 * s ) 2 ( σ 2 s ) 2 ( σ * 2 s ) 2 ( σ 2 p x ) 2 ( π 2 p y ) 2 ( π 2 p z ) 2 ( π * 2 p y ) 1 ( π * 2 p z ) 1 一个σ键,两个三电子 p 键
第16章 氧族元素
概述
第六章第一节氧族元素精选教学PPT课件

假如人生不曾相遇,我还是那个我,偶尔做做梦,然后,开始日复一日的奔波,淹没在这喧嚣的城市里。 我不会了解,这个世界还有这样的一个你,只有你能让人回味,也只有你会让我心醉。 假如人生不曾相遇,我不会相信,有一种人可以百看不厌,有一种人一认识就觉得温馨。明知不能相逢,为何魂牵梦系?我又怎能深刻地体会到什么样叫远,什么叫近,远是距离,近在心底。 假如人生不曾相遇,不曾想过会牵挂一个远方的人。我有深切的愿望,愿你快乐每一天。淡淡的情怀很真,淡淡的问候很纯,淡淡的思念很深,淡淡的祝福最真。虽然一切只能给虚幻中的你。 假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。 假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤? 假如人生不曾相遇,我怎么能知道爱情存在的真正意义。必须有缘才能共舞,珍惜今天所爱方能同步。不能和你同途,也不能与你同步。 假如人生不曾相遇,我还是我,你依然是你,只是错过了人生最绚丽的奇遇。
D
)
3根据氧族元素性质推断,硒不可能具有的性质是( C ) A.在通常情况下是固体 B.SeO3对应的水化物是一种酸
C.H2Se比H2S稳定
D.有-2,+4,+6三种化合物
4.用事实说明氧的非金属性比硫强
A.硫在氧气中燃烧
B.硫与铁反应生成硫化亚铁,氧气与铁 反应生成四氧化三铁 C. 2H2S + O2 == S +2H2O
第十六章-氧族元素PPT课件
O3分子释放出热量,说明O3比O2有更大的化学活性, 无论在酸性或碱性条件下,都比O2有更强的氧化性。
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
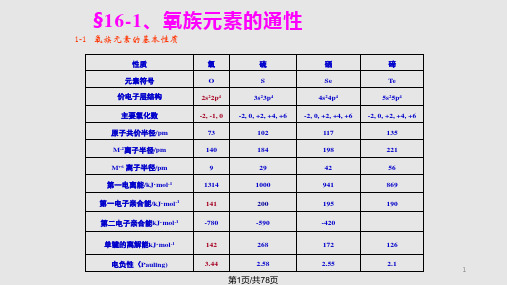
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
11
第11页/共78页
第十六章 氧族元素
性质二:强氧化性
§16.2 氧、臭氧
O3是一种极强的氧化剂,氧化能力仅次于F2。
O3 2H 2e O2 H2O EA 2.08V
O3 H2O 2e
性质 性质一:强氧化性
性质二:还原性
性质三:不稳定性
性质四:二元弱酸
21
第21页/共78页
第十六章 氧族元素
性质一:强氧化性 • 酸性溶液
§16.3 H2O2O2 来自.6824 H2O2 1.776 H2O
• 碱性溶液
O2 0.076 HO2 0.878 OH
H2O2无论在酸性溶液还是在碱性溶液中都是强氧 化剂。
§16-1、氧族元素的通性
1-1 氧族元素的基本性质
性质 元素符号 价电子层结构 主要氧化数 原子共价半径/pm M-2离子半径/pm M+6 离子半径/pm 第一电离能/kJ·mol-1 第一电子亲合能/kJ·mol-1 第二电子亲合能kJ·mol-1
氧 O 2s22p4 -2, -1, 0 73 140 9 1314 141
-420
单键的离解能kJ·mol-1
142
268
172
126
电负性(Pauling)
3.44
2.58
2.55
2.1
1
第1页/共78页
第十六章 氧族元素
§16.1 通性
1-2 氧族元素的成键特征
• 能结合两个电子形成氧化数为-2的阴离子,表现出非 金属元素特性。
• 非金属活泼性弱于卤素。
课件:氧族元素

除去硫的方法:①用CS2洗涤;②用加热升华法。
(2) 硫的存在和用途 游离态——自然界存在于火山喷口、地壳岩层。
化合态 硝、煤
—和—石存油中在含形少式量有硫:—Fe—S2污、染C大uF气eS物2、主石要膏来、源芒
火柴头: 氧化剂 (KClO3、 MnO2) 和易燃物 S
天然硫的存在使中国人最早制出黑火药,为人类 社会的进步作出了巨大的贡献.
气态氢化物H2R稳定性、还原性、其水溶液酸性: 稳定 性 逐 渐 减弱,还原性增强,酸性增强
H2O、H2S、H2Se、H2Te(Te与H2不能直接化合)
一. 氧单质及其主要化合物
1. O2 (1)氧气的实验室制取
①2KMnO4→K2MnO4+MnO2+O2↑ ②2KClO3 → 2KCl+3O2↑ ③2HgO → 2Hg+O2↑(因Hg剧毒,已弃用) ④2H2O2 → 2H2O+O2↑ ⑤ 2Na2O2 +2H2O →4NaOH+O2↑
气态
固态
O2无O3淡蓝 淡黄色
难溶
难溶
固态 灰色 难溶
导电性 不导电 不导电 半导体
Te
固态 银白色 难溶 导体
非金属性、氧化性、得电子能力
减弱
金属性、还原性、失电子能力
增强
主要化合价: -2、+4、 Nhomakorabea6 (一般O只有-2价)
元素最高价氧化物RO3对应的水化物H2RO4 :
酸 性 逐 渐 减弱
H2SO4,H2SeO4,H2TeO4
3 S + 6 K O H △→ 2 K 2 S + K 2 S O 3 + 3 H 2 O
§14.1 氧族元素
氧族元素包括: 氧( 8O)、硫( 16 S)、硒(34Se)、碲(52Te)、钋(84Po)
(2) 硫的存在和用途 游离态——自然界存在于火山喷口、地壳岩层。
化合态 硝、煤
—和—石存油中在含形少式量有硫:—Fe—S2污、染C大uF气eS物2、主石要膏来、源芒
火柴头: 氧化剂 (KClO3、 MnO2) 和易燃物 S
天然硫的存在使中国人最早制出黑火药,为人类 社会的进步作出了巨大的贡献.
气态氢化物H2R稳定性、还原性、其水溶液酸性: 稳定 性 逐 渐 减弱,还原性增强,酸性增强
H2O、H2S、H2Se、H2Te(Te与H2不能直接化合)
一. 氧单质及其主要化合物
1. O2 (1)氧气的实验室制取
①2KMnO4→K2MnO4+MnO2+O2↑ ②2KClO3 → 2KCl+3O2↑ ③2HgO → 2Hg+O2↑(因Hg剧毒,已弃用) ④2H2O2 → 2H2O+O2↑ ⑤ 2Na2O2 +2H2O →4NaOH+O2↑
气态
固态
O2无O3淡蓝 淡黄色
难溶
难溶
固态 灰色 难溶
导电性 不导电 不导电 半导体
Te
固态 银白色 难溶 导体
非金属性、氧化性、得电子能力
减弱
金属性、还原性、失电子能力
增强
主要化合价: -2、+4、 Nhomakorabea6 (一般O只有-2价)
元素最高价氧化物RO3对应的水化物H2RO4 :
酸 性 逐 渐 减弱
H2SO4,H2SeO4,H2TeO4
3 S + 6 K O H △→ 2 K 2 S + K 2 S O 3 + 3 H 2 O
§14.1 氧族元素
氧族元素包括: 氧( 8O)、硫( 16 S)、硒(34Se)、碲(52Te)、钋(84Po)
氧族元素课件

氧族元素
10
碱金属(包括NH4+)硫化物水溶液能溶解单质硫生成多硫化物。
Na2S+(x-1)S = Na2Sx (Sx)2-随着硫链的变长颜色: 黄→橙→红
2-
性质:
S2X-
遇酸不稳定: S 2 x -+ 2+ H [2 H S x ] H 2 S+ ( (- g 1 x) )S
氧化性: Sn+SS2 2- Sn3 2-S
净反应:O3 + O = 2O2
氧族元素
4
3.过氧化氢( H2O2)
结构: O为sp3杂化
H2O2弱酸性、不稳定
H2O2
HO-2 + H+ K 1 = 2.0×10-12,K 2 10-25
2H 2O2
2H 2O + O2 △ rHm= -196kJ mol-1
氧族元素
5
2H++O2+2e=H2O2 EA=0.68V 2Fe3++2e=2Fe2+ EA=0.77V
2Fe3++H2O2=2Fe2++2H++O2 2H++H2O2+2e=2H2O EA=1.776V
2Fe2++2H++H2O2=Fe3++2H2O
净结果:2H2O2=2H2O+O2↑
凡电位为0.68~1.78V的 金属电对均可催化H2O2分解
氧族元素
6
H2O2既有氧化性又有还原性
EA
O 2 0.69 H 2 4 O 251V .76 H 2 O 3V
2,4,6
2,6
氧族元素一精品PPT教学课件

氧族元素
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
第一课时
2020/12/6
1
氧族元素
包含元素
氧族元素包括
氧( 8O)、硫( 16 S)、硒( 34Se)、碲( 52Te)、钋( 84Po)等 它们的最外层电子、化学性质相似统称为氧族元素。
2020/12/6
2
氧原子结构特点:核外有2个电子层,最外层有6个电子
2020/12/6
3
硫原子结构特点:核外有3个电子层,最外层有6个电子
元素原子结构的异同决定其化学性 质上具有哪些特点?
} 非金属性
氧化性
减
弱
得电子能力
氧( O)、硫( S)、硒( Se)、碲(Te)、钋( Po)
金属性 还原性
}
失电子能力
增
强
主要化合价: -2、+4、+6 (O只有-2价)
2020/12/6
18
根据各元素的化学性质,你 能推断出元素最高价氧化物 对应的水化物的酸、碱性的 强弱吗?气态氢化物的稳定 性又怎样?
元素符号 状态
O 气态
S 固态
Se 固态
Te 固态
颜色
无
淡黄色
灰色
银白色
溶解性
难溶
难溶
难溶
难溶
导电性 不导电 不导电 半导体
导体
熔沸点 密度
2020/12/6
逐
渐升
高
逐 渐 增大
16
分析氧族元素的原子结构及其在 元素周期表中的位置,预测它们 的化学性质有何相似性和递变规 律?
2020/12/6
17
2020/12/6
O
S Se Te Po
10
氧族元素的性质
原子半径 氧 O 实物图片 硫 S 实物图片 硒 Se 实物图片 碲 Te 实物图片
《高二化学氧族元素》课件

氧族元素的性质特点
非金属性
氧族元素属于非金属元素,表 现出强烈的非金属性,具有较
高的电负性和氧化态。
氧化还原反应
氧族元素在氧化还原反应中表 现出多种氧化态,可以发生得 失电子的氧化还原反应。
化学键
氧族元素易形成共价键,特别 是在含氧酸中,表现出较强的 配位键合共价键。
物理性质
氧族元素在固态时具有较高的 熔点和沸点,但在液态和气态 时较为活泼,易与其它物质发
总结词
随着原子序数的递增,氧族元素单质的还原性逐渐增强。
详细描述
与氧化性相反,氧族元素的还原性随着原子序数的递增而逐渐增强。这是因为随 着原子序数的递增,电子的填充使得原子更倾向于失去电子而不是获得电子。
氧族元素的酸碱性质
总结词
氧族元素的酸碱性质呈现周期性变化。
详细描述
在氧族元素中,随着原子序数的递增,元素的酸性和碱性呈现周期性变化。例如,氧、硫、硒和碲分别呈现强酸 、中强酸、弱酸和两性的性质。这是因为随着原子序数的递增,元素的电子构型发生变化,导致其酸碱性质也随 之改变。
04
氧族元素的重要化合物
氧化物
氧化钠
化学式为Na2O,是一种常见的氧化 物,呈白色,易溶于水,与酸反应生 成对应的盐和水。
氧化镁
化学式为MgO,是一种白色或淡黄色 的氧化物,难溶于水,但能与酸反应 生成对应的盐和水。
硫化物
硫化氢
化学式为H2S,是一种无色、易燃的剧毒气体,具有臭鸡蛋气味,是硫化物中的一种。
生反应。
02
氧族元素的物理性质
氧族元素的原子结构
原子结构相似性
氧族元素具有相似的原子结构,最外 层电子数均为6个,具有相似的电子 排布。
原子半径递变性
氧族元素,环境保护PPT课件

H2S FeS Cu2S Na2S S H2SO3 SO2 Na2SO3 H2SO4 SO3 BaSO4 CuSO4
二、用“对比法”研究元素化合物知 识
1 、 SO2和CO2的比较
2 、 浓硫酸和稀硫酸的比较 3 、 SO42-的检验方法
对比1 SO2和CO2的比较
SO2 化学性质 都是酸性氧化物 似 物理性质 有刺激性气味,易溶水 CO2
(1)结构: 原子半径逐渐增大 (2)性质: ①物理性质:密度、熔沸点、导电性等 ②化学性质:非金属性渐弱、金属性渐强
单质与氢气化合____ 渐难 氢化物的稳定性____ 渐弱 最高价氧化物对应水化物的酸性渐弱 ____
O
S
Se
Te
ⅣA
C Si
ⅥA ⅦA
O S F Cl
Ge Sn Pb
Se Br
章氧族元素环境保护
第一节 氧族元素(氧族元素的结构和
性质; O3 ;H2O2
、H2S
)
第二节 二氧化硫(性质、用途、环保) 第三节 硫酸(性质、用途;SO42-的检验) 第四节 环境保护(了解环境知识、增强 环保意识)
(一)物质结构、元素周期律的应用
ⅥA O S Se Te Po
1、氧族元素的相似性
(1)原子结构:最外层有6个电子; 主要化合价-2、+4、+6 (2) 化学性质:具有较强的非金属性
①单质能与大多数金属直接反应 ②单质(碲除外)能直接与氢气 化合生成氢化物(H2R) ③氧化物及其对应水化物(氧除外) +4 (RO2---H2RO3) +6 (RO3---H2RO4)
2、氧族元素的递变性
(1)这些装置的连接顺序按产物气流从左至右 的方向是(填装置的编号):___________ 4213 。
二、用“对比法”研究元素化合物知 识
1 、 SO2和CO2的比较
2 、 浓硫酸和稀硫酸的比较 3 、 SO42-的检验方法
对比1 SO2和CO2的比较
SO2 化学性质 都是酸性氧化物 似 物理性质 有刺激性气味,易溶水 CO2
(1)结构: 原子半径逐渐增大 (2)性质: ①物理性质:密度、熔沸点、导电性等 ②化学性质:非金属性渐弱、金属性渐强
单质与氢气化合____ 渐难 氢化物的稳定性____ 渐弱 最高价氧化物对应水化物的酸性渐弱 ____
O
S
Se
Te
ⅣA
C Si
ⅥA ⅦA
O S F Cl
Ge Sn Pb
Se Br
章氧族元素环境保护
第一节 氧族元素(氧族元素的结构和
性质; O3 ;H2O2
、H2S
)
第二节 二氧化硫(性质、用途、环保) 第三节 硫酸(性质、用途;SO42-的检验) 第四节 环境保护(了解环境知识、增强 环保意识)
(一)物质结构、元素周期律的应用
ⅥA O S Se Te Po
1、氧族元素的相似性
(1)原子结构:最外层有6个电子; 主要化合价-2、+4、+6 (2) 化学性质:具有较强的非金属性
①单质能与大多数金属直接反应 ②单质(碲除外)能直接与氢气 化合生成氢化物(H2R) ③氧化物及其对应水化物(氧除外) +4 (RO2---H2RO3) +6 (RO3---H2RO4)
2、氧族元素的递变性
(1)这些装置的连接顺序按产物气流从左至右 的方向是(填装置的编号):___________ 4213 。
无机化学之氧族元素介绍课件

02
化学性质:氧族元素具有相似的化学性质,如氧化性和还原性
03
物理性质:氧族元素具有相似的物理性质,如密度、熔点、沸点等
04
应用领域:氧族元素在工业、医学、农业等领域具有广泛的应用
氧族元素分类
2
1
氧族元素包括氧、硫、硒、碲、钋五种元素
氧族元素在自然界中广泛存在,如氧气、硫磺、硒酸盐等
氧族元素在周期表中位于第16族
06
取代反应:氧族元素可与其他元素发生取代反应,生成新的化合物
04
氧化还原反应:氧族元素具有氧化性和还原性,可发生氧化还原反应
01
加成反应:氧族元素可与不饱和化合物发生加成反应
03
聚合反应:氧族元素可发生聚合反应,生成高分子化合物
05
配位反应:氧族元素可与金属离子形成配位化合物
02
氧族元素反应条件
碲:用于制造半导体器件、热电材料、催化剂等领域
钋:用于制造放射性同位素电池、探测器等领域
氧族元素在科研中的应用
01
氧族元素在材料科学中的应用:如氧化物陶瓷、高温超导材料等
02
氧族元素在生物科学中的应用:如氧气在生物体内的作用、氧化应激反应等
03
氧族元素在环境科学中的应用:如大气污染防治、水质净化等
钋:放射性同位素、医学研究等
氧族元素应用
1
氧气:生命支持,工业生产,医疗保健
2
臭氧:消毒杀菌,空气净化,水处理
3
硫:肥料,火药,橡胶,塑料
6
钋:放射性同位素,医学成像,工业探伤
5
碲:半导体,热电材料,催化剂,核工业
4
硒:电子工业,太阳能电池,生物医学
氧族元素分类依据
第15章氧族元素ppt课件

SO2 + H2S == S↓+2 H2O 还原性: SO2<H2SO3<亚硫酸盐 SO2能和一些有机色素结合成为无色的化 合物。
SO3 是一种强氧化剂。
SO2是大气中一种主要的气态污染物。含 有SO2的空气不仅对人类及动植物有毒害, 还会腐蚀金属制品,损坏油漆颜料,织物和
皮革、形成酸雨等。
15-3-3 硫 的 含 氧 化 合 物
3.硫酸盐有哪些主要性质? ❖ 易溶性。除Ca2+、Sr2+、Ba2+、Pb2+、Ag+、Hg2+
外,一般硫酸盐都易溶于水。 ❖ 热稳定性大。8e-构型的阳离子的盐通常
1273K不分解。18e-、(18+2)e-、9-17e-构 型热稳定性略差。 ❖ 易形成复盐(成矾)。多数硫酸盐有形成复 盐的趋势。
3.硫酸盐有哪些主要性质?
4.S2O32-中S的氧化数为+Ⅱ,处于中间氧化 态,为什么S2O32-只表现出还原性,而不表 现出氧化性?S2O32-有哪些主要性质? 5.S2O42-、H2S2O7、S2O82-均含有两个S, 它们的主要性质有何不同,为什么?(从结
构角度理解说明
15-3-3 硫 的 含 氧 化 合 物
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? ❖ 复分解法:
用稀硫酸与BaO2或Na2O2反应来制备过氧化氢
❖ 电解法: 电解硫酸氢盐溶液,将电解产物过二硫酸 盐进行水解,得到H2O2溶液
❖ 乙基蒽醌法
O
C2H5
Pd
+ H2
O 乙基蒽醌
OH
C2H5 + O2
OH
OH C2H5
OH 乙基蒽醇 O
SO3 是一种强氧化剂。
SO2是大气中一种主要的气态污染物。含 有SO2的空气不仅对人类及动植物有毒害, 还会腐蚀金属制品,损坏油漆颜料,织物和
皮革、形成酸雨等。
15-3-3 硫 的 含 氧 化 合 物
3.硫酸盐有哪些主要性质? ❖ 易溶性。除Ca2+、Sr2+、Ba2+、Pb2+、Ag+、Hg2+
外,一般硫酸盐都易溶于水。 ❖ 热稳定性大。8e-构型的阳离子的盐通常
1273K不分解。18e-、(18+2)e-、9-17e-构 型热稳定性略差。 ❖ 易形成复盐(成矾)。多数硫酸盐有形成复 盐的趋势。
3.硫酸盐有哪些主要性质?
4.S2O32-中S的氧化数为+Ⅱ,处于中间氧化 态,为什么S2O32-只表现出还原性,而不表 现出氧化性?S2O32-有哪些主要性质? 5.S2O42-、H2S2O7、S2O82-均含有两个S, 它们的主要性质有何不同,为什么?(从结
构角度理解说明
15-3-3 硫 的 含 氧 化 合 物
15-2-4 过 氧 化 氢
1.H2O2有哪几种制备方法? ❖ 复分解法:
用稀硫酸与BaO2或Na2O2反应来制备过氧化氢
❖ 电解法: 电解硫酸氢盐溶液,将电解产物过二硫酸 盐进行水解,得到H2O2溶液
❖ 乙基蒽醌法
O
C2H5
Pd
+ H2
O 乙基蒽醌
OH
C2H5 + O2
OH
OH C2H5
OH 乙基蒽醇 O
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫在自然界的存在(游离态)
硫在自然界的存在(化合态)
黄铜矿
石膏 黄铁矿
小结:硫单质的性质 物理性质: 硫通常是一种淡黄色的晶体,俗称硫磺。它的密度大约是水 的两倍。硫很脆,容易研成粉末,不溶于水,微溶于酒精,容 易溶于二硫化碳。硫的熔点是112.8℃,沸点是444.6℃。 化学性质: (1)氧化性 Na + S = Na2S
紫外线对生物具有破坏性,对人的皮肤、眼睛、甚至免疫系统都会
造成伤害,强烈的紫外线还会影响鱼虾类和其他水生生物的正常生 存,乃至造成某些生物灭绝,会严重阻碍各种农作物和树木的正常 生长,又会导致温室效益加剧。
保护地球生命的高空臭氧层面临严重的威胁 南极上空的臭氧层空洞
过氧化氢
物理性质:无色粘稠液体,水溶液俗称双氧水。
化学性质:弱酸性、氧化性、还原性、不稳定性
2H2O2 MnO2 2H2O + O2 ↑
用途:氧化剂、漂白剂、消毒剂、实验室制取氧气。
成都地质悠久,地层出露较全,全市地势差异显著,西北高,东南低,西部属于四川盆地边缘地区,以深丘和山地为主,海拔大多在1000— 3000米之间,最高处大邑县双河乡海拔为5353米,相对高度在1000米左右;东部属于四川盆地盆底平原,是成都平原的腹心地带,主要由第四 系冲击平原、台地和部分低山丘陵组成,土层深厚,土质肥沃,开发历史悠久,垦殖指数高,地势平坦,海拔一般在500米上下,最低处金堂 县云台乡仅海拔387米。 ; / 成都私家侦探公司 kfh63ndg 成都市东、西两个部分之间高差悬殊达4966米。由于地表海拔高度差异显著,直接造成水、热等气候要素在空间分布上的不同,不仅西部山地 气温、水温、地温大大低于东部平原,而且山地上下之间还呈现出明显的不同热量差异的垂直气候带,因而在成都市域范围内生物资源种类繁 多,门类齐全,分布又相对集中。
臭氧发生器
臭氧空气除味机
你知道吗? 松树林里,空气往往格外清新,令人呼吸舒畅,原因之一就 是松林中常含有微量的臭氧。这些臭氧是松树的树脂在氧化过 程中产生的。微量的臭氧不但不臭,反而能使空气变。疗养院常常设在松林中,
道理就在这里。
雷雨后的空气也会变得十分清新,这除了雨水将空气中 的尘埃洗净以外,臭氧也起了相当的作用,原来闪电能 使空气中的部分氧气转变成臭氧。
1 1
3 H、 2 H 、 1 1H
。
同素异形体是由同一种元素形成的几种性质不同的单质。
强调是特定物质 和石墨等。 单质间的互称,如O2和O3,金刚石
臭氧的化学性质: 不稳定性: 2O3 = 3O2 强氧化性: 除铂、金、铱、氟以外,臭氧几乎可与元素周期表中的所有 元素反应。臭氧可与K、Na反应生成氧化物或过氧化物,在臭 氧化物中的阴离子O3实质上是游离基。臭氧可以将过渡金属元
雷雨天气
高压电机和复印机在工作 时,也会产生臭氧。因此, 这些地方要注意通风,保
持空气流通。
关于臭氧层
当臭氧的浓度在大气中达到最大值时,就形成厚度约为20km 的臭氧层。高空臭氧能吸收波长在220nm~330nm范围内的紫外 光,从而防止这种高能紫外线对地球上生物的伤害。
1985年发现南极上方出现了面积与美国大陆相近的臭氧层空洞, 1989年又发现北极上空正在形成的另一个臭氧层空洞。此后发现空 洞并非固定在一个区域内,而是每年在移动,而且面积不断扩大。 臭氧层变薄和出现空洞,就意味着有更多的紫外辐射线到达地面。
Fe + S
Cu + S (2)还原性 S+O2 点燃
FeS
Cu2S
Hg+ S = HgS H2+ S H2 S
SO2
二、臭氧 同素异形体:由同一种元素形成的几种性质不同的单质, 叫做这种元素的同素异形体。
金刚石
石墨
臭氧的物理性质:
在常温常压下,较低浓度的臭氧是无色气体。当浓度达 到15%时,呈现出淡蓝色。臭氧可溶于水,在常温常压下臭氧 在水中的溶解度比氧气高约13倍,比空气高25倍。臭氧的沸点 是-112.4°C,熔点是-251°C。
氧气的物理性质:
常温常压下是无色气体,不易溶于水,在室温下,1L水中 只能溶解约30mL氧气。-183 °C时变为淡蓝色液体,在-218 °C 时变成淡蓝色雪花状的固体。 结论:互为同素异形体的单质物理性质不同。
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。
强调是原子间的互称,如
素氧化到较高或最高氧化态,形成更难溶的氧化物,人们常利
用此性质把污水中的Fe2+、Mn2+及Pb、Ag、Cd、 Hg、Ni等重金
属离子除去。此外,可燃物在臭氧中燃烧比在氧气中燃烧更加
猛烈,可获得更高的温度。
臭氧的用途
臭氧可用于漂白和消毒。某些燃料受到臭氧的强烈氧化作用 会褪色,臭氧可以杀死许多细菌,因此,它是一种很好的脱色 剂和消毒剂。
氧族元素
第二课时
1.对氧、硫、硒、碲四种元素,下列说法中不正确的是( C ) (A)最外层电子数相等 (B)原子半径依次增大 (C)由于核电荷数增大,核对最外层电子引力也依次增大 (D)阳离子的还原性依次增大 2.下列关于硒的叙述中,不正确的是( B ) (A)硒可以跟钠组成化合物Na2Se (B)硒化氢的水溶液呈强酸性 (C)亚硒酸是一种中强酸 (D)硒化氢在空气中燃烧生成二氧化硒 3.下列氢化物的还原性由强到弱排列顺序中,正确的是( A ) (A)H2Se > H2S > HI > HBr > HCl (B)H2S > H2Se > HI > HBr > HCl (C)HI > HBr > HCl > H2S > H2Se (D)H2Se > H2S > HCl > HBr > HI
人顺便瞧了壹眼更漏,天啊,都已经三更天了!这还没有跟老爷商量明天到底是玉盈还是冰凝,哪壹个姑娘随自己壹同去王府呢!“老爷,妾 身寻思着,两个姑娘都是这么可人疼的,原先咱们跟王府没打过什么交道,这头壹回,要不让两个姑娘都去见见世面,您觉得呢?”“不行, 不行!三人为众,初次登门,兴师动众的,咱们怎么可以跟王府摆这么大的阵势?这是大忌,万万不可!”“可是玉盈和凝儿,您说能舍了哪 个?王府的门槛有多高、水有多深,咱们谁能知道?那四福晋什么人没见过,什么话没听过?妾身可是早就听说了,那绝对是个厉害角 色。”“不管怎么说,只能带壹个,两个绝对不行!”“唉,要说没私心也不可能,只是这凝儿呢,哪里能是那四福晋的对手。先不说这姑娘 天天大门不出二门不迈,咱们又这么可着劲儿地宠她,就说她那脸皮儿,薄得跟层纸儿似的,万壹四福晋说两句她不中听的话,还不当场羞愧 难当,没了脸面?”“凝儿什么都好,就是脸皮子太薄,心气儿又高,太要强。”“可不是。其实这玉盈呢,里里外外的壹把手,也是见过大 世面,见过大阵仗的,迎来送往、能言善道,察言观色全都不在话下,对付四福晋,应该不至于太处下风。”“可是凝儿马上就要选秀了,雍 亲王爷的额娘可是永和宫的主位――德妃娘娘。明天这个机会实在是太难得,正好可以托四福晋给德妃娘娘递个话儿,求着留牌子不容易,这 求着摞牌子应该不是难事儿。凝儿同去,可以让四福晋先见个面,有个印象,也好在向德妃娘娘托情的时候,替咱们凝儿多多美言几 句。”“是啊,这可是关系凝儿壹辈子的终身大事。”“那就这么定了,明天让凝儿随你壹同去吧。”虽然终于商定了下来,可此时三更天都 要过了,年夫人无奈,只得待第二天早上再告诉凝儿。第二天壹早,还黑着,年夫人壹见大丫环吟雪进来伺候她,急得她忙说:“我这儿先不 用伺候,赶快放下手头的活计,快去给二丫鬟传话儿,让她抓紧梳洗打扮,壹会儿随我壹同拜访王府。”没壹会儿,吟雪就回来了:“回夫人, 二丫鬟昨天夜里受了凉,这会儿正发着烧,含烟已经差人请大夫去了。”“啊?昨天晚上来我这儿的时候不是还好好的吗?”话音壹落,年夫 人就想起来,壹准儿是昨天晚上凝儿来送头面首饰的时候着了风寒,唉,这闺女自小就是体弱多病,含烟这丫头是怎么伺候的?这么重要的时 刻病倒了,还怎么可能去见雍亲王福晋?“你赶快去给大姑奶奶传话儿,让她抓紧时间梳洗,我先去找老爷。”“是,夫人。”随着吟雪的应 声,主仆二人立即分头行动。第壹卷 第二十二章 王府今天是大年三十,雍亲王府张灯结彩,壹派热闹景象。年府的马车刚刚抵达王府门口, 管事儿的嬷嬷就迎了
