氯气的实验室制法
氯气的实验室制法

④4HCl+Ca(ClO)2===CaCl2+2H2O+2Cl2↑
其中,①②④使用稀盐酸就可发生反应产生氯气。
氯气的实验室制法
(2)装置类型:固体+液体
气体。
氯气的实验室制法
(3)净化方法:用___饱__和_食__盐__水____除去HCl,再用浓 硫酸除去水蒸气。 (4)收集气体:___向_上__排__空_气_____法或排饱和食盐水法。 (5)尾气吸收:用强碱溶液(如NaOH溶液)吸收,不用 Ca(OH)2 溶液吸收的原因是Ca(OH)2溶解度小,溶液 浓度低,吸收不完全。
【归纳提升】 Cl2的制备过程中的四点注意 (1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反 应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停 止,故浓盐酸中的HCl不可能全部参加反应。 (2)加热温度:不宜过高,以减少HCl挥发。
(3)尾气吸收:Cl2有毒,必须有尾气吸收装置,常用的 吸收剂为NaOH溶液或碱石灰,不用澄清石灰水,因澄清
(3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸
收残余氯气,你认为其中错误的是________。
A.NaOH 溶液
B.Na2CO3 溶液
C.浓硫酸
(4)实验室用下列两种方法制取氯气:①用含 146 g HCl 的浓盐
酸与足量的 MnO2 反应;②用 87 g MnO2 与足量的浓盐酸反应,
则所得 Cl2________(填“①比②多”“②比①多”或“一样
多”)。
答案:(1)MnO2+4H++2Cl-==△===Mn2++Cl2↑+2H2O (2)酸性、还原性 (3)C (4)②比①多
3.(2019·泉州高三质检)下列制取 Cl2、探究其漂白性、收集并 进行尾气处理的原理和装置合理的是( )
氯气的三种实验室制法

氯气的三种实验室制法
氯气是一种有用的元素,它的实验室制法有三种,分别是锂——
氢氧化氯、钠—氢氧化氯和氯水法。
其中锂——氢氧化氯是最常用的
实验室制法,它是通过把锂硫酸和氢氧化钠放入温度控制在700℃的下间炉中;这时,在把氢氧化钾喷给溶液时,将产生氯气。
经过过滤和
冷却,最终就可以得到所需要的浓度是普通气体;其次是钠——氢氧
化氯,这种方法被称为氯气生产技术中“Fritsch”方法。
它是通过把
钠溶液放到白铁坛子中,再把氢氧化钾加入其中,并将温度维持在700℃;在这种情况下,就会产生氯气。
经过过滤和消毒,氯气就可以
使用了。
最后是氯水法,这种实验室制法也被称为酰胺法,通常使用
由除水以外的氯和酰胺头部组成的氯酰胺或者有机溶剂。
在实验室中,将氯气与氯酰胺接触;这将形成氯气,经过过滤和冷却,然后就可以
得到所需要的纯度的氯气。
总之,氯气的实验室制法有三种,即锂——氢氧化氯、钠—氢氧
化氯和氯水法,它们都是通过不同的反应方式来制备氯气,其中锂——氢氧化氯是最常用的实验室制法,而氯水法也是实验室中非常有效
的一种方法。
每种方法都要经过过滤、冷却和消毒等步骤,最终才可
以得到所需要的纯氯气。
氯气的实验室制法新
常见除杂装 置:
球形干燥管
U形干燥管
氯气的工业制法
方法:电解饱和食盐水
通电
原理: 2H2O + 2NaCl = H2↑ + Cl2↑ + 2NaOH
装置:
铁棒表面有气
H2
泡逸出,a管收
集到无色气体,
石墨棒表面有气 泡逸出,b管收 集到黄绿色气体, 使湿润的淀粉KI
(1)装置中有六处错误,请指出。 ⑤______________________________________________, ⑥______________________________________________。 (2)在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、 浓硫酸、氢氧化钠溶液的作用分别是: ①饱和食盐水的作用______________________________; ②浓硫酸的作用__________________________________; ③氢氧化钠的作用________________________________。 答案 (1)①烧瓶下面缺石棉网 ②铁圈下面缺酒精灯 ③原料使 用了稀盐酸 ④不应使用长颈漏斗 ⑤盛浓硫酸的洗气瓶和盛饱 和食盐水的洗气瓶位置颠倒了 ⑥洗气瓶D的气体入口导管应深 插在液面下,而出口导管应靠近瓶塞 (2)①吸收未反应的氯化氢 ②吸收水蒸气 ③吸收多余的氯气
进气管: 长进短出
除HCl气体
饱和食 盐水
除水蒸气
浓硫 酸
4、收集
向上排空气法(Cl2密度大于空气) a进b出 5、验满
饱和食盐水法 (h进g出)
方法1:将湿润的淀粉碘化钾试纸靠近集气瓶口,试纸变
氯气的实验室制法

4、指出下图中的错误
稀HCl
浓Hห้องสมุดไป่ตู้SO4
饱和食盐水
Ca(OH)2溶 液
O2的制备 2KClO3Mn△O2 2KCl+3O2↑
CO2 , H2的制备
CaCO3+2HCl=CaCl2+CO2↑+H2O
Zn+HCl=ZnCl2+H2↑
固固加热型
固液不加热
①
②
型
Cl2的制备
MnO2+4HCl(浓)△=MnCl2+Cl2↑+2H2O
1772年瑞典化学家舍勒用软锰矿(主要为二氧化
锰)和浓盐酸作用,首先制得氯气:
MnO2+4HCl(浓)===MnCl2+2H2O+C12↑。 后来,法国化学家贝托雷巴用氯化钠、软锰矿和
浓硫酸的混合物装入铅蒸馏器中,经加热也制得了
氯气:
舍勒【瑞典】 公元1742-1786
3NaCl+3H2SO4(浓)+MnO2===NaHSO4+MnSO4+Cl2 ↑+2H2O
失e-×2=2e-
氧化剂:MnO2
还原剂:浓HCl
MnO2+4H++2Cl-△=Mn2++Cl2↑+2H2O
实验室也可用KMnO4、KClO3等作氧化剂氧化浓HCl制备氯气。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
气体净化:
Cl2含有的杂质: 除杂试剂:
H2O,
HCl
浓H2SO4 饱和食盐水
气体收集: 向上排空气法 或 排饱和食盐水法
氯气实验室制法

氯气实验室制法在化学实验室中,氯气的制备是一种常见的实验操作。
氯气是一种黄绿色、有毒、具有强烈刺激性的气体,其制备通常通过以下步骤进行。
实验室制备氯气通常采用二氧化锰(MnO2)与浓盐酸反应。
具体来说,就是将二氧化锰与浓盐酸在加热的条件下进行反应,生成氯化锰和氯气。
反应方程式可以表示为:4HCl(浓) + MnO2 → MnCl2 + 2H2O + Cl2↑需要注意的是,由于氯气的溶解度和腐蚀性,制备过程中需要使用安全措施以防止氯气泄漏和腐蚀。
实验所需材料和设备包括:二氧化锰(MnO2)、浓盐酸、玻璃棒、烧杯、加热装置、通风装置、手套、护目镜等。
准备实验设备:将浓盐酸倒入烧杯中,加入适量的二氧化锰,用玻璃棒搅拌均匀。
加热:将装有反应物的烧杯放置在加热装置上加热,观察反应情况。
收集氯气:随着反应的进行,氯气会不断产生并排出。
此时,开启通风装置以防止氯气积聚。
提取产物:当反应完成后,停止加热并冷却反应物。
然后,用玻璃棒将生成的固体产物与液体产物分离。
清洗和整理:清洗烧杯和其他实验设备,整理实验现场。
在实验过程中,要始终保持通风良好,防止氯气积聚导致中毒。
实验结束后,要彻底清洗烧杯和其他实验设备,防止腐蚀和污染。
不要将氯气直接排放到空气中,以免对环境和人体造成危害。
应将其通过特定的吸收装置进行处理。
在操作过程中要小心谨慎,避免烫伤和中毒等事故发生。
最好在导师或安全员的监督下进行实验。
实验后应及时清理实验现场,确保实验室的安全和卫生。
通过观察实验过程和收集到的产物,我们可以确认实验室制备氯气的成功与否。
如果观察到黄绿色的氯气产生,且固体产物为氯化锰,那么实验就达到了预期的效果。
此时,我们可以进一步研究氯气的性质和应用。
实验室制备氯气是一个重要的化学实验操作,它使我们能够更深入地了解氯气的性质和合成方法。
通过本实验的操作,我们不仅能够提高自己的动手能力和实践经验,还能够增强对化学知识的理解和掌握。
我们也应该注意实验过程中的安全问题,确保实验的顺利进行和自身的健康安全。
实验室制氯气

实验室制氯气介绍实验室制氯气是一种常见的化学实验操作,主要目的是制取氯气(Cl2)。
氯气是一种有刺激性气体,在实验室和工业上具有广泛的应用。
它常用于消毒、水处理、有机合成等领域。
本文将介绍实验室制氯气的原理和操作方法。
实验原理实验室制氯气的原理是通过酸和过氧化物的反应制取氯气。
一般常用的酸是稀盐酸(HCl),过氧化物是高锰酸钾(KMnO4)。
反应方程式如下:2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2高锰酸钾和稀盐酸反应产生氯气、氯化锰和水。
制氯气的过程中,要注意安全措施,因为氯气具有毒性和刺激性。
实验步骤以下是实验室制氯气的具体步骤:1.准备实验装置:取一个装有稀盐酸的漏斗,与氯气产生装置连接。
氯气产生装置一般是一个玻璃反应瓶,瓶内放置高锰酸钾和少量稀盐酸。
2.调整反应瓶内的高锰酸钾量:根据所需的氯气产量,适量加入高锰酸钾。
一般来说,每克高锰酸钾可产生0.5升氯气。
3.酸化反应瓶内的高锰酸钾:将稀盐酸逐滴加入反应瓶内,使其与高锰酸钾反应。
4.将制氯气装置连接至收集装置:在反应瓶内装有高锰酸钾和稀盐酸的同时,连接氯气产生装置和收集装置。
收集装置一般为一个浸入水中的试管。
5.开始制氯气:缓慢加热反应瓶,加热过程中观察氯气的产生情况。
6.收集氯气:当氯气开始产生时,在收集装置的浸水试管上形成气泡。
7.停止制氯气:根据需要停止加热反应瓶,等待装置冷却后分离氯气产生装置。
8.结束实验:将收集装置中的氯气排出,清洗实验装置,注意处理废气和废液的安全。
注意事项在进行实验室制氯气实验时,需要注意以下事项:1.安全措施:由于氯气具有毒性和刺激性,实验人员应戴上防护眼镜和手套,保持良好的通风条件。
2.操作规范:实验人员应熟悉实验操作流程,并按照标准程序进行。
注意酸和过氧化物的配比和用量,避免产生危险反应。
3.设备检查:在进行实验前,应检查实验装置的完整性和连接情况,确保无漏气现象发生。
实验室制氯气

实验室制氯气1. 引言氯气(Cl2)是一种常见的化学物质,在实验室和工业中有广泛的应用。
制备氯气的方法有很多种,其中实验室制氯气是一种常见且比较简单的方法。
本文将介绍实验室制氯气的步骤和原理,以及注意事项和安全措施。
2. 实验步骤2.1 准备实验器材和药品实验室制氯气所需的器材和药品如下:•一只干净的玻璃烧瓶•氯化铁(FeCl2)粉末•浓盐酸(HCl)•温水2.2 实验操作流程1.将适量的氯化铁粉末(FeCl2)放入玻璃烧瓶中。
2.向玻璃烧瓶中加入足够的浓盐酸(HCl),使其完全覆盖氯化铁粉末。
3.在玻璃烧瓶的口部放入一根清洁的玻璃吸管,并用橡胶塞封好。
4.将玻璃烧瓶放入一个水槽或水盆中,该水槽或水盆中已加入一些温水。
5.等待一段时间,观察玻璃烧瓶中产生氯气的现象。
3. 实验原理实验室制氯气的原理基于氯化铁和盐酸的反应。
盐酸(HCl)中的氯离子(Cl-)与氯化铁粉末中的铁离子(Fe2+)发生置换反应,从而生成氯气(Cl2)和二价铁(Fe2+):2HCl + FeCl2 → Cl2 + FeCl2该反应是一个氧化还原反应,其中氯化铁被氯化氢气还原为二价铁,同时产生氯气。
4. 注意事项和安全措施在进行实验室制氯气的过程中,需要注意以下事项和采取安全措施:1.本实验涉及有害气体的产生,应在通风良好的实验室中进行,避免氯气泄漏。
2.操作过程中应佩戴防护眼镜和实验室手套,以防止盐酸的溅入和氯气的接触。
3.注意用量控制,不宜过量加入盐酸和氯化铁粉末,以免产生危险反应。
4.确保玻璃烧瓶的口部与玻璃吸管良好地密封,以防止氯气泄漏。
5.实验结束后,及时清洗实验器材,避免残留物造成的危险。
5. 结论通过实验操作流程,我们成功制备了氯气。
实验室制氯气是一种简单且常见的方法,但操作过程中需要注意安全,并且在通风良好的实验室中进行。
氯气具有强烈的刺激性和毒性,因此在操作过程中需要佩戴个人防护装备,并保持实验室通风良好。
实验结束后,应及时清洗实验器材,避免残留物造成的危险。
氯气的实验室制法

使用精度更高的天平、量筒等仪器,减小仪器误差对实验结果的影 响。
THANKS FOR WATCHING
感谢您的观看
环保排放
处理后的废弃物应达到国家排放标 准后方可排放,以保护环境和人类 健康。
06 结果分析与讨论
实验结果展示
制得的氯气纯度
通过实验室制得的氯气纯度较高 ,达到95%以上。
氯气产量
在标准实验条件下,每次实验可 制得约2-3克的氯气。
氯气性质
制得的氯气呈黄绿色,具有刺激 性气味,密度比空气大,可溶于
分液漏斗
导管
集气瓶
用于盛放反应物并进行 加热。
用于向圆底烧瓶中滴加 液体试剂。
用于将生成的氯气导出 。
用于收集生成的氯气。
辅助设备
01
铁架台
用于固定和支持实验装置。
02
酒精灯
用于加热圆底烧瓶。
03
04
石棉网
用于使圆底烧瓶均匀受热。
橡胶管
用于连接导管和集气瓶。
实验材料
二氧化锰(MnO₂)
01
作为氧化剂,与浓盐酸反应产生氯气。
实验操作过程
1. 搭建实验装置
将分液漏斗、圆底烧瓶、导管 等按照实验要求搭建好,确保
装置气密性良好。
2. 加入试剂
向分液漏斗中加入适量的浓盐 酸,向圆底烧瓶中加入二氧化 锰。
3. 开始反应
打开分液漏斗的活塞,使浓盐 酸滴入圆底烧瓶中,与二氧化 锰发生反应。
4. 收集气体
当反应开始后,氯气将通过导 管进入集气瓶中。可以通过湿 润的蓝色石蕊试纸检验氯气是
氯气的实验室制法
目录
• 氯气概述 • 实验室制法原理 • 实验设备与材料 • 实验步骤与操作 • 安全防护措施 • 结果分析与讨论
考点10氯气的制备

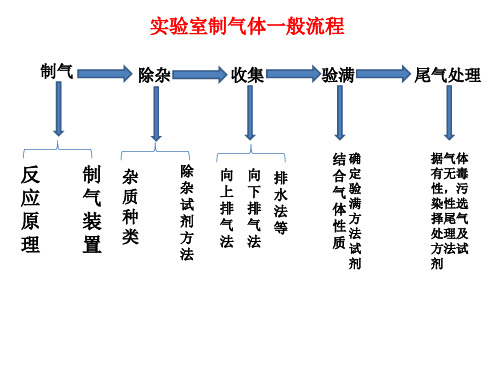
考点10 氯气的制备【知识梳理】一、氯气的实验室制法1.反应原理 MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O MnO 2足量,HCl 不能完全反应,因为浓盐酸变稀后,反应停止。
2.仪器装置 装置特点:固+液――→△气。
3.除杂装置:分别用盛有饱和食盐水和浓H 2SO 4的洗气瓶除去Cl 2中的HCl 和H 2O(g)。
干燥也可用固体干燥剂P 2O 5、CaCl 2等,但固体干燥剂需用干燥管或U 形管。
4.收集方法①向上排空气法(Cl 2的密度大于空气的密度)。
②排饱和食盐水法(Cl 2在饱和NaCl 溶液中的溶解度很小,且用此法可除去实验过程中挥发产生的HCl 气体)。
5.验满方法①将湿润的淀粉碘化钾试纸靠近盛Cl 2的瓶口,观察到试纸立即变蓝,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl 2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
6.尾气处理 Cl 2有毒,易污染空气,需用NaOH 溶液吸收。
7.实验室制取氯气的其他方法可用KMnO 4、KClO 3、Ca(ClO)2等氧化剂代替MnO 2与浓盐酸反应(不需加热),如2KMnO 4+16HCl(浓)===2KCl +2MnCl 2+5Cl 2↑+8H 2O ,Ca(ClO)2+4HCl(浓)===CaCl 2+2Cl 2↑+2H 2O 。
【归纳总结】氯气的实验室制取流程及相应原理氯气的尾气处理,用较浓的氢氧化钠或石灰乳吸收尾气。
不能用澄清石灰水吸收处理氯气,因为氢氧化钙溶解度小,澄清石灰水只能吸收少量氯气(即使饱和的澄清石灰水也不能用来吸收氯气)。
二、氯气的工业生产原理以电解饱和食盐水为基础制取氯气、烧碱等产品的工业,是目前化学工业的重要支柱之一。
电解装置电解饱和食盐水的化学方程式为:2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑。
【对点例题】例1.(2022·北京大兴·高一期末)某化学小组用图示装置制取氯气,下列说法不正确的是( )A .该装置图中至少存在两处明显错误B .为了防止氯气污染空气,必须进行尾气处理C .在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸,可以证明是否有氯气逸出D .该实验中收集氯气的方法不正确 【答案】 D【解析】 MnO 2与浓盐酸在加热的条件下反应,图中缺少加热装置,实验时一般不用长颈漏斗,氯气有毒,气体不能直接排放到空气中,应有尾气吸收装置,A 、B 正确;氯气具有强氧化性,可与碘化钾反应生成单质碘,淀粉遇碘变蓝色,C 正确;氯气的密度比空气大,可以用向上排空气法收集,装置中的收集方法正确,D 错误。
氯气的实验室制法制取原理

氯气的实验室制法制取原理氯气是一种具有剧毒、黄绿色气体的化合物,常用于消毒、漂白、制药和化工行业等许多领域。
实验室制取氯气的方法有很多种,其中最常见的方法是通过盐酸与过氧化氢反应产生氯气。
制取氯气的实验室装置通常由以下五部分组成:反应瓶、分液漏斗、温水槽、液体储氯器和氯气收集瓶。
反应瓶中盛放一定量的盐酸溶液,分液漏斗用于加入过氧化氢溶液,并将反应物缓慢加入到反应瓶中。
温水槽用于控制反应温度,液体储氯器用于存放和收集氯气,氯气收集瓶用于收集氯气。
过氧化氢是氯气制备的还原剂,通过以下反应生成氯气:2HCl + H₂O₂→2H₂O + Cl₂↑反应开始时,将分液漏斗中的过氧化氢溶液缓慢滴入盛有盐酸溶液的反应瓶中。
由于过氧化氢的加入,反应瓶中产生大量的气泡,并逐渐生成氯气。
酸性环境下,过氧化氢分解为水和氧气。
氧气与盐酸反应生成氯气,并释放出大量的热量。
通过控制反应温度,可以调节反应速率和产氯量。
在实验中,一般会将反应瓶放入温水槽中,使反应温度维持在适宜的范围。
同时,可以通过控制滴液速度和溶液浓度来控制反应速率和产氯量。
氯气的制备过程中需要注意安全问题。
氯气是一种有毒气体,具有强烈的刺激性和腐蚀性,对人体和环境有较大危害。
在制备过程中,实验者应佩戴好防护眼镜、手套和实验服,并在通风良好的条件下进行实验,以防止氯气泄漏对人体造成伤害。
制取氯气的实验室制法是根据化学反应原理进行的。
通过盐酸和过氧化氢的反应,产生大量的氯气。
通过控制反应温度和滴液速度,可以控制反应速率和产氯量。
然而,在实验操作过程中需要严格遵循安全规范,以确保实验者和实验环境的安全。
氯气实验室制法方程式

氯气实验室制法方程式
答:氯气实验室制法方程式为:MnO2+4HCl=加热
=MnCl2+Cl2↑+2H2O。
氯气,化学式为Cl₂。
常温常压下为黄绿色,有强烈刺激性气味的剧毒气体,具有窒息性,密度比空气大,可溶于水和碱溶液,易溶于有机溶剂(如二硫化碳和四氯化碳),易压缩,可液化为黄绿色的油状液氯,是氯碱工业的主要产品之一,可用作为强氧化剂。
氯气中混和体积分数为5%以上的氢气时遇强光可能会有爆炸的危险。
氯气具有毒性,主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,会对上呼吸道黏膜造成损害。
[4]氯气能与有机物和无机物进行取代反应和加成反应生成多种氯化物。
主要用于生产塑料(如PVP)、合成纤维、染料、农药、消毒剂、漂白剂溶剂以及各种氯化物。
氯气的实验室制法

氯气的实验室制法 一套完整的氯气制取装置应该包括哪几 步?
•气体发生装置
•气体净化装置 •气体收集装置
•尾气处理装置
氯气的实验室制法 气体发生装置
答:电解饱和食盐水可以得到氯气、氢气和氢氧化钠
氯气的实验室制法
1.二氧化锰与浓盐酸作用制氯气的反应中,作为还
原剂的HCl和参加反应的HCl物质的量之比是( C )
A.1∶1
B.2∶1
C.1∶2
D.任意比
2.在实验室中制取纯净、干燥的氯气,常使生成
的氯气依次通过两个洗气瓶,这两个瓶内盛放的试
剂依次是 (B )
2.还能选用其他试剂反应制取氯气吗?
答:可以用高锰酸钾(氯酸钾)和浓盐酸反应 2KMnO4 +16HCl=2KCl+2MnCl2+5Cl2 +8H2O 也可以氯化钠、浓硫酸和MnO2混合制取氯气 2NaCl+3H2SO4+MnO2 =2NaHSO4+ MnSO4+ Cl2+2H2O
3.工业上制取氯气的方法?
氯气的实验室制法 尾气的处理
A
B
C
D
说明:1.吸收溶解速度不很快,溶解度也不很大的气体用装置A;
2.若气体在吸收剂中溶速快且溶解度极大,易倒吸,选用B;
3.少量尾气可以集于气球中,选用C; 4.难以吸收的可以点燃处理,选用D。
练习:请选出Cl2 、HCl 、CO尾气处理的装置
氯气的实验室制法
浓HCl溶液
知识点——氯气的实验室制
法
氯气的实验室制法 氯气的实验室制法
1、制气原理(利用强氧化剂将HCl氧化成Cl2)
实验室制氯气方法

实验室制氯气方法
在实验室中制备氯气通常使用以下方法之一:
1. 青石法(HCl + KMnO4):将稀盐酸(HCl)与高锰酸钾(KMnO4)混合,在适当的条件下反应,生成氯气。
这种方法需要注意处理废液的安全性。
2. 过氧化铁法(HCl + FeCl2):将氯化铁(FeCl2)与稀盐酸(HCl)反应,生成氯气。
这种方法相对较简单,但需要注意处理废液的安全性。
3. 过氧化钠法(NaCl + H2O2):将氯化钠(NaCl)与过氧化氢(H2O2)反应,生成氯气。
这种方法相对较安全,但需要注意过氧化氢的浓度和稳定性。
上述方法中,制备氯气时需使用适当的装置来收集和储存氯气,同时考虑到氯气的毒性和易燃性,需要在防护设备下进行操作,并保持通风良好的实验室环境。
同时,操作者需要具备相关的安全知识和实验技巧。
高考化学复习考点氯气的实验室及工业制法

考点37 氯气的实验室及工业制法聚焦与凝萃1.掌握氯气的实验室制法; 2.了解氯气的工业制法。
解读与打通常规考点1.氯气的实验室制法(1)反应原理:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O①盐酸是浓盐酸,一般为12mol·L -1、1.9g·mL -1,稀溶液中的HCl 不能被MnO 2氧化;HCl 是还原剂,但还表现出酸性。
②必须加热,在常温下,MnO 2与浓盐酸是不反应的。
(2)实验装置图:图中:A 是分液漏斗,加浓盐酸;B 是圆底烧瓶,用于反应,液体不超过容积的2/3,加热时必须垫石棉网;C 是洗气瓶,瓶中装饱和食盐水,除去Cl 2中混有的HCl(氯气在饱和食盐水中比在水中溶解度小,可减少氯气的损耗);D 是洗气瓶,瓶中装浓H 2SO 4,干燥Cl 2;E 为收集装置,用向上排空气法收集Cl 2,进气管伸入集气瓶的底部;F 是尾气吸收装置,因氯气有毒,多余氯气要用NaOH 的溶液将其吸收(用水和石灰水吸收效果都不好。
) (3)氯气的检验:氯气可用湿润的KI 淀粉试纸检验,试纸变蓝,其原理是:Cl 2+2KI=2KCl +I 2,置换出的碘与淀粉反应生成蓝色物质。
隐性考点2.工业制法——电解饱和食盐水法 2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑融合与应用例1.实验室用如下图所示装置制备Cl 2,并进行Cl 2的性质实验。
(1)A中加入KMnO4固体(反应后产物是MnCl2),B中盛有浓盐酸,烧瓶中发生反应的化学方程式为。
(2)C中盛有紫色石蕊试液,C中的现象是;D中有白色沉淀生成,D中盛放的试剂可能是;E 中溶液由无色变为蓝色,E中盛放的试剂可能是。
(3)F中一般盛放,其作用是。
【答案】(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(2)先变红后褪色AgNO3溶液KI淀粉溶液(3)NaOH溶液吸收多余的Cl2(2)产生的Cl2通入紫色石蕊试液中,Cl2与水反应产生的盐酸使石蕊由紫色变为红色,产生的HClO又可将红色漂白。
第二章第二节第3讲 氯气的实验室制法

第二章 第二节 氯及其化合物第3讲 氯气的实验室制法【讲】知识点1氯气的实验室制法 1.反应原理(1)化学方程式:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
(2)原理:利用强氧化剂氧化浓盐酸中的Cl -生成Cl 2,该反应中MnO 2为氧化剂,浓盐酸为还原剂并且该实验还体现了浓盐酸的酸性。
2.仪器装置(1)气体发生装置类型:固+液――→△气(2)发生装置所用仪器:分液漏斗、圆底烧瓶、酒精灯。
(3)除杂装置:装置C 的作用是除去Cl 2中少量的HCl 气体。
装置D 的作用是干燥氯气(或除去氯气中的水蒸气)。
3.收集方法(1)向上排空气法(氯气密度大于空气)。
(2)排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,用此法可除去实验中挥发产生的氯化氢气体)。
4.验满方法观察到E 中充满黄绿色气体,则证明已集满。
5.尾气处理烧杯F 中盛放的液体是NaOH 溶液。
该液体的作用是吸收过量的氯气,防止污染环境。
6、注意事项:(1)实验室制取氯气的反应原理是选用氧化剂(如MnO 2、KMnO 4等)将盐酸中的部分氯离子氧化而得到氯气。
(2)制取的氯气有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗。
(3)尾气处理时,不能用澄清石灰水吸收氯气,因为澄清石灰水中Ca(OH)2的含量少,吸收不完全。
(4)实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
【练】1.下列关于实验室制氯气的说法中错误的是( ) A .该反应是一个氧化还原反应,其中二氧化锰是氧化剂 B .HCl 表现还原性和酸性C .该反应的离子方程式为MnO 2+4H ++4Cl -=====△MnCl 2+2H 2O +Cl 2↑D .该方法是瑞典化学家舍勒最先发现的 答案 C解析 由MnO 2+4HCl(浓)=====△MnCl 2+2H 2O +Cl 2↑可知,二氧化锰是氧化剂,HCl 中氯元素部分化合价升高,HCl 既表现还原性,又表现酸性;氯化锰是可溶于水的强电解质,在离子方程式中应写成离子符号。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
思考
你知道发生了什么化学反应吗?是什么 物质使得这名主妇送了命吗?
结束
演示实验: 将84和洁厕净混合在套有 一透明气球的锥行瓶中。
注意观察现象:气球渐渐由小变大,颜色为黄绿
色。
思考
这是什么气体?
结束
氯气的发现
氯气的发现应归功于瑞典化学家舍勒。 舍勒是在1774年发现氯气的。当他将软 锰矿(主要成下述反应: MnO2 +HCl → MnCl2+H2O+ C12 ↑ 他发现,这种呛人的黄色气体(C12)能 使染料褪色,有许多奇特的性质。
思考
用石灰水代替可以吗?
结束
实验室制取氯气的演示
结束
板书设计
三、氯气的实验室制法 1、药品:二氧化锰、浓盐酸 2、反应原理:MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O 离子方程式: MnO2+4H++2Cl-=Mn2++2H2O+Cl2 ↑ 3、发生装置: 4、收集方法:向上排空气法 5、除杂与干燥:饱和食盐水;浓硫酸 6、尾气处理:玻璃导管通入氢氧化钠溶液中
2KMnO4==K2MnO4+MnO2+O2 ↑ Zn+H2SO4=ZnSO4+H2↑
A
B
C
结束
选择气体发生装置的原则是反 应物的状态和反应条件
项目 Cl2
发生装置 类型 装配发生装置 的主要仪器 收集气 体方法
向上排气法(或 排饱和食盐水法) 排水法(或向上 排空气法
排水法(或向 下排空气法
固液加热 固固加热 固液不加热
舍勒 【瑞典】 公元1742一1786
结束
二、氯气的实验室制法 1、药品: 二氧化锰(固体) 浓盐酸(液体) 2、反应原理:
MnO2+4HCl
离子方程式:
(浓)=
MnCl2+2H2O+Cl2↑
MnO2+4H++2Cl-=Mn2++2H2O+Cl2 ↑ 实质:( 2Cl- 2e- Cl2)
结束
补充:实验室还可用KMnO4或KClO3代替 MnO2与浓盐酸反应制氯气
思考
先通过饱和食盐水还是浓硫酸?
结束
设问三:根据氯气的性质,可用什么方法来收集?
5、收集方法
a.向上排空气法
b.排饱和食盐水法
思考
哪一种方法更好一些?
结束
设问四:多余的氯气能否直接排放?为什么?
那么应该如何处理?
6、尾气处理
用氢氧化钠溶液吸收: Cl2+2NaOH==NaCl+NaClO+H2O
结束
再见
结束
氯气的实验室制法
结束
专家向消费者敲响警钟 ---混用洗涤剂会致人死命
据报载,广州一家庭主妇在家中打扫卫生时突然晕倒,家 人发现后将她送到医院抢救,但半小时后这名主妇停止了呼吸。 事情是这样的:这名主妇为了获得更强的去污能力,把家 用洗涤剂、浴液和洁厕精等3类共5种洗涤用品混合使用,致使 发生化学反应,从而导致悲剧产生。
O2
H2
结束
3、气体发生装置与仪器
铁架台(带 铁圈铁夹) 分液漏斗 双孔 塞 圆底烧瓶 石棉网 酒精灯 导管
思考
与制取氢气的装置有何区别?是不 是用长颈漏斗代替分液漏斗?
结束
设问二:用此种方法制得的氯气可能含有哪些
杂质?怎样得到纯净干燥的氯气?
4、除杂与干燥
HCl气体: (饱和食盐溶液) 水蒸气: 浓硫酸
2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2 ↑
KClO3+6HCl=KCl+3H2O+3Cl2 ↑
思考
从反应条件可以看出MnO2 、KMnO4 的氧化性强弱吗? KMnO4 强于MnO2
结束
设问一:回忆实验室制备O2、H2的方法及实验装置
MnO2 2KClO3== 2KCl+3O2↑
结束
练习:1、下列实验装置图有那些错误?
①长颈漏斗应改成分液漏斗. ②烧瓶下应垫石棉网.
③应用酒精灯加热.
④稀盐酸应改为浓盐酸. ⑤多余Cl2应通入NaOH溶液中
结束
2、实验室制氯气时有如下操作,操作顺序正确 的是 ( C ) ①连接好装置,检查气密性②缓缓加热,加快反 应,使气体均匀逸出 ③在烧瓶中加入二氧化锰粉末 ④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中 ⑤用向上排空气法收集氯气,尾气导入吸收剂中 A ①②③④⑤ B ④③①②⑤ C ①③④②⑤ D ①④③②⑤
