执业药师《药物分析》辅导:常见氧化还原滴定方法
合集下载
第九章 常用的氧化还原滴定
KMnO4
PbO2 Na2C2O4( 过) Pb → 2+ +H2C2O4 ( 剩) MnO2 ∆、H2SO4 Mn
2+
5
碱性, 碱性 △
有机物+KMnO4(过) 有机物 过
H+,歧化 歧化
CO32- + MnO42-+MnO4KMnO4
Fe2+(过) 过
MnO4- +MnO2
Fe2+(剩) 剩
环境水(地表水、引用水、生活污水) 环境水 地表水、引用水、生活污水) 地表水 COD测定 高锰酸盐指数 测定(高锰酸盐指数 测定 高锰酸盐指数): 水样+ 水样 KMnO4(过) 过
Na2C2O4(过) 过 H2SO4, △
KMnO4(剩) 剩
KMnO4 H2C2O4(剩) 剩
6
KMnO4法测定 法测定Ca
15
应用3: 卡尔·费歇尔法测水 应用 卡尔 费歇尔法测水
原理: 氧化SO 需定量的水。 原理:I2氧化 2需定量的水。 I2 +SO2 +2H2O H2SO4 + 2HI
在吡啶存在下,加入甲醇反应才向右定量进行。 在吡啶存在下,加入甲醇反应才向右定量进行。 反应才向右定量进行
I2 + SO2 + CH3OH + Py + H2O 2PyH+I- + PyH+CH3OSO3-
I-
Pb2+、Ba2+与Na2S2O3的摩尔比为 1 :3
18
氧化还原滴定的计算
法测定HCOOH 例6 KMnO4法测定 HCOOH
OH-
KMnO4-(过) 过
分析化学常用氧化还原滴定法

b 间接碘量法(滴定碘法) • 用I- 的还原性测氧化性物质,滴定生成的I2
KIO3, MnO4-, Cr2O72-, Cu2+, H3AsO4, H2O2,PbO2
用Na2S2O3标液滴定反应生成的 I2 I2+2S2O32-=2I-+S4O62- E S4O62-/S2O32-=0.09V
弱酸性至中性!!!
' Fe3 / Fe2
除Fe3+黄色
利用Cr2O72- -Fe2+反应测定其他物质
(1) 测定氧化剂:NO3-、ClO3- 等 NO3- Fe2+(过)NO +Fe3+ +Fe2+(剩)
Cr2O72-
(2) 测定强还原剂:Ti3+、Sn2+等 Ti4+ 预还原器 Ti3+ Fe3+ Ti4+ + Fe2+
Na2S2O3溶液的配制与标定(1)
蒸馏水 煮沸
冷却后溶解 Na2S2O3·5H2O
加入少许 Na2CO3
贮于棕色 玻璃瓶
赶赶杀 菌
CO2 O2
→
→
→
酸氧分 性化解
S2O32- S2O32- S2O32-
不↓ ↓
稳 定
(SO42S↓)
, (SO32-, S↓)
→
HSO3-,S↓
酸 维抑
性 持制
S2O32不 稳 定
指示剂:二苯胺磺酸钠 重铬酸钾回收!!!
重铬酸钾法测定铁(有汞法)
Fe2O3FeO SHnCCl,l2Fe2 Sn2 剩 SP混酸Fe2
HgCl 2 过
Hg2Cl2 二苯胺磺酸钠(无色-紫色)
Cr2O72-
常用氧化还原滴定法及其应用实例

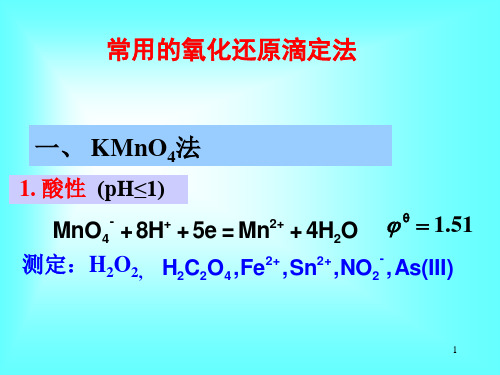
一、 KMnO4法
在沉淀Ca2+时,为了获得颗粒较大的晶形沉淀, 并保证Ca2+与C2O42-有1∶1的关系,必须选择适当的沉 淀条ቤተ መጻሕፍቲ ባይዱ。
通常 是在 Ca2+的试 液中 先加 盐酸 酸化 ,再 加入 (NH4)2C2O4。由于C2O42-在酸性溶液中大部分以HC2O4-存 在,C2O42-的浓度很小,此时即使Ca2+浓度大,也不会 生成CaC2O4沉淀。
一、 KMnO4法
这样不仅可避免Ca(OH)2或(CaOH)2C2O4沉淀的生 成,而且所得Ca2C2O4沉淀又便于过滤和洗涤。放置冷 却后,过滤,洗涤,将Ca2C2O4溶于稀硫酸中,即可用 KMnO4标准溶液滴定热溶液中与Ca2+定量结合的C2O42-。
一、 KMnO4法
有机物的测定
在强碱性溶液中,过量KMnO4能定量的氧化某些 有机物。例如KMnO4与甲酸的反应为:
使用经久放置的KMnO4溶液时应重新标定。
一、 KMnO4法
标定KMnO4溶液的基准物质很多,如H2C2O4·2H2O、 As2O3 、(NH4)2Fe(SO4)2·6H2O 、 Na2C2O4和纯铁丝等。
最常用的是Na2C2O4,它易于提纯、稳定、无结晶 水,在105~110℃烘两小时即可使用。
常用氧化还原滴定法
一、 KMnO4法
1.概述
KMnO4的氧化能力与溶液的酸度有关:
①强酸
θ(MnO4-/ Mn2+ )= 1.51 v
②中性、弱酸性或弱碱性
θ(MnO4-/ MnO2 ) = 0.58 v ③强碱性 θ(MnO4-/ MnO42- ) = 0.56 v
一、 KMnO4法
KMnO4法
第七章常用的氧化还原滴定法汇总

氧化还原滴定法
KMnO4标准溶液
剩余Na2C2O4溶液
过量Na2C2O4 剩余KMnO4溶液
过量KMnO4 酸化的水样
2020/6/26
氧化还原滴定法
2020/6/26
KMnO4标准溶液 KMnO4 c V1 V2
? 指示剂: 自身指示剂
Na2C2O4 c/ V/
COD
预处理的水样
氧化还原滴定法
4MnO4-+12H+→4MnO2 + O2↑+6H2O
氧化还原滴定法
指示剂: 自身指示剂 滴定终点: 微红色在0.5内不褪色 催化剂: Mn2+自动催化
2020/6/26
(1998年,同济大学)试述用Na2C2O4标定KMnO4 的标 定条件并写出求算KMnO4标准溶液浓度的数学表达式。
氧化还原滴定法
强酸性 (pH≤1)
MnO4- +5e Mn2+
Eθ=1.51V
弱酸性、中性、弱碱性
MnO4- + 3e MnO2
Eθ=0.59V
强碱性(pH>14)
MnO4- + e MnO42-
Eθ=0.56V
可见,不同条件下, 电子转移数不同,化学计量关系不同
适用条件:一般都在强酸性(1-2mol·L-1 H2SO4)条件下使用, 但测有机物时选碱性溶液中进行。
1.概述
高锰酸钾法:利用高锰酸钾的强氧化能力及氧化还原滴定 原理来测定其他物质的容量分析方法。
高锰酸钾:一种强氧化剂
氧化还原滴定法
2020/6/26
原理
➢ 强酸性 (pH≤1) MnO4- + 8H+ + 5e = Mn2+ + 4H2O
氧化还原滴定法

0.0592 γ Oxα Re d 0.0592 cOx lg + lg z γ Re d α Ox z cRe d
θ
特定条件下 E = E
′
0.0592 cOx + lg z cRe d
溶液中, 查条件电位表 1 mol/L HCl 溶液中, Eθ′′ =1.28 V
E = E
θ
′
+ 0 . 0592 lg
z 2Ox1 + z1 Red 2 = z 2 Red 1 + z1Ox 2
Ox1 + z1e = Red 1 Ox 2 + z 2 e = Red 2
0.0592 [Ox1 ] E1 = E1 + lg z1 [ Red 1 ]
θ'
0.0592 [Ox 2 ] E2 = E2 + lg z2 [ Red 2 ]
温度升高10℃ 速度增大 温度升高 ℃,速度增大2~3倍; 倍 碘量法,加热引起碘挥发; 碘量法,加热引起碘挥发; 某些还原性物质被氧氧化; 某些还原性物质被氧氧化;
催化剂; 催化剂;
14
三、氧化还原滴定原理
(一) 氧化还原指示剂 Redox indicator 一 分类
自身指示剂 电对自身颜色变化, 电对自身颜色变化, MnO4- / Mn2+ 吸附 淀粉吸附 I2
§17-4
一、概述
氧化还原滴定法
二、氧化还原平衡 三、氧化还原滴定原理 四、氧化还原预处理 五、氧化还原滴定法的分类及应用示例
1
一、概述
氧化还原滴定法: 氧化还原滴定法:
以氧化还原反应为基础的滴定分析方法。 以氧化还原反应为基础的滴定分析方法。
特点: 特点:
第六章氧化还原滴定法

其实际电位与按Nernst方程式计算所得电位相符,
或相差甚小。如:Fe3+/Fe2+、Ce4+/Ce3+、
Cu2+/Cu+、I2/I-等。
• 不可逆氧化还原电对在氧化还原反应的任一瞬间,
不能建立由电对半反应所示的氧化还原平衡,其
实际电位与按Nernst方程式计算所得电位相差颇
大(100~200mv以上)。如:
[I- ] K CuI
sp Cu2+
Cu2+ 1, 若 [I- ] 1mol/L,
O' Cu2+ /Cu+
O Cu2+ /Cu+
0.059 lg
[I- ]
K CuI sp Cu2+
0.16
0.059
lg
1.1
1 10-12
1
0.16 0.71
0.87(V)
1.110-12
• 解:在I-存在时,Cu+以CuI形式沉淀。
[Cu+ ]
Cu2+ /Cu+
K CuI sp
[I- ]
,
O Cu2+
[Cu2+ ] cCu2+
Cu2 +
[Cu
2+
]
/Cu+ 0.059 lg [Cu+ ]
O Cu2+ /Cu+
[Cu2+ ][I- ]
0.059 lg
AgCl e Ag Cl-
AgCl/ Ag
AgCl/ Ag
氧化还原滴定法(2)

2.标定: 以K2Cr2O7 为基准物,加入碘化钾置换出定量的 碘,再用硫代硫酸钠标准溶液滴定碘
• 标定方法为:精密称取在120℃干燥至恒重的基准物质重 铬酸钾0.15g,置碘量瓶中,加水50ml溶解,加碘化钾 2.0g,轻轻振摇,加稀硫酸40ml,摇匀,密塞,水封后 在暗处放置10分钟,取出加水50ml稀释,用待标定 Na2S2O3溶液滴定至近终点时,加淀粉指示剂3ml,继续 滴定至溶液由蓝色变亮绿色为终点。
• 标定反应为:
• 2MnO4- + 5C2O42- + 16H+ + 10CO2↑ + 8H2O
2Mn2+
标定时注意事项
• 1. 滴定速度:开始时因反应速度慢,滴定速 度要慢;开始后反应本身所产生的Mn2+起催化 作用,加快反应进行,滴定速度可加快。
• 2. 温度:近终点时加热至65℃,促使反应完 全
• (三)氧化还原指示剂
三、分类
• 氧化还原滴定法根据使用的标准溶液不同可分 为
• 高锰酸钾法、 • 重铬酸钾法、 • 碘量法、 • 溴酸钾法等。
• 主要介绍:高锰酸钾法以及碘量法
二、高锰酸钾法
• (一)基本原理和条件 • (二)测定方法 • (三)标准溶液的配置与标定
(一)基本原理和条件
• 高锰酸钾法是以具有强氧化能力的高锰酸钾做 标准溶液,利用其氧化还原滴定原理来测定其 他物质的滴定分析方法。
• 3. 酸度:保持一定的酸度(3mol/L H2SO4 )。 • 4. 滴定终点:滴入微过量高锰酸钾,利用自
身的粉红色指示终点(30秒不褪色)。
三、碘量法
• (一)基本原理 • (二)测定方法 • (三)标准溶液的配置与标定
第五章 氧化还原滴定法

在氧化还原滴定法中是以氧化剂或还原剂作为标准溶液, 习惯上分为高锰酸钾法、重铬酸钾法、碘法等滴定方法。
各种滴定方法都有其特 点和应用范围。本章主要 介绍几种氧化还原滴定法 的基本原理和应用。
上页 下页
第五章 氧化还原滴定法 氧化还原平衡 一、标准电极电位和条件电极电位 在氧化还原反应中,氧化剂和还原剂的强弱,可以用 有关电对的电极电位(简称电位)来衡量。电对的电位越高, 其氧化态的氧化能力越强;电位越低,其还原态的还原能 力越强。氧化剂可以氧化电位比它低的还原剂;还原剂可 以还原电位比它高的氧化剂。氧化还原电对的电极电位可 用能斯特公式求得。例如,下述Ox/Red电对(省略离子的 电荷)的半反应:
当滴定到达终点时,指示剂变色,从而可以测定和计算铁 的含量。对于某些没有变价的元素,也可以通过转化为具有 氧化还原性质的物质进行间接测定。例如钙的含量测定等。 所以在滴定分析中,氧化还原滴定法应用较为广泛。
上页 下页
第五章 氧化还原滴定法
但是,氧化还原反应是在溶液中氧化剂与还原剂之间的 电子转移,反应机理比较复杂,除主反应外,经常可能发生 各种副反应,使反应物之间不是定量进行,而且反应速率一 般较慢。因此对氧化还原反应必须选择适当的条件,使之符 合滴定分析的基本要求。
上页 下页
第五章 氧化还原滴定法 两电对的电极电位为:
当反应达到平衡时,E1=E2,则:
上页 下页
第五章 氧化还原滴定法 当反应式达到平衡时,则有:
将上式代入得:
由此可知氧化还原反应的平衡常数K值的大小是直接 由氧化剂和还原剂两电对的条件电极电位之差来决定的。 两者差值越大,K值也就越大,反应进行得越完全。根据 两个电对的电极电位值,就可以计算氧化还原反应的平衡 常数K值。
各种滴定方法都有其特 点和应用范围。本章主要 介绍几种氧化还原滴定法 的基本原理和应用。
上页 下页
第五章 氧化还原滴定法 氧化还原平衡 一、标准电极电位和条件电极电位 在氧化还原反应中,氧化剂和还原剂的强弱,可以用 有关电对的电极电位(简称电位)来衡量。电对的电位越高, 其氧化态的氧化能力越强;电位越低,其还原态的还原能 力越强。氧化剂可以氧化电位比它低的还原剂;还原剂可 以还原电位比它高的氧化剂。氧化还原电对的电极电位可 用能斯特公式求得。例如,下述Ox/Red电对(省略离子的 电荷)的半反应:
当滴定到达终点时,指示剂变色,从而可以测定和计算铁 的含量。对于某些没有变价的元素,也可以通过转化为具有 氧化还原性质的物质进行间接测定。例如钙的含量测定等。 所以在滴定分析中,氧化还原滴定法应用较为广泛。
上页 下页
第五章 氧化还原滴定法
但是,氧化还原反应是在溶液中氧化剂与还原剂之间的 电子转移,反应机理比较复杂,除主反应外,经常可能发生 各种副反应,使反应物之间不是定量进行,而且反应速率一 般较慢。因此对氧化还原反应必须选择适当的条件,使之符 合滴定分析的基本要求。
上页 下页
第五章 氧化还原滴定法 两电对的电极电位为:
当反应达到平衡时,E1=E2,则:
上页 下页
第五章 氧化还原滴定法 当反应式达到平衡时,则有:
将上式代入得:
由此可知氧化还原反应的平衡常数K值的大小是直接 由氧化剂和还原剂两电对的条件电极电位之差来决定的。 两者差值越大,K值也就越大,反应进行得越完全。根据 两个电对的电极电位值,就可以计算氧化还原反应的平衡 常数K值。
氧化还原滴定法 第四节 常用氧化还原滴定法

+
2、碘量法的条件
2) I 2的挥发和I -的氧化 I 2的挥发和空气中O 2 对I −的氧化是碘量法中 最为主要的两个误差来源。 在碘量法滴定中应设法予以避免。
3、标准溶液的配制与标定
1) Na2 S 2O3标准溶液的配制与标定 配制过程见书上412页 Na2 S 2O3标准溶液采用间接滴定法标定 Cr2 O + 6I + 14H = 2Cr + 3I 2 + 7 H 2 O
27 − + 3+
I 2 + 2 S 2O32− = 2I − + S 4O62−
2) I 2标准溶液的配制与标定 I 2具有挥发性,准确称量较为困难,其标准溶液采用 间接法配制。 将I 2溶于过量的KI,生成KI 3,这样既增大了I 2的溶解度, 又大大降低了I 2的挥发性。 I 2标准溶液的标定常采用As 2 O 3作为基准物质,也可以 采用标定好的Na2 S 2O3标准溶液标定。
4、碘量法的应用
1)胆矾中铜的测定 CuSO4 ⋅ 5 H 2O中铜的测定。 2Cu
2+
+ 4 I = 2CuIห้องสมุดไป่ตู้↓ + I 2
2− 3
−
I 2 + 2 S 2O
= 2 I + S 4O
−
2− 6
c( Na2 S 2O3 )V ( Na2 S 2O3 ) ⋅ M (Cu ) w(Cu ) = ms
MnO2的含量可以通过公式计 算 [c( NaC2O4 )V ( NaC2O4 ) − 5 / 2c( KMnO4 )V ( KMnO4 )]⋅ M (MnO2 ) w(MnO2 ) = ms
二、重铬酸钾法
2、碘量法的条件
2) I 2的挥发和I -的氧化 I 2的挥发和空气中O 2 对I −的氧化是碘量法中 最为主要的两个误差来源。 在碘量法滴定中应设法予以避免。
3、标准溶液的配制与标定
1) Na2 S 2O3标准溶液的配制与标定 配制过程见书上412页 Na2 S 2O3标准溶液采用间接滴定法标定 Cr2 O + 6I + 14H = 2Cr + 3I 2 + 7 H 2 O
27 − + 3+
I 2 + 2 S 2O32− = 2I − + S 4O62−
2) I 2标准溶液的配制与标定 I 2具有挥发性,准确称量较为困难,其标准溶液采用 间接法配制。 将I 2溶于过量的KI,生成KI 3,这样既增大了I 2的溶解度, 又大大降低了I 2的挥发性。 I 2标准溶液的标定常采用As 2 O 3作为基准物质,也可以 采用标定好的Na2 S 2O3标准溶液标定。
4、碘量法的应用
1)胆矾中铜的测定 CuSO4 ⋅ 5 H 2O中铜的测定。 2Cu
2+
+ 4 I = 2CuIห้องสมุดไป่ตู้↓ + I 2
2− 3
−
I 2 + 2 S 2O
= 2 I + S 4O
−
2− 6
c( Na2 S 2O3 )V ( Na2 S 2O3 ) ⋅ M (Cu ) w(Cu ) = ms
MnO2的含量可以通过公式计 算 [c( NaC2O4 )V ( NaC2O4 ) − 5 / 2c( KMnO4 )V ( KMnO4 )]⋅ M (MnO2 ) w(MnO2 ) = ms
二、重铬酸钾法
氧化还原滴定法

பைடு நூலகம்
氧化还原滴定法
三、滴定方法
(一)氧化还原指示剂 1、自身指示剂:有些标准溶液本身有颜色, 、自身指示剂:有些标准溶液本身有颜色, 可利用自身颜色的变化指示终点, 可利用自身颜色的变化指示终点,而不必另外加 指示剂,例如KMnO4自身可作指示剂。 自身可作指示剂。 指示剂,例如 2、专属指示剂:碘与淀粉反应生成蓝色化合 、专属指示剂: 因此,碘量法中就用淀粉作指示剂, 物,因此,碘量法中就用淀粉作指示剂,淀粉被 称为碘量法的专属指示剂。 称为碘量法的专属指示剂。 3、氧化还原指示剂:氧化还原指示剂是本身 、氧化还原指示剂:
氧化还原滴定法
氧化还原滴定法
一、方法简介 二、氧化还原平衡 三、滴定方法
氧化还原滴定法
一、方法简介
氧化还原滴定法是以氧化还原反应为基础 的滴定分析方法, 的滴定分析方法,它是以氧化剂或还原剂为标准 溶液来测定还原性或氧化性物质含量的方法。 溶液来测定还原性或氧化性物质含量的方法。 氧化还原法的分类: 氧化还原法的分类: 高锰酸钾法—以 为标准溶液; 高锰酸钾法 以KMnO4为标准溶液; 重铬酸钾法—以 为标准溶液; 重铬酸钾法 以K2Cr2O7为标准溶液; 碘量法—以 为标准溶液; 碘量法 以I2和Na2S203为标准溶液;
蓝
紫 紫红 紫红 浅蓝 浅蓝
邻苯氨基苯甲酸 0.89 邻二氮菲—亚铁 邻二氮菲 亚铁 1.06 硝基邻二氮菲— 1.25 硝基邻二氮菲 亚铁
氧化还原滴定法
(二)高锰酸钾法
1.方法简介 方法简介 高锰酸钾是一种较强的氧化剂, 高锰酸钾是一种较强的氧化剂,在强酸性溶 液中与还原剂作用, 被还原为Mn 在弱酸 液中与还原剂作用,Mn04-被还原为 2+.在弱酸 或碱性溶液中与还原剂作用, 或碱性溶液中与还原剂作用, Mn04-被还原为 Mn4+,生成褐色的 生成褐色的MnO2沉淀。所以高锰酸钾是一 沉淀。 生成褐色的 种应用广泛的氧化剂。 种应用广泛的氧化剂。 从强酸反应式中得知KMn04获得5e,所以 从强酸反应式中得知 获得 所以 KMn04的基本单元为(1/5 KMn04),在弱酸或碱 的基本单元为( ),在弱酸或碱 获得3e,所以 所以KMn04的基本 性溶液中得知KMn04获得 所以 性溶液中得知
氧化还原滴定法
三、滴定方法
(一)氧化还原指示剂 1、自身指示剂:有些标准溶液本身有颜色, 、自身指示剂:有些标准溶液本身有颜色, 可利用自身颜色的变化指示终点, 可利用自身颜色的变化指示终点,而不必另外加 指示剂,例如KMnO4自身可作指示剂。 自身可作指示剂。 指示剂,例如 2、专属指示剂:碘与淀粉反应生成蓝色化合 、专属指示剂: 因此,碘量法中就用淀粉作指示剂, 物,因此,碘量法中就用淀粉作指示剂,淀粉被 称为碘量法的专属指示剂。 称为碘量法的专属指示剂。 3、氧化还原指示剂:氧化还原指示剂是本身 、氧化还原指示剂:
氧化还原滴定法
氧化还原滴定法
一、方法简介 二、氧化还原平衡 三、滴定方法
氧化还原滴定法
一、方法简介
氧化还原滴定法是以氧化还原反应为基础 的滴定分析方法, 的滴定分析方法,它是以氧化剂或还原剂为标准 溶液来测定还原性或氧化性物质含量的方法。 溶液来测定还原性或氧化性物质含量的方法。 氧化还原法的分类: 氧化还原法的分类: 高锰酸钾法—以 为标准溶液; 高锰酸钾法 以KMnO4为标准溶液; 重铬酸钾法—以 为标准溶液; 重铬酸钾法 以K2Cr2O7为标准溶液; 碘量法—以 为标准溶液; 碘量法 以I2和Na2S203为标准溶液;
蓝
紫 紫红 紫红 浅蓝 浅蓝
邻苯氨基苯甲酸 0.89 邻二氮菲—亚铁 邻二氮菲 亚铁 1.06 硝基邻二氮菲— 1.25 硝基邻二氮菲 亚铁
氧化还原滴定法
(二)高锰酸钾法
1.方法简介 方法简介 高锰酸钾是一种较强的氧化剂, 高锰酸钾是一种较强的氧化剂,在强酸性溶 液中与还原剂作用, 被还原为Mn 在弱酸 液中与还原剂作用,Mn04-被还原为 2+.在弱酸 或碱性溶液中与还原剂作用, 或碱性溶液中与还原剂作用, Mn04-被还原为 Mn4+,生成褐色的 生成褐色的MnO2沉淀。所以高锰酸钾是一 沉淀。 生成褐色的 种应用广泛的氧化剂。 种应用广泛的氧化剂。 从强酸反应式中得知KMn04获得5e,所以 从强酸反应式中得知 获得 所以 KMn04的基本单元为(1/5 KMn04),在弱酸或碱 的基本单元为( ),在弱酸或碱 获得3e,所以 所以KMn04的基本 性溶液中得知KMn04获得 所以 性溶液中得知
氧化还原滴定法

第二十二章 氧化还原滴定法
学习要求
★ 掌握氧化还原滴定法的分类及应用 。 ★ 了解氧化还原滴定法的基本原理 。 了解氧化还原预处理方法。 ★ * 了解氧化还原预处理方法。
1、氧化还原滴定法概述
氧化还原滴定法( 氧化还原滴定法(Redox Titration)是滴定分析中 Titration) 应用最广泛的方法之一。 应用最广泛的方法之一。它是以溶液中氧化剂与还原剂 之间的电子转移为基础的一种滴定分析方法。 之间的电子转移为基础的一种滴定分析方法。 可以用来进行氧化还原滴定的反应很多。 可以用来进行氧化还原滴定的反应很多。根据所应 用的氧化剂和还原剂,可将氧化还原滴定法分为: 用的氧化剂和还原剂,可将氧化还原滴定法分为:高锰 酸钾法、重铬酸钾法、碘量法、铈量法、溴酸盐法、 酸钾法、重铬酸钾法、碘量法、铈量法、溴酸盐法、钒 酸盐法等。 酸盐法等。 利用氧化还原法, 利用氧化还原法 , 不仅可以测定具有氧化性或还 原性的物质, 原性的物质,而且还可以测定能与氧化剂或还原剂定量 反应形成沉淀的物质。因此, 反应形成沉淀的物质。因此,氧化还原法的应用范围很 广泛。 广泛。
当加入20.02ml Ce4+时,即过量 %: 即过量0.1%: 当加入 即过量
ϕ = ϕ′
Ce 4+ / Ce 3+
0.0592 lg + 1 ′( Ce3+ ) c
′( Ce4+ ) c
0.1 = 1.44 + 0.0592lg 100 ( = 1.26 V )
当加入20.20ml Ce4+时,即过量 %: 即过量1%: 当加入 0.0592 c′( Ce4+ ) ϕ = ϕ′ 4+ lg 3+ + Ce / Ce 1 ′( Ce3+ ) c
学习要求
★ 掌握氧化还原滴定法的分类及应用 。 ★ 了解氧化还原滴定法的基本原理 。 了解氧化还原预处理方法。 ★ * 了解氧化还原预处理方法。
1、氧化还原滴定法概述
氧化还原滴定法( 氧化还原滴定法(Redox Titration)是滴定分析中 Titration) 应用最广泛的方法之一。 应用最广泛的方法之一。它是以溶液中氧化剂与还原剂 之间的电子转移为基础的一种滴定分析方法。 之间的电子转移为基础的一种滴定分析方法。 可以用来进行氧化还原滴定的反应很多。 可以用来进行氧化还原滴定的反应很多。根据所应 用的氧化剂和还原剂,可将氧化还原滴定法分为: 用的氧化剂和还原剂,可将氧化还原滴定法分为:高锰 酸钾法、重铬酸钾法、碘量法、铈量法、溴酸盐法、 酸钾法、重铬酸钾法、碘量法、铈量法、溴酸盐法、钒 酸盐法等。 酸盐法等。 利用氧化还原法, 利用氧化还原法 , 不仅可以测定具有氧化性或还 原性的物质, 原性的物质,而且还可以测定能与氧化剂或还原剂定量 反应形成沉淀的物质。因此, 反应形成沉淀的物质。因此,氧化还原法的应用范围很 广泛。 广泛。
当加入20.02ml Ce4+时,即过量 %: 即过量0.1%: 当加入 即过量
ϕ = ϕ′
Ce 4+ / Ce 3+
0.0592 lg + 1 ′( Ce3+ ) c
′( Ce4+ ) c
0.1 = 1.44 + 0.0592lg 100 ( = 1.26 V )
当加入20.20ml Ce4+时,即过量 %: 即过量1%: 当加入 0.0592 c′( Ce4+ ) ϕ = ϕ′ 4+ lg 3+ + Ce / Ce 1 ′( Ce3+ ) c
2-知识点4:氧化还原滴定法基本原理及常用方法.

早,则大量的I2与淀粉结合成蓝色物质,这一部分碘就不容 易与Na2S2O3反应,因而使滴定发生误差。
6Fe3+ + 2Cr3+ + 7H2O
试样(铁矿石等)一般用HCl溶液加热分解后,将铁
还原为亚铁,常用的还原剂为SnCl2,其反应方程为
2Fe3+ + Sn2+
2Fe2+ + Sn4+
过量SnCl2用HgCl2氧化:
SnCl2 + 2HgCl2
SnCl4 + Hg2Cl2
适当稀释后用K2Cr2O7标准溶液滴定。
氧化还原指示剂的半反应可用下式表示
InOx(氧化态) 十 ne
InRed(还原态)
例:二苯胺磺酸钠指示剂
一些氧化还原指示剂的条件电极电势及颜色变化
指示剂
In /V c(H+)=1 mol·L-1
颜色变化 氧化态 还原态
次甲基蓝
0.36
二苯胺
0.76
二苯胺磺酸钠
0.84
邻苯氨基苯甲酸
0.89
邻二氮杂菲-亚铁
应用NaAsO2代替Na2S2O3。
标定Na2S2O3溶液的基准物质有:纯碘、KIO3、KBr03、
K2Cr2O7、K3[Fe(CN)6]、纯铜等。这些物质除纯碘外,
都能与KI反应析出I2,析出的I2用Na2S2O3标准溶液滴定。
IO3- + 5I- 十 6H+ BrO3-+ 6I- 十 6H+ Cr2O72-+ 6I- 十 14H+ 2[Fe(CN)6]3-+2I- 2Cu2+ + 4I-
2. I2与硫代硫酸钠的反应
I2和Na2S2O3的反应是碘量法中最重要的反应,I2和 Na2S2O3的反应须在中性或弱酸性溶液中进行。因为在碱性 溶液中,会同时发生如下反应:
6Fe3+ + 2Cr3+ + 7H2O
试样(铁矿石等)一般用HCl溶液加热分解后,将铁
还原为亚铁,常用的还原剂为SnCl2,其反应方程为
2Fe3+ + Sn2+
2Fe2+ + Sn4+
过量SnCl2用HgCl2氧化:
SnCl2 + 2HgCl2
SnCl4 + Hg2Cl2
适当稀释后用K2Cr2O7标准溶液滴定。
氧化还原指示剂的半反应可用下式表示
InOx(氧化态) 十 ne
InRed(还原态)
例:二苯胺磺酸钠指示剂
一些氧化还原指示剂的条件电极电势及颜色变化
指示剂
In /V c(H+)=1 mol·L-1
颜色变化 氧化态 还原态
次甲基蓝
0.36
二苯胺
0.76
二苯胺磺酸钠
0.84
邻苯氨基苯甲酸
0.89
邻二氮杂菲-亚铁
应用NaAsO2代替Na2S2O3。
标定Na2S2O3溶液的基准物质有:纯碘、KIO3、KBr03、
K2Cr2O7、K3[Fe(CN)6]、纯铜等。这些物质除纯碘外,
都能与KI反应析出I2,析出的I2用Na2S2O3标准溶液滴定。
IO3- + 5I- 十 6H+ BrO3-+ 6I- 十 6H+ Cr2O72-+ 6I- 十 14H+ 2[Fe(CN)6]3-+2I- 2Cu2+ + 4I-
2. I2与硫代硫酸钠的反应
I2和Na2S2O3的反应是碘量法中最重要的反应,I2和 Na2S2O3的反应须在中性或弱酸性溶液中进行。因为在碱性 溶液中,会同时发生如下反应:
常用的氧化还原滴定法

二、KMnO4标准溶液的配制与标定
粗称KMnO4溶于水
微沸约1h 充分氧化还原物质
滤去MnO2 (玻璃砂漏斗)
棕色瓶暗处保存
用前标定
基准物: Na2C2O4, H2C2O4·2H2O, (NH4)2FeSO4·6H2O, 纯Fe丝等
KMnO4的标定— 典型反应
2MnO-4 + 5C2O24- +16H+ = 2Mn2+ +10CO2 + 8H2O
SO32-,S2-, Vc等.
注意:
应在酸性,中性或弱碱性溶液中进行。如果 pH>9,则
3I 2
6OH
IO
3
5I
3H 2O
三. 间接碘量法(滴定碘法):
置换碘量法 - 比 Θ (I2 I ) 电位高的氧化性物质可 用此法测定。
a.某氧化剂与I-作用,使I-氧化而析出I2; b. 用Na2S2O3标准溶液滴定析出的I2。
3. 应维持溶液为弱酸性,在弱酸性溶液中,碘与淀粉的反 应最灵敏,若PH<2 ,淀粉易水解成糊精,遇I2显红色;若 PH>9,则因I2生成了IO- ,遇淀粉不显色。
4. 临用前配置。
5. 直接碘量法,可滴定前加入,间接碘量法则在临近终点 加入,因为大量碘存在时,I2被淀粉表面牢固地吸附而 不易与Na2S2O3立即作用,致使终点变色迟缓,给滴定带来 误差.
1. 直接滴定法:可测Fe2+、As(III)、Sb(III)、
C2O42-、NO2-、H2O2等。 2. 间接滴定法:凡能与C2O42-定量生成 的M
(Ca2+、Pb2+……)。
第六章氧化还原滴定法(制药专业)汇总

上式只适用于对称电对,不适用于不对称电对。
第三节 氧化还原反应的速率与影响因素
1、反应物的浓度 一般:[反应物] v
15
2、温度 T v v 增加2~3倍/10℃
3、催化剂 正催化剂, v 负催化剂(阻化剂), v
4、诱导作用
在氧化还原反应中,一种反应的进行,能够诱发和促进 另一种反应的现象,叫诱导作用 。
13
例如,在1mol/LHCl溶液中Ce4+与As(Ⅲ)的反应:
H 3A3 s O 2C4e H 2O H 3A4 s O 2C3e 2H
C4e e C3e 1.2V 8
H 3A4 s O 2H 2e H 3A3 s O H 2O 0.57 V7
该反应的lgK´=24>9, = 0.7>0.4V,从化学平衡看,此反应
定20.00mL0.1000mol/LFe2+溶液,滴定反应为: M4 n 5 F O 2 e8 H M 2 n 5 F3 e4 H 2 O M 4 /n M O 2 n 1 .4V 5 , F 3 e /F2 e 0 .7V 3
1、滴定前 无法准确计算。 2、滴定开始至计量点前
C 2 u/CuC 2 u/Cu0.0
5lg9 1 Ks(p Cu ) I
0.1 60.05lg9 1.110 120.8V 7
I2/2I
0.54V
C2 u/Cu
I2/I
∴Cu2+能够氧化I−。
3、酸度的影响 主要考虑有H+或OH−参加电极反应。
6
例:碘法中一个重要的反应是
H3AsO4 + 2I− + 2H+
F3 e/F2 e
c(F3 e ) 5 lg c(9 F2 e )
常用氧化还原滴定方法

3. 土壤中有机质的测定
土壤中有机质含量的高低,是判断土壤肥力的重 要指标。
土壤中的有机质的含量,是通过测定土壤中碳的 含量而换算的。即在浓H2SO4的存在下,加K2Cr2O7 溶液,并在一定温度下(170—180℃)使土壤里的碳 被 K2Cr2O7 氧 化 成 CO2 , 剩 余 的 K2Cr2O7 , 以 邻 苯 氨 基 苯 甲 酸 作 指 示 剂 , 再 用 还 原 剂 (NH4)2Fe(SO4)2 滴 定。其反应如下:
最后,再用Na2S2O3标准溶液滴定:
2S2O3+I2=2S4O62-+2I-
4.直接碘量法测硫
弱定H酸2性S测。,定以溶淀液粉中为的指S示2-或剂H,2S用时I2,标先准将溶溶液液直调接至滴
H2S+I2 = S+2I-+2H+
测定钢铁中的S含量时,先将样品高温熔融,
通溶H2空液SO气,3。氧再化以,淀形粉成为S指O2示,剂以,水用吸I收2标,准得溶到液H2滴SO定3
E0I2/I—=0.535V
还
原剂由作E0用可;知而I2是I-是一一种种较中弱等的强氧度化的剂还,原能剂与,较能强与的
许多氧化剂作用,因此碘量法又可以用直接的和间
接的两种方式进行滴定。
1、碘滴定法(也称直接碘量法)
电位比E0I2/I—低的还原性物质,可以直接用I2 的标准溶液滴定的并不多,只限于较强的还原剂, 如:S2-、SO32-、Sn2+、S2O32-、AsO32-、SbO33-
I2,析出的I2,以淀粉为指示剂用Na2S2O3标准
溶液滴定。反应式如下:
Ba2++ CrO42—=BaCrO4 ↓(黄) 2BaCrO4+4H+=2 Ba2++H2Cr2O7+H2O Cr2O72—+6I—+14H+=3I2+Cr3++7H2O I2+2S2O32—=2I—+S4O62—
