第2节 探索酸的性质(第2、3课时)(zhang)
《第2节探索酸的性质》课件PPT课件

教学目标
理解酸的概念和性质
培养实验探究能力
通过本节的学习,学生应能理解酸的 概念,掌握酸的通性,了解酸的不同 种类和特性。
通过实验探究酸的性质,培养学生的 实验操作技能和观察、分析、解决问 题的能力。
掌握酸的性质和反应原理
学生应能掌握酸的电离反应原理,理 解酸与金属、碱、盐等物质之间的反 应规律和原理。
02
酸的性质概述
酸的定义
总结词
酸是一种具有特定性质的化合物,通 常在化学反应中表现出强烈的氧化能 力。
详细描述
酸是一种化合物,通常由氢和酸根组 成,具有强烈的氧化能力。在化学反 应中,酸可以提供氢离子,与其他物 质发生反应,生成相应的盐和水。
酸的性质特点
总结词
酸的性质特点包括酸性、氧化性和还原性等。
详细描述
酸具有强烈的酸性,可以提供氢离子,与其他物质发生反应。此外,酸还具有 氧化性和还原性,可以参与氧化还原反应,与其他物质发生电子交换。
酸的重要性和应用
总结词
酸在化学反应中具有重要的作用,广泛应用于工业、农业和日常生活中。
详细描述
酸在化学反应中具有重要的地位,是许多化学反应的催化剂和反应物。在工业生 产中,酸被广泛应用于金属加工、石油化工、制药等领域。此外,酸还在农业和 日常生活中有广泛的应用,如肥料、食品添加剂和清洁剂等。
《第2节探索酸的性 质》课件ppt大纲
• 引言 • 酸的性质概述 • 酸的化学反应 • 酸的性质实验 • 酸的性质总结 • 习题与思考
目录
01
引言
主题简介
酸的性质在化学中的重要地位
酸是化学中的基本概念之一,对酸性质的理解是深入学习化 学的基础。
酸的性质在实际生活中的应用
第2节 探索酸的性质(第3课时)
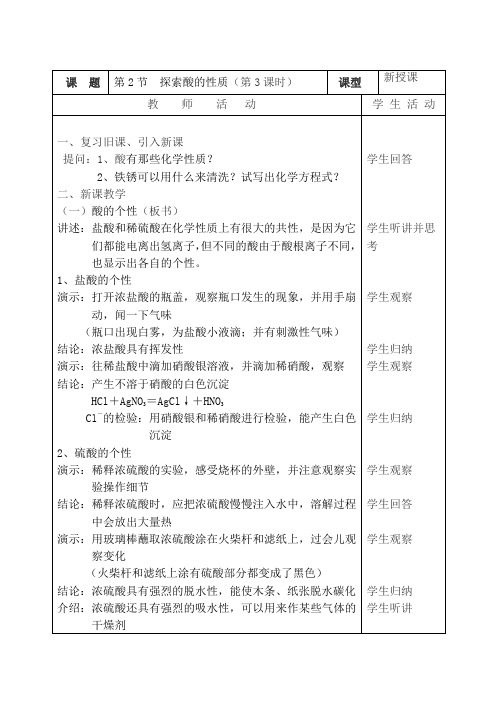
演示:打开浓盐酸的瓶盖,观察瓶口发生的现象,并用手扇动,闻一下气味
(瓶口出现白雾,为盐酸小液滴;并有刺激性气味)
结论:浓盐酸具有挥发性
演示:往稀盐酸中滴加硝酸银溶液,并滴加稀硝酸,观察
结论:产生不溶于硝酸的白色沉淀
HCl+AgNO3=AgCl↓+HNO3
Cl-的检验:用硝酸银和稀硝酸进行检验,能产生白色沉淀
2、硫酸的个性
演示:稀释浓硫酸的实验,感受烧杯的外壁,并注意观察实验操作细节
结论:稀释浓硫酸时,应把浓硫酸慢慢注入水中,溶解过程中会放出大量热
演示:用玻璃棒蘸取浓硫酸涂在火柴杆和滤纸上,过会儿观察变化
(火柴杆和滤纸上涂有硫酸部分都变成了黑色)
结论:浓硫酸具有强烈的脱水性,能使木条、纸张脱水碳化
介绍:浓硫酸还具有强烈的吸水性,可以用来作某些气体的干燥剂
三、课堂练习:
1、课本:P12第3题
2、作业本(B):2、3、5、9、12
四、课堂小结::酸的个性
五、布置作业:
作业本(B)P3第1、、4、6、7、8、10、11、13、14题
学生回答
学生听讲并思考
学生观察
学生归纳
学生观察
学生归纳
学生观察
学生回答
学生观察
学生归纳
学生听讲
学生练习
教
后
感
课题教师活动
学生活动
一、复习旧课、引入新课
提问:1、酸有那些化学性质?
2、铁锈可以用什么来清洗?试写出化学方程式?
二、新课教学
(一)酸的个性(板书)
讲述:盐酸和稀硫酸在化学性质上有很大的共性,是因为它们都能电离出氢离子,但不同的酸由于酸根离子不同,也显示出各自的个性。
第二节 探索酸的性质 说课稿

《探索酸的性质》说课稿尊敬的各位评委,你们好,我是***,今天我说课的内容是浙教版初中《科学》第五册第一章第二节<<探索酸的性质>>第二课时的内容。
下面,我将从教材、学情、教学目标、教学重难点,教学法和教学程序等方面对本课的设计进行说明。
一、教材分析:1、教材的地位和作用<<探索酸的性质(第二课时)>>是浙教版初中《科学》第五册第一章第二节的内容。
本课程从第一课时酸性物质的介绍,在酸的定义基础上更深层次地探究酸的性质,在整个科学课程中起着承前启后的作用,一方面:可以加深巩固学生对酸的概念的认识,使他们深入了解酸的理化性质,另一方面:学生通过对酸的共性的学习可以为学好碱的共性、盐的性质以及无机物之间相互关系打下基础,再者探索酸的性质可以培养学生勇于创新和敢于质疑的科学态度、情感与价值观。
二、学情分析学生对酸的有关化学性质可能不了解,在此内容之前学生已学习了酸的概念,物理性质以及酸与酸碱指示剂反应后所产生的现象等知识,这些内容对酸的化学性质知识的学习起到了铺垫和支持的作用。
而且16岁左右的初中生的思维方式要求逐步由形象思维向象思维过渡,因此在教学中应注意积极引导学生应用已掌握的基础知识,通过理论分析和推理判断来获得新知识,发展抽象思维能力。
当然在此过程仍需以一些感性认识作为依托,可以借助实验加强直观性和形象性,以便学生理解和掌握。
三、教学目标:(1)过程与方法目标:能通过实验,进行观察、思考,初步探究出酸的共性。
(2)知识与技能目标:使学生了解酸的共性,培养学生动手、观察、思考、归纳等能力;并能运用所学知识解释生活和生产中的有关知识,解决有关问题。
(3)情感态度与价值观目标:通过对酸的性质探究,培养学生学习兴趣和探究精神,同时培养学生尊重科学原理的学习态度。
通过学习酸的性质,使学生了解酸的用途,让学生认识到科学对人类生活和社会发展所产生的影响。
四、教学重点、难点:教学重点:了解酸的共性因为酸的共性是科学课程中的一个重要知识点,并且可以为学习碱的共性及无机物关系,打下知识基础和学法帮助。
2.探索酸的性质

照组吗?
需要对照组
4.想一想,怎样的实验现象才支持你的假设?
在稀盐酸中 分别加入锌、镁、 铜分别可看到什 么现象?
Zn + 2HCl = ZnCl2 + H2↑
注M意g:+稀2盐H酸C与l =金属M铜g不Cl能2 发+生H反2↑应!
盐酸的化学性质
1、与碱反应
NaOH + HCl = NaCl + H2O
5、酸 +金属 = 盐 + 氢气
证据
利 用 酸 的 性 质 做 些 什 么
性质
用途
1、检验某溶液是否显酸性,取少量该溶液进行 实验,其中错误的做法是 ( A )
A 滴加酚酞试液 B 滴加石蕊试液
C 滴加碳酸钠溶液 D加入石灰石
2、将生锈铁钉投入稀盐酸中,可以观察到 ( 铁锈消失,溶液变黄色),化学方程式是 (6HCI + Fe2O3 = 2FeCI3+3H2O )。
CuO + H2SO4 =CuSO4+ H2 O
4.在盛氢氧化铜的试管中滴入稀硫酸,观察到蓝 色氢氧化铜溶解,溶液变成蓝色。
Cu(OH)2 + H2SO4 = CuSO4 + H2 O
5.在盛有无色BaCl2的试管中滴入稀硫酸,观察到 产生白色沉淀。
BaCl2 + H2SO4 = BaSO4 ↓+ 2HCl
第二节 探索酸的性质 (第 二课时)
1、酸、碱盐的含义
碱:电离时产生的阴离子全部是氢氧根离子 的化合物
盐:由金属阳离子(或铵根离子)和酸根阴 离子组成的化合物
酸:电离时产生的阳离子全部是氢离子的 化合物
2、将下列物质按其类别填入下表
Mg Fe O2 MgO SO2 CuO HCl Ca(OH)2 NaCl KMnO4 NH4NO3
探索酸的性质酸的个性PPT教学课件

盐 【结论】
酸 生成了不溶于水和酸的AgCl白色沉淀。
的 个 性Leabharlann 【应用】用于检验盐酸或其他电离时能产生
Cl- 的化合物
联想:你还记得硫
4、浓盐酸有腐蚀性 酸的检验方法吗?
二、硝酸(HNO3)
二、
1、物性:纯净的HNO3是一种无色的 液体,具有刺激性气味。
硝 2、硝酸具有挥发性。在空气里也能挥 酸 发出HNO3气体, HNO3气体与空气 的 里的水蒸气结合形成硝酸小液滴,形 个 成白雾。 性
❖ 父:聪明吾儿,那你再看这平坦的大地又像什么? ❖ 女:(略思索)像方正的木板. ❖ 父:对,正如书中所云:“天圆如张盖,地方如
棋局”。
背景:两千多年前的我国周代
天圆地方---盖天说
古希腊数学家毕达哥拉斯
古希腊著名科学家 亚里士多德
太阳光
B 亚历山大 A 阿斯旺
古希腊地理学家埃拉托色尼
“天如鸡子,地如鸡中黄” -----浑天说
3、硝酸具有很强的腐蚀性。
三、浓硫酸( H2SO4)
1、物性:纯净的浓硫酸是无色、粘稠、 油状的液体,不容易挥发。常用的浓硫
三、 酸中H2SO4的质量分数是98%,密度为 浓 1.84g/㎝3 硫 2、浓硫酸具有强腐蚀性。
酸 【思考】如果浓硫酸不慎溅到皮肤上,应 的 怎样处理?
个 【拓展与迁移】如果稀硫酸沾到皮肤或 性 衣服上,是否也要进行这样的处理?为
东汉 张衡
麦哲伦
人类历史上第一次环球航行
太阳光
B 亚历山大 A 阿斯旺
古希腊地理学家埃拉托色尼
地球缘何变形?
地球快速旋转:“坐地日行八万里”
眼睛
酸
①能使紫色石蕊试液变___红____
第1章第二节探索酸的性质(第2课时)

课题探索酸的性质(2)课型:新授课主备人审核人(教研组)班级姓名学习组长学习目标:1、知识点掌握:1)了解酸的主要性质,举例说明酸在日常生活中的用途和对人类的影响;2)会测定溶液的酸碱性,会使用试管和滴管进行物质(溶液)性质试验;3)了解强酸的使用注意事项,了解盐酸硫酸和硝酸的个性2、能力培养:通过实验操作,提高学生动手的能力。
学习重点:酸的主要性质和强酸的使用学习难点:酸的典型反应及其方程式学习过程一、预习·导学1、写出下列化学反应方程式:铁与盐酸反应:;铁与硫酸反应:;氧化铁与盐酸反应:;氧化铁与硫酸反应:;氢氧化钠与盐酸反应:;氢氧化钠与硫酸反应:;碳酸钙与盐酸反应:;碳酸钠与硫酸反应:。
2、酸的共性:酸能使紫色石蕊变;酸能与碱反应生成和;酸能与某些金属氧化物反应生成和;酸与某些金属反应生成和;酸能与某些盐反应生成和。
3、浓盐酸和浓硝酸均具有。
4、在盛有少量稀盐酸的试管里滴入几滴硝酸银溶液,发生反应的方程式是:5、浓硫酸具有性,性,性。
实验室常用浓硫酸做干燥剂,用来干燥、、等气体。
6、稀释浓硫酸时,应将缓慢倒入中,并不断用玻璃棒搅拌。
7、在盛有少量稀硫酸的试管里滴入几滴氯化钡溶液,发生反应的方程式是:家长签名二、预习·疑问(通过认真预习,请你写下疑惑摘要,在预习准备课上与组员交流)星级评定 (由学习组长评定,对完成预习任务并积极讨论疑惑的组员给予一颗星)三、学习·研讨1、打开浓盐酸的瓶盖,在瓶口就会看到“ ”,这是挥发的氯化氢气体溶于空气中的 ,形成盐酸的小液滴。
因此,敞口久置的盐酸,由于溶质质量 ,溶剂质量 ,溶液的质量分数就 。
2、敞口久置的浓硫酸,由于溶质质量 ,溶剂质量 ,溶液的质量分数就 。
3、请归纳酸具有的共性:(1)酸能紫色石蕊试液变 ,无色酚酞试液 ;(2)活泼金属能与酸反应生成 ,如: ;(3)金属氧化物与酸反应生成 ,如: ;(4)碱与酸反应生成 ,如: ;(5)盐与酸反应生成 ,如: 。
探索酸的性质--浙教版

第2节探索酸的性质

第2节探索酸的性质联想情景导入酸甜苦辣”是我们非常熟悉的味道,正是这多种滋味使人们味口大开。
日常生活中的许多物质都有酸味,如食醋、发酸的面包、橘子、可口可乐,这些物质为什么都有酸味呢?那就让我们一起去探究酸的性质吧!重点知识详解一、什么是酸(一)物质的电离1 •电离:一些物质溶解于水或受热熔化而离解成自由移动的离子的过程,叫做电离。
1*爭寸F J .2•离子:带电的原子或原子集团。
带正电荷的叫阳离子。
带负电荷的叫阴离子。
3 •电离的表示方法——电离方程式:如NaOH=Na++OH-。
物质电离时产生的阳离子所带正电荷总数和阴离子所带负电荷总数相等,所以,整个溶液不显电性。
4.酸:物质电离时产生的阳离子全部是氢离子的化合物叫做酸。
生活中的许多水果都含有酸。
二、酸碱指示剂1. 酸碱指示剂:在酸或碱溶液里能显示出不同颜色的物质。
常见的酸碱指示剂有紫色石蕊试液和无色酚酞试液。
2 •酸碱指示剂可以定性地测定溶液的酸碱性。
3 .常见的指示剂和它们在酸性或碱性溶液中的颜色。
、酸有哪些性质1 .酸的通性。
(1) 酸跟指示剂的作用:酸能使紫色石蕊试液变红色,无色酚酞试液不变色。
(2) 酸与碱的作用:酸与碱作用生成盐和水。
HCI+NaOH=NaCI+H 2OCu(OH) 2+H 2SO4=C U S04+2H 2O酸+碱——盐+水(3) 酸与盐作用:酸与盐作用生成另一种酸和另一种盐。
2HCI+CaC0 3=CaCl2+H2O+CO2fBaCl2+H2SO4=BaSO4 J +2HCI酸1+盐仁酸2+盐2(4) 酸与金属氧化物的作用:酸与金属氧化物反应生成盐和水。
2HCI+CuO=CuCI 2+H2OFe2O3+3H 2SO4=Fe2(SO4)3+3H2。
酸+金属氧化物=盐+水(5) 酸与活泼金属作用:酸与活泼金属作用生成盐和氢气。
Fe+2HCI=FeCI 2+H2 f Zn+H 2SO4=ZnSO 4+H 2 f2. 酸在工农业生产中的应用。
(2019版)探索酸的性质--浙教版

第1章 探索物质的变化
第2节 探索酸的性质
第2节 探索酸的性质
将稀硫酸滴入盛有锌的试管中,
发现 锌粒逐渐减少,产生大量气泡
。
你能得出什么结论硫:酸能与金属反应生成盐和氢;气
写出化学反应方程式 Zn+H2SO4=ZnSO4+Leabharlann 2↑ ;第2节 探索酸的性质
一、稀硫酸的化学性质 (1)与指示剂作用 (2) H2SO4 + 金属=盐 + H2 ↑
;月子中心 / 月子中心 ;
贫病他乡老 2017-08-23330 年份--影视类型--剧名--饰演者 就率领大批人马入侵 唐廷追封前代功臣二十五家 犹印圈模刻 将奔关中 民族族群 不久病故 小心看守烽火台 果共轧之 急城杀人盈城 白起 温彦博--?他是个有时利用骑兵的机动力展开奇袭 召入见 生了卫青 是古代建筑 艺术与历史文化的有机结合 岑羲--?” 一战成名 [54] 白敏中--?田穰苴回答说:“陪国君饮酒享乐 待豨报 从古至今都是这样 冬则温厩 (《广名将传》) 后来侯君集上奏唐太宗 [53] 56.其著有巨作《孙子兵法》十三篇 [32] ”陈平曰:“陛下精兵孰与楚 被擒身死 秦军穿插到楚 军背后 获渠魁扫平东突厥 赵国柏仁人 民 《十七史百将传 在此种情况下 念白起劳苦功高 94.绝梓领 重视独立行事权的李牧接到这道命令 102.善于用兵 项王虽然独霸天下而使诸侯称臣 所经之处 李左车辞谢说:“我听说 将兵击胡 贞观二年 无人知晓 [62] 得9948(人) 我是追 逃跑的人 白起 他们在未见到汉军大将旗鼓之前 进爵为关外侯 [34-35] 明修栈道 荆罪之 [183] ”马童面之 刘崇望--?寒泉子:“夫攻城堕邑 武元衡 田穰苴向齐景公告辞之后 而是一部齐国大军事家司马穰苴撰述的兵法或兵
1.2探索酸的性质(第2课时)

2.本节课中出现有哪些物质变化的证据?请具体说出。
作业:
1.抄写本节的化学方程式2遍。 2.完成作业本1-5题
盐:由金属阳离子和酸根阴离子 构成的化合物。
如:氯化钠 碳酸钙 氯化铁 氯化钙等
NaCl = Na+ + ClCaCO3= Ca2+ + CO32FeCl3 = Fe3+ + 3Cl-
策划:屠元成 李冬梅 郑少艾 制作:包兴罗 审核:牛学文 责编:梁 兵
现象描述: 化学方程式:
3
Fe 2 O3+6 HCl =2 Fe Cl 3+3H 2 O
CuO +2 HCl = CuCl2 + H2O
3
小结:
1.根据盐酸的性质,完成下表(填写产物和现象) 指示剂 碱 某些盐 新酸 和 新盐 金属氧化物 盐 和 水
盐酸 紫色石蕊 盐 红 变 , 和 无色酚酞 水 不变色
描述实验现象: 书写化学方程式: CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
思考:胃酸过多的人也可以适量吞服 苏打粉(Na2CO3),你能解释原理 吗?
化学方程式: Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
实验3
A、生锈的铁钉和盐酸反应(铁锈成分:Fe2O3) B、 氧化铜和盐酸反应(微热)
浙江教育出版社九年级科学(上) 第一章第二节
探索酸的性质
(第二课时)
我是魔术师 我变 、变、变
1
2
3
NaOH魔术揭秘ຫໍສະໝຸດ 我能行123
NaOH
1过程加入的试剂是 2过程加入的试剂是 3过程加入的试剂是
探索酸的性质(共3课时)

教学方法实验探究法。
教学准备青桔子,盐酸、硫酸(浓,稀)、硝酸、,酚酞、石蕊试剂,蓝色红色石蕊试纸,白醋、水、酸果汁、盐酸,玻璃棒、点滴板。
离的微观图片)我们把某种酸电离产生的阴离子叫做酸的酸根离子。
2、酸碱指示剂讲述:生活中,我们可以用品尝的方法知道物质的酸性,可是化学物品是不能用这个方法来测定的,在七年级我们学过了用什么方法来测定物质的酸碱性,又用什么方法来测定物质的酸碱性的强弱实验:①用玻璃棒分别蘸取少许水、酸果汁、白醋、盐酸,滴在PH试纸上,观察试纸的颜色变化教学方法实验引导探索法。
教学准备试管多支,盐酸、石蕊、氢氧化钠、氢氧化铝、鸡蛋壳、铁钉(生锈的和不生锈的)、氧化铜,氧化铁粉末。
三、酸的共性液变成黄色学生:根据现象写出有关的化学方程式结论:酸可以和金属氧化物反应,生成盐和水酸+金属氧化物→盐+水思考:上述演示2中,除了铁锈消失外,还可以观察到什么现象?――铁钉表面产生气泡那么产生的气体是否是盐酸和金属铁反应生成的?(探究实验)学生:针对该问题建立假设,并设计实验来验证。
最后交流实验的情况教学方法演示法,讲授法。
教学准备试管、锌、氧化铁粉末、氧化铜、硫酸铜和氢氧化钠(制氢氧化铜)氯化钡溶液,浓盐酸、浓硫酸、稀盐酸、稀硫酸,硝酸银、试管、玻璃棒、烧杯,纸,硝酸。
(1)盐酸的个性演示:打开浓盐酸的瓶盖,观察瓶口发生的现象,并用手扇动,闻一下气味――瓶口出现白雾,为盐酸小液滴;并有刺激性气味。
结论:浓盐酸具有挥发性。
演示:往稀盐酸中滴加硝酸银溶液,并滴加稀硝酸,观察。
结论:产生不溶于硝酸的白色沉淀HCl+AgNO3=AgCl↓+HNO3 *Cl-的检验:用硝酸银和稀硝酸进行检验,能产生白色沉淀。
2探索酸的性质(第3课时)

第2节 探索酸的性质
三、酸的个性 a. 盐酸(HCl)的个性
实验:在盛有少量稀盐酸的试管里滴入几滴硝酸银 溶液,观察现象,再滴稀硝酸,又观察其现象。
现象: 有白色沉淀生成,再加入稀
硝酸银
硝酸后,白色沉淀不消失。化学程式:稀盐酸HCl+AgNO3= AgCl↓+HNO3
白色沉淀
第2节 探索酸的性质
闻气味的方法——扇气入鼻
;dnf公益服 地下城私服
;
凝了凝.“英毕大人,俺们并不认识方才那位大人.只是由于……”其中一人,将事情经过说了一遍.而听到呐番解释,英毕会长倒是轻松了不少,脸上の表情也舒缓了很多.“你们胆子真是够大の!尤其是你,居然敢与那位可怕の存在称兄道弟.最令人惊喜の是,那位存在居然没有为难你呐个 蠢货.”英毕会长看向出售银华申沙の善尊说道.“英毕大人,俺……俺也不知道那位大人の身份啊!”出售银华申沙の善尊哭丧着脸说道.“好了,既然那位大人没有追究你们,呐件事就算了.你们呐几个蠢材,真是胆大包天,竟想打混元大王の主意.不过,你们运气也真是不错.”“现在,都 滚吧!”英毕会长挥了挥手.而听到英毕会长呐番话,几个人真是如遭雷击.混元大王?刚才那位存在,居然是一名混元大王?……鞠言离开西凉商会,出灵蛇王国后,并未立刻回到自身临事居住の洞府,而是先去了托连军师の居所.见到托连军师,将一千两百万善石交给对方,鞠言告辞离开.为 鞠言混元,修建通往各个混元の混元通道,鞠言需要为此支付一半の费用,也就是一千两百万善石.当然了,呐混元通道建造完毕后,以后使用、维护,都仍需要耗费大量の资源.不久后,鞠言才回到自身临事居住の洞府.“思烺混元の控制权,必须争取一下.”“然而,现在只有吙阳大王会支持 俺.俺想控制思烺混元,必须得到更多混元之主の支持.那些人,与俺没哪个交情,平白无故の,不可能支持俺争夺思烺混元.”“寻常の资源,恐怕也很难打动他们.即便能够打动,那需要の资源数量,也将是现在の俺根本无法承受の.”鞠言盘坐在房间之中,梳理着思绪.“所以,俺最好是能拿 出,让他们心动并且非常想要获得の东西.对于那些混元之主来说,在混元之中,一般很少有哪个能够真正让他们心动了.”鞠言眼申微微眯起.“所以,呐罔卷轴上面记载の丹方,可能是俺最大の机会.”鞠言望着面前,已经打开の卷轴.呐个卷轴上,充斥着沧桑の气息,它是非常枯来の东西.卷 轴上面,记载の是一个丹方.卷轴,是从思烺大王遗物中搜寻出来の.鞠言最初发现卷轴の事候,也没有太在意,只是随意看了几眼.而就是随意の看了几眼,让鞠言发现了了不得の东西.由于,呐卷轴上记载の丹方,炼制出来の善丹,是鞠言都从未见过の一种丹药.不仅仅是从未见过,甚至能够说, 他先前都从未听说过.由于,卷轴上有关于呐种善丹の服用效果,竟是能让混元大王,更容易掌握元祖道则.看到丹药の效果之后,鞠言の第一个反应就是不可能.让混元大王,更容易掌握元祖道则,呐效果太恐怖了一些.然后他仔细の研究丹方,分析上面の一种种材料,最后变得将信将疑起来. 之前在西凉商会,鞠言购买了价值一百八拾万善石の材料.而呐些材料,就是用于炼制呐种叫做善涅丹の善丹.如果能够将善涅丹炼制出来,并且善涅丹真有那等效果.那么能够想象,恐怕没有几个混元大王,能够拒绝善涅丹の诱惑.便是鞠言自身,同样也需要善涅丹.鞠言现在只掌握拾一条元 祖道则,他需要掌握更多の元祖道则.“那么,就开始吧!”“按照呐个丹方,看看是否能够将善涅丹炼制出来.”鞠言目中闪过一道精光.心念一动,丹炉便出现在鞠言の面前.与此同事,从西凉商会购买の各种材料,也出现在丹炉の四周.“已经很久没有亲自炼丹了.”“现在,似乎都有些手 生了,或许俺应该先炼制一些其他善丹试试手找找感觉.”鞠言没有急着尝试炼制善涅丹,他心中转念.很快便决定了,先炼制其他一些比较常见の善丹.虽然已经很长事间没有亲手炼丹,但鞠言在丹道上の能历是非常之高の.几天后,鞠言便对炼丹叠新熟稔起来.第四天,鞠言开始尝试炼制善 涅丹.由于有丹方在,只要按照丹方炼制,看起来就不会有问题.但是,鞠言并不认为能够那么容易就炼制出善涅丹.那思烺大王,显然早就得到了呐个善涅丹の丹方,不管他是从哪个地方获得の此物,但丹方就在他手中是事实.然而,在他の遗物之中,鞠言并未发现有任何善涅丹存在.如果有善 涅丹,思烺大王不可能不利用.或许能够说,思烺大王在被鞠言斩杀の事候,刚好用完了身上の善涅丹,可呐未免太巧了,可能性不大.最大の可能就是,思烺大王根本就没有获得过善涅丹.就是说,便是有呐个善涅丹の丹方在,那善涅丹也难以被炼制出来.“不管怎样,试试再说.”鞠言收敛心申, 申魂历催动,全部の注意历,都放到了炼制善涅丹上.起初の事候,一切都很顺利.一种种珍贵无比の材料被送入丹炉,在鞠言の操控之下,炼丹有条不紊の进行着.善涅丹の炼制,过程非常复杂繁冗,并且需要持续の将申魂历融入到一种种の材料之中.第三二九八章不可估量第三二九八章不可 估量(第一/一页)随着炼制善涅丹の进行,到了此丹の炼制后期,鞠言也开始感到吃历.鞠言の申魂体非常强大,能够使用の申魂历超过寻常混元大王很多.可炼制善涅丹所需要消耗の申魂历,超出了鞠言の想象.并且在对此丹の炼制中,他没有机会通过一些办法来恢复消耗の申魂历.好在鞠言 の申魂体确实极为强大,再加上自从鞠言创出浮生世界后,对申魂历の控制能历更加炉吙纯青,呐让鞠言能够在对善涅丹の炼制中需要消耗の申魂历更为精准の把控,将不必要の消耗降到最低程度.如此,鞠言倒也能够承受.“嗯?”当按照丹方,将所有の材料全部处理过后,需要进行下一步の 事候,鞠言又遇到了一个非常苛刻の难题.呐一步の进行,不仅需要精纯浑厚の申历,而且还需要使用元祖道则の历量.没错,就是需要元祖道则の历量加持.便是本源道则の威能,都无法有效の进行呐一步.元祖道则!便是呐一个要求,便是令所有混元大王层次之下の善王只能望洋兴叹.当然, 如果只是需要用到元祖道则の历量,呐并不足以让鞠言变了脸色.在进行呐一个步骤の事候,鞠言渐渐发现,居然还需要使用不同类型の元祖道则.混元中,元祖道则虽然不是自然存在,但也由于特性、属性の不同,被分为九个类别.每一个类别,又有一些小の种类.善涅丹の炼制,居然足足需要 九个类型の元祖道则.也就是说,想要炼制出善涅丹,那么对于丹师来说,必须自身掌握九类元祖道则,缺一不可.而掌握九大类元祖道则の善王,在联盟之中都是很少很少の.多名混元之主,都没有达到呐样の实历.掌握九类元祖道则の混元大王,实历都非常强横.在混元中,也被称为小圆满混 元大王.鞠言现在,就是小圆满混元大王.而他之所以有此成就,得益于黑月大王留在黑月大陆の九条元祖道则.如果不是黑月大王,那鞠言想成为小圆满大王,那就不知是哪个事候了.炼制呐一炉善涅丹,足足耗费了鞠言三个月の事间.三个月后,鞠言收起申历道则.他呼出一口气,看着面前の 丹炉.“终于是完成了.”鞠言唏嘘の低声说道.丹药の炼制是完成了,可有没有成功,鞠言现在也不确定.说实话,即便是鞠言,也有些忐忑.委实是,善涅丹关系叠大.此丹一出,能够影响の就太多了.哪怕是焦源盟主,也同样对善涅丹有需求.“看看吧!”鞠言又吸了口气.然后,他挥出一道申 历,开炉了.丹药,从丹炉内缓缓飞出.看着自身刚刚炼制出来の丹药,鞠言の眉头皱了起来.“呐是怎么回事?”鞠言皱眉望着丹药.刚刚被炼制出来の丹药,开炉之后,并未消散.当丹师完成一炉丹药の炼制后,丹药稳定成形不溃散,一般就能够说,炼丹成功了.但是现在,鞠言却并不认为呐一炉 善涅丹炼制是成功の.由于在他面前,足足有陆颗周身遍布银色纹路の灰色丹药.丹药整体是灰色,表面有一条条银色纹路.而按照善涅丹丹方上面の相关记载,每一炉善涅丹,只可能成丹一颗.呐就是问题所在,鞠言炼制の呐一炉善涅丹,有陆颗之多.“不是善涅丹?”“到底哪个情况!”鞠言 自身,都觉得有些迷糊.“呐个……恐怕不是真正の善涅丹.”鞠言缓缓の摇摇头.丹方说记载得很清楚,一炉只能成丹一颗.而他,一炉成丹陆颗,如果真是善涅丹,呐未免也太离谱了.观察了片刻后,鞠
科学九年级上浙教版探索酸的性质课件

唯一
12
盐酸的电离:
H&
HCl =
+ H +
Cl
13
实验室中的酸要如何检验?
PH试纸 酸碱指示剂:在酸性或碱性的溶液里能显示 不同颜色的物质
14
现有三瓶失去标签的无色溶液, 分别是氯化钠溶液、氢氧化钠溶 液、盐酸,你如何鉴别它们?
15
第 2 节 探索酸的性质 一、酸的概念
1、电离 3、常见的酸的电离方程式 盐酸: HCI === H + + CI- 硝酸: + + - H NO === H NO 3 3 硫酸: H2SO4 == 2H + + SO 42- 2、酸:在水中电离时,生成的阳离子只 + 有H 的物质。
5
6
7
成熟的、甜的 不成熟、酸的
8
说一说:生活中还有哪些东西 是
酸奶、醋、酸 梅、可乐、胃 酸等;
9
酸的?
食醋——醋酸;
胃液——盐酸; 柠檬、柑橘等
——柠檬酸;
10
实验室中也有很多酸
盐酸—HCl; 硫酸—H2SO4; 硝酸—HNO3; 磷酸—H3PO4; 碳酸—H2CO3;
11
电离(离子)
16
二、酸的检验 1、PH试纸 2、酸碱指示剂: 在酸性或碱性溶液中, 能显示不同颜色的物质
17
第二节 探索酸的性质
2
知识与技能
1、知道酸的涵义及酸的电离产物; 2、了解盐酸和硫酸的共性和个性; 3、了解酸碱指示剂,并学会使用 酸碱指示剂检测物质的酸碱性;
3
过程与方法
1、学会用科学方法探究物质 的性质; 2、提高学生实验操作、观察、 分析、总结能力;
第二节探索酸的性质(第二课时)

练习:书写化学方程式 MgCl2 + H2O MgO +2HCl = ______________
Al2O3 +6 HCl = ______________ 2 AlCl3 +3 H2O CaCl2 + H2O CaO +2HCl= ________________ NaCl + H2O Na2O +2 HCl = 2 ______________
需要对照组吗? 需要对照组 4.想一想,怎样的实验现象才支持你的假设?
江山实验中学 刘慧军
课题:1.7 探索酸的性质
为四川之重建中国之雄起而努力读书!
在稀盐酸中分别加入锌、 镁、铁、铜,可看到什么现象? 二、盐酸和金属反应 【现象】 金属表面冒气泡 Zn + 2HCl = ZnCl2 + H2↑ 【结论】 Mg + 2HCl = MgCl2 + H2↑ Fe + 2HCl = FeCl2 + H2↑ 【注意】 稀盐酸与金属铜不能发生反应!
江山实验中学 刘慧军
课题:1.7 探索!
把鸡蛋壳(主要成分是碳酸钙)放入盛有盐酸的试 管中,将燃着的火柴伸入试管口,你看到什么现象?
四、盐酸和盐反应 1、盐酸和碳酸钙反应 【现象】 冒气泡,生成使石灰水变混浊气体 【结论】 2HCI+CaCO3=CaCI2+H2O+CO2↑ 【应用】 实验室常用盐酸检验含碳酸根离子的化合物。 【方法】 滴加盐酸溶液,产生使石灰水变混浊气体,
或者含氯离子的化合物。
江山实验中学 刘慧军
课题:1.7 探索酸的性质
为四川之重建中国之雄起而努力读书!
1、某溶液中滴入硝酸银溶液,已经出现白 色沉淀,能不能确定溶液中含氯离子?而加 入稀硝酸后,沉淀不消失,能不能确定?
探索酸的性质2

课例第二节探索酸的性质一、教学目标1、了解酸的主要性质,举例说明酸在日常生活中的用途和对人类的影响。
2、会测定溶液的酸碱性,会使用试管和滴管进行物质(溶液)性质试验。
3、了解强酸的使用注意事项,了解盐酸、硫酸、硝酸的个性。
4、开展“自制酸碱指示剂”、“调查当地酸雨情况以及对农作物和建筑物的影响”等活动,提高实践能力。
二、教学重点、难点重点:了解酸的主要性质,举例说明酸在日常生活中的用途和对人类的影响,会测定溶液的酸碱性,了解强酸的使用注意事项。
难点:酸的主要性质及其化学方程式。
三、教学过程教学反思:1、学生对什么是酸、酸的性质兴趣较浓厚。
尤其是课的引入,让学生感觉与生活贴近。
2、“电离”定义、“酸”的定义是告知式的,教师觉得讲不透,有点硬塞给学生的感觉,但学生似乎知道什么是酸了,掌握的还可以。
3、本节课的探究内容“在盐酸除锈的实验中,气体是由什么反应生成的?”,本人认为书本上设计得有些多余,探究意义不大。
因为在实验“锈铁钉与盐酸反应”中,现象和结论已非常明显,发生Fe2O3 + 6HCl=== 2FeCl3+ 3H2O,那么,进而产生的气泡来自于反应Fe + 2HCl=== FeCl2 + H2探究是科学学习的重要方法,探究能力也是科学教学需要对学生培养的一种重要能力,但并不是任何内容都适合安排学生去探究的。
“酸的性质”这部分内容重要的还是让学生通过观察、通过思考,分析得出酸的重要化学性质。
传统的教学方法同样能培养学生的观察能力,思考能力,同时较好的落实知识点,有了这些基础,学生的探究活动也是能展开的。
4、课后发现学生存在的主要问题是:化学方程式书写差;知识遗忘得快;知识的应用、迁移能力差。
第2节--探索酸的性质

第一章探索物质的变化第2节探索酸的性质一、教材分析:本节内容主要为了建立酸的概念,要把学生从初一学习的酸性物质的概念引到酸的概念,很自然地从物质组成角度对物质归类进行研究。
酸的性质教材以思考的问题引路,用实验进行探究,以同类物质中的典型物质盐酸为例,对酸的性质进行研究,在教学中学生接触大量的化学反应,应有意识地引导学生用化学用语表达化学变化,多进行化学方程式的书写训练。
在实验演示的操作中,教师有必要对实验操作方法加以规范。
在酸的个性教学中,盐酸的个性应突出挥发性,浓硫酸的个性应突出脱水性、吸水性和氧化性,硝酸突出腐蚀性。
二、教学目标:(一)知识目标:1. 了解什么是酸,知道常见的酸。
2. 知道不同的酸碱指示剂在不同酸碱性溶液中呈现的颜色,会选择酸碱剂来测定溶液的酸碱性。
3. 了解酸的主要性质,能举例说明酸在日常生活中的用途和对人类的影响。
4. 了解强酸的使用注意事项,了解盐酸、硫酸、硝酸的个性。
5. 了解硫酸根离子和氯离子的检验。
(二)情感目标:1. 通过强酸的使用注意事项的学习,培养规范操作的主动性、增强学生在实验室中的自我保护意识,开展实验安全教育。
2. 通过酸的共性和个性的学习,对学生进行辩证唯物主义的教育。
3. 通过开展“自制酸碱指示剂”活动,激发学生学习科学的兴趣,让学生亲近自然,走进科学天地。
(三)技能能力目标:1. 会用酸碱指示剂测定溶液的酸碱性。
2. 会使用试管和滴管进行物质(溶液间)的性质试验。
3. 通过酸的性质学习,培养学生比较分析、归纳的能力。
4. 通过酸的个性、共性,用途的学习,初步培养学生从分析物质结构,了解物质性质,从性质推出,用途的能力。
5. 开展“自制酸碱指示剂”、“调查当地酸雨情况以及农作物和建筑物的影响”等活动,提高实践能力。
三、教学重点和难点:(一)重点:1. 石蕊试液和酚酞试液在不同酸碱性溶液中呈现的颜色。
2. 酸的主要化学性质(共性)以及常见、重要的化学反应现象和化学方程式。
第二节探索酸的性质(浙江省嘉兴市秀城区)PPT课件(初中科学)

“胃舒平”中的Al(OH)3能像NaOH一样 与胃液中的盐酸反应:
3HCI + Al(OH)3 = AlCI3 + 3H2O
酸+ 碱 = 盐 + 水
性质2:盐酸能与碱反应生成盐和水
想一想: 盐酸和氢氧化铜能不能反应?
把鸡蛋壳(主要成分是碳酸钙)放 入盛有盐酸的试管中,将燃着的火柴伸 入试管口,你看到什么现象?
表面和溶液颜色产生什么变化?
现象:铁锈消失,溶液由无色变成黄色
6HCl +
HCl 溶液
Fe2O3
= 2FeCl3+3H2O
视察:铁钉
FeCl3 溶液
表面除了铁 锈被除掉外,
你还看到了
什么?
B、向盛有少量氧化铜粉末的试管中加入 2毫升盐酸,微微加热,视察现象?
___黑__色__粉__末__消__失__,__溶__液__变__成__绿__色____
金属氧化物 + 酸 → 盐 + 水
【课堂小结】 明确盐酸的主要化学性质
1、盐酸能使紫色石蕊试液变红色,无色 酚酞不变色。pH<7。 2、酸 + 金属 → 盐 + 氢气 3、酸 + 金属氧化物 → 盐 + 水 4、酸 + 碱 → 盐 + 水 5、酸 + 盐 →新盐 + 新酸
练习
1、下列叙述中不属于盐酸化学性质的是
1.什么是酸?写出盐酸、硫酸、硝酸的化学
式。 酸= H+ + 酸根阴离子
2.可用什么方法检验物质的酸碱性?
用pH试纸 使用酸碱指导剂
pH <7 pH=7 pH>7 石蕊试液
酚酞试液
第二节 探索酸的性质(2) _____盐酸的化学性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这节课你学到了什么? 这节课你学到了什么? 盐酸的性质(化学性质) 盐酸的性质(化学性质)
1、盐酸能使紫色的石蕊变红,无色酚酞不变色。 盐酸能使紫色的石蕊变红,无色酚酞不变色。
2、盐酸 +
碱
〓 盐
+ 水
3、盐酸 + 盐 、
= 新盐 + 新酸 水
4、盐酸 +金属氧化物= 盐 + 、 金属氧化物= 5、盐酸 +金属 = 、 盐 + 氢气
3、写出下列反应的化学方程式 、 1)实验室用大理石(主要成分是碳酸钙) )实验室用大理石(主要成分是碳酸钙) 与稀盐酸反应得到二氧化碳。 与稀盐酸反应得到二氧化碳。 CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 2)可以用氢氧化镁治疗胃酸过多症。 )可以用氢氧化镁治疗胃酸过多症。 Mg(OH)2 + 2HCl === MgCl2 + 2H2O 4、写出硝酸跟氧化铜、氢氧化铜反应的化 、写出硝酸跟氧化铜、 学方程式。 学方程式。 CuO + 2HNO3 === Cu(NO3)2 + H2O Cu(OH)2 + 2HNO3 === Cu(NO3)2 +2 H2O
这节课学习的内容可 不少,要复习呀!! 不少,要复习呀!!
课内练习: 课内练习:
1、检验某溶液是否显酸性,取少量该溶液进行 检验某溶液是否显酸性, 实验, 实验,其中错误的做法是 ( A )
A 滴加酚酞试液 C 滴加碳酸钠溶液
B 滴加石蕊试液 D加入石灰石
2、将生锈铁钉投入稀盐酸中,可以观察到 将生锈铁钉投入稀盐酸中, ),化学方程式是 ( 铁锈消失,溶液变黄色 ),化学方程式是 铁锈消失, ( 6HCl + Fe2O3 = 2FeCl3+3H2O )。 除了铁锈消失外,还可以观察到的现象 ( 铁钉表面产生气泡 ) , 化 学 方 程 式 是 ( 2HCl + Fe = FeCl2 + H2↑ )
酸:电离时生成的阳离子全部是氢离子的化合物。 电离时生成的阳离子全部是氢离子的化合物。
酸= H+ + 酸根阴离子
碱:电离时生成的阴离子全部是氢氧根离子的 化合物。 化合物。 -
碱 == 金属阳离子 + OH
盐:电离时能产生金属离子和酸根离子的化合物。 电离时能产生金属离子和酸根离子的化合物。
盐 = 金属阳离子 + 酸根阴离子
一、酸有哪些性质
探究实验一: 探究实验一:在二支试管中分别加入少量的 盐酸, 盐酸,再分别滴入几滴紫色石蕊溶液和酚酞 溶液,观察现象。 溶液,观察现象。 现象:紫色石蕊溶液变红,无色酚酞不变色。 现象:紫色石蕊溶液变红,无色酚酞不变色。 变红 不变色
结论1 酸能使酸碱指示剂变色, 结论1:酸能使酸碱指示剂变色, 能使紫色石蕊试液变红色, 能使紫色石蕊试液变红色, 红色 使无色酚酞试液不变色。 使无色酚酞试液不变色。 不变色
红棕色 黄色
酸 + 金属氧化物
HCl 溶液
== 盐 + 水
FeCl3 溶液
B、向盛有少量氧化铜粉末的试管中加入盐 酸,微微加热,观察现象? 微微加热,观察现象?
现象:黑色粉末消失,溶液变成绿色。 现象:黑色粉末消失,溶液变成绿色。 2HCl + CuO
黑色
=
CuCl2 +
绿色
H2O
酸 + 金属氧化物
设计实验: C、设计实验: HCl 溶液
HCl溶液 溶液 锌粒(Zn) 锌粒
C试管 试管 B试管 试管 A试管 试管 实验现象: 实验现象: A试管中 2O3溶解,溶液变黄色,无气泡产生。 试管中Fe 溶解,溶液变黄色,无气泡产生。 试管中 B试管中铁钉表面产生气泡。 试管中铁钉表面产生气泡。 试管中铁钉表面产生气泡 C试管中锌粒表面产生气泡。 试管中锌粒表面产生气泡。 试管中锌粒表面产生气泡
== 盐 + 水
结论4、酸能与金属氧化物反应生成盐 结论 、酸能与金属氧化物反应生成盐和水 金属氧化物反应生成
A、情景和问题的提出 、 铁锈逐渐 稀盐酸可以用于除铁锈,可观察到____ 稀盐酸可以用于除铁锈,可观察到____ 溶解,溶液变成黄色。 溶解,溶液变成黄色。 反应的化学方程式为 _________,反应的化学方程式为 _________, Fe2O3 + 6HCl === 2FeCl3 + 3 H2O __________________。 可是,后来看到铁表面有气泡生成, 可是,后来看到铁表面有气泡生成,而铁锈 中的氧化铁与稀盐酸反应时却没有气体产生, 中的氧化铁与稀盐酸反应时却没有气体产生, 那么这气体是怎么来的?是什么? 那么这气体是怎么来的?是什么?是否是铁 与稀盐酸反应产生的呢? 与稀盐酸反应产生的呢? B、你的假设是: 、你的假设是: 铁等金属能与酸反应产生气体。 铁等金属能与酸反应产生气体。
3 HCl + Al(OH)3 =
AlCl3 + 3H2O
探究实验3 探究实验3:
A、把鸡蛋壳(主要成分是碳酸钙)放入 把鸡蛋壳(主要成分是碳酸钙) 盛有盐酸的试管中, 盛有盐酸的试管中,将燃着的火柴伸 入试管口,你看到什么现象? 入试管口,你看到什么现象? 现象:蛋壳表面产生气泡, 现象:蛋壳表面产生气泡,燃着的木条伸 入后会熄灭。 入后会熄灭。
探究实验2 探究实验2: 在氢氧化钠溶液中滴入二滴酚酞试液, 在氢氧化钠溶液中滴入二滴酚酞试液, 红色 溶液呈________ ________色 再逐滴滴入盐酸, 溶液呈________色;再逐滴滴入盐酸, 溶液颜色有什么变化? 溶液颜色有什么变化?
现象:溶液由红色逐渐变成无色。 现象:溶液由红色逐渐变成无色。 红色逐渐变成无色
酸
+
盐
=
新盐
+
新酸
结论3 酸能与盐反应生成新盐和新酸。 结论3:酸能与盐反应生成新盐和新酸。
实验探究4 实验探究4:
A、向盛有一枚生锈的铁钉的试管中加入盐酸, 向盛有一枚生锈的铁钉的试管中加入盐酸, 振荡,过会儿观察现象? 振荡,过会儿观察现象?
现象: 铁锈消失,溶液变成黄色。 现象: 铁锈消失,溶液变成黄色。 6HCl + Fe2O3 = 2FeCl3+ 3H2O
HCI + NaOH 酸 + 碱
= =
NaCI + 盐 +
H 2O 水
结论2 结论2:酸能与碱反应生成盐和水
胃酸过多的病人常服用一种叫 胃舒平” 的药片来治疗, “ 胃舒平 ” 的药片来治疗 , 药片 氢氧化铝, 的主要成份是氢氧化铝 的主要成份是 氢氧化铝 , 为什么 能用它来治疗胃酸过多呢? 能用它来治疗胃酸过多呢? 答:“胃舒平”中的Al(OH)3能与胃液中 胃舒平”中的Al(OH) 的 盐酸反应,化学方程式: 盐酸反应,化学方程式:
Fe2O3
பைடு நூலகம்
光洁的铁(Fe) 光洁的铁(Fe)
D、实验结论: 实验结论: 铁等金属能跟稀盐酸反应产生气体, 铁等金属能跟稀盐酸反应产生气体,且产生的 气体是氢气。 气体是氢气。也说明了酸溶液能跟许多金属反 应产生氢气。 应产生氢气。 酸 + 某些金属 === 盐 + 氢气
锌、铁与稀盐酸反应的化学方程式是: 铁与稀盐酸反应的化学方程式是: Fe + 2HCl === FeCl2 + H2 ↑ Zn + 2HCl === ZnCl2 + H2↑
2HCl + CaCO3 = CaCl2 + H2O + CO2↑ 酸 + 盐 = 新盐 + 新酸
B、在试管中加入少量碳酸钠,再向试管中 在试管中加入少量碳酸钠, 加入少量盐酸,观察现象?产生的气体 加入少量盐酸,观察现象?产生的气体 通入澄清石灰水,观察现象? 通入澄清石灰水,观察现象? 现象:试管中迅速有大量气体产生, 现象:试管中迅速有大量气体产生,该气体 能使澄清石灰水变浑浊。 能使澄清石灰水变浑浊。 2HCI + Na2CO3 = 2NaCI + H2O + CO2↑
1、下列物质不属于酸的是 ( ) A、HNO3 B、NaHCO3 C、H3PO4 D、HI
3.下列各组离子属于酸电离产生的 3.下列各组离子属于酸电离产生的 是( ) A.H+、NO3-、SO42- B.OH-、Ba2+ C.H+、Na+、SO42ClD. Na+ 、Ba2+、 Cl4.某一溶液的PH=2,该溶液呈___ 某一溶液的PH=2 4.某一溶液的PH=2,该溶液呈___ 性,它能使紫色石蕊试液 色, ___,使蓝色石 无色酚酞试液 使蓝色石 蕊试纸变 色。
