2019版高考化学一轮复习第五章物质结构元素周期律高效演练
(新课标)2019版高考化学一轮复习第五单元物质结构元素周期律考点规范练14原子结构化学键

6.A A 项 ,O 和 S 在元素周期表中位于同一主族 , 故二氧化碳与羰基硫结构相似 , 但由于 O和 S 非金
属性不同 , 羰基硫为极性分子 ,A 项错误 ;B 项 , 由类推法根据 CO2 可写出羰基硫的电子式 ,B 项正确 ;C
项, 羰基硫和 CO2 同为分子晶体且组成的结构相似 , 羰基硫的相对分子质量较大 , 故羰基硫沸点比 CO2
,A 和 E 所形成的简单氢化物中 , 共价键极性
的强弱顺序为
>
( 用化学式表示 ) 。
(6) 用原子结构解释“B 与 G的单质都能与 H2 反应生成 HX型氢化物”的原
因:
。
13.(10 分 )X 、Y、 Z、 W是原子序数依次增大的短周期主族元素 ,X 、 Z 在周期表中的相对位置如图所
示;X 的单质在氧气中燃烧能生成两种无色气体 ,Y 的最简单气态氢化物的水溶液显碱性。
考点规范练 14 原子结构 化学键
( 时间 :45 分钟 满分 :100 分 ) 一、选择题 ( 本题共 10 小题 , 每小题 5 分 , 共 50 分。每小题只有一个选项符合题目要求 ) 1.(2017 湖北荆州模拟 ) 下列叙述中 , 正确的是 ( )
A. 14C中含有 14 个中子 B. 1 H、 2H、 3H 是同一种核素 C.H2O与 D2O(重水 ) 互称同位素 D.C60 、 C70、金刚石、石墨均为碳的同素异形体 2. 重水 (D2O)主要用于核反应堆中中子的减速剂和冷却剂 来研究反应机理等。下列说法正确的是 ( ) A.D 是氢的一种核素 , 原子核内有 2 个中子
( 填化学式 );ZO 2 和 YO中还原性较强的是
( 填化学式 ) 。
14.(14 分 )A 、B、 X、 Y 和 Z 是原子序数依次递增的短周期元素 , 其中 A与 Y 同主族 ,X 与 Z 同主族 ,A
(通用版)2019版高考化学一轮复习 第五章 物质结构 元素周期律学案

第五章 物质结构 元素周期律第一节原子结构__化学键教材复习——打牢基础,基稳才能楼高1.构成原子的微粒及作用原子(A ZX)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子Z 个——决定元素的种类中子A —Z 个]在质子数确定后决定原子种类同位素核外电子Z 个——最外层电子数决定元素的化学性质2.原子(离子)中构成微粒之间的等量关系 (1)原子中:质子数(Z )=核电荷数=核外电子数; (2)原子核中:质量数(A )=质子数(Z )+中子数(N ); (3)阳离子:核外电子数=质子数-阳离子所带的电荷数; (4)阴离子:核外电子数=质子数+阴离子所带的电荷数。
3.符号中各数字的含义微点拨(1)并不是所有微粒均会有中子和电子。
有的微粒不一定有中子,如定有电子,如(2)质子数相同的微粒不一定属于同一种元素,如 (1)“三素”概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用微点拨(1)同位素的“六同三不同”同位素之间的转化,不是化学变化,是核反应。
同位素是指同一元素的不同“原子”间的关系,同素异形体是指同一元素的不同[对点练习]1.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。
下列有关48Ti和50Ti的说法正确的是( )A.48Ti和50Ti的质子数相同,互称同位素B.48Ti和50Ti的质量数不同,属于两种元素C.48Ti和50Ti的质子数相同,是同一种核素D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体解析:选A 48Ti和50Ti的质子数相同,中子数不同,是Ti元素的不同核素,互称同位素,A正确。
2.(2017·海南高考)下列分子中,其中子总数为24的是( )A .18O 3 B .2H 172O 2 C .14N 16O 2D .14C 16O 2解析:选D18O 3中含有的中子总数为(18-8)×3=30,故A 错误;2H 172O 2中含有的中子数为(2×1+2×9)=20,故B 错误;14N 16O 2中含有的中子数为7+2×8=23,故C 错误;14C 16O 2中含有的中子数为8+2×8=24,故D 正确。
2019届高考鲁科版化学一轮复习课件:第5章 原子结构与元素周期律 突破全国卷专题讲座(五)(共16张)

2019/9/24
最新中小学教学课件
17
谢谢欣赏!
2019/9/24
最新中小学教学课件
18
[解题策略] 一、元素推断的常用思路 根据原子结构、元素周期表的知识及已知条件,可推算原子 序数,判断元素在周期表中的位置等,基本思路如下:
二、元素推断的特殊技巧举例 (1)位置图示法 所谓图示法就是采用图形或图表对题目条件进行形象化的展 示,直观地揭示题目条件间的内在联系和变化规律,把握解 题的关键。
一些,那不要紧,只要明白即可。 第二,朗读。 老师要求大家朗读课文、单词时一定要出声地读出来。 第三,提问。 听课时,对经过自己思考过但未听懂的问题可以及时举手请教,对老师的讲解,同学的回答,有不同看法的,也可以提出疑问。这种方法也可以保证
自己集中注意力。 第四,回答问题。 上课时积极回答问题是吸收知识的有效途径。课堂上回答问题要主动大胆。回答时要先想一想“老师提的是什么问题?”,“它和学过的内容有什么
2.元素的位置关系和原子序数关系的应用 (1)同一周期中元素的原子序数一般比左边元素原子序数大 1, 比右边元素的原子序数小 1。 (2)同主族上下周期元素的原子序数关系 ①若在 ⅠA 族或 ⅡA 族,原子序数之差为上周期所包含的 元素种数。 ②若在 ⅢA~ⅦA 族,原子序数之差为下周期所包含的元素 种数。
编后语
听课不仅要动脑,还要动口。这样,上课就能够主动接受和吸收知识,把被动的听课变成了一种积极、互动的活动。这对提高我们的学习积极性和口头 表达能力,以及考试时回答主观题很有帮助的。实践证明,凡积极举手发言的学生,学习进步特别快。上课的动口,主要有以下几个方式:
近年高考化学一轮复习第五章物质结构元素周期律第1课时原子结构练习(2021年整理)

2019版高考化学一轮复习第五章物质结构元素周期律第1课时原子结构练习编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019版高考化学一轮复习第五章物质结构元素周期律第1课时原子结构练习)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019版高考化学一轮复习第五章物质结构元素周期律第1课时原子结构练习的全部内容。
课时1 原子结构一、选择题1.(2017·宝鸡模拟)美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,曾获得诺贝尔化学奖。
钯(Pd)元素的原子序数为46,下列叙述错误的是( )A。
错误!Pd和错误!Pd互为同位素B.钯是第5周期元素C.Pd2+核外有48个电子D。
错误!Pd的原子核内有62个中子解析Pd原子核外有46个电子,则Pd2+核外有44个电子。
答案C2.有两种不同的碳原子,一种原子核内有6个质子和6个中子,另一种原子核内有6个质子和7个中子,则它们不相同的是( )A.核电荷数B.核外电子数C.电子层数D.原子的质量数解析由题意可知,这两种碳原子分别为错误!C和错误!C,它们的核电荷数均为6,核外电子数均为6,电子层数均为2但其质量数分别为12和13。
答案D3.长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。
下列说法正确的是( )A.LiH、LiD、LiT的摩尔质量之比为1∶2∶3B.它们都是强氧化剂C.H、D、T之间互称为同素异形体D.它们都是强还原剂解析LiH、LiD、LiT的摩尔质量之比等于它们的相对分子质量之比,应为8∶9∶10,A错;氕化锂、氘化锂、氚化锂中氕、氘、氚均为-1价,处于最低价态,具有强还原性,是强还原剂,故B错,D对;H、D、T之间互称为同位素,C错.答案D4.下列关于原子结构及微粒间的数量关系的说法不正确的是()A.同种元素的原子均有相同的质子数和中子数B.微粒Na+、Mg2+、O2-具有相同的电子层结构C.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构D。
(全国通用)2019版高考化学一轮复习第5章物质结构元素周期律第3节化学键学案.doc
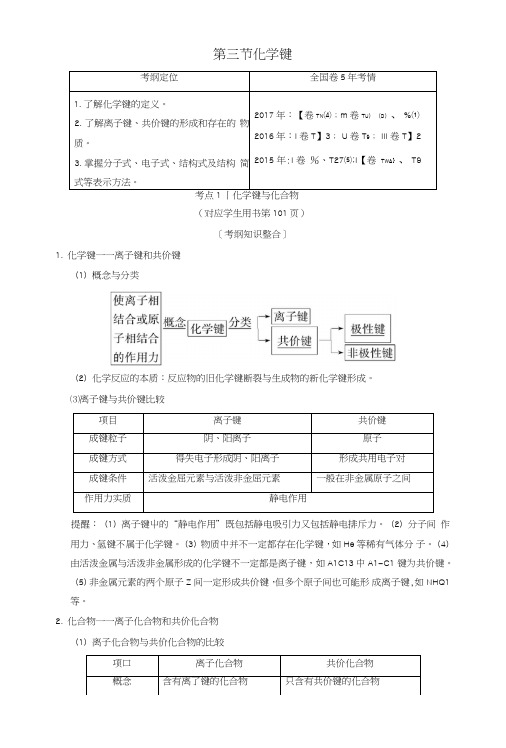
第三节化学键考纲定位全国卷5年考情1.了解化学键的定义。
2.了解离子键、共价键的形成和存在的物质。
3.掌握分子式、电子式、结构式及结构简式等表示方法。
2017年:【卷T N⑷;m卷T U)(D)、%⑴2016年:I卷T】3; U卷T9; III卷T】22015 年:I 卷%、T27⑸;I【卷T WA}、T9考点1丨化学键与化合物(对应学生用书笫101页)[考纲知识整合]1.化学键一一离子键和共价键(1)概念与分类(2)化学反应的本质:反应物的旧化学键断裂与生成物的新化学键形成。
⑶离子键与共价键比较项目离子键共价键成键粒子阴、阳离子原子成键方式得失电子形成阴、阳离子形成共用电子对成键条件活泼金屈元素与活泼非金屈元素一般在非金属原子之间作用力实质静电作用提醒:(1)离子键屮的“静电作用”既包括静电吸引力又包括静电排斥力。
(2)分子间作用力、氢键不属于化学键。
(3)物质中并不一定都存在化学键,如He等稀有气体分子。
(4)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如A1C13中A1-C1 键为共价键。
(5)非金属元素的两个原子Z间一定形成共价键,但多个原子间也可能形成离子键,如NHQ1等。
2.化合物一一离子化合物和共价化合物(1)离子化合物与共价化合物的比较项口离子化合物共价化合物概念含有离了键的化合物只含有共价键的化合物构成微粒阴、阳离子分子或原子化学键类型 一定含有离子键,可能含 有共价键只含有共价键 与物质类 别的关系① 强碱② 绝大多数盐 ③ 活泼金屈氧化物① 含氧酸② 弱碱 ③ 气态氢化物 ④ 非金属氧化物 ⑤ 极少数盐 ⑥ 绝大多数有机物(2)① 根据化学键的类型判断凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。
② 根据化合物的类型来判断大多数碱性氧化物、强碱和盐属于离子化合物;非金属氢化物、非金属氧化物、含氧酸 属于共价化合物。
③ 根据化合物的性质来判断一般熔点、沸点较低的化合物是共俭化合物。
2019高考化学一轮复习第5章第2讲

元
(1)同周期从左到右非金属性增强;同主族从上到下非
素
金属性减弱
非
金
(2)单质与H2化合越容易,形成的气态氢化物越稳定,
判断 非金属性越强
属
性 依据 (3)单质氧化性越强,阴离子还原性越弱,非金属性越
强 比
较
(4)最高价氧化物的水化物酸性越强,非金属性越强
(5)若An-+B―→Bm-+A,则B比A非金属性强
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
元素周期表在科研、生产等方面有哪些指导意 义? 提示 (1)科学预言方面的意义在于为新元素的发现及预测它 们的原子结构和性质提供了线索。(2)对工农业生产的指导意 义在于在周期表中一定的区域内寻找新的物质。(3)对探矿有 指导意义的是地球化学元素的分布与它们在元素周期表中的 位置关系。
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
解析 (4)由题中所给药品可知可用Na2S与氯气发生置换反应 判断非金属性强弱,因为无加热装置,所以只能选择 KMnO4与浓盐酸反应制取氯气;(5)由B中药品Na2CO3 可 知,用最高价氧化物对应水化物的酸性强弱来判断非金属性 强弱,所以A中加入硫酸,B、C装置中加入相应的盐。
考基梳理 助学提升
考点通解 能力对接
考向集训 名师揭秘
【应用1】 (2019·江门调研)短周期金属元素甲~戊在元素周期表中的 相对位置如表所示。下列判断正确的是(双选)( )。 A.丙的单质能从丁的硫酸盐溶液中置换出丁的单质 B.金属性:甲>丙 C.氢氧化物碱性:丙>丁>戊 D.丙与戊最高价氧化物的水化物间发生的反应,能证明 丙和戊的金属性强弱 甲乙
全国2019版高考化学一轮复习方案文档:第五章物质结构 元素周期律 6 章末综合检测(五)

神笛 2005
B.Cl-的结构示意图: C.14062Pd 和 14063Pd 互为同位素
意图为
,b 与 c 形成化合物的电子式为
是( )
A.原子半径:a>c>d>b
B.最高价氧化物对应水化物的酸性:c>d>a
C.原子序数:a>d>b>c
D.元素的非金属性:a>d>c
神笛 2005
,下列比较中正确的
神笛 2005
解析:选 B。根据 a 的原子结构示意图判断,x=2,所以 a 为硅,再利用 b 与 c 形成 化合物的电子式得到 b 为钠、c 为氮,由 c、d 同主族得 d 为磷。原子半径: Na>Si>P>N,A 错误;最高价氧化物对应水化物的酸性:HNO3>H3PO4>H2SiO3,B 正确; 原子序数:P>Si>Na>N,C 错误;元素的非金属性:N>P>Si,D 错误。
布相同时,核电荷数越大,微粒半径越小,半径大小顺序应为 S2->Cl->K+>Ca2+,C 错误;
同种元素的原子得电子能力相同,D 正确。
4.(2018·长春模拟)X、Y、Z、W、Q 是原子序数依次增大的五种短周期主族元素。其
中 Z 是金属,W 的单质是淡黄色固体,X、Y、W 在周期表中的相对位置关系如图所示,
M 为碳元素,N 位于第三周期,且最外层电子数是电子层数的 2 倍,则推得 N 为硫元素。
2019版高考化学一轮复习第五章物质结构元素周期律第一讲原子结构化学键课后达标训练

第一讲 原子结构 化学键[ 课后达标训练 ])美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献, (Pd )元素的原子序数为 46,下列叙述错误的是( )B.钯是第五周期元素 C. Pd 2+核外有48个电子 D.14?Pd 的原子核内有62个中子解析:选Co Pd 原子核外有46个电子,则Pd 2+核外有44个电子。
2.有5种单核粒子,它们分别是 :9口、18口、49口+、;0口2+、49口( “□”内元素符号未写出) ,则它们所属元素的种类有 ()个R 微粒的核外电子数为 a ,核内中子数为b ,A.b + m +n R a +ma -m +bD . a -a m +-b mR解析:选D 。
由题意可知,在化合物 AnR 中,R 的化合价为—m 其离子符号为 Rg ,已知 一个FT 的核外电子数为a ,则该同位素的核内质子数为 a — m 质量数=质子数+中子数= a —m+ b, D 正确。
、选择题1 . (2018 •宝鸡模拟 曾获得诺贝尔化学奖。
钯A.102 Pd 和1463Pd 互为同位素A . 2 种B .3种 C . 4 种D .5种 解析:选B 。
质子数决定元素的种类,质子数有 19、18、20,共 3种。
3. (2018 •豫东名校联考)化学键使得一百多种元素构成了世界的万物。
列关于化学键的叙述中正确的是(A. 离子化合物中一定含有共价键,共价化合物中不含离子键B. 共价化合物中可能含离子键,离子化合物中只含离子键C. 构成单质分子的粒子一定含有共价键D.在氧化钠子核之间的排斥作用解析:选 D 。
离子化合物必含离子键,不一定含有共价键,但共价化合物必含共价键, 定不含离子键,A 、B 错误;稀有气体分子为单原子分子,不含共价键, C 错误;离子键中既存在静电吸引,也存在静电排斥,D 正确。
4•已知R 元素的某种同位素能形成化合物A mn ,其中A 的化合价为+ n 。
近年届高考化学一轮复习第5章原子结构与元素周期律突破全国卷专题讲座(五)突破训练鲁科版(2021年

2019届高考化学一轮复习第5章原子结构与元素周期律突破全国卷专题讲座(五)突破训练鲁科版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019届高考化学一轮复习第5章原子结构与元素周期律突破全国卷专题讲座(五)突破训练鲁科版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019届高考化学一轮复习第5章原子结构与元素周期律突破全国卷专题讲座(五)突破训练鲁科版的全部内容。
第5章原子结构与元素周期律[突破训练]1.(2018·郑州高三模拟)几种短周期元素的原子半径及主要化合价如表所示:A.相同条件下,单质与稀硫酸反应的速率快慢:R>Y>XB.离子半径:T2->X2+C.元素最高价氧化物对应水化物的碱性:Y>R>XD.单质与氢气化合的难易程度:Z>T解析:选B。
根据表格中的数据,由化合价数据知Z为S,T为O,R为Al,再根据原子半径数据,X和Y位于同主族,Y为Be,X为Mg.镁、铍、铝与稀硫酸反应(接触面积相同)时,镁的反应速率最快,A选项错误;O2-与Mg2+都是10电子粒子,O2-的半径较大,B选项正确;碱性:Mg(OH)2>Be(OH)2,Mg(OH)2>Al(OH)3,氢氧化镁的碱性最强,C选项错误;氧的非金属性比硫的强,氧气与氢气化合比硫与氢气化合容易,D选项错误。
2.短周期元素W、X、Y、Z位于同一周期,其原子序数依次递增,四种元素原子的最外层电子数均为奇数,Z的一种含氧酸及其盐溶液是日常生活中常用的杀菌消毒剂。
下列判断正确的是( )A.简单离子的半径大小为W+>X3+>Y3->Z-B.W、X的最高价氧化物对应的水化物可相互反应C.Y、Z可形成两种化合物,其中一种含非极性共价键D.X3+能抑制水的电离解析:选B。
近年届高考化学一轮复习第五章物质结构元素周期律题组层级快练16元素周期律和元素周期表(2021年整

2019届高考化学一轮复习第五章物质结构元素周期律题组层级快练16 元素周期律和元素周期表编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019届高考化学一轮复习第五章物质结构元素周期律题组层级快练16 元素周期律和元素周期表)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019届高考化学一轮复习第五章物质结构元素周期律题组层级快练16 元素周期律和元素周期表的全部内容。
题组层级快练(十六)1.元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是()A.同周期的主族元素中,ⅦA族元素的原子半径最小B.元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素C.ⅥA族元素的原子,其半径越大,气态氢化物越稳定D.室温下,0族元素的单质都是气体答案C解析C项,ⅥA族元素的原子,从上到下,原子半径逐渐增大,元素的非金属性逐渐减弱,气态氢化物的稳定性逐渐减弱,故不正确。
2.(2017·长春模拟)下列结论错误的是( )①微粒半径:K+〉Al3+〉S2->Cl-②氢化物的稳定性:HF>HCl〉H2S〉PH3〉SiH4③离子的还原性:S2-〉Cl-〉Br->I-④氧化性:Cl2〉S〉Se〉Te⑤酸性:H2SO4〉H3PO4〉H2CO3〉HClO⑥非金属性:O〉N〉P〉Si⑦金属性:Be〈Mg〈Ca<KA.只有①B.①③C.②④⑤⑥⑦D.①③⑤答案B解析①中顺序应为S2->Cl-〉K+>Al3+,③中顺序应为S2->I-〉Br->Cl-.3.(2016·江苏)短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。
近年届高考化学一轮复习第五章物质结构元素周期律题组层级快练15原子结构(2021年整理)

2019届高考化学一轮复习第五章物质结构元素周期律题组层级快练15 原子结构编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019届高考化学一轮复习第五章物质结构元素周期律题组层级快练15 原子结构)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019届高考化学一轮复习第五章物质结构元素周期律题组层级快练15 原子结构的全部内容。
题组层级快练(十五)1.下列有关说法正确的是()A.112277Cn的原子核内中子数与核外电子数之差为55B. 92235U和 92238U是同位素,核反应属于化学变化C.40Ca2+与18O22-具有相同的电子数D.Si2O64-中质子总数为80答案C解析112277Cn的原子核内中子数和核外电子数分别为165、112,两者之差为53,A项错误;核反应不是化学变化,B项错误;40Ca2+和18O22-的电子数都是18,C项正确;Si2O64-中电子总数为80,质子总数为76,D项错误。
2.有以下六种原子:36Li、37Li、1123Na、1224Mg、 614C、 714N,下列相关说法不正确的是()A.36Li和37Li在元素周期表中所处的位置相同B. 614C和 714N质量数相等,二者互为同位素C.1123Na和1224Mg的中子数相同但不属于同种元素D.37Li的质量数和 714N的中子数相等答案B解析36Li和37Li质子数相同,中子数不同,二者互为同位素,A项正确; 614C和 714N的质子数不相等,二者不互为同位素,B项错误;1123Na和1224Mg质子数不相同,属于不同种元素,C项正确;37Li的质量数为7,714N的中子数也为7,D项正确。
近年高考化学总复习第5章物质结构,元素周期律第1节原子结构化学键模拟预测通关新人教版(2021年整

2019版高考化学总复习第5章物质结构,元素周期律第1节原子结构化学键模拟预测通关新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019版高考化学总复习第5章物质结构,元素周期律第1节原子结构化学键模拟预测通关新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019版高考化学总复习第5章物质结构,元素周期律第1节原子结构化学键模拟预测通关新人教版的全部内容。
第1节原子结构化学键一、选择题1.科研人员最近发现放射性元素钬(错误!Ho)可有效治疗肝癌。
下列说法正确的是( )A.该原子的相对原子质量为166B.该原子中含有的质子数为99C.该原子含有的电子数为67D.该原子的质子数比中子数多32解析:选C。
该原子的质量数为166,为该原子的相对原子质量近似整数值,A错误;该原子中含有的质子数为67,中子数为99,中子数比质子数多32,B、D错误;由原子中原子序数=核电荷数=质子数=核外电子数,可知钬原子含有的电子数为67,C正确。
2.某原子的核电荷数是其电子层数的5倍,质子数是其最外层电子数的3倍,则该原子的核电荷数为()A.11 B.15C.17 D.34解析:选B.该原子的电子层数若为2,则核电荷数是10,质子数是最外层电子数的错误!倍;若为3层,则核电荷数为15,质子数是最外层电子数的3倍,B项符合要求;若为4层,则核电荷数为20,质子数是最外层电子数的10倍.3.下列有关化学用语表示正确的是( )A.CaH2的电子式:B.NH4Cl的电子式:C.CO2的电子式:D.CH2F2的电子式:答案:A4.有以下六种原子:错误!Li、错误!Li、错误!Na、错误!Mg、错误!C、错误!N,下列相关说法不正确的是( )A.6,3Li和错误!Li在元素周期表中所处的位置相同B.错误!C和错误!N质量数相等,二者互为同位素C.错误!Na和错误!Mg的中子数相同但不属于同种元素D.73Li的质量数和错误!7N的中子数相等解析:选B. 错误!Li 和错误!Li质子数相同,中子数不同,二者属于同位素,A正确;14 6C和错误!N的质子数不相等,二者不互为同位素,B错误;错误! Na和2412Mg质子数不相同,属于不同种元素,C正确;73Li的质量数为7,错误!N 的中子数也为7,D正确.5.下列各组化合物中,化学键的类型相同的是( )A.CaCl2和Na2S B.Na2O和Na2O2C.CO2和NH4Cl D.HCl和NaOH解析:选A.A项,CaCl2和Na2S中都只有离子键;B项,Na2O只有离子键,而Na2O2除有离子键外,还有非极性共价键(过氧根离子中);C项,CO2中只有共价键,NH4Cl中既有离子键又有共价键;D项,HCl只有共价键,而NaOH 中除有共价键(氢氧根离子中)外,还有离子键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.2 元素周期表元素周期律
高效演练·直击高考
1.(2018·鞍山模拟)W、X、Y、Z为原子序数递增的四种短周期元素。
W是原子半径最小的元素,X的一种核素在考古时常用来鉴定一些文物的年代,Y是植物生长所需化学肥料中主要的营养元素之一,Z原子的最外层电子数是X原子最外层电子数的1.5倍。
下列说法正确的是( )
A.氢化物的沸点:Z一定高于Y
B.最高价氧化物对应水化物的酸性:X强于Y
C.W、X、Y、Z都能分别与氯元素形成共价化合物
D.仅由W、Y、Z三种元素组成的化合物不可能属于盐类
【解析】选C。
W、X、Y、Z为原子序数递增的四种短周期元素。
W是原子半径最小的元素,则W是H。
X的一种核素在考古时常用来鉴定一些文物的年代,所以X是C。
Y是植物生长所需化学肥料中主要的营养元素之一,则Y是N。
Z原子的最外层电子数是X原子最外层电子数的1.5倍,即最外层电子数是6,所以Z是O 或S。
A项,若Z为S,则硫化氢的沸点低于氨气的沸点,错误;B项,碳元素的非金属性弱于氮,则最高价氧化物对应水化物的酸性:H2CO3弱于HNO3,错误;C项,W、X、Y、Z都能分别与氯元素形成共价化合物,例如HCl、CCl4、NCl3、ClO2、SCl2,正确;D项,仅由W、Y、Z三种元素组成的化合物可能属于盐类,例如硝酸铵是盐类,错误。
2.(2018·湘潭模拟) 2017年5月9日发布了113号Nh、115号Mc、117号Ts、118号Og这4种新元素的中文名称,分别为“”(nǐ)、“镆”(mò)、“”
(tián)、“”(ào)。
下列有关说法正确的是( )
A.115号元素在周期表中的位置是第7周期ⅤB
B.这四种元素都是主族元素
C.118号元素在通常情况下呈气态,其余三种为固态
D.117号元素Ts位于金属非金属分界线上,可能是半导体,与它同族的上一周期元素的原子序数为99
【解析】选C。
A.第7周期稀有气体原子序数=86+32=118,是第7周期最后一种元素,位于18列,115号元素处于第15列,故115号元素位于第7周期第ⅤA族,故A错误;B. 第7周期稀有气体原子序数=86+32=118,是第7周期最后一种元素,位于18列,113号Nh、115号Mc、117号Ts、118号Og这4种位于ⅢA、ⅤA、ⅦA和0族,故B错误;C. 根据元素周期律,稀有气体118号元素在通常情况下呈气态,卤素中的碘为固体,则117号Ts为固体,第ⅤA族的P为固体,则115号Mc为固体,第ⅢA族的113号Nh为金属元素,为固态,故C正确;D.117号元素Ts位于第7周期,第ⅦA族,是金属非金属分界线附近的金属元素,属于导体,与它同族的上一周期元素的原子序数为117-32=85,故D错误。
3.(新题预测)X、Y、Z、R、W是原子序数依次增大的五种短周期元素。
Y和R同主族,可组成共价化合物RY2;Y 和Z最外层电子数之和与W的最外层电子数相同;25 ℃时,0.1 mol·L-1X和W形成化合物的水溶液pH为1。
下列说法正确的是( )
A.Y和其他四种元素均可形成至少两种化合物(两种元素组成)
B.R元素的最高价氧化物的水化物酸性最强
C.原子半径:X<Y<Z<R<W
D.由Y、Z、W三种元素组成化合物的水溶液一定显碱性
【解析】选A。
由“Y和R同主族,可组成共价化合物RY2”推出Y是O,R是S;由“25 ℃时,0.1 mol·L-1X 和W形成化合物的水溶液pH为1”及五种短周期元素原子序数大小关系推出X是H,W是Cl;再根据Y、Z、W最外层电子数的关系可推出Z为Na。
O和H可形成H2O、H2O2,O和Na可形成Na2O、Na2O2,O和S可形成SO2和SO3,O和Cl可形成Cl2O、ClO2、Cl2O7等,A项正确;短周期元素的最高价含氧酸中HClO4的酸性最强,B项错误;原子半径:Na>S>Cl>O>H,C项错误;NaClO4是强酸强碱盐,溶液呈中性,D项错误。
4.(2017·天津高考)根据元素周期表和元素周期律,判断下列叙述不正确的是
( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族
【解析】选C。
元素的非金属性决定气态氢化物的稳定性,由于非金属性:O>N>Si,所以气态氢化物的稳定性:H2O>NH3>SiH4,A正确;氢元素可以与氧元素、氮元素等形成水、氨气等共价化合物,也可与Na等元素形成离子化合物,B正确;如图示实验可证明酸性HCl>H2CO3>H2SiO3,但元素的非金属性的强弱与元素的最高价氧化物对应的水化物的酸性强弱有关,HCl不是氯元素的最高价氧化物所对应的水化物,故不能根据酸性强弱来判断氯和碳的非金属性强弱,C不正确;根据元素周期表可知,D正确。
5.(新题预测)X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的一种氧化物是红棕色气体。
请回答:
(1)Q元素在元素周期表中的位置为______________________。
(2)Z、J两元素对应的简单离子的半径从大到小顺序为________(填离子符号)。
(3)元素的非金属性:Z________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有__________(填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的一种氢化物发生氧化还原反应的化学方程式为________。
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸碱性恰好相反,写出A的电子式:__________;B 的水溶液不呈中性的原因:_____________
_________(用离子方程式表示)。
(6)液态A类似X2Z,也能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
___________________________。
【解析】元素Z在地壳中含量最高,是O;J元素的焰色反应呈黄色,是Na;Q的最外层电子数与其电子总数之比为3∶8,即最外层电子数是6,Q是S;X能与J形成离子化合物,且J+的半径大于X-的半径,则X是H,不是F(Na+的半径小于F-的半径);Y的一种氧化物是红棕色气体,则Y是N。
(1)S在元素周期表的第3周期第ⅥA族。
(2)Na+和O2-核外电子层结构相同,核电荷数越大,半径越小,故r(O2-)>r(Na+)。
(3)Q的氢化物的水溶液放置在空气中会变浑浊,即氧气置换出S,非金属性O>S,A不符合题意;根据O与S 之间形成的化合物中S的化合价为正价知非金属性O>S,B不符合题意;不能根据氧气和S单质的状态判断非金属性强弱,C符合题意;同主族由上到下元素的非金属性逐渐减弱,即非金属性O>S,D不符合题意。
(4)硫化氢与过氧化氢可发生氧化还原反应:H2O2+H2S S↓+2H2O。
(5)根据题意A是氨气,B是N,N水解使溶液呈酸性。
(6)液氨的电离类似水,电离生成N、N。
答案:(1)第3周期第ⅥA族
(2)O2->Na+
(3)> C
(4)H2O2+H2S S↓+2H2O
(5) N+H2O NH3·H2O+H+
(6)2NH3 N+N。
