葡萄球菌的SOP文件
检验科细菌耐药性监测标准操作程序SOP文件

检验科细菌耐药性监测SOP文件一、耐甲氧西林葡萄球菌(Methicillin-Resistant Staphylococci,MRS)MRS是引起临床感染的常见病原菌,同时也是引起医院感染的重要病原菌之一,其耐药特点是耐受甲氧西林的同时,还对临床广泛应用的多种抗生素呈现多重耐药,因而该菌所致感染已成为临床治疗的一大难题。
(一)MRS测定方法1、纸片扩散法接种物:直接悬液法从非选择琼脂平皿上挑取少许单个菌落至无菌生理盐水调至浓度0.5 McFarland,具体操作同常规纸片法药敏试验。
苯唑西林纸片,1μg/片,检测MRS平板应置于35℃(而不是37℃)孵育24h(而不是16~18h)。
结果判断:金黄色葡萄球菌:S:≥13mm;I:11~12mm;R:≤10mm。
凝固酶阴性葡萄球菌:S:≥18mm;R≤17mm。
对于苯唑西林纸片周围的抑菌圈内有任何小菌落或稀薄“菌膜”生长都应列为MRS。
2、琼脂筛选法:如果纸片试验结果中介时,可做琼脂筛选法,培养基为MH琼脂+6μg/ml苯唑西林+4%NaCl,调整菌液浓度0.5McFarland,于35℃孵育24h,凡有任何生长即使一个菌落均报MRS。
(二)MRS监测意义对于MRS,应报告对所有头孢菌素类和其他β-内酰胺酶类耐药,喹喏酮类药物,除氟哌酸外,环丙氟哌酸,氟嗪酸有较好抗菌活性(耐药率10~23%之间),利福平敏感率在90%以上,未见耐万古霉素菌株,但已有万古霉素中介金黄色葡萄球菌。
二、高水平耐药的肠球菌(HLAR)及耐万古霉素的肠球菌(VRE)(一)药敏测定方法1、常规测定方法:采用K-B纸片扩散法,头孢菌素不用做(均为耐药),氨苄,庆大霉素,替考拉宁,万古霉素一定要做。
2、高水平氨基糖甙类耐药性测定:⑴高含量纸片扩散法:通常测定庆大霉素和链霉素的高度耐药性,具体操作如常规纸片法药敏试验。
药敏纸片:庆大霉素:120μg/片;链霉素300μg/片结果判断:R:≤6mm;I:7~9mm;S:≥10mm⑵含单一高浓度抗生素琼脂平皿法:稀释法:庆大霉素:R:≥500μg/ml;链霉素:R:2000μg/ml3、万古霉素耐药性测定:纸片扩散法,具体操作如常规纸片法药敏试验,万古霉素纸片为:30μg/片,检测平皿置35℃24h(而不是16~18h),并注意抑菌圈内有无小菌落或薄膜生长。
钴60辐照灭菌生物指标菌(金黄色葡萄球菌)使用SOP

1.目的:建立钴60辐照灭菌生物指标菌——金黄色葡萄球菌CVCC1882的使用规程,保证正确使用,对钴60辐照灭菌效果进行验证。
2.适用范围:适用于用钴60辐照灭菌生物指标菌——金黄色葡萄球菌CVCC1882对钴60辐照灭菌效果进行的监测。
3.职责:钴60辐照灭菌操作人员、QA人员、QC微生物检验员对本标准的实施负责。
4.方法:4.1金黄色葡萄球菌作为供试品无菌检查的阳性对照菌。
4.2 培养基的制备4.2.1营养肉汤培养基胨 10.0g,氯化钠 5.0g,牛肉浸出粉 3.0g,水 1000mL。
取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,调节pH值使灭菌后为7.2±0.2,分装,灭菌。
4.2.2 营养琼脂培养基按上述4.2.1营养肉汤培养基的处方及制法,加入14.0g琼脂,调节pH使灭菌后为7.2±0.2,分装,灭菌。
4.2.3 硫乙醇酸盐流体培养基(用于培养好氧菌、厌氧菌)酪胨(胰酶水解) 15.0g,氯化钠 2.5g,葡萄糖 5.0g,新配制的0.1%刃天青溶液1.0mL,硫乙醇酸钠(或硫乙醇酸 0.3mL) 0.5g,L-胱氨酸 0.5g,琼脂 0.75g,酵母浸出粉 5.0g,水 1000mL。
除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH值使灭菌后为7.1±0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20分钟),迅速冷却,只限加热一次,并应防止被污染。
硫乙醇酸盐流体培养基置30~35℃培养。
4.2.3 改良马丁培养基(用于培养真菌)胨 5.0g,磷酸氢二钾 1.0g,酵母浸出粉身碎骨2.0g,硫酸镁 0.5g,葡萄糖 20.0g,水 1000mL。
耐甲氧西林葡萄球菌检测标准操作程序

SOP_15-26 耐甲氧西林葡萄球菌检测标准操作程序
【目的】
筛选耐甲氧西林葡萄球菌。
【适用范围】
临床分离的具有意义的所有葡萄球菌。
【该SOP变动程序】
本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:专业主管、科主任。
【试剂】MH平板、头孢西丁、苯唑西林等。
【方法】
1.纸片扩散法(推荐)
纸片扩散法检出耐甲氧西林的葡萄球菌株是可靠方法之一。
挑选来自过夜琼脂平板的培养物,制备被检菌株的悬液,调整至适当浓度,具体操作如常规纸片法药敏试验一样,贴苯唑青霉素(1μg/片)或头孢西丁(30μg/片)孵育33-35℃,整24h(不可延长),小心挑选模糊生长的培养物,或在抑菌环内的菌落,这类微生物提示耐甲氧西林菌株。
若检测凝固酶阴性葡萄球菌时,则孵育时间延长至48h。
2.微量肉汤稀释法
为检测抗葡萄球菌的抗生素MICs,CLSI最近推荐使用加有阳离子和补充2%NaCl的MHB 培养基(M-H肉汤),接种5×105/m1被检菌株悬液,孵育35℃,24h,用苯唑西林检测金黄色葡萄球菌,凝固酶阴性葡萄球菌也可选用甲氧西林检出异质性耐药菌株。
3.琼脂筛选法
琼脂筛选是用M-H琼脂,补充4%NaCl和苯唑青霉素(6μg/m1)或甲氧西林(10μg/m1)倾注成平板,调整被检菌悬液为0.5号麦氏管浓度,用棉拭子浸沾菌悬液,涂于平板上,35℃整24h,检查平板中生长的菌落,甚至只有一个菌落,提示耐苯唑西林菌株。
用于检出凝固酶阴性葡萄球菌时,孵育48h,增加敏感性。
【相关文件】2009年以后CLSI《抗生素敏感性试验执行标准》。
微生物金黄色葡萄球菌的操作规程

凡在上述选择平板上有可疑菌落生长,经染色镜检,证明为革兰氏阳性葡萄球菌,血浆凝固酶实验阳性,可报告检出金黄色葡萄球菌。
5.4血琼脂培养1采样方法见GB18204.4-2013附录A
6.2将1ml样品放入9ml氯化钠肉汤或胰酪胨大豆肉汤培养基中,36℃培养24h。
6.3从培养液中取1接种环-2接种环,划线接种在Baird Parker平板或用血琼脂培养基,于36℃培养24h。在Baird Parker平板培养基上菌落为圆形、光滑、凸起湿润、颜色呈黑灰色、边缘整齐、周围浑浊、外层有一透明带;在血琼脂平板上菌落呈圆形、金黄色、凸起、表面光滑、周围有溶血圈。
6.4挑取典型菌落作涂片染色镜检,为革兰氏阳性,呈葡萄状排列。
6.5血浆凝固酶实验:吸取1:4新鲜血浆0.5ml放入灭菌小试管中,再加入待测检菌24h肉汤培养物0.5ml。混匀,放36℃温箱或水浴锅中,每30min观察1次,24h之内如呈现凝块即为阳性。同时以已知血浆凝固酶阳性和阴性菌株肉汤培养物及肉汤培养基各0.5ml,分别加入小试管内与1:4血浆0.5ml混匀,作为对照。
四、设备和材料
4.1恒温培养箱
4.2电炉或微波炉。
4.3恒温水浴箱
4.4显微镜
4.5天平
4.6离心机
4.7高压灭菌锅
4.8无菌试管、平皿(直径9cm)、刻度吸管等。
4.9PH计或PH试纸。
4.10载玻片
4.11酒精灯
五、培养基和试剂
5.1胰酪胨大豆肉汤
5.2氯化钠肉汤(75g/L)
5.3Baird Parker平板
作业指导书1
文件编号:
版本号/修订状态:
金黄色葡萄球菌的测定
页码/总页数:
实施日期:
葡萄球菌属检验
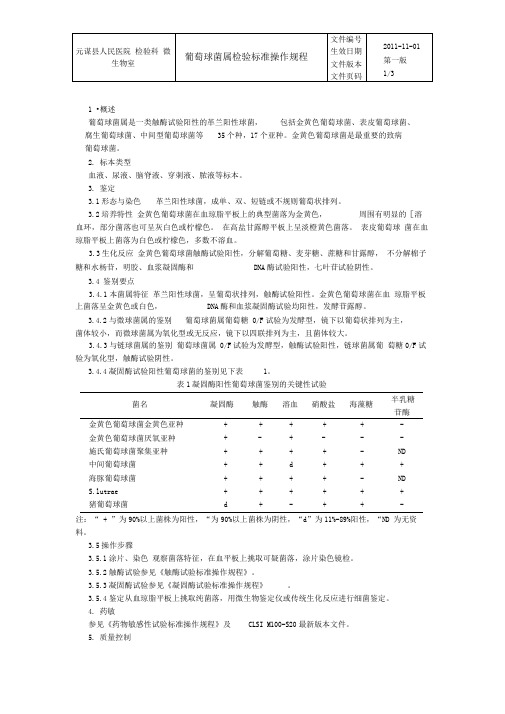
1 •概述葡萄球菌属是一类触酶试验阳性的革兰阳性球菌,包括金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、中间型葡萄球菌等35个种,17个亚种。
金黄色葡萄球菌是最重要的致病葡萄球菌。
2.标本类型血液、尿液、脑脊液、穿刺液、脓液等标本。
3.鉴定3.1形态与染色革兰阳性球菌,成单、双、短链或不规则葡萄状排列。
3.2培养特性金黄色葡萄球菌在血琼脂平板上的典型菌落为金黄色,周围有明显的[溶血环,部分菌落也可呈灰白色或柠檬色。
在高盐甘露醇平板上呈淡橙黄色菌落。
表皮葡萄球菌在血琼脂平板上菌落为白色或柠檬色,多数不溶血。
3.3生化反应金黄色葡萄球菌触酶试验阳性,分解葡萄糖、麦芽糖、蔗糖和甘露醇,不分解棉子糖和水杨苷,明胶、血浆凝固酶和DNA酶试验阳性,七叶苷试验阴性。
3.4 鉴别要点3.4.1本菌属特征革兰阳性球菌,呈葡萄状排列,触酶试验阳性。
金黄色葡萄球菌在血琼脂平板上菌落呈金黄色或白色,DNA酶和血浆凝固酶试验均阳性,发酵苷露醇。
3.4.2与微球菌属的鉴别葡萄球菌属葡萄糖0/F试验为发酵型,镜下以葡萄状排列为主,菌体较小,而微球菌属为氧化型或无反应,镜下以四联排列为主,且菌体较大。
3.4.3与链球菌属的鉴别葡萄球菌属0/F试验为发酵型,触酶试验阳性,链球菌属葡萄糖0/F试验为氧化型,触酶试验阴性。
3.4.4凝固酶试验阳性葡萄球菌的鉴别见下表1。
表1凝固酶阳性葡萄球菌鉴别的关键性试验半乳糖菌名凝固酶触酶溶血硝酸盐海藻糖苷酶金黄色葡萄球菌金黄色亚种+ + + + + - 金黄色葡萄球菌厌氧亚种+ - + - - - 施氏葡萄球菌聚集亚种+ + + + - ND 中间葡萄球菌+ + d + + + 海豚葡萄球菌+ + + + - ND S.lutrae + + + + + + 猪葡萄球菌 d + - + + -注:“ + ”为90%以上菌株为阳性,“为90%以上菌株为阴性,“d”为11%-89%阳性,“ND 为无资料。
生化药敏实验葡萄球菌的实验流程

生化药敏实验葡萄球菌的实验流程1.首先,准备好生化药敏实验所需的培养基和试剂。
First, prepare the culture medium and reagents required for the biochemical sensitivity test.2.从实验对象中取得葡萄球菌的样本。
Obtain a sample of Staphylococcus from the test subject.3.将葡萄球菌培养在含有营养物质的琼脂平板上。
Culture the Staphylococcus on a nutrient-rich agar plate.4.将平板放入孵育箱中,使葡萄球菌在37°C下培养24小时。
Place the plate in an incubator and culture the Staphylococcus at 37°C for 24 hours.5.从培养好的葡萄球菌中挑出一些细菌,进行药敏试验。
Pick some bacteria from the cultured Staphylococcus for sensitivity testing.6.在含有不同抗生素的药敏试验培养基上涂抹葡萄球菌样本。
Streak the Staphylococcus sample onto sensitivity testing medium containing different antibiotics.7.将培养基板放置在孵育箱中,培养葡萄球菌对抗生素的敏感性。
Place the culture plates in an incubator to culture the sensitivity of Staphylococcus to antibiotics.8.检查培养基上是否出现抑菌圈,记录葡萄球菌对各种抗生素的敏感性。
Check for inhibition zones on the culture plates andrecord the sensitivity of Staphylococcus to various antibiotics.9.根据抗生素的敏感性结果,选择合适的治疗药物。
钴60辐照灭菌生物指标菌(金黄色葡萄球菌)使用SOP

1.目的:建立钴60辐照灭菌生物指标菌——金黄色葡萄球菌CVCC1882的使用规程,保证正确使用,对钴60辐照灭菌效果进行验证。
2.适用范围:适用于用钴60辐照灭菌生物指标菌——金黄色葡萄球菌CVCC1882对钴60辐照灭菌效果进行的监测。
3.职责:钴60辐照灭菌操作人员、QA人员、QC微生物检验员对本标准的实施负责。
4.方法:4.1金黄色葡萄球菌作为供试品无菌检查的阳性对照菌。
4.2 培养基的制备4.2.1营养肉汤培养基胨 10.0g,氯化钠 5.0g,牛肉浸出粉 3.0g,水 1000mL。
取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,调节pH值使灭菌后为7.2±0.2,分装,灭菌。
4.2.2 营养琼脂培养基按上述4.2.1营养肉汤培养基的处方及制法,加入14.0g琼脂,调节pH使灭菌后为7.2±0.2,分装,灭菌。
4.2.3 硫乙醇酸盐流体培养基(用于培养好氧菌、厌氧菌)酪胨(胰酶水解) 15.0g,氯化钠 2.5g,葡萄糖 5.0g,新配制的0.1%刃天青溶液1.0mL,硫乙醇酸钠(或硫乙醇酸 0.3mL) 0.5g,L-胱氨酸 0.5g,琼脂 0.75g,酵母浸出粉 5.0g,水 1000mL。
除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH值使灭菌后为7.1±0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20分钟),迅速冷却,只限加热一次,并应防止被污染。
硫乙醇酸盐流体培养基置30~35℃培养。
4.2.3 改良马丁培养基(用于培养真菌)胨 5.0g,磷酸氢二钾 1.0g,酵母浸出粉身碎骨2.0g,硫酸镁 0.5g,葡萄糖 20.0g,水 1000mL。
生化药敏实验葡萄球菌的实验流程

生化药敏实验葡萄球菌的实验流程English response:The experiment process of the biochemical drugsensitivity test for Staphylococcus aureus involves several steps.1. Inoculation: The first step is to inoculate the Staphylococcus aureus bacteria onto a nutrient agar plate using a sterile inoculating loop. This is done to create a culture of the bacteria for the subsequent tests.2. Preparation of antibiotic discs: Antibiotic discs containing different antibiotics are then placed onto the agar plate. These discs release the antibiotics into the agar, creating a concentration gradient of the antibiotic around the disc.3. Incubation: The agar plate is then incubated at the optimal temperature for the growth of Staphylococcus aureus,typically around 37 degrees Celsius. During this time, the bacteria will grow and form colonies on the agar plate.4. Measurement of inhibition zones: After incubation,the agar plate is examined for the presence of clear zones around the antibiotic discs. The diameter of these zones is measured and compared to standardized values to determinethe sensitivity of the bacteria to the antibiotics.5. Data analysis: The results of the experiment arethen analyzed to determine the sensitivity of the Staphylococcus aureus bacteria to the different antibiotics tested. This information is important for guiding the selection of appropriate antibiotics for treatinginfections caused by this bacterium.中文回答:生化药敏实验葡萄球菌的实验流程包括以下几个步骤。
生化药敏实验葡萄球菌的流程

生化药敏实验葡萄球菌的流程英文回答:Biochemical sensitivity testing for Staphylococcus aureus involves a series of steps to determine the susceptibility of the bacteria to different antibiotics. This testing is crucial in guiding the choice ofappropriate antibiotics for treatment.First, a pure culture of Staphylococcus aureus is obtained. This can be done by swabbing a suspected infected site or by using a clinical specimen such as blood or urine. The culture is then streaked onto a solid agar medium, such as Mueller-Hinton agar, using a sterile inoculating loop.Next, antibiotic discs are placed onto the agar surface. These discs contain specific concentrations of different antibiotics. The antibiotics chosen are based on the suspected resistance patterns of Staphylococcus aureus and the local epidemiology. Common antibiotics used includemethicillin, oxacillin, vancomycin, and cefoxitin.The agar plates are then incubated at the optimal temperature for Staphylococcus aureus growth, usually around 37 degrees Celsius, for 18 to 24 hours. During this time, the bacteria will grow and form colonies on the agar surface.After incubation, the plates are examined for zones of inhibition around the antibiotic discs. The presence of a clear zone around a disc indicates that the antibiotic has effectively inhibited the growth of Staphylococcus aureus. The diameter of the zone is measured and compared to standardized interpretive charts to determine the susceptibility of the bacteria to the antibiotic.Based on the size of the zone, the bacteria can be classified as susceptible, intermediate, or resistant to the antibiotic. Susceptible bacteria are inhibited by the antibiotic and are likely to respond well to treatment. Intermediate bacteria may show some response to the antibiotic but may require higher doses or combinationtherapy. Resistant bacteria are not affected by the antibiotic and alternative treatment options must be considered.In addition to measuring zones of inhibition, some laboratories also perform minimum inhibitory concentration (MIC) testing. MIC is the lowest concentration of an antibiotic that prevents visible growth of the bacteria. This testing provides more detailed information about the susceptibility of the bacteria and can help guide treatment decisions.Overall, biochemical sensitivity testing for Staphylococcus aureus is a critical step in determining the most effective antibiotics for treatment. It allows healthcare providers to make informed decisions and tailor treatment regimens to individual patients.中文回答:生化药敏实验是用来确定葡萄球菌对不同抗生素的敏感性的一系列步骤。
生化药敏实验葡萄球菌的流程

生化药敏实验葡萄球菌的流程英文回答:Biochemical sensitivity testing is a laboratory technique used to determine the susceptibility of bacteria to different antibiotics. In this process, Staphylococcus aureus, a common bacterium responsible for various infections, is tested for its response to different antibiotics.The first step in the process is to obtain a pure culture of Staphylococcus aureus. This can be done by swabbing a suspected infection site, such as a wound or a nasal cavity, and streaking the swab onto a culture medium. The culture medium provides the necessary nutrients for the bacteria to grow and multiply. After incubating the culture medium for a certain period of time, individual colonies of Staphylococcus aureus can be observed.Once a pure culture of Staphylococcus aureus isobtained, the next step is to prepare a suspension of the bacteria. This involves transferring a small amount of the bacterial colonies into a sterile saline solution and adjusting the concentration of the suspension to a standardized level. This ensures that the bacteria are present in a consistent number for testing.The next step is to prepare a series of test tubes, each containing a different antibiotic. The antibiotics used in the testing are chosen based on their known effectiveness against Staphylococcus aureus. The test tubes are inoculated with the bacterial suspension, and then incubated for a specific period of time.After the incubation period, the test tubes are examined for the presence or absence of bacterial growth. If there is no growth in a particular test tube, it indicates that the bacteria are sensitive to that antibiotic. On the other hand, if there is growth in a test tube, it means that the bacteria are resistant to that antibiotic.Based on the results of the sensitivity testing, a profile of the susceptibility of Staphylococcus aureus to different antibiotics can be determined. This information is valuable in guiding the choice of appropriate antibiotics for the treatment of Staphylococcus aureus infections.中文回答:生化药敏实验是一种用于确定细菌对不同抗生素的敏感性的实验技术。
葡萄球菌药敏实验流程

葡萄球菌药敏实验流程英文回答:Staphylococcus aureus is a common bacterium that can cause various infections in humans. To determine the susceptibility of Staphylococcus aureus to different antibiotics, a drug sensitivity test, also known as an antibiotic susceptibility test, is performed. This test helps in selecting the appropriate antibiotic for the treatment of infections caused by Staphylococcus aureus.The following is a general outline of the procedure for conducting a Staphylococcus aureus drug sensitivity test:1. Isolation and identification of Staphylococcus aureus: The first step is to isolate and identify the Staphylococcus aureus strain from the clinical sample, such as blood, wound swab, or urine.2. Preparation of the bacterial suspension: A pureculture of Staphylococcus aureus is prepared by streaking the isolated colonies on a nutrient agar plate. A few colonies are then transferred to a tube containing asterile saline solution, and the suspension is adjusted to match the turbidity of a 0.5 McFarland standard.3. Inoculation of the Mueller-Hinton agar plate: Usinga sterile cotton swab, the bacterial suspension is evenly spread on the surface of a Mueller-Hinton agar plate. This agar medium is commonly used for antibiotic susceptibility testing.4. Placement of antibiotic discs: Sterile antibiotic discs impregnated with different antibiotics are placed on the surface of the agar plate. The selection of antibiotics depends on the suspected infection and the local resistance patterns.5. Incubation: The agar plate is then incubated at 35-37°C for 18-24 hours. During this time, the bacteria grow and form visible colonies on the agar surface.6. Measurement of inhibition zones: After incubation, the plate is examined, and the diameter of the clear zones around each antibiotic disc is measured. These zones indicate the susceptibility of the bacteria to the respective antibiotics. Larger zones indicate greater sensitivity, while smaller or no zones indicate resistance.7. Interpretation of results: The measured zone diameters are compared to the interpretive standards provided by organizations such as the Clinical and Laboratory Standards Institute (CLSI). These standards categorize the bacteria as susceptible, intermediate, or resistant to each antibiotic.8. Reporting of results: The results of the drug sensitivity test are reported, indicating which antibiotics are effective against the Staphylococcus aureus strain and which are not. This information helps guide the selection of appropriate antibiotics for treatment.中文回答:葡萄球菌是一种常见的细菌,可以引起人类各种感染。
(705)金黄色葡萄球菌检验操作程序ZL-SOP-QC-705A

编码:ZL-SOP-QC-705A金黄色葡萄球菌检验操作程序1.目的:建立金黄色葡萄球菌检验的标准操作程序,保证正确操作。
2. 适用范围:本标准适用于金黄色葡萄球菌检验。
3. 职责:质量技术部QC4. 引用标准:GB-4789.10-2010 食品微生物学检验金黄色葡萄球菌检验5. 内容5.1 金黄色葡萄球菌检验:适用于食品中金黄色葡萄球菌检验。
5.2 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:⑴恒温培养箱:36 ℃±1 ℃。
⑵冰箱:2 ℃~5 ℃。
⑶恒温水浴箱:37 ℃~65 ℃。
⑷天平:感量 0.1 g。
⑸均质器。
⑹振荡器。
⑺无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。
⑻无菌锥形瓶:容量 100 mL、500 mL。
⑼无菌培养皿:直径 90 mm。
⑽注射器:0.5 mL。
⑾ pH 计或 pH 比色管或精密 pH 试纸。
5.3 培养基和试剂5.3.1 10 %氯化钠胰酪胨大豆肉汤:见附录 A 中 A.1。
5.3.2 7.5 %氯化钠肉汤:见附录 A 中 A.2。
5.3.3 血琼脂平板:见附录 A 中 A.3。
5.3.4 Baird-Parker 琼脂平板:见附录 A 中 A.4。
5.3.5 脑心浸出液肉汤(BHI) :见附录 A 中 A.5。
5.3.6 兔血浆:见附录 A 中 A.6。
5.3.7 稀释液:磷酸盐缓冲液:见附录 A 中 A.7。
5.3.8 营养琼脂小斜面:见附录 A 中 A.8。
5.3.9 革兰氏染色液:见附录 A 中 A.9。
5.3.10 无菌生理盐水:见附录 A 中 A.10。
第一法金黄色葡萄球菌定性检验5.4 检验程序金黄色葡萄球菌定性检验程序见图1。
图1 金黄色葡萄球菌检验程序5.5 操作步骤5.5.1 样品的处理称取 25 g 样品至盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌均质杯内, 8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌均质袋中,用拍击式均质器拍打 1 min~2 min。
葡萄球菌属的常规鉴定标准操作程序

葡萄球菌属的常规鉴定标准操作程序葡萄球菌属的常规鉴定标准操作程序1 概述葡萄球菌属是一类触媒试验阳性的革兰阳性球菌,包括金黄色葡萄球菌,表面葡萄球菌、腐生葡萄球菌等32个种。
是临床最常见的化脓性球菌,广泛分布于自然界中,在人体表面鼻、咽、肠道也经常存在。
2 形态与染色革兰阳性球菌,直径0.4~1.2µm成单、双、短链或不规则状排列。
在液体培养基浓汁标本中,往往排列成双或短链状多数有鞭毛。
3 培养特性金黄色葡萄球菌在血琼脂平板上典型菌落为金黄色,周围有明显的透明(β)溶血环,部分菌落呈橙色,在高盐甘露醇平板上呈橙色菌落。
表皮葡萄球菌等其他葡萄球菌在血琼脂平板上菌落为白色或柠檬色,不溶血。
4 生化反应触酶试验阳性,多数能分解葡萄糖、麦蚜糖、蔗糖和甘露醇。
不分解棉籽糖和水杨苷,液化明胶,血浆凝固酶和DNA酶实验分阳性。
5 鉴别要点5.1 本菌属特征:触酶实验阳性,革兰阳性球菌,葡萄状排列,菌落中等大小,中等干燥。
5.2 与微球菌属的鉴别:触酶实验都为阳性,但O∕F试验葡萄球菌属为发酵型,而微球菌为氧化型或无反应,而且菌体较葡萄菌属更大,排列呈四联状为主。
5.3 与链球菌属的鉴别:葡萄球菌属触酶试验都为阳性,而链球菌为阴性,O∕F试验葡萄球菌属为发酵型而链球菌为氧化型。
5.4 凝固酶阳性葡萄球菌的鉴别见下表。
结合型凝游离型凝鸟氨酸脱菌名PYP试验DNA试验VP试验固酶试验固酶试验羧酶实验金黄色葡萄球菌+ + - + + -中间型葡萄球菌- + + + - -施氏葡萄球菌+ - + + + -路邓葡萄球菌+ - + - + +注:“+”为90%以上菌株为阳性,“--”为90%以上菌株为阳性。
5.5 凝固酶阳性葡萄球菌的鉴别见下表+腐生葡萄球菌——+ V + +—溶血葡萄球菌+ ——V + ——人型葡萄球菌——+ —+ ——华纳葡萄球菌——+ V + ——模仿葡萄球菌+ —+ + + ——头状葡萄球菌——V + + ——耳葡萄球菌V ———V ——施氏葡萄球菌+ + —————路邓葡萄球菌+ V V — + —V注:“+"为90%以上菌株为阳性,“—”为90%以上菌株为阴性。
精品SN0172-92出口食品中金黄色葡萄球菌检验方法

SN0172-92代替ZBX09003-86Methodfordetectionofstaphylococcusaureusinfoodforexport1、主题内容与适用范围本标准规定了出口食品中金黄色葡萄球菌的检验方法。
本标准适用于出口食品的检验。
2、设备和材料2.1 供常规平板计数用的基本设备与材料。
2.2L形玻璃棒。
3 培养基和试剂3.1 普通肉汤培养基。
3.2 胰蛋白胨大豆肉汤。
3.3Baird-Parker培养基。
3.4 甲苯胺蓝-DNA琼脂。
3.5 生理盐水。
3.6 凝固酶试验兔血浆。
4、样品制备4.1 固体或半固体食品:以无菌操作称取25g样品,放入装有225mL灭菌生理盐水的灭菌均质杯内,于8000r/min均质1~2min,制成1:10样品匀液。
4.2液体食品:用灭菌吸管吸取25mL样品,放入装有225mL灭菌生理盐水的灭菌玻璃瓶内(瓶内预置适当数量的玻璃珠),经充分振摇制成1:10样品匀液。
4.3 供计数检验时,可按十进位递增稀释法将样品匀液再进行适当稀释。
5、检验步骤5.1 最近似值(MPN)测定法适用于检测认为带有大量竞争菌的食品及其原料和未经处理的食品中的少量金黄色葡萄球菌。
5.1.1 选三个连续稀释度,从每个稀释度分别取1mL稀释样品液,接种3管含10%氯化钠胰蛋白胨大豆肉汤。
样品的最高稀释度必须达到能获得阴性终点,置36±1℃培养48h。
5.1.2 用3mm接种环,从有细菌生长的各管中移取1环,划线接种于表面干燥的Baird-Parker琼脂平板,置36±1℃培养45~48h。
5.1.3从有细菌生长的每一平板上至少挑取1个可疑金黄色葡萄球菌菌落[见附录B(参考件)],移种到肉汤培养基中,置36±1℃培养20~24h。
5.1.4 取肉汤培养物0.3mL同0.5mL凝固酶试验兔血浆于8mm×100mm试管内充分混合,置36±1℃培养,定时观察是否有凝块形成,至少观察6h,以内容物完全凝固,使试管倒置或倾斜时不流动者为阳性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
葡萄球菌的SOP文件
葡萄球菌属(Staphyloccus) sop文号: 作者:批准人及签名: 日期: 实验方法的审批和修正(每十二个月或有任何修需主任签名) 修正内容: 日期: 主任签名: 实验方法的废止日期: 批准人签名: 1. 生化学特性葡萄球菌是革兰氏阳性球菌,大小0.5---1.5um,呈单、双四联、短链状(3—4个细胞)或无规则葡萄状排列.无动力,无芽胞.其代谢方式是呼吸兼发酵.触酶阳性.通常氧化酶阴性,还原硝酸盐,能被溶葡萄球菌素溶菌,但不被溶菌酶溶菌.能利用多种碳水化合物,产酸.产生胞外酶,如葡萄球菌凝固酶.多数菌为兼性厌氧菌,有氧条件下生长好,最适生长温度35--40℃最适pН7.0—7.5. DNA中G+C含量:30--39 mol%. 模式菌:金黄色葡萄球菌. 常见各菌种的生化反应特性如表Ⅰ 2. 临床意义: 葡萄球菌是人类化脓性感染的最重要的病原菌.可引起局部毛囊炎、疖肿、蜂窝组织炎、肺炎、心胞炎、骨髓炎、肾盂肾炎、肾脓肿、化脓性脑膜炎、败血症、脓毒血症、食物中毒、中毒性休克综合症(TSS )等疾病。
3.标本:根据病种及检查目的的不同,采集不同标本。
3.1标本种类:脓汁、渗出液、咽拭子、血液、脑脊液、痰等,如疑为食物中毒的患者,应分别采集剩余食物、呕吐物、和粪便。
3.2采取方式:按不同标本要求采集(见另外SOP)3.3标本要求:按不同标本的要求判定是否合格(见另外SOP)。
3.4预处理:按不同标本要求进行(见另外SOP)。
4.仪器和设备:4.1SDA型超净工作台(770×590×600mm):北京四达净化技术研究所 4.2 CHK型光学显微镜:日本Olympus株式会社 4.3 HH.BH11型孵育箱:上海市跃进医疗器械一厂 4.4 接种器具与火焰灯: 上海求精生化仪器厂 4.5 YXQ.SG46.28Q型手提式高压灭菌锅:哈尔滨松花江医疗器械厂 4.6 GL-360型冰箱:美国好运公司5.试剂:5.1种类及品号:革兰氏染色液D014 血平板B108 血液增菌培养基B150 高盐甘露醇琼脂平板B154 5%Nacl琼脂B134 氧化酶试剂D012 氧化酶试纸D013 新生霉素纸片C038 兔血浆(EDTA抗凝)自制OF试验培养基A088 3%H2O2溶液E062 杆菌肽纸片(0.04u/片) C037 呋喃唑酮纸片(100µg/片)C082 其它各种生化反应用培养基及配套试剂(具体种类见前面列表)。
以上试剂均為天和微生物試剂有限公司。
5.2保存:试剂应严格按有关要求登记、保存。
5.2.1培养基类:应在2--8℃冰箱保存。
5.2.2药敏纸片类:应在-20℃冰箱保存。
5.2.3生化反应配套试剂及氧化酶试剂:应在2--8℃冰箱保存。
5 .2 .4 革兰氏染色液:20--25℃条件保存。
6.检验流程:
7.检验方法:7.1分离培养:应根据不同标本分别采用不同的分离培养方法,脓汁、脑脊的离心可直接分离培养,血液标本必须真菌后再进行分离培养、粪便、呕吐物及剩余食物等应使用选择性较高的高盐甘露醇琼脂平板进行分离培养.培养温度35℃、时间24—48小时,需氧条件。
7.2涂片染色:脓汁、脑脊的离心沉淀物可直接涂片、染色。
其它标本在分离培养后,选取可疑菌落进行涂片、染色。
7.3各种试验方法(见另外SOP)。
7.4结果判定:镜检为革兰氏阳性球菌、在血平板上形成圆形凸起1-2mm溶血菌落,在高盐甘露醇琼脂平板上生长良好,然后进行属间鉴别和种间鉴别。
7.4.1属间鉴别:应于其它革兰氏阳性球菌鉴别,试验项目与判定标准见表2:表2葡萄球菌属于其它革兰阳性球菌的鉴别
7.5结果报告:应按有关原则(参见另外SOP文件)准确报告,细菌结果应报告至种的水平。
8.特殊情况的处理: 8.1在晚间、周末及假日无值班人员或其它不能马上接种标本的时候,应按有关原则(参见另SOP文件)将标本进行妥善保存。
8.2如果遇到停电等暂时不能进行检验的情况时,应委托给**医院检验科代为检验。
参考文献:1.叶应妩、王毓三主编,全国临床检验操作规程(第2版),东南大学出版社,1997。
2.李仲兴、郑家齐、李家宏主编,诊断细菌学,黄河文化出版社,1992。
3.蔡文城编著,实用临床微生物诊断学,东南大学出版社,1998。
