8吸光光度法
吸光光度法显色反应及显色条件的选择

吸光光度法 / 显色反应及显色条件的选择
• 干扰的消除 • 共存离子如本身有颜色,或与显色剂作用生成有色化合物, 都将干扰测定。 • 消除共存离子的干扰的方法: • 加人配位掩蔽剂或氧化还原掩蔽剂,使干扰离子生成无色 配合物或无色离子。
吸光光度法 / 显色反应及显色条件的选择
• 选择适当的显色条件以避免干扰 • 利用酸效应,控制显色剂离解平衡,降低[ R ] ,使干扰 离子不与显色剂作用
• 此类化合物在一定的条件下就能与某些金属离子作用,改 变生色团的电子云结构,使颜色发生明显的变化。
吸光光度法 / 显色剂
• • • • • • 偶氮类显色剂特点 性质稳定 显色反应灵敏度高 选择性好 对比度大 是目前应用最广泛的一类显色剂。其中以偶氮胂III 等最为 突出。偶氮胂III的结构式为
吸光光度法 / 吸光光度法的应用
• 吸收光谱重叠 • 找出两个波长,在该波长下,二组分的吸光度差值 △ A 较大
吸光光度法 / 吸光光度法的应用
• 在波长为λ1和λ2时测定吸光度 A1和 A 2 ,由吸光度值的 加和性得联立方程:
吸光光度法 / 吸光光度法的应用
吸光光度法 / 吸光光度法的应用
吸光光度法 / /显色反应及显色条件的选择 •进行光度分析时,首先要把待测组分转变成有色化合物, 然后测定吸光度或吸收曲线 •将待测组分转变成有色化合物的反应叫显色反应 •与待测组分形成有色化合物的试剂称为显色剂
吸光光度法 / 显色反应及显色条件的选择 显色反应的分类 •配位反应----最主要的显色反应 •氧化还原反应 显色反应的选择 •灵敏度高 摩尔吸收系数 K 的大小是显色反应灵敏度高低的重要标志 应当选择生成的有色物质的‘较大的显色反应
吸光光度法 / 显色剂
吸光光度法

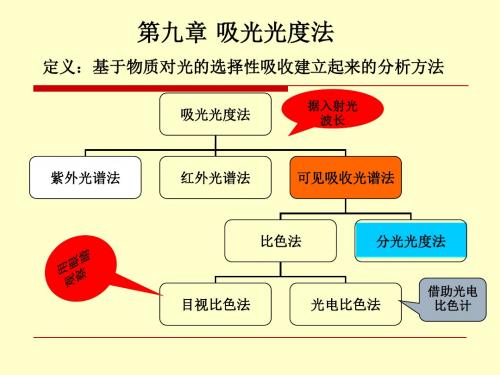
第20 章吸光光度法吸光光度法(light absorption method)是基于物质对光的选择性吸收而建立起来的分析方法。
包括比色法(colorimetric method)和分光光度法(spectrophotometry)。
前者是通过比较有色溶液颜色深浅来确定有色物质的含量;后者是根据物质对一定波长光的吸收程度来确定物质的含量的。
分光光度法包括紫外分光光度法(ultraviolet spectrophotometry)、可见光分光光度法(visible spectrophotometry)、红外分光光度法(infrared spectrophotometry)。
本章主要讨论可见光分光光度法。
20.1 概述20.1.1 物质对光的选择性吸收1. 光的性质光是一种电磁波,具有波粒二象性。
光的偏振、干涉、衍射、折射等现象就是其波动性的反映,波长λ与频率ν之间的关系式:λν=c (c为光速)亦反映光的波动性。
光又是由大量具有能量的粒子流所组成,这些粒子称为光子。
光子的能量则反映微粒性,光子的能量E 与波长λ的关系:E = hν = hc/λ(h为普朗克常量)亦可用来表示光的微粒性。
由上述关系可知,光子的能量与光的波长(或频率)有关,波长越短,光能越大,反之亦然。
光的能量范围很广,在波长或频率上相差大约20个数量级。
不同光的波长范围及其在分析化学中的应用情况见表20-1。
表20-1 各种光的波长范围及其在分析化学中的应用情况光的名称波长范围跃迁类型分析方法X-射线远紫外光近紫外光可见光近红外光中红外光远红外光微波无线电波10-1~ 10nm10 ~ 200nm200 ~ 400nm400 ~ 750nm0.75 ~ 2.5μm2.5 ~ 50μm50 ~ 1000μm0.1 ~ 100cm1 ~ 1000mK和L层电子中层电子价电子价电子分子振动分子振动分子振动和低位振动分子转动X射线光谱法真空紫外光度法紫外光度法比色及可见光度法近红外光谱法中红外光谱法远红外光谱法微波光谱法核自旋共振光谱2. 物质的颜色与其对光的选择性吸收光可分为单色光与复合光,单色光(chromatic light)是仅具有单一波长的光,而复合光(polychromatic light)是由不同波长的光(不同能量的光子)所组成。
吸光光度法是基于物质对光的选择性吸收而建立起来的一类

1852年;比尔: 阐明了物质对光的吸收程度与溶液浓度之间的关 系.
Ak2c
由比尔将二者结合起来,就得到布格-朗伯-比尔定 律,一般叫做朗伯-比尔定律.
AKbc
2、朗伯-比尔定律 的推导〔数学表达 式〕<略〕
3、灵敏度的表示方法
<1>吸收系数a〔吸光系数a 〕 当液层厚度b以cm为单位、吸光物质的浓度c以
§8-4 吸光光度法分析条件的选择
在光度分析中,一般需先选择适当的试剂与试样中的 待测组分反应使之生成有色化合物,然后再进行测定.
因此,分析条件的选择包括反应条件和测量条件的选 择.
一、显色反应及其条件的选择 〔一〕显色反应和显色剂 1、概念:
显色反应:将被测组分转变成有色化合物的反应称 为显色反应. M + R = MR
这种方法简便、快速,对于解离度小的络合物,可 以得到满意的结果.
2、等摩尔连续变化法
此 法 的 做 法 是 保 持 CM 和 CR 的 浓度保持不变,即CM + CR = 常数, 连续改变CM和CR的比值,在选定 的仪器条件和波长下测定溶液的 吸光度A.
以A对CM/CR +CM作图.
等摩尔连续变化法测定络合物组成
g·L-1为单位时,K用a表示,称为吸收系数,其单位为 L·g-1·cm-1.此时朗伯-比尔定律表示为
A=abc
<2>摩尔吸光系数ε 当液层厚度b以cm为单位、吸光物质的浓度c
以mol·L-1为单位时,K用ε表示,称为摩尔吸收系 数,其单位为L·mol-1·cm-1.此时朗伯-比尔定律表 示为
A= εbc
二、吸光光度法的测量误差及测量条件的选择
光度法的误差除各种化学因素外,还有因仪器精度 不够,测量不准所带来的误差.
第8章吸光光度法

MR + H+
显然,增大酸度对显色 反应不利。 ⑴影响显色剂浓度和颜色; ⑵影响Mn+的存在状态;
⑶影响配合物的组成。
实际工作中,作 A ~ pH 曲线,寻找适宜 pH 范围。
A
pH
3、显色温度的选择: 一般在室温,有时需加热,通过实验确定
4、显色反应时间:制作吸光度-时间曲线
(c(M)、 c(R) 、 pH一定)
一、显色反应的选择:
1、显色反应的类型:配位反应和氧化还原反应。 2、对显色反应的要求: ⑴灵敏度足够高:κ>105 超高灵敏,κ=(6~10)104 高灵敏,κ=(2~6)104中等,κ<2×104不灵敏 ⑵显色剂在测定波长处无明显吸收,试剂空白小。 对比度:两有色物质最大吸收波长之差 Δλ=|λMAXMR-λMAXR|≥60nm
2、吸收曲线:测量某 种物质对不同波长单色 光的吸收程度,以波长 为横坐标,吸光度为纵 坐标,得到的一条吸收 光谱曲线。
(1)用途: ①进行定性分析; ②进行定量分析; ③选择吸收波长; ④判断干扰情况。
9
定性分析与定量分析的基础
不同物质吸收光谱的形状以及max 不同
B 定性分析基础 物质对光的选择 吸收
练习题
1、人眼能感觉到的光称为可见光,其波长范围 是 A。400~780nm B。200~320nm C。200~780nm D。200~1000nm 答案: A 2 、符合比尔定律的一有色溶液,当其浓度增大 时,最大吸收波长和吸光度分别是 A。不变,增加 B。不变,减少 C。增加,不变 D。减少,不变 答案: A
Ia
透光率 (透射比)Transmittance
吸光光度法的灵敏度与准确度知识讲解

A
50℃
25℃
t /min
另外,还有介 质条件、有机 溶剂、表面活 性剂等.
16
8.4.3 测定中的干扰以及消除方法
1.化学法
测Co2+ :(掩蔽法)
Co2+, Fe3+
⑴NaF
Co2+ FeF63-
SCN- Co(SCN)2 (蓝)
(2)Sn2+
Co2+ Fe2+,Sn4+
SCN- Co(SCN)2
HL
H++L
HL、L 颜色不同
Ka=[H+][L]/[HL]
配制一系列c相同,pH不同的溶液,测A.
A = H L [ H L ] + L [ L ]= H L K [ a H + + ] [ H c ( + ] H L ) + L K K a a + [ c H ( + H ] L )
高酸度下,几乎全部以HL存在,可测得AHL=εHL·c(HL);
c(R)≈[R´]=10-4mol·L-1
3
[FeR3] [Fe][R]3
3 3
Fe(A)
R(H)
lg[F [F e R e ] 3] lg3 lgF e (A ) 3 lgR (H ) 3 lg [R ]
14
lg [F eR 3 ] [F e]
pH3~8为适宜 的酸度范围
15
3. 显色温度及显色时间 (c(M)、 c(R) 、 pH一定)
8.4.1 显色剂与显色反应
生色团:-N=N-,-N=O,
O
C=S,-N
(共轭双键)πe
O
: :: :
助色团-NH,-OH,-X (孤对电子)ne
第8章 光度法答案(1)

第8章吸光光度法一、选择题1.符合朗伯-比尔定律的一有色溶液,当有色溶液的浓度增加时,最大吸收波长和吸光度分别是( A )A.不变、增加B.不变、减少C.增加、不变D.减少、不变2.相同质量的铁和镉(M Fe=55.85g·mol-1,M Cd=112.4 g·mol-1)各用一种显色剂在同样体积溶液中显色,用分光光度法测定,前者用2cm比色皿,后者用1cm比色皿,测得的吸光度相同,则两有色络合物的摩尔吸光系数为( D )A.基本相同B.铁为镉的两倍C.镉为铁的两倍D.镉为铁的四倍3.在符合朗伯-比尔定律的范围内,有色物的浓度、最大吸收波长、吸光度三者的关系( B )A.增加,增加,增加B.减小,不变,减小C.减小,增加,增加D.增加,不变,减小4.以下说法错误的是( A )A.摩尔吸光系数ε随浓度增大而增大B.吸光度A随浓度增大而增大C.透光率T随浓度增大而减小D.透光率T随比色皿加厚而减小5.符合朗伯比耳定律的一有色溶液,通过1cm比色皿,测得透光率为80%,若通过5cm的比色皿,其透光率为(C )有色配合物的摩尔吸光系数ε与下述各因素有关的是( C )A.比色皿的厚度B.有色配合物的浓度C.入射光的波长D.配合物的稳定性7.下列表述中错误的是( A )A.比色分析所用的参比溶液又称空白溶液B.滤光片应选用使溶液吸光度最大者较适宜C.当摩尔吸收系数ε在105~106L/(mol·cm)范围内,可认为该反应的灵敏度是高的。
D.吸光度具有加和性8.符合比尔定律的有色溶液,浓度为c时,透光率为T0,浓度增大一倍时,透光率的对数为(D)2 2lg T09.一有色溶液对某波长光的吸收遵守吸收定律。
当选用2.0cm的比色皿时,测得透光率为T,若改用1.0cm的吸收池,则透光率应为( D )T2 D.10.吸光光度分析中比较适宜的吸光度范围是( B )A.0.1~某金属离子M与试剂R形成一有色配合物MR,若溶液中M的浓度为×10-4mol·L-1,用1cm比色皿于波长525nm处测得吸光度A为,此配合物在525nm处的摩尔吸光系数为( B )A.4.0×10-3B.×103C.×10-4 二、填空题1.某显色剂R与金属离子M和N分别形成有色配合物MR和NR,在某一波长下测得MR和NR的总吸光度A为。
8吸光光度法

四、显色反应和显色条件的选择
(2) 显色溶液的pH值
例: pH=1.8~2.5
Fe(ssal)+ 紫红色
pH=4~8
Fe(ssal)-2 橙红色
pH=8~11.5
Fe(ssal) 3 3- 黄色
常用的光源 :
可见光区: 钨灯 (辐射波长为320nm~2500nm) 紫外区: 氢灯、氘灯(辐射波长为185nm~400nm)
31
三. 仪器和方法
* 单色器(滤光片、棱镜或光栅)
作用 :
将光源发射的复合光分解成单色光的光学系统
1. 滤光片----光电比色计的单色器
组成:由有色玻璃制成
作用:只允许和它颜色相同的光通过,得 到的是近似的单色光
选择的原则:滤光片最易通过的光是有色溶液
最易吸收的光
互补色
32
三. 仪器和方法 2. 棱镜或光栅
----分光光度计的单色器
由棱镜或光栅等色散元件及狭缝和透镜等组成
组成 :
入射狭缝:光源的光由此进入单色器
准光装置:透镜或反射镜使入射光成为平行光束
色散元件:将复合光分解成单色光
聚焦装置:将分光后的单色光聚焦至出射狭缝
(透镜或凹面镜)
33
三. 仪器和方法 * 样品室(石英池和玻璃池) 用于放置各种类型的吸收池(比色皿)和相 应的池架附件
石英或玻璃池,紫外区一定要用石英池
厚度(光程): 0.5, 1, 2, 3, …cm
36
三. 仪器和方法
*检测系统 光电管或光电倍增管
将光强度转换成电流来进行测量。光电检测器。 要求:对测定波长范围内的光有快速、灵敏的响应,
17
二 . 吸光光度法的基本原理
吸光光度法

(1)吸收系数
第一、吸收系数a
当c的单位为g/L,b的单位为cm时,K用a表示 ,称为吸收系数,其单位为L/g·cm,这时朗伯-比 耳定律变为: A=abc
第二、摩尔吸收系数κ
当式中浓度c的单位为mol/L,液层厚度的单位 为cm时,则用另一符号κ表示,称为摩尔吸收系数 ,它表示物质的浓度为1mol/L,液层厚度为1cm时 ,溶液的吸光度。其单位为L/mol·cm。这时朗伯比耳定律就变为: A=κbc
4、检测系统(又叫光电转化器)
在光度计中,常用的是硒光电池。硒光电池和眼睛相 似,对于各种不同波长的光线,灵敏度是不同的。对于波 长为500-600nm的光线最灵敏。而对紫外线,红外线则 不能应用。
光电管和光电倍增管用于较精密的分光光度计中。具 有灵敏度高、光敏范围广及不易疲劳等特点。
1、选择性要好
一种显色剂最好只与一种被测组分起 显色反应,这样干扰就少。或者干扰离 子容易被消除、或者显色剂与被测组分 和干扰离子生成的有色化合物的吸收峰 相隔较远。
3、对比度要大
如果显色剂有颜色,则有色化合物与显色剂的 最大吸收波长的差别要大,一般要求在60nm以上 。
5、显色反应的条件要易于控制
但有时会发生偏离, 特别在浓度较大时, 偏离更大.
原因:1)非单色光、非0平行光 c 2)化学因素:离解、缔合、异构化等
1、物理因素
(1)单色光不纯所引起的偏离
严格地讲,朗伯-比耳定律只对一定波长的单色 光才成立。但在实际工作中,目前用各种方法得到 的入射光并非纯的单色光,而是具有一定波长范围 的单色光。那么,在这种情况下,吸光度与浓度并 不完全成直线关系,因而导致了对朗伯—比耳定律的 偏离。
第八章 吸光光度法

对浓度作图时,应得到一条通过坐标原点的直线,该直线称 为标准曲线或工作曲线。在相同条件下测得试液的吸光度, 从工作曲线上就可以查得试液的浓度。但在实际工作中,常 常遇到偏离线性关系的现象,特别是在溶液浓度较高时,常 会出现标准曲线向上或向下弯曲产生负偏离或正偏离(p244, 图9-4)。
例如:CuSO4溶液由于吸收了580-600 nm的黄色光,呈 现的是与黄色呈互补色的蓝色。不同波长的光具有不同的颜 色,见P294,表9-1。
物质吸收了光子的能量由基态跃迁到较高能态(激发 态),这个过程叫做物质对光的吸收。
M(基态)+hυ → M*(激发态)
当照射光光子的能量hυ与物质的基态与激发态能量之差相等 时,即ΔE= hυ,才能发生吸收。
(2) 平衡效应、酸效ห้องสมุดไป่ตู้、溶剂效应 溶液中有色化合物的平衡移动会使最大吸收波长发生变化,
使工作曲线产生弯曲。溶液的酸度、溶剂会对有色化合物的 形成、分解等产生影响,而使吸收光谱的形状和最大吸收波 长发生变化,从而导致偏离。
§ 8-2 目视比色法及光度计的基本部件
一、目视比色法
用眼睛比较溶液颜色的深浅以测定物质含量的方法称为 目视比色法。常用的目视比色法是标准系列法。这种方法就 是使用一套由同种材料制成的、大小形状相同的平底玻璃管 (称为比色管),于管中分别加入一系列不同量的标准溶液 和待测液,在实验条件相同的情况下,再加入等量的显色 剂,稀释至一定刻度,然后从管口垂直向下观察,比较待测 液与标准溶液颜色深浅。若待测液与某一标准溶液颜色深度 一致,则说明两者浓度相等,若待测液介于两标准溶液之 间,则取两标准液平均值为待测液浓度。
等电点常用的检测方法

等电点常用的检测方法等电点是指溶液中离子总电荷为零时的pH值。
在生化学中,等电点的测定十分重要,可用于分离、检测和鉴定蛋白质等生物分子。
以下是关于等电点常用的10种检测方法的详细描述:1. 等电聚焦法等电聚焦法是一种基于电荷的分离技术,通过将带有不同电荷的生物分子置于电解质溶液中,利用电场分离它们。
该方法可以分离具有相似分子量和电荷的蛋白质,特别是针对等电点非常接近的蛋白质。
等电聚焦法结合其他技术,例如凝胶电泳、Western blot等,可用于确定蛋白质的丰度、结构和功能。
2. 弱离子交换层析法弱离子交换层析法是一种高效的蛋白质分离方法,该方法通过在弱酸或弱碱柱上吸附蛋白质,并根据其等电点的差异进行分离。
当蛋白质在强酸或强碱的pH值下具有相同的电荷时,会发生共存,并不会被分离。
弱离子交换层析法适用于寻找等电点相近的蛋白质分离。
3. 等电聚丙烯酰胺凝胶电泳法等电聚丙烯酰胺凝胶电泳法是将蛋白质样品置于凝胶上,然后通过改变凝胶pH的缓冲溶液来移动蛋白质并分离它们。
该方法利用凝胶pH等离子体电位变化来使蛋白质在凝胶中停止运动,从而将等离子体电位与蛋白质标记等电点pI相等。
由于该方法可以使用同一pH缓冲溶液进行多次聚焦,因此该方法的等电点分离效果比其他方法更加理想。
4. 细胞凝胶电泳法细胞凝胶电泳法是利用细胞的膜电位和pH等离子体电位差异分离细胞。
该方法可用于分离具有不同等电点的细胞,并且可以通过改变pH缓冲溶液的pH值来使分离更具特异性。
5. pH梯度制备法pH梯度制备法是一种制备带有不同pH的水溶液的方法,这些溶液可用于等电点分离、药物筛选、酶催化和蛋白质研究等领域。
该方法可以通过改变缓冲溶液的浓度和组成来控制pH梯度,以此选择性放大具有某些分子量或等电点的生物大分子。
6. 免疫层析法免疫层析法是以免疫反应为基础的方法,可以通过介导特异性抗体和抗原结合来分离目标生物分子。
该方法可以应用于从复杂混合物中纯化含有多种酶和受体的等离子体,其优点在于其针对性很高,可以选择性地分离几乎任何单一分子。
水质化学-8-吸收光谱法.

紫红
吸收光 波长 / nm 400~450 450~480 480~490 490~500 500~560
物质颜色
紫 蓝 绿蓝 蓝绿
吸收光 波长 / nm 560~580 580~600 600~650 650~780
三、吸收曲线
任何一种溶液对不同波长的光的吸收程 度是不相等的。如果将某种波长的单色光依 次通过一定浓度的某一溶液,测量该溶液对 各种单色光的吸收程度,以波长为纵坐标, 以吸光度为纵坐标可以得到一条曲线,叫做 吸收光谱曲线或光吸收曲线,简称吸收曲线。 它清楚地描述了溶液对不同波长的光的吸收 情况。
6
9
10
o
§ 8.2 光吸收的基本定律
——朗伯-比耳定律
吸收光谱法进行定量分析的理论基础是朗伯-比 耳定律(The Lambert-Beer’s Law),它是光吸收的基 本定律。
1、朗伯定律 当一束平行的单色光通过溶液浓度一定的有色溶
液时,溶液对光的吸收程度与液层的厚度成正比:
A
lg长
实验证明,如果 将两种适当颜色的单 色光按一定强度比例 混合,也可以得到白 光,我们通常将这两 种颜色的单色光称为 互补色光。右图为互 补色光示意图,图中 处于直线关系的两种 颜色的光是互补色光, 它们彼此按一定比例 混合即成为白光。
/nm
400-450 450-480 480-490 490-500 500-560 560-580 580-610 610-650 650-760
光颜色的互补性
颜色
互补光
紫
蓝 绿蓝 蓝绿
绿 黄绿
黄 橙 红
黄绿
黄 橙 红 红紫 紫 蓝 绿蓝 蓝绿
2、物质的颜色
第八章 吸光光度法

第四节 吸光度测量条件的选择
一、入射光波长的选择
吸收大,灵敏度高 1、原则: 对朗伯-比尔定律偏离小 一般选λ max处 如有干扰,要避开。 “吸收最大,干扰最小”。
选500nm进行测定 选520nm进行测定
2013-7-14
二、参比溶液的选择 显色剂、其他试剂均无色时 用蒸馏水作参比; 显色剂有色、其他试剂无色时 用同样浓度的显色剂作参比; 显色剂无色、其他试剂有色时 用其他试剂作参比; 显色剂、其他试剂均有色时 用不加待测离子的试剂和显色剂混合溶液作参比。
二、光吸收的基本定律(朗伯-比尔定律) 1、透光率和吸光度 透光率 T 取值为0.0 % ~ 100.0 % 全部吸收 T = 0.0 % 全部透射 T = 100.0 % 吸光度 A lg T A 取值为0 ~ +∞ 全部吸收 A = + ∞
2013-7-14
全部透射
A=0
2、朗伯-比尔定律 当单色光通过均匀的溶液 时,吸光度与溶液的浓度 和液层的厚度成正比。 表示为:A=Kbc A——吸光度 光度法定 K——比例常数 量的依据 b——液层厚度,比色皿 厚度 c——溶液浓度 单色光 2013-7-14 均匀溶液
2013-7-14
2、单色器
作用:将光源发出的复合光转变为所需波长的单色光。 分为棱镜和光栅两种。
2013-7-14
光栅的分辨率比棱镜大, 可用的波长范围也较宽。
3、吸收池(比色皿)
作用:用来盛放待测溶液。 光学玻璃制成的无色透明的长方体容器,规格 有0.5,1.0,2.0,5.0cm等。
2013-7-14
显色反应及显色条件的选择
将待测组分转变为有色化合物的反应。 与待测组分形成有色化合物的试剂。
8.光度法思考题习题da

第8章 吸光光度法思考题参考答案1. 与化学分析法相比,吸光光度法的主要特点是什么?答:吸光光度法主要用于测定试样中的微量组分,与化学分析法相比具有以下特点: (1) 灵敏度高。
常可不经富集用于测定质量分数为210-~510-的微量组分。
(2) 准确度虽无化学分析法高,但符合微量分析的要求。
一般目视比色法的相对误差为5%~l0%,分光光度法为2%~5%。
(3) 应用广泛。
几乎所有的无机离子和许多有机化合物都可以直接或间接地用分光光度法进行测定。
(4) 仪器简单,操作方便,快速。
有时可不经分离直接进行比色或分光光度测定。
2. 何谓单色光、复合光、互补光、可见光?答:将仅具有某一波长的光称为单色光; 由不同波长的光组成的光称为复合光;如果把两种适当颜色的单色光按一定强度比例混合能得到白光。
那么这两种单色光称为互补光;人眼能感觉到的光的波长大约在400~750 nm 之间,称为可见光。
3. 朗伯-比耳定律的物理意义是什么?什么是透光度?什么是吸光度?二者之间的关系是什么?答:物理意义为:当一束平行的单色光通过单一均匀的、非散射的吸光物质溶液时,溶液的吸光度A 与吸光物质的浓度和光通过的液层厚度的乘积成正比。
透过光强度I 与入射光强度I 0之比称为透光度,用T 表示。
即 T = I / I 0 。
lg (I 0/I ) 表明了溶液对光的吸收程度,定义为吸光度。
透光度与吸光度的关系是A = – lg T4. 摩尔吸收系数的物理意义是什么?其大小和哪些因素有关?答:摩尔吸收系数是吸光物质在特定波长和溶剂情况下的一个特征常数,在数值上等于浓度为1mol·L -1吸光物质在1cm 光程中的吸光度,是物质吸光能力的量度。
它可以作为定性鉴定的参数,也可以估量定量方法的灵敏度。
值越大,说明有色物质对入射光的吸收能力越强,显色反应的灵敏度高。
其大小与入射光波长、溶液的性质以及温度等因素有关,而与溶液的浓度及液层厚度无关。
吸光光度法
(6)干扰及其消除方法 干扰物质本身有颜色或与显色剂反应,在测量条件下也有吸收,造成正 干扰。 干扰物质与被测组分反应或与显色剂反应,使显色反应不完全。 干扰物质在测量条件下从溶液中析出,便溶液变混浊,无法准确测定溶 液的吸光度。 为消除以上原因引起的干扰,可采取以下几种方法。 a.控制溶液酸度 b.加入掩蔽剂 选取的条件是掩蔽剂不与待测离子作用,掩蔽剂以及它 与干扰物质形成的络合物的颜色应不干扰待测离子的测定。 c.利用氧化还原反应,改变干扰离子的价态 d.利用校正系数 e.用参比溶液消除显色剂和某些共存有色离子的干扰。 f.选择适当的波长 g.当溶液中存在有消耗显色剂的干扰离子时,可通过增加显色剂的用量 来消除干扰。 h.分离 以上方法均不奏效时,采用预先分离的方法。
准确度较高。一般相对误差为2℅-5℅。
应用广泛。可测绝大多数无机阴离子、金属阳离子,有机 物;可用于定量分析,某些有机物的定性分析,某些物理 化学常数及络合物组成的测定。
§9.1 吸光光光度法基本原理
一、光的性质 -----波粒二象性
描述光的波动性用波长、频率等参数。
光的微粒性:是把光看作带有能量的微粒流,单
标准曲线就是根据这一原理制作的。具体方法为: (1)配制一系列不同浓度的标准溶液; (2)在选择的实验条件下,分别测量各标准溶液的 吸光度 (3)以标准溶液中待测组分的浓度为横坐标,吸光 度为纵坐标作A-c曲线,得到一条通过原点的直线, 称为标准曲线。曲线的斜率为b (4)测量待测溶液的吸光度,在标准曲线上就可以 查到与之相对应的被测物质的含量。
3.双波长分光光度计
A1 1bc Ab1 A 2 2bc Ab 2
等吸收点法选择波长
8章吸光光度法

2019/10/20
光学光谱区
远紫外 近紫外 可见 近红外 中红外
(真空紫外)
远红外
10nm~200nm 200nm 400nm
780 nm 2.5 m 50 m
~400nm ~ 780nm ~ 2.5 m ~ 50 m ~300 m
2019/10/20
三、物质对光的选择性吸收
单色光:具有相同能量(相同波长)的光. 复合光:具有不同能量(不同波长)的光复合 在一起. 例如白光. 互补光:把两种适当颜色的光按一定的强度
2019/10/20
吸光质点间相互作用引起的对吸光定律的偏 离
质点间的静电作用 质点的散射 质点间的化学反应
2019/10/20
2.散射 试样不均匀,被测液含悬浮物或胶粒等散射指
点时,入射光因散射而损失。 3.化学因素
溶液中存在着离解、聚合、互变异构、配合 物的形成等化学平衡破坏了平衡浓度分析浓度的 正比关系,造成对朗伯—比耳定律的偏离。
2019/10/20
吸收曲线的讨论:
(1)不同物质,曲线形状 不同,最大吸收波长λmax 不同,可用作定性鉴定各 种物质
(2)同一种物质,浓度 不同,其吸收曲线形状相 似,λmax不变。
2019/10/20
(3)同一种物质,浓度不同,在某一定波长下吸光 度 A 有差异,在λmax处吸光度随浓度变化的幅度最 大,所以测定最灵敏。吸收曲线是定量分析中选择 入射光波长的重要依据。
2019/10/20
8.2 光度计及基本部件
1.目视比色法
观察方向
空白 c1
c2
c3
c4
方便、灵敏,准确度差. 常用于限界分析.
2019/10/20
目视比色法 特点
吸光光度法

It 透光度定义: T I0
T 取值为0.0 % ~ 100.0 % 全部吸收 全部透射 T = 0.0 % T = 100.0 % A=∞ A= 0.00
吸光度:A=lg (I0 / It )=lg(1/T)
全部吸收
全部透射
朗伯定律(1760年):光吸收与溶液层厚度成正比 比尔定律(1852年):光吸收与溶液浓度成正比
2.介质不均匀引起的偏离 胶体,悬浮、乳浊等对光产生散射,使实测
吸光度增加,导致线性关系上弯曲
3.化学反应引起的偏离 离解、缔合、异构等 如:Cr2O72-+H2O-=2HCrO4-=2H++2CrO42PAR的偶氮-醌腙式
4 显色反应的干扰及其消除方法
1)优化显色反应条件,控制溶液的酸度 2)加入隐蔽剂 3)改变价态 4)选择适当波长 5)选择合适参比溶液
2)单色器
将光源发射的复合光分解成单色光并可从中选出一任 波长单色光的光学系统。
①入射狭缝:光源的光由此进入单色器;
②准光装置:透镜或返射镜使入射光成为平行光束; ③色散元件:将复合光分解成单色光;棱镜或光栅; ④聚焦装置:透镜或 凹面反射镜,将分光
后所得单色光聚焦至
出射狭缝; ⑤出射狭缝。
16
单色器
棱镜:依据不同波长光通过棱镜时折射率不同
800
λ1
白光
600
500
λ2
入射狭缝 准直透镜 棱镜 聚焦透镜 出射狭缝
400
17
光栅:在镀铝的玻璃表面刻有数量很大的等宽度
等间距条痕(600、1200、2400条/mm )。 原理: 利用光通过光栅时
平面透 射光栅 透 镜
光屏
M1
发生衍射和干涉现象而 分光.
8章吸光光度法

需要知两个公式 A= a b c 以及ε =Ma,
解:先求a,再求ε
已知 M Fe=55.85 a =A / bc = 0.19/2×5.0×10-4=190L·g-1·cm-1 ε =Ma =55.85×190=1.1×104L·mol-1·cm-1
2019/11/9
I02 It2
lg I01
I01 101bc
I02 I02
102bc
1bclg(I01 I02)lg(I01 I02 10(12)bc)
当κ1 = κ2 时,A总 = κ1 bc,遵守比耳定律
当κ1 ≠ κ2 时,A总 ≠ κ1 bc,偏离比耳定律
2019/11/9
第8章 吸光光度法
8.1 概述 8.2 光吸收的基本定律 8.3 光度计的基本部件 8.4 显色反应与分析条件的选择 8.5 吸光度测量条件的选择 8.6 吸光光度法的应用
2019/11/9
化学分析与仪器分析方法比较
化学分析:常量组分(>1%), Er : 0.1%~0.2% 准确度高 依据化学反应, 使用玻璃仪器
(4)吸收曲线可以提供 物质的结构信息,并作 为物质定性分析的依据 之一。
2019/11/9
苯 (254nm)
甲苯 (262nm)
A
230
250
270
l
2019/11/9
苯和甲苯在环己烷中的吸收光谱
8-2 光的吸收定律
──朗伯-比耳(Larnbert-Beer)定律
吸光度与液层厚度 吸光度与物质浓度
1. 光学分析法: 基于电磁辐射与物质的相互作用.
非光谱法 (折射法,浊度法,旋光法)
光
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目视比色法
[Fe(SCN)n]3-n
Cx c1 c2 c3 c4 c5
三. 仪器和方法 分光光度法 : 仪器—分光光度计
基本组成:
光源 单色器 样品室 检测器
显示器
三. 仪器和方法
* 光源 (钨灯、氢灯、氘灯)
基本要求 :
能发射紫外光区或可见光谱区的连续光谱; 足够的辐射强度、稳定性较好、使用寿命较长
一. 概述 吸光光度法:
基于物质对光的选择性吸收而建立的 分析方法。
分类:根据物质所吸收光的波长范围不同, 分为紫外、可见及红外分光光度法。 基本方法: 有色物质浓度 ~ 颜色深浅 ~ 吸收光程度 通过比较颜色深浅(吸收光程度),测 定物质的浓度。
一. 概述
方法分类和比较
比色分析法
测定下限
10-5 ~ 10-6 mol·L-1 5% ~ 10%
(1)光电管
(2)光电二极管阵列
三. 仪器和方法
(1)光电管
涂光敏材料
光照 光敏材料 光强度大
产生电子
电压
产生电流 电流大
三. 仪器和方法
(2)光电二极管阵列
光照射
电容器 充电 电容器 放电
再次充电 测量周期
电容器充电的电量每个二极管检测到的光子 数目成正比光子数与光强度成正比。通过测量整 个波长范围内光强的变化就可得到吸收光谱。
三. 仪器和方法
*显示器
由检流计、数字显示、微机组 成的自动控制和结果处理系统
四、显色反应和显色条件的选择
1.显色剂作用 2. 显色反应的选择 3. 影响显色反应的因素
4. 显色剂的分类
四、显色反应和显色条件的选择
1.作用
无色或浅色 +显色剂 有色物 试样 配合反应 比色
显色反应
氧化还原反应 缩合反应 重氮化—偶氮化反应
= abc
A ∝ cb 当一束平行单色光通过溶液时,溶液的 吸光度A与溶液的c和b成正比。 当 b 一定时, A ∝ c, 可以定量
二 . 吸光光度法的基本原理
注意 :
A = lg
I0 I
= abc
(1) 物质不吸光, I=Io , A=0 物质吸收部分光, I<Io, A>0 吸收光 , A , 物质浓度 。
吸光光度法
王 燕
光分析方法
可见分光光度法 紫外可见分光光度法 原子吸收法
分子光谱
原子光谱
红外光谱法
光谱分析法
原子发射法 荧光光谱法 核磁共振法
概述
吸 光 光 度 法
原理
物质对光的选择性吸收
光的吸收定律
仪器和方法 显色反应和显色条件的选择
入射光 测定条件的选择 参比液 读数范围 单组分测定 具体应用 多组分测定 示差法测定
四、显色反应和显色条件的选择
2.显色反应的选择
(1)灵敏度高 (2) 选择性好 (3) 有色物组成恒定,化学性质稳定 (4) 显色剂在测定波长处无明显吸收 κ=104-105
对比度=λmax有色物 -λmax显色剂>60nm
四、显色反应和显色条件的选择
3.影响显色反应的因素
M + R MR (1) 显色剂用量 根据吸光度A与显色剂浓度cR的关系来确定
分光光度法
10-5 ~ 10-8 mol·L-1
相对误差
2% ~ 5%
适用于分析半微量和微量的物质
一. 概述
方法的评价 快速、简便 显色 比色
灵敏度高:浓度下限达10-5~10-6 mol· -1 L
准确度高:相对误差通常为2~5%,
分析有色、无色、浅色物
适用面广
溶液状态、均质固态样品
用于化学平衡等的研究
cR选择——引起A变化最小处的cR(即曲线平坦处)
四、显色反应和显色条件的选择
例:
(2) 显色溶液的pH值
pH=1.8~2.5 pH=4~8 pH=8~11.5 Fe(ssal)+ 紫红色 Fe(ssal)-2 橙红色 Fe(ssal) 3 3- 黄色
测定不同pH值下,显色溶液的吸光度A, 以A为纵坐标,pH为横坐标,制图。 选择曲线平坦处pH 显色时间和温度 由实验得出 溶剂 一般选择水作溶剂
二 . 吸光光度法的基本原理 1.可见光与颜色
阳光 复合光
连续光谱
棱镜 由两种或两种以上波长的光所组成
物质
不连续光谱
可见光区的划分 : λ/nm
400 450 500 550 600 650 760
二 . 吸光光度法的基本原理
互补光的对应关系
光的互补:蓝黄
二 . 吸光光度法的基本原理
2. 物质对光的选择性吸收
二 . 吸光光度法的基本原理
(3)是物质的吸光能力的度量。同一吸收物 质在不同波长下的值不同。在λmax处的 max表 明了吸收物质最大限度的吸光能力,反映了测 定可能达到的最大灵敏度。 (4) max越大表明该物质的吸光能力越强, 用光度法测定该物质的灵敏度越高。 >105:超高灵敏; = (6~10)×104 :高灵敏; = 104~103 :中等灵敏; < 103 :不灵敏。
-6
-6
= 8 . 9 × 10
-6
mol • L
-1
A = κbc
∴κ = A cb = = 1 . 1 × 10 L • mol ×2
4 -1
• cm
-1
二 . 吸光光度法的基本原理 4. 吸光度测定方法
(1) 配制一组浓度系 列的标准溶液(ci)
步骤
仪器测量
一组相应的吸 光度值(Ai) 工作曲线
例1=2 A2 A1 1 2 但 A1 》 A2 0
在max
处
单色光不纯
但 κ2=0
测量误差较小
二 . 吸光光度法的基本原理
2)溶液本身引起的偏差
(1)若溶液浓度>0.01mol· -1时,粒子 L 间的相互作用 (2)溶液以胶体、乳浊、悬浮状态存在 时,有反射、散射作用
二 . 吸光光度法的基本原理
若入射光包含λ1和λ2二种波长光, 当照射试样后
Io
Io1 试 样 Io2 I2 I1 I
按光吸收定律:
A 1 = κ λ1 cb = lg I o1 I1
A总 A 1 A 2
A 2 = κ λ2 cb = lg I o2 I2
-κ λ2 cb
I 1 = I o1 × 10
二 . 吸光光度法的基本原理 A、T% 和c 的关系
A = abc
- lg T % = A = abc
A、T% 、c 。
二 . 吸光光度法的基本原理
(6) 吸光系数的二种表示形式
A=abc A= bc
吸光系数a
摩尔吸光系数
浓度为1g/L的溶液,在某 浓度为1mol/L的溶液, 波长时,用1cm的比色皿, 在某波长时,用1cm的比 意义 所测得的吸光度 色皿,所测得的吸光度 L/g· cm L/ mol · cm
仪器测量
A
制图(ci 为横坐标, Ai 为纵坐标) · · (2) 配制样品
Ax ·
Ax
相同条件
· ·
查图得出cx
cx
c
二 . 吸光光度法的基本原理
5. 偏离Beer-Lanbert定律的原因
出现的现象: A与c偏离线性 在高浓度端, 工作曲线呈弯曲状。 产生原因:
c A
1) 单色光不纯
现有仪器无法获得纯单色光,只能获得小 范围的复合光。
(透镜或凹面镜)
三. 仪器和方法 光栅分光原理
利用不同波长入射光产生干涉条纹的衍射 角不同而将复合光分成单色光。
三. 仪器和方法
* 样品室
用于放置各种类型的吸收池(比色皿)和相 应的池架附件
比色皿: 石英池和玻璃池 比色皿厚度: 0.5, 1, 2, 3, …cm
三. 仪器和方法
* 检测器(光电管或光电倍增管) 作用:通过光电效应,使透过吸收池的光 信号变成可测的电信号的装置。 要求:对测定波长范围内的光有快速、 灵敏的响应,产生的光电流应与照射于 检测器上的光强度成正比。
二 . 吸光光度法的基本原理 (3)溶液内部的化学变化
包括离解、缔合、生成新物质、形成异构体
使原物质浓度改变
吸光度值变化 产生偏离
2 CrO
24
例:
Cr 2 O 7 + H 2 O
2-
+ 2H
+
(橙色)
κ Cr
2O 7 2-
(黄色)
>> κ CrO
24
λmax=450nm
pH
, 平衡
移,
A总
三. 仪器和方法
- κ λ1 cb
+ I o2 × 10
- κ λ2 cb
讨论 :
当为纯单色光时, λ1=λ2
κλ1= κλ2
A总= κλ1bc
当单色光不纯时, λ =λ 1 2 A总∝ c
κλ1= κλ2
线性破坏
结论: 单色光纯度越差,线性越差
二 . 吸光光度法的基本原理
减少单色光不纯引起偏差方法 ——— 在max处测量
I dI I
k 1 db k 1 db
0 b
吸光度 I
k 2c
A g
I0 I
k 1b
二 . 吸光光度法的基本原理
Beer - Lanbert定律——光吸收定律
I0
A = lg
A——吸光度 a——吸光系数 b——光程距离
I Io ——入射光强度 I——透射光强度 c——浓度
单位
二 . 吸光光度法的基本原理
摩尔吸收系数κ的讨论
(1)在数值上等于c=1 mol · -1、b=1cm时该溶 L 液在某一波长下的吸光度。是吸收物质在一定波 长和溶剂下的特征常数。 (2)不随c和b的改变而改变。在温度和波长等 条件一定时,仅与吸收物质本身的性质有关,
