第10章 分析化学基础知识
第10章 色谱分析基本概念
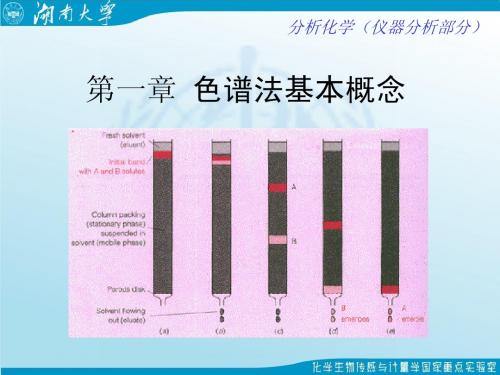
c
c0 σ 2π
e
当色谱峰为非正态分布时,可按正态分布函数加指数衰 减函数构建关系式。
目 录
1-1 色谱法概述
1-1-1 色谱法的特点、分类和作用 1-1-2 色谱分离过程 1-1-3 色谱流出曲线与术语
1-2 色谱理论基础
1-2-1 塔板理论 1-2-2 速率理论 1-2-3 分离度 1-3 定性定量方法 1-3-1 色谱定性分析 1-3-2 色谱定量分析
色谱柱长:L, 虚拟的塔板间距离:H,
色谱柱的理论塔板数:n,
则三者的关系为: n=L/H
理论塔板数与色谱参数之间的关系为:
tR 2 tR 2 n 5.54( ) 16( ) Y1/ 2 Wb
保留时间包含死时间,在死时间内不参与分配!
2.有效塔板数和有效塔板高度
• 单位柱长的塔板数越多,表明柱效越高。
调整保留时间(tR'):tR'= tR-tM
(2)用体积表示的保留值 保留体积(VR): VR = tR×F0 F0为柱出口处的载气流量,
单位:m L / min。
死体积(VM):
VM = tM ×F0
调整保留体积(VR'):
V R' = VR -VM
3. 相对保留值r21 组分2与组分1调整保留值之比: r21 = t´R2 / t´R1= V´R2 / V´R1 相对保留值只与柱温 和固定相性质有关,与其 他色谱操作条件无关,它 表示了固定相对这两种组 分的选择性。
式中为相比。 填充柱相比:6~35;毛细管柱的相比:50~1500。 容量因子越大,保留时间越长。 VM为流动相体积,即柱内固定相颗粒间的空隙体积; VS为固定相体积,对不同类型色谱柱, VS的含义不同; 气-液色谱柱: VS为固定液体积; 气-固色谱柱: VS为吸附剂表面容量;
【推荐下载】分析化学知识点总结汇总

第一章绪论第一节分析化学及其任务和作用定义:研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的科学,是化学学科的一个重要分支,是一门实验性、应用性很强的学科第二节分析方法的分类一、按任务分类定性分析:鉴定物质化学组成(化合物、元素、离子、基团)定量分析:测定各组分相对含量或纯度结构分析:确定物质化学结构(价态、晶态、平面与立体结构)二、按对象分类:无机分析,有机分析三、按测定原理分类(一)化学分析定义:以化学反应为为基础的分析方法,称为化学分析法.分类:定性分析重量分析:用称量方法求得生成物W重量定量分析滴定分析:从与组分反应的试剂R的浓度和体积求得组分C的含量反应式:mC+nR→CmRnX V W特点:仪器简单,结果准确,灵敏度较低,分析速度较慢,适于常量组分分析(二)仪器分析:以物质的物理或物理化学性质为基础建立起来的分析方法。
仪器分析分类:电化学分析 (电导分析、电位分析、库伦分析等)、光学分析(紫外分光光度法、红外分光光度法、原子吸收分光光度核磁共振波谱分析等)、色谱分析(液相色谱、气相色谱等)、质谱分析、放射化学分析、流动注射分析、热分析特点:灵敏,快速,准确,易于自动化,仪器复杂昂贵,适于微量、痕量组分分析四、按被测组分含量分类-常量组分分析:>1%;微量组分分析:0.01%~1%;痕量组分分析;< 0.01%五、按分析的取样量分类试样重试液体积常量分析 >0.1g >10ml半微量 0.1~0.01g 10~1ml微量 10~0.1mg 1~0.01ml超微量分析 <0.1mg ﹤0.01ml六、按分析的性质分类:例行分析(常规分析)、仲裁分析第三节试样分析的基本程序1、取样(采样):要使样品具有代表性,足够的量以保证分析的进行2、试样的制备:用有效的手段将样品处理成便于分析的待测样品,必要时要进行样品的分离与富集。
3、分析测定:要根据被测组分的性质、含量、结果的准确度的要求以及现有条件选择合适的测定方法。
分析化学每一章的名词解释和问答题

第一章蛋白质的结构与功能名词解释1.肽单元2.模体3.蛋白质变性4.β-折叠5.分子伴侣6.protein quaternary structure7.结构域8.蛋白质等电点9.辅基10.肽键11.α- 螺旋12.变构效应13.蛋白质一级结构14.蛋白质二级结构15.蛋白质三级结构16.蛋白质四级结构17.亚基18.肽问答题1.为何蛋白质的含氮量能表示蛋白质相对量?实验中又是如何依此原理计算蛋白质含量的?2.蛋白质的基本组成单位是什么?其结构特征是什么?3.何为氨基酸的等电点?如何计算精氨酸的等电点?(精氨酸的α- 羧基、α- 氨基和胍基的 pK 值分别为 2.17 , 9.04 和 12.48 )4.何谓肽键和肽链及蛋白质的一级结构?5.什么是蛋白质的二级结构?它主要有哪几种?各有何结构特征? 6 .举列说明蛋白质的四级结构。
7.已知核糖核酸酶分子中有 4 个二硫键,用尿素和β- 巯基乙醇使该酶变性后,其 4 个二硫键全部断裂。
在复性时,该酶 4 个二硫键由半胱氨酸随机配对产生,理论预期的正确配对率为 1 %,而实验结果观察到正确配对率为 95 %~100 %,为什么?8.什么是蛋白质变性?变性与沉淀的关系如何?9.举列说明蛋白质一级结构、空间构象与功能之间的关系。
10.举例说明蛋白质的变构效应。
11.常用的蛋白质分离纯化方法有哪几种?各自的作用原理是什么?12.测定蛋白质空间构象的主要方法是什么?其基本原理是什么?第二章核酸的结构与功能名词解释1.核小体2.碱基互补(碱基配对)3.脱氧核苷酸4.增色效应5.Tm值6.核糖体7.核酶8.核酸分子杂交9.TΨC 环10.反密码环11.Z-DNA12.核酸变性13.核酸复性问答题1.细胞内有哪几类主要的 RNA ?其主要功能是什么?2.用32P标记的病毒感染细胞后产生有标记的后代,而用35S标记的病毒感染细胞则不能产生有标记的后代,为什么?3.一种 DNA 分子含 40 %的腺嘌呤核苷酸,另一种 DNA 分子含 30 %的胞嘧啶核苷酸,请问哪一种 DNA 的 Tm 值高?为什么?4.已知人类细胞基因组的大小约 30 亿 bp ,试计算一个二倍体细胞中 DNA 的总长度,这么长的 DNA 分子是如何装配到直径只有几微米的细胞核内的?5.简述 DNA 双螺旋结构模式的要点及其与 DNA 生物学功能的关系。
第10章 吸光光度分析

无机及分析化学
34
3、吸光度范围
被测溶液的吸光度值在0.2~0.8范围内,使测定
结果有较高的准确度,过大或过小应予以调节。 而当A= 0.434或T% = 36.8时,测定的误差最小。 为此可从以下三方面加以控制: 一是改变试样的称样量,或采用稀释、浓缩、富
无机及分析化学
12
质量吸光系数,摩尔吸光系数
• 质量吸光系数 a: 当一定波长的单色光,通过浓度 为 1g/L,吸收池的液层厚度为 1cm的溶液时,测 得的吸光度。单位为L.g-1.cm-1
• 摩尔吸光系数ε • 物理意义:当一定波长的单色光,通过浓度为 1mol/L,吸收池的液层厚度为1cm的溶液时,测 得的吸光度。单位为L.mol-1.cm-1
比耳定律假设了吸收粒子之间是无相互作用的, 因此仅在稀溶液(c < 10-2 mol/L )的情况下才适用。
(2)非单色光引起的偏离
朗伯一比尔定律只对一定波长的单色光才能成立,但 在实际工作中,入射光是具有一定波长范围的。
无机及分析化学
18
化学因素
溶质的离解、缔合、互变异构及化学变化也会引起偏离。
不同的显色反应的适宜 pH 是通过实验确定的。 无机及分析化学
24
3 、显色温度:要求标准溶液和被测溶液在测定 过程中温度一致。
4 、显色时间:通过实验确定合适的显色时间, 并在一定的时间范围内进行比色测定。
5、溶 剂:有机溶剂降低有色化合物的解离度, 提高显色反应的灵敏度。 6、共存离子的影响
无机及分析化学
偏离朗伯—比尔定律。
无机及分析化学
19
§10-2 显色反应及其影响因素
一、显色反应与显色剂
显色剂
显色反应:加入某种试剂使被测组分变成有色化合物的反应 在光度分析中生成有色物质的反应主要有配位反应、 氧化还原反应等,其中以配位反应应用最广。
分析化学实验

分析化学实验目录第一章分析化学实验基本知识第一节分析化学实验的目的与要求第二节分析化学实验常用试剂与溶液配置第二章实验内容第一节化学分析实验一、酸碱滴定实验一氢氧化钠标准溶液的配制、标定和苯甲酸的测定实验二混合酸(盐酸和磷酸)的测定实验三.盐酸标准溶液的标定和药用氢氧化钠的测定二、非水滴定实验四高氯酸标准溶液的标定三、配位滴定实验五EDTA 标准溶液的标定和水的硬度的测定实验六药用明矾的测定实验七氧化还原滴定(一)硫代硫酸钠标准溶液的配制与标定(二)高锰酸钾标准溶液的标定和过氧化氢的测定实验八沉淀滴定硝酸银标准溶液、硫氰酸铵标准溶液的标定第二节仪器分析实验一、电化学分析法实验一用pH计测定溶液的pH值实验二磷酸的电位滴定实验三磺胺嘧啶的测定二、紫外—可见分光光度法实验三邻二氮菲比色法测定铁的条件实验实验四校正曲线法测定水中铁的含量实验五双波长分光光度法测定复方磺胺甲基恶唑中磺胺甲基恶唑和甲氧苄啶实验六导数光谱法测定安钠咖注射液中咖啡因的含量三、荧光分析法实验七硫酸奎宁的激发光谱、发射光谱的测定和含量的测定四、红外分光光度法实验八傅立叶变换红外光谱仪的性能检查和阿司匹林红外光谱的测定五、色谱法实验九薄层色谱法测定氧化铝的活性实验十氧化铝的活性测定方法(柱色谱法)实验十一纸色谱分离鉴别氨基酸成分实验十二纸色谱分离鉴别糖类成分实验十三苯、甲苯、二甲苯的分离鉴别和含量测定实验十四内标对比法测定酊剂中的乙醇实验十五内标对比法测定对乙酰氨基酚实验十六校正因子法测定复方炔诺酮中炔诺酮和炔雌醇实验十七外标法测定阿莫西林第三节综合性实验实验一未知样品的鉴别及含量测定实验二铜盐含量的测定(取样方法、含量测定)实验三葡萄糖中水及葡萄糖的含量测定(重量分析、滴定分析)实验四对乙酰氨基酚的吸光系数测定(精制、HPLC归一化法纯度检查、吸光系数测定)第四节设计性实验实验一化学定量分析实验二仪器分析第一章分析化学实验基本知识第一节分析化学实验的目的和要求分析化学是一门实践性很强的学科,分析化学实验与分析化学理论课一样,是化学和药学类专业的主要基础课程之一。
分析化学(第五版) 第10章 吸光光度法

10.1 概述 10.2 吸光光度法基本原理 10.3 分光光度计 10.4 显色反应及影响因素 10.5 光度分析法的设计 10.6 吸光光度法的误差 10.7 常用的吸光光度法 10.8 吸光光度法的应用
10.1 概述 吸收光谱 发射光谱 散射光谱 分子光谱 原子光谱
吸光光度法:分子光谱分析法的一种, 吸光光度法:分子光谱分析法的一种,又称分光光 度法, 度法,属于分子吸收光谱分析方法 基于外层电子跃迁
e 溶剂 有机溶剂,提高灵敏度、 有机溶剂,提高灵敏度、显色反应速率 f 干扰离子 消除办法: 消除办法: 提高酸度,加入隐蔽剂, 提高酸度,加入隐蔽剂,改变价态 选择合适参比 铬天菁S测 ,氟化铵褪色,消除锆、 钴干扰) 褪色空白(铬天菁 测Al,氟化铵褪色,消除锆、镍、钴干扰 选择适当波长
10.5 光度分析法的设计
2 物理化学因素 非均匀介质 胶体,悬浮、乳浊等对光产生散射, 胶体,悬浮、乳浊等对光产生散射,使实测 吸光度增加, 吸光度增加,导致线性关系上弯 化学反应 离解、缔合、 离解、缔合、异构等 如:Cr2O72-+H2O-=2HCrO4-=2H++2CrO42PAR的偶氮-醌腙式 的偶氮- 的偶氮
根据吸光度的加和性可以进行多组分的测定以及 某些化学反应平衡常数的测定
10.3 吸光光度计
1 分光光度计的组成
读出系统 光源 单色器 样品池 检测器
常用光源
光源 氢灯 氘灯 钨灯 卤钨灯 氙灯 能斯特灯 空心阴极灯 激光光源 波长范围(nm) 185~375 185~400 320~2500 250~2000 180~1000 1000~3500 特有 特有 适用于 紫外 紫外 可见,近红外 紫外,可见,近红外 紫外、可见(荧光) 红外 原子光谱 各种谱学手段
分析化学第三版下册答案

2 第一章绪论5 第二章光学分析法导论7 第三章紫外-可见吸收光谱法9 第四章红外吸收光谱法11 第五章分子发光分析法13 第六章原子发射光谱法21 第七章原子吸收与原子荧光光谱法27 第八章电化学分析导论30 第九章电位分析法34 第十章极谱分析法37 第十一章电解及库仑分析法41 第十二章色谱分析法第一章绪论1.解释下列名词:(1)仪器分析和化学分析;(2)标准曲线与线性范围;(3)灵敏度、精密度、准确度和检出限。
答:(1)仪器分析和化学分析:以物质的物理性质和物理化学性质(光、电、热、磁等)为基础的分析方法,这类方法一般需要特殊的仪器,又称为仪器分析法;化学分析是以物质化学反应为基础的分析方法。
(2)标准曲线与线性范围:标准曲线是被测物质的浓度或含量与仪器响应信号的关系曲线;标准曲线的直线部分所对应的被测物质浓度(或含量)的范围称为该方法的线性范围。
(3)灵敏度、精密度、准确度和检出限:物质单位浓度或单位质量的变化引起响应信号值变化的程度,称为方法的灵敏度;精密度是指使用同一方法,对同一试样进行多次测定所得测定结果的一致程度;试样含量的测定值与试样含量的真实值(或标准值)相符合的程度称为准确度;某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
2. 对试样中某一成分进行5次测定,所得测定结果(单位μg ⋅mL -1)分别为 0.36,0.38,0.35,0.37,0.39。
(1) 计算测定结果的相对标准偏差;(2) 如果试样中该成分的真实含量是0.38 μg ⋅mL -1,试计算测定结果的相对误差。
解:(1)测定结果的平均值37.0539.037.035.038.036.0=++++=x μg ⋅mL -1 标准偏差122222120158.015)37.039.0()37.037.0()37.035.0()37.038.0()37.036.0(1)(-=⋅=--+-+-+-+-=--=∑m Lg n x x s n i iμ相对标准偏差 %27.4%10037.00158.0%100=⨯=⨯=x s s r (2)相对误差 %63.2%10038.038.037.0%100-=⨯-=⨯-=μμx E r 。
分析化学知识点总结

第二章第三章第四章:准确度:指测量值与真实值接近的程度。
精确度:指各平行测量值之间相互接近的程度。
系统误差:由某种确定原因造成的误差,可用进行比较、校准仪器、对照试验、空白试验、以及回收试验等方法进行校正。
偶然误差:也叫随机误差,是由偶然因素引起的误差。
可用增加平行试验次数进行处理。
有效数字:是指在分析工作中实际上能测量到的数字,通常包括全部准确值和最后一位欠准确的值。
相对平均偏差:_1_r ||x n x x d n i i ∑=--=相对标准偏差:%100_r ⨯=x ss有效数字的计算:四舍六入五留双,例如:0.0250精确到一位有效数字0.02,0.0150则为0.02。
第五章;化学计量点:当加入的滴定剂的量与被测物质的量之间恰好满足化学反应式所表示的计量关系时,即为化学计量点。
滴定终点:滴定剂刚好变色时便停止滴定,这一点便为滴定终点。
滴定突跃:在化学计量点前后+-0.1%范围内,被测溶液浓度以及相关参数所发生的急剧变化称为滴定突跃。
In+X=XIn ,指示剂具有两种明显不同的颜色,在滴定突跃范围内由一种型体变化为另一种型体,溶液颜色发生明显变化。
基准物质:是用以直接配制标准溶液或者标定标准溶液浓度的物质。
条件:组成与化学式完全相符、纯度足够高、性质稳定、最好有较大的摩尔质量,以减少称量时的误差、应按滴定反应式定量进行反应,且没有副反应。
滴定度:每毫升标准溶液相当于被测物质的质量。
分布系数:指溶液中某型体的平衡浓度在溶质总浓度中所占的分数。
质子条件式:可用质量平衡和电荷平衡推出。
第六章:酸碱指示剂:一类有机弱酸或弱碱,它们的共轭酸碱对具有不同结构,呈现不同颜色。
HIn=H+In (In 为碱式色)非水滴定:1.酸性溶剂:给出质子能力较强的溶剂,例如冰醋酸,丙酸。
滴定弱碱性物质的介质。
2.碱性溶剂:接受质子的溶剂,例如乙二胺。
3.两性溶剂:既能接受质子又能给出质子的溶剂。
滴定不太弱的酸碱。
无机及分析化学第10章-常用的分离方法

2.微量组分的富集 离子交换树脂是富集微量组分的有
效方法之一。
*第五节 一般无机试样的制备
一、水溶法 二、酸溶法
三、 碱溶法 四、熔融分解法
第六节 一般物质的分析步骤
一、初步观察及溶样
试样外表的初步观察是指观察试样的性状,如颜色、 颗粒大小、结晶形状等,由此可推断试样中可能含有的 元素。
溶样是取少量试样,先以水为溶剂,若不溶时,可 依次选盐酸、硫酸或硝酸溶解,以确定适合的溶剂。由 溶二样、所阳得离溶液子的分颜析色还可估计可能存在的离子。
1.螯合萃取体系萃取条件的选择 (1)萃取剂的选择。 所选择的萃取剂与被萃取的金属
离子形成的螯合物越稳定,则萃取效率就越高。萃 取剂含有疏水基团越多,亲水基团越少,萃取效率 就越高。
(2)溶液的酸度。 溶液的酸度越小,越有利于萃取。 但是溶液酸度过低,金属离子可能发生水解,通过 控制溶液的酸度还可以提高萃取的选择性,借以达到 分离的目的。
萃取的过程,是将物质的亲水性转化为疏水性 的过程。
萃取分离法正是根据物质的亲水性和疏水性的差异来 进行萃
取分离。将亲水性的离子变为疏水性的化合物。 如果需要把有机相中的物质再转入水相中,这
个过程叫 反萃取。
一般说来,同量的萃取溶剂,分几次萃取的效
第二节 萃取分离法
二、萃取条件
不同的萃取体系,对萃取条件的要求不同,主要 有以下几点原则。
第四节 离子交换分离法
二、离子交换分离操作
2.交换 将欲分离的试液缓慢注入交换柱中,并以一定 的流速,流经交换柱进行交换。 3.洗脱过程 将交换到树脂上的离子,用洗脱剂置换下 来,是交换过程的逆过程。 4.再生 使交换柱上的树脂恢复到交换前形式的过程叫 再生,有时洗脱过程就是再生过程。
[无极及分析化学]各章知识点
![[无极及分析化学]各章知识点](https://img.taocdn.com/s3/m/6a2d240a16fc700abb68fc25.png)
3.掌握运用盖斯定律进行化学反应自由能变(参 考状态单质的标准摩尔自由能 = 零、反应自由能 由物质的生成自由能求得)。 4.掌握利用反应焓变、熵变、自由能变等热力学、 数据判断化学反应的方向、反应自发进行的温度 (低温、高温、任何温度)、反应是否自发可用温 度来调整。
5.掌握标准反应平衡常数的表达、利用已知 反应平衡常数求其他反应的平衡常数。 6.掌握化学平衡的移动;掌握标准自由能变 与标准平衡常数之间的换算;浓度、压力、温 度对化学平衡的影响。
第二章 化学反应的一般原理
一 、基本概念 5.化学反应速率(化学反应速率的概念、化学反 应速率方程式、反应速率(碰撞、过渡态)理论、 活化能、温度、催化剂对反应速度的影响) 6.化学反应条件的优化
二 计算
1.掌握运用盖斯定律进行化学反应焓变的计 算(参考状态单质的标准摩尔生成焓=零、反应 焓由物质的生成焓或燃烧焓求得) 2.熵(熵的变化规律、反应或过程前后熵的 变化)
二 、计算 1.分步沉淀 2. 定量分离的条件 3. 沉淀的溶解的平衡计算
第六章 氧化还原平衡与氧化还原滴定法
一、基本概念(术语) 1.电极电位 (条件、标准)。 2. 原电池写法(给定化学反应式能分解成正、 负极,并写出原电池的表示式)。 3. 判断氧化和还原反应进行的方向(用标准电 极电位的判断)。 4. 氧化和还原反应的平衡常数。
14. 共价键的特点共价化合物的特点 15.共价键的类型 16 . 杂化轨道和化合物的构型 17. 分子间的力(色、取、诱及氢键 18. 离子的极化 (极化力和变形性、对 晶体键型的影响、对化合物的影响)
第八章
配位化合物与配位滴定
一.基本概念(术语) 1.配合物的组成和命名 2. 配合物中心离子的杂化轨道类型 3. 内轨和外轨配合物,内轨和外轨配合物 合物与磁矩的关系. 4. 高自旋、低自旋配合物 5. 配合平衡的移动(酸度、沉淀、氧化 还原其的影响)
大学分析化学第一册第一章绪论[1]
![大学分析化学第一册第一章绪论[1]](https://img.taocdn.com/s3/m/4a7204d716fc700aba68fc1b.png)
作业每周二交,随机抽查,批改1/3。
学习方法:
预习、听讲、复习总结(查阅资料和文献)、 做作业;课外讨论学习。
1.学会应用知识去解决问题。
2. 以教材为主线,课堂讲课内容为重点,阅读相关 的资料和文献,扩大知识面。
3.实验是培养能力的重要环节,加强实验基础技能 训练。
2021/3/7
4
知之者不如好之者, 好之者不如乐之者。
5
二、分析化学的发展趋势
1.由分析对象来看
无机物分析
有机 物分析
2.由分析对象的数量级来看
常量
微量
痕量
生物活性物质
分子水平
3.由分析自动化程度来看
手工操作 仪器 自动
全自动
智能化仪器
No Image
定量分析的一般程序
取样与制样 分析试样必须具有代表性
试样的干燥 试样分解
一定温度下干燥试样,除去湿存水 用溶解或熔融法制备试液
社,2005. (3)分析化学(第4版、第5版 ),武汉大学等
, 高 教 出 版 社 , 2000 、
2006 (4)分析化学(第5版) 华东理工大学化学系主
编 高教出版社出版,
(5)21 2021/3/7 世纪的分析化学,汪尔康主编,科学3出
成绩评定:
期末考占70%,平时30%(作业、课堂作业、 学习态度等)。
13
三、分析化学的特点
1.分析化学中突出“量”的概 念
2.分析试样是一个获取信息、 降低3.系实统验的性不强确定性的过程
4.综合性强 分析化学工作者应具有很强的 责任心,高尚的职业道德。
2
第一章 绪论
第二节 分析方法的分类
一 、按分析任务分类 二、 按分析对象分类 三、 按分析原理和
(整理)分析化学每一章的名词解释和问答题.

第一章蛋白质的结构与功能名词解释1.肽单元2.模体3.蛋白质变性4.β-折叠5.分子伴侣6.protein quaternary structure7.结构域8.蛋白质等电点9.辅基10.肽键11.α- 螺旋12.变构效应13.蛋白质一级结构14.蛋白质二级结构15.蛋白质三级结构16.蛋白质四级结构17.亚基18.肽问答题1.为何蛋白质的含氮量能表示蛋白质相对量?实验中又是如何依此原理计算蛋白质含量的?2.蛋白质的基本组成单位是什么?其结构特征是什么?3.何为氨基酸的等电点?如何计算精氨酸的等电点?(精氨酸的α- 羧基、α- 氨基和胍基的 pK 值分别为 2.17 , 9.04 和 12.48 )4.何谓肽键和肽链及蛋白质的一级结构?5.什么是蛋白质的二级结构?它主要有哪几种?各有何结构特征? 6 .举列说明蛋白质的四级结构。
7.已知核糖核酸酶分子中有 4 个二硫键,用尿素和β- 巯基乙醇使该酶变性后,其 4 个二硫键全部断裂。
在复性时,该酶 4 个二硫键由半胱氨酸随机配对产生,理论预期的正确配对率为 1 %,而实验结果观察到正确配对率为 95 %~100 %,为什么?8.什么是蛋白质变性?变性与沉淀的关系如何?9.举列说明蛋白质一级结构、空间构象与功能之间的关系。
10.举例说明蛋白质的变构效应。
11.常用的蛋白质分离纯化方法有哪几种?各自的作用原理是什么?12.测定蛋白质空间构象的主要方法是什么?其基本原理是什么?第二章核酸的结构与功能名词解释1.核小体2.碱基互补(碱基配对)3.脱氧核苷酸4.增色效应5.Tm值6.核糖体7.核酶8.核酸分子杂交9.TΨC 环10.反密码环11.Z-DNA12.核酸变性13.核酸复性问答题1.细胞内有哪几类主要的 RNA ?其主要功能是什么?2.用32P标记的病毒感染细胞后产生有标记的后代,而用35S标记的病毒感染细胞则不能产生有标记的后代,为什么?3.一种 DNA 分子含 40 %的腺嘌呤核苷酸,另一种 DNA 分子含 30 %的胞嘧啶核苷酸,请问哪一种 DNA 的 Tm 值高?为什么?4.已知人类细胞基因组的大小约 30 亿 bp ,试计算一个二倍体细胞中 DNA 的总长度,这么长的 DNA 分子是如何装配到直径只有几微米的细胞核内的?5.简述 DNA 双螺旋结构模式的要点及其与 DNA 生物学功能的关系。
分析化学课程学习指导

分析化学课程学习指导一、分析化学十分注重对学生进行“量”的概念的培养。
初学完无机化学的学生在学习分析化学课程时,对分析化学处理复杂体系化学平衡的方法不易接受。
其主要的问题是,分析化学在处理复杂体系的化学平衡时采用了不同于无机化学的方法。
分析化学在处理复杂体系化学平衡时,根据平衡体系精确的化学计量关系,得到精确的计算式,然后根据实际情况,在允许的误差范围内对精确式作近似处理。
这个过程体现了分析化学对“量”与“误差”的把握。
通过比较不难发现,当近似到一定的程度时,无论是用无机化学的方法,还是分析化学的方法,所得到的结果是一样的。
分析化学在定量处理复杂平衡体系时,援引了A.Ringbom的副反应系数求条件常数的方法,使化学平衡的处理有了统一的思路,有利于学生建立起完整、系统的平衡概念和处理方法。
副反应系数是分析化学处理复杂体系化学平衡的重要知识点。
学生在掌握这一知识点时,应注意所讨论体系的主、副反应,进而找出副反应对主反应的影响。
二、容量分析的体系沿用四类滴定分章讲述,即先介绍平衡,再讲滴定曲线、指示剂、误差应用。
学生在学习时应注意掌握各种化学平衡与滴定分析方法之间的内在联系和处理问题的方法。
三、分析化学作为化学的一个分支学科,一方面,其理论与实验技术的发展离不开化学其他分支学科的发展;另一方面,分析化学的发展对化学其他分支学科的发展也起着重要作用。
在学习本课程时,要注意分析化学原理和方法与化学其他分支学科的内在的联系。
四、分析化学原理与方法的建立有赖于物理学、数学、电子学、信息科学及生物学等学科的发展。
分析化学的应用也广泛涉及生命科学、环境科学、材料科学、医学、地质、地理等学科。
在学习本课程时,学生应掌握必要的无机化学、普通物理、高等数学的知识。
建议学生在修完相应的课程后,再选修本课程。
在了解分析化学原理与方法的应用时,要注意结合应用对象的性能特征加以理解。
例如,分析生物样品中的无机元素和生物有机分子将采用完全不同的样品处理方法。
分析化学知识点总结

第一章绪论第一节分析化学及其任务和作用定义:研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的科学.是化学学科的一个重要分支.是一门实验性、应用性很强的学科第二节分析方法的分类一、按任务分类定性分析:鉴定物质化学组成(化合物、元素、离子、基团)定量分析:测定各组分相对含量或纯度结构分析:确定物质化学结构(价态、晶态、平面与立体结构)二、按对象分类:无机分析.有机分析三、按测定原理分类(一)化学分析定义:以化学反应为为基础的分析方法.称为化学分析法.分类:定性分析重量分析:用称量方法求得生成物W重量定量分析滴定分析:从与组分反应的试剂R的浓度和体积求得组分C的含量反应式:mC+nR→CmRnX V W特点:仪器简单.结果准确.灵敏度较低.分析速度较慢.适于常量组分分析(二)仪器分析:以物质的物理或物理化学性质为基础建立起来的分析方法。
仪器分析分类:电化学分析 (电导分析、电位分析、库伦分析等)、光学分析(紫外分光光度法、红外分光光度法、原子吸收分光光度核磁共振波谱分析等)、色谱分析(液相色谱、气相色谱等)、质谱分析、放射化学分析、流动注射分析、热分析特点:灵敏.快速.准确.易于自动化.仪器复杂昂贵.适于微量、痕量组分分析四、按被测组分含量分类-常量组分分析:>1%;微量组分分析:0.01%~1%;痕量组分分析;< 0.01%五、按分析的取样量分类试样重试液体积常量分析 >0.1g >10ml半微量 0.1~0.01g 10~1ml微量 10~0.1mg 1~0.01ml超微量分析 <0.1mg ﹤0.01ml六、按分析的性质分类:例行分析(常规分析)、仲裁分析第三节试样分析的基本程序1、取样(采样):要使样品具有代表性.足够的量以保证分析的进行2、试样的制备:用有效的手段将样品处理成便于分析的待测样品.必要时要进行样品的分离与富集。
3、分析测定:要根据被测组分的性质、含量、结果的准确度的要求以及现有条件选择合适的测定方法。
分析化学第10章-吸光光度法

电磁辐射波谱图
• 能 谱:波长很短(小于10nm)、能量大于102eV(如γ射线和X射线) 的电磁波谱,粒子性比较明显,称为能谱。——能谱分析法。 • 波 谱:波长大于1mm、能量小于10-3eV(如微波和无线电波)的电 磁波谱,波动性比较明显,称为波谱。——波谱分析法。 • 光学光谱:波长及能量介于以上两者之间的电磁波谱,通常借助 于光学仪器获得,称为光学光谱。——光谱分析法。 • 复合光:物质发出的光,是包含多种频率成分的光。 • 单色光:光谱分析中,常常采用一定的方法获得只包含一种频率 成分的光(单色光)来作为分析手段。 • 单色性:单色光的单色性通常用光谱线的宽度(或半宽度)表示。
波长范围/nm
400-450 450-480 480-490 490-500 500-560 560-580 580-600 600-650 650-700
物质颜色和吸收光颜色的关系
(2) 物质对光的选择性吸收(CuSO4溶液为何只吸收黄色光?)
当一束光照射到某物质或其溶液时,组成该物质的分子、 原子或离子与光子发生 “碰撞”,光子的能量就转移到分子、 原子上,使这些粒子由最低能态(基态)跃迁到较高能态 (激发态): M + hυ → M* 这个作用叫物质对光的吸收。 分子、原子或离子具有不连续的量子化能级,仅当照射光
分子光谱——气态或溶液中的分子---电子能级、振动能级和转动 能级跃迁 --- 发射或吸收的是一定频率范围的电磁辐 射组成的带状光谱。 分子光谱有三个层次: 转动光谱-反映分子纯转动能级跃迁引起的转动能量的变化。 分子转动能量小于 0.05 eV ,相当于远红外光的能 量,在远红外波段。 振动光谱-反映分子纯振动能级跃迁引起的转动能量的变化。分 子振动能量为0.05-1.0 eV,位于中红外波段。 电子光谱-反映分子纯电子能级跃迁引起的转动能量的变化。分 子转动能量小于 1.0-20 eV ,位于可见或紫外光波段。 固体光谱——炽热的固体物质及复杂分子受激后---发射出波长范 围相当广阔的连续光谱。
分析化学基础知识培训

分析化学基础知识培训分析化学是化学学科的一个重要分支,它主要研究物质的组成和性质,以及分子之间的相互作用和反应。
分析化学在化学工业、环境监测、生物医学、食品安全等领域有着广泛的应用。
为了提高从事相关工作的人员的专业素养,进行分析化学基础知识的培训是非常关键的。
首先,分析化学基础知识培训应包括基本概念和常用方法。
学习者需要了解分析化学的基本概念,例如,什么是定性分析和定量分析,什么是化学计量学,什么是常用的分析方法等等。
学习者还需要了解常见的分析化学仪器和设备,例如质谱仪、红外光谱仪、核磁共振仪等等,以及它们的原理和应用。
其次,培训中应介绍分析化学的样品制备和处理方法。
样品制备是分析化学中不可或缺的环节,它决定了后续分析的准确性和可靠性。
学习者需要了解各种样品制备和处理方法,例如提取、萃取、稀释、溶解等等,并学会根据具体实验目的选择合适的方法。
此外,培训还应涵盖分析化学的常见分析方法。
分析化学的研究对象多种多样,因此有多种分析方法可供选择。
培训中需要介绍常见的分析方法,例如光谱分析、色谱分析、电化学分析等等。
学习者需要了解这些方法的原理、操作步骤、样品要求以及数据分析处理方法。
分析化学基础知识培训还应涉及数据处理和质量控制的内容。
分析化学实验中产生的数据需要进行处理和分析,以得出准确和可靠的结果。
培训中需要介绍数据处理的方法,例如如何进行数据平滑和修正,如何进行数据统计和误差分析。
此外,还需要介绍质量控制的重要性和常用方法,例如如何进行质量控制样品的制备和检测。
最后,培训还应包括分析化学在实际应用中的案例分析。
学习者通过分析实际案例,了解分析化学在不同领域的应用和挑战,提高自己解决实际问题的能力。
总之,分析化学基础知识培训应包括基本概念和常用方法、样品制备和处理方法、常见分析方法、数据处理和质量控制的内容,以及实际应用案例分析。
通过培训,学习者可以全面了解分析化学的基本知识和应用,提高自己的专业素养和实践能力。
分析化学课后习题答案(第7-12章)

第七章原子吸收与原子荧光光谱法1.解释下列名词:(1)原子吸收线和原子发射线;(2)宽带吸收和窄带吸收;(3)积分吸收和峰值吸收;(4)谱线的自然宽度和变宽;(5)谱线的热变宽和压力变宽;(6)石墨炉原子化法和氢化物发生原子化法;(7)光谱通带;(8)基体改进剂;(9)特征浓度和特征质量;(10)共振原子荧光和非共振原子荧光。
答:(1)原子吸收线是基态原子吸收一定辐射能后被激发跃迁到不同的较高能态产生的光谱线;原子发射线是基态原子吸收一定的能量(光能、电能或辐射能)后被激发跃迁到较高的能态,然后从较高的能态跃迁回到基态时产生的光谱线。
(2)分子或离子的吸收为宽带吸收;气态基态原子的吸收为窄带吸收。
(3)积分吸收是吸收线轮廓的内的总面积即吸收系数对频率的积分;峰值吸收是中心频率ν0两旁很窄(dν= 0)范围内的积分吸收。
(4)在无外界条件影响时,谱线的固有宽度称为自然宽度;由各种因素引起的谱线宽度增加称为变宽。
(5)谱线的热变宽是由原子在空间作相对热运动引起的谱线变宽;压力变宽是由同种辐射原子间或辐射原子与其它粒子间相互碰撞产生的谱线变宽,与气体的压力有关,又称为压力变宽。
(6)以石墨管作为电阻发热体使试样中待测元素原子化的方法称为石墨炉原子化法;反应生成的挥发性氢化物在以电加热或火焰加热的石英管原子化器中的原子化称为氢化物发生原子化法。
(7)光谱通带是指单色器出射光束波长区间的宽度。
(8)基体改进剂是指能改变基体或被测定元素化合物的热稳定性以避免化学干扰的化学试剂。
(9)把能产生1%吸收或产生0.0044吸光度时所对应的被测定元素的质量浓度定义为元素的特征浓度;把能产生1%吸收或产生0.0044吸光度时所对应的被测定元素的质量定义为元素的特征质量。
(10)共振原子荧光是指气态基态原子吸收的辐射和发射的荧光波长相同时产生的荧光;气态基态原子吸收的辐射和发射的荧光波长不相同时产生的荧光称为非共振原子荧光。
无机及分析化学教案

无机及分析化学教案一、教学目标1. 知识与技能:(1)掌握无机化学的基本概念、原理和常见元素化合物的性质;(2)了解分析化学的基本原理和方法,具备基本的实验操作能力。
2. 过程与方法:(1)通过实验和观察,培养学生的科学思维和实验技能;(2)运用化学知识分析和解决实际问题。
3. 情感态度与价值观:(1)培养学生的科学素养,激发对化学学科的兴趣;(2)强化学生的环保意识,注重化学实验的安全操作。
二、教学内容1. 第一章:无机化学基本概念(1)物质的组成与结构(2)化学反应的基本类型(3)酸碱盐的基本概念2. 第二章:元素周期律与元素周期表(1)原子结构与元素周期律(2)元素周期表的结构与应用(3)常见元素的性质及应用3. 第三章:无机化合物(1)氧化物及其分类(2)酸碱盐的性质及分类(3)常见无机化合物的性质与应用4. 第四章:分析化学基本原理(1)定量分析的基本方法(2)定性分析的基本方法(3)分析仪器的使用与维护5. 第五章:实验操作技能(1)基本实验操作(2)常见仪器的使用(3)实验数据的处理与分析三、教学方法1. 采用讲授与实验相结合的教学方式,让学生在理论指导下进行实验操作;2. 利用多媒体手段,直观展示化学反应原理和实验操作过程;3. 设置课堂讨论和小组合作,培养学生的团队协作能力和解决问题的能力;4. 注重个体差异,鼓励学生提问和发表见解,提高学生的自主学习能力。
四、教学评价1. 平时成绩:包括课堂表现、作业完成情况和小测验成绩;3. 期中期末考试:考察学生对无机及分析化学知识的掌握程度。
五、教学资源1. 教材:无机化学、分析化学等相关教材;2. 实验器材:实验室常用的仪器和设备;3. 多媒体课件:用于直观展示化学反应原理和实验操作过程;4. 网络资源:查阅相关资料,拓展学生知识面。
六、第四章:分析化学基本原理(续)4. 第四章:分析化学基本原理(续)(1)滴定分析法(2)原子吸收光谱法(3)红外光谱法、紫外光谱法七、第五章:实验操作技能(续)5. 第五章:实验操作技能(续)(1)无机化学实验(2)分析化学实验(3)实验数据处理与分析八、第六章:常见无机化合物及其应用6. 第六章:常见无机化合物及其应用(1)金属元素化合物(2)非金属元素化合物(3)无机化合物的工业应用九、第七章:现代分析化学技术7. 第七章:现代分析化学技术(1)X射线荧光光谱法(2)质谱法(3)色谱法十、第八章:化学实验安全与环保8. 第八章:化学实验安全与环保(1)实验室安全知识(2)化学品的安全使用(3)实验室废弃物的处理十一、第九章:案例分析与讨论9. 第九章:案例分析与讨论(1)化学事故案例分析(2)环境保护案例分析(3)化学在生活中的应用案例分析十二、第十章:复习与拓展10. 第十章:复习与拓展(1)无机及分析化学知识的复习(2)化学实验技能的拓展(3)化学研究前沿的介绍重点和难点解析:一、教学目标二、教学内容三、教学方法四、教学评价五、教学资源六、第四章:分析化学基本原理(续)七、第五章:实验操作技能(续)八、第六章:常见无机化合物及其应用九、第七章:现代分析化学技术十、第八章:化学实验安全与环保十一、第九章:案例分析与讨论十二、第十章:复习与拓展本教案以培养学生科学素养、实验技能和环保意识为核心,通过多样化的教学方法和资源,覆盖了无机化学基本概念、元素周期律与元素周期表、无机化合物、分析化学基本原理、实验操作技能等多个方面。
第10章 配位化学前沿

16-Crown-5
18-Crown-6
21-Crown-7
A D + M+
-
D M
+
A
-
D M D
+
D M
+
D
2). 环糊精的分子识别 环糊精是由淀粉经酶促水解而生成的一 类由6~14个吡喃式α-D-葡萄糖所构成的环状
多糖。环状六员多糖称α-环糊精;环状七员多糖 称β-环糊精;环状八员多糖称γ-环糊精.三者的构 象都是圆锥体。
结构测定表明:
C60分子有12个五边形和20个六边形面围成的 球体。60个C原子处于32面体的顶点上,可 看作一截顶20面体(B12H122-),属于Ih点群对 称性。所有的C原子都是等价的。每个C原子 以近似与sp2.28方式杂化,分别与周围3个C原 子相连,形成3个σ键,剩余的轨道和电子共 同组成离域π键。 C70分子具有D5h对称性, 它是由两个类似于C60的半球体通过一组额外 的10个C原子桥联而成。富勒烯分子属于柏 拉图体结构,故服从Euler公式: F(面数), V(顶点数),E(棱边数) F+V=E+2
二. 金属原子簇合物
金属间通过两个或两个以上金属-金属键 形成多面体结构的化合物, 例如 Re2Cl82-, Re3Cl123-, Nb6Cl122+, Mo6Cl84+ and H2Ru6(CO)18 1。多核金属羰基化合物 多核金属羰基化合物中也存在着 M-M 键,故也属于金属羰基化合物。
OC OC Mn OC
诊断的重要工具。因而获得2003年诺贝 尔生理医学奖。但单纯水质子共振成像 灵敏度低,故需加入某种顺磁性造影剂, 以缩短弛豫时间T1, T2,提高成像对比度 和清晰度。其中Gd-L配合物是最好的造 影剂。例如
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:
20.32 + 8.4054 -0.0550 =? 20.32 + 8.41 – 0.06 = 28.67
乘除法: 乘除法: 以 有 效 数 字 位 数 最 少 的 数 为 准 即以相对误差最大的数为准) (即以相对误差最大的数为准)
例:
0.0212×22.62÷0.2915=? × ÷ 0.0212×22.6÷0.292=1.64 × ÷
零的有效数字 出现在第一位非零数字之前, ★出现在第一位非零数字之前,不算有效数字
0.02000 L (4位) , 0.0280 g (3位) 位 位
出现在两个非零数字之间或所有非零数字之后, ★出现在两个非零数字之间或所有非零数字之后, 记入有效数字 10.0400 (6位) 位 改变单位, ★ 改变单位,有效数字不变
有效数字修约规则: --四舍六入五留双 有效数字修约规则: --四舍六入五留双
例: 要修约为四位有效数字时 要修约为四位有效数字时:
尾数 ≤ 4时舍, 0.52664 ------- 0.5266 时 时入, 尾数 ≥ 6时入 0.36266 ------- 0.3627 时入 留双: 尾数 = 5时, 若后面数为 舍5留双 时 若后面数为0, 留双 10.235----10.24, 250.65----250.6 后面还有不是0的任何数皆入 若5后面还有不是 的任何数皆入 18.0850001----18.09 后面还有不是 的任何数皆入:
二、误差的表示方法 ---准确度、精密度、误差和偏差 准确度、 准确度 精密度、
测定结果与“真值” 测定结果与“真值”接近的程 准确度: 准确度: 度 误差表示 表示) (用误差表示) 绝对误差 = 测定值 - 真实值 = X - XT 绝对误差 相对误差 = ×100% 真实值 X – XT = ×100% XT
注意: 549, 注意:6.549, 2.451 6.5
一次修约至两位有效数字
2.5
只能对数字进行一次性修约
有效数字计算规则: ---先修约 有效数字计算规则: ---先修约,后计算 先修约, 加减法: 加减法: 以小数点后位数最少的数为准 即以绝对误差最大的数为准) (即以绝对误差最大的数为准)
被称量物质质量越大,相对误差越小, 被称量物质质量越大,相对误差越小, 准确度越高
平行测定的结果互相靠近的程度 精密度: 精密度: 偏差表示 表示) (用偏差表示)
绝对偏差(di) = 测定值-测定算术平均值 绝对偏差( 测定值-
=x −x
i
测定算术平均值× 相对偏差 = 绝对偏差 / 测定算术平均值×100%
1 2
读数: 1.14. 读数
在记录过程中,有效数字的位数不能随意添 在记录过程中 有效数字的位数不能随意添 加或减少。如 2.25cm →2.250 cm× 加或减少。 ×
m ◆分析天平 称至 分析天平(称至 称至0.1mg): 12.8218 g (6) , 0.2338 g (4) V ★滴定管 量至 滴定管(量至 量至0.01 mL): 26.32 mL (4), 3.97 mL (3)
二、偶然误差的正态分布
正负误差出现的几率相等 小误差出现的次数多, 小误差出现的次数多,大误差 出现的次数少 偶然误差出现的概率符合高斯 正态分布曲线
− 1 y = f ( x) = e σ 2π ( x−µ )2 2σ 2
令 z = ±(x-µ)/σ, 则有 x= µ±zσ µ
1 y= e σ 2π
z2 − 误差出现的概率密度; 单次测定值; 误差出现的概率密度 单次测定值 无限次测量的算术平均值(作为真实值 µ---无限次测量的算术平均值 作为真实值 无限次测量的算术平均值 作为真实值); σ---无限次测量的标准偏差 无限次测量的标准偏差
置信度或置信水平 置信水平
数组1: 数组 :+0.1, +0.4, 0.0, -0.3, +0.2, -0.3, +0.2, -0.2, -0.4, +0.3 数组2: 数组 :-0.1, -0.2, +0.9, 0.0, +0.1, +0.1, 0.0, +0.1, -0.7, -0.2 数组 1: 数组 2:
x = 0.0
2 × 0.01 RE % = × 100% ≤ 0.1% v
⇒ v ≥ 20mL
二、减少测定过程中的系统误差的方法
对照试验: ---消除方法误差 对照试验: ---消除方法误差 a. 用标准试样 b. 用已知的标准方法
---采用标准样加入法,用自己的分析方法, ---采用标准样加入法,用自己的分析方法, 采用标准样加入法 在同样条件下,测定分析试样的结果, 在同样条件下,测定分析试样的结果,可以检验 是否存在方法误差。 是否存在方法误差。
10-2 定量分析方法的分类
按实验手段的不同,可将定量分析方法分为两大类 按实验手段的不同 可将定量分析方法分为两大类: 可将定量分析方法分为两大类 一、化学分析法 以物质的化学反应为基础,主要采用两种方法: 以物质的化学反应为基础,主要采用两种方法 1. 重量分析法 如测定 2+或SO42-的含量 可使其 重量分析法:如测定 如测定Ba 的含量,可使其 形成BaSO4沉淀, 然后过滤、洗涤、烘干、称量。 形成 沉淀 然后过滤、洗涤、烘干、称量。 2. 滴定分析法 用一种已知浓度的试剂去滴定待 滴定分析法: 测物质,通过测量消耗的已知浓度试剂的量 通过测量消耗的已知浓度试剂的量,计算待 测物质 通过测量消耗的已知浓度试剂的量 计算待 测物质的量。 测物质的量。 二、仪器分析法 使用仪器对物质的组成和含量进行分析 对物质的组成 进行分析。 使用仪器对物质的组成和含量进行分析。 用量少 操作简单 快速 灵敏度高 准确度高
x = 0.0
d = 0.2 d = 0.2
s = 0.3 s = 0.4
标准偏差可以反映较大偏差的存在和测定次数的影响
标准偏差能更好地反映出结果的精密度】 【标准偏差能更好地反映出结果的精密度】
精密度和准确度的关系: 精密度和准确度的关系:
准确度高必须以精密度好为前提 精密度高的不一定准确度好 精密度差,说明实验分析结果不可靠, 精密度差,说明实验分析结果不可靠,也就失去 了衡量准确度的前提
0.02000 L 20.00 mL
pH, lgKӨ
---有效数字的位数取决于小数部分(尾数)数字的位数, ---有效数字的位数取决于小数部分(尾数)数字的位数, 有效数字的位数取决于小数部分 整数部分只代表该数的方次 11.02 两位有效数字, 02, 9.5× 例:pH = 11.02, 两位有效数字,则 [H+] = 9.5×10-12
空白试验: ---消除试剂误差 空白试验: ---消除试剂误差 在不加试样的情况下, 在不加试样的情况下,按照试样的分析步骤和条 件进行测定。其得到的结果叫空白值。在数据处 件进行测定。其得到的结果叫空白值。 理时,从分析结果中扣除。 理时,从分析结果中扣除。 仪器校准: ---消除仪器的误差 仪器校准: ---消除仪器的误差 定量分析实验所用的仪器,如滴定管、容量瓶、 定量分析实验所用的仪器,如滴定管、容量瓶、 移液管、天平等都要进行校正。 移液管、天平等都要进行校正。
第十章 分析化学概论
10-1 分析化学的任务和作用
三个主要问题: 三个主要问题: 体系中存在哪些物质? 体系中存在哪些物质? 体系中各物质的量是多少? 体系中各物质的量是多少?
定性分析 定量分析 结构分析
这些物质的结构和存在形态是什么? 这些物质的结构和存在形态是什么?
结论 分析化学是研究物质化学组成、含量、结构的 分析化学是研究物质化学组成、含量、 分析方法及有关理论的一门学科。 分析方法及有关理论的一门学科。
曲线y轴 曲线 轴:概率密度值 曲线下方的面积: 曲线下方的面积:随机误 差出现的概率。 差出现的概率。 曲线下方总面积 = 100% % 置信度(P):随机误差在不 置信度 : 同区间内出现的概率。 同区间内出现的概率。 置信度越高, 置信度越高,数据越可靠
± σ 范围内的概率为 范围内的概率为68.3% 偶然误差落在 ± 2σ 范围内的概率为 范围内的概率为95.5%
偶然误差落在
三、平均值的置信区间
在正态分布中, 均需进行无限数的测量而得到。 在正态分布中 µ与σ 均需进行无限数的测量而得到。 实际上,只能进行有限次的测定 故正态分布无法应用。 只能进行有限次的测定,故正态分布无法应用 实际上 只能进行有限次的测定 故正态分布无法应用。 仿照正态分布方法,以标准偏差 代替σ 以标准偏差s代替 仿照正态分布方法 以标准偏差 代替σ , 令
相对标准偏差 cv% 又称变异系数: 又称变异系数:
= ( s / x) × 100%
当测定次数n大于50次时(无限多次): 当测定次数n大于50次时(无限多次) 50次时 总体平均值, µ :总体平均值,作为真实值
σ 总体标准偏差: 总体标准偏差:
=
∑ ( x i− µ ) i
n
2
n
s
x
µ
σ
例:
⇒ w ≥ 0.2000 g
滴定: 滴定: 滴定管刻度线的最小分度值为0.1 例:50 mL滴定管刻度线的最小分度值为 mL,确 滴定管刻度线的最小分度值为 , 定液面位值时,可在两刻度之间估计读至0.01 mL , 定液面位值时,可在两刻度之间估计读至 所以读数误差 为± 0.01 mL,两次的读数误差为 ,两次的读数误差为0.02 mL,若相对误差不超过± 0.1 %,计算最少滴定剂 ,若相对误差不超过± , 体积? 体积?
三、减少偶然误差的方法
---增加平行测定次数, 一般4 ---增加平行测定次数, 一般4-6次即可 增加平行测定次数
10-5 实验数据的统计处理
一、有效数字
