有机化学 第四章 烯烃与炔烃
烯烃和炔烃

第五节 烯烃和炔烃的结构
一、烯烃的结构——sp2杂化
键: 284 kJ/mol
分子轨道理论
二、炔烃的结构——sp杂化
120pm
H—C≡C—H
乙烷、乙烯和乙炔分子中的键长、键角
名称
第一节 烯烃和炔烃的分类和命名
一、烯烃的分类和命名
单烯烃
➢双键的数目
二烯烃
多烯烃
链烯烃
➢分子骨架
环烯烃
端烯烃 内烯烃
(一)单烯烃的命名 烯烃分子中去掉一个氢原后剩下的一价基团叫做烯基。
乙烯基
ethenyl or vinyl
1-丙烯基
1-propenyl
2-丙烯基 或烯丙基
allyl
异丙烯基
isopropenyl
(二)醇脱水 醇在催化剂存在下加热,分子内失去一分子的水形成烯烃。
(三)邻二卤代烷脱卤素 邻二卤代烷在金属锌或镁作用下,同时脱去两个卤原子生成烯烃。
(四)卤代烷脱卤化氢 卤代烃在碱性试剂作用下失去一分子HX,生成烯烃。
二、炔烃的制备
乙炔是工业上最重要的炔烃,自然界中没有乙炔存在,通常用电石水 解法制备,近年来用轻油和重油在适当的条件下裂解得到乙炔和乙烯。
二、炔烃的分类和命名
➢三键的数目
单炔烃
多炔烃
炔烃的命名原则与烯烃类似,只需将“烯”字改为“炔”。炔
烃的英文名称是将烷烃后缀“ane”改为“yne”,例如:
三、烯炔的命名
分子中同时含有双键和三键的化合物,称为烯炔,英文名称词尾 用“-en-yne”表示。命名时,选择最长的连续碳链作为主链。
若双键和三键都在主链上,编号时要从靠近不饱和键的一端开始, 书写时先烯后炔。若两个不饱和键的编号相同,则应使双键具有最小 位次。例如:
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
第二节 炔烃的结构
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
4第四章 炔烃 二烯烃
RCCR` KMnO4 RCOOH + R`COOH
H2O
(2) 缓慢氧化——二酮
OO
CH3(CH2)7CC(CH2)7COOH
KMnO4 H2O
CH3(CH2)7-C-C-(CH2)7COOH
pH=7.5
92%~96%
•利用炔烃的氧化反应,检验叁键的存在及位置
•这些反应产率较低,不宜制备羧酸或二酮.
有机化学 Organic Chemistry 第四章 炔烃 二烯烃
第四章 炔烃 二烯烃
(一) 炔烃
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式:
CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名**
(1)异构体——从丁炔开始有异构体.
•同烯烃一样,由于碳链不同和叁键位置不同所引起的.由 于在碳链分支的地方不可能有叁键的存在,所以炔烃的 异构体比同碳原子数的烯烃要少. •由于叁键碳上只可能连有一个取代基,因此炔烃不存在 顺反异构现象.
炔烃和烯烃一样,也能和卤化氢、卤素等起亲电加成反
应,但炔的加成速度比烯慢
(A) 和卤素的加成
Br2
RC CR
Br
+
RC CR
Br-
反式加成
Br
R
CC
R
Br
卤素的活性F2>Cl2>Br2>I2
Br Br Br2 R C C R
这一反应可用于炔烃的鉴别。
Br Br
控制条件也可停止在一分子加成产物上.
❖加氯必须用FeCl3作催化剂。
•含有双键的炔烃在命名时,一般 先命名烯再命名炔 .
碳链编号以表示双键与叁键位置的两个数字之和最小
为原则。在同等的情况下,要使双键的位次最小。
烯烃与炔烃的知识点笔记

烯烃与炔烃的知识点笔记烯烃与炔烃是有机化合物中的两个重要类别。
它们的分子结构中都包含碳-碳双键或三键,这使得它们在化学反应中表现出独特的性质和反应活性。
本篇文章将从烯烃和炔烃的定义、结构、命名规则以及常见的反应类型等方面对这两类化合物进行详细的介绍。
1. 烯烃的定义和结构烯烃是一类分子中含有一个或多个碳-碳双键的有机化合物。
烯烃中的碳原子上有两个自由的π电子,这使得它们比饱和烃更加反应活泼。
烯烃的分子式通常用CnH2n表示,其中n代表了烯烃分子中碳原子的数量。
烯烃的结构可以分为直链烯烃和环烯烃两种。
直链烯烃的碳原子通过碳-碳双键连接成直线状排列,而环烯烃则由碳原子构成一个或多个环状结构,其中至少有一个碳原子上存在双键。
2. 烯烃的命名规则烯烃的命名通常遵循以下规则:•找到最长的碳链作为主链,它包含了所有的双键碳原子。
•从主链的一端开始编号,使得双键碳原子的编号最小。
•双键的位置通过数字表示,并在主链的编号前用短横线隔开。
•如果烯烃分子中有多个双键,则用前缀(如二烯、三烯等)指明双键的数量。
•如果存在其他取代基,其位置和名称也需标明。
例如,对于分子式为C4H8的烯烃,如果有一个双键存在于第二个碳原子和第三个碳原子之间,我们可以将其命名为1-丁烯。
3. 烯烃的反应类型烯烃因为含有双键,具有多样的反应类型和反应活性。
•加成反应:烯烃可以与许多试剂发生加成反应,其中一个试剂中的原子或基团与烯烃的双键断裂,形成新的化学键。
•氢化反应:烯烃可以与氢气发生氢化反应,双键断裂,氢原子加到碳原子上,生成饱和烃。
•氯代反应:烯烃可以与氯气发生氯代反应,双键断裂,氯原子取代双键上的碳原子,生成氯代烃。
•氧化反应:烯烃可以与氧气发生氧化反应,双键断裂,氧原子在碳原子上形成新的官能团。
4. 炔烃的定义和结构炔烃是一类含有一个或多个碳-碳三键的有机化合物。
炔烃的通式为CnH2n-2,其中n代表了炔烃分子中碳原子的数量。
炔烃中的碳原子上有两个自由的π电子,使得它们具有较高的反应活性。
烯烃与炔烃的合成与性质

烯烃与炔烃的合成与性质烯烃与炔烃是有机化学中常见的两类碳氢化合物,它们在化学反应中具有独特的合成途径和性质表现。
本文将对烯烃与炔烃的合成方法和性质进行探讨。
一、烯烃的合成与性质烯烃是指分子中两个相邻的碳原子之间存在双键的碳氢化合物。
烯烃的合成方法多种多样,包括烯烃的脱氢反应、卤代烷基化合物消去反应以及烯烃的重排等。
以下将分别介绍这些方法:1.1 烯烃的脱氢反应烯烃的脱氢反应是通过在适当的条件下去除烃分子中的氢原子而合成烯烃。
一种常见的脱氢反应是烷烃的脱氢反应,它可以通过加热烷烃和催化剂的作用而将烷烃转化为相应的烯烃。
例如,丙烷经过脱氢反应可合成丙烯:CH3-CH2-CH3 → CH2=CH-CH31.2 烯烃的卤代烷基化合物消去反应烯烃的卤代烷基化合物消去反应是通过用碱金属或溴在碱中的作用而合成烯烃。
这种反应是通过将卤代烷基化合物中的卤素原子取代为碱金属或溴离子,从而消去卤素原子,并使烷基团脱离分子结构,生成烯烃。
例如,溴乙烷可以通过和氢氧化钠反应生成乙烯:CH3-CH2-Br + NaOH → CH2=CH2 + NaBr + H2O1.3 烯烃的重排反应烯烃的重排反应是由于分子内部原子的重新排列而形成烯烃的化学反应。
这种重排反应常常能够产生简单烯烃和稳定的烯烃之间的异构体。
例如,对丁烯进行重排反应可以得到丙烯和正丁烯的异构体。
烯烃的性质也是有机化学研究中的重要方面。
烯烃具有以下几个重要的性质:2.1 烯烃的化学反应性烯烃的化学反应性主要表现在其双键上,双键可以进行加成反应、氧化反应、还原反应和聚合反应等。
在加成反应中,烯烃的双键会与其他化合物中的亲电性物质发生反应,形成加成产物。
氧化反应中,烯烃的双键可以与氧气或其他氧化剂发生反应,形成氧化产物。
还原反应中,烯烃的双键可以与还原剂发生反应,将双键还原为单键。
聚合反应中,烯烃的双键可以通过开环反应与其他烯烃或烯烃类化合物反应,形成高分子化合物。
第4章 炔烃、二烯烃
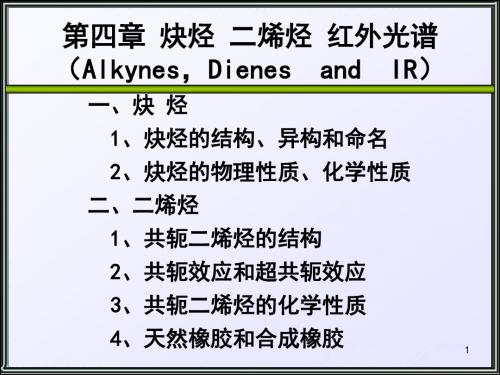
碳素酸的弱酸性
Na
+ 2 HC
+
HC
CH
CH
110℃
2 HC
CNa
+H
NH3
2
NaNH2
HC
CNa
+
13
R3C CH
Ka
R3C C
CH
+
44
H
+
物质名称
pKa
HOH
HC
H2 C
CH2
H3 C
CH3
15.7
25
50
端炔酸性的解释 端炔中的碳为sp杂化, 轨道中s成分较大, 核 对电子的束缚能力强, 电子云靠近碳原子, 使分子中的C-H键极性增加, 易断裂:
HC CH
+ 2 Ag(NH3)2NO3
+ 2 Cu(NH3)2Cl
AgC
CAg
+ 2 NH4NO3 + 2 NH3
乙炔银(白色)
HC CH
CuC
CCu
+ 2 NH4Cl + 2 NH3
乙炔亚铜(砖红色)
应用: 区别端炔与非端炔、端炔与烯烃。
RC CH
16
炔化物的生成
注意:炔化银或炔化亚铜在干燥状态下, 受热或震动容易爆炸。实验完毕后 加稀硝酸使其分解。
+
RC
CH2
> RCH
+
CH
22
炔烃的亲电加成
炔烃与烯烃反应活性比较: 炔烃的加成速度比烯烃慢。
加卤素
当化合物中同时含有双键和叁键时, 首先在双键上发生加成反应。
Br2 低温
Br Br
选择性加成
常见的烃-烯烃与炔烃

【例7】★★★ CH3-CH=CH-C≡C-CH3分子结构的下列叙述中,正确的是( ) A.6个碳原子有可能都在一条直线上 B.6个碳原子不可能在同一条直线上 C.6个碳原子有可能都在同一平面上 D.6个碳原子不可能都在同一平面上
【例8】★★★
CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物。请通 过对CaC2制取C2H2的反应进行思考,从中得到必要的启示,写出下列 反应的产物:
2
(4)乙炔的实验室制法 ①原料:碳化钙(CaC2,俗称电石)、水 ②反应原理:CaC2+2H2O → Ca(OH)2+C2H2↑ ③装置
☆反应十分剧烈,如果使用试管作为反应容器,需要在试管口放一团 棉花,防止出口堵塞 Ⅰ碳化钙与水剧烈反应,启普发生器不易控制反应
Ⅱ反应放出大量热,启普发生器是厚玻璃壁容器,容易因 膨胀不均引起破碎
【例13】★★★ 2)乙同学推测出乙炔中必定含有的一种杂质气体是_____,它与溴水反 应的化学方程式是_________
3)甲同学设计的实验____不能__验证乙炔与溴发生加成反应,理由是 _____ ①使溴水褪色的反应,未必就是加成反应 ②使溴水褪色的反应,就是加成反应 ③使溴水褪色的物质,未必是乙炔 ④使溴水褪色的物质,就是乙炔
【例13】★★★
为了探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取 一定量电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即 证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪 色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少 量还原性的杂质气体。由此他提出必须先除去之,再与溴水反应。 1)写出甲同学实验中的两个主要的化学方程式:—————————
烯烃与炔烃的知识点总结图

烯烃与炔烃的知识点总结图一、烯烃与炔烃的化学结构1. 烯烃的化学结构烯烃是一类含有双键结构的碳氢化合物,其通式为CnH2n。
其中的双键结构可以是一个或多个,由于双键结构的存在,烯烃具有较高的反应活性。
2. 炔烃的化学结构炔烃是一类含有三键结构的碳氢化合物,其通式为CnH2n-2。
炔烃中的三键结构使得其具有比烯烃更高的反应活性和独特的化学性质。
二、烯烃与炔烃的物理性质1. 烯烃的物理性质烯烃具有较低的沸点和熔点,且大多数烯烃为无色透明的液态化合物,但也存在一部分为气态或固态的烯烃。
由于双键结构的存在,烯烃具有一定的极性,导致其在水中的溶解性较好。
2. 炔烃的物理性质炔烃同样具有较低的沸点和熔点,但由于三键结构的存在,炔烃通常比相应的烯烃具有更高的反应活性和化学稳定性。
炔烃中的三键结构也导致其分子极性较大,因此炔烃在水中的溶解度通常较烯烃低一些。
三、烯烃与炔烃的化学性质1. 烯烃的化学性质烯烃通过双键上的加成反应、环化反应、氧化反应等,可以产生一系列的衍生物。
烯烃中较活泼的烯基碳原子也容易发生亲电性或自由基反应,在各种化合物的合成中具有广泛的应用。
2. 炔烃的化学性质炔烃由于其较高的反应活性,可以很容易地进行加成、氧化、取代、聚合等一系列有机反应,因此在化工生产和有机合成领域得到了广泛的应用。
炔烃分子中的炔基碳原子也常参与电子云密度的调控,从而影响相关的化学反应。
四、烯烃与炔烃的用途1. 烯烃的用途烯烃广泛应用于合成橡胶、合成树脂、合成塑料等领域,也作为有机合成中的重要中间体,在医药、农药、染料等行业得到了广泛应用。
2. 炔烃的用途炔烃广泛应用于乙炔气焰的制取、合成材料的生产、有机合成反应的催化剂等方面,在化工工业和有机化学领域发挥了重要的作用。
通过以上对烯烃与炔烃的知识点进行总结,我们可以得出如下几点结论:1. 烯烃与炔烃是重要的有机化合物,它们都具有较高的反应活性和广泛的应用前景。
2. 烯烃通过双键结构的存在,具有较好的极性和反应活性,广泛用于橡胶、树脂、塑料等大宗化工产品的生产。
烯烃与炔烃的知识点总结

烯烃与炔烃的知识点总结一、结构1. 烯烃的结构烯烃是一类碳氢化合物,其分子中含有碳-碳双键,通式为CnH2n。
烯烃的分子式可以表示为CnH2n,其中n为分子中碳原子的个数。
烯烃的普遍结构式为RCH=CHR',其中R和R'分别是烃基。
烯烃分为直链烯烃和支链烯烃两种,其结构式分别为RCH=CHR'和RR'C=CHR'。
直链烯烃和支链烯烃的碳原子排列不同,因而其物理性质和化学性质也有所区别。
2. 炔烃的结构炔烃是一类碳氢化合物,其分子中含有碳-碳三键,通式为CnH2n-2。
炔烃的分子式可以表示为CnH2n-2,其中n为分子中碳原子的个数。
炔烃的分子结构式为RC≡CR',其中R 和R'分别是烃基。
炔烃分为直链炔烃和支链炔烃两种,其结构式分别为RC≡CR'和RRC≡CR'。
和烯烃一样,直链炔烃和支链炔烃的物理性质和化学性质也有所区别。
二、物理性质1. 烯烃的物理性质烯烃通常是无色、有味或挥发性液体。
烯烃的沸点较烷烃高,密度小于水。
烯烃在一定温度下能燃烧,产生碳 dioxide、水和热。
烯烃对氧化质子有较高的活性,容易与氢气或卤素发生加成反应。
由于其含有双键,烯烃通常会发生立体异构现象。
此外,烯烃还可以与酸、醇、醛或酮等发生加成反应,生成醚、醇、胺等不同的功能团。
2. 炔烃的物理性质炔烃通常是无色、易燃的气体或液体,密度小于水。
炔烃的火焰温度较高,燃烧后会产生大量的光和热。
炔烃容易与氢气和卤素发生加成反应,生成炔烃的立体异构。
由于其含有三键,炔烃在化学反应中具有较高的活性,可以与酸、醇、醛或酮发生加成反应,生成多种功能团。
三、化学性质1. 烯烃的化学性质烯烃是一类具有较高反应活性的有机化合物。
烯烃在加成反应中容易发生立体异构,生成不同的加成产物。
烯烃可以在氧化剂的作用下发生氧化反应,生成醇或醛。
此外,烯烃还可以与卤素发生卤代反应,生成卤代烃。
《烯烃炔烃》课件

化学性质
烯烃对电子亲和性高,易 发生加成、聚合等多种化 学反应,具有广泛的反应 途径。
物理性质
烯烃通常是无色、具有较 低的沸点和熔点,同时也 具有一定的溶解性和挥发 性。
常见的烯烃有哪些?
• 乙烯:用于制造塑料、合成橡胶和化肥等。 • 丙烯:广泛用于制造纤维、油漆、胶粘剂和塑料等。 • 戊烯:可用于制造合成橡胶、染料和化工中间体等。
烯烃的应用领域
1
化工工业
烯烃是生产塑料、橡胶、化学纤维等的重要原料,支撑现代化工工业的发展。
2
能源领域
烯烃可以用作燃料和燃料添加剂,为能源产业的发展提供重要支持。
3
医药领域
烯烃在合成药物和医疗器械方面具有重要应用,用于改善人们的健康和合反应是通过开环加成反应,将烯烃分子的双键打开,连接成长链聚合物的过程。
炔烃是一类具有碳碳三键的烃类化合物,具有较高的反应活性和特殊的化学 性质,常见于有机合成和化学工业中。
2 链延长与链转移
聚合反应过程中,聚合链的延长和转移对聚合物结构和性质产生重要影响。
3 终止反应
聚合反应的终止阶段,产生不同类型的终止物质,决定聚合物链的长度和末端结构。
烯烃聚合反应的影响因素
催化剂种类 反应条件 物料纯度
不同催化剂对聚合反应速率和产物性质具有不 同的影响。
温度、压力和反应时间等条件可以调控聚合反 应的速率和产物分子量。
纯度高的原料和溶剂可以提高聚合反应的效率 和产物品质。
烯烃聚合反应的催化剂种类和选择
金属催化剂
• 铂族金属催化剂 • 过渡金属催化剂
配体催化剂
• 茂金属催化剂 • 挠性锁体催化剂
烯烃聚合反应的产物分析方法
通过分光光度法、GC-MS等分析技术,对聚合物的结构、分子量分布和物性 进行准确测定。
《烯烃炔烃》烯烃的顺反异构

《烯烃炔烃》烯烃的顺反异构在有机化学的广袤世界里,烯烃和炔烃是两类非常重要的化合物。
今天,咱们重点来聊聊烯烃中的一个有趣现象——顺反异构。
要理解顺反异构,咱们得先从烯烃的结构说起。
烯烃是含有碳碳双键的烃类化合物。
这个碳碳双键可不得了,它让烯烃的性质变得丰富多样。
想象一下,两个碳原子通过双键相连,就像是两个人手拉手,但是这两只手的姿势可以不一样。
当两个相同的原子或基团在双键的同侧时,我们称之为顺式结构;而当它们在双键的两侧时,那就是反式结构。
比如说,2-丁烯就有顺式和反式两种异构体。
顺-2-丁烯中,两个甲基在双键的同一侧;反-2-丁烯中,两个甲基则分居双键的两侧。
那么,顺反异构是怎么产生的呢?这得从双键的特性说起。
双键中的π键不能像单键那样自由旋转,所以一旦两个相同的基团在双键两侧的位置确定下来,就不容易改变了。
这种顺反异构对烯烃的性质有着显著的影响。
从物理性质上看,顺反异构体的沸点、熔点、密度等都可能不同。
一般来说,反式异构体的对称性更好,分子间的作用力相对较弱,所以沸点通常低于顺式异构体。
而在熔点方面,反式异构体往往高于顺式异构体,这是因为反式异构体的晶格排列更规整,分子间的相互作用更强。
在化学性质方面,顺反异构体也有所差异。
比如在加成反应中,它们的反应速率和产物可能不同。
由于空间位阻的影响,顺式异构体和反式异构体与某些试剂反应的难易程度会不一样。
再来说说如何判断烯烃是否存在顺反异构。
首先得看双键两端的碳原子上是否都连有两个不同的基团。
如果有,那就存在顺反异构;如果没有,那就不存在。
举个例子,1-丁烯就不存在顺反异构,因为双键一端的碳原子上有两个氢原子,是相同的基团。
而 2-戊烯就存在顺反异构,因为双键两端的碳原子上都连有不同的基团。
顺反异构在实际应用中也有着重要的意义。
在药物研发中,有时药物的活性与它的顺反异构有关。
可能一种异构体具有良好的疗效,而另一种则效果不佳甚至有副作用。
在材料科学中,顺反异构体的性质差异也会影响材料的性能。
有机化学第四章 炔烃

4.4.2
氧化反应
乙炔通入高锰酸钾溶液中 ,即可被氧化成CO2 和 H2O ,同时KMnO4溶液褪色并生成MnO2沉淀。因 反应现象非常明显,常用于炔烃的定性鉴别。
3HC≡CH+10KMnO4+2H2O→6CO2↑+10KOH+10 MnO2↓
此反应若在酸性条件下反应,则无二氧化锰沉淀产生。 但无论在什么条件下反应,炔烃都会被氧化成羧酸。 根据炔烃的氧化产物,可以方便地推断出炔烃的结构。
炔烃的异构可由碳链的结构及官能团位置变化引 起。 由于碳最高只有4价,叁键碳只能连有一个烃基, 所以炔烃不存在顺反异构体,炔烃的异构体数因 此较相应碳数烯烃的异构体要少。 例:丁烯与丁炔相比
丁烯有三个构造异构体及两个顺反异构体。 而丁炔只有1-丁炔和2-丁炔两个异构体。
炔烃 4
有机化学
炔烃=C
H Br
(P71)有错
有机化学 炔烃 23
4.4.1.3 亲电加成
(3)
加H2O
乙炔在高汞盐(5%HgSO4)催化下,通入10%稀 H2SO4中,可发生乙炔直接与水加成的反应,得 到乙醛,这是工业上合成乙醛的重要方法。
H2O , HgSO4
H2C H C O H
HC
CH
H
C
C
H
0.1203nm
有机化学
炔烃
9
C-sp杂化
乙炔分子这样的形状,与碳原子采用的杂化方式 是密切相关的,在乙炔中不饱和碳原子采用sp杂 化方式。
激 发
2p
2p 2s
杂 化
sp
2p
2s
有机化学考点四烷烃、烯烃、炔烃的结构和性质

【要点解读】1.烷烃、烯烃、炔烃的组成、结构特点和通式2.脂肪烃的物理性质性质变化规律状态常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态沸点随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低相对密度随着碳原子数的增多,相对密度逐渐增大,密度均比水小水溶性均难溶于水3.脂肪烃的化学性质(1)烷烃的化学性质①取代反应如乙烷和氯气生成一氯乙烷:CH 3CH 3+Cl 2错误!CH 3CH 2Cl +HCl 。
②分解反应③燃烧燃烧通式为C n H 2n +2+3n +12O 2错误!n CO 2+(n +1)H 2O 。
(2)烯烃的化学性质①与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
②燃烧燃烧通式为C n H 2n +错误!O 2错误!n CO 2+n H 2O 。
③加成反应④加聚反应(3)炔烃的化学性质①与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应.如CH≡CH 错误!CO 2(主要产物)。
②燃烧燃烧通式为C n H 2n -2+3n -12O 2错误!n CO 2+(n -1)H 2O 。
③加成反应如CH≡CH+H 2错误!CH 2===CH 2;CH≡CH+2H 2错误!CH 3—CH 3.④加聚反应如n CH≡CH 错误!。
【重难点指数】★★★★。
【重难点考向一】脂肪烃的结构、性质及应用【典型例题1】有机物的结构可用“键线式”表示,如:CH 3CH===CHCH 3可简写为。
有机物X 的键线式为,下列说法不正确的是( )A .X 的化学式为C 8H 8B .有机物Y 是X 的同分异构体,且属于芳香烃,则Y 的结构简式为C .X 能使酸性高锰酸钾溶液褪色D .X 与足量的H 2在一定条件下反应可生成环状的饱和烃Z,Z 的一氯代物有4种【答案】D【解析】本题考查有机物的结构及性质.由X的键线式可知其分子式为C8H8,与苯乙烯()互为同分异构体;X分子中含碳碳双键,能使酸性KMnO4溶液褪色,X与足量H2加成生成的环状饱和烃Z中只有两种不同位置的氢原子,故其一氯代物有两种。
有机化学 第四章 烯烃与炔烃
王鹏
4.2 烯烃与炔烃的同分异构
一、构造异构:
四个碳以上存在异构现象,不仅存在碳架异构, 还存在官能团位次异构,如:
二、构型异构——顺反异构现象:
由于碳碳双键存在不可旋转的特性,因此烯烃 存在特殊的顺反异构现象
山东科技大学 化学与环境工程学院
王鹏
4.2 烯烃与炔烃的同分异构
2-丁烯分子的不同构型:它们显然不是同一个 化合物,这种异构称为构型异构
双键的组成:
• 一个“头对头” 的σ键与一个“肩并肩”的π键组合 在一起,共同组成了烯烃中的双键 • π键的形成是在σ键的基础上形成的,不可能单独存 在
王鹏
山东科技大学 化学与环境工程学院
4.1 烯烃与炔烃的结构
二、三键的组成
三键中的碳原子是sp杂化,剩余的两个p轨道 与sp杂化的轴垂直,因此必然形成两个“肩并 肩”的π键
RC≡CR’> RC≡CH > HC≡CH
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
炔烃反应的产物:
• 对于炔烃而言,产物可以是部分氢化的烯烃,也可 以是全部氢化的烷烃,产物由催化剂决定,催化剂 活性越高,产物越易为烷烃
完全氢化:产生饱和烃,不存在顺反
• Pd-C催化氢化可得到烷烃
电子云呈柱状,对键轴呈圆柱形对 称。电子云密集于两原子之间,键 的极化性小 沿键轴的两碳原子可“自由”旋转
成键轨道“肩并肩”平行重叠,重 叠程度较小,键能较小,键不稳定
电子云呈块状,存在一个对称平面, 电子云分布在平面的上下方,键的 极化性大 沿键轴的两碳原子不能相对旋转
山东科技大学 化学与环境工程学院
构型与字母相反王鹏ccch3hhc2h5顺2戊烯z2戊烯顺2溴2丁烯e2溴2丁烯ccch3brhch3山东科技大学化学与环境工程学院练习练习?分别使用顺反和ze标记命名下列化合物3顺3甲基2戊烯王鹏253e3甲基2戊烯顺2丁烯z2丁烯顺12二氯1溴1丁烯e12二氯1溴1丁烯顺反失效e1氟1氯2溴2碘乙烯山东科技大学化学与环境工程学院王鹏4444烯烃和炔烃的物理性质烯烃和炔烃的物理性质?一熔沸点变化规律基本与烷烃相同?二烯烃与炔烃中不同杂化的碳原子具有不同的电负性且s成分越多电负性越强这使得炔烃存在极性?三对于分子的极性烯烃需要分顺反确定是否具有极性顺式构型为极性分子对称的反式烯烃常常是非极性分子山东科技大学化学与环境工程学院王鹏4545烯烃与炔烃的化学性质烯烃与炔烃的化学性质?化学性质概述
第四章 炔烃烯烃

机理:两次E2消除
X R X
d+
C H
d+
E2消 除
R'
X C R C
R'
E2消 除 R C C R'
C H
H
NH2 or
OH
NH2
由偕二卤代烃制备
H R C H
X 2 N aNH2 C X R' R C C R'
机理:两次E2消除
NH2 H R C H X
E2消 除
C X R'
H C R C
R'
烯醇式 Enol form
Hg++催化下,叁键比双键易水合。
H 2O , H g S O 4 H 2C CH C CH H 2S O 4 H 2C CH O C CH3
甲基乙烯基酮
炔烃的水合机理
H 2O H g ++ R C CH
d+
R C Hg CH
++
+ OH 2
R C CH Hg
+
亲电加成
p络合物 (汞化物)
由丙烯制备
Z ie g le r -N a tta 2 CH3 CH CH2 催化剂 CH3 CH2 C CH2 CH2 CH3
H+
CH3
异 构 化 CH3 C CH CH2 CH3
650 ~ 800 C
o
CH3 CH2 C CH CH2 + CH4
由丙酮和乙炔反应制备
CH3 C CH3 + CH CH O KOH
CH3 CH3 C C CH OH
H2 P d -B a S O 4
《烯烃炔烃》炔烃的稳定性探讨

《烯烃炔烃》炔烃的稳定性探讨《烯烃炔烃——炔烃的稳定性探讨》在有机化学的广袤领域中,烯烃和炔烃是两类非常重要的不饱和烃。
它们具有独特的结构和性质,而其中炔烃的稳定性一直是研究的焦点之一。
要探讨炔烃的稳定性,首先得了解炔烃的结构。
炔烃分子中含有碳碳三键,这是其最为显著的结构特征。
碳碳三键由一个σ 键和两个π键组成。
相比于烯烃中的碳碳双键(一个σ 键和一个π 键),炔烃中的π 键更强,电子云密度更大。
然而,这种更强的π 键并不意味着炔烃就一定更稳定。
实际上,在很多情况下,烯烃比炔烃更稳定。
这是为什么呢?从电子因素来看,炔烃中的π 电子云呈圆柱形对称分布,其重叠程度相对较小,导致π 键的稳定性不如烯烃中的π 键。
而且,由于炔烃的电子云密度较大,容易受到亲电试剂的进攻,这在一定程度上降低了其稳定性。
从空间因素考虑,炔烃中的碳碳三键使得分子的空间位阻较大。
相比之下,烯烃中的碳碳双键所带来的空间位阻较小,分子的构象更加灵活,有利于能量的分散,从而增强了稳定性。
再来看取代基对炔烃稳定性的影响。
当炔烃分子中存在给电子取代基时,能够向三键提供电子,增加分子的电子密度,从而提高其稳定性。
但这种影响相对较小,因为炔烃本身的电子云分布特点限制了给电子取代基的作用效果。
相反,当存在吸电子取代基时,会削弱炔烃的稳定性。
在化学反应中,炔烃的稳定性也有所体现。
例如,在加氢反应中,炔烃需要更高的条件才能被完全加氢转化为烷烃,这说明炔烃相对于烯烃更难发生加成反应,从侧面反映出其稳定性较差。
另外,与其他物质的反应活性也能反映炔烃的稳定性。
炔烃在与卤素等试剂的反应中,通常比烯烃反应活性低,这也是因为其稳定性相对较弱。
然而,我们也不能一概而论地说炔烃总是比烯烃不稳定。
在某些特定的环境和条件下,炔烃也可能表现出相对较高的稳定性。
比如,在一些具有特殊空间结构的分子中,炔烃的结构可能更有利于分子的稳定存在。
总之,炔烃的稳定性是一个相对复杂的问题,受到多种因素的综合影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H3C C
H
H C
Br2
CH3
H Br
-
C CH3
Br
CH3
H
CH3 C Br C
Br H CH3
• 乙烯与溴水的NaCl水溶液反应,得到溴代和氯代的 混合物,证明了分步反应的正确性
由Br2的加成可以推出亲电加成的特点:
• 第一步,亲电试剂对双键进攻形成碳正离子 。 • 第二步,亲核试剂与碳正离子中间体结合,形成加 成产物。
催化氢化中氢化热的意义:
不饱和烃氢化热越高,说明反应放出的热量越高,即 起始物的内能越高,该化合物的相对稳定性则越低 通过测定氢化热可以得到烯烃相对稳定性顺序:
R2C=CR2 > R2C=CHR, RHC=CHR > RCH=CH2 > CH2=CH2
炔烃也可以通过氢化热确定相对稳定性顺序:
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
烯烃越容易吸附于催化剂表面上,氢化反应速度越快。 双键碳上取代基少,则空间阻力越小,越容易与催化 剂结合。烯烃的催化氢化相对活性:
• 乙烯 > 单取代烯 > 二取代烯 > 三取代烯 > 全取代烯
炔烃也存在相同的情况,取代基越多,活性越差
• 活性小,机理相似,生成反-二溴烯,可进一步反应 • 原因:带有双键的溴鎓离子张力大,不稳定,难以 生成
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
3. 与HX的加成:
• 加成得到单卤代烃,HX反应速率HI > HBr > HCl • 反应机理: + C C
+
HX
X
slow
王鹏
山东科技大学 化学与环境工程学院
4.3 烯烃和炔烃的命名
一、烯基和炔基:
与烷基相似,烯烃或炔烃形式上去掉一个氢原 子后的剩余部分称为烯基和炔基,命名时以连 接基团的碳原子为1号 烯基:enyl结尾,炔基:ynyl结尾 常见的烯基见课本P52
二、烯烃和炔烃的命名:
1. 衍生物命名法:
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
一、加氢反应(催化加氢)
π键可以与氢气加成得到还原产物 催化剂存在下,烯烃和炔烃可与氢气加成得烷, 该反应是放热反应,1 mol氢气参与还原时放出 的热量称为氢化热
• 氢化热可以衡量起始物的稳定性
催化加快反应进行的原因:降低活化能
C C
X
H
C C H
- fast
C C H X
• 由烯烃与X2及HX的加成,可得出亲电加成的通式:
C C + E Nu
亲电试剂
slow
亲核试剂
C C E
+
Nu
-
Nu
fast
C C E
山东科技大学 化学与环境工程学院
王鹏
4.5 烯烃与炔烃的化学性质
对称烯烃与HX加成只有一种产物,但不对称 烯烃的反应产物存在两种异构体,那种异构体 的含量大? 马氏规则(Markovnikov规则):
反式 两个甲基在不同侧
顺式 两个甲基在相同一侧
王鹏
山东科技大学 化学与环境工程学院
4.2 烯烃与炔烃的同分异构
为了区分这两种化合物,将相同的取代基在同 侧的化合物称为顺式,分处两侧的称为反式 当各个双键碳原子上连接的两个取代基团均不 同时才存在顺反异构,如下面的情况:
炔烃不存在顺反异构现象,为什么?
王鹏
4.2 烯烃与炔烃的同分异构
一、构造异构:
四个碳以上存在异构现象,不仅存在碳架异构, 还存在官能团位次异构,如:
二、构型异构——顺反异构现象:
由于碳碳双键存在不可旋转的特性,因此烯烃 存在特殊的顺反异构现象
山东科技大学 化学与环境工程学院
王鹏
4.2 烯烃与炔烃的同分异构
2-丁烯分子的不同构型:它们显然不是同一个 化合物,这种异构称为构型异构
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
化学性质概述:
烯烃和炔烃中均含有较为活泼的π键,这导致 双键和三键容易断裂发生加成反应 与官能团直接相连的碳称为α-碳原子,其上的 氢称为α-氢原子。受π键的吸电子影响,α-氢原 子活泼易取代 端基炔烃还可以发生炔氢的取代反应 因此,对于烯烃和炔烃,主要发生三类反应: 不饱和键加成、 α-氢取代和炔氢取代
部分氢化:产生烯烃,存在顺反异构
• 活性低的催化剂氢化时得到烯烃:
– 喹啉或Pb(OAc)2毒化的Pd-BaSO4(Lindlar Pd)或Ni2B
• 催化氢化是顺式加氢,得到的是顺式烯烃 • 为得到反式的烯烃,可以用溶解金属法,如钠-液氨
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
山东科技大学 化学与环境工程学院
王鹏
4.5 烯烃与炔烃的化学性质
• 控制整个反应速率的第一步反应(慢),由亲电试 剂进攻而引起,所以称为亲电加成反应。 • 可以看出,影响正离子形成的因素都将影响亲电加 成反应,所以烯烃取代基多反应快,而卤素电负性 越强,鎓离子越易生成,反应也越快
炔烃与卤素的加成:
王鹏
山东科技大学 化学与环境工程学院
4.1 烯烃与炔烃的结构
三键的组成与双键相似,也是σ键与π键的组合, 不同的是,三键由两个π键一个σ键组成 乙烯与乙炔的结构模型见课本
三、 π键的特性:
电子云重叠程度低,键能小,活泼易反应 两碳原子不能发生相对旋转,否则将破坏平行 交盖,π键断裂
旋转90度
slow
C Br
+
C
+ Br-
C step 2 Br
+
C
+ Br-
fast Br
Br C C
• 反应分两步,其中第一步产生正电性的溴鎓离子是 整个反应的关键,随后溴负离子从背面进攻得到反 式加成产物——邻二溴烷
山东科技大学 化学与环境工程学院
王鹏
4.5 烯烃与炔烃的化学性质
Br H C C CH3 H H3C H C Br
2. Z、E标记:
• 按照次序规则中较优取代基处于同侧的称Z式,分 处两侧的称为E式 • Z、E标记与取代基大小有关,类似于手性中的赤式 与苏式
王鹏
山东科技大学 化学与环境工程学院
4.3 烯烃与炔烃的命名
3. 值得指出的是,顺、反标记与Z、E标记不是 中英文翻译的关系,它们之间不存在对应关系, 如下面的两个化合物命名:
RC≡CR’> RC≡CH > HC≡CH
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
炔烃反应的产物:
• 对于炔烃而言,产物可以是部分氢化的烯烃,也可 以是全部氢化的烷烃,产物由催化剂决定,催化剂 活性越高,产物越易为烷烃
完全氢化:产生饱和烃,不存在顺反
• Pd-C催化氢化可得到烷烃
电子云呈柱状,对键轴呈圆柱形对 称。电子云密集于两原子之间,键 的极化性小 沿键轴的两碳原子可“自由”旋转
成键轨道“肩并肩”平行重叠,重 叠程度较小,键能较小,键不稳定
电子云呈块状,存在一个对称平面, 电子云分布在平面的上下方,键的 极化性大 沿键轴的两碳原子不能相对旋转
山东科技大学 化学与环境工程学院
王鹏
山东科技大学 化学与环境工程学院
4.1 烯烃与炔烃的结构
π键电子具有较大流动性,因为成键轨道分散 成两层,核对电子云的束缚能力弱 σ键与π键的性质对比: σ键 π键
可单独存在,存在于任何共价键中 不能单独存在,只能在双键或叁键 中与σ键共存
成键轨道沿键轴“头碰头”重叠, 重叠程度大,键能较大,键较稳定
• 烯烃和炔烃可以与卤素加成,常用的是Cl2和Br2, 溴的CCl4溶液可以作为检验不饱和键存在的试剂
王鹏
山东科技大学 化学与环境工程学院
4.5 烯烃与炔烃的化学性质
• 卤素反应活性为:F2 > Cl2 > Br2 > I2,对相同的卤 素,烯烃取代基越多反应速度越快 • 与卤素加成的机理:
step 1 C C + Br2
双键的组成:
• 一个“头对头” 的σ键与一个“肩并肩”的π键组合 在一起,共同组成了烯烃中的双键 • π键的形成是在σ键的基础上形成的,不可能单独存 在
王鹏
山东科技大学 化学与环境工程学院
4.1 烯烃与炔烃的结构
二、三键的组成
三键中的碳原子是sp杂化,剩余的两个p轨道 与sp杂化的轴垂直,因此必然形成两个“肩并 肩”的π键
第四章 不饱和烃: 烯烃与炔烃
含不饱和键—π键的烃类
王鹏 山东科技大学化学与材料工程学院
4.1 烯烃与炔烃的结构
一、双键的组成:
双键碳原子是sp2杂化,结构为平面三角型;由 此“头碰头”形成的5个σ键(4个C-H,1个CC)处于同一平面上 未参与杂化的p轨道垂直于该平面,只能以 “肩并肩”方式重合,拉近了C-C距离
二、亲电加成反应
1. 亲电与亲核试剂:
• 需要电子的试剂称为亲电试剂,需要质子的试剂称 亲核试剂,如:H+、Br+等Lewis酸均属于亲电试剂 • π键:电子流动性大且易极化,属富电子的亲核试 剂 • 烯烃和炔烃的亲电加成反应可概括为:缺电子的亲 电试剂对富电子π键的进攻加成反应
2. 与X2的加成反应:
SP2 杂化轨道
C
C
C
C
p 轨道
王鹏
山东科技大学 化学与环境工程学院
乙烯分子的形成过程:
王鹏
山东科技大学 化学与环境工程学院
4.1 烯烃与炔烃的结构
