高二化学《2.1 脂肪烃(1)》教案
十二教案脂肪烃

十二教案脂肪烃一、教学目标1.知识与技能:(1)了解什么是脂肪烃。
(2)掌握脂肪烃的分类及其结构特点。
(3)了解脂肪烃在生活中的应用。
2.过程与方法:(1)激发学生的学习兴趣,调动学生的积极性。
(2)采用讲解、示范、实践等多种教学方法,培养学生的观察、实验和总结能力。
二、教学重难点1.教学重点(1)脂肪烃的分类及其结构特点。
(2)脂肪烃在生活中的应用。
2.教学难点脂肪烃的分类及结构特点的教学。
三、教学过程1.导入环节(10分钟)通过提问,导入脂肪烃的概念。
2.讲解和示范环节(20分钟)(1)讲解脂肪烃的分类及其结构特点:脂肪烃是由碳和氢组成的有机化合物,根据碳原子间的连接方式不同,可分为直链烷烃、支链烷烃和环烷烃。
直链烷烃的分子结构中,所有碳原子都是直线排列的;支链烷烃中,分子结构有分支;环烷烃由碳原子构成环状结构。
(2)通过示范,向学生展示脂肪烃的分子结构,引发学生对脂肪烃结构特点的认识。
3.探究环节(30分钟)(1)分组讨论:将学生分为小组,每个小组选择一种脂肪烃进行学习和讨论,通过查阅资料和互相交流,了解该种脂肪烃的应用领域、特点等,并向全班汇报。
(2)实验观察:学生可以利用实验观察脂肪烃的燃烧性质,了解其在生活中的应用。
4.总结提升环节(15分钟)(1)总结脂肪烃的分类及结构特点,并让学生将总结内容记录到笔记中。
(2)通过提问,检查学生的学习成果,评价学生对脂肪烃的认知和理解。
5.拓展练习环节(15分钟)以小组讨论的形式,让学生思考脂肪烃的应用领域是否有局限性,有哪些因素会影响其应用。
四、教学反思本节课通过激发学生的学习兴趣,调动学生的积极性,采用讲解、示范、实践等多种教学方法,培养学生的观察、实验和总结能力。
通过分组讨论和实验观察,学生能够更加深入地了解脂肪烃的分类和结构特点,培养学生的合作和探究能力。
同时,通过总结和拓展练习,巩固和拓宽学生的知识。
整个教学过程活跃而有趣,提高了学生对脂肪烃的认识和理解。
高中化学《2.1 脂肪烃》教案 新人教版选修5

北京市房山区实验中学高中化学选修五《2.1 脂肪烃》教案【知识与技能】1、了解烷烃、烯烃、炔烃的物理性质的规律性变化。
2、了解烷烃、烯烃、炔烃的结构特点。
3、掌握烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法【过程与方法】注意不同类型脂肪烃的结构和性质的对比;善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力;要注意充分发挥学生的主体性;培养学生的观察能力、实验能力、探究能力。
【情感、态度与价值观】根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想。
教学重点烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法教学难点烯烃的顺反异构教具学具多媒体教学方法问题推进法、讨论法。
教学过程主要教学内容教师活动学生活动★第一课时(烷烃、烯烃)【引入】师:同学们,从这节课开始我们来学习第二章的内容——烃和卤代烃。
在高一的时候我们接触过几种烃,大家能否举出一些例子?众生:能!甲烷、乙烯、苯。
师:很好!甲烷、乙烯、苯这三种有机物都仅含碳和氢两种元素,它们都是碳氢化合物,又称烃。
根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。
而卤代烃则是从结构上可以看成是烃分子中的氢原子被卤原子取代的产物,是烃的衍生物的一种。
我们先来学习第一节——脂肪烃。
【板书】第二章烃和卤代烃第一节脂肪烃师:什么样的烃是烷烃呢?请大家回忆一下。
(学生回答,教师给予评价)【板书】一、烷烃1、结构特点和通式:仅含C—C键和C—H键的饱和链烃,又叫烷烃。
(若C—C连成环状,称为环烷烃。
)烷烃的通式:C n H2n+2 (n≥1)师:接下来大家通过下表中给出的数据,仔细观察、思考、总结,看自己能得到什么信息?表2—1 部分烷烃的沸点和相对密度名称结构简式沸点/ºC 相对密度甲烷CH4-164 0.466乙烷CH3CH3-88.6 0.572丁烷CH3(CH2) 2CH3-0.5 0.578戊烷CH3(CH2)3CH336.1 0.626壬烷CH3(CH2) 7CH3150.8 0.718十一烷CH3(CH2) 9CH3194.5 0.741十六烷CH3(CH2) 14CH3287.5 0.774十八烷CH3(CH2) 16CH3317.0 0.775(教师引导学生根据上表总结出烷烃的物理性质的递变规律,并给予适当的评价)【板书】2、物理性质烷烃的物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐升高,相对密度逐渐增大;常温下的存在状态,也由气态(n≤4)逐渐过渡到液态、固态。
新人教版化学选修5高中《脂肪烃》教案一

新人教版化学选修5高中《脂肪烃》教案一基本说明1、教学内容所属模块:高中化学选修模块,《有机化学基础》2、年级:高二年级3、所用教材出版单位:人民教育出版社4、所属的章节:第二章第一节教学目标1、知识与技能:(1)了解烷烃、烯烃的物理性质与分子中碳原子数目的关系(2)理解烷烃、烯烃的结构和化学性质2、过程与方法:通过图片展示,提高学生的学习兴趣,通过学生作图和识图培养学生分析和处理数据的能力,通过分析烷烃和烯烃的结构特点,深化结构决定性质的观念,学会类比学习的方法。
体会分类学习的优越性3、情感态度与价值观:体验图表直观分析法,培养类比推理的思维方式内容分析:模块2已经安排了甲烷、烷烃、乙烯的学习,模块5的第一章已经安排了有机物的分类,。
学情分析:学生已经知道了甲烷、烷烃、乙烯的有关知识,烷烃、烯烃结构特点。
设计思路:巩固所学甲烷、烷烃、乙烯结构与性质,烷烃、烯烃结构特点的知识,学会推理归纳法,以类比学习法掌握烷烃、烯烃的性质。
2)氧化反应(燃烧)+nCOC182被酸性高锰酸钾溶液氧化甲烷乙烷丁烷戊烷物质-162ºC+36ºC-89ºC-1ºC沸点板书设计:脂肪烃(第一课时)一、烷烃和烯烃物理性质:化学性质1、烷烃的性质: (类似甲烷)(1)取代反应:(光卤代)CH3CH3+Cl2CH3CH2Cl+HCl(2)氧化反应(燃烧)C n H2n+2+O2nCO2+(n+1)H2O(3)裂解:C8H18C4H8+C4H10(4)性质稳定2、烯烃的性质:CnH2n(类似于乙烯)(1)氧化反应可燃烧:C n H2n+ O2nCO2+nH2O使酸性高锰酸钾溶液裉色(2)加成反应:(加H2、X2、HX、H2O)(3)加聚反应教学反思:本节课的设计是在原来教学设计的基础上将烯的顺反异构移至下一课时(在原来教学中略感时间吃紧)。
特别地将必修知识内容进行较详细的复习,旨在构建知识体系,同时先提出类比推理的学习方式,再以实例引导学生学习,学生比较容易接受。
新人教版高中化学教案-脂肪烃教案 (1)
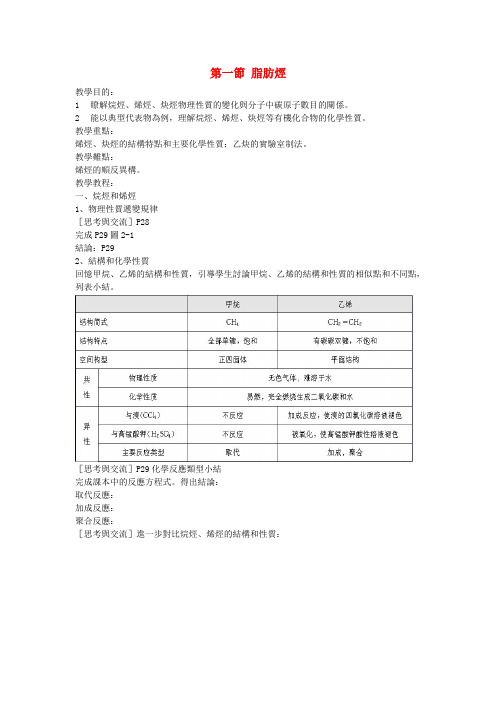
第一節脂肪烴教學目的:1瞭解烷烴、烯烴、炔烴物理性質的變化與分子中碳原子數目的關係。
2能以典型代表物為例,理解烷烴、烯烴、炔烴等有機化合物的化學性質。
教學重點:烯烴、炔烴的結構特點和主要化學性質;乙炔的實驗室制法。
教學難點:烯烴的順反異構。
教學教程:一、烷烴和烯烴1、物理性質遞變規律[思考與交流]P28完成P29圖2-1結論:P292、結構和化學性質回憶甲烷、乙烯的結構和性質,引導學生討論甲烷、乙烯的結構和性質的相似點和不同點,列表小結。
[思考與交流]P29化學反應類型小結完成課本中的反應方程式。
得出結論:取代反應:加成反應:聚合反應:[思考與交流]進一步對比烷烴、烯烴的結構和性質:[思考與交流]丙稀與氯化氫反應後,會生成什麼產物呢?試著寫出反應方程式: 導學在課堂P36[學與問]P30烷烴和烯烴結構對比完成課本中表格[資料卡片]P30二烯烴的不完全加成特點:競爭加成注意:當氯氣足量時兩個碳碳雙鍵可以完全反應二、烯烴的順反異構體觀察下列兩組有機物結構特點:它們都是互為同分異構體嗎? 歸納:什麼是順反異構?P32 思考:下列有機分子中,可形成順反異構的是 A CH 2=CHCH 3 B CH 2=CHCH 2CH 3 C CH 3CH =C(CH 3)2 D CH 3CH =CHCl答案:D三、炔烴1)結構:2)乙炔的實驗室制法:原理:CaC 2+2H 2O Ca(OH)2+C 2H 2↑實驗裝置: P.32圖2-6注意事項:a 、檢查氣密性;b 、怎樣除去雜質氣體?(將氣體通過裝有CuSO 4溶液的洗氣瓶)c 、氣體收集方法乙炔是無色無味的氣體,實驗室制的乙炔為什麼會有臭味呢?(1)因電石中含有 CaS 、Ca 3P 2等,也會與水反應,產生H 2S 、PH 3等氣體,所以所制乙炔氣體會有難聞的臭味;(2)如何去除乙炔的臭味呢?(NaOH 和CuSO 4溶液)(3)H 2S 對本實驗有影響嗎?為什麼?H 2S 具有較強還原性,能與溴反應,易被酸性高錳酸鉀溶液氧化,使其褪色,因而會對該實驗造成干擾。
最新精编高中人教版选修5高中化学第二章 第一节 脂肪烃(1)公开课优质课教学设计

课题:第二章第一节脂肪烃(1)教学目的知识技能1、了解烷烃、烯烃和炔烃的物理性质的规律性变化2、了解烷烃、烯烃、炔烃的结构特点过程与方法1、注意不同类型脂肪烃的结构和性质的对比2、善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力情感态度价值观根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想重点烯烃的结构特点和化学性质难点烯烃的顺反异构知识结构与板书设计第二章烃和卤代烃第一节脂肪烃一、烷烃(k)和烯烃(k)1、结构特点和通式:(1) 烷烃:(2) 烯烃:2、物理性质3、基本反应类型(1) 取代反应:(2) 加成反应:(3) 聚合反应:4、烷烃化学性质(与甲烷相似)烷烃不能使酸性高锰酸钾溶液和溴水褪色(1)取代反应:(2)氧化反应:5、烯烃的化学性质(与乙烯相似) (1)加成反应(2)氧化反应 燃烧:使酸性KMO 4 溶液褪色:催化氧化:2R —CH=CH 2 + O 2 2R1COR 2CH 3(3) 加聚反应 6、二烯烃的化学性质(1)二烯烃的加成反应:(1,4一加成反应是主要的) (2) 加聚反应: CH 2=CHCH=CH 2催化剂(顺丁橡胶)教学过程备注[引入]同学们,从这节课开始我们学习第二章的内容——烃和卤代烃。
甲烷、乙烯、苯这三种有机物都仅含碳和氢两种元素,它们都是碳氢化合物,又称烃。
根据结构的不同,烃可分为烷烃、烯烃、炔烃和芳香烃等。
而卤代烃则是从结构上可以看成是烃分子中的氢原子被卤原子取代的产物,是烃的衍生物的一种。
我们先学习第一节——脂肪烃。
第二章 烃和卤代烃第一节 脂肪烃 一、烷烃(k)和烯烃(k) 1、结构特点和通式:(1) 烷烃:仅含C —C 键和C —H 键的饱和链烃,又叫烷烃。
(若C —C 连成环状,称为环烷烃。
)通式:CH 2+2 (≥1)(2) 烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。
高中化学第二章 第一节 脂肪烃教案 新人教版选修

高中化学第二章第一节脂肪烃教案新人教版选修第一节脂肪烃 (2)技能掌握烯烃、炔烃的结构特点和主要化学性质乙炔的实验室制法过程方法要注意充分发挥学生的主体性培养学生的观察能力、实验能力和探究能力情感态度价值观在实践活动中,体会有机化合物在日常生活中的重要应用,同时关注有机物的合理使用重点炔烃的结构特点和化学性质难点乙炔的实验室制法知识结构与板书设计二、烯烃的顺反异构1、顺反异构2、形成条件:(1)具有碳碳双键 (2)组成双键的每个碳原子必须连接两个不同的原子或原子团、三、炔烃:分子里含有碳碳三键的一类脂肪烃称为炔烃。
1、乙炔的结构:分子式:C2H2,实验式:CH,电子式:结构式:H-C C-H,分子构型:直线型,键角:1802、乙炔的实验室制取3、乙炔的性质:乙炔是无色、无味的气体,微溶于水。
(1)氧化反应:可燃性(明亮带黑烟)2C2H2 +5O24CO2 +2H2O 易被 KMnO4酸性溶液氧化(叁键断裂)(2)加成反应:乙炔与溴发生加成反应四、脂肪烃的来源及其应用教学过程备注练习写出戊烯的同分异构体:思考以下两种结构是否相同?二、烯烃的顺反异构讲在烯烃中,由于双键的存在,除因双键位置不同而产生的同分异构体外,在烯烃中还有一种称为顺反异构(也称几何异构)的现象。
当 C C 双键上的两个碳原子所连接的原子或原子团不相同时,就会有两种不同的排列方式。
1、由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
2、形成条件:(1)具有碳碳双键 (2)组成双键的每个碳原子必须连接两个不同的原子或原子团、讲两个相同的原子或原子团居于同一边的为顺式( cis-),分居两边的为反式( trans-)。
例如,在2-丁烯中,两个甲基可能同时位于分子的一侧,也可能分别位于分子的两侧。
投影顺丁烯反丁烯的结构图三、炔烃分子里含有碳碳三键的一类脂肪烃称为炔烃。
自学讨论在学生自学教材的基础上,教师与学生一起讨论乙炔的分子结构特征,并推测乙炔可能的化学性质小结乙炔的组成和结构1、乙炔 (ethyne)的结构分子式:C2H2,实验式:CH,电子式:结构式:H-C C-H,分子构型:直线型,键角:180 投影乙炔的两钟模型2、乙炔的实验室制取 (1)反应原理:CaC22H2O CH CH Ca( OH)2 (2)装置:固 -液不加热制气装置。
高中化学脂肪烃教案

高中化学脂肪烃教案
一、教学目标:
1. 了解脂肪烃的结构特点;
2. 掌握脂肪烃产生和性质;
3. 了解脂肪烃的用途。
二、教学重点:
1. 脂肪烃的结构特点;
2. 脂肪烃的性质;
3. 脂肪烃的用途。
三、教学内容:
1. 脂肪烃的定义和分类;
2. 脂肪烃的结构特点;
3. 脂肪烃的产生和性质;
4. 脂肪烃的用途。
四、教学过程:
1. 脂肪烃的定义和分类(10分钟)
- 脂肪烃是由碳和氢组成的一类有机化合物,主要包括烷烃、烯烃和炔烃三类。
2. 脂肪烃的结构特点(15分钟)
- 烷烃的通式为CnH2n+2,烯烃的通式为CnH2n,炔烃的通式为CnH2n-2,其分子都是碳原子通过单、双、三键相连而构成的链状结构。
3. 脂肪烃的产生和性质(20分钟)
- 脂肪烃主要从石油中提炼得到,具有不溶于水、易燃烧等性质。
4. 脂肪烃的用途(15分钟)
- 脂肪烃广泛用于化工、燃料等方面,如汽油、柴油、润滑油等。
五、教学方法:
1. 讲解结合实例;
2. 学生讨论,激发学生思考。
六、教学评价:
1. 提问回答;
2. 课后作业。
七、教学反思:
通过本节课的教学,学生能够全面了解脂肪烃的结构特点、产生和用途,提高学生的化学素养和实践能力。
脂肪烃(示范课教案)
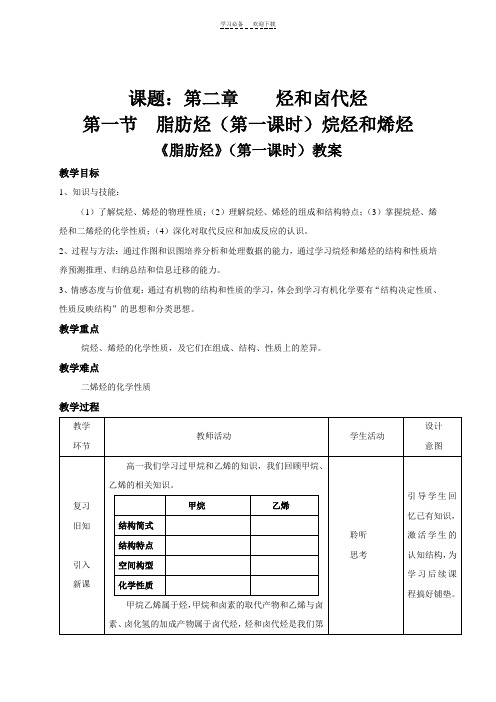
课题:第二章烃和卤代烃第一节脂肪烃(第一课时)烷烃和烯烃《脂肪烃》(第一课时)教案教学目标1、知识与技能:(1)了解烷烃、烯烃的物理性质;(2)理解烷烃、烯烃的组成和结构特点;(3)掌握烷烃、烯烃和二烯烃的化学性质;(4)深化对取代反应和加成反应的认识。
2、过程与方法:通过作图和识图培养分析和处理数据的能力,通过学习烷烃和烯烃的结构和性质培养预测推理、归纳总结和信息迁移的能力。
3、情感态度与价值观:通过有机物的结构和性质的学习,体会到学习有机化学要有“结构决定性质、性质反映结构”的思想和分类思想。
教学重点烷烃、烯烃的化学性质,及它们在组成、结构、性质上的差异。
教学难点二烯烃的化学性质教学过程达标练习1、下列性质不属于烷烃性质的是:()A.它们完全燃烧时生成CO2和H2O B.它们都溶于水C.它们都跟卤素发生取代反应D.通常情况下,它们和酸、碱和氧化剂都不反应2、下列物质①丁烷②丙烷③戊烷④壬烷⑤甲烷沸点由高到低排列顺序正确的是()A. ①>②>③>④>⑤B. ③>④>⑤>①>②C. ⑤>④>③>②>①D. ④>③>①>②>⑤3、制取一氯乙烷最好采用的方法是()A.乙烷和氯气发生取代反应B.乙烯跟氯气发生加成反应C.乙烯跟氢气发生加成反应D.乙烯跟氯化氢发生加成反应反应4、取代反应是有机化学中的一类重要反应,下列反应属于取代反应的是()A.丙烷与氯气在光照的作用下生成氯丙烷的反应B.乙烯与溴的四氯化碳溶液生成溴乙烷的反应C.丙烯使酸性高锰酸钾溶液褪色D.乙烯生成聚乙烯的反应5、下列关于乙烯和乙烷相比较的说法中,不正确的是()A.乙烯和乙烷的化学性质不同主要是因为乙烯中存在碳碳双键,乙烷中是碳碳单键B.乙烯分子中所有原子处于同一平面上,乙烷分子中原子不在同一平面上。
C.乙烯分子中的碳碳双键和乙烷分子中的碳碳单键相比较,双键更不易断裂,所以乙烯比乙烷稳定。
D.乙烯能使酸性高锰酸钾溶液褪色,乙烷不能。
推荐作业写出下列反应的化学方程式,并注明反应类型(1)丙烷燃烧(2)乙烷和溴蒸汽在光照的条件下反应(3)丙烯通入到溴的四氯化碳溶液中(4)丙烯在催化剂加热的条件下生成聚丙烯附表(一):【归纳小结】烷烃和烯烃组成、结构性质的对比(涉及化学性质的栏目填“能”或“否”)附表(二)无机反应与有机反应类型的对比附:板书计划板书设计:脂肪烃(第一课时)一、烷烃和烯烃1、物理性质:2、烷烃和烯烃的通式和结构特点:(1)组成通式;C n H2n+2(n≥1) C n H2n (n≥2)(2)结构特点3、烷烃和烯烃的化学性质(1)烷烃的化学性质:通常情况下,性质稳定。
高二化学(人教版)-脂肪烃(1)-1教案
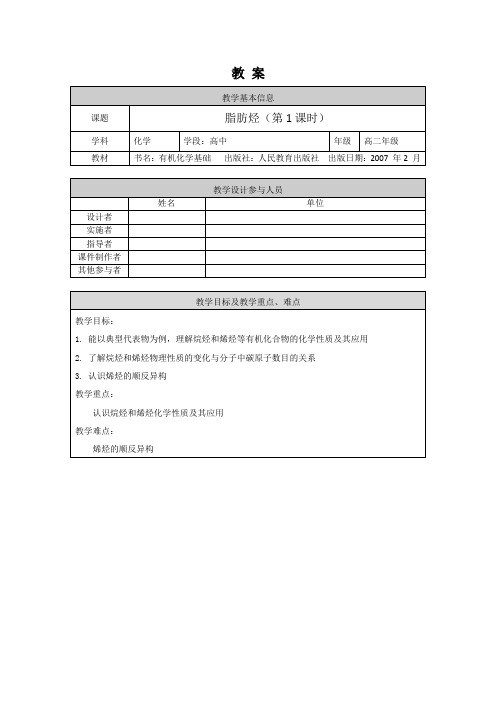
学习烷烃和烯烃化学性质的应用3:认识多种类别有机化合物之间的转化
任务5
请根据教材第28页两个表格中的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。通过所绘制的曲线图,我们可以得到哪些信息?
学习烷烃和烯烃的物理性质
任务6
请同学们分别搭建乙烷和乙烯的球棍分子模型。
请你沿碳碳键轴的方向旋转,感受两个模型有何不同?
认识烷烃和烯烃结构特点,为学习烯烃的顺反异构做铺垫
任务7
同学们观察乙烯分子的球棍模型,若将其分子中两个不ห้องสมุดไป่ตู้碳上的一个氢原子分别用甲基取代,请尝试能搭建出几种结构?
学习烯烃的顺反异构
1.甲烷与氯气生成一氯甲烷的反应
2.乙烯与溴的反应
3.乙烯生成聚乙烯的反应
思考:依据以上化学方程式,你能发现有机反应有何特点?
学习烷烃和烯烃化学性质的应用1:认识有机反应特点
任务2
写出下列反应的化学方程式,并注明反应类型。
1.丙烷与氯气生成一氯丙烷的反应
2.丙烯与溴化氢的反应
思考:思考:依据以上化学方程式,你还能发现有机反应有何特点?
继续学习烷烃和烯烃化学性质的应用1:认识有机反应特点
任务3
1,3-丁二烯是一种重要的基础化工原料,它的结构简式为CH2=CH-CH=CH2。我们从中可以得到哪些信息?
思考:一分子1,3-丁二烯和一分子氯气发生加成反应时,可能生成哪些产物?
学习烷烃和烯烃化学性质的应用2:认识有机化合物的一般思路
任务4
反馈评价
习题的讲与练
帮助学生评价学习效果
思维方法小结
新人教版高中化学选修五2.1《脂肪烃》优秀教案(重点资料).doc

第一节脂肪烃教学目的:12质。
教学重点:烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法。
教学难点:烯烃的顺反异构。
教学教程:一、烷烃和烯烃1、物理性质递变规律[思考与交流]P28完成P29图2-1结论:P292、结构和化学性质回忆甲烷、乙烯的结构和性质,引导学生讨论甲烷、乙烯的结构和性质的相似点和不同点,列表小结。
[思考与交流]P29化学反应类型小结完成课本中的反应方程式。
得出结论:取代反应:加成反应:聚合反应:[思考与交流]进一步对比烷烃、烯烃的结构和性质:[思考与交流]丙稀与氯化氢反应后,会生成什么产物呢?试着写出反应方程式:导学在课堂P36[学与问]P30烷烃和烯烃结构对比 完成课本中表格[资料卡片]P30二烯烃的不完全加成特点:竞争加成 注意:当氯气足量时两个碳碳双键可以完全反应 二、烯烃的顺反异构体 观察下列两组有机物结构特点:它们都是互为同分异构体吗? 归纳:什么是顺反异构?P32思考:下列有机分子中,可形成顺反异构的是 A CH 2=CHCH 3 B CH 2=CHCH 2CH 3 CCH 3CH =C(CH 3)2 DCH 3CH =CHCl答案:D 三、炔烃 1)结构:2)乙炔的实验室制法:原理:CaC 2+2H 2O Ca(OH)2+C 2H 2↑ 实验装置: P.32图2-6 注意事项:a 、检查气密性;b 、怎样除去杂质气体?(将气体通过装有CuSO 4溶液的洗气瓶)c 、气体收集方法—C —C —H HH H CH 3 CH 3 —C —C —HHH H CH 3CH 3 第一组CC =HHH 3C CH 3 C C =H HH 3CCH 3第二组乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?(1)因电石中含有 CaS、Ca3P2等,也会与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;(2)如何去除乙炔的臭味呢?(NaOH和CuSO4溶液)(3)H2S对本实验有影响吗?为什么?H2S具有较强还原性,能与溴反应,易被酸性高锰酸钾溶液氧化,使其褪色,因而会对该实验造成干扰。
高二下学期化学《脂肪烃》集体备课教案(精编版)

高二下学期化学《脂肪烃》集体备课教案1、内容和进度:完成2 -1 脂肪烃一节的教学第1课时:烷烃第2课时:烯烃第3课时:炔烃、脂肪烃的来源及其应用第4课时:习题讲解2、重点和难点突破教学重点:1、烯烃、炔烃的结构特点和主要化学性质2、乙炔的实验室制法教学难点:烯烃的顺反异构附导学案: 2-1 脂肪烃课前预习学案一、预习目标1、了解烷烃、烯烃代表物的结构和性质等知识2、了解乙炔和炔烃的结构、性质和制备等知识3、了解烯烃的顺反异构概念、存在条件和脂肪烃的来源二、预习内容(一)、烷烃和烯烃1、分子里碳原子跟碳原子都以结合成,碳原子剩余的跟氢原子结合的烃叫烷烃。
烷烃的通式为,烷烃的主要化学性质为(1)(2)2、烷烃和烯烃(1)烯烃是分子中含有的链烃的总称,分子组成的通式为cnh2n,最简式为。
烯烃的主要化学性质为(1)(2)(3)(3)顺反异构的概念(二)乙炔1、乙炔的分子式,最简式,结构简式2、电石遇水产生乙炔的化学方程式为减压分馏利用在减压时,____ _降低,从而达到分离_______目的催化裂化将重油(石蜡)在催化剂作用下,在一定的温度、压强下,将________断裂________. 提高汽油的产量裂解又称______裂化,使短链烃进一步断裂生成_________催化重整提高汽油的辛烷值和制取芳香烃三、提出疑惑同学们,通过你的自主学习,你还有哪些疑惑,请把它填在下面的表格中疑惑点疑惑内容课内探究学案一、学习目标1.了解烷烃、烯烃、炔烃物理性质的变化与分子中碳原子数目的关系2、能以典型代表物为例,理解烷烃、烯烃、炔烃的化学性质3、了解烷烃、烯烃、炔烃的特征结构、烯烃的顺反异构和乙炔的实验室制法4、让学生在复习、质疑、探究的学习过程中增长技能,学习重难点:1、物理性质的规律性变化、烷烃的取代反应2、烯烃的加成反应、加聚反应、烯烃的顺反异构现象3、实验室制乙炔的反应原理及反应特点二、学习过程探究一:烷烃、烯烃的熔、沸点阅读p28思考和交流思考; 烷烃的沸点与其分子中所含有的碳原子数之间的关系(a)随着分子里含碳原子数的增加,熔点、沸点逐渐,相对密度逐渐;(b)分子里碳原子数等于或小于的烃,在常温常压下是气体,其他烃在常温常压下都是液体或固体;(c)烷烃的相对密度水的密度。
【推荐】人教版高中化学选修五-脂肪烃第1课时(教案)

2.1脂肪烴教學設計第1課時教學目的知識技能1、瞭解烷烴、烯烴和炔烴的物理性質的規律性變化2、瞭解烷烴、烯烴、炔烴的結構特點過程與方法1、注意不同類型脂肪烴的結構和性質的對比2、善於運用形象生動的實物、模型、電腦課件等手段幫助學生理解概念、掌握概念、學會方法、形成能力情感態度價值觀根據有機物的結果和性質,培養學習有機物的基本方法“結構決定性質、性質反映結構”的思想重點烯烴的結構特點和化學性質難點烯烴的順反異構知識結構與板書設計第二章烴和鹵代烴第一節脂肪烴一、烷烴(alkane)和烯烴(alkene)1、結構特點和通式:(1) 烷烴: (2) 烯烴:2、物理性質3、基本反應類型(1) 取代反應: (2) 加成反應:(3) 聚合反應:4、烷烴化學性質(與甲烷相似)烷烴不能使酸性高錳酸鉀溶液和溴水褪色(1)取代反應:(2)氧化反應:5、烯烴的化學性質(與乙烯相似)(1)加成反應(2)氧化反應○1燃燒:○2使酸性KMnO4溶液褪色:○3催化氧化:2R—CH=CH2 + O22R1COR2CH3(3) 加聚反應6、二烯烴的化學性質(1)二烯烴的加成反應:(1,4一加成反應是主要的)(2) 加聚反應: n CH2=CHCH=CH2催化剂(順丁橡膠)教學過程備註引入]同學們,從這節課開始我們來學習第二章的內容——烴和鹵代烴。
甲烷、乙烯、苯這三種有機物都僅含碳和氫兩種元素,它們都是碳氫化合物,又稱烴。
根據結構的不同,烴可分為烷烴、烯烴、炔烴和芳香烴等。
而鹵代烴則是從結構上可以看成是烴分子中的氫原子被鹵原子取代的產物,是烴的衍生物的一種。
我們先來學習第一節——脂肪烴。
3、基本反應類型(1) 取代反應:有機物分子裏的某些原子或原子團被其他原子或原子團所取代的反應。
如烴的鹵代反應。
(2) 加成反應:有機物分子中雙鍵(三鍵)兩端的碳原子與其他原子或原子團所直接結合生成新的化合物的反應。
如不飽和碳原子與H 2、X 2、H 2O 的加成。
最新精编高中人教版选修五高中化学2.1脂肪烃第1课时公开课优质课教学设计2

普通高中课程标准实验教科书—化学选修5人教版]第二章烃和卤代烃第一节脂肪烃教学目标:1以烷、烯、炔的代表物为例,比较它们在组成、结构、性质上的差异。
2能说出天然气、石油液化气、汽油的组成,认识它们在生产生活中的应用。
3根据有机化合物组成和结构的特点,认识加成、取代反应。
教学重点:以烷、烯、炔的代表物为例,比较它们在组成、结构、性质上的差异。
教学难点:根据有机化合物组成和结构的特点,认识加成、取代反应。
实验探究:比较甲烷、乙烯、乙炔的化学性质。
课时划分:两课时教学过程:第一课时自学]第二章前言。
提问]1、什么是烃的衍生物?什么是卤代烃?2、有机反应特点?回答]烃分子中的氢原子被其他原子或原子团取代的产物称为的烃的衍生物;烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。
2、(1)反应缓慢。
有机分子中的原子一般以共价键结合,有机反应是分子之间的反应。
(2)反应产物复杂。
有机物往往具有多个反应部位,在生成主要产物的同时,往往伴有其他副产物的生成。
(3)反应常在有机溶剂中进行。
有机物一般在水中的溶解度较小,而在有机溶剂中的溶解度较大。
板书] 第二章烃和卤代烃第一节脂肪烃一、烷烃和烯烃复习]1、烷烃定义?2、举例什么是结构简式?结构式?2、写出戊烷的几种同分异构体,并用系统法命名。
思考与交流] 表2—1和表2—2:分别列举了部分烷烃与烯烃的沸点和相对密度。
请你根据表中给出的数据,以分子中碳原子数为横坐标,以沸点或相对密度为纵坐标,制作分子中碳原子数与沸点或相对密度变化的曲线图。
通过所绘制的曲线图你能得到什么信息?投影]动手]绘制碳原子数与沸点或相对密度变化曲线图:总结]烷烃和烯烃溶沸点变化规律:原子数相同时,支链越多,沸点越低。
沸点的高低与分子间引力--范德华引力(包括静电引力、诱导力和色散力)有关。
烃的碳原子数目越多,分子间的力就越大。
支链增多时,使分子间的距离增大,分子间的力减弱,因而沸点降低。
高中化学 第二章 第一节 脂肪烃教案 新人教版选修5
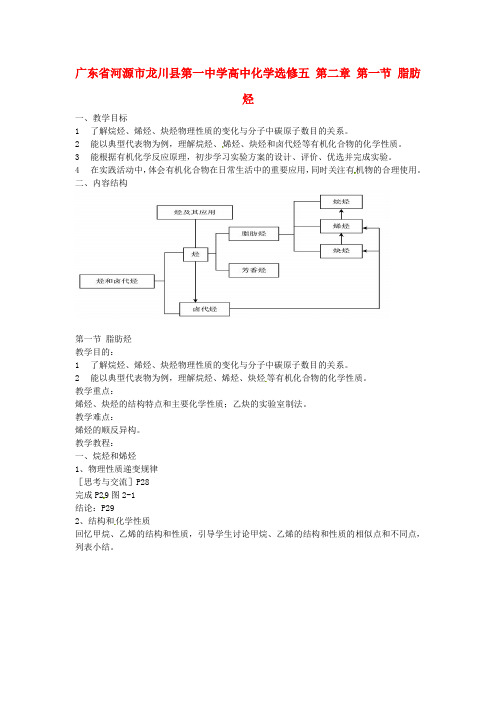
广东省河源市龙川县第一中学高中化学选修五第二章第一节脂肪烃一、教学目标1了解烷烃、烯烃、炔烃物理性质的变化与分子中碳原子数目的关系。
2能以典型代表物为例,理解烷烃、烯烃、炔烃和卤代烃等有机化合物的化学性质。
3能根据有机化学反应原理,初步学习实验方案的设计、评价、优选并完成实验。
4在实践活动中,体会有机化合物在日常生活中的重要应用,同时关注有机物的合理使用。
二、内容结构第一节脂肪烃教学目的:1了解烷烃、烯烃、炔烃物理性质的变化与分子中碳原子数目的关系。
2能以典型代表物为例,理解烷烃、烯烃、炔烃等有机化合物的化学性质。
教学重点:烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法。
教学难点:烯烃的顺反异构。
教学教程:一、烷烃和烯烃1、物理性质递变规律[思考与交流]P28完成P29图2-1结论:P292、结构和化学性质回忆甲烷、乙烯的结构和性质,引导学生讨论甲烷、乙烯的结构和性质的相似点和不同点,列表小结。
[思考与交流]P29化学反应类型小结完成课本中的反应方程式。
得出结论:取代反应:加成反应:聚合反应:[思考与交流]进一步对比烷烃、烯烃的结构和性质:[思考与交流]丙稀与氯化氢反应后,会生成什么产物呢?试着写出反应方程式: 导学在课堂P36[学与问]P30烷烃和烯烃结构对比完成课本中表格[资料卡片]P30二烯烃的不完全加成特点:竞争加成注意:当氯气足量时两个碳碳双键可以完全反应二、烯烃的顺反异构体观察下列两组有机物结构特点:—C —C —H H H H CH 3 CH 3 —C —C —H H H H CH 3 CH 3 第一组 C C = H H H 3C CH 3 C C = H H H 3C CH 3 第二组它们都是互为同分异构体吗?归纳:什么是顺反异构?P32思考:下列有机分子中,可形成顺反异构的是A CH2=CHCH3B CH2=CHCH2C H3C CH3CH=C(CH3)2D CH3CH=CHCl答案:D三、炔烃1)结构:2)乙炔的实验室制法:原理:CaC2+2H2O Ca(OH)2+C2H2↑实验装置: P.32图2-6注意事项:a、检查气密性;b、怎样除去杂质气体?(将气体通过装有CuSO4溶液的洗气瓶)c、气体收集方法乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?(1)因电石中含有 CaS、Ca3P2等,也会与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;(2)如何去除乙炔的臭味呢?(NaOH和CuSO4溶液)(3)H2S对本实验有影响吗?为什么?H2S具有较强还原性,能与溴反应,易被酸性高锰酸钾溶液氧化,使其褪色,因而会对该实验造成干扰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
湖南省蓝山二中高二化学《2.1 脂肪烃(1)》教案
教学目标:
1. 了解烷烃、烯烃和炔烃同系物的物理性质递变规律
2. 掌握烷烃、烯烃和炔烃的结构特点和主要化学性质
3. 了解天然气、石油液化气、汽油的来源和组成,认识它们在生产和生活中的应用
4. 了解脂肪烃的来源及其应用 教学重点: 烷烃、烯烃和炔烃的结构特点和主要化学性质
教学难点: 烷烃、烯烃和炔烃的结构特点和主要化学性质
教学过程
1.甲烷乙烯结构性质的相似点和不同点?特征反应分子式
电子式
结构式
结构简式
空间结构
复习
甲烷
乙烯CH 4C 2H 4CH 2CH 2CH 4正四面体平面结构取代加成
2.什么叫同系物?
一.烷烃和烯烃
1.同系物物性递变规律(P.28思考与交流)
分子中碳原子数结论:随着分子中碳原子数的递增,烷烃和烯烃同系物的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态(1~4个碳原子的烃常温常压下为气态)
·同碳原子数的烷烃,支链越多沸点越低
原因:结构相似的物质(分子晶体),分子间作用力随相对分子质量的增大而逐渐增大;
2.烷烃、烯烃的化学性质:(与甲烷、乙烯相似)知识回顾:甲烷、乙烯具有怎样的化学性质?(2)在特定条件下甲烷能与某些物质发生化学反应,如可以燃烧和发生取代反应等。
甲烷(1)通常下,甲烷稳定,如与强酸、强碱和强氧化剂等一般不发生化学反应。
取代反应:有机物分子中某些原子或原子团被其它原
子或原子团替代的反应
练习:
1、写出乙烷和氯气生成一氯乙烷的化学方程式
CH 3COOH CH 3COO +HOCH 2CH 3CH 2CH 3+H 2O 浓硫酸△2CH 3CH 2OH + O 2→2CH 3CHO + 2H 2O
Cu
△(溴苯)C 6H 6+ Br 2 FeBr 3
+ HO -NO 2浓H 2SO 4
55℃~60℃
-NO 2+ H 2O + HO -SO 3H 70℃~80℃-SO 3H +H 2O A
B C D E 2、下列反应属于取代反应的是
+HBr
乙烯
1)氧化反应
(1)将乙烯气体点燃:化学反应方程式:
(2)被氧化剂氧化:可使酸性高锰酸钾褪色
2)加成反应应用:用于
鉴别甲烷和
乙烯气体!
CH 2=CH 2+ Br 2→
CH 2
BrCH 2Br
3)聚合反应(加聚反应)
简写为:
烯烃的性质
A、氧化反应:
a、点燃燃烧;明亮的火焰,少量的黑烟。
溶液褪色。
b、使酸性KMnO
4
B、加成反应(与H2、X2、HX、H2O等):
请写出CH3CH=CH2分别与H2、Br2、HCl、H2O发生加成反应的化学方程式。
C、加聚反应:
nCH2=CHCH3→[CH2-CH]
n
CH3
分别写出下列烯烃发生加聚反应的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
思考:二烯烃能否发生加成、加聚反应呢?CH 2=CH-CH=CH 2+2Br 2CH 2=CH-CH=CH 2+Br 2CH 2-CH-CH-CH 2Br Br Br Br nCH 2=CH-CH=CH 2
1,2 加成1,4 加成CH 2-CH-CH=CH 2
Br Br
CH 2-CH=CH-CH 2
Br Br [CH 2-CH=CH-CH 2]n 以C 4H 8为例写出其烯烃类的同分异构体,并用系统命名法命名
思考:2-丁烯中与碳碳双键相连的两个碳
原子、两个氢原子是否处于同一平面?
若处于同一平面,与碳碳双键相连的两个碳原子是处于双键的同侧还是异侧?CH 2=CHCH 2CH 3
CH 3CH=CHCH 3CH 2=CCH 3CH 3
2-丁烯2-甲基-1-丙烯
1-丁烯
像这样每个双键碳原子连接了两种不同的原子或原子团,双键上的4个原子或原子团在空间就有两种不同的排列方式,产生两种不同的异构,即顺反异构。
3、烯烃的顺反异构
烯烃的同分异构现象碳链异构
位置异构
官能团异构
顺反异构(空间异构)
练习:下列物质中存在顺反异构的是()A.1,2-二氯乙烯B.1,2-二氯丙烯C.2-甲基-2-丁烯D.2-氯-2-丁烯
+36ºC -1ºC -89ºC -162º
C 沸点戊烷
丁烷乙烷甲烷物质1.下列烷烃的沸点是:
根据以上数据推断丙烷的沸点可能是(
)
A.约-40ºC
B.低于-162ºC
C.低于-89ºC
D.高于+36ºC A 2.制取氯乙烷的最好方法是()
A.乙烷和氯气反应
B.乙烯和氯气反应
C.乙烯和氯化氢反应
D.乙炔和氯化氢反应
巩固练习:
C 4.可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法是()
A.混合气体通过盛酸性高锰酸钾溶液的洗气瓶
B.混合气体通过盛足量溴水的洗气瓶
C.混合气体通过盛水的洗气瓶
D.混合气体跟氯化氢混合
3.在光照下,将等物质的量的甲烷与氯气充分反应,得到产物的物质的量最多的是( )A.CH 3Cl B.CH 2Cl 2 l 4 D.HCl
D
B
5.下列属于加成反应的是()
A.乙烯通入溴水中使溴水褪色
B.乙烯使酸性高锰酸钾溶液褪色
C.四氯化碳与溴水混合振荡,静置后溴水褪色
D.工业上乙烯水化制乙醇AD 6. 找出下列高聚物的单体
1) [ CH 2-CH ] n C 6H 52) [ CH 2-CH=C-CH 2]
n Cl 3) [CH 2-CH 2-CH-CH 2]
n
Cl [CH 2-CH=CH-CH 2-CH 2-CH 2]n 4)。
