醇类
醇类、醚类与硫醇类

本次研究工作总结
研究成果概述
本次研究成功合成了一系列醇类、醚类与硫醇类化合物,并对其结构进行了详细表征。通过对比实验,探讨了不同反 应条件对产物选择性和收率的影响。
研究方法创新
在合成过程中,我们采用了新的催化剂和反应条件,有效提高了反应的效率和产物的纯度。同时,通过改进分离和纯 化方法,成功获得了高纯度的目标产物。
开发高效合成方法
针对目前合成方法中存在的一些问题,如反应时 间长、产率低等,未来可以致力于开发更高效、 更绿色的合成方法,提高目标产物的收率和纯度 。
深入研究反应机理
虽然本次研究取得了一定的成果,但对于某些反 应的具体机理仍不明确。未来可以通过理论计算 、动力学实验等手段深入研究反应机理,为优化 合成路线提供理论指导。
实验数据分析
通过对实验数据的深入分析,我们发现了一些有趣的构效关系。例如,某些特定结构的醇类化合物表现 出优异的抗氧化性能,而某些醚类化合物则具有良好的抗菌活性。
对未来研究方向的展望
拓展应用领域
鉴于醇类、醚类与硫醇类化合物在有机合成、医 药、农药等领域的广泛应用,未来可以进一步探 索这些化合物在新领域的应用潜力,如材料科学 、能源科学等。
物理性质
醚类通常具有较低的沸点和密度,易挥发,多数 醚类具有香味。
3
化学性质
醚类相对稳定,不易被氧化或还原,但在强酸存 在下可发生裂解反应。
醚类合成方法
威廉姆森合成法
在无水条件下,卤代烃与醇钠反应生成醚,是实 验室和工业上常用的合成方法。
醇的脱水反应
两分子醇在酸性催化剂作用下脱水生成醚,是工 业上生产某些醚类的方法之一。
01
溶剂
由于醇类具有良好的溶解性能,常 被用作有机合成中的溶剂。
醇类

四、乙醇的制法
CH2=CH2 +H2O
酶
催化剂
加热加压
C2H5OH
C6H12O6
2C2H5OH+2CO2
练习:
1.下列物质在加热条件下,能使表面氧化变黑的原 质量为m克的铜线重新变为光亮的红色,且质量仍为 m克的是( BD ) A.纯碱溶液
C.稀硝酸
B.酒精
D.一氧化碳
2.一定量的乙醇在氧气不足的情况下燃烧,得到CO、 CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )A A.1.4 g
考考你!
3、用浓H2SO4跟分子式为C2H6O和C3H8O 的醇的混合液加热反应,可得到的烯烃的种 2 类为__________种,可得到的醚的种类为 _________种。 6
考考你!
4、写出下列各饱和一元醇的结构简式,并判断其中能发生消去反应的 有___________________________;能发生消去反应生成两种产物的有 ②③⑤⑥⑦⑧⑨ ③和⑦、⑤和⑧ ____________;能发生消去反应生成相同产物的有_________________; ③⑦⑨ ①②④⑥⑦⑧⑨ 能发生催化氧化反应的有________________;能被催化氧化生成相应醛 的有__________。 ①④⑥⑧ ①甲醇 ②2-丙醇 ③2-甲基-2-丁醇 ④2,2-二甲基-1-丙醇 ⑤2-甲基-2-丙醇 ⑥1-丁醇 ⑦3-甲基-2-丁醇 ⑧2-甲基-1-丙醇 ⑨2-戊醇
考考你!
下列给出一些化合物的结构简式:
A、 -CH2-OH B、 E、 CH3- OH -C-OH -OH C、 COOH -CH2-OH
D、
-CHCOOH
OH
CH3 F、 CH、CH2=CH-CH(CH3)CH2OH
醇的化学性质与应用

醇的化学性质与应用在化学领域中,醇是一类重要的有机化合物,其化学性质独特且多样。
醇分子中含有一个或多个羟基(OH基团),这使得醇具有一系列物理和化学性质,以及广泛的应用领域。
本文将探讨醇的化学性质以及其在医药、工业和实验室等领域中的应用。
一、醇的化学性质醇是通过醇类化合物中碳原子上的氢被羟基(OH基团)取代而形成的,其结构通用式为:R-OH。
根据羟基取代的位置和数量,醇可以分为一元醇、二元醇、多元醇等不同类型。
醇的化学性质主要涉及酸碱性、氧化还原性和水解性等方面。
1. 酸碱性:醇具有一定的酸碱性,能够与碱反应形成盐和水。
例如,乙醇(C2H5OH)与氢氧化钠(NaOH)反应,生成乙醇钠(C2H5ONa)和水(H2O),显示出酸碱中和的特性。
2. 氧化还原性:醇具有氧化还原反应的能力。
醇可以被氧化剂氧化为相应的醛或酮。
醇的氧化反应常常伴随着羟基氧化为醛或酮基团的生成,如乙醇可以被氧气氧化为乙醛。
3. 水解性:醇可发生水解反应,将醇分子中的羟基断裂,生成相应的酸。
例如,乙醇可以在酸性条件下水解为乙酸。
二、醇的应用领域由于其独特的化学性质,醇在众多领域发挥着重要作用。
下面将介绍醇在医药、工业和实验室等领域中的应用。
1. 医药领域:醇广泛应用于药物的合成和制备过程中。
醇可以作为药物活性部分的前体合成,同时也是一些药物的主要溶剂。
例如,乙二醇作为一种醇类物质,常用于制造药用注射剂。
2. 工业领域:醇在工业中具有多种应用。
一方面,醇可以用作溶剂,广泛应用于涂料、油墨、胶粘剂等领域。
另一方面,醇也可以用作合成化工产品的重要原料,例如乙二醇是合成聚酯纤维原料的关键物质。
3. 实验室应用:醇是实验室中常用的重要试剂和溶剂,用于溶解和稀释各种化合物。
醇的溶解能力较强,使其成为溶解固体样品或稀释液态试剂的理想选择。
总结起来,醇作为一类重要的有机化合物,具有独特的化学性质和广泛的应用领域。
从医药到工业,从实验室到生产现场,醇的应用与化学性质密不可分。
醇类的知识点总结

醇类的知识点总结一、醇类的命名与结构1.1 醇类的命名醇类通常以“-ol”结尾,如甲醇、乙醇、丙醇等。
对于含有多个羟基的醇类,一般采用字母顺序进行编号,并在编号前面加上羟基数目的前缀(di-、tri-等),如乙二醇。
有时也可以使用系统命名法来命名醇类,例如乙醇可以用1-羟基乙烷。
1.2 醇类的结构醇类的分子结构通常以一个或多个羟基(-OH)连接着一个或多个碳原子链。
这些碳原子也可能与其他官能团相连,如醛、酮、酸等。
二、醇类的物理性质2.1 水溶性醇类的水溶性与其分子大小、羟基数目和极性有关,一般来说,含有一定数量的碳原子(一般大于3个)和一个羟基的醇类,如乙醇、丙醇等,其溶解度较高。
而含有多个羟基的醇类,如甘油、乙二醇等,则溶解度更高。
不过,随着分子大小的增加,溶解度逐渐下降。
2.2 沸点和密度醇类的沸点和密度随着分子大小的增加而增加,这与其分子量和分子结构有关。
另外,含有更多羟基的醇类其沸点和密度也相对更高,这是因为羟基增加了分子之间的氢键作用。
2.3 氢键作用由于醇类分子中含有羟基(-OH),这使得它们具有形成氢键的能力。
这种氢键作用使得醇类分子之间产生较强的吸引力,从而影响了其物理和化学性质。
三、醇类的化学性质3.1 醇类的酸碱性醇类分子中的羟基在一定条件下可以释放质子,表现出酸性。
一般来说,醇类的酸性比较弱,且随着羟基数目的增加,酸性也相应增强。
另外,含有多个羟基的醇类也较易形成盐类。
3.2 醇类的氧化性醇类在一定条件下可以被氧化成醛、酮和酸等,其中主要是由于羟基上的氢被氧化成羟基后脱离,形成相应的氧化产物。
例如,乙醇经氧化可以生成乙醛。
3.3 醇类的醚化反应醇类分子中的羟基可以与醚类化合物发生醚化反应,形成醚。
例如,乙醇和乙醚可以发生醚化反应,生成乙基乙醚。
3.4 醇类的酯化反应醇类分子中的羟基可以与酸类化合物发生酯化反应,形成酯。
例如,甲醇和乙酸可以发生酯化反应,生成甲乙酸甲酯。
四、醇类的应用4.1 工业用途醇类作为溶剂在化工生产中有着广泛的应用,如酒精、丙醇等可以用作有机溶剂,用于溶解树脂、油漆等。
醇类

相连的C原子上有 原子的,氧化成酮 与-OH相连的 原子上有 个H原子的 氧化成酮 相连的 原子上有1个 原子的 氧化成酮.
O 2CH3-C-CH3 + 2H2O 丙酮
相连的C原子上没有 原子的,不能催化氧化 与-OH相连的 原子上没有 原子的 不能催化氧化 相连的 原子上没有H原子的 不能催化氧化.
(1)、 (1)、与钠反应
请写出2 丙醇、乙二醇、 请写出2-丙醇、乙二醇、丙三醇分别 与钠反应的化学方程式
(2)、消去反应(分子内脱水) 消去反应(分子内脱水) 判断醇类发生消去反应的条件 OH相 的碳上有氢 才可发生消去反应. -OH相邻的碳上有氢 才可发生消去反应 即醇分子结构中含有β-H 醇分子结构中含有β 写出2-丁醇发生消去反应的方程式 写出 -
CH3CHCH3 OH
2—丙醇 —
[练习] 练习]
①
写出下列醇的名称
CH3
CH3—CH—CH2—OH OH CH3—CH2—CH—CH3 CH3 CH3 CH3—CH—C—OH CH2—CH3
2—甲基 甲基—1—丙醇 甲基 丙醇
②
2—丁醇 丁醇
③
2,3—二甲基 , 二甲基—3—戊醇 二甲基 戊醇
7. 醇类化学性质: 醇类化学性质:
=
2 CH3-C-O-H + O2 CH3
不能发生催化氧化
醇催化氧化规律
a.-OH连接碳原子上有两个H原子, a.-OH连接碳原子上有两个H原子,则该醇 连接碳原子上有两个 被氧化生成醛 b.-OH连接碳原子上有一个H原子, b.-OH连接碳原子上有一个H原子, 连接碳原子上有一个 则该醇氧化生成酮 c.-OH连接碳原子上无H原子, c.-OH连接碳原子上无H原子,则该醇不能 连接碳原子上无 被氧化
从官能团判断醇

从官能团判断醇摘要:一、醇的定义与性质二、醇的分类1.饱和醇2.不饱和醇3.芳香醇三、醇的官能团判断方法1.饱和醇的判断2.不饱和醇的判断3.芳香醇的判断四、醇的应用领域正文:醇是一类有机化合物,其分子中含有跟链烃基或苯环侧链上的碳结合的羟基(-OH)。
醇类化合物具有较高的沸点,通常为160-200 摄氏度,且具有特殊的气味和口感。
醇可以分为饱和醇、不饱和醇和芳香醇三类。
1.饱和醇饱和醇的判断主要依据其分子中羟基(-OH) 所连接的碳原子上没有未饱和的键。
在饱和醇中,所有的碳原子都形成了单键。
例如,正丙醇(CH3CH2CH2OH) 和正丁醇(CH3CH2CH2CH2OH) 都属于饱和醇。
2.不饱和醇不饱和醇是指分子中羟基(-OH) 所连接的碳原子上含有未饱和键的醇。
不饱和醇可以进一步细分为烯醇和炔醇。
烯醇是指分子中羟基(-OH) 所连接的碳原子上有一个烯基(-C=C-R),如丙烯醇(CH2=CHCH2OH)。
炔醇是指分子中羟基(-OH) 所连接的碳原子上有一个炔基(-C≡C-R),如乙炔醇(CH3C≡CCH2OH)。
3.芳香醇芳香醇是指分子中羟基(-OH) 直接连接在苯环上的醇。
由于苯环的共轭结构,芳香醇具有较强的稳定性。
例如,苯甲醇(C6H5CH2OH) 和邻苯二甲醇(C6H4(OH)2) 都属于芳香醇。
醇类化合物广泛存在于自然界,并在许多领域具有重要的应用价值。
例如,醇可以作为溶剂、消毒剂、燃料等。
此外,醇还是许多生物活性物质和药物的重要组成部分,如醇类抗生素、醇类抗病毒药物等。
醇的知识点

醇复习知识点一、醇的定义:羟基与烃基或者苯环侧链上的碳原子相连的化合物。
二、醇的分类:(1)按羟基数目分为:一元醇、二元醇、多元醇。
(醇分子中含有羟基,且羟基个数不限,但不存在1个C原子上连有2个羟基的醇,因为这样的醇不稳定。
)(2)按羟基连接类别分为:脂肪醇、芳香醇。
(3)按连接链烃基类别分为:饱和醇、不饱和醇(不饱和醇中羟基连在不饱和碳上不稳定,易转化为羰基)。
(4)饱和一元醇的通式:Cn H2n+1OH 或CnH2n+2O、R—OH三、醇的物理性质(1)状态:C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇。
甲醇有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷高。
且随着碳原子数的增多而升高。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
由于醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。
醇中的氢键是醇分子中羟基中的氧原子与另一醇分子中羟基的氢原子间存在的相互吸引力。
甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了如下所示的结构:(4)几种常见的醇:1.甲醇:甲醇俗称木精,能与水任意比互溶,有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
工业酒精里为了防止盗窃通常加入了甲醇。
2.乙二醇:乙二醇是一种无色、粘稠、有甜味的液体,主要用来生产聚酯纤维。
乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂。
3.丙三醇(甘油):丙三醇俗称甘油,是无色粘稠,有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
四、乙醇的物理性质:1.乙醇的结构分子式:C2H6O 结构简式:CH3CH2OH2.乙醇的物理性质:无色、透明、有特殊香味的液体;沸点78℃;易挥发;密度比水小;能跟水以任意比互溶;能溶解多种无机物和有机物。
化工产品数据库-醇类

α萘乙酮| β萘乙酮| β巯基乙醇| γ丁内脂丁二醇四氢呋喃醋酸甲酯醋酸乙酯| 安全环奔料| 安全织带| 桉树醇糠硫醇叶醇香叶醇芳樟醇环己醇| 氨丁三醇| 氨基苯硫醇| 氨基丙醇| 氨基丙醇丁二醇己二醇| 氨基丙醇氯乙醇糠醇油醇| 氨基丙醇三甘醇| 氨基丙醇一乙醇胺三正丁胺十四醇十六醇| 氨基丙醇异丙醇胺正丙醇烯丙醇| 氨基丙醇元| 氨基丙二醇| 氨基醇| 氨基环已醇| 氨基甲基丙醇| 氨基甲基丙醇氨基乙氧基乙醇| 氨基羟甲基丙二醇| 氨基乙醇| 氨基乙腈盐酸盐| 氨基乙硫醇| 氨基乙醛缩二甲醇| 氨基乙醛缩二乙醇| 氨基乙氧基乙醇| 氨水丙二醇丙酸| 胺醇类| 八氟戊醇| 八森异丙醇| 八十醇| 八十醇醇| 巴豆胺| 白火酒蓝火酒| 白砂糖| 苯氨醇| 苯丙噻二唑| 苯二酚| 苯酚红| 苯甘氨醇| 苯酐废料| 苯酐聚酯多元醇| 苯磺酸钠| 苯基丙醇| 苯基丙二醇| 苯基乙二醇| 苯甲醇| 苯甲醇苄醇| 苯甲醇烧碱盐酸| 苯甲醇无氯级| 苯甲醇下角| 苯甲醇元| 苯甲醚| 苯甲醛二甲缩醛| 苯氧乙醇| 苯氧乙醇丙二醇| 苯氧乙醇丙炔醇| 苯氧乙醇聚醋酸异烯酯| 苯氧乙醇医用| 苯氧乙醇医用二丙酮醇| 苯乙醇| 苯乙醇元| 苯乙烯乙二醇二乙二醇| 泵式液体灌装机| 吡啶乙醇| 蓖麻油| 蓖麻油羟基硬脂酸癸二酸己二酸| 扁环环填料| 扁平吊装带| 苄醇| 苄醇中铬黄| 苄基三丁基氯化铵| 苄基三甲基溴化铵| 苄硫醇| 标准气体| 表氯醇| 表面处理剂| 别克冷凝器| 冰花钵| 冰花机| 冰片莰醇| 冰片羟基乙醇醇丁醇对羟基苯乙醇| 丙吡胺| 丙醇| 丙醇丙醇糠醇四氢糠醇| 丙醇丙二醇异丙醇二丙酮醇| 丙醇醇类| 丙醇氯丙醇| 丙醇正丙醇异丙醇| 丙醇正丙醇异丙醇丙醇| 丙丁醇二甘醇| 丙二醇| 丙二醇丙二醇| 丙二醇丙二醇丙二醇| 丙二醇丙炔醇正辛醇| 丙二醇丙三醇乙二醇| 丙二醇丁
醇的知识点

醇复习知识点一、醇的定义:羟基与烃基或者苯环侧链上的碳原子相连的化合物。
二、醇的分类:(1)按羟基数目分为:一元醇、二元醇、多元醇。
(醇分子中含有羟基,且羟基个数不限,但不存在1个C原子上连有2个羟基的醇,因为这样的醇不稳定。
)(2)按羟基连接类别分为:脂肪醇、芳香醇。
(3)按连接链烃基类别分为:饱和醇、不饱和醇(不饱和醇中羟基连在不饱和碳上不稳定,易转化为羰基)。
(4)饱和一元醇的通式:C n H2n+1OH 或C n H2n+2O、R—OH三、醇的物理性质(1)状态:C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇。
甲醇有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷高。
且随着碳原子数的增多而升高。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
由于醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着相互吸引作用,这种吸引作用叫氢键。
醇中的氢键是醇分子中羟基中的氧原子与另一醇分子中羟基的氢原子间存在的相互吸引力。
甲醇、乙醇、丙醇均可与水以任意比例混溶,这是因为甲醇、乙醇、丙醇与水形成了如下所示的结构:(4)几种常见的醇:1.甲醇:甲醇俗称木精,能与水任意比互溶,有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
工业酒精里为了防止盗窃通常加入了甲醇。
2.乙二醇:乙二醇是一种无色、粘稠、有甜味的液体,主要用来生产聚酯纤维。
乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂。
3.丙三醇(甘油):丙三醇俗称甘油,是无色粘稠,有甜味的液体,吸湿性强,有护肤作用,是重要的化工原料。
四、乙醇的物理性质:1.乙醇的结构分子式:C2H6O 结构简式:CH3CH2OH2.乙醇的物理性质:无色、透明、有特殊香味的液体;沸点78℃;易挥发;密度比水小;能跟水以任意比互溶;能溶解多种无机物和有机物。
醇类

醇类一、醇的分类根据醇分子中羟基的数目:一元醇、二元醇、多元醇等。
根据醇分子中烃基是否饱和:根据醇分子中是否含有苯环:二、通式:饱和一元醇:C n H2n+1OH或C n H2n+2O饱和多元醇:C n H2n+2 –m(OH)m或C n H2n+2O m三、命名1.选主链。
选含—OH的最长碳链作主链。
2.编号。
从离—OH最近的一端开始编号。
3.定名称。
在取代基名称之后,主链名称之前用阿拉伯数字标出—OH的位次,且主链称某醇。
其他同烷烃的命名。
取代基位置—取代基名称—羟基位置—母体名称(羟基位置用阿拉伯数字表示;羟基的个数用“二”、“三”等表示。
)取代基的位置+取代基名称+羟基位置+某醇四、同分异构体书写思路是:先写碳链异构→再写(—OH)位置异构→最后写类别异构(醚类)五、醇的概念醇是分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物.这一概念,可从以下几个层面理解:(1)醇分子中含有羟基,且羟基个数不限,但不存在1个C原子上连有2个羟基的醇,因为这样的醇不稳定:(2)羟基连接在链烃基上的是醇,如CH3OH、等,但不存在羟基连在烯键(或炔键)C原子上的醇,因为这样的醇也不稳定.(3)羟基连在苯环上的不是醇,如,羟基连在苯环的侧链上的是醇,如(4)此外还有定义中不包括的一点,羟基连在环烷基(或环烯基)的C原子上的也是醇,如等.六、常见醇的种类和组成说明:所有烃的含氧衍生物都可用通式3表示.七、醇的溶解性醇分子中因为含有羟基而有极性,分子越大,羟基越少,极性越弱,在水中越难溶解;分子越小,羟基越多,极性越强,在水中越易溶解.所以:(1)C1~C3的饱和一元醇与水以任意比混溶;C4~C11的饱和一元醇部分溶于水;C12以上的饱和一元醇不溶于水.(2)乙二醇、丙三醇与水以任意比混溶.(3)易溶于水.八、甲醇、乙二醇和丙三醇九、醇的化学通性醇类的化学性质与乙醇相似:能发生氧化反应和取代反应.如丙三醇的硝化反应为:硝化甘油是一种烈性炸药.十、醇的氧化规律醇分子能否氧化,取决于醇的结构.如果醇分子中含有—CH2OH基团,则该醇可被氧化成醛:十一、有关生成醇的反应已经学过的生成醇的反应,有以下三种:此外,还有乙醛还原法、乙酸乙酯水解法、葡萄糖发酵法等都可生成乙醇,这些知识,将逐渐学到.3.例题精讲[例1]1998年山西朔州发生假酒案,假酒中严重超标的有毒成分主要是()解析:甲醇的气味与乙醇相似,但甲醇剧毒,在工业酒精中往往含有大量的甲醇,用工业酒精勾兑的酒中甲醇严重超标.一般说来,人饮用10 mL甲醇就能导致失明,再多则会死亡.答案:B[例2]把质量为m g的Cu丝灼烧变黑,立即放入下列物质中,使Cu丝变红,而且质量仍为m g的是()A.稀H2SO4 B.C2H5OHC.稀HNO3 D.CH3COOH(aq)E.CO解析:Cu丝灼烧变黑,发生如下反应若将CuO放入稀H2SO4、稀HNO3或CH3COOH(aq)中,CuO被溶解,生成Cu2+进入溶液;稀HNO3还能进一步将Cu氧化,故都能使Cu丝质量减轻.A、C、D不可选.若将热的CuO放入CO中,CO夺取CuO中的O原子将Cu还原出来.Cu丝质量不变,E可选.若将热的CuO放入酒精,发生氧化反应形成的Cu覆盖在Cu丝上,Cu丝质量仍为m g,B可选.答案:BE[例3]婴儿用的一次性纸尿片中,有一层能吸水保水的物质.下列高分子中有可能被采用的是()解析:一次性纸尿片能吸水保水的主要原因是水能溶解在材料当中(水少材料多时),反之材料能溶解在水中(材料少水多时).大多数有机物是难溶于水的,但多元醇却易溶于水,如丙三醇,(聚乙烯醇)是一种多元醇,且C与—OH之比仅2∶1,分子具有一定极性,易溶于水,因而可选.C、D都不溶于水,因而不可选.A分子具有更强的极性,A也易溶于水,但尿液呈碱性,且具有38℃左右的温度,在此条件下,A水解产生HF,HF剧毒,故A不能用.答案:B[例4],叫做异戊二烯.已知维生素A的结构简式可写为,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是()A.维生素A的分子式为C20H30OB.维生素A是一种易溶于水的醇C.维生素A分子中有异戊二烯的碳链结构D.1 mol维生素A在催化剂作用下最多可与7 mol H2发生加成反应解析(公式法):维生素A分子中的C、O原子个数分别为20和1,维生素A分子的不饱和度Ω=环数+双键数=6,所以其分子内的H原子数为2×20+2-2×6=30,维生素A 分子式为C20H30O.维生素A分子中仅有一个—OH,且C链较长,所以其分子极性较弱,故维生素A不溶于水.异戊二烯结构为,维生素A分子的侧链上有2个这样的结构.维生素A分子中只有5个烯键,1 mol维生素A最多可与5 mol H2加成.答案:AC[例5]由丁炔二醇制备1,3—丁二烯,请在下面这个流程图的空框中填入有机物的结构简式.解析(逆推法):由1,3—丁二烯逆推可知①、②分别为卤代烃和醇,由于①乃丁炔二醇加成的产物,而加成的结果,自然去不掉羟基,所以①为醇,②为卤代烃.①为能发生消去反应的醇,则羟基所在碳的邻碳上必然有氢,氢从何来?加成反应的结果.答案:①CH2(OH)CH2CH2CH2OH②CH2BrCH2CH2CH2Br[例6]图6-5是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并加入20 mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,由于浓H2SO4流入B中,则D中导管口有气泡产生.过几分钟后,无水硫酸铜粉末由无色变为蓝色.此时水浴加热后,发生化学反应,生成的气体从F处逸出,点燃气体,有绿色火焰.试回答:图6-5(1)B中逸出的气体主要成分是________________.(2)D瓶的作用是____________________________.(3)E管的作用是____________________________.(4)F管口点燃的气体是______________________.(5)A瓶中无水硫酸铜粉末变蓝的原因是_____________________________________.(6)由A中发生的反应事实,可推断出的结论是_________________________________.解析:由题意,将C中浓H2SO4滴入B中浓盐酸中,由于浓H2SO4有吸水性,且溶于水要放出大量的热,故B中逸出HCl(g),经D中浓H2SO4干燥,进入A中,HCl溶于C2H5OH 中,二者发生反应:C2H5OH+HCl C2H5Cl+H2OCuSO4吸收水分变为胆矾,促使上列反应向右进行.加热时,生成的C2H5Cl从F处逸出,点燃火焰呈绿色.答案:(1)氯化氢(2)干燥HCl(3)冷凝乙醇蒸气(4)CH3CH2Cl(5)乙醇与HCl反应生成的水被无水硫酸铜吸收后生成了胆矾(6)醇分子中的羟基可被氯化氢分子中的氯原子取代4.实战演练一、选择题(每小题5分,共45分)1.集邮爱好者在收藏有价值的邮票时,常将邮票从信封上剪下来浸在水中,以便去掉邮票背面的粘合剂。
高中化学-醇类

甲醇用做F1赛车的燃料
乙二醇
乙二醇是无色,具有甜味的黏稠液体,熔点为-16℃,沸点为 197℃,与水互溶能显著降低水的凝固点。它是目前市售汽车发 动机防冻液的主要化学成分,也是合成涤纶等高分子化合物的 主要原料。
乙二醇用于制造合成涤纶
丙三醇
丙三醇俗称甘油,是无色、无臭有甜味的黏稠液体,沸点为 290℃(分解)、能与水互溶,具有很强的吸水能力。丙三醇主要 用于制造日用化妆品和三硝酸甘油酯。三硝酸甘油酯俗称硝化甘 油,主要用做炸药,也是治疗心绞痛药物的主要化学成分之一。
八、白酒中的醇
白酒中的香味成分十分复杂, 其中主要包括酸、醇、酯、 醛等几大类物质,高级醇便 是白酒中的一类重要的香气 物质。
高级醇在白酒中不但呈香 (臭)、呈味,而且增加了 酒的甜感助香作用,同时它 又是酯形成的前体物质。
但是如果其含量超过一定的 限度,不但起不了呈香呈味 的作用,反而成为酒中异杂 味—苦味的主要来源。
沸点
78.4 °C 引燃温度 363℃ (351.6 K)
黏度
1.200 mPa·s (cP), 20.0 °C
饱和蒸汽 5.33(kPa) 临界压力 6.38(MPa) 爆炸极限% 3.3-19.0
压
(19℃)
(V/V)
二、乙醇制法
1. 发酵法
白酒酿造都使用发酵法制取乙醇。
淀粉 水解 葡萄糖
乙醇
醇);与二级碳原子相连接的称二级醇(仲醇);与三级碳 原子相连接的称三级醇(叔醇)。
R'
RCH2OH
伯醇
R CH R' OH
仲醇
R C R"
OH
叔醇
三、醇的命名
1、习惯命名法
醇类简介——精选推荐

醇的简介2009·6目录醇 (3)甲醇(附一) (8)乙醇(附二) (17)丁醇(附三) (24)木糖醇(附四) (33)甘露醇(附五) (42)附一、二、三、四、五为几种常见醇的简介及简要的工业市场分析参考。
醇一、醇的总述(一)自然分布自然界有许多种醇,在发酵液中有乙醇及其同系列的其他醇。
植物香精油中有多种萜醇和芳香醇,它们以游离状态或以酯、缩醛的形式存在。
还有许多醇以酯的形式存在于动植物油、脂、蜡中。
大体上,醇可分:一元饱和醇:CnH2n+1 OH和n元饱和醇:CmH2m+2-n(OH)n(m>=n),(二)三种分类①醇根据烃基的不同,可以分为芳香醇、脂环醇和脂肪醇,其中,脂肪醇又可分为饱和脂肪醇和不饱和脂肪醇②根据所含羟基的多少,可分为一元、二元、三元或多元醇。
③按羟基所连的碳进行分类⑴伯醇羟基所连的碳为伯碳⑵仲醇羟基所连的碳为仲碳⑶叔醇羟基所连的碳为叔碳(三)命名方法醇有三种命名方法:1、普通命名法将醇看作是由烃基和羟基两部分组成,羟基部分以醇字表示,烃基部分去掉基字,与醇字合在一起。
例如,正丁醇(一级醇)CH3CH2CH2CH2OH、异丁醇(一级醇)(CH3)2CHCH2OH、二级丁醇(二级醇)CH3CH2CH(OH)CH3、三级丁醇(三级醇)(CH3)3COH、新戊醇(一级醇)(CH3)3C-CH2OH。
2、以醇的来源或特征命名例如,木醇(即甲醇)由干馏木材得到,香茅醇由还原香茅醛得到,橙花醇存在于橙花油中,甘醇(即乙二醇)因具有醇和甘油的特征而得名。
3、习惯命名法把所有的醇都看作是甲醇的衍生物,命名为××甲醇。
如三甲基甲醇、三苯甲醇。
4、系统命名法即选择含羟基的最长碳链,按其所含碳原子数称为某醇,并从靠近羟基的一端依次编号,写全名时,将羟基所在碳原子的编号写在某醇前面,例如1-丁醇CH3CH2CH2CH2OH。
当分子中含多个羟基时,应选择含羟基最多的最长的碳链为主链,并从靠近羟基一端开始编号,当不可能将所有羟基都包含到同一主链内时,应将羟基作为取代基。
醇类的理化性质
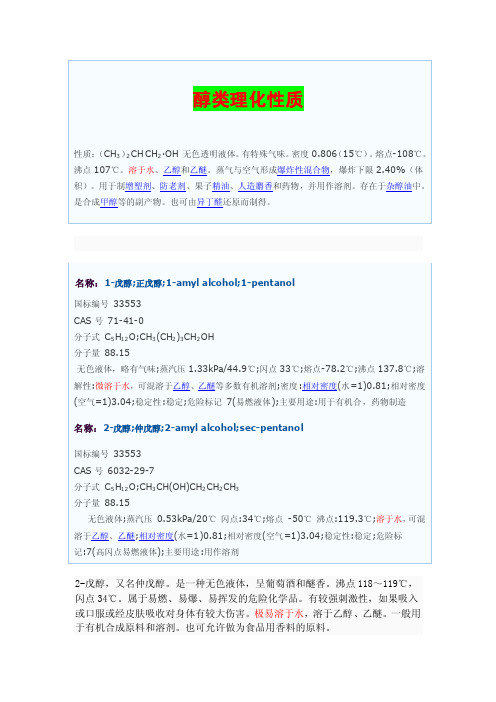
2-戊醇,又名仲戊醇。
是一种无色液体,呈葡萄酒和醚香。
沸点118~119℃,闪点34℃。
属于易燃、易爆、易挥发的危险化学品。
有较强刺激性,如果吸入或口服或经皮肤吸收对身体有较大伤害。
极易溶于水,溶于乙醇、乙醚。
一般用于有机合成原料和溶剂。
也可允许做为食品用香料的原料。
分子式:分子式:
HOCH
分子式:C3H8O3
分子质量:92.09
沸点:290℃
熔点:18-183℃
中文名称:甘油
无色透明粘稠液体。
味甜,具有吸湿性,可燃。
熔点17.8℃(18.17℃,20℃)。
沸点290℃(分解),263.0℃(53.2kPa),240.0℃(26.6kPa)167.2℃(1.33kPa)153.8℃(0.665kPa),125.5℃(0.133kPa),闪点(开杯)177℃,相对密度1.26362(20/20℃),自燃点392.8℃,折射率1.4746,粘度(20℃)1499mPa·s,蒸气压(100℃)26Pa,表面张力(20℃)63.4mN/m。
甘油能与水和乙醇混溶,水溶液为中性。
1份甘油能溶解在500份乙醚或11份乙酸乙酯
中。
不溶于苯、氯仿、四氯化碳、二硫化碳、石油醚、油类。
能从空气中吸收潮气,也能吸收硫化氢、氰化氢和二氧化硫。
无气味。
纯甘油外置于0℃的低温处,能形成熔点为17.8℃的有光泽斜方晶体,含少量水即妨碍结晶。
分子式:。
醇类

在液相中,溶 剂化作用会对 醇的酸性强弱 产生影响。
H HC
R
O HH
O HO H
H
OH
溶剂化作用使 负电荷分散, 而使RO-稳定。
1oROH负离子 空间位阻小, 溶剂化作用大。
CH3
CH3
C
CH3
O
H OH
3oROH负离子 空间位阻大, 溶剂化作用小。
2、羟基被卤原子取代 (1)醇和氢卤酸的反应
3-羟甲基-1,7-庚二醇
同一个碳原子上连有两个羟基的结构是不能稳 定存在的
OH CH3CH
- H2O
OH
O CH3C
H
在多元醇中,只有当碳原子数多于羟基数目时, 才需标出羟基所在的位置。
CH3CH CH2 OH OH
1,2-丙二醇
三、结构和物理性质
::
H
C O
H
H sp3
H
H
CO
H H
1090 H
构型翻转
1oROH、2oROH 都能与 磺酰氯反应。
(3)醇与卤化磷的反应 常用的卤化试剂
PCl5 、PCl3 、 PBr3 、 P + I2
PI3
3ROH + PBr3 → 3RBr + H3PO4 5ROH + PX5 → RX + HX + POX3
适用范围
主要应用于1oROH, 2oROH 转化为卤代烷。3oROH很少使用。
CH3 +OH2
CH3
+
H2O CH3 C CH CH3
CH3
重排
CH3
CH3
CH3
= CH2 C CH CH3 +
有机化学烃类醇类与酯类

有机化学烃类醇类与酯类有机化学是研究有机物的结构、性质、合成和反应的学科。
在有机化学中,烃类、醇类和酯类是三个重要的化合物类别。
本文将介绍它们的定义、结构特点、性质以及一些常见的应用。
一、烃类烃类是由碳和氢组成的有机化合物,分为两类:脂肪烃和芳香烃。
脂肪烃是由直链或支链烷基基团组成的化合物,而芳香烃则具有苯环结构。
脂肪烃的结构通常可以用分子式CnH2n+2表示,其中n为非负整数。
脂肪烃分为烷烃和烯烃两类。
烷烃由碳原子通过所有单键连接而成,是最简单的脂肪烃类。
烯烃则存在一个或多个碳-碳双键,分子式为CnH2n。
烯烃中的双键使其具有反应性,可以进行加成反应、氢化反应等。
芳香烃的特点是具有苯环结构,即由六个碳原子通过共用电子形成环状结构,每个碳原子还与一个氢原子相连。
芳香烃是许多天然物质的重要组成部分,也是合成有机化合物的重要原料。
二、醇类醇类是由氢、氧和一个或多个羟基(-OH)组成的有机化合物。
醇类分为一元醇和二元醇,根据羟基的位置还可以细分为顺式醇和反式醇。
一元醇的通式为R-OH,其中R表示烷基或芳香基团。
一元醇是最简单的醇类化合物,常见的有甲醇、乙醇等。
醇类的羟基使其具有一些特殊的性质,如溶解性、酸碱性等。
二元醇具有两个羟基,通式为R(OH)2。
二元醇在有机合成中有重要的应用,常见的有乙二醇、丙二醇等。
二元醇的两个羟基可以与其他化合物发生反应,形成酯、醚等。
三、酯类酯类是由酸和醇反应生成的有机化合物,结构通式为R-COO-R',其中R和R'分别为烷基、芳香基或氢原子。
酯类是一类具有香气的化合物,在食品、香水等方面有广泛应用。
酯的制备通常是通过酸酐法或醇酸反应进行。
酯类具有低毒性、较好的溶解性和挥发性等性质,使其在化学工业中具有广泛的用途,如溶剂、香料、塑料等。
总结有机化学烃类、醇类和酯类是有机化合物中重要的类别。
烃类分为脂肪烃和芳香烃,具有碳氢化合物的特点。
醇类是由羟基组成的有机化合物,根据羟基的数量和位置进行分类。
醇类

醇alcohol常用分类分子通式仅限一元饱和醇:CnH2n+1OHn元饱和醇:CmH2m+2-n(OH)n(m>=n)三种分类①醇根据烃基的不同,可以分为芳香醇、脂环醇和脂肪醇,其中,脂肪醇又可分为饱和脂肪醇和不饱和脂肪醇②根据所含羟基的多少,可分为一元、二元、三元或多元醇。
③按羟基所连的碳进行分类⑴伯醇羟基所连的碳为伯碳⑵仲醇羟基所连的碳为仲碳⑶叔醇羟基所连的碳为叔碳命名方法醇有三种命名方法普通命名法1.将醇看作是由烃基和羟基两部分组成,羟基部分以醇字表示,烃基部分去掉基字,与醇字合在一起。
例如,正丁醇(一级醇)CH3CH2CH2CH2OH、异丁醇(一级醇)(C H3)2CHCH2OH、二级丁醇(二级醇)CH3CH2CH(OH)CH3、三级丁醇(三级醇)(CH 3)3COH、新戊醇(一级醇)(CH3)3C-CH2OH。
2以醇的来源或特征命名例如,木醇(即甲醇)由干馏木材得到,香茅醇由还原香茅醛得到,橙花醇存在于橙花油中,甘醇(即乙二醇)因具有醇和甘油的特征而得名。
习惯命名法把所有的醇都看作是甲醇的衍生物,命名为××甲醇。
如三甲基甲醇、三苯甲醇。
系统命名法即选择含羟基的最长碳链,按其所含碳原子数称为某醇,并从靠近羟基的一端依次编号,写全名时,将羟基所在碳原子的编号写在某醇前面,例如1-丁醇CH3CH2CH 2CH2OH。
当分子中含多个羟基时,应选择含羟基最多的最长的碳链为主链,并从靠近羟基一端开始编号,当不可能将所有羟基都包含到同一主链内时,应将羟基作为取代基。
在支链的命名时,与主链相连的碳永远是1号碳。
侧链的位置编号和名称写在醇前面,例如2-甲基-1-丙醇。
含有羟基的多官能团化合物命名时,羟基可看作取代基而不以醇命名。
物理性质状态C1-C4是低级一元醇,是无色流动液体,比水轻,C1-C3能与水以任意比例混合。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体,可以部分溶于水。
醇类(Alcohols)

醇類(Alcohols)乙醇(酒精)為一種鎮靜-安眠藥,也就是它不是中樞神經興奮劑。
乙醇沒有多少醫療用途,但卻是廣被濫用的娛樂性藥物,可造成嚴重的醫療和社會經濟的問題。
其它具有毒理重要性的醇類為甲醇和乙二醇(ethylene glycol)。
Ⅰ﹑乙醇(ethanol)A﹑藥動學喝下酒精後,它很快且大部分被吸收,分佈到全身的組織。
乙醇透過二種酵素被代謝為醋酸;此兩種酵素為醇脫氫 (alcohol dehydrogenase)和醛脫氫 (aldehyde dehydrogenase)。
醇脫氫 先把乙醇氧化成乙醛,此反應需要NAD當輔 ;由於細胞內NAD的含量有限,因此代謝以零級反應進行,亦即每小時代謝7-10公克乙醇。
乙醛很快地被醛脫氫 代謝為醋酸。
乙醇的代謝主要在肝臟進行,有一部分在腸道進行。
在腸道的代謝,女性要比男性低。
除了上述的代謝系統外,有一部分乙醇可被微粒體乙醇氧化系統(microsomal ethanol-oxidizing system, MEOS)代謝;此系統在低濃度的乙醇(血濃度<100mg/dL)並不重要。
長期飲酒或應用誘導物質如巴比妥鹽類可增加MEOS的活性,此為酒精愈喝愈多(tolerance)的一部分理由。
醛脫氫 可被disulfiram以及一些其它的藥物如metronidazole(抗黴菌劑),口服抗糖尿病藥,以及一些頭孢菌素(cepharosporins,抗生素)抑制。
臨床上disulfiram作為戒酒的藥物,因為醛脫氫 被此藥抑制後,乙醛會在體內累積;而乙醛會令酗酒者嚐到噁心、嘔吐、頭痛、低血壓等副作用,使他們不敢再繼續喝酒。
B、急性作用1.中樞神經系統乙醇為中樞神經抑制劑,可產生鎮靜、中樞抑制作用消失、判斷受損、口齒不清楚,以及運動失調等作用。
血中乙醇濃度在50-80mg/dL已可損及駕駛的能力;而濃度在120-160mg/dL則可造成酩酊大醉的狀態;濃度高於300mg/dL可導致知覺喪失、麻醉、昏迷,甚至致命的呼吸和心血管抑制;濃度高於500 mg/dL通常是致命的。
化学教学:醇类、醚类与酚类

学习成果评量
1. 有关 C4H10O 的异构物之下列叙述,何者正确? (A)能被过锰酸钾的酸性溶液氧化成羧酸者共有 2 种 (B)能被二铬酸钾的酸性溶液氧化成醛者共有 3 种 (C)能被氧化剂氧化成酮者共有 4 种 (D)不能被氧化剂氧化者共有 3 种
2. 下列化合物中,沸点最高的是?
(A) C2H5Cl (C) CH3OCH3
可利用合成气来制造甲醇。 • 合成气为 CO 与 H2 的混合气体, • 水煤气为常见的合成气之一,
一氧化碳与氢气在高温、高压及催化剂作用下,可 反应产生甲醇。
7-6.2 醇类的反应与制备
甲醇及乙醇除了可与汽油混合作为汽车燃料, 亦有完全使用甲醇与乙醇的引擎。 甲醇与乙醇可转化为氢气,用于氢氧燃料电池, 液态甲醇与乙醇比压缩氢气更安全及储存更方便,
解答
①、③、④可能为溴化钠溶液、碘化钠溶液或 氯化钠溶液
③、④可能为溴化钠溶液或碘化钠溶液, ①则为氯化钠溶液
练习题 7-9
解答
④为碘化钠溶液, ③则为溴化钠溶液
⑤为乙炔的正己烷溶液, ②则为乙醇的正己烷溶液 ①、②、③、④、⑤ 均会被 KMnO4/OH- 氧化 故选(A)(E)
7-6.3
醚类
将水分子的两个氢原子以烃基取代则得醚,
异丙醇等二级醇氧化得酮:
三级醇无上述反应,不会被氧化。因此,可藉此辨 别三级醇。
7-6.2 醇类的反应与制备
工业上,可用烯类的水合反应、醣类的发酵或利 用合成气来制造醇类。
例如:
在酸的催化下,丙烯经水合反应可得 2-丙醇,
葡萄糖经过发酵亦可制得乙醇。
7-6.2 醇类的反应与制备
甲醇的制备:
7-6.1 醇类的结构、命名与分类 7-6.2 醇类的反应与制备 7-6.3 醚 类 7-6.4 酚 类
一、醇类

4-(正)丙基-5-己烯-1-醇
e. 芳醇的命名,可把芳基作为取代基:
1-苯乙醇 (-苯乙醇) 2-苯乙醇 (-苯乙醇)
2
1
CH2-CH2-OH
3-苯基-2-丙烯-1-醇 (肉桂醇)
f. 多元醇: 结构简单的常以俗名称呼,结构复杂的, 应尽可能选择包含多个羟基在内的碳链作为主链, 并把羟基的数目(以二、三、…表示)和位次(用 1,2,…表示)放在醇名之前表示出来. 例1:
五、醇的化学性质
•醇的性质主要是由它的官能团(-OH)决定的。 • 醇的化学反应中,根据键的断裂方式,主要有:
•氢氧键断裂和碳氧键断裂两种不同类型的反应。
1.羟基的酸性----------- 与活泼金属的反应
• 醇与水都含有羟基,都属于极性化合物,具有相
似的性质:如与活泼金属(Na,K,Mg,Al等)反应,放 出氢气:
醇钠
RCH2OH + Na (CH3)3COH + K
RCH2ONa + 1/2H2 (CH3)3COK + 1/2H2
醇钾
作碱性试剂 或亲核试剂 作消除反应试剂
2、氧化和脱氢
(1)伯醇、仲醇的氧化 •氧化剂:高锰酸钾、铬酸 • 伯醇氧化—醛—羧酸;仲醇氧化—酮。
例1:
例2:
(2)叔醇分子,只有在剧烈条件下发生氧化, 则碳链断裂,生成含碳原子较少的产物:
二、 醇的分类
一元醇:
伯醇:RCH2-OH 伯醇(第一醇)(1°醇) 仲醇:R2CH-OH 仲醇(第二)醇(2°醇)
叔醇:R3C-OH
叔醇(第三醇)(3°醇)
① 按-OH数 目分类:
二元醇: 多元醇:
CH2—CH2 OH OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市育英学校
北京市育英学校
醇分子间形成氢键示意图: 醇分子间形成氢键示意图:
R O H H O R H R O H O R H R O H O R
甲醇,乙醇, 甲醇,乙醇,丙醇可与水以任意比例互溶 P49学与问 你能得出什么结论? 学与问:你能得出什么结论 学与问 你能得出什么结论?
北京市育英学校
醇类的化学性质: 醇类的化学性质:
以苯甲醇、乙二醇为例, 以苯甲醇、乙二醇为例,书写其 化学反应方程式
1. 2CH3CH2OH + 2Na 2. 2CH3CH2OH + O2 3.CH3CH2OH
△
2CH3CH2ONa + H2↑ 2CH3CHO + 2H2O
催化剂
浓硫酸 170℃ ℃
CH2=CH2↑ + H2O
浓硫酸 140℃ ℃
4. C2H5 – OH + HO – C2H5
C2H5– O–C2H5 + H2O 5.CH3COOH + HOC2H5 6. CH3CH2OH + HBr 7. C2H5OH + 3O2
△
CH3COOC2H5+H2O CH3CH2Br + H2O 2CO2 + 3H2O
点燃
北京市育英学校
氧化反应: 氧化反应:有机物分子中失去氢原子或加 入氧原子的反应( 或加O) 入氧原子的反应(失H或加 ) 或加 还原反应:有机物分子中加入氢原子或失去 还原反应: 氧原子的反应( 或失O) 氧原子的反应(加H或失 ) 或失
工业上如何制取无水乙醇? 工业上如何制取无水乙醇?
选5P17
北京市育英学校
②
①
乙醇的结构式: 乙醇的结构式
④
H H H—C—C—O—H H H
化学性质 与活泼金属 与酸酯化反应 催化氧化 消去反应 分子间脱水 与氢溴酸取代反应
③
化学键断裂位置 ① ①③ ②④ ①② ②
写出以上反应的化学方程式
北京市育英学校
北京市育英学校
北京市育英学校
重要的醇: 重要的醇:
甲醇、乙醇、苯甲醇、乙二醇、 甲醇、乙醇、苯甲醇、乙二醇、丙三醇
书写以上物质的结构简式、 书写以上物质的结构简式、分子式
无色、粘稠有甜味的液体;易溶于水和乙醇, 无色、粘稠有甜味的液体;易溶于水和乙醇, 无色透明、有特殊香味的液体;密度比水小; 无色透明、有特殊香味的液体;密度比水小; 说说它们的物理性质和主要用途 。 是重要的化工原料。乙二醇作汽车防冻液, 是重要的化工原料。乙二醇作汽车防冻液,丙三醇 易挥发;与水可以任意比例互溶,是良好的溶剂。 易挥发;与水可以任意比例互溶,是良好的溶剂 配制化妆品。 配制化妆品。
B
)
(B)CrO3 ) (D)C2H5OH )
北京市育英学校
羟基( OH OH) 羟基(—OH)与烃基或苯环侧链 上的碳原子相连的化合物称为醇 上的碳原子相连的化合物称为醇。 羟基( OH 与苯环直接相连 OH) 直接相连的 羟基(—OH)与苯环直接相连的 化合物称为酚 化合物称为酚。
醇类可以怎样进行分类呢? 醇类可以怎样进行分类呢?
思考与交流:选5P49
对比表格中的能得出什么结论?
名称 甲醇 乙烷 乙醇 丙烷 丙醇 丁烷 结构简式 CH3OH C2H6 C2H5OH C3H8 C3H7OH C4H10 相对分子质量 32 30 46 44 60 58 沸点/℃ 沸点 ℃ 64.7 -88.6 78.5 -42.1 97.2 -0.5
北京市育英学校
反馈练习
1、酒精完全燃烧后,生成的产物可用一种物质完全 酒精完全燃烧后, 吸收,这种物质是: 吸收,这种物质是:
C
A: 浓硫酸 : C: 碱石灰 : B:浓NaOH溶液 : 溶液 D:无水氯化钙 :
北京市育英学校
2、能用来检验酒精中是否含有水的试剂是: 能用来检验酒精中是否含有水的试剂是:
B
A: CuSO4··5H2O : C:浓硫酸 : B: 无水硫酸铜 : D: 金属钠 :
3、在下列物质中加入溴水数滴,振荡,溴水不 在下列物质中加入溴水数滴,振荡, 褪色的是: 褪色的是:
B
A:NaOH溶液 : 溶液 C:SO2溶液 :
B:酒 精 : D:氢硫酸溶液 :
北京市育英学校
4.用硫酸酸化的CrO3遇酒精后,其颜色会从 用硫酸酸化的CrO 遇酒精后, 红色变为蓝绿色, 红色变为蓝绿色,用这个现象可以测得汽车司 机是否酒后驾车。反应的化学方程式如下: 机是否酒后驾车。反应的化学方程式如下: 2CrO3+3C2H5OH+3H2SO4 = Cr2(SO4)3+3CH3CHO+6H2O 此反应的氧化剂是 此反应的氧化剂是( 氧化剂 (A)H2SO4 ) (C)Cr2(SO4)3 )
