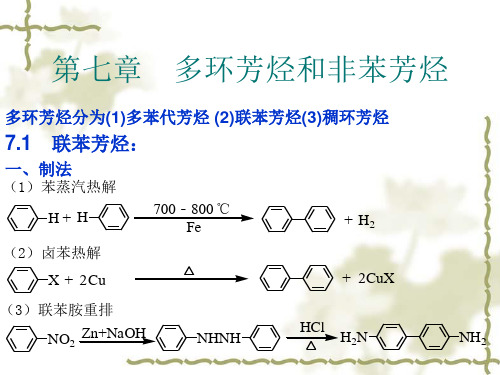
有机化学7
有机化学第七章(多)
4 3 2 1
1
α-甲基萘 β-甲基萘 1-甲基萘 2-甲基萘
SO3H
5 4 NO2
SO3H 2 3
4 3 2 1 OH
CH3 5
4-甲基-1-萘磺酸 5-硝基-2-萘磺酸
5-甲基-1质: (1)性状:无色片状晶体,mp:80.2℃,bp:218 ℃,有特殊气味。 性状: 有特殊气味。 性状 无色片状晶体, ℃ 有特殊气味 (2)易升华,蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 易升华, 易升华 蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 萘的化学性质与苯相似,但由于离域的不太好, 萘的化学性质与苯相似,但由于离域的不太好,π电子云不是均匀 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 而且也较易进行加成和氧化反应。 而且也较易进行加成和氧化反应。 1.亲电取代反应 亲电取代反应 萘环上的π电子云不是均匀分布,据测定,它的α 萘环上的π电子云不是均匀分布,据测定,它的α位上电子云密度 最高, 位次之, 位最低, 最高,β位次之,γ位最低,所以萘的亲电取代反应一般发生在 特殊情况下也能在β位反应。 α位。特殊情况下也能在β位反应。
CH3
(2)原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时 位取代。 -位取代。如: NO
2
NO2
萘亲电取代的定位规律
但是,萘的亲电取代反应有的不遵循定位规律, 但是,萘的亲电取代反应有的不遵循定位规律,如:
H2 SO4 H2O
9,10-蒽醌和它的衍生物是蒽醌类染料的主要原料。 -蒽醌和它的衍生物是蒽醌类染料的主要原料。
有机化学课件第07章碳氧双键化合物
二元羧酸的顺反异构体的熔点和溶解度与它们的结构有关。反式丁烯二酸的 对称性比顺式丁烯二酸好,极性较小,同时,顺式丁烯二酸能形成分子内氢键。 因此,反式丁烯二酸的熔点(287℃)比顺式(130℃)高,但顺式丁烯二酸的溶解度大。
乙酸
乙酰氯
乙酐
乙酰胺
乙腈 乙酸甲酯
O
O
O
O
CH3C O CCH 2CH3
COOCH 3
O
CH 3
CH 3C
N CH 3
O 马来酐
乙丙酐
环己(基)甲酸甲酯 N,N-二甲基乙酰胺
O
C N CH 3
C O
OC 2H5 H C OC2H5
OC 2H5
CO
O C
O
NH
N-甲基邻苯二甲酰亚胺
原甲酸三乙酯
己内酯
己内酰胺
随着碳氧双键化合物结构的变化(例如,形成共轭体系),反应性能发生变化!
14
7. 碳氧双键化合物
7.3 碳氧双键化合物的化学性质
7.3.1 羰基化合物的酸性
化合物的酸性,是指化合物分子中的氢原子以质子形式离去的能力。
RCOOH
RCOO + H
R'COCHR 2 7.3.1.1 羧酸的酸性
R'COC R 2 + H
碳原子的位置也可用希腊字母表示。
H
O
δ
β
O
γ
α
β
γ
α
β'
α'
γ'
4
7. 碳氧双键化合物
7.2 碳氧双键化合物的结构特征和物理性质
有机化学——第7章醇酚醚

25
6、氧化脱氢反应
在有机化合物的分子中加入氧或脱去氢的反应都叫做氧化反应。
1) 伯醇氧化生成醛,醛进一步氧化生成酸。
CH3 CH2 CH2OH
K2CrO7-H2SO4
CH3 CH2CHO
[O]
CH3 CH2 COOH
2) 仲醇氧化生成酮,酮不易被继续氧化 。
H3 C CH OH CH3 [O] CH3 C O CH3
烯丙位 苯甲位 一级醇
}
醛
弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂 CrO3+稀H2SO4
费慈纳-莫法特试剂
醛(产率不高, 不用。)
醛(产率很高)
稀酸,反应条件温和, 不饱和键不受影响。 酸性 (H3PO4) , 其它基团不受影响。 碱性,可逆,分子内 双键不受影响。 28
反应机理 1oROH (SN2)
SN2
SN2
BrCH2CH3 +
2oROH , 3oROH (SN1)
SN2
SN1
(CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
18
ROH + SOCl2
b.p. 79oC
RCl + SO2 + HCl
该反应的特点是:反应条件温 和,反应速率快,产率高,没 有副产物。
13
2、与氢卤酸反应
发生亲核取代反应,生成卤代烃和水,是制取卤代烃的重要方法。
R OH + HX
R X + H2O
氢卤酸的活性次序:HI > HBr > HCl; 醇的活性次序:烯丙式醇,苄基醇 > 3º 醇 > 2º 醇 > 1º 醇。 烯丙醇、叔醇、大多数仲醇及空间位阻大的伯醇,反应是按SN1
有机化学第七章 芳烃

H
H
H
H
H
H
可以解释:为什么苯分子特别稳定? 为什么苯分子中碳碳键长完全等同? 为什么邻位二取代物只有一种?
(b)分子轨道理论 分子轨道理论认为:苯分子形成σ键后,苯的
六个碳原子上的六个P 轨道经线性组合可以形成六 个分子轨道,其中ψ1 、ψ2 和ψ3 是成键轨道,ψ4、 ψ5和 ψ6是反键轨道。当苯分子处于基态时六个电 子填满三个成键轨道,反键轨道则是空的。
-络合物
(b)硝化反应
2 H2SO4 HNO3
NO2
HNO3 H2SO4,45℃
CH3
HNO3 H2SO4,30℃
NO2
CH3 NO2
CH3
NO2
HNO3 H2SO4,95℃
NO2
NO2
NO2
H3O 2 HSO4
反应比苯容易 反应比苯困难
硝化反应机理
硝化反应中进攻试剂是NO2+,浓硫酸的作 用促进NO2+的生成:
苯环的特殊稳定性可以从它具有较低的氢化热 得到证明:
环己三烯氢化热=360kj/mol(假想值) 苯环氢化热=208kj/mol 相差152kj/mol
氢化热简图:
环己三烯+3H2
环己二烯+2H2
苯+3H2
环己烯+H2
231kj/mol
120kj/mol
208kj/mol
360kj/mol
环己烷
苯分子的近代概念
ቤተ መጻሕፍቲ ባይዱ
(1)煤的干馏
煤隔绝空气加热至1000~1300℃时分解所得到的 液态产物——煤焦油,其中含有大量芳烃化合物。 再经分馏得到各类芳烃。
馏分名称 轻油 酚油 萘油 洗油 蒽油
大学有机化学第七章 醇、硫醇、酚

C+稳定 脱水成烯越容易, 所以叔醇>仲醇>伯醇。
CH3 b a 提问: CH3-C-CH2CH3 b OH -H2O
*问 140 ℃ H3C C=C H3C
CH3 H
H+ CH3 C
CH3 H CH3 C H CH3 2,3-二甲基-1-丁醇
HOCH2CH2-SH
CH3CH2CH-CH2-CH3 SH
2-巯基乙醇
3-戊硫醇
二、物理性质(略)
三、硫醇的化学性质
1、弱酸性 R—SH + NaOH——>RS-Na+ + H2O 提问: R—OH + NaOH——> X
2、重金属盐的生成
重金属离子:As++、Hg++、Pb++、Cu++、Ag+
3、醛酮与Grignard试剂的加成
+ + H – C = O + R–MgX H2.5 3.5 H 无水乙醚 R-C-OMgX H + MgX2
1° 无水乙醚 CH3-CH-OMgX CH3CHO + CH3CH2MgX CH2CH3 CH3-CH-OH CH2CH3 2° + MgX2
H R-C-OMgX H
与金属钠反应: 伯醇 > 仲醇 > 叔醇
(二)羟基被卤素取代(补充)
R-OH + HX R-X + H2O
反应速度快慢与两种因素有关:
1、与氢卤酸有关: HI > HBr > HCl 2、与醇的类别有关: 如: CH CH3 3 ZnCl2-浓HCl CH3-C-OH CH3-C-Cl + 立即混浊 CH3 CH3
《有机化学》第7章 芳香烃

所以如果希望获得所需的产物,使用正确的反应步骤是重要的。
2023/6/13
18
第三节 稠环芳烃
一、 萘
萘,分子式C10H8,光亮的片状结构,熔点80.2 ℃,沸点218 ℃,有特殊气味,易 升华,不溶于水,易溶于乙醇、乙醚、苯等有机溶剂。其化学性质与苯相似。
2023/6/13
11
⑷ 傅-克(Friedel-Crafts)反应 ① 烷基化反应 凡在有机化合物分子中引入烷基的反应,称为烷基化反应。反
应中提供烷基的试剂叫烷基化剂,它可以是卤代烷、烯烃和醇。
当烷基化剂含有三个或三个以上直链碳原子时,产物发生碳链异构。
② 酰基化反应 凡在有机化合物分子中引入酰基(
①若原有两个取代基不是同一类的,则第三个取代基进入的位置一般受邻、对 位定位基的支配,因为邻、对位基反应的速率大于间位基。
②若原有两个取代基是同一类的,则第三个取代基进入的位置主要受强的定位基 的支配。
2023/6/13
17
⑵ 选择适当的合成路线
例如:由甲苯制备对硝基苯甲酸。
比较这两个结构,反应步骤必须是先硝化,后侧链氧化。
1.取代反应
在萘环上,p电子的离域并不像苯环那样完全平均化,而是在α-碳原子上的电子 云密度较高,β-碳原子上次之,中间共用的两个碳原子上更小,因此亲电取代反应 一般发生在α位。
⑴ 卤化反应
在Fe或FeCl3存在下,将Cl2 通入萘的苯溶液中,主要得到α-氯萘。α-氯萘为无 色液体,沸点259 ℃,可做高沸点溶剂和增塑剂。
2023/6/13
6
苯分子去掉一个氢原子后的基团(C6H5―)叫做苯基,也可以用Ph―代 表。芳烃分子的芳环上去掉一个氢原子后的基团叫做芳基,可用Ar―代表。甲 苯分子中苯环上去掉一个氢原子后所得的基团CH3C6H5―称甲苯基;如果甲苯 的甲基上去掉一个氢原子,C6H5CH2―称苯甲基,又称苄基。
有机化学第七章 芳烃

1
一、教学目的和要求 通过对本章的学习,掌握芳烃的定义、分类、苯的结构、 闭合共轭体系、芳香性及苯的同系物的命名,掌握苯环上 的亲电取代反应及定位规则,侧链卤代和氧化反应,掌握 萘的结构及命名,萘的亲电取代反应、氧化反应;熟悉休 克尔规则及非苯芳烃的芳香性判断;了解联苯、蒽、菲的 结构及命名以及苯及其同系物的主要物理性质(易燃性)。 二、教学重点内容 芳烃的结构、闭合共轭体系、命名、亲电取代反应及其定 位规律、侧链氧化、萘的结构、命名及亲电取代反应、非 苯芳烃芳香性的判断是本章的重点。
CH3 CH3 CH3
(1)单环芳烃
苯 甲苯 间二甲苯
(2)多环芳烃
连 苯 三
C H 苯 甲
烷
(3)稠环芳烃
萘 蒽 菲
4
5.1
芳烃的构造异构和命名
5.1.1 构造异构
苯及其同系物的通式为:CnH2n-6。 例如苯有六个碳和六个氢,其六个碳和六个氢是等同的; 结构异构: 一元取代:只有一种
CH3 CH CH2 H3C CH CH3
(a)
(b) (c) (d) (e)
卤化
硝化 磺化 Friedel-Crafts反应 氯甲基化
17
(1)亲电取代反应
(a) 卤化
苯环上和卤代反应较困难,常用FeX3(Lewis酸)作催化剂。
+ Cl2
FeCl3,25oC 90%
Cl + HCl
控制苯过量,不要太激烈,避免二卤代。 因是亲电反应,所以苯的同系物(甲苯)比苯更易反应。 Cl 卤代活性: F2>Cl2>Br2>ICH CH3 CH3 CH3 2。 3
14
5.3
单环芳烃的物理性质
大学有机化学 第7章 旋光异构(IV)

尽管手性碳和分子手性没有
必然的关系,但它们有密切的联
系。在大多数情况下,手性分子 中往往存在手性碳原子,而且含
有手性碳的分子肯定有旋光异构
体。
旋光异构
一、物质的旋光性 二、物质的旋光性与分子结构的关系 三、含一个手性碳原子化合物的旋光异构
四、含两个手性碳原子化合物的旋光异构
五、不含手性碳原子化合物的旋光异构 六、环状化合物的立体异构 七、反应中的立体化学
1. 对称面
假设分子中有一平面能把分子切成相
互对称的两半,该平面就是分子的对称面。
具有对称面的分子与其镜像能够重合, 因而无手性,无旋光性,也无旋光异构体 (含手性碳的例外)。
分子的对称面 具有对称面的分子为非手性分子
2. 对称中心:
若分子中有一点 P,通过 P 点画任何直
线,如果在此直线上的P 点两侧,距离 P 点
47
CHO OH H CH2OH
D-(+)-甘油醛 COOH OH H CH3 D-(-)-乳酸
CHO H HO CH2OH L-(-)-甘油醛 COOH H HO CH3 L-(+)-乳酸
规则:在用 DL 表示的 Fischer 投影式中, C* 上羟基像甘 油醛那样处于右侧为D-构型;处于左侧为L-构型。
方法是将这个分子本身以及它的镜像都作成模型,
再来比较实物和镜像是否能完全重合。若不能完
全重合,则该分子有手性,存在对映异构体。 但往往比较麻烦。
物质分子是否有手性(即能否与其 镜象完全重叠),可从分子中有无对称 因素(symmetry of elements)来判断,最常见 的分子对称因素有对称面和对称中心。
三、含一个手性碳化合物的旋光异构
(一)对映体和外消旋体 (二)旋光异构体构型的表示方法 (三)构型的标记和命名 1. D/L相对构型标示法 2. R/S 绝对构型标示法:
有机化学第七章 立体化学

COOH
HO H 意两个对调,构型改变:
H
HOOC OH
CH3
(S)
H COOH 构型改变
COOH
H OH CH3
(R)
CH3 COOH 构型改变
CH3 H OH
COOH
(S)
(三)构型和命名法
(1)D/L构型标记法 (2)R/S构型标记法
CH3
C
CH3CH2
Br
H
CH3
C
Br
CH2CH3
H
实物
镜子
镜象
一般情况下,除旋光方向外,一对对映体的理化性质 基本相同。
在手性环境中,一对对映体表现出不同的性质。
手性环境——偏振光、手性溶剂、手性试剂等。
(2)构型表示方法
透视式:直观,但书写麻烦,不适用于复杂化合物 两种方法
Fischer投影式:使用方便,适用于简单和复杂化合物
例如,在温度为20°C时,用钠光灯为光源测得的 葡萄糖水溶液的比旋光度为右旋52.2°,应记为:
[α]D20= + 52.2°(水)
“D”代表钠光波长。钠光波长589 nm相当于太阳 光谱中的D线。
比旋光度是旋光性物质的一个物理常数。
(3)手性的概念
手——左、右手互为实物与镜像的关系,不能完全重合。 手性——像左右手一样,实物与其镜象不能叠合的性质。
COOH
COOH
H OH
HO H
CH3 R-乳酸
CH3 S-乳酸
OH>COOH>CH 3
CHO
CHO
HO H
H OH
CH2OH S-甘油醛
CH2OH R-甘油醛
OH>CHO>CH 2OH
有机化学_第7章_自由基反应

2015-6-1
9
2015-6-1
10
CH2 > CH2
苯甲基自由基
CHCH2 > (CH3)3C > (CH3)2CH
三级丁基自由基 异丙基自由基
烯丙基自由基
> CH3CH2 > CH3
乙基自由基
2015-6-1
>
苯基自由基
11
甲基自由基
Question: List in order of decreasing stability all of radicals that can be obtained by abstraction of a hydrogen atom from 2-methylbutane.
2015-6-1
29
Chain Initiation
R O O R 2R O
△
2R O R OH Br
CH3CHCH2 Br CH3CHCH2 ① ②
HBr
Br Chain Propagation:
CH2=CH CH3
Br CH3CHCH2 Br HBr CH3CH2CH2Br Br
Chain Termination:
2015-6-1
20
5.4.2 甲烷的卤化
X
+ CH3-H 439.3
CH3 + H-X H /(kJmol-1) 568.2 -128.9
Ea/(kJmol-1)
F
+4.2
Cl
Br I
431.8
366.1 298.3
+7.5
+73.2 +141
+16.7
+75.3 > +141
有机化学第7章 芳烃及非苯芳烃
SO 3H
CH 3 X
Friedel-Crafts反应
F-C酰化反应
• 芳烃在无水AlCl3催化下与酰卤(RCOX)或酸酐作用, 生成芳酮的反应,叫酰基化反应.
例:
傅-克酰基化反应机理:
(1)进攻的亲电试剂是:酰基正离子
+
RCOCl + AlCl3
R-C=O + AlCl4
(2) 反应历程:
+ + R-C=O
傅-克酰基化反应的应用
① 制备芳香酮
O
+ R C Cl
AlCl3
O CR
② 制备直链烷烃
F-C烷基化反应
R +RCl AlCl3
傅-克烷基化反应的特点 特点一:烷基化反应易发生重排,不适合制备长的直链烷基苯。
+ CH3CH2CH2Cl AlCl3
CH 2CH 2CH 3 +
30%
+ (CH3)CHCH2Cl AlCl3
H
HC
C
H
C
C
HC
C
X
HC
C
H
C
H
H
• 上面两式是等同的
Br
Br
C
苯的邻位二元取代物 H C
C
Br
HC
C
H
C
H
C
H
C
C
Br
HC
C
H
C
H
• 实际上是一种
• 凯库勒假定:苯的双键是不固定的,而是不停地来
回移动,所以下列两种结构式迅速互变,不能分离.
H
C
HC
C
H
HC
C
(有机化学课件)第七章 卤代烃

(3) 隔离型卤代烃
卤原子与碳碳重键或苯环相 隔两个或多个饱和碳原子,与 一般卤代烷性质接近。
7.2 卤代烃的命名
普通命名法
简单卤代烃的命名,一般是由烃基的名称加上卤原子的名称而成。
反应
Cl CH2 CH2 OH
Ca(OH)2
CH2 CH2 O
机理
Cl CH2 CH2 OH
HO– – H2O
Cl CH2 CH2 O-
分子内类SN2
CH2 CH2 O
邻基参与 例2
H2O
CH3CH2 S CH2CH2Cl k
CH3CH2 S CH2CH2OH
H2O
CH3CH2 CH2 CH2CH2Cl
亲核试剂的进攻与离去基团的离去同时发生; Nu从L的背后沿着C-L键轴线进攻中心C原子; 中心C原子为手性时,发生Walden 转化,即构型反转。
SN2反应的立体化学特征
SN2反应的立体化学特征为中心C原子的构型反转。
(S)–2–碘辛烷
(R)–2–碘(128I)辛烷
7.6.2 单分子亲核取代反应(SN1)机理
亲核取代反应 (II)
(3) 与氰化钠作用
(4) 与氨作用
C2H5OH (CH3)2CHCH2Cl + 2 NH3
110 oC, 3 h, 84%
(5) 卤离子的交换反应
(CH3)2CHCH2NH2 + NH4Cl 异丁胺
CH3CH CH3 + NaI Br
丙酮 室温
CH3CH CH3 + NaBr I 63%
有机化学第7章,ppt

苯分子环状结构及π电子云分布图
共振论认为苯的结构是两个或多个经典结构 的共振杂化体:
共振能=极限结构的能量-杂化体的能量
苯的氢化热比假想的 1,3,5-环己三烯的低 150 kJ· -1,称作共振能或离域能,体现了苯的稳定性。 mol
7.2.3 分子轨道理论对苯结构的处理
苯的分子轨道模型
反键轨道
sp 2 杂 化
H E +E
+
sp 3 杂 化
E
π络合物
+
+
+ -H
E
+H
取代苯
+
亲电试剂
σ络合物
讨论:1.当过渡态
+H
E
+
比
H E+
+
稳定时,中间体 σ
H E+
络合物较难形成,一旦形成后很快转化成产物。
+H
2.当过渡态 + 比 + 能量相近时, σ 络合物能逆转回反应物,即反应可逆。
K
2K, T HF
K
=
=
2K+
0.1462nm
成环 C 不在同一平面 π 电子 = 8 不能形成环状共轭体系
无 芳 性
成环 C 在同一平面 π 电子 = 10 n = 2 环状闭合共轭体系
有芳 性
薁
7 6 5 4 3 8 1 2
天蓝色片状固体,熔点90° 含10个π 电子,成环C都在同一平面 是闭环共轭体系,有芳性
的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
沸点
b.p:与偶极矩有关: o- > m- , p蒸馏法分离出邻位异构体
有机化学-第七章

7.2 苯环上的亲电取代反应
苯与亲电试剂E+作用时,亲电试剂先与离域的π电子结合, 生成π络合物。 亲电试剂从苯环的π体系中得到两个π电子,与苯环上一 个碳原子形成σ键。这个碳原子由sp2杂化变成sp3杂化状 态,苯环中的闭合共轭体系被破坏,变成四个π电子离域 在五个碳原子上。 σ络合物的能量比苯高,不稳定。它很容易从sp3杂化碳 原子上失去一个质子,使该碳原子恢复成sp2杂化状态, 再形成六个π电子离域的闭合共轭体系——苯环。
练习
1. 排列下列化合物的亲电取代活性顺序
(1)
7.2 苯环上的亲电取代反应
(2)
7.2 苯环上的亲电取代反应
2. 利用什么二取代苯, 经亲电取代反应制备下列化 合物:
7.3
单环芳烃的加成及氧化反应
7.3 单环芳烃的加成及氧化反应
一、加成反应
1.加氢反应
苯在液相中用碱金属和乙醇还原,通常生成 1,4-环己二烯,这个反应称为伯奇(Birth) 反应:
7.1 芳香烃的分类及结构
练习
利用休克规则判断下列化合物是否有芳香性?
无
有
有
无
无
7.2
苯环上的亲电取代反应
本章重点
7.2 苯环上的亲电取代反应
一、苯环上亲电取代反应机理
苯环上没有典型的 C=C 双键性质,但环上电子 云密度高,而易被亲电试剂进攻,引起 C—H 键 的氢被取代,这种由亲电试剂的进攻而引起的取 代反应,称为亲电取代反应。 从苯的结构可知,苯环碳原子所在平面上下电子 密度高,有利于亲电试剂的进攻。
苯分子环状结构
7.1 芳香烃的分类及结构
价键理论对苯结构的处理
(2012)有机化学 第七章 醇、酚、醚

酚羟基是一个强的邻、对位定位基,活化了苯 环,使其易于发生亲电取代反应。比较苯、苯 酚分别与溴水、硝酸反应的条件及其产物。有 关反应式:
1.卤代:
2.硝化: 3.磺化:
(三)与FeCl3的显色反应
凡具有酚羟基结构和烯醇式(—C=C—OH)结构 的化合物都能与与FeCl3的显色反应。
OH 、 OH
CH OH
CH OH
C H 2OH
2 H IO 4
C
O
O
C OH
H
O
C H
H
H
四、硫醇
硫醇(thio-alcohol) 的官能团是巯基 (-SH)。硫醇可看作醇分子中的氧原 子被硫原子取代的产物。
(一)硫醇的命名
按相应的醇命名,在醇字前加“硫”字。
C H 3C H 2S H
C H 2S H
乙硫醇
第七章
醇、酚、醚
(alcohols、phenols、ethers)
醇:脂肪烃基或芳香烃的侧链与羟基 相连形成的化合物。 酚:羟基与芳香烃的苯环直接相连形 成的化合物。 醚:醇或酚中羟基上的氢被烃基(脂 肪烃基或芳香烃基)取代后形成的产 物。
R OH
Ar OH
R
O R'
醇
酚
醚
C HO H OH HO H H OH H OH C H2O H
2. 氧化反应
硫醇的氧化表现在巯基上,实质是脱氢反应。
-2 2
[H ] R S S R
R SH
+ 2 [H ]
二、结构
δ O δ
-
OH δ
-
有机化学 (7)

有机化学1. 以下关于有机化合物的特性的描述不正确的是() [单选题] *A、容易燃烧B、熔、沸点较低C、反应比较快(正确答案)D、结构复杂,种类繁多2. 7、下列环烷烃中开环加氢最容易的是() [单选题] *A、环丙烷(正确答案)B、环丁烷C、环戊烷D、环己烷3. 8、下列化合物中含有季碳原子的是() [单选题] *A、CH3CH(CH3)2B、CH3(CH2)2CH3C、C(CH3)4(正确答案)D、CH3CH34. 9、石油醚是实验室中常用的有机溶剂,它的成分是() [单选题] *A、一定沸程的烷烃混合物(正确答案)B、一定沸程的芳香烃混合物C、醚类混合物D、烷烃和醚的混合物5. 10、正丁烷与异丁烷互为同分异构体,其异构现象属于() [单选题] *A、碳链异构(正确答案)B、位置异构C、顺反异构D、旋光异构6. 11、下列化合物中没有顺反异构的是() [单选题] *A、1,3-戊二烯B、4-甲基-3-庚烯C、2-甲基-2-丁烯(正确答案)D、2,3-二氯-2-丁烯7. 12、下列化合物能与银氨溶液反应,产生白色沉淀的是() [单选题] *A、1-丁炔(正确答案)B、1,3-丁二烯C、乙烯D、2-丁炔8. 13、下列化合物不能使高锰酸钾溶液的紫红色褪色的是() [单选题] *A、4-甲基-2-戊炔B、3-甲基-2-己烷(正确答案)C、环己烯D、甲基环己烯9. 14、下列基团能活化苯环的是() [单选题] *A、-ClB、-SO3HC、-OH(正确答案)D、-COOH10. 15、下列基团属于间位定位基的是() [单选题] *A、-NH2B、-NO2 (正确答案)C、-ClD、-OH11. 16、卤代烃与氨反应的产物是() [单选题] *A、腈B、胺(正确答案)C、醇D、醚12. 17、丙三醇俗称() [单选题] *A、甘油(正确答案)B、木醇C、木精D、酒精13. 18、下列物质属于叔醇的是() [单选题] *A、1-丙醇B、2-丙醇C、2-甲基丙醇D、2-甲基-2-丙醇(正确答案)14. 19、羟基直接与芳环相连的化合物属于() [单选题] *A、醇B、酚(正确答案)C、醚D、醛15. 20、误食工业酒精会严重危及人的健康甚至生命,这是因为其中含有() [单选题] *A、甲醇(正确答案)B、乙醇C、丙三醇D、丙醇16. 21、在乙醇钠的水溶液中加入1滴酚酞后,溶液将显() [单选题] *A、无色B、红色(正确答案)C、蓝色D、黄色17. 22、鉴别1-丁炔和2-丁炔,可用() [单选题] *A、氯化亚铜的氨溶液(正确答案)B、高锰酸钾溶液C、溴水D、三氯化铁溶液18. 23、2-丁醇发生分子内脱水反应时,其主要产物是() [单选题] *A、1-丁烯B、2-丁烯(正确答案)C、1-丁炔D、2-丁炔19. 24、下列化合物属于一卤代烃的是() [单选题] *A、2-氯甲苯(正确答案)B、1,2-二氯苯C、三氯甲烷D、2,4-二氯甲苯20. 25、常用于表示格氏试剂的通式是() [单选题] *A.RMgRB.RMgx(正确答案)C.RXD.MgX221. 26、以下关于有机化合物的特性的描述不正确的是() [单选题] *A、容易燃烧B、熔、沸点较高(正确答案)C、一般是非电解质D、结构复杂,种类繁多22. 27、C三C 是以下哪一类有机物的官能团() [单选题] *A、烷烃B、烯烃(正确答案)C、炔烃D、芳香烃23. 28、以下有机物的结构简式错误的是() [单选题] *A..CH3(CH2)2CH3B..(CH3)CHCH3C..CH3CH=CHCH2CH3(正确答案)D.CH3CHOHCH2CH324. 29、下列有机物中不含π键的是() [单选题] *A..CH3CH3(正确答案)B..CH2=CH2C..CH三CHD..CH3COOH25. 30、以下不是正己烷(CH3(CH2)4CH3) 的同分异构体的是() [单选题] *A..C(CH3)4(正确答案)B..CH3(CH2)2CH(CH3)2C..CH3CH2CH(CH3)CH2CH3D..CH3CH2C(CH3)326. 31、烯烃的通式是() [单选题] *H2n-2(n≥2)H2n(n≥2)(正确答案)H2n+2(n≥1)H2n-6(n≥6)27. 32、下列环烷烃中开环加氢最容易的是() [单选题] *A、环丙烷(正确答案)B、环丁烷C、环戊烷D、环己烷28. 33、下列化合物中含有叔碳原子的是() [单选题] *A、CH3CH(CH3)2 (正确答案)B、CH3(CH2)2CH3C、C(CH3)4D、CH3CH329. 34、石油醚是实验室中常用的有机溶剂,它的成分是() [单选题] *A、一定沸程的烷烃混合物(正确答案)B、一定沸程的芳香烃混合物C、醚类混合物D、烷烃和醚的混合物30. 35、1-丁烯与2-丁烯互为同分异构体,其异构现象属于() [单选题] *A、碳链异构B、位置异构(正确答案)C、顺反异构D、旋光异构31. 36、某烯烃用酸性高锰酸钾氧化后得到CH3CH2COOH .CO2 和H2O ,则该烯烃是() [单选题] *A、CH3CH2CH=CH2B、(CH3)2CH=CH2C、CH3CH2C三CHD、CH3CH=CHCH3(正确答案)32. 37、下列化合物不能使溴水褪色的是() [单选题] *A、丁烷(正确答案)B、1-丁烯C、1-丁炔D、2-丁烯33. 38、下列化合物中与溴反应最快的是() [单选题] *A、1-丁炔B、2-戊炔C、丙炔D、丙烯(正确答案)34. 39、下列基团属于吸电子基的是() [单选题] *A、-CH3B、-CH2CH3C、-OH (正确答案)D、-CH(CH3)235. 40、下列基团属于邻、对位定位基的是() [单选题] *A、-CNB、-CH2CH3 (正确答案)C、-SO3HD、-COOH36. 41、常用于表示格氏试剂的通式是() [单选题] *A、RMgRB、RMgX(正确答案)C、RXD、MgX237. 42、乙醇俗称() [单选题] *A、甘油B、木醇C、木精D、酒精(正确答案)38. 43、下列物质属于仲醇的是() [单选题] *A、1-丙醇B、2-丙醇(正确答案)C、2-甲基丙醇D、2-甲基-2-丙醇39. 44、误食工业酒精会严重危及人的健康甚至生命,这是因为其中含有() [单选题] *A、甲醇(正确答案)B、乙醇C、丙三醇D、丙醇40. 45、在强碱存在下,不能发生碘仿反应的物质是() [单选题] *A、C6H5CHO(正确答案)B、CH3COCH3C、CH3CHOD、CH3CH2OH41. 46、下列化合物属于一卤代烃的是() [单选题] *A、2-氯甲苯(正确答案)B、1,2-二氯苯C、三氯甲烷D、2,4-二氯甲苯42. 48、2-丁醇发生分子内脱水反应时,其主要产物是() [单选题] *A、1-丁烯B、2-丁烯(正确答案)C、1-丁炔D、2-丁炔43. 47、在乙醇钠的水溶液中加入1滴酚酞后,溶液将显() [单选题] *A、无色B、红色(正确答案)C、蓝色D、黄色44. 49、下列化合物中能与托伦试剂反应产生银镜的是() [单选题] *A、甲醇B、丙酮C、甲酸(正确答案)D、乙酸45. 50、鉴别1-丁炔和2-丁炔,可用() [单选题] *A、氯化亚铜的氨溶液(正确答案)B、高锰酸钾溶液C、溴水D、三氯化铁溶液46. 2、以下哪个是醇类的官能团() [单选题] *A、C=CB、-OH(正确答案)C、-COOHD、-CHO47. 3、以下有机物的结构简式错误的是() [单选题] *A、CH3(CH2)2CH3B、(CH3)3CCH3C、CH3CH=CHCH2CH3(正确答案)D、CH3CH2OHCH2CH348. 4、下列有机物中只含σ键的是() [单选题] *A、CH2=CH2B、CH三CHC、CH3CH2CH3(正确答案)D、CH3COOH49. 5、以下不是正己烷(CH3(CH2)4CH3) 的同分异构体的是 [单选题] *A、CH3(CH2)2CH(CH3)2B、C(CH3)4(正确答案)C、CH3CH2CH(CH3)CH2CH3D、CH3CH(CH3)CH(CH3)250. 6、烷烃的通式是() [单选题] *H2n-2(n≥2)H2n(n≥2)H2n+2(n≥1)(正确答案)H2n-6(n≥6)。
高等有机化学7

第七章芳香亲核取代反应12芳香亲核取代反应芳香亲核取代反应机理3芳香亲核取代反应(S N 2Ar)离去基团邻对位含有强吸电子取代基芳香化合物的亲核取代反应反应机理: (S N 2Ar)1)常见S N 2Ar 反应致活基团N 2+> +NR 3>NO>NO 2>CF 3>COR>CN>CO 2H>SO 3->Cl>Br>I>CO 2->Ph 2)常见的亲核试剂H -, HS -, RO -, -CN, -SCN, -OH, -CH 2R, -CHXR, NR 3, M-CH 2R 3)芳环上可被亲核试剂取代的基团F>NO 2>Cl, Br, I>-N 2+>OSO 2R>+NR 3>OAr>OR, SR, SAr>SO 2R>NR 24芳香亲核取代反应对位含有硝基芳环上的亲核取代反应反应机理: (S N 2Ar)芳环上可被亲核试剂取代的基团的活性F > Cl, Br, I由于亲核加成是速控步, L 的吸电子能力越强, 与其相连的碳原子电正性越大,对反应越有利.从反应机理看, 芳环的邻对位有吸电子取代基可以稳定中间体环己二烯负离子,对反应有利.5芳香亲核取代反应芳环上的亲核取代反应(S N 2Ar )L + Nu :-Nu + L :-Cl10% NaOH 360o C pressure H 2O +OHCl 135-160 o C H 2O +OHO 2N O 2N NaOH, H 2O Cl 100 o CH 2O +OH O 2N O 2N Na 2CO 3, H 2O NO 2NO 2Cl H 2O +OH O 2N O 2NH 2O NO 2NO 2NO 2NO 2RT硝基的影响吸电子的诱导效应吸电子的共轭效应S N 2Ar 反应硝基为邻对位致活基团6芳香亲核取代反应芳香硝基化合物的芳香亲核取代反应Cl 是好的离去基团, 不好的活化基团.硝基是好的离去基团, 也是好的活化基团Cl 位于2个硝基的邻对位, 易离去.NO 2NO 2OHNO 2NH 2NO 25% NaOHNH 3ClNO 2OMeNO 2NHNH 2NO 2H 2NNH 2NO 2NO 2NO 2MeONa MeOH7芳香亲核取代反应芳香硝基化合物的芳香亲核取代反应实例:NMe 2HNO 2NMe 2KOHONOH + Me 2NHONFO 2N OMe 93%O 2N MeONa MeOH 25o C O 2NOEt NO 2O 2N X +NO 2PhNH 2180o CO 2N NHPh + EtOH NO 2O 2NN NO 2HN + HXX= Cl, BrX= NO 2X= OC 6H 4OMe-489芳香亲核取代反应(S N 1Ar 机理)芳香重氮盐参与的芳香亲核取代反应(无铜催化无强碱)(S N 1Ar)重氮盐热不稳定,0 o C 分解较慢, 温度升高酸性增大均可以加速分解反应.同位素标记证明第一步反应可逆.X -的亲核性不能比:Nu -的强,才有利于形成Ar-Nu ;否则会有利于生成Ar-X.X -可以为HSO 4-,BF 4-,BCl 4-,BBr 4-,Cl -,Br -,I 3-等.10芳香亲核取代反应(S N 1Ar)芳香重氮盐参与的芳香亲核取代反应(无铜催化无强碱)(S N 1Ar)芳环上取代基对反应的影响: (主要看速控步)1)吸电子取代基不利于苯正离子稳定, 对反应不利; 2)给电子取代基有利于苯正离子稳定, 对反应有利;相对速度: p -NO 2< m -Cl < H < p -Mev 1/240 1/24 1 4.53) 邻对位有易形成共轭效应的给电子取代基时, 增加了C-N 键的双键性质, 不利于氮气离去, 因此对反应不利.N N Cl -+RH 2O, 29oCR+ N 2+ Cl -+11芳香亲核取代反应(S N 1Ar)芳香重氮盐的水解(S N 1Ar 机理)HSO 4-的亲核性比H 2O 弱, 只得到酚; 若用HCl, HNO 3代替H 2SO 4还会生成副产物PhCl, PhONO 2.12芳香亲核取代反应(S N 1Ar)Schiemann 反应(制备ArF)13芳香亲核取代反应(S N 1Ar)Schiemann-Olah 反应(制备ArCl, ArBr, ArI)Olah 将该反应推广到制备ArCl 和ArBr1415芳香亲核取代反应(苯炔中间体)苯炔与芳香亲核取代反应机理一.苯炔的结构sp 2-sp 2重叠很弱二.以苯炔为中间体的芳香亲核取代反应离去基团邻对位无强吸电子取代基,但邻位有氢芳香化合物在强碱条件下的亲核取代。
有机化学 (7)

13% 50%
8% 4%
79% 43%
35
(2)、催化剂
AlCl3 FeCl3 (3)、试剂
8% 13%
30% 2%
62% 85%
HNO3/H2SO4 HNO3/醋酐
31% 71%
2% 1%
67% 28%
36
(4)、空间效应
3 2 4 2 2
2
o-/pY=CH3CH3CH2(CH3)2CH(CH3)3C构体的量越多。
3 2 3 2 3 2 2
19
3
五、氯甲基化反应
苯、萘及其环上有R-、RO-等推电子基团的衍生物,可发生 此反应。 此反应
20
六、Cattermann-Koch 反应
3 3
七 Cattermann-Adams 七、 C tt Ad 反应
2 o
21
§8.2.2 苯环上的自由基取代反应
自由基是缺电子物种,具有亲电性。
反应条件 如亲电试剂 溶剂和温度等对第二取代基的进入 反应条件,如亲电试剂、溶剂和温度等对第二取代基的进入 位置也有影响。
57
2)、氧化反应
3
3
3
3
2 2 2 o 5
2
58
2 2 2 o 5
3)、还原反应
3 2
2 o
2 o
2
59
二、蒽和菲
α β β α γ α γ α β β
60
苯 共振能/KJ.mol-1 每个环的共振能/KJ.mol-1 芳香性/稳性 活性 152 152
37
58% 45% 30% 16%
5% 6% 8% 11%
37% 48% 62% 73%
1 57 1.57 0.97 0.48 0.22
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Carbocation stability favors SN2
Governed by steric factors
favors SN1 SN1 SN2 & SN1 SN2 SN2 Access to the site of reaction
E
[R]+ + X-
SN1:
3o
>
2o
>
1o
R-X + HOH ROH2+ + XROH + H3O+ + X5-13
CH2Cl2 methylene chloride or dichloromethane
5-1
5-2
Physical Properties of Methyl Halides
-
Reactions of Alkyl Halides: Nucleophilic Substitution
Our study of organic reactions will be organized around mechanistic similarities. This method of organization ___________ allows organic chemistry to be understood - not just memorized - based on unifying principles of reactivity. reactivity by _______ analogy to rationalize reason ___ It allows you to _______ reactions that you may never have previously seen. Nucleophiles attack electrophillic centers:
HB H-Br pKa = -9
5-6
Nucleophilic Substitution Mechanism (I): the SN2 Reaction
SN2 pathway ( Substitution, The ____ ubstitution Nucleophilic, ucleophilic Bimolecular)
5-3
nucleophile
(neutral or negatively ( g y charged) g )
electrophile
(neutral or positively charged)
l leaving i group
5-4
The Nucleophile Introduces a Wide Variety of New Functional Groups
+ -
C-X bond strength decreases with the i increasing i size i of f X and db bond dl length. th
Polar C C-X X bond
Boiling B ili points i t i increase with ith th the size i of fX and are higher than those of corresponding alkanes, due to increased strength of dipole-dipole and dispersion interactions.
5-7 5-8
Comparison of SN1 and SN2 Pathways
‡ ‡
Recognizing Leaving Groups (LGs)
Leaving group reactivity correlates to basicity. g ability. y The ______ the base, the ____fix as prefix
Simple compounds (common names):
X = F: methylfluoride or fluoromethane Cl: -chloride chloroBr: -bromide bromoI: -iodide iodoCHCl3 chloroform or trichloromethane CCl4 carbontetrachloride or tetrachloromethane
• Simutaneous bond making g and bond breaking • The TS≠ involves the association two molecules (bimolecular) of ___ • reaction rate =
k [substrate] [nucleophile] mol L-1 s-1
The Nucleophiles
Nucleophilicity depends on: basicity y, p polarizability y, and solvent p properties p . more basic, more nucleophilic higher polarizability, better nucleophile Basicity is the affinity of a base for a proton; N l Nucleophilicity hili it i is th the affinity ffi it of faL Lewis i b base f for a carbon b atom. t
transition state
Nucleophilic Substitution Mechanism (II): the SN1 Reaction
SN1 pathway ( Substitution, Nucleophilic, The ____ p Unimolecular )
RDS TS‡
Substrates in SN1 Reactions: Carbocation Stability
Governed by electronic factors
ROH + H3O+ + HX
Its stability influences the of RDS and the reaction rate. G‡
<
< y basicity
<
more basic and more polarizable
Polar protic
<
<
<
Increasing Nucleophilicity
<
(slower)
(very slow)
(does not occur)
Bulky substituents hinder the attack of the nucleophile
Incre easing ba asicity X–
Solvolysis: SN1 Reaction
R-X + HOH (solvent)
Hyperconjugation yp j g stablizes positive charge.
Reaction coordinate
5-14
Substrates in SN1 Reactions: Carbocation Stability
Why are these 1o carbocations as stable as 2o carbocations?
• Bond breaking precedes bond making
one • The TS≠ of the rate-determining rate determining step involves just ___ molecule (unimolecular); reaction rate = k [substrate] mol L-1 s-1
solvent Polar aprotic
Increasing Nucleophilicity
H2O < NH3 row 2 row 3 < < < basicity < <
Within a row, nucleophilicity increases from right to left basicity and parallels with _______
more basic b i and d more polarizable l i bl
< <
5-15
<
5-16
Generalizations about Nucleophilicity (II)
Increasing Nucleophilicity
Summary on Nucleophilicity of Nucleophiles
The Substrate: Steric Effects in SN2 Reactions
1
0.1
>
>
>>
~
>
0 03 0.03
Increasing reactivity
1.3 105
methyl > primary > secondary > tertiary
5-11
(fast)
Comparing p g nucleophiles p having g the same reactive atom, , the species p with the negative charge is the more powerful nucleophile than their conjugated acid.
