拉乌尔定律和亨利定律
亨利定律与拉乌尔定律的区别和联系

尊敬的读者:今天我想和你一起探讨一个有趣且深刻的主题——亨利定律与拉乌尔定律的区别和联系。
这个主题看似简单,但其中蕴含着深刻的内涵,需要我们从多个角度进行思考和剖析。
本文将深入探讨这两个定律,并从多个层面展开讨论,以便让读者更全面地理解这两个概念。
让我们以从简到繁的方式来探讨亨利定律与拉乌尔定律。
亨利定律,又称为90/10定律,指的是在某种现象中,前10%的个体通常会占据整体现象的90%的份额。
这个定律最初被意大利经济学家维尔弗雷多·帕累托(Vilfredo Pareto)提出,并被广泛应用于各个领域。
相比之下,拉乌尔定律则是认为在某个领域,相对强者的数量总是呈现一个拉乌尔分布,即比例越来越大的分布。
这两个定律在描述现象时有着不同的侧重点,亨利定律更注重于个体实力的不平等导致的整体不平等,而拉乌尔定律则更侧重于描述相对强者的数量分布规律。
在深入探讨亨利定律与拉乌尔定律的区别和联系之前,我们需要了解这两个定律的基本概念和应用范围。
亨利定律最初是在经济领域提出的,但后来被扩展到社会学、心理学、生物学等领域,被认为是一种普适的规律。
而拉乌尔定律则更多地应用于社会学、政治学等领域,并且在实际应用中往往伴随着政治、社会等因素的干扰和调整。
从应用范围上来看,亨利定律更具有普适性,而拉乌尔定律更多地受到具体领域和外部因素的影响。
我们还需要从实际应用的角度,分析亨利定律与拉乌尔定律在不同领域的应用情况。
在经济学领域,亨利定律被广泛应用于描述财富分配不均的现象,而拉乌尔定律则更多地被用来解释社会阶层的分布规律。
在实际社会中,这两个定律往往相互交织,相互影响,对于理解社会和经济现象具有重要意义。
在总结和回顾本文的内容时,我们可以看到亨利定律与拉乌尔定律在描述不平等现象时有着不同的侧重点,但在实际应用中又常常相互交织。
而对于我们个人来说,理解这两个定律不仅可以帮助我们更好地认识社会和经济现象,也可以帮助我们更好地规划个人的发展和生活。
2.4 拉乌尔定律、亨利定律
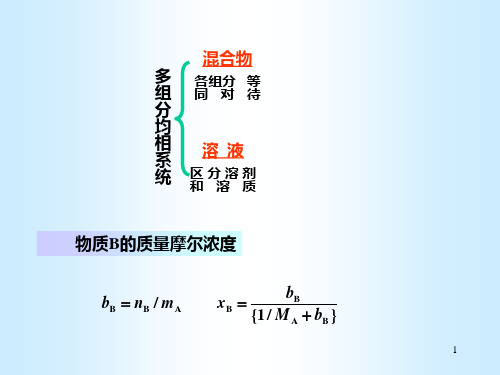
多 组
各组分 等 同对待
分
均
相 系
溶液
统
区分溶剂 和溶质
物质B的质量摩尔浓度
bB nB / mA
xB
{1 /
bB MA
bB }
1
§2-4 拉乌尔定律、亨利定律
1. 液态混合物和溶液的饱和蒸气 压
设由组分A, B, C……组成液态混 合物或溶液, T一定时, 达到气, 液两相 平衡.
此时, 气态混合物的总压力为p, 则 p 即为温度T下该液态混合物或溶液的 饱和蒸气压.
水(A)和乙酸乙酯(B)不完全混溶, 在37.55℃时两液相呈平衡.
一相中含质量分数为w(B) = 0.0675的酯, 另一相中含w(A) =
0.0379的水, 假定拉乌尔定律对每相中的溶剂都能适用, 已知
37.55℃时, 纯乙酸乙酯的蒸气压力是22.13kPa, 纯水的蒸气
压力是6.399kPa, 试计算:
ln p(s) 3133 27.650 11.99 p(s) 160.3k Pa Pa 200K / K
计算结果表明, 所给过程是恒温恒压不可逆相变化过程, 为
此可根据计算所得的液体及固体CO2在200 K的蒸气压数据, 设
计以下可逆过程进行计算:
8
s, 100kPa, 200K
s, 160.3kPa, 200K G2
(1)计算下述过程Gm :
CO2( s, 100kPa, 200K ) →CO2( l, 100kPa, 200K )
(2)判断在100 kPa下, CO2(l)能否稳定存在?
(1) 200 K时液体及固体CO2的饱和蒸气压:
ln p(l) 2013 22.405 12.34 p(l) 228.7kPa Pa 200K / K
拉乌尔定律和亨利定律的区别

拉乌尔定律和亨利定律的区别拉乌尔定律和亨利定律都是热力学中的重要定律,它们分别描述了气体和液体中溶解度与温度、压力之间的关系。
在研究物质的溶解度时,这两个定律都具有重要作用,但它们之间存在着一些明显的区别。
拉乌尔定律是描述气体溶解度与温度之间关系的定律。
它的基本表述是:在一定的压力下,气体的溶解度随着温度的升高而降低。
这个定律主要适用于理想气体,即气体分子之间不存在相互作用力的情况。
在实际情况下,气体分子之间会存在一定的相互作用力,因此拉乌尔定律只能作为近似计算的基础。
亨利定律则是描述气体或液体在溶剂中的溶解度与压力之间关系的定律。
它的基本表述是:在一定的温度下,气体或液体的溶解度随着压力的升高而增加。
这个定律适用于气体和液体的溶解度,但是在气体的溶解度计算中,由于气体分子之间的相互作用力较小,因此亨利定律通常更为准确。
在实际应用中,拉乌尔定律和亨利定律经常被用来计算化学反应中气体的溶解度。
例如,在某些化学反应中,气体的溶解度是反应速率的重要影响因素。
通过应用拉乌尔定律和亨利定律,我们可以计算出在不同温度和压力下气体的溶解度,从而更好地理解反应的动力学过程。
另一方面,拉乌尔定律和亨利定律在环境科学中也具有非常重要的应用。
例如,在海洋环境中,气体的溶解度对海洋生态系统和海洋化学循环过程具有重要影响。
通过应用这些定律,我们可以更好地理解海洋生态系统和化学循环的过程,预测海洋环境的变化和响应措施。
总之,拉乌尔定律和亨利定律都是热力学中非常重要的定律,它们分别描述了气体和液体中溶解度与温度、压力之间的关系。
尽管它们之间存在着一些区别,但在应用中它们经常被一起使用,以便更好地理解物质的溶解过程。
拉乌尔定律与亨利定律

必须考虑60m的水压;水柱高度与Pa的换算。
不要忘了水面上的压力.
或者直接计算压力增加值;因为必 气泡V 4 r 3
须考虑常压时N2的残留即溶解。
3
另外,PV=nRT的应用;P=101.325KPa
经济舱综合症
深静脉血栓形成(DVT(deep vein thrombosis)) 又叫“经济舱综合症(EC S(Economiccabinsyndrome))
第一,要在飞行中尽量多活动,即使不便离 开座位,也要尽量活动脚趾,让血液流通。 其次,要多喝水和不含酒精的饮料,少喝酒。
上网;钓鱼;打牌时也要避免患经济舱综合症
神舟七号飞船,2008年9月25日晚
2008年9月27日翟志刚出舱活动 这是中国人首次漫步太空
16:16 轨道舱第一次泄压完毕,舱内气压由1 个标准大气压降至70千帕。 16:27 轨道舱第二次泄压,气压降至2千帕, 满足出舱条件。航天服内压力为40千帕。
对策:提高氧浓度;用氦(溶解更少)代替氮;
减少气泡:包括预备运动或者药物.
课堂练习题P161,3-4 提示:
P=101325Pa(PN278%),有一个比例或者亨利系数.约 为1.39× 10-5kg(N2)/kg(血液).不用P134例2的系数。
暂不考虑温度对系数的影响。即在体温时仍近似
用上面的系数。
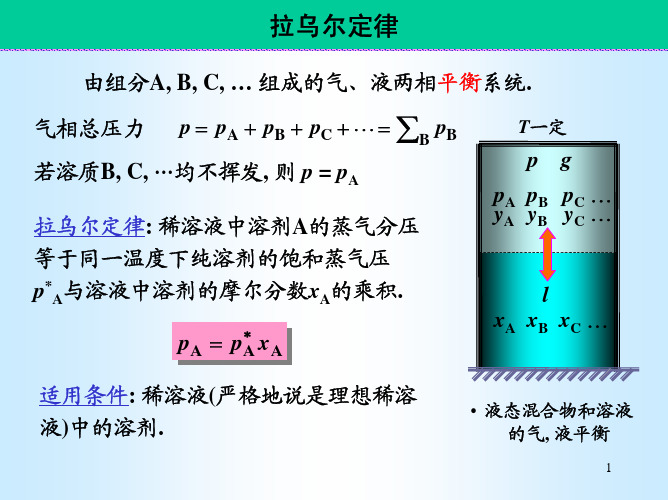
§3.6 拉乌尔定律与亨利定律
PA PA xA
(拉乌尔) Raoult’s Law(1887年):定T下,在稀薄
溶纯液溶中剂的,溶蒸剂气A的压蒸PA气 压PA,等于同温下,
乘以溶液中溶剂的摩尔分数xA Raoult’s Law适用于非电解质的稀薄溶液.
拉乌尔定律和亨利定律的区别

拉乌尔定律和亨利定律的区别
拉乌尔定律和亨利定律都是人口学中的规律,但它们针对的对象不同。
拉乌尔定律是指:在一定时间内,城市人口增加量等于自然增长量与城市外迁入量之和,即ΔP = ΔN + ΔM。
它将城市内部增长与城市间迁移联系在了一起,描述了人口城市化的趋势和现象。
而亨利定律是指:在相同条件下,农村人口增长率高于城市人口增长率,但城市人口总数增加量高于农村人口。
它主要反映出城乡人口比例变化的趋势,表明了城市化进程对农村人口的吸引力。
需要注意的是,以上内容纯属学术探讨,不涉及任何政治话题。
拉乌尔定律和亨利定律

第五节 拉乌尔定律和亨利定律一、亨利定律在一定的温度下,稀溶液中挥发性溶质在气相中的平衡分压与其在溶液中的摩尔分数成正比。
p B =k x x B亨利定律适用于稀溶液中挥发性溶质,是单元操作“吸收”的理论基础。
应用亨利定律应注意以下几点:① 亨利定律只适用于溶质在气相中和液相中分子形式相同的物质;② 气体混合物溶于同一种溶剂时,亨利定律对各种气体分别适用。
其压力为该种气体的分压;③亨利定律除了用摩尔分数表示外,还可以用物质的量浓度c B 、质量摩尔浓度b B 或质量分数w B 等表示,此时,亨利定律的表达式相应为:p B =k c c Bp B =k m b Bp B =k w w B④亨利定律适用于稀溶液中挥发性溶质,溶液越稀,定律越准确。
二、亨利定律的应用亨利定律是化工单元操作----气体吸收的理论基础,气体吸收是利用混合气体中各种气体在溶剂中溶解度的差异,有选择性地将溶解度大的气体吸收,使之从混合气体中分离出来。
若以相同的分压进行比较,则x k 越小,B x 越大,因此,x k 可作为吸收气体所用溶剂的选择依据。
三、二组分液体混合二组分系统F = C -Φ+2。
其中K =2。
故F = 2-Φ+2=4-Φ。
即二组分的最多能以四相平衡共存,最大自由度为3(温度、压力和组成)。
需要用比较复杂的三维坐标系。
但为了讨论的方便,可固定一个自由度(常是温度或压力)。
此时二组分系统的自由度f = 2-Φ+1= 3-Φ。
最大自由度为2,便可以用平面坐标描述。
1. 拉乌尔定律在一定温度下,溶入了非电解质溶质的稀溶液,其溶剂的饱和蒸气压与溶剂的摩尔分数成正比,比例系数为该溶剂在此温度下的饱和蒸气压。
表达式为。
拉乌尔和亨利定律公式

拉乌尔定律(Laval's law)是一种经济学理论,用来描述贸易自由化对于贸易伙伴国家之间贸易顺差(即出口额大于进口额)的影响。
拉乌尔定律的公式为:
贸易顺差=对外直接投资(FDI)+人力资本净流出
其中,对外直接投资(FDI)指的是企业直接投资海外的资金总额,人力资本净流出指的是人力资本(即技能、知识、经验等人才)从国内流向海外的总额。
拉乌尔定律认为,贸易自由化能够促进企业直接投资海外,并且还能促进人力资本的流动,进而提升贸易顺差。
亨利定律(Heckscher-Ohlin theorem)是一种经济学理论,用来解释国家间的贸易为什么会出现顺差或逆差(即出口额大于进口额或出口额小于进口额)。
亨利定律的公式为:
贸易顺差=绝对成本差
其中,绝对成本差指的是生产相同产品的成本在两个国家之间的差异。
根据亨利定律,如果生产相同产品的成本在一个国家更低,那么该国家就会出现贸易顺差,而另一个国家则会出现贸易逆差。
拉乌尔定律和亨利定律是两种经济学理论,用来解释国家间贸易顺差
的原因。
拉乌尔定律认为,贸易自由化能够促进企业直接投资海外,并且还能促进人力资本的流动,从而提升贸易顺差。
而亨利定律则认为,如果生产相同产品的成本在一个国家更低,那么该国家就会出现贸易顺差,而另一个国家则会出现贸易逆差。
这两种理论的公式分别为:
拉乌尔定律:贸易顺差=对外直接投资(FDI)+人力资本净流出
亨利定律:贸易顺差=绝对成本差
这两种理论都是用来解释国家间贸易顺差的原因,但它们所考虑的因素有所不同。
拉乌尔定律认为,贸易自由化和人力资本流动是导致贸易顺差的主要因素,而亨利定律则认为,生产成本差异是导致贸易顺差的主要因素。
拉乌尔定律与亨利定律课件

拉乌尔定律和亨利定律都是描述 气体溶质在液体中的溶解度的规
律。
两个定律都指出,气体的溶解度 与其分压成正比。
两个定律都适用于一定温度和压 力条件下,气体的溶解度与分压
之间的关系。
两个定律的不同之处
拉乌尔定律适用于稀溶液,而亨 利定律适用于任何浓度的溶液。
拉乌尔定律中的比例系数是溶质 的摩尔溶解度,而亨利定律中的
在食品行业
拉乌尔定律可以用来预测在特定温 度和压力条件下,气体在液体食品 中的溶解度,从而控制食品的质量 和口感。
03
亨利定律
亨利定律概述
01
描述气体溶解度与压力之间的关 系
02
由英国物理学家Henry在1803年 发现
亨利定律的物理意义
当气体溶解度在一定温度下保持恒定 时,气体的溶解度与该气体的分压成 正比
拉乌尔定律公式
通常表示为 S = K * P,其中 S 是溶解度,K 是常数,P 是压力。
拉乌尔定律适用范围
适用于描述气体在液体中的溶解度与温度和压力的关系,尤其在高 压和低温条件下。
拉乌尔定律的物理意义
揭示了气体在液体中的溶解度与压力和温度之间的依赖关系。 随着压力的增加,气体的溶解度会增加;随着温度的升高,气体的溶解度会降低。
即当气体的压力增加时,其溶解度也 会相应增加
亨利定律的应用场景
在化工生产中,常常需要将气体溶解在液体中,利用亨利定律可以指导生产过程 中的压力控制,以获得所需的溶解度和产品纯度
在环保领域,亨利定律可以用于计算气体在水中的溶解度,从而评估气体对水生 生态的影响
04
拉乌尔定律与亨利定律的比较
两个定律的相同之处
拉乌尔定律的数学表达式为 S = kPa,其中S为溶解度, k为常数,Pa为压力。亨利 定律的数学表达式为P = kC ,其中P为压力,k为常数, C为浓度。
亨利定律与拉乌尔定律的区别和联系

亨利定律与拉乌尔定律的区别和联系
亨利定律和拉乌尔定律都是物理化学的基本定律,二者区别和联系如下:
区别:
适用范围:亨利定律适用于气体在溶液中的溶解度,而拉乌尔定律适用于难挥发非电解质稀溶液的蒸气压。
定律形式:亨利定律形式为p=kX(A),其中p为气体分压,k为亨利常数,X(A)为气体A在溶液中的摩尔分数。
拉乌尔定律形式为p(B)=p X(B)=p(1-X(A)),其中p为溶剂饱和蒸气压,X(B)为溶剂在溶液中的摩尔分数,X(A)为溶质在溶液中的摩尔分数。
应用领域:亨利定律主要用于气体在液体中的溶解度计算,而拉乌尔定律主要用于蒸馏和吸收等过程的计算。
联系:
亨利定律和拉乌尔定律都是溶液热力学的基本定律,对相平衡和溶液热力学函数的研究起指导作用。
在一定温度下,气体在溶液中的溶解度与该气体溶在溶液内的摩尔浓度成正比,这是亨利定律的核心内容,也是拉乌尔定律的一个重要应用。
总之,亨利定律和拉乌尔定律虽然有不同的适用范围和形式,但都是溶液热力学的基本定律,对相平衡和溶液热力学函数的研究起指导作用。
稀溶液中的两个定律

1)解释溶剂的沸点升高 T T
T T
p
沸腾时,蒸汽压 外压
p T T
T
p*A
10个分子的平衡
T
T
6个分子的平衡
p*A xA pA T
2)解释溶剂的凝固点降低
pA
外压恒定
C
固体 纯溶剂
O*
D
O
B
Tf Tf*
T
溶剂凝固点下降示
意图
应用举例:防冻液
液体 纯溶剂 加入非挥发溶 质后,溶剂蒸 汽压曲线
若fusHm为常数,积分
d
ln
xA
fus H m RT 2
dT
xA 1
d
ln
xA
Tf
T
f
fus H m RT 2
dT
ln xA
fus H m R
1 Tf
1
T
f
ln 1 xB
fus H m R
T
f
Tf
T
f
T
f
(适用于不挥发性溶质 稀溶液精确求Tf )
ln 1 xB
p*A pA p*A xB
pA p*A xB
2. 凝固点降低 Freezing-point depression
纯溶剂: 溶剂(l) 稀溶液: 溶液(l)
溶剂(s)
Tf
溶剂(s)
Tf
相平衡, 溶剂: A(l) = A*(s) A*(l) + RT ln xA = A*(s)
1
ln xA RT
pB KB,x xB KB,mmB KB,ccB
KB,x KB,m KB,c 亨利常数
K= f ( T,p )
§4.7 理想液态混合物
拉乌尔定律与亨利定律
拉乌尔定律和亨利定律的对比
p
稀 溶 液 区 稀 溶 液 区
kx, B
kx, A
pA=f(xB) pB=f(xB)
pB* p A* pA= pA* xA pA=kx,AxA pB=kx B
4
• 开启易拉罐后, 压力减小, CO2 气体的溶解度随 之减小, 从液体 中释放出来. • 热玻棒插入 碳酸饮料中, 亨利常数随 之增大, CO2 气体从液体 中释放出来.
其它形式:
p B = k c ,B c B ;
p B = k b ,B b B
2
注意 : k x ,B , k c ,B , k b ,B的大小和单位都是不同 的.
拉乌尔定律和亨利定律的微观解释
稀溶液中, 溶质分子数目很少. 溶剂: 每个溶剂分子进入气相的概 率(或难易程度)由A-A分子间力决定; 但由于溶质占据了部分溶剂分子位置, 导致溶剂的蒸气压按比例 ( xA )下降. 挥发性溶质: 每个溶质分子B 进入 气相的概率(或难易程度)由B-A分子间 力决定, 那么进入气相的全部B 分子数 目( 分压)就仅取决于液相中B分子的数 溶剂分子 溶质分子 • 微观图像 目(浓度). 而在非稀溶液中, 每一溶剂分子进入气相的难易程度取决于 A-A和A-B两种分子间力, 每一溶质分子进入气相的难易程度取 决于B-A 和B-B 两种分子间力, 而两种作用力的相对贡献大小 3 是随浓度而变的.
pA pB pC … yA yB yC …
pA =
∗ pA x A
xA xB xC …
l
适用条件: 稀溶液(严格地说是理想稀溶 液)中的溶剂.
• 液态混合物和溶液 的气, 液平衡
1
亨利定律
亨利定律:一定温度下, 稀溶液中任一挥发性溶质B在平衡气相 中的分压力pB与它在平衡液相中的摩尔分数xB成正比. pBB= kx, BBxB p = kx, xB kx, B ⎯亨利常数, 与温度 及溶剂、溶质的特性有关.
拉乌尔定律和亨利定律

91.3k Pa (1- 0.0120) KHx,B 0.0120
KHx,B 927k Pa
例2 97.11℃时,wB=0.0300的乙醇水溶液的蒸气总 压 为 101.325kPa , 纯 水 的 pA*=91.3kPa 。 设 可 看 作理想稀溶液,试求:xB=0.0200 时的蒸气总压 和气相组成。
利用吉布斯–杜亥姆方程证明,如果溶剂遵守拉乌 尔定律,溶质必定遵守亨利定律。
dfB fB dxB xB
ln{ fB} ln xB lnC
fB
CxB
xB ,
fB xB
C
实验事实告诉我们:对于溶质,下式成立
K Hx,B
lim
xB 0
fB xB
所以 C K Hx,B ,则
fB K Hx,B xB
(1y)A=0.2p0A0时 ,pA液x相A 的xA和蒸气总压。 9.96kPa 0.200 1.99kPa
pB pB xB pB (1 xA )
2.97kPa(1 0.200) 2.38kPa
p pA pB
1.99kPa 2.38kPa 4.37kPa
例1 苯(A)和甲苯(B)的混合物可看作理想混合物。
20℃ 时 它 们 的 饱 和 蒸 气 压 分 别 为 9.96kPa 和
2.97kPa。试计算:(1) xA=0.200 时,混合物中苯 和 甲 苯 的 分 压 和 蒸 气 总 压 ; (2) 当 蒸 气 的
(yA2=)0.200时y A,液pp相A 的 xpAA*和x蒸pA A*气x Ap总B* 压x B。
当压力较高,气相不能看作理想气体
路易斯–兰德尔规则
fi
f
* i
xi
fi pxii
拉乌尔定律和亨利定律

拉乌尔定律和亨利定律--溶液的蒸气压我们知道,液体可以蒸发成气体,气体也可以凝结为液体。
在一定的温度下,二者可以达成平衡,即液体的蒸发速度等于蒸气的凝结速度。
达到这种平衡时,蒸气有一定的压力,这个压力就叫做此液体的饱和蒸气压(简称蒸气压)。
蒸气压与温度有关,温度越高,分子具有的动能越大,蒸发速度越快,因而蒸气压越大。
溶液的蒸气压除与温度有关外,还与浓度有关。
拉乌尔定律和亨利定律所描述的就是溶液蒸气压和浓度之间的关系。
3.3.1 拉乌尔定律1887年法国物理学家拉乌尔(Raoult)在溶液蒸气压实验中总结出著名的拉乌尔定律。
拉乌尔定律指出:如果溶质是不挥发性的,即它的蒸气压极小,与溶剂相比可以忽略不计,则在一定的温度下,稀溶液的蒸气压等于纯溶剂的蒸气压与其克分子分数的乘积。
即式中p1--溶剂的蒸气压,溶质是不挥发性时,即为溶液的蒸气压;x1 ──溶液中溶剂的克分分数。
拉乌尔定律还可以表述为:在一定的温度下,当不挥发物质溶解在溶剂中时,溶液的蒸气压相对下降等于溶质的克分子分数。
即式中△p——溶液的蒸气压下降值;x2——溶质的克分子分数。
对于溶质是挥发性物质,它的蒸气压不能忽略时,拉乌尔定律仍然适用,但要注意此时p1是溶液中溶剂的蒸气压。
3.3.2 亨利定律亨利定律是1803年由亨利在对气体在液体中溶解度的实验研究中得出的。
亨利定律指出:在一定的温度下,气体在液体中的溶解度和该气体的平衡分压成正比。
即p2=k x x2 (3.22)式中x2 ──气体溶质在溶液中的克分子分数;p2──该气体的平衡分压;k x──常数。
亨利定律中的浓度单位除可用克分子分数外,也可用其他浓度单位表示,但是采用不同的单位时,常数k不同。
亨利定律可以推广到具有挥发性溶质溶于液体的稀溶液。
但是需要特别注意的是,亨利定律的应用是有条件的:只有当溶质在液相和在气相里都以相同的质点存在时亨利定律才适用。
由于气体在金属中往往以原子状态存在,因此气体在金属中的溶解往往不服从亨利定律。
45拉乌尔定律与亨利定律

虽然,亨利定律式与拉乌尔定律式形 式相似,但亨利定律适用于挥发性溶质 B, 拉乌尔定律适用于溶剂 A。比例系数kx,B 并不具有纯溶质 B 在同温度下液体饱和蒸 气压 pB*的含义。
应用亨利定律时,须注意以下几点:
*拉乌尔定律和亨利定律的微观解释
亨利定律式与拉乌尔定律都仅适用于稀溶液,且溶 液越稀,其行为与这两个定律越符合;反之,偏离越大。 另外,不同物质组成的溶液符合这两个定律的浓度范围 不同。
2.亨利定律 在等温等压下的 稀溶液中,挥发性溶质 B 在气相
中平衡分压 pB与其在溶液中摩尔分数 xB(或质量摩尔 浓度、物质的量浓度)成正比。比例系数 kx,B称为亨利 系数。
pB ? kx,B xB
开启易拉罐后,压力减小, CO2气体的溶解度随之减小, 从液体中释放出来。
热玻棒插入碳酸饮料中, 亨利 常数随之增大, CO2气体从液 体中释放出来。
当溶液仅由溶剂 A 与溶质 B 组成时:
?pA ? pA? ? pA ? pA? xB (xB ? 0)
?pA 是加入溶质之后引起溶剂蒸气压的下降值。
拉乌尔定律最初是从含有不挥发性非电解质的 溶液中总结出来的,但后来进一步的实验证明,在含 有挥发性非电解质的稀薄溶液中,溶剂也遵守拉乌尔 定律。但由于在该情况下,溶液的蒸气压为溶剂与溶 质的蒸气压之和,因此溶液的蒸气压不一定低于同温 同压下纯溶剂的蒸气压。
例如,苯-甲苯 溶液能在很宽的浓度范围内符合这 两个定律,但丙酮-氯仿溶液则只在很稀的浓度时才能符 合。为了对以上现象作出合理的解释,先看一看溶液的 微观模型。
拉乌尔定律和亨利定律的区别

拉乌尔定律和亨利定律的区别
拉乌尔定律和亨利定律是热力学中两个重要的定律,它们都与气体的性质有关,但是它们的研究对象和研究内容有所不同。
拉乌尔定律是指在一定温度下,气体的体积与压强成反比。
也就是说,当气体的压强增加时,它的体积会减小,反之亦然。
这个定律是由法国物理学家拉乌尔在19世纪初发现的,它适用于理想气体和实际气体。
理想气体是指分子之间没有相互作用力的气体,而实际气体则是指分子之间存在相互作用力的气体。
虽然实际气体的体积与压强的关系不是完全符合拉乌尔定律,但是在一定范围内,它仍然是适用的。
亨利定律则是指在一定温度下,气体溶解在液体中的浓度与气体的压强成正比。
也就是说,当气体的压强增加时,它在液体中的溶解度也会增加,反之亦然。
这个定律是由英国化学家亨利在18世纪末发现的,它适用于气体在液体中的溶解。
亨利定律的应用非常广泛,例如在饮料工业中,二氧化碳的溶解度与压强的关系就是根据亨利定律来计算的。
从以上的介绍可以看出,拉乌尔定律和亨利定律的研究对象和研究内容有所不同。
拉乌尔定律研究的是气体的体积与压强的关系,而亨利定律研究的是气体在液体中的溶解度与压强的关系。
虽然它们的研究对象不同,但是它们都是热力学中非常重要的定律,对于我们理解气体的性质和应用气体有很大的帮助。
定理

(1).拉乌尔定律是从实验中总结出来的一条重要规律。
即:在一定温度下,汽液相平衡时,溶液上方气相中任意组分所具有的分压,
等于在相同温度下该组分饱和蒸气压乘以改组分在液相中的的分子分数。
数学表达式为: PA=P*A×XA
(2).道尔顿定律:
道尔顿定律是表示理想气体混合物的总压和分压的关系的定律。
总压——气体气体中某一组分对器壁所施加压力。
.亨利定律:
在一定温度和平衡状态下,一种气体在液体里溶解度和该气体的平衡分压成正比。
(1).低温甲醇洗工艺可以脱除气体中的多种杂质,在-30℃~-70 ℃的条件下,甲醇能同时脱除气体中的硫化氢、硫氧化碳、二硫化碳、RSH(硫醇)、C4H4S(噻吩)、CO2、HCN、NH3、NO、以及石蜡烃、方香烃、粗汽油杂质、同时还可以对气体进行干燥.
(2).低温甲醇洗工艺对气体的净化程度非常高,净化气中总硫可以将低到0.1PPm以下,同时二氧化碳可以降低到10PPm. (3).低甲醇洗工艺由于采取硫化氢和二氧化碳分别在硫化氢吸收塔和二氧化碳吸收塔内吸收。 (4).低温甲醇洗对氢气、一氧化碳、甲烷、的溶解度都很低,同时低温下甲醇的蒸气压低,所以有用气体和甲醇的损失小.
(5).甲醇具有很高的热化学稳定性,不降解,不起泡,同时对设备的腐蚀性小且由于粘度小所以动能损耗低.
材料化学基本第四章

1.实际溶液中溶剂的化学势及活度
2.实际溶液中溶质的化学势及活度
3.活度及活度系数的测定与计算
(1)蒸气压法 (2)凝固点降低法
(1)蒸气压法
(2)凝固点降低法
三、渗透系数
在本节讨论实际溶液时讲到,活度系数γ可以表示实际溶液与理 想溶液的偏差程度,它是一无量纲量。在实际中,用γ能够适当 地表示溶质偏差的大小;但对于溶剂,用γ来表示实际溶液与理 想溶液的偏差时往往不很理想(偏差不显著)。为此,贝耶伦建议 用渗透系数ϕ来代替溶剂的活度系数,即用ϕ来表示溶剂的非理想 程度。所以在国家标准中没有列入溶剂的活度系数γ,而列出的 是渗透系数ϕ。
材料化学
朱光明 秦华宇 主编
第四章 溶液与固溶体
第一节 第二节 第三节 第四节 第五节
拉乌尔定律和亨利定律 理想液体混合物和稀溶液 实际溶液 溶液中化学反应的平衡常数 固溶体
第一节 拉乌尔定律和亨利定律
一、拉乌尔定律 二、亨利定律
一、拉乌尔定律
1987年拉乌尔根据大量的实验结果总结出一个重要定律:溶液中 溶剂的蒸气压,等于纯溶剂在同一温度下的蒸气压乘以溶液中溶 剂的摩尔分数,此定律称为拉乌尔定律。
图4-5 稀水溶液中凝固点下降 和沸点上升示意图
4.渗透压
一定温度下,在一个U形容器内用半透膜a a′将纯溶剂和溶液分开, 半透膜只允许溶剂分子通过,而不允许溶液中溶质分子通过.溶剂 分子会自纯溶剂一方透过半透膜而进入溶液的一方,致使溶液体 积增大。这种溶剂分子由纯溶剂一方通过半透膜向溶液中迁移的 现象称为渗透现象。可以想象为溶液对膜另一侧的纯溶剂分子表 现出“负压”,好像是把它们“吸”入了溶液一样。为了阻止纯 溶剂一方的溶剂分子进入溶液,需要在溶液上方施加额外的压力, 以增加其蒸气压,使半透膜双方溶剂的化学势相等而达到平衡。 这个额外的压力就定义为渗透压,用Π表示。
拉乌尔、亨利

1偏差的情况拉乌尔定律:在等温等压下,对溶液中组元i ,当其组元的浓度1i X →时,该组元在气相中的蒸气压i P 与其在溶液中的浓度i X 成线性关系。
数学描述为:其中,i P ----组元i 在气相中的蒸气压;;i P *----纯组元i 的蒸气压;i X ----组元i 在液相中的摩尔分数;"1i i X X ≤≤----组元i 服从拉乌尔定律的定义域。
亨利定律: 在等温等压下,对溶液中的组元i ,当其组元的浓度0(%0)i X or i →→时,该组元在气相中的蒸气压i P 与其在溶液中的浓度(%)i X or i 成线性关系。
数学描述为:或 其中,i P ----组元i 在气相中的蒸气压;,%,,H i i k k ----组元i 的浓度等于1或1%时,服从亨利定理的蒸气压;i X ,[]%i ----组元i 在液相中的摩尔分数或质量百分浓度;'0i i X X ≤≤,'0%%i i ≤≤----组元i 服从亨利定律的定义域。
2)掌握拉乌尔定律和亨利定律的区别与联系拉乌尔定律与亨利定律在以下方面有区别关于拉乌尔定律:● 是描述溶剂组元i 在液相中浓度与其在气相中的蒸气压的线性关系;在1i X −−→时,在定义域"1i i X X ≤≤成立;● 线性关系的斜率是纯溶剂i 的蒸气压;● 组元i 的浓度必须用摩尔分数。
而亨利定律:● 是描述溶质组元i 在液相中浓度与其在气相中的蒸气压的线性关系;在0i X −−→或%0i −−→时,在定义域'0i i X X ≤≤或'0%%i i ≤≤成立; ● 线性关系的斜率是从服从亨利定律的线性关系延长到1i X =的蒸气压(当浓度用摩尔分数,实际上是假想纯溶质i 的蒸气压)或从服从亨利定律的线性关系延长到%1i =的蒸气压(当浓度用质量百分浓度,实际上是假想%i 的蒸气压);● 组元i 的浓度可以用摩尔分数,也可以用质量百分浓度。
拉乌尔定律与亨利定律

出现减压病的几种状况:
潜水员急速上浮,或在长时间或深潜后没有进行减压
停留; 未有加压设施的飞机升空时; 飞机的座舱增压失效时; 潜水员于潜水后马上搭乘飞机;
太空人进行太空漫步,或舱外活动时,而宇航服内的
压力较舱内压力低时。
肥胖者较易患减压病!研究起着重 要的指导作用,常应用于蒸馏和吸收等过程 的计算中。
2012-8-28 4
亨利定律(Henry's law )
英国的W.亨利在1803年研究气体在液体中的溶解度规律 时发现的,可表述为:在一定温度下,稀薄溶液中溶质 的蒸气分压与溶液浓度成正比: pB=kxB 式中pB是稀薄溶液中溶质的蒸气分压;xB是溶质的物质 的量分数; k为亨利常数,其值与温度、压力以及溶质 和溶剂的本性有关。由于在稀薄溶液中各种浓度成正比, 所以上式中的xB还可以是mB或cB等。
2012-8-28
5
生活中的小应用
开启易拉罐后, 压力减小, CO2气体的溶解度随之减小, 从液体中释放出来。
2012-8-28
6
热玻璃棒插入碳酸饮料 中,亨利常数随之增大, CO2气体从液体中释放 出来。
2012-8-28
7
潜水减压病
当潜水员在下潜到较深的水下 时,根据亨利定律较大的压力 会将其肺部空气中的氮气压入 其血液和组织中。当潜水员快 速减压上浮时,迅速降低的周 围压力会使血液及组织中的氮 气形成气泡,这些气泡还可能 因内部压强过大而爆裂,使潜 水员出现皮疹、关节痛、感觉 器衰弱、麻痹甚至死亡,这就 是减压病。
预防措施: 1.适量提高氧气瓶中的氧气浓度,减少氮气浓度;用氦 气代替氮气,因为它的溶解度更小; 2.进行预备运动; 3.限制潜水深度与时间。 治疗措施: 1.及时送入高压舱中再加压治疗减压病是唯一有效的方 法,可使90%以上的急性减压病获得治愈; 2.对于严重病例,药物作为辅助疗法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
= 0 .244 kg ⋅ mol −1
的摩尔质量为0.122kg⋅mol-1, 故 已知苯甲酸 C6H5COOH 的摩尔质量为 ⋅ 苯甲酸在苯中的分子式为 (C6H5COOH)2 .
00-8-16
4
葡萄糖(C 溶于400g乙醇中 溶液的沸点较纯乙 乙醇中, 例 10g葡萄糖 6H12O6)溶于 葡萄糖 溶于 乙醇中 醇的上升0.1428℃, 另外有 有机物质溶于 有机物质溶于100g乙醇中 此溶 乙醇中, 醇的上升 ℃ 另外有2g有机物质溶于 乙醇中 液的沸点则上升0.1250℃, 求此有机物的相对摩尔质量 液的沸点则上升 ℃ 求此有机物的相对摩尔质量.
溶于苯中达到气液平衡. 例 20℃下HCl溶于苯中达到气液平衡 液相中每 ℃ 溶于苯中达到气液平衡 液相中每100g苯含有 苯含有 1.87g HCl, 气相中苯的摩尔分数为 气相中苯的摩尔分数为0.095. 已知苯与 已知苯与HCl的摩尔质 的摩尔质 量分别为78.11g⋅mol−1与36.46 g⋅mol−1. 20℃苯饱和蒸气压为 量分别为 ⋅ ⋅ ℃ 10.01 kPa. 试计算 ℃时HCl在苯中溶解的亨利系数 试计算20℃ 在苯中溶解的亨利系数. 在苯中溶解的亨利系数
拉乌尔定律和亨利定 律
x ( HCl ) =
1.87 / 36.46 = 0.0385 1.87 / 36.46 + 100 / 78.11 x (C6 H 6 ) = 1 − 0.0385 = 0.9615
溶剂苯服从拉乌尔定律, 并结合分压定律, 有 溶剂苯服从拉乌尔定律, 并结合分压定律,
p( C 6 H 6 ) = p ∗ ( C 6 H 6 ) ⋅ x ( C 6 H 6 ) = p ⋅ y ( C 6 H 6 )
∗ ∗ pA , 2 = 1.7422 × pA ,1 = 1.7422 × 101 .325kPa = 176 .525kPa
沸腾时
00-8-16
∗ ∗ p = pA , 2 x A + pB , 2 (1 − x A ) ∗ p − pB , 2 101 .325 − 76 .198 0.250; x xA = ∗ = = B = 0.75 ∗ pA , 2 − pB , 2 176 .525 − 76 .198
∆ Tf = K f bB = 40 × 0.25063 K = 10.03K
′ ′ mB / M B 5 / 9000 ′ ( 2 ) bB = mol ⋅ kg − 1 = 5.848 × 10 − 3 mol ⋅ kg − 1 = mA 0.095
′ ∆ Tf′ = K f bB = 40 × 5.848 × 10 −3 K = 0.2339 K
理想液态混合物, 用 到K-K方程, 组成
∗ ∗ p A , 2 和 pB , 2 , 则 苯和甲苯的的饱和蒸气压为 在373.1K苯和甲苯的的饱和蒸气压为
∗ pA,2 ln ∗ = − 30726 1 − 1 = 0.5551 pA,1 8.314 373.1 353.3
对题给有机物(C)的乙醇 溶液 对题给有机物 的乙醇(A)溶液 的乙醇
mC / M C 2 × 10 −3 kg −1 ∆ Tb′ 0.1250K bC = kg = = = mA M C × 0.1 Kb 1.0282K ⋅ mol −1 ⋅ kg 0.02 × 1.0282 MC = kg ⋅ mol −1 = 164.5 × 10 −3 kg ⋅ mol −1 0.1250 M r = 164.5
00-8-16 7
渗透压
∏ = cBRT 对稀溶液: 对稀溶液 cB = ρA bB
bB = 0.560K ∆Tf = = 0.301mol ⋅ kg −1 K f 1.86K ⋅ kg ⋅ mol −1
则 cB = 998.2 kg ⋅m−3×0.301 mol⋅kg−1 = 301 mol⋅m−3 ⋅ ⋅
Π = 301.0 mol⋅m−3×8.314 J⋅K−1⋅mol−1×310.2 K ⋅ ⋅
冰点下降
(2)另一溶质相对摩尔质量为 另一溶质相对摩尔质量为9000, 溶于樟脑形成质量百分数 另一溶质相对摩尔质量为 5%的溶液 求凝固点降低多少? 的溶液, 求凝固点降低多少 的溶液
m B / M B 5 / 210 (1) bB = mol ⋅ kg −1 = 0.25063 mol ⋅ kg −1 = mA 0.095
∗ pB,2 ln ∗ = − 31999 1 − 1 = − 0.2850 pB,1 8.314 373 .1 383 .7 ∗ ∗ pB , 2 = 0 .7520 × pB ,1 = 0 .7520 × 101 .325 kPa = 76 .198 kPa
得
p ∗ (C6 H 6 ) ⋅ x (C6 H 6 ) 10.01kPa × 0.9615 p= = = 101.3kPa y (C6 H 6 ) 0.095
p( HCl) p{1 − y(C6 H 6 )} 101.3kPa(1 − 0.095) 故 k ( HCl) = = = x( HCl) x( HCl) 0.0385 = 2381kPa
渗透压
M ( C 12 H 22 O 11 ) = 342.299g ⋅ mol − 1 (1 ) 1000/18.01 5 x ( H 2 O) = = 0 .99641 1000/18.01 5 + 68.4/342.2 99 p ( H 2 O) = p * ( H 2 O) x ( H 2 O)
= 2.339 × 0.99641kPa = 2.3306kPa m 68.4 + 1000 ( 2) V = cm 3 = 1.0434 × 10 3 cm 3 = ρ 1.024 n 68 .4 / 342 .299 c= mol ⋅ dm − 3 = V 1.0434 = 0.1915 mol ⋅ dm − 3 = 0.1915 × 10 3 mol ⋅ m − 3 ∴ π = cRT = 0.1915 × 10 3 × 8.314 × 293.15Pa = 467kPa
00-8-16 3
苯中溶入0.245g苯甲酸 测得凝固点降低 苯甲酸, 例 在25.00g苯中溶入 苯中溶入 苯甲酸 测得凝固点降低0.2048 K.
凝固点降低 试求苯甲酸在苯中的分子式. 试求苯甲酸在苯中的分子式
mB ∆Tf = Kf bB = Kf MBmA
MB =
K f mB 5 .10 ×ቤተ መጻሕፍቲ ባይዱ0 .245 = kg ⋅ mol − 1 ∆ Tf m A 0 .2048 × 25 .00
5
即
00-8-16
人的血浆的凝固点为–0.560℃, 求37.0℃时血浆的渗透 例 人的血浆的凝固点为 ℃ ℃ 已知37 时水的体积质量(密度 密度)为 压. 已知 ℃时水的体积质量 密度 为998.2 kg⋅m−3, 水的凝 ⋅ 固点降低常数K 血浆可视为稀溶液. 固点降低常数 f = 1.86 K⋅kg⋅mol−1 . 血浆可视为稀溶液 ⋅ ⋅
00-8-16 1
已知101.325kPa下 , 纯苯 的正常沸点和蒸发焓分别为 例 已知 下 纯苯(A)的正常沸点和蒸发焓分别为 353.3K和30762J⋅mol−1, 纯甲苯 的正常沸点和蒸发焓分别为 纯甲苯(B)的正常沸点和蒸发焓分别为 和 ⋅ 383.7K和31999J⋅mol−1. 苯和甲苯形成理想液态混合物 若有该 苯和甲苯形成理想液态混合物, 和 ⋅ 种液态混合物在101.325kPa, 373.1K沸腾 计算其组成 沸腾, 种液态混合物在 沸腾 计算其组成.
2
已知樟脑(C 的凝固降低常数K 例 已知樟脑 10H15O)的凝固降低常数 f = 40K⋅mol–1⋅kg , (1) 的凝固降低常数 ⋅ 某一溶质相对摩尔质量为210, 溶于樟脑形成质量百分数 的 溶于樟脑形成质量百分数5%的 某一溶质相对摩尔质量为 溶液, 求凝固点降低多少? 溶液 求凝固点降低多少
= 776 kPa
00-8-16 6
蔗糖(C 溶于1kg的水中 已知 ℃ 的水中,已知 例 在20℃下将 ℃下将68.4g蔗糖 12H22O11)溶于 蔗糖 溶于 的水中 已知20℃ 下此溶液的密度为1.024g⋅cm-3, 纯水饱和蒸气压为 纯水饱和蒸气压为2.339kPa.求: 下此溶液的密度为 ⋅ 求 (1)此溶液的蒸气压 此溶液的蒸气压; 此溶液的蒸气压 (2)此溶液的渗透压 此溶液的渗透压. 此溶液的渗透压
沸点上升
对题给葡萄糖(B)的乙醇 溶液 对题给葡萄糖 的乙醇(A)溶液 的乙醇
m B / M B 10 / 180 bB = mol ⋅ kg −1 = 0.1216mol ⋅ kg −1 = mA 0.4 ∆Tb 0.1428 Kb = K ⋅ mol −1 ⋅ kg = 1.0282K ⋅ mol −1 ⋅ kg = bB 0.1216
