《化学与技术》课件(人教版) 课题1.1 化工生产过程中的基本问题
高中化学选修2课件

SO2(g)
催化剂 加热
第二步:催化氧化
2SO2 (g) + O2 (g) 第三步:吸收 SO3(g)+ H2O(l)
2SO3(g) H2SO4(l)
(二)硫酸工业生产的原理
7
以黄铁矿(FeS2)为原料 第一步:造气 高温 8SO2(g)+ 2Fe2O3(s) 4FeS2(s)+ 11O2 (g) 第二步:催化氧化 2SO2 (g) + O2 (g) 第三步:吸收
三个主要设备: 沸 腾 炉、接 触 室、吸收塔
发烟硫酸是浓度超过100%的硫酸,也 就是它含有游离的三氧化硫气体 .浓硫酸一般指浓度大于75%的硫酸.
14
三、生产中反应条件的控制
1、影响化学反应速率的因素有哪些? 反应物浓度、温度、压强(对有气体参加的 反应)、催化剂 2、什么是化学平衡? 指在一定条件下的可逆反应里,正反应和逆 反应的速率相等,反应混合物中各组分的浓度 保持不变的状态。
1
新课标人教版高中化学课件系列
选修2 化学与技术 第一章 走进化学工业
第一节 化工生产过程中的基本问题 第1课时
走进化学工业
2
化工生产过程中的基本问题
复习回顾:
3
硫酸的性质
• (1)物理性质:硫酸是一种无色,难挥发,易溶于水 的油状液体。 • 浓硫酸溶于水时会放出大量的热。因此,稀释硫 水 中,并_______ 浓硫酸 倒入____ 不断搅拌 。 酸时应该把______ • (2)化学性质: 吸水 性、______ 脱水 性和 • 浓硫酸具有酸性、______ 强氧化 性。 ______
三、生产中反应条件的控制
越高 ; 思考压强的增大,SO2的转化率_____ 那么是否压强越高越好呢? 根据平衡移动原理,加压对提高 SO 2 的转化率 有利,但在常压、400~500℃时,SO2的转化率已经很 高,加压对设备的要求高,会增大投资和能量消耗。 应选择压强:(2)常压
化工生产过程中的基本问题第1课时(22张)-人教版高中化学选修2课件
(2)生产步骤:分析产品与生产原料之间关键元素的性质,确定主 要生产步骤。H2SO4 中硫的化合价是+6 价,因为不能从 S 或 FeS2 直 接得到 H2SO4,因此需要经过中间步骤,先得到 SO3,再通过 SO3 与 H2O 反应得到 H2SO4。
分析生产原料的性质,确定反应原理。S 或 FeS2 与 O2 反应生 成 SO2,可以使 SO2 与 O2 进一步反应生成 SO3。
工业制 硫酸的 三反应 过程
三阶段 三原理
1.S(s)+O2(g) SO2(g)或 4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g)
2.2SO2(g)+O2(g)
2SO3(g)
3.H2O(l)+SO3(g) H2SO4(l) 造气、催化氧化、吸收
化学平衡移动原理、热交换原理、逆流原理
(3)工业上制硫酸的基本生产原理:工业制硫酸主要分造气、催 化氧化、吸收三个阶段。
①造气:以 S 为原料制备 SO2。 化学方程式:S(s)+O2(g) SO2(g)(属放热反应)。 ②催化氧化:利用催化氧化反应将 SO2 氧化成 SO3。
化学方程式:2SO2(g)+O2(g)
2SO3(g)(属放热反应)。
硫酸,理由是 。
(2)在催化反应室,下列措施中有利于提高 SO2 平衡转化率的
有
。
A.升高温度
B.减小压强
C.不断补充空气
D.及时分离出 SO3
(3)在生产中为提高催化剂催化效率采取了哪些措施?
。
(至少答出两点措施)
(4)已知 2SO2(g)+O2(g)
2SO3(g) ΔH=-196 kJ·mol-1。在
1.1 化工生产过程中的基本问题 课件(人教版选修2)

解析
(3)催化剂只能改变可逆反应的化学反应速率,而不
会使其平衡发生移动,故不能提高SO2的转化率及反应过程
中放出的热量;ABD正确。 (4)要测定SO2的含量,所用试剂需能与SO2反应,且能明显
指示反应的终点,分析知答案为B、C。
(5)对于可逆反应,其热化学方程式中的焓变是指可逆反应 进行到底的热效应,计算时根据方程式列比例计算即可。 一万吨98%的H2SO4溶液中含H2SO4的质量为9.8×109g,
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C.碘水、淀粉溶液
D.氨水、酚酞试液
自主探究 精要解读 实验探究
(5)已知: 2SO2(g)+O2(g) 2SO3(g); ΔH=-196.6 kJ· mol 1, 计算每生产一万吨 98%的硫酸所需要 SO3 的质量和由 SO2 生产这些 SO3 所放出的热量。
③SO3吸收:三氧化硫转化成硫酸,反应化学方程式为 SO3+H2O ===H2SO4 属______ 放热 反应)。 ____________________(
自主探究 精要解读 实验探究
笃学二
生产中原料的选择
1. 原料选择依据
化学反应原理 外,还有 在工业生产中,选择原料除依据_____________ 厂址选择 、____ 原料、能源、_____ 工业 用 许多因素需要考虑,如_________ 贮存 、_____ 运输 、预处理成本及__________ 环境保护 水的供应能力、_____
用黄铁矿为原料生产硫酸的过程中,排出的炉渣和矿灰,
炼铁的原料 ;可以用来提炼_______________ 贵重的有色金属 ;废 可作为___________ 水泥的原料 或用于_____ 制砖 。 渣还可以作为制造___________
人教版高中化学选修2-化学与技术:化工生产过程中的基本问题_课件3共19页PPT

51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许多人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
高中化学(人教版)选修2课件:第1单元-课题1《化学生产过程中的基本问题》(共72张PPT)

新课标 · 化学 选修2 化学与 课 堂 互 动 探 究 当 堂 双 基 达 标 课 时 作 业
菜
教 学 目 标 分 析 教 学 方 案 设 计 课 前 自 主 导 学
新课标 · 化学 选修2 化学与 课 堂 互 动 探 究 当 堂 双 基 达 标 课 时 作 业
菜
教 学 目 标 分 析 教 学 方 案 设 计 课 前 自 主 导 学
新课标 · 化学 选修2 化学与 课 堂 互 动 重 点 难 点 探 究 1.掌握硫酸工业生产中的 当 “三原料、三阶段、三设备、 堂 三反应”。(重点) 双 2.能运用化学平衡原理分析 基 二氧化硫催化氧化反应的适 达 宜条件,了解硫酸生产过程 标
中反应条件的控制。(重难 点)
课 时 作 业
菜
பைடு நூலகம்
教 学 目 标 分 析 教 学 方 案 设 计
菜
教 学 目 标 分 析 教 学 方 案 设 计 课 前 自 主 导 学
新课标 · 化学 选修2 化学与 课 堂 互 动 探 究 当 堂 双 基 达 标 课 时 作 业
菜
教 学 目 标 分 析 教 学 方 案 设 计
课题 1
●课标要求
了解我国基本化工的生产资源,基本化工产品的主要种
新课标 · 化学 选修2 化学与 课 堂 互 动 化工生产过程中的基本问题 探 究 教师用书独具演示 当 堂 双 基 达 标 课 时 作 业
新课标 · 化学 选修2 化学与 课 堂 互 动 探 究 当 堂 双 基 达 标 课 时 作 业
演示结束
菜
教 学 目 标 分 析 教 学 方 案 设 计 课 前 自 主 导 学
课 标 解 读 1.了解我国基本化工的生 产资源、基本化工产品的 主要种类和发展概况。 2.掌握工业制硫酸的工艺 流程。 3.认识化学平衡原理在化 工生产中的实际应用。 4.初步了解生产中三废的 处理和利用。
人教版高二化学选修2《课题1化工生产过程中的基本问题》教案及教学反思

课题1 化工生产过程中的基本问题一、教学内容本节课是人教版高二化学选修2中的第1课,主要介绍化工生产过程中的基本问题,包括反应平衡、反应热、反应速率、选择性等方面的内容。
1.1 反应平衡反应平衡是化工生产中非常重要的一个概念。
在反应过程中,不同物质之间的摩尔比例发生变化,但是最终达到一定的比例关系时,反应就处于平衡状态。
反应平衡的研究可以帮助我们实现反应的控制和优化,从而提高化工产品的成品率和质量。
1.2 反应热反应热是指化学反应所释放或吸收的热量。
了解反应热对于控制化工生产过程中的温度、时间等因素非常重要。
同时,反应热还可以指导我们进行热力学分析,优化工艺和节约能源。
1.3 反应速率反应速率是指化学反应中反应物转化成产物的速度。
了解反应速率有助于我们准确掌握反应过程,调整反应的速率和时间,提高化工产品的生产效率。
1.4 选择性选择性是指化学反应中某种物质转化成特定产物的程度。
选择性不仅可以反映反应的效率,还可以指导我们精确控制化工反应过程,提高产品质量和减少废料。
二、教学目标通过本节课的学习,学生应当掌握以下知识和技能:1.理解反应平衡的概念,掌握反应平衡常数的计算方法;2.了解反应热的概念和意义,掌握反应热的计算方法;3.掌握反应速率的计算方法,了解影响反应速率的因素;4.理解选择性的概念,掌握选择性的计算方法和影响选择性的因素;5.培养对化学反应中物质的量的敏感度,能够进行反应平衡、反应热、反应速率和选择性等方面的计算和分析。
三、教学过程3.1 导入通过引导学生思考化工生产中遇到的基本问题,激发学生学习的兴趣和动力。
同时,可以提出几道简单的化学反应题目,让学生体验反应平衡、反应热和反应速率等概念的应用。
3.2 概念讲解通过多媒体教学、图表演示等形式,详细讲解化工生产过程中常见的基本问题,包括反应平衡、反应热、反应速率和选择性等方面的内容。
教师应当重点强调反应平衡常数的计算方法、影响选择性的因素,以及反应速率的计算方法和反应速率与反应浓度之间的关系。
化学人教版选修2课件:1.1 化工生产过程中的基本问题

-4-
课题1
化工生产过程中 的基本问题
三 四 五
M 目标导航 Z 知识梳理 Z 重难聚焦
UBIAODAOHANG HISHI SHULI
HONGNAN JVJIAO
D典例透析 S随堂演练
IANLI TOUXI
UITANGYANLIAN
一
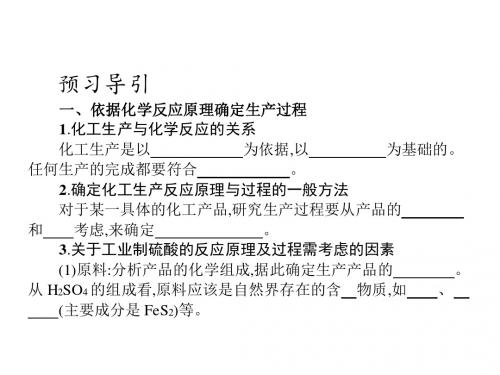
二
3.确定化工生产反应原理与过程的案例研究——生产硫酸 (1)关于工业制硫酸的反应原理及过程需考虑的因素。 ①分析产品的化学组成,据此确定生产该产品的主要原料。从 H2SO4的组成看,原料应该是自然界存在的含硫物质,如硫黄、黄铁 矿(主要成分是FeS2)等。 ②分析产品与生产原料之间关键元素的性质,确定主要生产步骤。 H2SO4中S的化合价是+6价,因此先从S或FeS2得到SO3,再由SO3与 H2O反应得到H2SO4。 ③分析生产原料的性质,确定反应原理。生产H2SO4的主要化学 过程可以分成SO2的生成和SO2转化为SO3两个阶段。
-5-
课题1
化工生产过程中 的基本问题
三 四 五
M 目标导航 Z 知识梳理 Z 重难聚焦
UBIAODAOHANG HISHI SHULI
HONGNAN JVJIAO
D典例透析 S随堂演练
IANLI TOUXI
UITANGYANLIAN
一
二
(2)工业制硫酸的过程及反应原理。 工业上制硫酸主要分造气、催化氧化和吸收三个阶段。以硫黄 为原料制硫酸的反应原理用化学方程式表示为:
-11-
课题1
化工生产过程中 的基本问题
三 四 五
M 目标导航 Z 知识梳理 Z 重难聚焦
UBIAODAOHANG HISHI SHULI
HONGNAN JVJIAO
化学:第一单元课题1《化学生产过程中的基本问题》课件(新人教版选修2)

思考: 思考 为什么不主张用黄铁矿(主要成分 主要成分FeS2)作为原料生产硫酸 作为原料生产硫酸? 为什么不主张用黄铁矿 主要成分 作为原料生产硫酸
(二)硫酸工业原料的选择 二 硫酸工业原料的选择 硫O3 (s)+ 8SO2(g) 第一步: 第一步: 4FeS2(S) +11 O2 (g) 第二步: 第二步: 2SO2(g) + O2 (g) 第三步: 第三步: SO3 (g) + H2O(l)
2. 如何处理废水中的酸性物质? 如何处理废水中的酸性物质?
用石灰浆(Ca(OH)2或石灰石粉中和. 用石灰浆 或石灰石粉中和
3. 如何利用废渣和生产过程中的产生的 大量热能? 大量热能
废渣:分离后循环利用 剩下的作铺路用的 废渣 分离后循环利用,剩下的作铺路用的 分离后循环利用 沥青或用于制砖
能量的充分利用
化工生产过程:
• • • • • • (1)确定化学反应原理 (2)选择原料 (3)选择设备和工艺流程 (4)三废处理(环境保护) (5)能源的利用(综合经济利益) (6)其它问题(如厂址,成本,反应条件等问 题)
小结:(本节课重点)
• • • • • • 1. 工业上接触法制硫酸概括为“五个三” : 工业上接触法制硫酸概括为“五个三” 三种原料: 硫磺 或黄铁矿 空气 和水 三种原料 硫磺(或黄铁矿 空气,和水 或黄铁矿),空气 三个反应: 三个反应 三个生产过程: 造气,催化氧化 三个生产过程 造气 催化氧化 吸收 催化氧化,吸收 三个主要设备: 三个主要设备 沸 腾 炉,接 触 室,吸收塔 ,接 ,吸收塔 硫酸工业生产的三个适宜条件 三个适宜条件: 硫酸工业生产的三个适宜条件
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学习目标
化工生产过程中的基本问题
1.了解生产硫酸的基本流程。 了解生产硫酸的基本流程。 了解生产硫酸的基本流程 2.了解生产中原料的选择。 了解生产中原料的选择。 了解生产中原料的选择 3.了解化学科学实验与化工生产的区别。 了解化学科学实验与化工生产的区别。 了解化学科学实验与化工生产的区别 4.注意生产中的三废处理,防止环境污染。 注意生产中的三废处理,防止环境污染。 注意生产中的三废处理
SO2+NH3+H2O===NH4HSO3 SO2+2NH3+H2O===(NH4)2SO3 2NH4HSO3 + H2SO4===(NH4)2SO4 + 2SO2↑ + 2H2O (NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O 废水用石灰乳中和: 废水用石灰乳中和 : Ca(OH)2 + H2SO4===CaSO4 +2H2O 废渣可用于制砖、制水泥、 废渣可用于制砖 、 制水泥 、 回收有色金属等综合 利用。 利用。
3.厂址的选择:硫酸是一种强腐蚀性液体,不 .厂址的选择:硫酸是一种强腐蚀性液体, 宜大量的贮存和长途运输;生产设备易腐蚀, 宜大量的贮存和长途运输;生产设备易腐蚀, 寿命较短,同时废渣、废液、废气排放量大, 寿命较短,同时废渣、废液、废气排放量大, 污染环境。 污染环境。因此厂址宜靠近原料供应地和产品 销售地,有充足的水源保证和热能供应, 销售地,有充足的水源保证和热能供应,靠近 交通运输线,不要建在人口密集的居民区,旅 交通运输线,不要建在人口密集的居民区, 游景点和文物保护区,地震、 游景点和文物保护区,地震、洪水等自然灾害 多发区。 多发区。 4.废气、废水、废渣的利用:尾气中的 2用 .废气、废水、废渣的利用:尾气中的SO 氨水吸收,生成的(NH4)2SO4作化肥,SO2循环 作化肥, 氨水吸收,生成的 利用。 利用。
思考感悟 是否温度越低越有利于SO 转化为SO 是否温度越低越有利于 2转化为 3? 提示】 【 提示 】 工业生产中反应温度的选择往往 还要考虑该温度下催化剂的活性, 还要考虑该温度下催化剂的活性 , 所以应选 择温度为低温(400~500 ℃)。 ~ 择温度为低温 。
3. 阅读课本 6 表 1- 2, 从中可看出压强增大时 , . 阅读课本P - , 从中可看出压强增大时, SO2的转化率增大。 的转化率增大。 注意: 注意:工业生产中压强的选择往往还要考虑成本 和能量消耗等问题。 和能量消耗等问题。 四、生产中的三废处理 1.尾气吸收 工业的尾气主要是SO H2SO4工业的尾气主要是 2。 SO2+Ca(OH)2===CaSO3+H2O, , CaSO3+H2SO4===CaSO4+SO2↑+H2O。 。
硫铁矿的主要成分是FeS2,硫铁矿在燃烧前需 硫铁矿的主要成分是 粉碎,增大和氧气的接触面积, 粉碎,增大和氧气的接触面积,使燃烧速率加 快且更充分,提高原料利用率。 快且更充分,提高原料利用率。 该反应在沸腾炉中进行, 该反应在沸腾炉中进行,从炉内出来的气体叫 炉气,成分为SO 及矿尘, 炉气,成分为 2、O2、N2、H2O及矿尘,砷、 及矿尘 硒化合物等。其中砷、硒化合物和矿尘能使催 硒化合物等。其中砷、 化剂中毒,可通过除尘、洗涤等方法除去; 化剂中毒,可通过除尘、洗涤等方法除去;水 蒸气对设备和生产有不良影响, 蒸气对设备和生产有不良影响,可通过干燥除 去。 (2)SO2的催化氧化: 的催化氧化:
化学反应方程式SO 化学反应方程式 3(g)+ H2O(l)===H2SO4(l), + , 放热 反应 反应)。 属_____反应 。 3.工业制硫酸主要生产流程 .
二、生产中原料的选择 我国生产硫酸需考虑的问题: 我国生产硫酸需考虑的问题: 1.从基建投资 、 加工费用及环保方面考虑 , 用 . 从基建投资、加工费用及环保方面考虑, _______制硫酸优于用 黄铁矿制硫酸。 制硫酸优于用_______制硫酸 制硫酸。 硫黄 制硫酸优于用 缺乏 2 . 我 国 天 然 硫 资 源 ______ , 而 且 开 采 条 件 比较复杂 。 _________。 3.我国黄铁矿储量比天然硫黄要 大 .我国黄铁矿储量比天然硫黄要_______。 。 4.硫黄制硫酸比黄铁矿制硫酸生产流程 短 , .硫黄制硫酸比黄铁矿制硫酸生产流程_____, 设备_______, 三废_________少 设备 简单 , 三废 治理量 少 , 劳动生产率 高 ,易于设备________。 _____,易于设备 大型化 。
有一定的SO 有一定的 2 和 O2 , 再通过一定措施将这部分 气体送回接触室, 提高原料利用率, 气体送回接触室 , 提高原料利用率 , 同时减少 废气排放。 废气排放。
特别提醒: 特别提醒 : ① 在生产中常用过量空气是为了 增大O 的浓度,提高SO 的转化率。 增大 2的浓度,提高 2的转化率。 ②常用浓H2SO4而不用水吸收SO3,是由于水 常用浓 而不用水吸收 反应易形成酸雾,吸收速度慢, 与SO3反应易形成酸雾,吸收速度慢,且腐蚀 设备。 设备。
变式训练1 在接触法制硫酸的工业生产中 , 下列 在接触法制硫酸的工业生产中, 变式训练 生产操作与说明这些操作的主要原因都正确的是 ( D ) A.黄铁矿煅烧前需要粉碎,因为大块黄铁矿不能 .黄铁矿煅烧前需要粉碎, 燃烧 B.从沸腾炉出来的炉气需要净化, 这样可以提高 .从沸腾炉出来的炉气需要净化, 产品的纯度 C.SO2氧化为 3时需使用催化剂,这样可以提高 氧化为SO 时需使用催化剂, . 反应速率和SO 反应速率和 2的转化率 D. 用质量分数为 的硫酸吸收SO . 用质量分数为98.3%的硫酸吸收 3 , 目的是 的硫酸吸收 防止形成酸雾,以便使SO 防止形成酸雾,以便使 3吸收完全 析:炉气净化的目的是防止炉气中的杂质和矿尘使催 化剂中毒、失效。 化剂中毒、失效。
1 -1 SO2(g)+ O2(g) SO3(g);∆H=- =-98.3 kJ·mol + ; =- 2 此反应是一个可逆反应, 此反应是一个可逆反应,正反应是气体体积缩小的 放热反应,由化学平衡理论可知, 放热反应,由化学平衡理论可知,在较低温度下进 行有利, 但温度低时催化剂活性不高, 反应速率低, 行有利, 但温度低时催化剂活性不高, 反应速率低, 实际生产中选择常压下 400 ℃~500 ℃进行, 化学反 平衡转化率都比较理想。 应速率和 SO2 平衡转化率都比较理想。
核心要点突破 一、化学原理与硫酸工业生产流程
二、化学原理在化工生产中的应用 1.增大反应速率的措施 (1)升高温度;(2)使用催化剂;(3)在沸腾炉中燃 升高温度; 使用催化剂 使用催化剂; 在沸腾炉中燃 升高温度 料燃烧时,使原料粉碎,增大与空气的接触面积。 料燃烧时,使原料粉碎,增大与空气的接触面积。 2.逆流原理的应用 沸腾炉中原料从炉顶落下,热空气从炉底吹入, 沸腾炉中原料从炉顶落下,热空气从炉底吹入, 使原料与助燃气体充分接触,反应进行彻底充分; 使原料与助燃气体充分接触,反应进行彻底充分; 吸收塔中使用大量耐酸瓷环(片 , 吸收塔中使用大量耐酸瓷环 片),浓硫酸从塔顶 喷下,三氧化硫气体从塔底吹入,提高吸收程度。 喷下,三氧化硫气体从塔底吹入,提高吸收程度。
3.热交换原理的应用 由于2SO2+O2 由于 2SO3是放热反应,在接触室 是放热反应,
内使用热交换器,用反应后热的气体预热接触室 内使用热交换器, 的原料气,达到节约能源,降低生产成本的目的。 的原料气,达到节约能源,降低生产成本的目的。
4.循环操作原理的应用 由于2SO2+O2 由于 2SO3是可逆反应,尾气中还 是可逆反应,
2.污水处理 . 不同化工生产过程产生的污水,杂质不同, 不同化工生产过程产生的污水,杂质不同,要 根据杂质的性质不同, 根据杂质的性质不同,采用不同的物理化学方 如酸碱中和法,重金属离子沉淀法等。 法,如酸碱中和法,重金属离子沉淀法等。 3. 3.废渣的处理 根据废渣的成分进行综合利用。 根据废渣的成分进行综合利用。如硫酸工业的 废渣可用来作为炼铁的原料, 废渣可用来作为炼铁的原料,提炼贵重的有色 金属,作水泥原料或用于建筑材料。 金属,作水泥原料或用于建筑材料。
在接触室的两层催化剂之间装上一个热交换器, 在接触室的两层催化剂之间装上一个热交换器, 把反应生成的热传递给进入接触室需要预热的炉 同时冷却反应后生成的气体。 气,同时冷却反应后生成的气体。 (3)SO3的吸收: 的吸收: SO3(g) + H2O(l)===H2SO4(l) ; ∆H = - 130.3 kJ·mol-1 工业上并不直接用水吸收三氧化硫, 工业上并不直接用水吸收三氧化硫,而是用质量 分数为98%的硫酸做吸收剂,因为三氧化硫与水 的硫酸做吸收剂, 分数为 的硫酸做吸收剂 蒸气容易形成酸雾, 蒸气容易形成酸雾,从而降低了三氧化硫的吸收 同时采用逆流吸收,硫酸从塔底放出。 率。同时采用逆流吸收,硫酸从塔底放出。
(1)以S为原料制备 2 以 为原料制备 为原料制备SO 化学反应方程式S(s)+O2(g)===SO2(g),(属______ + 化学反应方程式 , 属 放热 反应)。 反应 。 (2)利用催化氧化反应将 2氧化成 3 利用催化氧化反应将SO 氧化成SO 利用催化氧化反应将 化学反应方程式2SO2(g)+O2(g) 化学反应方程式 + (属_____反应 。 属 放热 反应 反应)。 (3)三氧化硫转化成硫酸 三氧化硫转化成硫酸 2SO3(g), ,
5.由于原料多需进口 , 硫黄制硫酸成本比黄铁 . 由于原料多需进口, 矿制硫酸_____。 矿制硫酸 高 。 三、生产中反应条件的控制 1. 硫酸工业生产的三个主要设备是 沸腾炉 、 . 硫酸工业生产的三个主要设备是________、 接触室 、 吸收塔 。 ________、_________。 2.阅读课本 6表1-1,从中可看出温度较 低 .阅读课本P - ,从中可看出温度较_____ 有利于SO 转化为SO 时,有利于 2转化为 3。 二氧化硫催化氧化的反应方程式2SO2+O2 二氧化硫催化氧化的反应方程式 放热 反应 2SO3,属______反应。 反应。
