有机化学武汉大学2碳正离子97页PPT
第三章碳正离子

7
4
1
+
3
2
OAc
OAc
7
4
5
OAc
6
3
1
2
有旋光
3
4
7
5
外消旋 OAc 1
2
6
OAc
7
4
3
5
1
6
+
2
5
6
+2
1
4
3
7.
2) π电子参与
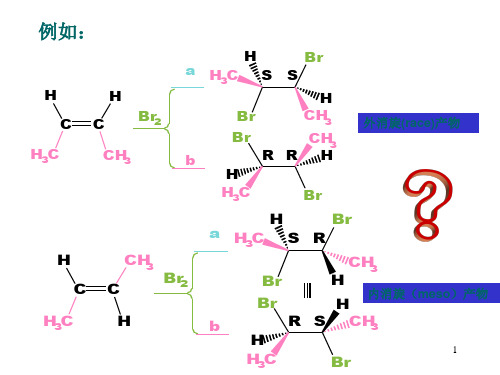
例:对向-7-取代原菠烯形成非经典碳正离子:
TsO 7
4
5
3
1
7
AcO 7
4
3 HOAc
4
5
1
+
5
3
1
6 同向2-7-取代原6 菠烯2形成经典6 碳正离2 子:
.
China Pharmaceutical University
b) p-π共轭效应
碳正离子中心碳原子p空轨道与π电子共轭,分散正电荷, 稳定碳正离子。
+ Ph C Ph >
Ph
+
Ph C Ph > H
+ PhCH2
+
CH2
CH
CH2
.
China Pharmaceutical University
7
OTs
7
7
7+
3
5
1
44 3
4
4
3
+
5
3
5
1
5
1
+
1
6
2
6Ac
.
China Pharmaceutical University
碳正离子

有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R—X →R+ +X-在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF5作为Lewis酸生成稳定SbF6一,会使反应向右进行,有利于碳正离子的生成。
R—Br+ Ag+→R++ AgBr ;R—F+SbF5→R++SbF6-。
但是醇、醚、酰卤在酸或Lewis酸的催化下也可以离解为碳正离子。
R一0H →R+-OH2→R++H20 ;CH3COF+BF3-→CH3CO++BF4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH3)3CH + SbF5·FSO3H →(CH3)3C++ SbF5·FSO3-+H22、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
C CH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N2而生成碳正离子。
RN R +N2;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP 3杂化角锥构型 SP 2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp2杂化的s成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P轨道伸展于平面两侧,便于溶剂化。
第三章碳正离子

RNu + :X Reaction Coordinate (progress)
3) Stereochemistry of the SN1 Reaction
Since carbocations are planer and sp2-hybridized, they are achiral.
Thus if we carry out an SN1 reaction on one enantiomer of a chiral reactant, the product ( a racemic mixture) must be optically inactive.
碳原子与离去基团之间原有的共价键断裂, 离去基带着一对电子离开分子。
通式:R-X + Y :
R- Y + X :
四种SN反应类型
(A) neutral substrate + neutral nucleophile
(B) neutral substrate + anionic nucleophile
甲基推电子基通过C-Hσ键与C+的空轨道共轭。
σ共轭效应的研究 在超酸催化下进行 超酸:强的质子给予体,强度用哈米特酸度H°表示
超酸特点:1) 给质子能力强,亲核性低; 2) 凝固点低; 3) 粘度小。
China Pharmaceutical University
在超酸介质中可得到热力学最稳定的碳正离子
第三章 亲核取代反应及碳正离子
(Nucleophilic Substitution and Carbocations)
一、碳正离子的产生、结构和稳定性 1、产生及类型:有机反应中产生的活性中间体的一种。
有机化学武汉大学2碳正离子

2. 碳正离子的稳定性
以溴代烷为例,不同结构的溴代烷的C—Br键异 裂,生成C+,所需能量如下:
H3C Br CH3CH2 Br
CH3 CH3CH2
B. 1,2-H原子位移:
CC H
CC H
CC H
总之,由于在SN1反应中生成了C+,因此 引发了重排,可以说碳架的重排是SN1反应的另 一特点。
5. Markovnikov’s Rule
在不对称的烯烃中, HX 可以按照不同的方式加成, 但只 有一个是占优势的 如果反应只在一个方向上进行, 为区域专一性的 (regiospecific)反应,如果同时得到不同方向的反应 产物,但以一种为主,则为区域选择性 (regioselective)反应 Markovnikov 在十九世纪发现 在烯烃的HX加成中,H 总是加在含氢较多的碳上,称为Markovnikov’s rule
+ Br+ Br-
Δ H=219Kcal Δ H=184Kcal
CH3CHCH3 Br
CH3
CH3CCH3
Br
CH3CHCH3 + Br-
Δ H=164Kcal
CH3 CH3CCH3 + Br-
Δ H=149Kcal
不同结构的C+能量不同,生成C+的能量越少,说明C+所 具有的能量越低,越稳定,由上可知,C+的稳定性为:
所以有: 3o >2o >1o >CH3W
同时碳正离子的稳定性是3o C+ >2o C+ >1o C+ >CH3+,即碳正离子的稳定性与反应速度是一致的, 碳正离子越稳定,越易生成,反应速度越快。可以解 释为:在碳正离子形成过程中,推电子基团能稳定碳 原子的部分正电荷,从而稳定过渡态,降低过渡态的 活化能,即C+越稳定,形成C+ 过渡态的能量越低, 反应速度越快。
碳正离子

结构
ቤተ መጻሕፍቲ ባይዱ
碳正离子与自由基一样,是一个活泼的中间体。碳正离子有一个正电荷,最外层有6个电子。带正电荷的碳原 子以sp2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。碳原子剩余的P轨道与 这个平面垂直。碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。 根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。 碳正离子的结构与稳定性直接受到与之相连接的基团的影响。它们稳定性的一般规律如下: (1)苄基型或烯丙型一般较稳定; (2)其它碳正离子是:3°>2°>1°; 而烯丙型,苄基型的碳正离子与二级碳正离子的稳定性比较,尚有争论。 (可以用超共轭解释不同碳正离子的稳定性) 碳正离子越稳定,能量越低,形成越容易。
第一个溶液中稳定的碳正离子的NMR图谱在1958年时由Doering等人所发表.其为七甲基苯离子 (heptamethylbenzenium ion),由六甲基苯加上氯化铝、氯甲烷所制成.Story等人于1960制备出稳定的7norbornadienyl阳离子,借由norbornadienyl chloride与-80℃下溶于液态二氧化硫的四氟硼酸银反应产 生.此NMR图谱显示出一个非传统的中间物(第一个发现的非传统稳定离子) 1962年,Olah借由核磁共振直接发现 三级丁基碳阳离子跟溶于魔酸(magic acid)里的三级丁基氟一样稳定.Norbornyl阳离子的NMR图谱最先由 Schleyer等人发表,而Saunders等人则显示出屏障间质子抢夺的过程.
形成过程
碳正离子的形成过程大概是这样的: C+上原本连有一个电负性较大的或者吸电子的基团(如-Br, -OH等) 那么这个基团就会将它连接的碳上的电子吸引过去使该碳稍微显正电性吸电子基团在适当溶液中还可能带着一对 电子离去(例如Br- ),那么剩下的烃基就形成了碳正离子。
有机化学(武汉大学)2 碳正离子共97页

66、节制使快乐增加并使享受加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
有机化学(武汉大学)2 碳正离子
11、用道德的示范来造就一个人,显然比用法律来约束他更有价值ห้องสมุดไป่ตู้—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
碳正离子.ppt

2020/1/31
11
B. 1,2-H原子位移:
CC H
CC H
CC H
总之,由于在SN1反应中生成了C+,因此 引发了重排,可以说碳架的重排是SN1反应的另 一特点。
2020/1/31
12
5. Markovnikov’s Rule
在不对称的烯烃中, HX 可以按照不同的方式加成, 但只 有一个是占优势的 如果反应只在一个方向上进行, 为区域专一性的 (regiospecific)反应,如果同时得到不同方向的反应 产物,但以一种为主,则为区域选择性 (regioselective)反应 Markovnikov 在十九世纪发现 在烯烃的HX加成中,H 总是加在含氢较多的碳上,称为Markovnikov’s rule
碳正离子
2020/1/31
1
1. 碳正离子的结构特点及其形成
碳原子外层轨道含有6个电 子,需要接受一对电子才能满 足C原子外层的稳定结构,因 而它是非常活泼的反应中间体, 是非常强的Lewis酸。结构如 右图:
2020/1/31
2
2. 碳正离子的稳定性
以溴代烷为例,不同结构的溴代烷的C—Br键异 裂,生成C+,所需能量如下:
CC H
CC H
总之,由于在SN1反应中生成了C+,因此引发了重
排,可以说碳架的重排是SN1反应的另一特点。
2020/1/31
9
4. SN1反应的速度与烷基结构的关系
O
R W + CF3COOH H W + ROCCF3
CH3
CH3
CH3 C W > CH3 CH W > CH3 CH2 W > CH3 W
碳正离子

碳正离子碳正离子是一种带正电的极不稳定的碳氢化合物。
分析这种物质对发现能廉价制造几十种当代必需的化工产品是至关重要的。
欧拉教授发现了利用超强酸使碳正离子保持稳定的方法,能够配制高浓度的碳正离子和仔细研究它。
他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物。
碳正离子与自由基一样,是一个活泼的中间体。
碳正离子有一个正电荷,最外层有6个电子。
带正电荷的碳原子以SP2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。
碳原子剩余的P轨道与这个平面垂直。
碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
它们稳定性的一般规律如下:(1)苄基型或烯丙型一般较稳定;(2)其它碳正离子是:3°>2°>1°;碳正离子越稳定,能量越低,形成越容易,加成速度也越快,可见碳正离子的稳定性决定烯烃加成的取向。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子碳负离子(Carbanion)指的是含有一个连有三个基团,并且带有一对孤对电子的碳的活性中间体。
碳负离子带有一个单位负电荷,通常是四面体构型,其中孤对电子占一个sp3 杂化轨道。
通过比较相应酸的酸性大小,可以大致判断碳负离子的稳定性大小。
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。
这些基团可以是苯基、电负性较强的杂原子(如O,N,基团如-NO2、-C(=O)-、-CO2R、-SO2-、-CN和-CONR2等)或末端炔烃(也可看作电负性的缘故),例如,三苯甲烷、三氰基甲烷、硝基甲烷和1,3-二羰基化合物具有较强的酸性。
除此之外,不同于缩酮,缩硫酮的α氢也具有较强的酸性。
这可以用硫的3d轨道与C-S键σ*轨道的超共轭效应来解释。
第五讲 高等有机碳正离子ppt课件

慢
水 解 COOC H 2 5
t Bu
a- 反应物稳定性低, 由于基团较小,过渡 态比基态有较小的空 间要求,所需活化能 少,反应活性高。
OH
慢
O
快
OH
66-14
c) 有时反应物的稳定性和反应活性之间没有规律。 稳定性
H C 3 HC CH CH 3
﹥
H C CH 3 3 HCCH
﹥
H C CH C H CH 2 3 2
66-11
② 反应活性(Reactivity)
反应活性是指物种反应速度的快慢,涉及反应活化能 E 的大小,是动力学性质。同一底物在不同反应条件下的活性 差别可能很大。 同一底物在不同反应条件下的活性差别很大。如,自 由基在惰性气氛下是很稳定的,一旦有氧气存在,其稳定 性又极差,生存期变得极短(活性变大),很快就反应掉 了。
中间体越稳定,越容易生成,相应的过渡态也越容易 形成,反应活性就越大。
66-16
5.2 碳正离子
碳正离子是有机化学反应中常见的活性中间体,对 它的稳定性和反应活性的研究对某些有机反应历程的阐 明是十分重要的,同时对碳正离子稳定性的研究,有助
于判断反应是按何种反应历程进行,有助于推断反应所 生成的主要产物。
66-4
反应机理所要解决的问题
反应是如何开始的? 产物生成的合理途径? 经过了什么中间体?
反应条件起什么作用? 决速步骤是哪一步? 副产物是如何生成的?
大部分有机反应都是经由活泼中间体而生成产物的, 活泼中间体是理解有机化学反应机理的关键。
66-5
过渡态与活泼中间体 过渡态 活化能Ea
与溴加成的相对速率:18:27:1 与氯加成的相对速率:50:63:1
第三章有机化学中的活性中间体ppt课件

二、 自由基的生成
主要有三种产生自由基的方法:热解、光解 和氧化还原。
1、热解 在加热的情况下,共价键可以发生均裂而产生自 由基。
RR
2R
常用的引发剂:过氧化苯甲酰(BPO)、偶氮二异丁 腈(AIBN).
OO
O
3C >
2CH>
CH2 >
CH2
当共轭体系上连有取代基时,供电子基团使正碳离子
稳定性增加;吸电子基团使其稳定性减弱:
CH3
CH2 >
CH2 > O2N
CH2
环丙甲基正离子比苄基正离子还稳定:
3C >
2CH > CH2 >
CH2
环丙甲基正离子的结构:
C
中心碳原子上的空的 p 轨道与环丙基中的弯曲 轨道进行侧面交盖,其 结果是使正电荷分散。
CC
HCl
CC
Cl
C O H C OH
C OH
3) 由其它正离子转化而生成
NH2 NaNO2
N2
N2
HCl
HH
Ph3CSbF6
SbF6
4) 在超酸中制备C正离子溶液
比100%的H2SO4的酸性更强的酸-超酸 (Super acid)
常见的超酸
与100%H2SO4的酸性比较
HSO3F (氟硫酸)
1000倍
三、影响正碳离子的稳定性的因素:
CH3 3C > CH3 2CH > CH3CH2 > CH3
1、σ- p超共轭效应:
轨道交盖在这里
H
空的 p 轨道
有机化学武汉大学2碳正离子PPT课件
2)反应的选择性是由碳正离子的稳定性决定的,双 键连有拉电子基团(CF3,X,OH,OR,OCOR)时,会
出现违反Markonikovs(马氏规则)的情况。
H F3C C CH2
+H-X
稳定性:
H
F3C C CH2
H
H F3C C CH2
HX H > F3C C CH2
H
CF3为拉电子基团
33
H 3 C B r
C 3 + H B r -
C 3 C 2 H B H rC 3 C 2 H + B r H -ΔH=184Kcal
CH3CHCH3 Br
CH 3
CH 3CC3H
Br
CH3CHCH3 + Br-
ΔH=164Kcal
CH 3 CH 3CC3H+Br-
ΔH=149Kcal
10
不同结构的C+能量不同,生成C+的能量越少,说明C+所 具有的能量越低,越稳定,由上可知,C+的稳定性为:
C CH2
0~10 0C
H3C C C
C3 HH
CH3 C CH3 H
异 辛 烷
30
历程
H3C
CH3
C CH2 H
H3C
CH3 C
H2C CH3
CH3
H3C C CH3
CH3
C CH3 H3C
CH3 H CC
CH3 H
C
CH3 C CH3 CH3
H3C
CH3 H CC CH3 H
CH3
C H + H3C
Br S
H
CH3
Br
H CH3
第三章碳正离子

举例:
CH 3 H 3 C C Br
CH 3
Rate -limiting step
H3C
CH 3 C+
CH 3
Fast + Br -
step
OH 2
H
CH 3 H 3 C C OH
CH 3
OH 2
H3C
CH 3 H
CO
H CH 3
34
SN1 反应势能图:
G# RX + :Nu -
R + + :X Carbocation intermediate
pKR+=log[R+]/[ROH] + HR
当反应达到平衡、 [R+]=[ROH]时,pKR+ = HR (酸度函 数);
pKR+ 愈大, 碳正离子愈稳定。
H
7
China Pharmaceutical University
一些碳正离子的pKR+值
碳正离子
三苯基甲基 4-甲氧基三苯基甲基 4-硝基三苯基甲基 二苯基甲基 三环丙基甲基 环庚三烯正离子 三苯基环丙烯基
AcOH
+ OBs
OAc
5
OBs
6
7
4
1
+
3
2
OAc
OAc
7
4
5
OAc
6
3
1
2
有旋光
3
4
7
5
外消旋 OAc 1
2Leabharlann 6OAc7
4
5
6
4
3
5
1
+2
3
6
武汉大学有机化学课件YOUJI-1[3]新
![武汉大学有机化学课件YOUJI-1[3]新](https://img.taocdn.com/s3/m/a22b9582b9d528ea81c77963.png)
3°正碳 离子,较 低活化能 即可生成。
CH3CH2CH=CH2 + HBr
HAc
80%
CH3CH2CHCH3 Br
(CH3)2C=CH2 + HCl
100%
(CH3)2C-CH3 Cl CH3CH2CH2CH2CHBrCH3 + CH3CH2CH2CHBrCH2CH3
CH3CH2CH2CH=CHCH3 + HBr
F3C CH CH2 H F3C CH CH2 H
正碳离子Ⅰ 正碳离子Ⅱ
F3C
CH CH2 H
三氟甲基的强烈-I作用使碳正离 子Ⅰ不稳定。
F3C CH2 CH2
三氟甲基的强-I作用距离正离子较远, 作用较弱,因而碳正离子Ⅱ较稳定。
(3)重排问题
甲基迁移
(CH3)3CCHCH3
HCl
+
(CH3)2C-CH(CH3)2
YE
3 烯烃与卤素的加成
反应式
CCl4 0oC
(CH3)2CHCH=CHCH3 + Br2
(CH3)2CHCHBrCHBrCH3
(CH3)3CCH=CH2 + Cl2
CCl4 50oC
(CH3)3CCHClCH2Cl
反应机理
C C + δ Br
+
δ Br
-
慢 Br-
C
C Br
or
C
C Br
(Ⅰ) 快 BrBr
δ
δ
C C
X
C C X
C C X
讨
(1) 速率问题
论
*1 HI > HBr > HCl *2 双键上电子云密度越高,反应速率 越快。
第三章碳正离子

NO2
+ H2SO4
H
4
China Pharmaceutical University
2、结构
经典碳正离子(Carbenium ion):
中心碳原子sp2 杂化 与其他三个基团或原子以σ键相连 形成具平面的构型
H
5
China Pharmaceutical University
。 一些情形下,键角不是120,或者不是平面结构。
如:
H3C
。
+
>120
CH
H3C
+
C
=
HH
H
6
China Pharmaceutical University
3、稳定性及研究方法
碳正离子的相对稳定性可由其pKR+来定量表示:
R+ + H2O
ROH + H+
, [ROH][H+ ]
KR+ =
p KR+ = log
[R+]
[R+]
+ p [H+]
[ROH]
H
30
China Pharmaceutical University
H
31
China Pharmaceutical University
H
32
China Pharmaceutical University
1.The SN1 Reaction
1) Kinetics of the SN1 Reaction first-order reaction v = k [RX]
为, 说明由邻近基团参与形成了原菠基非经典碳正离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4、与肝胆人共事,无字句处读书。——周恩来 5、阅读使人充实,会谈使人敏捷,写作使人精确。——培根有机化学武汉大 Nhomakorabea2碳正离子
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
