天一大联考 2017—2018学年高二下学期期末考试复习化学(附答案)
【精品】2017-2018学年全国各地高二(下)期末化学试卷(word解析版) (12份)

目录2017-2018学年天津一中高二(下)期末化学试卷以及答案解析2017-2018学年江苏省南京市金陵中学高二(下)期末化学试卷以及答案解析2017-2018学年黑龙江省双鸭山一中高二(下)期末化学试卷以及答案解析2017-2018学年黑龙江省伊春二中高二(下)期末化学试卷以及答案解析2017-2018学年黑龙江省绥化市青冈一中高二(下)期末化学试卷以及答案解析2017-2018学年吉林省延边州汪清六中高二(下)期末化学试卷以及答案解析2017-2018学年宁夏石嘴山市平罗中学高二(下)期末化学试卷以及答案解析2017-2018学年内蒙古乌兰察布市集宁一中西校区高二(下)期末化学试卷以及答案解析2017-2018学年青海省西宁四中高二(下)期末化学试卷以及答案解析2017-2018学年新疆石河子二中高二(下)期末化学试卷以及答案解析2017-2018学年辽宁省大连市渤海高级中学高二(下)期末化学试卷以及答案解析2017-2018学年陕西省宝鸡中学高二(下)期末化学试卷以及答案解析2017-2018学年天津一中高二(下)期末化学试卷一、选择题(每小题有1个正确答案)1.(2分)下列说法错误的是()A.当运动员肌肉挫伤时.可向受伤部位喷射药剂氯乙烷(化学式为C2H5Cl,沸点为12.3℃),进行局部冷冻麻醉处理,氯乙烷用于冷冻麻醉与其沸点较低,易挥发吸热有关B.福尔马林可用作食品的保鲜剂C.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用D.对医疗器械高温消毒时,病毒蛋白质受热变性2.(2分)由2﹣氯丙烷制取少量的1,2﹣丙二醇时,需要经过下列哪几步反应()A.加成→消去→取代B.消去→加成→水解C.取代→消去→加成D.消去→加成→消去3.(2分)下列关于“油”的叙述不正确的是()A.将石油通过常压蒸馏所得到的汽油主要成分是烷烃B.人造黄油的主要成分是饱和高级脂肪酸甘油酯C.以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相同D.乙醇汽油替代汽油将大大节省化石能源4.(2分)下列有机物在常温下呈液态的是()A.甲醛B.一氯甲烷C.三亚油酸甘油酯 D.苯甲酸5.(2分)下列有机物分离提纯的方法正确的是()A.除去苯中少量苯酚,加入适量浓溴水,过滤B.除去乙烷中的乙烯,把混合气体通入酸性高锰酸钾溶液中C.除去乙醇中的氢氧化钠,用蒸馏法D.提纯蛋白质时可先加入(CH3COO)2Pb 溶液,过滤后再加水重新溶解6.(2分)某一定量有机物和足量Na反应得到V a L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得V b L二氧化碳,若在同温同压下V a=V b≠0,则该有机物可能是()①CH3CH(OH)COOH ②HOOC﹣COOH ③CH3CH2COOH ④HOOCCH2CH(OH)CH2COOH⑤CH3CH(OH)CH2OH.A.②B.②③④C.只有④D.①7.(2分)下列说法正确的是()A .的名称为2,2,4﹣三甲基﹣4﹣戊烯B.化合物CH3CH2NHCHO 属于醛C .分子中最多10 个碳原子共平面D.通式相同的两种有机物要么互为同系物要么互为同分异构8.(2分)符合下列分子式的物质中不可能只含一种氢的是()A.C6H6B.C6H4Br2C.C5H10Cl2D.C4H9Br9.(2分)下列选项中的两种物质属于官能团异构的是()A.1﹣氯丙烷和2﹣氯丙烷 B.乙苯和对二甲苯C.乙酸甲酯和丁酸 D.1﹣丁醇和乙醚10.(2分)苯甲酸粗品中含有泥沙和NaCl 杂质,可通过系列操作完成苯甲酸的提纯。
2017-2018学年高二下学期期末考试化学试卷 含答案

海南中学2017-2018学年第一学期期末高二选修4 化学反应原理考试试题可能用到的元素相对原子质量:C-12,H-1,O-16,N-14,Ag-108,Pb-207,Cl-35.5,Cu-64,Zn-65第Ⅰ卷(共44分)一、单选题(本题包括10小题,每题2分,共20分,每小题仅一个正确答案)1.当今世界面临日益加剧的能源危机,下列关于能源的描述不正确的是()A.提高燃料的利用效率是解决能源危机的方向B.正在探索的新能源有太阳能、氢能、风能、海洋能和生物质能等.C.新能源的优点是可以再生、没有污染或者很少污染D.燃烧热是评价燃料优劣的唯一标准.2.25℃时,向纯水中加入NaOH,使溶液的pH=11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为()A.1010:1B. 5×109:1C.108:1D.1:13.在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是()A.反应混和物各组分的浓度B.反应物的转化率C.正、逆反应速率D.反应混和物的压强4.在下述条件下,一定..能大量共存的离子组是()A.无色透明的水溶液中:K+、Ba2+、I-、MnO4-B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+C.c(HCO3-)=0.1 mol·L-1的溶液中:Na+、K+、CO32-、Br-D.强碱性溶液中:ClO-、S2-、HSO3-、Na+5.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是()A.加热B.不用稀硫酸,改用98%的浓硫酸C.滴加少量CuSO4溶液D.不用铁片,改用铁粉6.下列溶液中各微粒的浓度关系错误的是()A.0.1 molL﹣1 CH3COOH溶液中:c(CH3COO﹣)+c(OH﹣)=c(H+)B.0.1 molL﹣1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32﹣)+c(OH﹣)C.25℃时,有等浓度的①NH4HSO4溶液、②NH4HCO3溶液中c(NH4+):①>②D.含等物质的量的NaX和弱酸(HX)混合溶液中一定存在:c(Na+)>c(X ﹣)7.高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车,总反应方程式如下:下列叙述不正确的是()A.该电池放电时的正极和充电时的阴极均发生还原反应B.放电时负极反应为:MH+OH——e—=M+H2OC.充电时阳极反应为:NiOOH+H2O+e—=Ni(OH)2+OH—D.放电时每转移1mol电子,正极有1molNiOOH被还原8.某课外活动小组,为研究金属的腐蚀与防护的原理,做了如下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图的装置进行实验,过一段时间后观察。
2017-2018学年高二化学下学期期末联考试题(含解析)

教学资料参考范本2017-2018学年高二化学下学期期末联考试题(含解析)撰写人:__________________部门:__________________时间:__________________第 I卷(选择题,共48分)A. AB. BC. CD. D【答案】D【解析】分析:A. 水解是吸热的,热溶液中碳酸钠水解程度大,碱性强;B.部分氧气在雷达作用下转化成臭氧;C. 牙齿中的羟基磷灰石能与牙膏里的氟离子转化成更难溶的氟磷灰石;D.铜绿的生成是由于发生了吸氧腐蚀。
详解:A. 热溶液中碳酸钠水解程度大,碱性强,因此热纯碱溶液比冷纯碱溶液除油污效果好,A正确;B.雷雨过后空气中O3含量增加、尘埃减少,所以感觉到空气特别的清新,B正确;C. 使用含氟牙膏, 牙齿中的羟基磷灰石与牙膏里的氟离子转化成更难溶的氟磷灰石, 能防止龋齿,C正确;D.铜合金水龙头使用长了会生成铜绿,是由于发生了吸氧腐蚀,D错误;答案选D.点睛:较强的酸性条件下发生析氢腐蚀,弱酸性、中性和碱性条件下发生吸氧腐蚀,吸氧腐蚀比析氢腐蚀更普遍。
2. 下列措施中,不能加快化学反应速率的是A. 往H2O2溶液中加入少量二氧化锰B. 稀硫酸与锌粒反应时加入几滴CuSO4溶液C. 高炉炼铁时将铁矿石粉碎D. 向铁片和稀盐酸的混合物中加入一定量的CH3COONa晶体【答案】D【解析】分析:增大反应速率,可升高温度、增大浓度、压强、增大固体表面积或加入催化剂等,以此解答该题.详解:A.二氧化锰可以作为H2O2分解的催化剂,能加快化学反应速率,A错误;B. 锌粒与CuSO4溶液反应生成单质铜,锌与铜能形成原电池,加快反应速率,B错误;C. 高炉炼铁时将铁矿石粉碎,能增大固体表面积,加快化学反应速率,C错误;D. CH3COONa与盐酸反应生成醋酸,降低氢离子的浓度,使反应速率减慢,D正确;答案选D.点睛:形成原电池,能加快化学反应速率。
3. 下列实验现象不能说明相应的化学反应一定是放热反应的是。
2017~2018学年第二学期期末考试高二化学答案
2017~2018学年第二学期期末考试高二化学参考答案第Ⅰ卷选择题(共55分)一、选择题(本题包括5小题,每小题2分,共10分。
每小题只有一个选项符合题意)1 2 3 4 5C BD B A二、选择题(本题包括15小题,每小题3分,共45分。
每小题只有一个选项符合题意)6 7 8 9 10 11 12 13 14 15C B C A BD A C D D16 17 18 19 20B D AC A第Ⅱ卷非选择题(共45分)三、填空题(本题包括4小题,共45分。
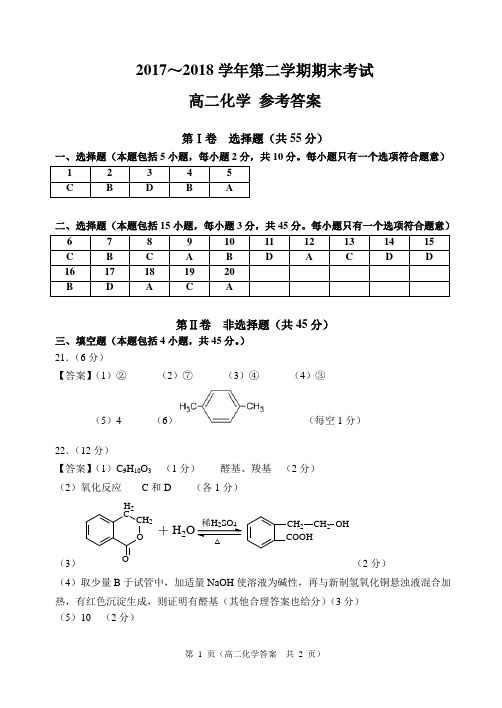
)21.(6分)【答案】(1)②(2)⑦(3)④(4)③(5)4 (6)(每空1分)22.(12分)【答案】(1)C9H10O3(1分)醛基、羧基(2分)(2)氧化反应C和D (各1分)(3)OOCCH2H2+H2O24COOHCH2CH2OH△(2分)(4)取少量B于试管中,加适量NaOH使溶液为碱性,再与新制氢氧化铜悬浊液混合加热,有红色沉淀生成,则证明有醛基(其他合理答案也给分)(3分)(5)10 (2分)23.(12分)【答案】(1) 三颈烧瓶或答圆底烧瓶、三口瓶都可(1分)(2)B中水面会下降,玻璃管中的水柱会上升,甚至溢出(2分)(3)CH3CH2OH CH2=CH2↑+H2O (2分)CH2=CH2+Br2→CH2BrCH2Br (2分)(4)c (2分)(5)蒸馏(1分)(6)1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞(2分)24.(15分)【答案】(1)苯甲醇(1分)消去反应(1分)(2)羧基(1分)(2分)(3)CBr3CH2Br+△CCH3OHCH2OH+2NaBr(3分)(4)C COOHCH3HOnCCH3COOnOHH+(n-1)H2O(3分)(5)CH CH CH3、CH2CH CH2(各2分)。
河南天一大联考2017-2018高二化学11月阶段性测试含答案

河南天一大联考2017-2018高二化学11月阶段性测试(含答案)绝密★启用前天一大联考2017-2018学年高二年级阶段性测试(一)化学考生注意:1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小題答案后,用铅冕把答題卡对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号;回答非选择題时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答題卡一并交回。
可能用到的相对原子质量:H1C12016一、选择题:本题共16小题,每小题3分,共48分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.氢能的制取、贮存及利用的示意图如下:下列说法错误的是A.氢能属于二次能源B.水电解产生氢气的同时放出能量C.燃料电池可实现由化学能转变为电能D.太阳能、风能、水能及氢能都属于新能源2.四支试管中均盛有4KMnO4溶液.使其在不同的条件下分别与H2C204溶液反应褪色时间最短的是3.下列措施能使C(s)+H20(g)=CO(g)+H2(g)A.升高温度B.增大压强C.加入催化剂D.增大碳的量4.高温下脱氮反应:N20(g)+C0(g)转化率,可采取的措施是A.增大压强B.升高温度C.加入催化剂D.D起始时增大n(CO)/n(N20)5.在25℃和的101kPa下,1g乙炔完全燃烧生成C02与H2O(I)时,放出5O.OkJ热量。
下列执化学方程式正确的是6.在某闭容器中发生反应:CO(g)+H20(g)=CO2(g)+H2(s)△H0。
下列措施能使反应速率加快的是A.及时分离出C02B.恒容,通入ArC.恒压,通入ArD.恒容,通入CO7.H2O2在有、无催化剂条件下的反应为2H202(I)=2H20(1)+02(g),其能里与反应进程关系的曲线如下图所示:下列说法正确的是A.该反应的△HS0B.该反应的△H0C.催化剂可改变反应的熔变D.反应进程中没有化学键断裂与生成8.高温下,在恒容密闭容器中发生反应:NH3(s)+CH4(g)=HCN(g)+3H2(g)。
河南省天一大联考2017-2018学年高考化学模拟试卷 Word版含解析
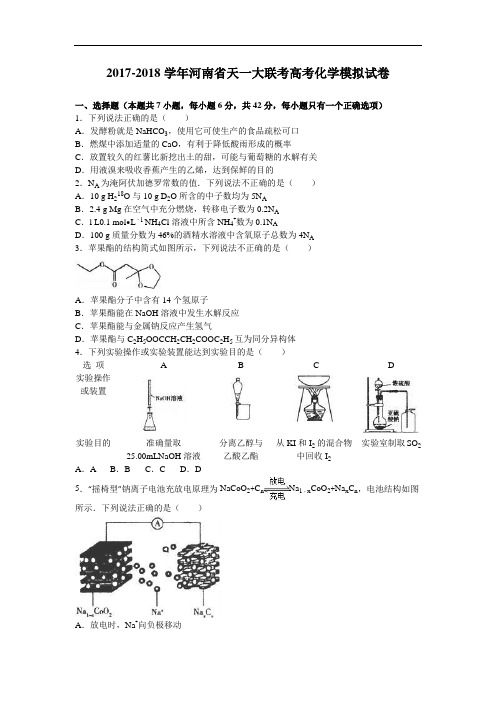
2017-2018学年河南省天一大联考高考化学模拟试卷一、选择题(本题共7小题,每小题6分,共42分,每小题只有一个正确选项)1.下列说法正确的是()A.发酵粉就是NaHCO3,使用它可使生产的食品疏松可口B.燃煤中添加适量的CaO,有利于降低酸雨形成的概率C.放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关D.用液溴来吸收香蕉产生的乙烯,达到保鲜的目的2.N A为淹阿伏加德罗常数的值.下列说法不正确的是()A.10 g H218O与10 g D2O所含的中子数均为5N AB.2.4 g Mg在空气中充分燃烧,转移电子数为0.2N AC.l L0.1 mol•L﹣l NH4Cl溶液中所含NH4+数为0.1N AD.100 g质量分数为46%的酒精水溶液中含氧原子总数为4N A3.苹果酯的结构简式如图所示,下列说法不正确的是()A.苹果酯分子中含有14个氢原子B.苹果酯能在NaOH溶液中发生水解反应C.苹果酯能与金属钠反应产生氢气D.苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体5.“摇椅型”钠离子电池充放电原理为NaCoO2+C n Na1CoO2+Na x C n,电池结构如图﹣x所示.下列说法正确的是()A.放电时,Na+向负极移动B.放电时,钴的化合价升高C.充电时,阴极的质量减小CoO2+xNa+D.充电时,阳极的电极反应式为NaCoO2﹣xe﹣═Na1﹣x6.W、X、Y、Z为元素周期表中短周期主族元素,W原子K、M层电子数之和是其核电荷数的一半,X与、W处于同一周期,虽为同周期原子半径最小的金属元素,Y原子K、L 层电子数之比为1:2,Y、Z处于同一周期,四种元素最外层电子数之和为18.下列说法正确的是()A.原子序数大小顺序为Z>Y>XB.W、X的简单离子能抑制水的电离C.单质的熔点大小顺序为X>W>YD.原子半径大小顺序为X>Y>Z7.pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4﹣)、pc(C2O42﹣)随着溶液pH的变化曲线如图所示:已知草酸的电离常数K=5.6×10﹣2,K=5.4×10﹣5下列叙述正确的是()A.曲线Ⅰ表示H2C2O4的变化B.pH=4时,c(HC2O4﹣)>c(C2O42﹣)C.c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)在a点和b点一定相等D.常温下,随PH的升高先增大后减小二、非选择题(本题共3小题,共43)8.NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:实验步骤如下:①打开装置D导管上的旋塞,加热制取氨气.②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热D并关闭旋塞.③向装置A中b容器内充入加热介质并加热到210一220℃,然后通入N2O.④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶.⑤过滤,用乙醚洗涤,晾干.已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解.回答下列问题:(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是.(2)装置B中盛放的药品为;装置C的主要作用是.(3)步骤①先加热通氨气的目的是;步骤②氨气与熔化的钠反应的方程式为.(4)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是.(5)N2O可由NH4NO3在240﹣245℃分解制得,该反应的化学方程式为.(6)步骤⑤用乙醚洗涤的主要目的是.(7)消防时,销毁NaN3常用NaClO溶液,将其转化为N2,该反应过程中得到的还原产物是.9.镍催化剂广泛应用于工业生产,利用废弃的含镍催化剂(含Al2O3、Ni、Fe、SiO2及少量的CaO)可制备金属镍,其制备工艺流程如图1所示:已知:K sp(CaF2)=1.46×10﹣10,K sp(NiC2O4)=4.05×10﹣10回答下列问题:(1)该工艺提取Ni的效率关键在于“酸浸”的效率,写出能增大酸浸速率的措施有(写出两种即可).“滤渣i”的成分为.(2)“除铁、铝”操作中加入Ni(OH)2的目的是.(3)分离“滤渣ii”中两种成分的简单方法是.(4)“除钙”操作中加入NH4F的离子方程式为,NH4F的电子式为(5)如果“沉镍”操作后测得滤液中C2O42﹣的浓度为0.0900mol•L﹣1,则溶液中c(Ni2+)=.(6)草酸镍晶体(NiC2O4•nH2O)在隔绝空气、高温分解时的质量损失率与温度的关系如图2所示:通过计算可知n=,草酸镍晶体受热分解制镍的化学方程式为.10.CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5﹣4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为.写出该条件下2与溶液反应生成3的热化学反应方程式.(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H.300℃时,一定量的CO2和H2混合气体在容积为2L的恒容密闭容.从反应开始到达到平衡时的反应速率v(CH4)=.500℃时该反应的平衡常数K=16,则该反应韵△H(填“>”或“<”)0.(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H(g)⇌CH3OH(g)+H2O(g)△H.①在容积为2L的恒容密闭容器中,通入2molCO2和3mol H2发生上述反应,下铡碳法能够表明该可逆反应达到平衡状态的是(填字母).a.消耗3mol H2(g)时,有lmol CH3OH(g)生成b.转移3mol电子时,反应的CO2为11.2L(标准状况)c.体系中气体的密度不变d.水蒸气的体积分数保持不变e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3:1②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为.若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12mol电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120mL,则此时乙装置中溶液的pH=假设食盐水中有足量的NaCl,且Cl2完全逸出).三、化学•选修2:化学与技术11.采用软锰矿浆(主要成分为Mn02,还含有Fe2O3、FeO、NiO、CoO等杂质)对工业烟气脱硫是工业生产中的一项新技术,该技术在脱硫的过程中还可以生产金属锰及化学肥料.该工艺流程如下图:(1)步骤①的反应器为“喷射鼓泡反应器,即将高速废气流通入到一定液固比的软锰矿浆中,并不断搅拌,采用这种设备的好处是,该反应的还原产物为.(2)写出步骤②中反应的离子方程式:(3)若步骤③调节pH使用的是NaOH溶液,则导致的后果是.(4)步骤④加入(NH4)2S的目的是除去溶液中的Ni2+、Co2+,加入(NH4)2S时溶液的pH最好控制在6.0以下,原因是.(5)步骤⑤所用设备名称为.(6)步骤⑥的化学肥料为,该肥料加入到步骤⑤中的作用是.四、化学•选修3:物质结构与性质12.硫及其化合物具有广泛的用途.回答下列问题:(l)Se与S同主族,且为相邻周期,基态Se原子核外电子排布式为若ls22s22p63s13p5是S原子的核外电子排布式,出现这种排布现象的原因是.(2)过渡金属的硫酸盐中形成的配合物较多.如Co(NH3)5ClSO4就是一种配合物,Co 化合价为,其中含有的化学键类型有,在该配合物水溶液中,滴加BaCl2溶液,有白色沉淀,而另取配合物溶液滴加硝酸酸化的AgNO3溶液,则无沉淀生成,则该配合物中配位原子是(3)含硫的有机物具有广泛的用途.如硫代乙酰胺(CH3CSNH2)可用于生产催化剂、农药等,其中两个碳原子的杂化轨道类型分别为,1mol硫代乙酰胺含有molσ键,molπ键.(4)硫化铜纳米晶体在光热疗领域引起广泛关注.图是CuS的晶胞结构,该晶胞的棱长为apm,则CuS的密度为g•cm﹣3(N A表示阿伏加德罗常数的值,用代数式表示,下同),最近的Cu2+与S2﹣间的距离为pm.五、化学选修5:有机化学基础13.丙烯(CH3CH═CH2)是重要的有机化工原料,以丙烯为起始原料制备F的合成路线如图所示:已知:①B中核磁共振氢谱有3组峰;②E的摩尔质量为194g•mol﹣1;③F为高分子化合物;④RCOOR′+R n18OH RCO18OR″+R′OH.回答下列问题:(1)A含有的官能团是,B的名称是.(2)①的反应类型是,③的反应类型是.(3)D的结构简式为;F的结构简式为.(4)E中最多有个原子共平面.(5)同时满足下列条件的D的同分异构体有种,其中核磁共振氢谱中有3组峰,且峰面积之比为1:1:1的结构简式为.i.与NaHCO3溶液反应有气体产生ii.结构中除苯环外无其它环状结构,且苯环上有2个支链(6)参照上述F的合成路线,设计一条由甲苯为唯一有机原料制作苯甲酸甲酯()的合成路线.2016年河南省天一大联考高考化学模拟试卷参考答案与试题解析一、选择题(本题共7小题,每小题6分,共42分,每小题只有一个正确选项)1.下列说法正确的是()A.发酵粉就是NaHCO3,使用它可使生产的食品疏松可口B.燃煤中添加适量的CaO,有利于降低酸雨形成的概率C.放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关D.用液溴来吸收香蕉产生的乙烯,达到保鲜的目的【考点】物质的组成、结构和性质的关系.【分析】A.把NaHCO3作为发酵粉使用时,往往加入少量的明矾;B.CaO与二氧化硫反应;C.葡萄糖为单糖,不能水解;D.溴有毒,不能用于水果保鲜.【解答】解:A.发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,把NaHCO3作为发酵粉使用时,往往加入少量的明矾,故A错误;B.向煤中掺入生石灰,在氧气参与反应和高温的条件下,用来吸收SO2,只生成硫酸钙,可以减少SO2的排放,故B正确;C.葡萄糖不能水解,淀粉水解生成葡萄糖,故C错误;D.用高锰酸钾溶液吸收水果产生的乙烯,能达到保鲜的目的,溴有毒,故D错误.故选B.2.N A为淹阿伏加德罗常数的值.下列说法不正确的是()A.10 g H218O与10 g D2O所含的中子数均为5N AB.2.4 g Mg在空气中充分燃烧,转移电子数为0.2N AC.l L0.1 mol•L﹣l NH4Cl溶液中所含NH4+数为0.1N AD.100 g质量分数为46%的酒精水溶液中含氧原子总数为4N A【考点】阿伏加德罗常数.【分析】A、求出10 g H218O与10 g D2O的物质的量,然后根据H218O与D2O中均含10个中子来分析;B、求出镁的物质的量,然后根据镁反应后变为+2价来分析;C、铵根离子为弱碱阳离子,在溶液中会水解;D、酒精溶液中,除了酒精外,水也含氧原子.【解答】解:A、10 g H218O与10 g D2O的物质的量均为0.5mol,而H218O与D2O中均含10个中子,而0.5mol两者中含有的中子数均为5N A个,故A正确;B、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁失去0.2N A个电子,故B正确;C、铵根离子为弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.1N A个,故C错误;D、酒精溶液中,除了酒精外,水也含氧原子,而100g46%乙醇溶液中乙醇的质量为46g,物质的量为1mol,含1mol氧原子;而水的质量为54g,物质的量为3mol,含氧原子3mol,故溶液中的氧原子的个数共为4N A个,故D正确.故选C.3.苹果酯的结构简式如图所示,下列说法不正确的是()A.苹果酯分子中含有14个氢原子B.苹果酯能在NaOH溶液中发生水解反应C.苹果酯能与金属钠反应产生氢气D.苹果酯与C2H5OOCCH2CH2COOC2H5互为同分异构体【考点】有机物的结构和性质.【分析】苹果酯含有酯基,可发生水解反应,结合有机物结构简式确定分子式,以判断H 原子数以及同分异构体,以此解答该题.【解答】解:A.由结构简式可知有机物分子式为C8H14O4,则含有14个氢原子,故A正确;B.含有酯基,可在碱性条件下水解,故B正确;C.只有酯基和醚基,与钠不反应,故C错误;D.苹果酯与C2H5OOCCH2CH2COOC2H5的分子式都为,但结构不同C8H14O4,互为同分异构体,故D正确.故选C.【考点】化学实验方案的评价.【分析】A.酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液;B.互溶且沸点相差较大的液体应该采用蒸馏方法分离,互不相溶的液体采用分液方法分离;C.碘易升华,加热时碘生成碘蒸气,该实验无法回收碘;D.浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,应该采用向上排空气法收集.【解答】解:A.酸式滴定管只能量取酸性溶液,碱式滴定管只能量取碱性溶液,所以NaOH 溶液应该用碱式滴定管量取,故A错误;B.互溶且沸点相差较大的液体应该采用蒸馏方法分离,互不相溶的液体采用分液方法分离,乙醇和乙酸乙酯互溶,应该采用蒸馏方法分离,故B错误;C.碘易升华,加热时碘生成碘蒸气,该实验无法回收碘,所以无法实现实验目的,故C错误;D.浓硫酸和亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,应该采用向上排空气法收集,所以能实现实验目的,故D正确;故选D.CoO2+Na x C n,电池结构如图5.“摇椅型”钠离子电池充放电原理为NaCoO2+C n Na1﹣x所示.下列说法正确的是()A.放电时,Na+向负极移动B.放电时,钴的化合价升高C.充电时,阴极的质量减小CoO2+xNa+D.充电时,阳极的电极反应式为NaCoO2﹣xe﹣═Na1﹣x【考点】原电池和电解池的工作原理.【分析】根据电池反应式知,负极反应式为Na x C6﹣xe﹣=C6+xNa+、正极反应式为Na1﹣x CoO2+xNa++xe﹣=NaCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,据此分析解答.【解答】解:A.根据图片知,放电时,Na+向正极移动,故A错误;B.从总反应中可知,放电时,钴的化合价降低,故B错误;C.充电时,阴极得电子发生还原反应,阴极反应式为Na x C6﹣xe﹣=C6+xNa+,质量增重,故C错误;CoO2+xNa+,故D正确.D.充电时,阳极的电极反应式为NaCoO2﹣xe﹣═Na1﹣x故选:D.6.W、X、Y、Z为元素周期表中短周期主族元素,W原子K、M层电子数之和是其核电荷数的一半,X与、W处于同一周期,虽为同周期原子半径最小的金属元素,Y原子K、L 层电子数之比为1:2,Y、Z处于同一周期,四种元素最外层电子数之和为18.下列说法正确的是()A.原子序数大小顺序为Z>Y>XB.W、X的简单离子能抑制水的电离C.单质的熔点大小顺序为X>W>YD.原子半径大小顺序为X>Y>Z【考点】原子结构与元素周期律的关系.【分析】W原子K、M层电子数之和是其核电荷数的一半,设M层电子数为x,则2×(2+x)=2+x+8,x=6,W为S元素,X与、W处于同一周期,为同周期原子半径最小的金属元素,则X为Al元素,Y原子K、L层电子数之比为1:2,应为C元素,Y、Z处于同一周期,四种元素最外层电子数之和为18,则Z的最外层电子数为18﹣6﹣3﹣4=5,则Z为N元素,以此解答该题.【解答】解:W原子K、M层电子数之和是其核电荷数的一半,设M层电子数为x,则2×(2+x)=2+x+8,x=6,W为S元素,X与、W处于同一周期,为同周期原子半径最小的金属元素,则X为Al元素,Y原子K、L层电子数之比为1:2,应为C元素,Y、Z处于同一周期,四种元素最外层电子数之和为18,则Z的最外层电子数为18﹣6﹣3﹣4=5,则Z 为N元素,A.由以上分析可知原子序数大小顺序为Al>N>C,故A错误;B.W、X的简单离子都可发生水解,促进水的电离,故B错误;C.C的单质中金刚石、石墨熔点较高,大于铝、硫等晶体,故C错误;D.一般来说,原子核外电子层数越多,半径越大,同周期原子从左到右半径逐渐减小,则原子半径大小顺序为X>Y>Z,故D正确.故选D.7.pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4﹣)、pc(C2O42﹣)随着溶液pH的变化曲线如图所示:已知草酸的电离常数K=5.6×10﹣2,K=5.4×10﹣5下列叙述正确的是()A.曲线Ⅰ表示H2C2O4的变化B.pH=4时,c(HC2O4﹣)>c(C2O42﹣)C.c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)在a点和b点一定相等D.常温下,随PH的升高先增大后减小【考点】弱电解质在水溶液中的电离平衡.【分析】H2C2O4⇌H++HC2O4﹣,HC2O4﹣⇌H++C2O42﹣,PH增加促进电离平衡正向移动,所以由图可知:曲线Ⅰ是HC2O4﹣的物质的量浓度的负对数,曲线Ⅱ是H2C2O4的物质的量浓度的负对数,曲线Ⅲ是C2O42﹣的物质的量浓度的负对数,由此分析解答.【解答】解:A、曲线Ⅰ表示HC2O4﹣的物质的量浓度的负对数的变化,而不是H2C2O4的变化,故A错误;B、pH=4时,pc(C2O42﹣)>pc(HC2O4﹣),所以c(HC2O4﹣)>c(C2O42﹣),故B正确;C、在a点pc(HC2O4﹣)=pc(H2C2O4),所以c(HC2O4﹣)=c(H2C2O4),而b点pc(HC2O4﹣)=pc(C2O42﹣)即c(HC2O4﹣)=c(C2O42﹣),所以不能说明c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)在a点和b点是否相等,故C错误;D、常温下,的分子和分母同乘以氢离子的浓度,即为,只要温度不变,比值不变,故D错误;故选B.二、非选择题(本题共3小题,共43)8.NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:实验步骤如下:①打开装置D导管上的旋塞,加热制取氨气.②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热D并关闭旋塞.③向装置A中b容器内充入加热介质并加热到210一220℃,然后通入N2O.④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶.⑤过滤,用乙醚洗涤,晾干.已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解.回答下列问题:(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是反应过程可能生成的NaOH能腐蚀玻璃.(2)装置B中盛放的药品为碱石灰;装置C的主要作用是冷凝分离出水.(3)步骤①先加热通氨气的目的是排尽装置中的空气;步骤②氨气与熔化的钠反应的方程式为2Na+2NH32NaNH2+H2.(4)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是水的沸点为100℃,不能达到反应控制的温度210一220℃.(5)N2O可由NH4NO3在240﹣245℃分解制得,该反应的化学方程式为NH4NO3N2O↑+2H2O↑.(6)步骤⑤用乙醚洗涤的主要目的是减少晶体的损失,有利于产品快速干燥.(7)消防时,销毁NaN3常用NaClO溶液,将其转化为N2,该反应过程中得到的还原产物是NaCl.【考点】制备实验方案的设计.【分析】(1)反应过程中会产生NaOH,腐蚀玻璃;(2)制备的氨气中含有大量的水,用C冷凝分离出水,B中盛放碱石灰干燥氨气;(3)加热时空气中的氧气等能与钠反应,用氨气排尽装置中的空气;步骤②制备NaNH2,还生成氢气;(4)水的沸点为100℃,不能达到控制的温度;(5)N2O可由NH4NO3在240﹣245℃分解制得,反应还生成水,利用待定系数法结合原子守恒配平;(6)NaN3不溶于乙醚,减少晶体的损失,有利于产品快速干燥;(7)NaN3与NaClO溶液反应转化为N2,氯元素被还原生成氯化钠.【解答】解:(1)反应过程中有水生成,会反应生成NaOH腐蚀玻璃,故答案为:反应过程可能生成的NaOH能腐蚀玻璃;(2)制备的氨气中含有大量的水,用C装置冷凝分离出水,B中盛放碱石灰干燥氨气,故答案为:碱石灰;冷凝分离出水;(3)用氨气排尽装置中的空气,防止加热时空气中的氧气等能与钠反应,步骤②制备NaNH2,还生成氢气,反应方程式为:2Na+2NH32NaNH2+H2,故答案为:排尽装置中的空气;2Na+2NH32NaNH2+H2;(4)水的沸点为100℃,不能达到反应控制的温度210一220℃,故用油浴加热,故答案为:水的沸点为100℃,不能达到反应控制的温度210一220℃;(5)N2O可由NH4NO3在240﹣245℃分解制得,反应还生成水,反应方程式为:NH4NO3N2O↑+2H2O↑,故答案为:NH4NO3N2O↑+2H2O↑;(6)NaN3不溶于乙醚,减少晶体的损失,有利于产品快速干燥,故答案为:减少晶体的损失,有利于产品快速干燥;(7)NaN3与NaClO溶液反应转化为N2,氯元素被还原生成氯化钠,故答案为:NaCl.9.镍催化剂广泛应用于工业生产,利用废弃的含镍催化剂(含Al2O3、Ni、Fe、SiO2及少量的CaO)可制备金属镍,其制备工艺流程如图1所示:已知:K sp(CaF2)=1.46×10﹣10,K sp(NiC2O4)=4.05×10﹣10回答下列问题:(1)该工艺提取Ni的效率关键在于“酸浸”的效率,写出能增大酸浸速率的措施有适当增大硫酸浓度升高温度(写出两种即可).“滤渣i”的成分为二氧化硅.(2)“除铁、铝”操作中加入Ni(OH)2的目的是调节溶液pH,使Fe3+、Al3+转化为沉淀.(3)分离“滤渣ii”中两种成分的简单方法是加入过量的氢氧化钠溶液,过滤得到氢氧化铁,在滤液中通入过量的二氧化碳,过滤得到氢氧化铝.(4)“除钙”操作中加入NH4F的离子方程式为2F﹣+Ca2+=CaF2↓,NH4F的电子式为(5)如果“沉镍”操作后测得滤液中C2O42﹣的浓度为0.0900mol•L﹣1,则溶液中c(Ni2+)= 4.5×10﹣9mol/L.(6)草酸镍晶体(NiC2O4•nH2O)在隔绝空气、高温分解时的质量损失率与温度的关系如图2所示:通过计算可知n=2,草酸镍晶体受热分解制镍的化学方程式为NiC2O4Ni+2CO2↑.【考点】制备实验方案的设计.【分析】废镍催化剂粉碎,增大与硫酸的接触面积,SiO2不与硫酸反应,滤渣i为二氧化硅,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,加入的是H2O2将Fe2+氧化为Fe3+,加入Ni(HO)2调节5.0<pH<6.7,使Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca 2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,加入分解得到Ni.(1)增大硫酸浓度、升高温度也可以增大酸浸速率;“滤渣i”的成分为二氧化硅;(2)加入Ni(HO)2调节溶液pH,使Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,(3)“滤渣ii”中含有氢氧化铁、氢氧化铝,用氢氧化钠溶解,过滤得到氢氧化铁,滤液中通入二氧化碳得到氢氧化铝;(4)加入适量NH4F溶液,生成CaF2沉淀;NH4F由铵根离子与氟离子构成;(5)根据K sp(NiC2O4)=c(C2O42﹣)×c(Ni2+)═4.05×10﹣10计算;(6)第一过程为失去结晶水,根据质量损失率计算n的值;第二过程为NiC2O4分解生成Ni,由C、O原子之比可知同时生成二氧化碳.【解答】解:废镍催化剂粉碎,增大与硫酸的接触面积,SiO2不与硫酸反应,滤渣i为二氧化硅,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,加入的是H2O2将Fe2+氧化为Fe3+,加入Ni(HO)2调节5.0<pH<6.7,使Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca 2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,加入分解得到Ni.(1)适当增大硫酸浓度、升高温度也可以增大酸浸速率;二氧化硅不硫酸反应,“滤渣i”的成分为二氧化硅,故答案为:适当增大硫酸浓度、升高温度;二氧化硅;(2)加入Ni(HO)2调节溶液pH,使Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,故答案为:调节溶液pH,使Fe3+、Al3+转化为沉淀;(3)“滤渣ii”中含有氢氧化铁、氢氧化铝,分离方法为:加入过量的氢氧化钠溶液,过滤得到氢氧化铁,在滤液中通入过量的二氧化碳,过滤得到氢氧化铝,故答案为:加入过量的氢氧化钠溶液,过滤得到氢氧化铁,在滤液中通入过量的二氧化碳,过滤得到氢氧化铝;(4)加入适量NH4F溶液,生成CaF2沉淀,反应离子方程式为:2F﹣+Ca2+=CaF2↓,NH4F由铵根离子与氟离子构成,电子式为,故答案为:2F﹣+Ca2+=CaF2↓;;(5)C2O42﹣的浓度为0.0900mol•L﹣1,根据K sp(NiC2O4)=c(C2O42﹣)×c(Ni2+)=4.05×10﹣10,可知c(Ni2+)=4.5×10﹣9mol/L,故答案为:4.5×10﹣9mol/L;(6)第一过程为失去结晶水,则=19.7%,解得n=2,第二过程为NiC2O4分解生成Ni,由C、O原子之比可知同时生成二氧化碳,反应方程式为:NiC2O4Ni+2CO2↑,故答案为:2;NiC2O4Ni+2CO2↑.10.CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5﹣4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为2+3CO(NH2)2+2O.写出该条件下2与溶液反应生成3的热化学反应方程式NaOH(aq)+CO2()═3()△﹣(﹣).(3)在一定温度和催化剂作用下,可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H.300℃时,一定量的CO2和H2混合气体在容积为2L的恒容密闭容5min= 1.6mol.从反应开始到达到平衡时的反应速率v(CH4)=0.16mol/(L•min).500℃时该反应的平衡常数K=16,则该反应韵△H<(填“>”或“<”)0.(4)CO2还可用于生产甲醇,一定条件下,发生反应CO2(g)+3H(g)⇌CH3OH(g)+H2O(g)△H.①在容积为2L的恒容密闭容器中,通入2molCO2和3mol H2发生上述反应,下铡碳法能够表明该可逆反应达到平衡状态的是de(填字母).a.消耗3mol H2(g)时,有lmol CH3OH(g)生成b.转移3mol电子时,反应的CO2为11.2L(标准状况)c.体系中气体的密度不变d.水蒸气的体积分数保持不变e.单位时间内生成H2(g)与生成H2O(g)的物质的量之比为3:1②用多孔石墨作电极,30% KOH溶液作电解质溶液,可设计如图甲所示的甲醇燃料电池,该电池的负极反应式为CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O.若将该燃料电池与电解饱和食盐水的装置进行串联(如图),当有0.12mol电子发生转移时,断开电源,将溶液冷却至室温,测得食盐溶液为120mL,则此时乙装置中溶液的pH=14假设食盐水中有足量的NaCl,且Cl2完全逸出).【考点】化学平衡的计算;热化学方程式;原电池和电解池的工作原理;化学平衡的影响因素;化学平衡状态的判断.【分析】(1)工业上利用高温、高压条件,可用CO2与NH3合成尿素[CO(NH2)2],该反应的化学方程式为:CO2+NH3CO(NH2)2+H2O;(2)根据题意可知,22gCO2通入1mol•L﹣1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L﹣1NaOH溶液2L中充分。
2017-2018学年高二下学期期末考试 化学 含答案

2018/2018学年度第二学期高二年级期终考试化 学 试 题可能用到的相对原子质量:H 1 Li 7 C 12 O 16 K 39 Zn 65选 择 题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
1.最近科学家Sutherland 等人利用H 2S 、HCN (氰化氢)和紫外线合成了核酸前体,将探索地球生命起源的研究向前推进了一大步。
下列说法不正确...的是 A .核酸存在于一切生物体中B .0.05mol·L -1H 2S 溶液pH=1C .HCN 的结构式为:H -C≡ND .HCN 和H 2S 均属于弱电解质 2.下列反应中,△H <0,△S <0的是A .C(s) + CO 2(g) = 2CO(g)B .NH 3(g) + HCl(g) = NH 4Cl(s)C .C(s) + H 2O(g) = CO(g)+H 2 (g)D .CaCO 3(s) = CaO(s)+ CO 2(g)3.下列滴定反应不需要...用指示剂的是 A .硝酸银标准溶液滴定含氯离子的溶液[Ag + + Cl - = AgCl↓] B .盐酸标准溶液滴定氨水[H + + NH 3·H 2O = NH 4+ + H 2O]C .Na 2S 2O 3标准溶液滴定含单质碘的溶液[I 2 + 2Na 2S 2O 3(无色) = Na 2S 4O 6 (无色)+2NaI]D .酸性高锰酸钾标准溶液滴定草酸溶液[2MnO 4-+5H 2C 2O 4+6H += 2Mn 2+(无色)+10CO 2↑+8H 2O]4.用下列装置进行实验,装置正确且能达到相应实验目的的是A .用图甲所示装置制备酚醛树脂B .用图乙所示装置测定盐酸浓度C .用图丙所示装置观察吸氧腐蚀D .用图丁所示装置验证产生乙烯5.常温下,下列各组离子一定能在指定溶液中大量共存的是A .能使甲基橙变红的溶液中:K +、Na +、CO 32-、AlO 2-B .能使酚酞变红的溶液中:Al 3+、Cu 2+、SO 42-、Cl -C .c (FeCl 3)=0.1mol·L -1的溶液中:Mg 2+、K +、SO 42-、NO 3-D .由水电离产生的c (H +)=1×10-13mol·L -1的溶液中:NH 4+、Na +、CH 3COO -、NO 3-6.下列有关物质性质或应用的说法不正确...的是 A .石油分馏可获得乙烯、丙烯和丁二烯B .盐析可提纯蛋白质并保持其生理活性C .从煤焦油中可分离出苯、甲苯及二甲苯甲 乙 丙 丁 稀酸性 高锰酸钾溶液乙醇 P 2O 5 苯酚 甲醛 浓盐酸 碳素钢钉食盐水红墨水 空气 溶液D .锂具有还原性、导电性和比能量高,可用作锂电池的负极材料 7.下列可逆反应平衡常数,其表达式或与有关常数的关系正确的是A .反应C(s) + H 2O(g) CO(g) + H 2(g) 的平衡常数为:22(CO)(H )(C)(H O)c c K c c ⋅⋅=B .反应Cr 2O 72-+H 2O 2CrO 42-+2H +的平衡常数为:222+42272(CrO )(H )(Cr O )(H O)c c K c c --⋅⋅= C .NH 4+ + H 2O NH 3·H 2O +H +的平衡常数为:32w(NH H O)b K K K ⋅=D .2AgI(s) + S 2-(aq)Ag 2S(s) + 2I -(aq)的平衡常数为:22(Ag S)(AgI)Ksp K Ksp =8.下列指定反应的离子方程式正确的是A .FeCl 3溶液中Fe 3+的水解:Fe 3+ + 3H 2O = Fe(OH)3↓+3H +B .用惰性电极电解MgCl 2溶液:2Cl - + 2H 2O 电解2OH -+ H 2↑+ Cl 2↑C .邻羟基苯甲酸中加入足量NaHCO 3溶液:OHCOOH+ 2HCO 3-O -COO-+ 2CO 2 ↑+2H 2OD .向含NaOH 的Cu(OH)2悬浊液中加入乙醛溶液并加热: CH 3CHO +2Cu(OH)2+ OH -△CH 3COO -+ Cu 2O ↓+3H 2O9.25℃时,下列有关曲线与对应的叙述正确的是A .图甲可表示体积均为V 0L 、pH 均为11的氨水与NaOH 溶液分别用水稀释至V L 情况,则b 曲线为氨水B .图乙可表示水溶液中H +与OH -的浓度变化曲线,则升高温度可实现a→bC .图丙可表示体积均为100mL 、 pH 均为3的盐酸与醋酸,分别与0.003gZn 反应,则a 表示盐酸D .图丁可表示体积为V 0L1 mol·L -1盐酸用水稀释至V L 情况,则0~a 范围内:pH = lg 0VV 10. NH 3—O 2碱性燃料电池的示意图如下,有关说法正确的是-7c (OH -)/mol·L -111 2甲 乙 丙 丁NH 3N 2,H 2OO 2,H 2O2OH -透过膜A .该电池总反应为:4NH 3 + 3O 2 = 2N 2+ 6H 2O B .a 极的电极反应为:2NH 3 -6e - = N2+ 6H + C .b 极的电极反应为:4OH- -4e - = 2H 2O + O 2↑ D .a 极每产生1molN 2,约有6×6.02×1023个OH -迁移至b 极不定项选择题:本题包括5小题,每小题4分,共计20分。
天一大联考2017—2018学年高二下学期期末考试复习化学(附答案)

天⼀⼤联考2017—2018学年⾼⼆下学期期末考试复习化学(附答案)天⼀⼤联考 2017—2018学年⾼⼆下学期期末考试复习化学(附答案)考⽣注意:1.答题前,考⽣务必将⾃⼰的姓名、考⽣号填写在试卷和答题卡上,并将考⽣号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每⼩题答案后,⽤铅笔杷答題卡对应题⽬的答案标号涂⿊。
如需改动,⽤橡⽪擦⼲净后,再选条其他答案标号。
回答⾮选择題时,将答案写在答题卡上。
写在本试卷上⽆效。
3.考试结束后,将本试卷和答題卡⼀并交同。
可能⽤到的相对及⼦质量:H 1 C 12 0 16 Se 79 Hg 201⼀、选择题:本题共16⼩题,分为必做题和选做题两部分,其中1-12题为必做题,每个试题考⽣都必须作答; 13-16题为选做题,考⽣根据要求作答。
每⼩题所铪的四个选项中,只有⼀项符台题⽬要求。
每⼩题3 分,共48分。
1.⼀种“将阳光和⽔转化为氢燃料”的新技术原理如下图所⽰。
下列说法正确的是A.氢能是⼆次能源B.图中能量转化⽅式只有⼀种C.⽔分解为氢⽓和氧⽓的同时放出能量D.装置⼯作时需不断补充CoFe204和FeAl2042.硫化钠是实验室常⽤试剂。
下列有关0.1 mol?L-1 Na2S溶液的说法正确的是A.10℃时c(S2-)⽐25℃时⼩B.加⽔稀释,溶液pH不断增⼤C. c (S2-) >c(HS-) >c(H2S)D. c(Na+)> +c(H+) =c(S2-) +c(HS-) +c(0H-)3. C3H6(丙烯)是液化⽯油⽓的主要成分之⼀。
25℃101kPa3时1.0 g丙烯完全燃烧,⽣成了稳定的氧化物,释放了 45.761 kJ热量。
下列热化学⽅程式正确的是4.下列说法正确的是A.电解精炼铜时,粗铜与外加直流电源的负极相连B.镀层破损后,镀锌铁⽚中铁⽐镀锡铁⽚中铁更耐腐蚀C.为减缓地下输油钢管镑蚀,将钢管与外加直流电源的正极相连D.银质奖牌表⾯键⾦时,可将奖牌与外加直流电源的正极相连5.恒容密闭容器中进⾏反应c(s) +NH3(g)=HCN(g) +H2(g),不能说明该反应已达到平衡状态的是B.容器内压强不再随时间变化⽽变化C.⽓体的密度不再随时间变化⽽变化D.单位时间内断裂的N—H键与断裂的H—H键数⽬之⽐为3:16.下列指定的离⼦⽅程式正确的是7.常温下,下列各组离⼦在指定溶液中能⼤量共存的是8.铜棒和银棒及AgN03和CuS04溶液可构成铜银原电池(如下图)。
2017-2018学年高二化学下学期期末考试试题 (I)

2017-2018学年高二化学下学期期末考试试题 (I)试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,时间100分钟。
注意事项:1、答卷前,考生务必将自己的班级、姓名、学号,座位号填写在答题纸上。
2、用2B铅笔将选择题的正确选项在答题卡上对应题目的答案标号处涂黑。
不能答在试卷上。
3、务必保持答题纸的整洁。
考试结束后,将答题卡、答题纸一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Ca-40 Zn-65一.选择题(每小题3分,每题只有一个选项符合题意)1.下列元素中,不属于...主族元素的是A.钾 B.铁 C.碘 D.硅2.下列各组三种元素中,属于同一周期的是A.C、H、O B.F、Cl、BrC.Li、Mg、B D.Si、S、P3.下列关于放射性气体氡222 86Rn的说法正确的是A.质量数为222 B.中子数为86C.质子数为136 D.核电荷数为2224.第三周期R元素的原子,其次外层的电子数为最外层电子数的2倍,则R是A.Li B.S C.Si D.P5.下列有关元素周期律的叙述中,正确的是A.氧化性强弱:F2<Cl2 B.金属性强弱:K<NaC.酸性强弱:H3PO4<H2SO4 D.碱性强弱:NaOH<Mg(OH)26.已知:① 2H2 (g) + O2 (g) = 2H2O (g) 2molH2燃烧放热Q1 kJ;②2 H2 (g) + O2 (g) = 2 H2O (l) 2molH2燃烧放热Q2 kJ;③H2 (g)+1/2 O2 (g) = H2O(g) 1molH2燃烧放热 Q3 kJ;其中Q1、Q2、Q3的大小关系为A.Q1 = Q2 = Q3 B.2Q3 = Q1 < Q2 C.Q3 < Q2 < Q1 D.Q1 < Q2 < 3Q37.航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其化学方程式可表示为:2NH4ClO4 = N2↑+ 4H2O↑+ Cl2↑+2O2↑△H<0(放热反应)下列对此反应的叙述中错误的是A.上述反应属于分解反应B.上述反应瞬间产生大量高温气体推动航天飞机飞行C.反应从能量变化上说,主要是化学能转变为热能和动能D.在反应中高氯酸铵只起氧化剂作用8.关于如图所示装置的叙述,正确的是A.铜是负极,铜片上有气泡产生 B.铜片质量逐渐减少C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原9.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是①锌片溶解了32.5 g②锌片增重32.5 g③铜片上析出l g H2 ④铜片上析出1 mol H2A.①和③ B.①和④ C.②和③ D.②和④10.X,Y,Z都是金属,把X浸入A ,Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为负极。
最新2017至2018高二下学期化学期末试题附全套答案

最新2017至2018高二下学期化学期末试题附全套答案考试时间:90分钟满分:100分可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cu-64第Ⅰ卷(选择题,共48分)选择题(本题包括16个小题。
每小题只有1个选项符合题意,每小题3分。
共48分)1.下列说法中正确的是A.吸热、熵增的非自发反应在高温条件下也可能转变为自发进行的反应B.熵增反应都是自发的,熵减反应都是非自发的C.放热反应都是自发的,吸热反应都是非自发的D.放热、熵增的自发反应在一定的条件下也可能转变为非自发反应2.已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ•mo l-12CH3OH(l)+3O2(g) === 2CO2(g)+4H2O(l) ΔH =-1452 kJ•mol-1H+(aq)+OH-(aq) === H2O(l) ΔH=-57.3 kJ•mol-1下列说法正确的是A.H2(g)的燃烧热为-571.6 kJ•mol-1B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多C.12H2SO4(aq)+12Ba(OH)2(aq) === 12BaSO4(s)+H2O(l)ΔH=-57.3 k J•mol-1D.3H2(g)+CO2(g) === CH3OH(l)+H2O(l) ΔH=+135.9 kJ•mol-13.NH3•H2O(aq)与H2SO4(aq)反应生成1 mol (NH4)2SO4的ΔH=-24.2 kJ•mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ•mol-1。
则NH3•H2O在水溶液中电离的ΔH等于A.+45.2 kJ•mol-1B.-45.2 kJ•mol-1C.+69.4 kJ•mo l-1 D.-69.4 kJ•mol-14.如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是①X、Y的最高价氧化物对应的水化物的酸性为Y<X②Y、Z的气态氢化物的稳定性Y<Z③W的单质常温下呈液态,可与铁粉反应④W的原子序数比Z的大9A.只有③ B.①②C.①②③D.①②③④5.广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化。
最新2017-2018高二化学下学期期末试题(含答案)

最新2017-2018高二化学下学期期末试题(含答案)7.下列说法正确的是:A.淀粉、纤维素、油脂都是高分子化合物B.石油分馏和煤的干馏过程,都属于物理变化C.聚乙烯是无毒高分子材料,可用于制作食品包装袋D.甲烷、汽油、柴油、酒精都是碳氢化合物,都可作燃料8.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
下列叙述错误的是A.雾和霾的分散剂相同B.雾霾中含有硝酸铵和硫酸铵C.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关9.下列实验及其结论都正确的是选项实验结论A.氯气的水溶液可以导电氯气是电解质B.铝箔在酒精灯火焰上加热熔化但不滴落铝箔表面氧化铝熔点高于铝C.将Na2S 滴入AgNO3 和AgCl的混合浊液中产生黑色沉淀Ksp(AgCl)>Ksp(Ag2S)D.用分液漏斗分离苯和四氯化碳四氯化碳密度比苯大10.常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。
某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是A.实验时需先点燃E处的酒精灯B.C、D中所盛试剂为饱和氯化钠溶液、浓硫酸C.二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HClD.G中可收集到纯净的产品11.短周期主族元素A、B、C、D的原子序数依次增大.甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。
甲、乙的溶液均呈碱性。
下列说法错误的是A.甲和戊加入水中都能破坏水的电离平衡B.乙和戊都含有离子键C.原子半径r(D)>r(B)>r(C)>r(A)D.A、B、C形成的化合物一定显酸性12.科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。
相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是A.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原B.电子由液态Cu-Si合金流出,从液态铝流入C.三层液熔盐的作用是增大电解反应面积,提高硅沉积效率D.电流强度不同,会影响硅提纯速率13.常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV 的变化关系如图所示.下列叙述中错误的是A.Khl(CO32-)(Khl为第一级水解平衡常数)的数量级为10-4B.曲线N表示Na2CO3溶液的pH随lgV的变化关系C.Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)D.若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体26.(15分)碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4•H2O)为原料可制备碘化钠.资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.回答下列问题:(1)水合肼的制备有关反应原理为: NaClO+2NH3 ====== N2H4•H2O+NaCl①用下图装置制取水合肼,其连接顺序为(按气流方向,用小写字母表示).A B C D②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加NaClO溶液.滴加NaClO溶液时不能过快的理由.(2)碘化钠的制备i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;ii.继续加入稍过量的N2H4•H2O(水合肼),还原NalO 和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.③步骤i反应完全的现象是.④步骤ii中IO3-参与反应的离子方程式为.⑤步骤iii “将溶液与活性炭分离”的方法是.⑥本次实验产率为. 实验发现,水合肼实际用量比理论值偏高,可能的原因是.⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性: (填写“合理”或“不合理”),27.(15分)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
2017-2018学年度高二下学期期末考试化学试题(含参考答案,全国卷)

2017-2018学年度高二下学期期末考试化学试题(含参考答案,全国卷)2017-2018学年度高二下学期期末考试化学试题可能用到的相对原子质量:H-1 C-14 O-16 Na-23 Mg-24 C1-35.5 Cu-64 Ag-108第I卷(选择题共48分)一、选择题(本题包括16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1、化学与社会、科学、技术环境密切相关,下列说法不正确的是A.高纯度的硅单质广泛用作半导体材料B.工业上京用情性电极电解熔融的MgO来制取MgC.合理利用太阳能、风能和氢能等能源有利于实现“低碳经济”D.钢铁在潮湿的空气中容易生锈,其主要原因是形成了原电池2、“水”是传统中医里将药材与适量水共研细,取极细药材粉末的方法。
《医学人门》中记载了提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干。
”文中不涉及的操作方法是A.萃取B.溶解C.洗涤D.蒸发3、下列化学用语正确的是A.氯化氢的电子式:B.质了数为30,中子数为35的锌原子:6535ZnC.乙酸的结构简式:CH3COOHD.四氯化碳的比例模型:4、阿司匹外是一种解热镇痛药,其结构如图所示,下列有关阿司匹林的说法正确的是A.分了式为C9H10O4B.苯环上的一氯代物只有两种C.只含有一种官能团D.能发生水解反应5、下列关于酸碱中和滴定的说法中正确的是A.一般用石蕊试液作中和滴定的指示剂B.滴定时应控制滴加速率:先快后慢C.标准液浓度越大,滴定误差越小D.滴定时,眼睛注视滴定管内液面的变化6、用N A表示阿伏加德罗常数的数值。
下列说法正确的是A.2.24 L CO2中含有的原子教为0.3N AB.0.1mol/L的NaCl溶液中含有的Na+数目为0.1N AC.78 g Na2O2中所含的离子总数为4N AD.常温常压下,3.2 g CH4在足量O2中充分燃烧,转移的电子数为1.6N A7、短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元装,常温下,Y的块状单质在Z的最高价氧化物对应水化物的浓溶液中会发生钝化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
天一大联考 2017—2018学年高二下学期期末考试复习化学(附答案)考生注意:1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔杷答題卡对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选条其他答案标号。
回答非选择題时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答題卡一并交同。
可能用到的相对及子质量:H 1 C 12 0 16 Se 79 Hg 201一、选择题:本题共16小题,分为必做题和选做题两部分,其中1-12题为必做题,每个试题考生都必须作答; 13-16题为选做题,考生根据要求作答。
每小题所铪的四个选项中,只有一项符台题目要求。
每小题3 分,共48分。
1.一种“将阳光和水转化为氢燃料”的新技术原理如下图所示。
下列说法正确的是A.氢能是二次能源B.图中能量转化方式只有一种C.水分解为氢气和氧气的同时放出能量D.装置工作时需不断补充CoFe204和FeAl2042.硫化钠是实验室常用试剂。
下列有关0.1 mol•L-1 Na2S溶液的说法正确的是A.10℃时c(S2-)比25℃时小B.加水稀释,溶液pH不断增大C. c (S2-) >c(HS-) >c(H2S)D. c(Na+)> +c(H+) =c(S2-) +c(HS-) +c(0H-)3. C3H6(丙烯)是液化石油气的主要成分之一。
25℃101kPa3时1.0 g丙烯完全燃烧,生成了稳定的氧化物,释放了 45.761 kJ热量。
下列热化学方程式正确的是4.下列说法正确的是A.电解精炼铜时,粗铜与外加直流电源的负极相连B.镀层破损后,镀锌铁片中铁比镀锡铁片中铁更耐腐蚀C.为减缓地下输油钢管镑蚀,将钢管与外加直流电源的正极相连D.银质奖牌表面键金时,可将奖牌与外加直流电源的正极相连5.恒容密闭容器中进行反应c(s) +NH3(g)=HCN(g) +H2(g),不能说明该反应已达到平衡状态的是B.容器内压强不再随时间变化而变化C.气体的密度不再随时间变化而变化D.单位时间内断裂的N—H键与断裂的H—H键数目之比为3:16.下列指定的离子方程式正确的是7.常温下,下列各组离子在指定溶液中能大量共存的是8.铜棒和银棒及AgN03和CuS04溶液可构成铜银原电池(如下图)。
下列说法正确的是A.甲、乙两池盛放的溶液依次是AgNO3、CuSO4溶液B.电池工作时,K+、N03-均不发生迁移C.电池工作时,甲、乙两池中成分和浓度均始终不变D.电池工作时,电池总反应为Cu+2Ag+=Cu2++2Ag9.25 ℃时,体积均为25.0 mL、浓度均为0,1 mol•L-1的NaCl、NaBr及NaI溶液分别用AgN03溶液滴定,滴定曲线如下图所示[已知 K sp(AgCl) =1.8 x1O 、K sp (AgBr) =5.4 x lO-13、K sp (AgI)= 8.3 x 10-17、K sp(Ag2CrO4) =9.0xl0-12、pAs= -lgC(Ag+),Ag2CrO4呈砖红色下列说法正确的是A.AgN03溶液的浓度为0.1 mol•L-1B.①、②、③^次表示Cl-、Br-、I-的反应终点C.①、②、③中只有滴定Cl-时可用溶液作指示剂D.向饱和AgI悬浊液中加入1 mol • L-1 NaCl溶液,沉淀由黄色变为白色10.在2.5 L恒容密闭容器书分别充入H2S(g)、C02(g)各0.1 mol,在高温下发生反应:H2S(g)+C02(g)=COS(g) +H 20(g)5据图判断,下列有关说法正确的是A.由图甲可知该反应正反应的活化能为276. 5 kJ • mol -1B.由图乙可知0 一 t min 时平均速率 v( COS) =t06.0 mol •L -1•min -1C.由图丙可确定t 1min 时改变的条件一定是加入催化剂D.由图丁可确定横坐标x 可能是n(C02)/n(H 2S) 11.由下列实验及现象不能推出相应结论的是12.NaOH 和Na 2S03具有很强的脱除S02的能力,失效后可通过膜电解进行再生(装置如下图所示)。
下列说法正确的是A .“CM ”为阴离子透过膜B.装置工作时,阴极室PH 减小C.阳极发生的反应为SO32-+H20-2e-=S042-+2H+D.中间室流出液的主要成分为NaHS03和H2S03以下为选做题。
请考生从A、B两钽中任选_组作答,不得交叉选择,若两组都做,则按第一组评分。
选做题 A组选修3 物质结构与性质13下列有关说法正确的是A.电负性:Si>NB.第一电离能:S>PC.熔点:NaCl>KJBrD.在水中的溶解性:CH3OCH3> C2H5OH14.下列说法正确的是A.HBrO的酸性比HBr03的强B.鉴别晶体与非晶体可用X -射线衍射实验C.钾焰色反应的紫色辐射波长比钠焰色反应的黄光的波长要长D.元素周期表中s 区、d区及ds区一定都是金属元素15. W、X、Y、Z是元素周期表中原子序数依次增大的前四周期元素,基态W原子核外有3个来成对电子,X 是元素周期表所有元素中电负性最大的.Y与X同主族,基态1原子最外层只有〖个电子,其余各电子层(n)电子数均满足2n2个。
下列说法正确的是A. WX3分子为极性分子B. X的简单氢化物的沸点比Y的低C.晶体中金属Z的堆积模型与金属钠相同D.基态Z中占据能层能最最高的电子的电子云轮廓为哑铃形16.某配合物化学式为[RE2(Pro)6(H20)4 ] (C104)6.化学式中RE代表稀土元素Pr<镨)和Er(铒),Pw为脯氨酸(结构如右图所示)。
下列说法不正确的是A. Pro存在手性异构体B. C104-的空间几何构型为正四面体C. Pro和H20与RE3+以配位键结合D. 1个Pro分子中含有10个cr键选做题 B组选修5 有机化学基础13.化学与生活密切相关,下列有关说法正确的是A.食品保鲜膜的主要成分为聚氯乙烯B.油脂、糖类及蛋白质均属于高分子化合物C.医用酒精中乙醇的体积分数为75%D.家用天然气中添加有特殊气味的物质,可促进气体完全燃烧14. 一种香豆素衍生物的结构简式如图所示,下列有关说法正确的是A.该有机物分子中冇三种含氧官能团B.能与FeCl3溶液发生显色反应C. 1 mol该有机物最多可与1 mol Br,反应D. 1 mol该有机物最多可与3 mol NaOH反应A.m、p的一氯取代物均只有3种B. p、q中所有碳原子均位于同一平面C. m、p、q均能与Br2的CC14溶液反应D. m、n、p、q中能与酸性高锰酸钾溶液反应的只有2种16.下列实验操作及得出的结论均正确的是二、非选择题:本题共5小题,分为必做题和选做题。
其中17-19题是必做题,每个试题考生都必须作答。
20、21题是选做题,考生根据选择题从A、B两组中选一组作答,且与选择题部分所选一致。
不得交叉选择,若两组都做,则按所做的第一组评分。
17.(11分)盐酸、醋酸(pKa=-1gKa=4.75)、氨水(pKb =-1gKb=4.75)及氢氧化钠均是实验室常用试剂。
回答下列问题:(1)常温下,将下列溶液等体积混合,所得溶液的pH =7的是 (填字母)。
a. pH =3的盐酸与pH =11的氨水b. pH =3的醋酸与pH = 11的氨水c. pH =3的盐酸与pH = 11的氣氧化钠溶液d. pH =3的醋酸与pH = 11的氢氧化钠溶液(2)常温下,在两个锥形瓶中分别盛有25.00 tnLpH均为3的盐酸和醋酸,分别用0. 001 0 mol•L-1 NaOH溶液滴定至终点, (填“盐酸”或“醋酸”)消耗NaOH溶液多。
(3)将50.5 mL pH=3的盐酸与49.5 mL pH = 11的NaOH溶液混合,所得溶液的pH为 (假设溶液总体积具有加和性)(4)用0.100 mol • L-1盐酸滴定25.00 mL 0.100 mol •L-1氯水的滴定曲线如下图所示。
①滴定可用的指示剂为 (填“甲基橙”或“酚酞”)②A点由水电离产生的c(H+)是 mol •L-1。
③B点溶液中离于浓度由大到小的顺序为。
18. (11分)Cu20是一种红棕色粉末,CuCl是一种微溶于水的白色粉末,它们都是用途非常广泛的一价铜的化合物。
回答下列问题:①阳极的电极材料是,阴极的电极反应式为。
②阳极上发生一系列连续反应.其反应机理如下:(I) (填方程式)(3)实验室可用CuSO4、NaCl及Na2S03反应制取CuCl,生成CuCl的离子方程式为。
(4)反应2CuCl(s) +Hg22+ (aq)=Hg2Cl2(S) +2Cu+(aq)达到平衡时,平衡常数 K≈。
[已知Ksp(CuCl) =1.2xlO-6、Ksp (Hg2Cl2)=1.3x10-10保留 2 位有效数字]。
19.(12分)乙撤工业是石油化工产业的核心。
回答下列问题:(1)由丙烷气裂解得到乙烯和甲烷气体的热化学方程式为。
通过煤制合成气、合成气制甲醇,再由甲醇分解可制备乙烯。
①一种生产=合成气的反应:C(s) +H20(g)—CO(g) +H2(g),该反应在高温下可自发进行,该反应的 (填字母)。
②在三个容积均为1 L的恒容密闭容器中只发生反应:2CH3OH(g)=C2H4(g)+2H20(g),依据表中的相关数据可确定该反应的△H 0(填“ >”“<”或“=”,下同);容器C达到平衡时。
容器中总压强P(C)/>p(A) 2;容器A达到平衡时,向容器中再充入CH3OH(g)、C2H4(g)、H20(g)各0.1 mol,此时v(正) v(逆)。
(3)乙醇脱水可发生如下反应:平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压-总压×物隄的量分数)lnKp= log e Kp,e ≈2.718,e≈1.65]及产物选择性如下图所示:①脱水制乙烯的反应属于反应(填“吸热或“放热”)。
②读图2,乙酵脱水反应用分子筛催化剂(活化温度范围373 - 523 K),欲制备乙烯应控制的温度为。
③图1中A点反应物及产物浓度间应满足的关系是。
选做题 A组选修3 物质结构与性质20. (8 分)已知反应 K2Cr207 + 3H2C204 +4H2S04 =K2SO4+ Cr2(S04)3 +6C02↑ +7H20。
回答下列问题:(1)基态Cr原子价电子轨道表达式(电子排布图)为;铬的第二电离能L2(Cr)比锰的及(Mn)大,其原因是。
(2)钠和钾处于同主族,但纳的熔点和沸点均比钾高,原因是。
