生物化学之蛋白质三级结构
生物化学第5章 蛋白质的三维结构

9
α-螺旋
特征: 每隔3.6个AA残基螺旋上升 一 圈,螺距0.54nm; 螺旋体中所有氨基酸残基R 侧链都伸向外侧; 每个氨基酸残基的>N-H与 前 面第三个氨基酸残基的 >C=0形成氢键,肽链上所有 的肽键都参与氢键的形成, 取向几乎都平行于螺旋轴。
原胶原纤维中原胶 分子的排列
一股原胶 原 蛋白 分子
原胶原蛋白分子中的 单链 (左手螺旋)
胶原纤维(collagen fibril)中原胶原蛋白分子的排列19
胶原纤维通过Lys-Lys的交联得到进一步稳定和增强
20
六、 超二级结构和结构域
1.超二级结构(super-secondary structure):
在蛋白质分子中,特别是球状蛋白质中,由若干 相 邻的二级结构单元(即α-螺旋、β-折叠片和β-转 角等 )彼此相互作用组合在一起,形成有规则、在空 间上能 辨认的二级结构组合体,充当三级结构的构件 单元,称 超二级结构或模体(motif)或折叠花样 (folding motif)。
类型:αα; β α β ; β β
∆G = ∆H –T ∆S ∆G is change in Gibbs Free Energy. If the ending state
is lower in free energy than the starting state, reaction will proceed spontaneously. ∆H is change in Enthalpy. Enthalpy is the energy from bonds and attractive interactions. Negative ∆H is favorable. (e.g. forming more bonds.) ∆S is change in Entropy. Entropy is disorder. Positive ∆S is favorable. (e.g. increasing the amount of disorder.)
第2章 第3节蛋白质的三级结构和肌红蛋白

第一章蛋白质第三节蛋白质的三级结构与肌红蛋白生物大分子案例:人类自然憋气的极限时间2013年07月11日武汉东湖海洋世界水下芭蕾表演案例2:抹香鲸的1.5小时⏹抹香鲸对巨乌贼的嗜好产生了“龙涎香”李新梅湖南大学生物学院李新梅湖南大学生物学院⏹抹香鲸体内的肌红蛋白含有率是陆栖哺乳动物的8-9倍抹香鲸肉牛肉⏹案例:为什么从肉的颜色可以判断是否肉新鲜?新鲜的肌肉是氧合肌红蛋白的鲜红色李新梅湖南大学生物学院一、为什么肌红蛋白具有贮存氧的功能?1、肌红蛋白通过辅基血红素与氧结合⏹肌红蛋白由一条153个氨基酸的多肽链,含有血红素辅基李新梅湖南大学生物学院主要结合氧和贮存氧部分是血红素辅基的亚铁O 2与肌红蛋白血红素的亚铁结合,结合后亚铁价态不改变93位的组氨酸血红素的结构和位置⏹肌红蛋白多肽链折叠形成一种近似于球状(1)疏水裂隙保证血红素中的亚铁价态不变⏹由于疏水作用力驱动,多肽链折叠成球状构象,疏水性氨基酸通常位于球蛋白的内部李新梅湖南大学生物学院(水化层⏹主要因素3、肌红蛋白的球状构象是由八个a-螺旋组成的三级结构⏹8个a-螺旋分别称为A,B ,C,D ,E ,F ,G ,H –血红素位于E 和F 螺旋之间学习小结习题⏹二、蛋白质的三级结构⏹利用全世界的闲置计算资源来预测蛋白质的形状,尝试得到最低能量的状态李新梅湖南大学生物学院1、什么是蛋白质的三级结构?2、三级结构的特征αα 超二级结构⏹具有活性的球状蛋白质至少具备三级结构李新梅湖南大学生物学院3、三级结构的结构配件是什么?维持力是什么呢?丙糖磷酸异构酶(侧面观)丙糖磷酸异构酶(顶)丙酮酸激酶βαβ超二级结构构成的球状蛋白ββ超二级结构大豆胰蛋白酶抑制剂玉红氧还蛋白木瓜蛋白酶结构域2⏹β β β β形成的希腊钥匙3、维持三级结构的力有哪些?维持三级结构的力⏹⏹⏹(((学习小结李新梅湖南大学生物学院4⏹(5)案例分析:–新鲜肉类的颜色取决于名为“肌红蛋白”,可分为脱氧肌红蛋白、氧合肌红蛋白和高铁肌红蛋白三种形态–肉类加工行业有不法商贩通过使用二氧化硫使肉类保鲜,其机制是什么?李新梅湖南大学生物学院。
第三章 蛋白质的结构【生物化学】

-转角
(1)一种非重复性结构; (2)4个连续的氨基酸残基组 成; (3)主链骨架以180返回折叠; (4)C1 羰基氧与C4亚氨基形 成氢键; (5)Gly、Pro频率高 (6)2型转角常以Gly 作为第 3个残基
无规卷曲
没有明显规律的多肽主 链骨架的构象 在ɑ螺旋构象、ß-转角、
ß-折叠以及三股螺旋中 无规卷曲是用来阐述没 有确定规律性的那部分肽 链结构。酶和蛋白质的活 性中心通常由无规卷曲充 当,与生物活性有关,对 外界理化性质敏感
第三章 蛋白质的三维结构
The Three-dimensional Structure of Proteins
一种球状蛋白质-胰凝乳蛋白酶的结构,图中 蓝色的小分子是一个甘氨酸的结构
多肽主链折叠的空间限制
刚性的肽键平面-肽单元
参与肽键的6个原子C1、C、O、N、H、C2位于同一平 面,肽平面中羰基氧与亚氨基氢几乎总是处于相反的位置, 此 同一平面上的6个原子构成了所谓的肽单元 (peptide unit),也 就是肽平面 。
持结构的稳定性 毛发结构
非典型的α-螺旋有3.010,4.416(π螺旋)等
α-螺旋的偶极矩和帽化
•偶极矩的存在加速 α螺旋的形成
•所谓帽化就是给裸 露的N-H或者C=O提 供配偶体,或折叠蛋 白其他部分以促成 与末端暴露的非极 性残基的疏水作用, 稳定和保护α螺旋。
α螺旋的两亲性质
疏水和亲水侧链的 非对称性分布,与 进一步高级结构的 形成或功能有关
⑵侧链基团的大小 多聚异亮氨酸有大的侧链基团, 造成空间位阻,不能形成螺旋 多聚脯氨酸具亚氨基不能形成 氢键,脯氨酸存在即在多肽链形 成一个结节,螺旋中断。
-折叠
定义 几乎完全伸展的肽段侧向聚集在一起,相邻
蛋白三级结构 加 修饰位点

蛋白三级结构加修饰位点
蛋白质的三级结构指的是蛋白质分子的空间结构,包括其立体构象和空间排列。
蛋白质的三级结构通常由多肽链的折叠和卷曲形成,其中包括α螺旋、β折叠和无规卷曲等结构。
蛋白质的三级结构对其功能起着至关重要的作用,因为它决定了蛋白质的活性和特异性。
蛋白质的修饰位点是指蛋白质分子上可以被特定化学反应或酶催化作用所改变的位置。
蛋白质修饰可以通过磷酸化、甲基化、乙酰化、泛素化等方式进行,这些修饰可以影响蛋白质的稳定性、活性、亲和性和细胞定位等。
修饰位点的确定通常需要通过生物化学实验和质谱分析等技术手段来进行确认。
从结构角度来看,蛋白质的三级结构和修饰位点之间存在密切的关联。
蛋白质的三级结构通常会受到其修饰位点的影响,修饰可以改变蛋白质的空间结构,从而影响其功能。
同时,蛋白质的三级结构也可以为修饰位点的暴露提供特定的结构基础,使得修饰反应能够顺利进行。
因此,研究蛋白质的三级结构和修饰位点的关系对于深入理解蛋白质功能和调控具有重要意义。
总的来说,蛋白质的三级结构和修饰位点是蛋白质分子结构与功能调控中的重要方面,它们相互作用,共同影响着蛋白质的生物学功能。
对它们的研究有助于揭示蛋白质分子的内在机制,为生命科学领域的进一步发展提供理论基础和实验依据。
生物化学 第5章蛋白质三维结构

310螺旋
α螺旋
π螺旋
(二)β-折叠片(β-pleated sheet)
• β-折叠片是蛋白质二级结构元件,是两条或两条以 上充分伸展成锯齿状折叠构象的多肽链,侧向聚集, 按肽键的长轴方向平行并列,通过氢键形成折扇状 的结构。
1、-折叠片的结构特征
1) 多肽链充分伸展,肽平面折叠成锯齿状; 2) 侧链交错位于锯齿状结构的上下方;
酰胺平面与二面角(Φ 、Ψ )
酰胺平面(肽平面):每个肽单位的六个 原子(Cα -CO-NH-Cα )都被酰胺键 固定在同一个平面上,该平面称为酰胺平 面(或肽平面)。
四、蛋白质的二级结构
四、蛋白质的二级结构
蛋白质的二级结构(secondary structure)是指多 肽链主链骨架中若干肽单位各自沿一定的轴盘 旋或折叠,并以氢键为主要次级键而形成的有 规则的构象。
第五章 蛋白质的三维结构
本章要点
研究蛋白质构象的方法 稳定蛋白质三维结构的作用力 多肽主链折叠的空间限制 蛋白质的二级结构 超二级结构和结构域 蛋白质的三级结构 蛋白质的四级结构
一、研究蛋白质构象的方法
X-射线衍射法
单色的X射线通过蛋白质晶体产 生衍射图,对衍射图中衍射斑点的位 置与强度进行测定和计算,可以确定 晶体的结构。
B.肽链平面充分伸展
C.每隔3.6个氨基酸螺旋上升一圈
D.每个氨基酸残基上升高度为0.15nm
2、列哪些因素妨碍蛋白质形成α-螺旋结构?
(E)
A.脯氨酸的存在
B.氨基酸残基的大的支链
C.酸性氨基酸的相邻存在 D.碱性氨基酸的相邻存在
E.以上各项都是
5、其他类型的螺旋
螺旋末端的最后一圈 不稳定,胶原蛋白中存在
生物化学-03 蛋白质3 结构

第三章 蛋白质
2.4.2 蛋白质的空间结构 (1)维持蛋白质空间结构的化学键 (2)蛋白质的二级结构 (3)球状蛋白质与三级结构 (4)蛋白质的四级结构
熟悉维持蛋白质空间结构的各种化学键,理解 蛋白质的二级、三级和四级结构的概念
能判断维持蛋白质空间结构的主要作用力 应用蛋白质的结构知识解决实际问题
βαβ
βββ
αα
ββ
E、结构域
结构域:在较多的球状蛋白质分子中,多肽链往 往形成几个紧密的球状构象,彼此分开,以松 散的肽链相连,此球状构象就是结构域。
结构域存在的原因:
1、局域分别折叠比整条肽链折叠在动力学上更为合理 2、结构域之间由肽链连接,有利于结构的调整
图示:假设具有2个结构域的蛋白质的线性折叠途径
例如:铁氧还蛋白
稳定蛋白质构象的力
盐键
氢键
二
疏
硫
水
键
作
用
酯键
范德华力
(2)蛋白质的二级结构
A、酰胺平面与α-碳原子的二面角
①肽键中C-N键有部分双键性质——不能自由旋转 ②相关的6个原子处于同一平面(肽平面、酰胺平面) ③键长及键角(约120º)一定 ④大多数情况以两个Cα反式结构存在
O C ¨N
在β-折叠片层中,多肽链间依靠相邻肽链间形 成的 __键来维持结构的稳定性。
练习
β-转角结构是由第一个氨基酸残基的 C=O 与 第___个氨基酸残基的 N-H 之间形成氢键而 构成的。
具有四级结构的蛋白质分子中,每一条肽链称 为一个_____。
维持蛋白质构象的作用力有____,___ _,____,____和____。
蛋白质四级结构的特征
(1)寡聚蛋白质的由两个到几十个亚基组成。一 般为偶数。
蛋白质的一二三四级结构名词解释生物化学

蛋白质的一二三四级结构名词解释生物化学引言蛋白质是生物体中重要的基础分子,参与了几乎所有生命活动的调控和实现。
蛋白质的结构决定了其功能和性质,在生物化学中,蛋白质的结构可分为一级、二级、三级和四级结构。
本文将对这四个层次的蛋白质结构进行详细解释。
一级结构蛋白质的一级结构是指由氨基酸残基组成的线性多肽链序列。
每个氨基酸残基通过肽键连接,形成多肽链。
在一级结构中,通过不同的氨基酸残基的排列顺序,蛋白质可以具有不同的序列,从而决定了蛋白质的独特性质和功能。
氨基酸的种类和排列顺序决定了蛋白质的信息内容。
二级结构蛋白质的二级结构是由蛋白质中氨基酸间的氢键作用而形成的局部空间结构。
常见的二级结构有α-螺旋和β-折叠。
α-螺旋是由多肽链在一定的角度下形成螺旋状的结构,而β-折叠是由多肽链形成平行或反平行的β片层结构。
这两种二级结构形式不同,给蛋白质带来了不同的物理和化学性质,从而影响了蛋白质的功能。
三级结构蛋白质的三级结构是指蛋白质中氨基酸残基间的相对空间排列。
这种排列是由蛋白质中的各种化学键(如氢键、离子键、疏水作用等)以及局部和全局的构象约束所决定的。
三级结构的形成使蛋白质获得了空间结构上的稳定性和独特的形状。
不同的氨基酸残基相互作用形成了螺旋、折叠和环等形状,进而塑造了蛋白质的功能。
四级结构蛋白质的四级结构是由多个多肽链和其他非氨基酸成分(如金属离子、辅基、配体等)相互作用而形成的复合物。
这种相互作用使多个多肽链形成互相配对或组装的结构,从而形成一个功能完整的蛋白质分子。
四级结构的形成不仅受到一二三级结构的影响,还可能受到环境因素的调控。
结论蛋白质的一级、二级、三级和四级结构相互作用,共同决定了蛋白质的功能和性质。
一级结构是蛋白质的线性多肽链序列,二级结构是形成的局部空间结构,三级结构是氨基酸残基间的相对空间排列,四级结构是多个多肽链和其他非氨基酸成分的复合物。
深入理解和研究蛋白质的一二三四级结构,对于揭示生命活动的分子机制、疾病发生机理以及药物设计等领域具有重要的意义。
蛋白三级结构 加 修饰位点

蛋白三级结构加修饰位点全文共四篇示例,供读者参考第一篇示例:蛋白质是一类广泛存在于生物体内的有机大分子,由氨基酸经缩合反应形成的线性多聚体构成。
蛋白质的功能具有极大的多样性,涉及生物体内的几乎所有生命活动。
在蛋白质的结构中,三级结构是一个非常重要的概念,是指蛋白质分子上不同部分的二级结构经过空间排列形成的整体结构。
而修饰位点则是指蛋白质分子上可以经过修饰的特定位置,通过不同的修饰方式来调节蛋白质的功能和活性。
蛋白质的三级结构是其功能的基础,也是其与其他生物分子相互作用的关键。
蛋白质的三级结构通常包括四个层次:一级结构是蛋白质的氨基酸序列,二级结构是氨基酸残基之间的氢键作用形成的α-螺旋、β-折叠等结构,三级结构是不同二级结构之间的空间排列,最后四级结构是多个蛋白质分子之间的相互作用形成的复合蛋白。
三级结构的稳定性主要由两种相互作用来维持:非共价相互作用和共价相互作用。
非共价相互作用包括疏水、静电、氢键和范德华力等,通过这些力能够维持蛋白质分子的空间构象。
共价相互作用则主要是二硫键的形成,通过协助两个半胱氨酸残基之间的氧化反应来稳定蛋白质的结构。
修饰位点是指蛋白质分子上可以发生修饰的特定氨基酸残基位置。
蛋白质修饰是生物体内调节蛋白功能的重要方式,可以通过糖基化、磷酸化、甲基化、乙酰化等方式来改变蛋白质的功能和活性。
修饰位点通常位于蛋白质的表面或者活性中心,这些位点的重要性不言而喻。
磷酸化是蛋白质修饰中最为常见的一种方式,通过激酶和磷酸酶的作用来调节蛋白质的磷酸化水平。
磷酸化通常发生在赖氨酸、谷氨酸或苏氨酸残基上,能够改变蛋白质的活性、稳定性和相互作用方式。
磷酸化还可以作为信号传导的一种方式,参与细胞内的多种生理过程。
蛋白质的三级结构和修饰位点是蛋白质生物学功能的重要组成部分,对于生命的多个方面都具有重要作用。
通过深入研究蛋白质的三级结构和修饰位点,可以揭示蛋白质的功能机制,为新药物的研发和疾病的治疗提供重要的理论基础。
生物化学之蛋白质三级结构PPT教学课件

5
2020/10/16
α Helix (Cont’d)
• The structure is stabilized by a hydrogen bond between the hydrogen atom attached to the electronegative nitrogen atom of a peptide linkage and the electronegative carbonyl oxygen atom of the fourth amino acid on the amino-terminal side of that peptide bond.
– For the same reason, many adjacent Lys and/or Arg residues, which have positively charged R groups at pH 7.0, also prevent the formation ofα helix.
2020/10/16
4
2020/10/16
α Helix (α-螺旋)
• The polypeptide backbone is tightly wound around an imaginary axis drawn longitudinally through the middle of the helix.
• Within theα-helix, every peptide bond (except those close to each end of the helix) participates in hydrogen bonding.
生物化学之蛋白质三级结构

• Secondary structure refers to the local conformation of some part of a polypeptide. • The most prominent secondary structures are the α helix and β conformations predicated by Caltech Trio in 1951.
α Helix (Cont’d)
• The structure is stabilized by a hydrogen bond between the hydrogen atom attached to the electronegative nitrogen atom of a peptide linkage and the electronegative carbonyl oxygen atom of the fourth amino acid on the amino-terminal side of that peptide bond. • Within theα-helix, every peptide bond (except those close to each end of the helix) participates in hydrogen bonding. • Each successive turn of the helix is held to adjacent turns by three to four hydrogen bonds.
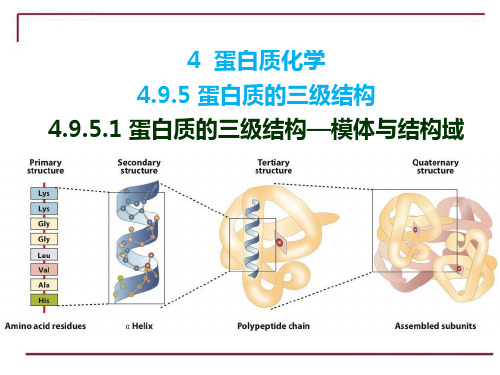
生物化学3.4.12.1 4.9.5.1 蛋白质的三级结构—模体与结构域
α螺旋-环-α螺旋
EF手相结构
4.9.5.1 蛋白质的三级结构—模体与结构域
三级结构的功能区块:结构域(domain) 是在一个蛋白质分子内的相对独立的球状结构和/或功能模块
,是由若干个结构模体组成的相对独立的球形结构单位,它 们通常是独自折叠形成的,与蛋白质的功能直接相关。某些 结构域在同一个蛋白质分子上被重复使用,某些蛋白质由多 个拷贝的一种和多种结构域组成。
多肽链。单个亚基没有生理功能。
4.9.5.1 蛋白质的三级结构—模体与结构域
β发夹环
卷曲螺旋
βαβ
四螺旋束
4.9.5.1 蛋白质的三级结构—模体与结构域
功能是与 DNA旋-转角-α螺旋 与DNA的相互作用
4.9.5.1 蛋白质的三级结构—模体与结构域
功能是 结合Ca 2+
常见模体(1) β发夹环—两个反平行β股由一个环相连;(2 ) β折叠-α螺旋-β折叠,即βαβ;(3)卷曲螺旋和螺旋束— 两个或多个α螺旋的聚合体; (4) α螺旋-环-α螺旋(EF手 相) ;(5)α螺旋-β转角-α螺旋,即αβα;(6)Rossmann 卷曲
亚基:参与构成蛋白质四级结构的、每条具有独立三级结构的
4 蛋白质化学 4.9.5 蛋白质的三级结构 4.9.5.1 蛋白质的三级结构—模体与结构域
4.9.5.1 蛋白质的三级结构—模体与结构域
三级结构的功能区块:模体(motif)
结构生物学的模体有两种不同的用法:(1)是指在蛋白质或 核酸一级结构上,特指具有特殊生化功能的特定氨基酸或碱 基序列,因此被称为序列模体;(2)是指具有特定功能的或 作为一个独立结构域一部分的相邻的二级结构的聚合体,它 一般被称为功能模体或结构模体相当于超二级结构。
关于蛋白质分子三级结构的描述

关于蛋白质分子三级结构的描述蛋白质是生命体中的主要生物分子,其功能与其特定的三维结构密切相关。
蛋白质的三级结构是指其链上各个氨基酸残基之间的空间排列方式,包括了蛋白质的局部结构、次级结构、超级结构等层次。
蛋白质的三级结构对其功能的发挥起着重要作用,并对蛋白质的稳定性和可折叠性产生影响。
本文将对蛋白质的三级结构进行详细描述。
蛋白质的三级结构由其氨基酸序列及其氨基酸残基之间的非共价相互作用所决定。
这些相互作用包括了氢键、范德华力、离子键和疏水相互作用等。
通过这些非共价相互作用,蛋白质可以在细胞中形成稳定的结构。
蛋白质的局部结构是指相互作用在局部产生的结构模式。
其中最常见的局部结构是α螺旋和β折叠,它们是蛋白质中常见的结构单元。
α螺旋是一种右旋稳定结构,其中氢键将多个氨基酸残基链接在一起。
β折叠是由两个或多个β片段通过氢键相互连接而成的结构,常形成蛋白质的折叠面。
除此之外,还有一些其他的局部结构,如β转角、β螺旋和短片段等。
蛋白质的次级结构是指具有相对独立的局部结构模式在蛋白质链上的排列方式。
其中最常见的次级结构是α螺旋和β折叠。
蛋白质的次级结构对蛋白质的稳定性起着重要作用。
一些氨基酸序列中具有多个α螺旋和β折叠可以形成更复杂的次级结构,如α+β结构,这些次级结构可以进一步形成蛋白质的域。
蛋白质的超级结构是由多个次级结构组合形成的更大的结构单元。
蛋白质的超级结构决定了蛋白质的整体形状和功能。
超级结构的组合方式是通过一些特定的连接模式实现的,如两个蛋白质链之间的非共价连接、蛋白质链的环状连接以及链内的交链连接等。
超级结构的形成更多是通过蛋白质的序列信息以及非共价相互作用的共同作用完成的。
总之,蛋白质的三级结构涉及了蛋白质的局部结构、次级结构和超级结构。
蛋白质的三级结构对其功能的发挥起着重要作用,决定了蛋白质的形状和稳定性。
蛋白质的三级结构的形成依赖于其氨基酸序列以及其残基之间的非共价相互作用。
对蛋白质的三级结构的研究有助于我们更好地理解蛋白质的功能和机制,也为药物设计和生物工程提供了重要的基础。
5生物化学 蛋白质三级结构 分离 纯化

❖ 蛋白质分子中的氢键数量被最大化。 ❖ 不溶性蛋白质或膜中的蛋白质由于它们的作用或环
境遵循不同的规则,但弱的作用力对它们的结构仍 然是关键的作用,如:穿膜区呈α螺旋结构,侧链外 露。 ❖ 多聚体化是球状蛋白质的普遍现象.
细胞色素C的αα结构 细胞核抗原的βαβ结构 纤溶酶原的ββ结构
Up and down βBarrel
GFP
β-barrel with Greek key
β – sheet formed structure
❖ Domain
结构域是在二级结构或 超二级结构的基础 上形成的三级结构 的局部折叠区来回 折叠。
肌 红 蛋 白 (myoglobin,Mb) 与 血 红 蛋 白 (hemoglobin, Hb) 都是含有血红素(Heme)辅基 的 蛋 白 质 。 血 红 素 (Heme) 是铁卟啉化合物,由4个甲 炔基相连成为一个环形, Fe2+ 居 于 环 中 。 铁 离 子 有 6 个配位键,其中4个与吡咯 环的N配位结合,1个配位键 和肌红蛋白的93位(F8)组氨 酸残基结合,氧则与Fe2+ 形 成 第 6 个 配 位 键 , 接 近 第 64 位(E7)组氨酸。
通常由50-300个氨基 酸残基三维空间可 以明显区分和相对 独立,并且具有一 定的生物学功能。
❖ 基序(motif)是结构域 的亚单位,通常由2-3个 二级结构单位组成,一 般为α螺旋、β折叠和环 (loop)
蛋白质的三级结构
蛋白质每个原子的空间位置, 其主要研究方法是X-光衍射和核 磁共振法。
α- 螺 旋 的 特 性
右旋,3.6个氨基酸 第n个AA(NH)与第n-4个
生物化学 蛋白质三级结构

一、一级结构蛋白质的一级结构就是从N端,即氨基末端,到C端,羧基末端的氨基酸排列顺序,是组成蛋白质的多肽链的数目、多肽链的氨基酸顺序。
主要靠羧基和氨基脱水形成的肽链相互连接。
一级结构是二、三、四级高级结构的基础。
二、高级结构(一)二级结构是指某一段肽链的局部空间结构,有α-螺旋、β-折叠、β-转角和无规卷曲四种表现形式。
通过骨架上的羰基和酰胺基团之间形成的氢键来维持二级结构的稳定。
(二)三级结构整条肽链中全部氨基酸残基的相对空间位置,即在二级结构基础上,进一步盘绕,折叠,所形成的特定空间结构。
主要靠次级键,如氢键、盐键、疏水键和范德华力,来维系三级结构稳定。
所有的蛋白质都具有三级结构,三级结构是生物学活性的基础。
(三)四级结构由若干条有完整的三级结构多肽链之间,即亚基之间,相互聚合,所呈现的特定空间排布和相互作用。
主要靠氢键和离子键的维系。
三、结构与功能的关系1.一级结构相似的蛋白质往往具有相似的高级结构与功能。
不同种属的生物体分离出来的同一功能的蛋白质,其一级结构只有极少的差别。
细胞色素C(Cyt c)是线粒体电子传递链中的组分,存在于从细菌到人的所有需氧生物中。
通过比较Cyt c的序列可以反映不同种属生物的进化关系。
亲缘越近的物种,Cyt c中氨基酸残基的差异越小。
如人与黑猩猩的Cyt c完全一致,人与绵羊的Cyt c有10个残基不同,与植物之间相差更多。
2.蛋白质的功能依赖于特定的高级结构。
当特定构象存在时,蛋白质表现出生物功能;当特定构象被破坏时,即使一级结构没有被破坏,蛋白质也会丧失原有的生物学活性。
牛胰核糖核酸酶由一条多肽链构成,包含8个带巯基(-SH)的半胱氨酸,脱氢后形成4对二硫键(-S-S-)。
当牛胰核糖核苷酸酶未被处理,处于天然构象时,具有正常的催化活性。
β-巯基乙醇可破坏该酶的二硫键,尿素可破坏该酶的氢键,使用β-巯基乙醇和尿素处理过后的牛胰核糖核苷酸酶处于去折叠状态,丧失了正常的生物学活性,不具有催化活性。
生物化学2.6.2 蛋白质的超二级结构以及三级、四级结构

羧肽酶
(b)
腺苷酸激酶
2.结构域(structure domain)
结构域: 多肽链在二级结构或超二级结构的基础上形成三级
结构的折叠区,这种相对独立的紧密球状实体就是结构域 (structure domain)或简称域(domain)。
★ 结构域是多肽链的独立折叠单位,
一般由100-200个氨基酸残基构成
主讲教师:尹春光
蛋白质的空间结构:
α-螺旋 β-折叠 β-转角 无规卷曲
1.超二级结构(super secondary structure):
超二级结构 • 由若干个相邻的二级结构单元(α-螺旋、β-折叠、β-转角
及无规卷曲)组合在一起,彼此相互作用,形成有规则的、 在空间上能够辨认的二级结构组合体 。
• 疏水相互作用力、氢 键、范德华力、盐键
氢键
范德华力
疏水相互作用
离子键
稳定蛋白质空间
范德华力 离子键
四. 蛋白质的四级结构
亚基: • 自然界很多蛋白质是以独立折叠的球状多肽链
聚集体形式存在,这些具有三级结构的多肽链 称为亚基。
四. 蛋白质的四级结构
蛋白质四级结构(quaternary stucture): • 亚基通过非共价键相互作用彼此缔合在一起 ,亚基的
缔合方式或组织方式称为蛋白质四级结构(quaternary stucture)。
超二级结构基本类型 • αα;ββ;βαβ;
(1)αα结构(复绕α-螺旋)
(2)βxβ结构(βαβ)
x:无规卷曲 x:α-螺旋
(3)α-螺旋-β转角- α-螺旋
超二级结构
αα
β×β
βαβ(两个:Rossman折叠)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Quaternary Structure
Protein Secondary Structure
• Secondary structure refers to the local conformation of some part of a polypeptide.
David L. NelsoNINGER PRINCIPLES OF BIOCHEMISTRY
Fourth Edition
Part I Structure and Catalysis
2014.10.20
Chapter 6 The 3D Structure of Proteins
α Helix (α-螺旋)
• The polypeptide backbone is tightly wound around an imaginary axis drawn longitudinally through the middle of the helix.
• The R groups of the amino acid residues protrude outward from the helical backbone.
Robert Corey (1897-1971) Caltech, USA
Herman Branson (1914-1995) Caltech, USA
Major Secondary Structures
• α helix • β conformations
– β sheet
• β turn
• Collagen triple helix (helix) • Supersecondary structures
Different Aspects of αhelix
Ball-and-stick model Viewed from the end
Space-filling model
Right-handed and Left-Handed Helix
• Naturally occurring L-amino acids can form either right- or lefthanded helices.
• The most prominent secondary structures are the α helix and β conformations predicated by Caltech Trio in 1951.
Linus Pauling (1901-1994) Caltech, USA
• Extended left handed helices have not been observed in proteins.
• αhelix can form in polypeptides consisting of either L- or D-amino acids. But all residues must be of one stereoisomeric series.
• Within theα-helix, every peptide bond (except those close to each end of the helix) participates in hydrogen bonding.
• Each successive turn of the helix is held to adjacent turns by three to four hydrogen bonds.
• Each helical turn includes 3.6 amino acid residues extending about 5.4 Å along the long axis.
• Ψ= -45o to -50o; Φ= -60o
α Helix (Cont’d)
• The structure is stabilized by a hydrogen bond between the hydrogen atom attached to the electronegative nitrogen atom of a peptide linkage and the electronegative carbonyl oxygen atom of the fourth amino acid on the amino-terminal side of that peptide bond.
• A D-amino acid will disrupt a regular structure consisting of Lamino acids, and vice versa.
What Affects α Helix Stability?
a) The electrostatic repulsion (or attraction) between successive amino acid residues with charged R groups. – If a polypeptide chain has a long block of Glu residues, the negatively charged carboxyl groups of adjacent Glu residues at pH 7.0 repel each other, preventing the formation of α helix. – For the same reason, many adjacent Lys and/or Arg residues, which have positively charged R groups at pH 7.0, also prevent the formation ofα helix.
