人民卫生版-物理化学 第二章 1-2节
物理化学第六版侯新朴人民卫生出版社课后答案

思考题 1. 【答】 1 不一定正确。
绝热条件可以保证系统和环境之间没有热交换 封闭条件可以保证系统和环境之间没有物质交换。
但是单单这两个条件不能保证系统和环境之间有其他能量交换方式 如作功。
当绝热封闭的系统在重力场中高度发生大幅度变化时 系统和地球间的作功不能忽略 系统的状态将发生变化。
2 正确。
3 不正确。
系统和环境间发生物质交换时 可以作功又吸热 但显然不是封闭系统。
为了防止混淆 一般在讨论功和热的时候 都指定为封闭系统 但这并不意味着发生物质交换时没有功和热的发生。
但至少在这种情况下功和热的意义是含混的。
4 正确。
当发生化学作用 即系统和环境间物质交换 时 将同时有热和功发生 而且还有物质转移 因此是敞开系统。
3.【答】 1 对一个物理化学过程的完整描述 包括过程的始态、终态和过程所经历的具体途径 因此仅仅给定过程的始、终态不能完 整 地说明该过程。
Q、W都是途径依赖量 其数值依赖于过程的始态、终态和具体途径 只要过程不完全确定 Q、W的数值就可 能 不确定。
因为Q W △U 只要过程始、终态确定 则△U确定 因此Q W也确定。
2 在已经给定始、终态的情况下 又限定过程为绝热过程 Q 0 Q 确定 W △U W和△U也确定。
5. 【答】 1 正确。
状态是各种状态性质的综合表现 状态性质改变 状态一定改变。
2 不正确。
比如理想气体的等温过程中 状态改变但是热力学能不变。
3 不正确。
温度是热运动的―强度‖ 热是热运动的―数量‖ 两者没有必然练习。
4 不正确。
绝热和刚性只意味着内有热交换和体积功 不能排除其他作功方式的存在。
5 不正确。
理想气体可逆等温压缩时 向外放热 热力学能不减少。
6 正确。
7 不正确。
H是状态函数 但是△H却是依赖于过程的物理量 因此热 Qp 不是状态函数 他依赖于过程。
8 不正确。
理想气体的焓仅与温度有关。
9 不正确。
10 正确。
Q―W △U --。
11 不正确。
第二章药物的鉴别试验

反映手性药物特性及其纯度的主要指标,可用区别药品、 检查纯度或测定制剂的含量。
对固体供试品:
[ α]
t D
100
对液体供试品:
cl
100 [ α] dl
t D
D 为钠光谱的D线; t 为测定时的温度 α 为测得的旋光度;L为测定管的长度(dm) d 为液体的相对密度 C 为每100ml溶液中含被测物质的重量(g,按照无水物或者干燥物计算)
摩尔吸收系数 ε =A/CL 百分吸收系数 E 1cm
例 盐酸氨溴索 Ch.P(2010) 精密称取本品适量,加0.01mol/L盐酸溶液溶解并
1%
A CL
【性状】吸收系数
定量稀释制成每1ml中约含25μg的溶液,照紫外-可见分光光度法,在244nm的
1% )为233~247。 波长处测定吸光度,吸收系数( E1 cm
【性状】 本品在丙酮、三氯甲烷或乙酸乙酯中易溶,在乙醇中溶解,在乙醚中微溶, 在水中几乎不溶。
(3)物理常数:用于药品鉴别,反映其纯杂程度。 ChP2010版收载的物理常数包括:相对密度、馏程、 熔点、凝点、比旋度、折光率、吸收系数、黏度、 酸值、皂化值、羟值、碘值等。
其测定结果不仅对药品具有鉴别意义,也可反映
② 有机氟化物的茜素氟蓝法
③ 芳香第一胺类重氮化-偶合反应:用于芳伯氨基或潜在芳伯氨基
④ 托烷生物碱类-Vitali反应 ⑤ 肾上腺皮质激素类的四氮唑 ⑥ 含羰基结构的苯肼反应 ⑦ 氨基酸及氨基糖苷类的茚三酮呈色反应
⑧ 双缩脲反应
①三氯化铁呈色反应(酚羟基)
对乙酰氨基酚 蓝紫色
⑤肾上腺皮质激素类的四氮唑比色法
发生沉淀反应或产生气体。
呈色反应鉴别法
物理化学第二章

卡诺热机工作原理
高低温热源 脱离高低温热源
p A
绝 热 压 缩
D
高温热源T2
等温膨胀
低温热源T1 等温压缩
B
绝 热 膨 胀
C
V
p
A (p1V1)
U=0, Q2=-W1=RT2ln(V2/V1)
Q=0 W4= U=CV(T2-T1)
D (p4V4)
B (p2V2)
Q=0 W2= U=CV(T1-T2)
• 化学变化及自然界发生的一切过 程进行的方向及其限度
• 第二定律是决定自然界发展方向 的根本规律
水的流动
• 水自发流动的方向:
• 从地势高的地方流向低的地方 • 自发从低处流向高处是不可能的
• 水从长江源头流至东海,损失了势能, 放出了热能。
• 1m3水从沱沱河(5000m)流到崇明岛(0m): • 热量=势能=5×107J=13.9度电能
• 常见的热机如: 汽车, 飞机, 轮船, 火力发电机等等.
• 卡诺设计了一种理想热机-卡诺热机, 此热机在高温 热源和等温热源间工作, 其工作介质是理想气体, 整 个循环过程均不存在摩擦力, 卡诺热机的循环由两个 绝热过程和两个等温过程组成.
• 卡诺证明了在相同两热源间工作的热机, 以卡诺热机 的效率为最大, 其它任何热机的效率不可能超过卡诺 热机.
• 欲长江黄河的水倒流,除非能将损失的 热量收集起来,使之全部转化为功,并 还给河水。实际上这是作不到的。
热的传递
• 长江三峡工程可将水的势能转化成清 洁的电能,每年可节约5000万吨煤。
• 三峡的电能归根到底来源于何处?
•
太阳
• 阳光普照大地,给地球送来了 光和热。
• 热:因温差而传递的能量
物理化学国家级教材-物理化学
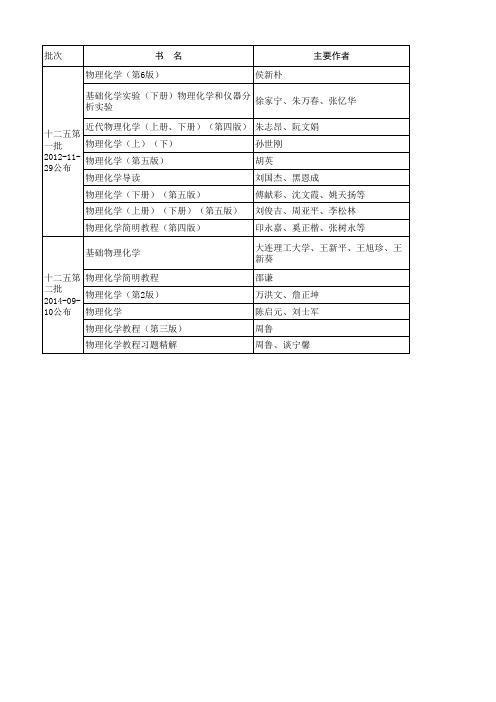
第一作者单位 北京大学 吉林大学 南开大学 厦门大学 华东理工 华东理工 南京大学 天津大学 山东大学 大连理工大学 山东科技大学 华中师范大学 中南大学 四川大学 四川大学
出版社 人民卫生出版社 高等教育出版社 科学出版社 厦门大学出版社 高等教育出版社 科学出版社 高等教育出版社 高等教育出版社 高等教育出版社 高等教育出版社 化学工业出版社 高等教育出版社 科学出版社 科学出版社 科学出版社ຫໍສະໝຸດ 批次书 物理化学(第6版)
名 侯新朴
主要作者
基础化学实验(下册)物理化学和仪器分 徐家宁、朱万春、张忆华 析实验 近代物理化学(上册、下册)(第四版) 十二五第 物理化学(上)(下) 一批 2012-11- 物理化学(第五版) 29公布 物理化学导读 物理化学(下册)(第五版) 物理化学(上册)(下册)(第五版) 物理化学简明教程(第四版) 基础物理化学 十二五第 物理化学简明教程 二批 物理化学(第2版) 2014-0910公布 物理化学 物理化学教程(第三版) 物理化学教程习题精解 朱志昂、阮文娟 孙世刚 胡英 刘国杰、黑恩成 傅献彩、沈文霞、姚天扬等 刘俊吉、周亚平、李松林 印永嘉、奚正楷、张树永等 大连理工大学、王新平、王旭珍、王 新葵 邵谦 万洪文、詹正坤 陈启元、刘士军 周鲁 周鲁、谈宁馨
第五版物理化学第二章习题答案

热力学第一定律第二章℃,求过程中系统与环境交换的功。
1mol理想气体在恒定压力下温度升高12.1n = 1mol解:理想气体),应用式(2.2.3对于理想气体恒压过程) =-8.314J(nRT-p(V-V) =--nRTW =-pΔV =11amb22下全部凝结成液态水。
求过程的功。
假设:100℃,101.325kPa2.2 1mol水蒸气(HO,g)在2相对于水蒸气的体积,液态水的体积可以忽略不计。
解: n = 1mol水蒸气可看作理想气体, 应用式(2.2.3)恒温恒压相变过程, p(V-V) ≈ pVg =nRT = 3.102kJW =-pΔV =-g ambl水(H,求过程的体积功。
O,l)2.3 在25℃及恒定压力下,电解1mol21/2O(g) HO(l) =H(g) + 222解: n = 1mol恒温恒压化学变化过程, 应用式(2.2.3)W=-pΔV =-(pV-pV)≈-pV=-nRT=-3.718kJ 2222amb2 112.4 系统由相同的始态经过不同途径达到相同的末态。
若途径a的Q=2.078kJ,Wa=-a4.157kJ;而途径b的Q=-0.692kJ。
求W.bb解: 热力学能变只与始末态有关,与具体途径无关,故ΔU = ΔU ba由热力学第一定律可得 Qa + Wa = Q + W bb∴ W = Q + W -Q= -1.387kJ b baa两不同途径到达相同的末℃,200 kPaba,的5 mol某理想气体,经途径 2.5 始态为25;再恒容加热到压力100 kPa,步骤的功a先经绝热膨胀到 -28.47℃,态。
途经的。
途径b为恒压加热过程。
求途径200 kPa的末态,步骤的热b及。
解:先确定系统的始、末态nRT15.8.314×298×513m==0.V0619=1200000P1nRT5×8.314×244.583m1016==0=VV=.2P100000ΔU=W+Q=(-5.57+25.42)kJ=19.85kJ aa 对于途径b,其功为W=-pΔV=-200000(0.1016-0.0619)J=-7.932kJ1b根据热力学第一定律的值。
物理化学第二章

(2.2.1) )
对一微小变化
dS ≡
δ QR
T
(2.2.2) )
2.2.2 熵函数
对一可逆循环
∫ dS ≡ ∫
δQR
T
=0
(2.2.2) )
熵的定义式。 式(2.2.1)和(2.2.2)均为熵的定义式。 ) )均为熵的定义式 注意: 注意: 1) 熵是体系的状态函数。 是体系的状态函数 状态函数。 2) 熵与热温商不能混淆。Q/T的数值与过程有关, 热温商不能混淆 不能混淆。 的数值与过程有关, 的数值与过程有关 式中T 为环境温度。 式中 为环境温度 。 只有在可逆过程中两者才 发生联系。 为体系温度。 发生联系。 S = Q 可逆过程 的T 为体系温度。 ∆
2.2.4 熵增加原理 实际体系: 实际体系: —— 体系 环境 = 大孤立体系 体系+环境
环境视为无限大,其微小变化可当作可逆过程: 环境视为无限大,其微小变化可当作可逆过程: 可当作可逆过程
dS 环 = −
δQ
T环
dS −
δQ
T环
= dS 体系 + dS 环境 = dS 孤立 ≥ 0
>0 自发,不可逆 自发, =0 平衡,可逆 平衡,
δQ可逆
T
dS −
−
δQ实际
T
≥0
δQ实际
T环
≥0 或
dS −
δQ
T环
≥0
> 0 不可逆过程 = 0 可逆过程 < 0 不可能发生
δQ
T环 )→ II ≥ 0 I
或
∆S I → II − ∑ (
I
II
——克劳修斯不等式 克劳修斯不等式
2.2 热力学第二定律
物化教材习题解答(人卫版)第2章习题

第二章习题解答1. J 3500110ln 19.1519V V ln V p V V ln nRT W 121112max =⨯⨯=== ∆U=∆H=01max 12K J 166.130003500T W V V lnnR S -⋅====∆2. 等温可逆膨胀:1-2K J 14.191V V lnnR S ⋅=∆= 向真空膨胀:由于始态和终态同上,体系的熵变也为19.14 J ⋅K –13. 先求冷热水混合后温度:500⨯C p (T –343)+100⨯ C p (T –303) = 0 T=336.3 K (63.3︒C) 再计算熵变:303Tln C 343T lnC S 21+=∆303T ln 184.4100343T ln 184.4500⨯+⨯==–41.27 + 43.63 = 2.34 J ⋅K–14. Sn 摩尔数mol 106.269.118250n ==nC p,m,Sn (T –473)+1000C p,H2O (T –283)=02.106⨯24.14(T –473)+1000⨯4.184(T –283)=0 T=285.3 K1-O H ,p Sn ,m ,p K J 17.887.3370.25283Tln C 1000473T ln nC S 2⋅=+-=+=∆5. 体系熵变按可逆相变计算:1-m ,V K J 0.1092.37340670T H S ⋅==∆=∆体真空蒸发热:Q=∆H –∆nRT=40670–8.314⨯373.2=37567 J环境熵变:1-K J 7.1002.37337567T Q S ⋅-=-=-=∆体环∆S 总= ∆S 体 + ∆S 环= 8.28 J ⋅K –1 >0 自发进行6. 体系: 设计可逆过程:81.2263273ln 3.75T T ln nC S 12)l (m ,p 1===∆J ⋅K –107.222736025T H S 2-=-=∆=∆凝固 J ⋅K –1 40.1273263ln 6.37T T ln nC S 12)s (m ,p 3-===∆J ⋅K –1 ∆S 体=∆S 1+∆S 2+∆S 3=–20.66 J ⋅K –1 环境:⎰-=--+-=∆+∆=∆5648)263273)(6.373.75(6025dT C H H p 273263J47.2126365648T Q S -=-=-=∆体环 J ⋅K –1总熵:∆S 总=∆S 体+∆S 环=0.81 J ⋅K –1>0 过程自发。
人卫版物理化学(第六版)课后习题答案详解

《物理化学》作业习题物理化学教研组解2009,7第一章 热力学第一定律与热化学1. 一隔板将一刚性决热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去左、右气体的压力达到平衡。
若以全部气体作为体系,则ΔU 、Q 、W 为正?为负?或为零?解:0===∆W Q U2. 试证明1mol 理想气体在衡压下升温1K 时,气体与环境交换的功等于摩尔气体常数R 。
证明:R T nR V V p W =∆=-=)(123. 已知冰和水的密度分别为:0.92×103kg ·m -3,现有1mol 的水发生如下变化:(1) 在100oC ,101.325kPa 下蒸发为水蒸气,且水蒸气可视为理想气体;(2) 在0 oC 、101.325kPa 下变为冰。
试求上述过程体系所作的体积功。
解:(1) )(m 1096.11092.010183633--⨯⨯⨯==冰V )(m 1096.1100.110183633--⨯⨯⨯==水V )(10101.3373314.81)(3J nRT V V p W e ⨯=⨯⨯===冰水- (2) )(16.0)108.11096.1(101325)(55J V V p W e =⨯-⨯⨯=-=--水冰4. 若一封闭体系从某一始态变化到某一终态。
(1) Q 、W 、Q -W 、ΔU 是否已经完全确定。
(2) 若在绝热条件下,使体系从某一始态变化到某一终态,则(1)中的各量是否已完全确定?为什么?解:(1) Q -W 与ΔU 完全确定。
(2) Q 、W 、Q -W 及ΔU 均确定。
5. 1mol 理想气体从100o C 、0.025m 3 经过下述四个过程变为100o C 、0.1m 3: (1) 恒温可逆膨胀; (2) 向真空膨胀; (3) 恒外压为终态压力下膨胀;(4) 恒温下先以恒外压等于气体体积为0.05m 3时的压力膨胀至0.05 m 3,再以恒外压等于终态压力下膨胀至0.1m 3。
第二章习题--水的物理化学处理方法

第二章 水的物理化学处理方法2-1 自由沉淀、絮凝沉淀、拥挤沉淀与压缩沉淀各有什么特点?说明它们的内在区别和特点。
悬浮颗粒在水中的沉降,根据其浓度及特性,可分为四种基本类型:自由沉淀:颗粒在沉降过程中呈离散状态,其形状、尺寸、质量均不改变,下沉速度不受干扰。
絮凝沉淀:沉降过程中各颗粒之间相互粘结,其尺寸、质量会随深度增加而逐渐增大,沉速亦随深度而增加。
拥挤沉淀:颗粒在水中的浓度较大,颗粒间相互靠得很近,在下沉过程中彼此受到周围颗粒作用力的干扰,但颗粒间相对位置不变,作为一个整体而成层下降。
清水与浑水间形成明显的界面,沉降过程实际上就是该界面下沉过程。
压缩沉淀:颗粒在水中的浓度很高时会相互接触。
上层颗粒的重力作用可将下层颗粒间的水挤压出界面,使颗粒群被压缩。
2-2 水中颗粒的密度s =2.6 3/g cm ,粒径d=0.1 mm ,求它在水温10 ℃情况下的单颗粒沉降速度。
解:6.7×10-3m/s 。
2-3 非絮凝性悬浮颗粒在静止条件下的沉降数据列于表2-22中。
试确定理想式沉淀池过流率为1.8m 3/m 2h 时的悬浮颗粒去除率。
试验用的沉淀柱取样口离水面120cm 和240cm 。
ρ表示在时间t 时由各个取样口取出的水样中悬浮物的浓度,ρ0代表初始的悬浮物浓度。
2-4 生活污水悬浮物浓度300mg/L ,静置沉淀试验所得资料如表2-23所示。
求沉淀效率为65%时的颗粒截留速度。
2-5 污水性质及沉淀试验资料同习题2-4,污水流量1 000m 3/h ,试求:(1)采用平流式、竖流式、辐流式沉淀池所需的池数及澄清区的有效尺寸; (2)污泥的含水率为96%时的每日污泥容积。
解:以平流式沉淀池为例:6座池子,长24m ,宽5m ,有效水深1.8m 。
污泥的含水率为96%时的每日污泥容积19.5m 3。
2-6 已知平流式沉淀池的长度L=20m ,池宽B=4m ,池深 H=2m 。
今欲改装成斜板沉淀池,斜板水平间距10cm ,斜板长度l =1 m ,倾角60°。
PHYSICAL CHEMISTRY (THEORETICAL CHEMISTRY)

解释: (1) T 恒定时, pVm = 常数, 意味着 p , Vm 0. (2) p = (n/V)RT, 表明在恒温下, 气体分子碰撞器壁的压 力与分子数密度成简单的比例关系, 可见每一分子碰 撞器壁的动量变化不受气体密度(或气体分子间距)的 影响, 而这只有在分子间没有相互作用时才有可能. 理想气体状态方程近似适用于低压实际气体. 易液化气 体的适用压力范围较窄, 难液化气体则相对较宽.
00-7-28
17
00-7-28
ห้องสมุดไป่ตู้
• 波义耳定律的一个应用 —— 气压水井
18
理想气体状态方程
波义尔定律 盖 吕萨克定律 pV = 常数 V / T = 常数 (n, T 恒定) (n, p 恒定) (T, p 恒定) • 相同质量, 温度 和压力时He 和 He 0.6g/L Ar 具有不同的 体积(和密度). 两种气体的 体积与其物质 Ar 1.6g/L 的量成正比.
阿伏加德罗定律 V / n = 常数 • 气球在液氮 冷却作用下 体积减小
理想气体状态方程: 上述三经验定律相结合, 得到 pV = nRT
式中 R 为摩尔气体常数, 数值为8.314,单位 Jmol-1 K-1 .
00-7-28
19
理想气体模型
理想气体: 凡在任何温度、压力下均服从理想气体状态方程 的气体称为理想气体. 理想气体的两个特征: (1)分子本身必定不占有体积; (2)分子间无相互作用.
00-7-28 5
2.任务:
1)在于采用物理学的原理、实验方法与数学手段 来研究在化学变化中引起物理条件的变化,或称 为伴随着物理变化,采用不同的物理条件引起不 同的化学反应结果的规律与原因; 2)研究重新组合到底经过什么途径?有什么规律? 为什么要经过这一途径?等等, 这些需要从理论上进行解释。热力学和动力 学中可找到部分答案。 由此种种因素的促使,物 理化学的形成势在必行。
物理化学课后习题答案第二章

第二章2.1 1mol 理想气体在恒定压力下温度升高1℃,求过程中系统与环境交换的功。
解:理想气体n = 1mol恒压升温p 1, V 1, T 1 p 2, V2, T 2 对于理想气体恒压过程,应用式(2.2.3)W =-p amb ΔV =-p(V 2-V 1) =-(nRT 2-nRT 1) =-8.314J2.2 2.2 1mol 1mol 水蒸气(H 2O,g)在100℃,101.325kPa 下全部凝结成液态水。
求过程的功。
假设:相对于水蒸气的体积,液态水的体积可以忽略不计。
解: n = 1mol H 2O(g) H 2O(l)恒温恒压相变过程,水蒸气可看作理想气体, 应用式(2.2.3)W =-p amb ΔV =-p(V l -V g ) ≈ pVg = nRT = 3.102kJ 2.3 在25℃及恒定压力下,电解1mol 水(H 2O,l),求过程的体积功。
H 2O(l) = H 2(g) + 1/2O 2(g) 解: n = 1mol H 2O(l) H 2(g) + + O 2(g) n 1=1mol 1mol + 0.5mol = n 0.5mol = n 2V 1 = V l V(H 2) + V (O V(O 2) = V2 恒温恒压化学变化过程, 应用式(2.2.3)W=-p amb ΔV =-(p 2V 2-p 1V 1)≈-p 2V 2 =-n 2RT=-3.718kJ100℃,101.325kPa25℃,101.325kPa2.4 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,Wa=-4.157kJ ;而途径b 的Q b =-0.692kJ 。
求W b 解: 热力学能变只与始末态有关,与具体途径无关,故 ΔU a = ΔU b由热力学第一定律可得 Qa + Wa = Q b + W b ∴ W b = Q a + W a -Q b = -1.387kJ2.6 4mol 4mol 某理想气体,温度升高20℃, 求ΔH -ΔU 的值。
物理化学二章节-PPT课件

的效率最大, 此效率与工作物质无关, 只与两热源的
温度有关, 此书的基本结论即为卡诺定理. • 卡诺当时是用热质论来证明卡诺定理的, 后来 Kelvin和Claudius对卡诺的工作进行了修正, 用热力
每次碰撞,小球的部分动能会转变为热能损失掉。 此过程的逆过程的发生几率极其微小。
第二定律的表述
19世纪英国卓越的科学家。 原名W.汤姆孙 (Wil-liaM ThoMson),1824-1907。 英国政府于1866年封他为 爵士,1892年封为男爵, 称为开尔文男爵,以后他 就改名为开尔文。
• Kelvin:
• No process is possible in which the sole result is the absorption of heat from a reservoir and its complete conversion into work.
• 从单一热源取出热使之完全变 成功,而不发生其它变化是不 可能的。
风的走向
• 空气的流动形成风 • 风的流动:从高压处流向低压处
• 风的流动因磨擦将空气的势能变为 热能而散失。 • 风的逆向流动是不可能的。
电的输送
• 电流总是从电压高的一端流向电压低的 一端,即电子由电压低的一端流向电压 高的一端。
• 电子的流动须克服电路的电阻,其结果 是电能(功)转变为热能(电灯光等)。
水的流动
• 水自发流动的方向:
• 从地势高的地方流向低的地方 • 自发从低处流向高处是不可能的
• 水从长江源头流至东海,损失了势能, 放出了热能。
• 1m3水从沱沱河(5000m)流到崇明岛(0m): • 热量=势能=5×107J=13.9度电能 • 欲长江黄河的水倒流,除非能将损失的 热量收集起来,使之全部转化为功,并 还给河水。实际上这是作不到的。
物理化学B

物理化学BPhysical Chemistry B课程编号:学分: 3学时: 45 (其中:讲课学时:45)先修课程:无机化学、有机化学、分析化学适用专业:药学、药物制剂学、生物技术、食品科学与工程、食品质量与检验、生物工程、制药工程、生物工程、食品安全教材:《物理化学》,濮良忠,人民卫生出版社,2009年2月第3版开课学院:化学化工学院一、课程的性质与任务《物理化学B》是药学类专业核心课之一,是一门从物质的物理现象和化学现象的联系入手探求化学变化一般规律的科学。
它的任务是使学生掌握化学热力学、化学平衡、多相平衡、化学动力学、电化学、表面化学和胶体化学的基本知识。
通过学习,加深对无机化学、有机化学和分析化学等课程的理解, 着重学习与药学专业有关的化学新知识、新理论、新技术;用物理化学的基本原理和方法解决实际问题,为后续课程和以后的工作及科学研究打下坚实的基础。
《物理化学》的主要内容是:化学热力学(热力学第一定律、第二定律),溶液和相平衡,化学平衡,电化学(电解质溶液和可逆电池), 化学动力学, 表面现象和胶体溶液。
内容的深广度以“加强基础,联系专业”为原则,体现检验专业的特点。
二、课程的基本内容及要求绪论1、教学内容(1)物理化学的由来、发展、能解决的问题(2)物理化学与药学专业的关系(3)物理化学的学习方法2、基本要求(1)了解本课程的性质、研究对象与方法、任务;(2)掌握学习本课程的几个基础概念。
3、重难点重点:物理化学的基本内容和任务,物理量的表示与运算。
难点:物理量的表示与运算。
第一章热力学第一定律1、教学内容(1)热力学的几个基本概念: 体系和环境,过程和途径,状态和状态函数,热力学平衡, 热量和功。
(2)热力学第一定律和内能,热力学第一定律的数学表达式,内能变化的物理意义,理想气体的内能。
(3)焓的定义,焓变化的物理意义,理想气体的焓,热容的几种定义(平均热容、比热、摩尔热容、等压摩尔热容、等容摩尔热容)。
物理化学第二章-习题及答案

第一章 热力学第一定律填空题1、一定温度、压力下,在容器中进行如下反应:Zn(s)+2HCl(aq)= ZnCl 2(aq)+H 2(g)若按质量守恒定律,则反应系统为 系统;若将系统与环境的分界面设在容器中液体的表面上,则反应系统为 系统。
2、所谓状态是指系统所有性质的 。
而平衡态则是指系统的状态 的情况。
系统处于平衡态的四个条件分别是系统内必须达到 平衡、 平衡、 平衡和 平衡。
3、下列各公式的适用条件分别为:U=f(T)和H=f(T)适用于 ;Q v =△U 适用于 ;Q p =△H 适用于 ; △U=dT nC 12T T m ,v ⎰适用于 ; △H=dT nC 21T T m ,P ⎰适用于 ; Q p =Q V +△n g RT 适用于 ;PV r=常数适用于 。
4、按标准摩尔生成焓与标准摩尔燃烧焓的定义,在C (石墨)、CO (g )和CO 2(g)之间, 的标准摩尔生成焓正好等于 的标准摩尔燃烧焓。
标准摩尔生成焓为零的是 ,因为它是 。
标准摩尔燃烧焓为零的是 ,因为它是 。
5、在节流膨胀过程中,系统的各状态函数中,只有 的值不改变。
理想气体经节流膨胀后,它的 不改变,即它的节流膨胀系数μ= 。
这是因为它的焓 。
6、化学反应热会随反应温度改变而改变的原因是 ;基尔霍夫公式可直接使用的条件是 。
7、在 、不做非体积功的条件下,系统焓的增加值 系统吸收的热量。
8、由标准状态下元素的 完全反应生成1mol 纯物质的焓变叫做物质的 。
9、某化学反应在恒压、绝热和只做膨胀功的条件下进行, 系统温度由T 1升高到T 2,则此过程的焓变 零;若此反应在恒温(T 1)、恒压和只做膨胀功的条件下进行,则其焓变 零。
10、实际气体的μ=0P T H〈⎪⎭⎫ ⎝⎛∂∂,经节流膨胀后该气体的温度将 。
11、公式Q P =ΔH 的适用条件是 。
12、若某化学反应,只做体积功且满足等容或等压条件,则反应的热效应只由 决定,而与 无关。
物理化学 人民卫生出版社 第6版 复习指导

物理化学人民卫生出版社第6版复习指导熟悉热力学的一些基本概念,如系统与环境、系统的性质、状态函数、热和功及过程与途径等。
2 熟悉热力学第一定律及热力学能的概念。
掌握热和功只有在系统与环境间有能量交换时才有意义。
3 掌握状态函数的概念和特性,掌握热力学能和焓都是状态函数。
4 熟悉准静态过程与可逆过程的意义和特点。
5 掌握热力学第一定律的各种计算方法,如计算理想气体在等温、等压过程中的Q、W、和。
6 了解节流膨胀的概念和意义。
7 掌握应用生成焓及燃烧焓计算反应热的方法。
本章知识点一、基本概念1、系统的分类:敞开系统、封闭系统、孤立系统2、系统的性质:广度性质(m,n,V,C,U,S)、强度性质(T, p, ρ,η)3、状态函数:特征:异途同归,值变相等;周而复始,值变为零。
4、热与功:(1)Q,W的取值符号;(2)Q,W不是状态函数,其数值与过程有关。
二、热力学第一定律1、数学表达式:ΔU = U2pedV (pe为系统外压)2、不同过程的体积功:(特征)(1)自由膨胀:pe = 0, W=0(2)恒外压膨胀(压缩):W=2,例1-4 习题:1,2,3,6,7,8,12二、概念题1、下列说法中哪些是不正确的?【(1)做功;(3)物质交换】(1)绝热封闭系统就是孤立系统;(2)不做功的封闭系统未必就是孤立系统;(3)做功又吸热的系统是封闭系统;(4)与环境有化学作用的系统是敞开系统。
2、一隔板将一刚性绝热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去,左右气体的压力达到平衡。
若以全部气体作为系统,则ΔU,Q,W为正?为负?或为零?【ΔU = W= Q = 0】3、下列物理量中哪些是强度性质?【 A D】A、 UmB、 HC、 QD、 T4、若系统经下列变化过程,则Q,W,Q+W和ΔU各量是否已完全确定?为什么?(1)使一封闭系统由某一始态经不同途径变到同一终态;【Q+W=ΔU确定;Q,W不确定】(2)在绝热的条件下使系统从某一始态变到某一终态。
卫生理化检验技术

2. 三种酸加入顺序为硝酸、硫酸、高氯酸。 3. 消化过程中不单独补加高氯酸,而是硝酸-
高氯酸(1:1)混合酸。 4.对于含有较多酒精、甘油、油脂等样品,不
宜使用本方法。
硫酸高温催化法
原子吸收分光光度法
又称原子吸收光谱法; 当特定波长光通过样品蒸气时,被待测元素
的基态原子吸收,根据透射光强度减弱的程 度,求得样品中待测元素含量; 具有灵敏度高,选择性好,干扰少,精密度 好,应用范围广等特点
荧光分析法
是利用一定波长的紫外-可见光照射某些 物质,这些物质就会发射出特定波长和 不同强度的可见光,从而对物质进行定 性、定量分析;
2.整个消化过程注意调节火力,以防产生爆沸或爆炸; 3.防止炭化现象,及时补加硝酸; 4. 必须脱硝。
硝酸-高氯酸法
先加硝酸进行消化,待大量有机物分解 后,再加高氯酸消化。也可直接使用硝 酸-高氯酸混合液将样品浸泡过夜,或 先小火加热至大量泡沫消失后,再逐渐 提高温度使消化完全。
注意事项
初步阐明环境中各种物理、化学因素对人体的 影响程度,为制订各类卫生标准和采取卫生措 施提供科学依据,还可用来检验其检测的对象 是否符合相应的卫生标准,及评价已采取卫生 措施的效果。
卫生理化检验的分类
根据研究领域分:
营养与食品卫生检验 研究对象为食品、主要检验其中营养与卫生有关的化学物质,其目的是为 人们食用富含营养、安全卫生的食品提供保证
空气中氧的作用下,使有机物彻底分 解,生成CO2、水和其他气体挥发逸 去,剩下的无机物用盐酸或硝酸溶解 后供测试用。
干法操作:炭化、灰化、溶解
医用物理第二版第2章 流体的运动详解

习题2-1.一水平圆管,粗处的直径为8cm,流速为1m•s –1,粗处的直径为细处的2倍,求细处的流速与水在管中的体积流量.2-2.将半径为2cm 的引水管连接到草坪的洒水器上,洒水器装一个有20个小孔的莲蓬头,每个小孔直径为0.5cm.如果水在引水管中的流速为1m•s –1,试求由各小孔喷出的水流速度就是多少?2-3.一粗细不均匀的水平管,粗处的截面积为30cm 2,细处的截面积为10cm 2.用此水平管排水,其流量为3×10–3m 3•s –1.求:(1)粗细两处的流速;(2)粗细两处的压强差.2-4.水在粗细不均匀的管中做定常流动,出口处的截面积为10cm 2,流速为2m•s –1,另一细处的截面积为2cm 2,细处比出口处高0.1m.设大气压强P 0≈105Pa,若不考虑水的黏性,(1)求细处的压强;(2)若在细处开一小孔,水会流出来不?2-5.一种测流速(或流量)的装置如2-5图所示.密度为ρ的理想液体在水平管中做定常流动,已知水平管中A 、B 两处的横截面积分别为S A 与S B ,B 处与大气相通,压强为P 0.若A 处用一竖直细管与注有密度为ρ'(ρ<ρ')的液体的容器C 相通,竖直管中液柱上升的高度为h ,求液体在B 处的流速与液体在管中的体积流量.2-6.用如图2-6图所示的装置采集气体.设U 形管中水柱的高度差为3cm,水平管的横截面积S 为12cm 2,气体的密度为2kg•m –3.求2min 采集的气体的体积.2-7.注射器活塞的面积为S 1,出水孔的面积为S 2,且, S 1 >>S 2活塞的冲程为L,作用于活塞的力为F,如果注射器水平放置,活塞的速度不变,求水从注射器射出的速度与持续的时间(注:一个标准大气压值就是760毫米汞柱 =101325Pa )、2-8.设37℃时血液的黏度η=3、4×10–3Pa•s,密度ρ=1、05×103kg•m –3,若血液以72cm•s –1的平均流速通过主动脉产生了湍流,设此时的雷诺数为1000,求该主动脉的横截面积.2-9.体积为20cm 3的液体在均匀水平管内从压强为1、2×105Pa 的截面流到压强为1、0×105Pa 的截面,求克服黏性力所作的功.2-10.某段微血管的直径受神经控制而缩小了一半,如果其她条件不变,问通过它的血流量将变为原来的多少?2-11.假设排尿时,尿从计示压强为5、33×103 Pa 的膀胱经过尿道后由尿道口排出,已知尿道长4cm,体积流量为21cm 3•s –1,尿的黏度为6、9×10–4 Pa•s,求尿道的有效直径.2-12.某条犬的一根大动脉,内直径为8mm,长度为10cm,流过这段血管的血流流量为1cm 3•s –1,设血液的黏度为2、0×10–3Pa•s .求:(1)血液的平均速度;(2)这段动脉管的流阻;(3)这段血管的血压降落.2-13.设某人的心输出量为8、2×10–5 m 3•s –1,体循环的总压强差为1、2×104Pa,试求此人体循环的总流阻(也称总外周阻力).2-14.液体中有一空气泡,其直径为lmm,密度为1.29 kg•m –3,液体的密度为0、9×103 kg•m –3,黏度为0、15Pa•s .求该空气泡在液体中上升的收尾速度.习题2-5 习题2-62-15.一个红细胞可近似瞧为一个直径为5、0×10–6m 、密度为1、09×103kg•m –3的小球.设血液的黏度为1、2×10–3Pa•s,密度为1、03×103kg•m –3.试计算该红细胞在37℃的血液中沉淀2cm 所需的时间.如果用一台加速度为106g 的超速离心机,问沉淀同样距离所需时间又就是多少?2-1.一水平圆管,粗处的直径为8cm,流速为1m•s -1,粗处的直径为细处的2倍,求细处的流速与水在管中的体积流量.解:(1)已知:d 1=8cm,v 1=1m•s -1,d 1= 2d 2.求:v 2=?,Q =?根据连续性方程1122S S =v v ,有22112244d d ππ=v v ,代入已知条件得()12144m s -==⋅v v(2)水的体积流量为()()2223311122118101 5.02410m s 44Q S S d ππ---====⋅⨯⨯=⨯⋅v v v 2-2.将半径为2cm 的引水管连接到草坪的洒水器上,洒水器装一个有20个小孔的莲蓬头,每个小孔直径为0.5cm.如果水在引水管中的流速为1m•s -1,试求由各小孔喷出的水流速度就是多少?解:已知:总管的半径r 1=2cm,水的流速v 1=1m•s -1;支管的半径为r 2=0.25cm,支管数目为20.求:v 2=?根据连续性方程1122S nS =v v ,有221122r n r ππ=v v ,代入数据,得()()222222101200.2510--⨯⨯=⨯⨯v 从而,解得小孔喷出的水流速度()12 3.2m s -=⋅v .2-3.一粗细不均匀的水平管,粗处的截面积为30cm 2,细处的截面积为10cm 2.用此水平管排水,其流量为3×10-3 m 3•s -1.求:(1)粗细两处的流速;(2)粗细两处的压强差.解:已知:S 1=30cm 2,S 2=10cm 2,Q =3×10-3 m 3•s -1.求:(1) v 1=?,v 2=?;(2) P 1-P 2=?(1)根据连续性方程1122Q S S ==v v ,得 ()()33111244123103101m s , 3m s 30101010Q Q S S ------⨯⨯===⋅===⋅⨯⨯v v (2)根据水平管的伯努利方程22112211++22P P ρρ=v v ,得粗细两处的压强差 ()()22322312211111031410Pa 222P P ρρ-=-=⨯⨯-=⨯v v2-4.水在粗细不均匀的管中做定常流动,出口处的截面积为10cm 2,流速为2m•s -1,另一细处的截面积为2cm 2,细处比出口处高0.1m.设大气压强P 0≈105Pa,若不考虑水的黏性,(1)求细处的压强;(2)若在细处开一小孔,水会流出来不?解:(1) 已知:S 1=10cm 2,v 1=2m•s -1,S 2=2cm 2,P 1= P 0≈105Pa,h 2-h 1=0.1m.求:P 2=?根据连续性方程S 1v 1=S 2v 2,得第二点的流速()111212 510m s S S -===⋅v v v 又根据伯努利方程2211122211+g +g 22P h P h ρρρρ+=+v v ,得第二点的压强 ()()()()()222112125322341-g 211010210109.80.12=5.10210Pa P P h h ρρ=++-=+⨯⨯-+⨯⨯-⨯v v (2) 因为()4205.10210Pa P P =⨯<,所以在细处开一小孔,水不会流出来.2-5.一种测流速(或流量)的装置如右图所示.密度为ρ的理想液体在水平管中做定常流动,已知水平管中A 、B 两处的横截面积分别为S A 与S B ,B 处与大气相通,压强为P 0.若A 处用一竖直细管与注有密度为ρ'(ρ<ρ')的液体的容器C 相通,竖直管中液柱上升的高度为h ,求液体在B 处的流速与液体在管中的体积流量. 解:根据水平管的伯努利方程22A A B B 1122P P ρρ+=+v v 与连续性方程A A B B S S =v v ,解得B 处的流速 B A B A 22B A 2(()P P S S S ρ-=-)v 又由竖直管中液柱的高度差,可知B A P P gh ρ'-=,因而B 处的流速为B A22B A 2()gh S S S ρρ'=-v 进而得水平管中液体的体积流量为 习题2-5B B A B 22B A 2()gh Q S S S S S ρρ'==-v 2-6.用如下图所示的装置采集气体.设U 形管中水柱的高度差为3cm,水平管的横截面积S 为12cm 2,气体的密度为2kg•m -3.求2min 采集的气体的体积.解:根据水平管的伯努利方程2211221122P P ρρ+=+v v , 因弯管处流速v 2=0,因此上式可化为211212P P ρ+=v , 又由U 形管中水柱的高度差知1、2两处的压强差为21P P gh ρ-=水,联立上面两式,解得气体的流速 ()32112g 2109.831017.15m s 2h ρρ--⨯⨯⨯⨯===⋅水v 2min 采集的气体的体积为()4311121017.32260 2.5m V S t -=∆=⨯⨯⨯⨯=v2-7.注射器活塞的面积为S 1,出水孔的面积为S 2,且, S 1 >>S 2活塞的冲程为L,作用于活塞的力为F,如果注射器水平放置,活塞的速度不变,求水从注射器射出的速度与持续的时间(注:一个标准大气压值就是760毫米汞柱 =101325Pa )、解:设活塞与出水孔处的流速分别为v 1与v 2,由连续性方程S 1v 1=S 2v 2,且S 1 >>S 2可得v 1 ≈0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章
热力学第二定律
Clausius
教学要求 掌握:熵增加原理、克劳修斯不等式及在系统变化 方向和限度判别中的意义与应用;物质简单 状态变化、相变化和化学变化各种过程中的 ΔS、ΔF、ΔG,及环境ΔS的计算;ΔS、ΔF、 ΔG判据及应用条件;热力学基本方程。 熟悉:卡诺循环与卡诺定理;熵函数的引入、熵与 混乱度的关系;自发变化的共同性质;热力 学第三定律及规定熵的意义; 了解:热力学第二定律的建立过程。
p2V2 V1 V2 V
自发过程---举例
例2 热量从高温物体传入低温物体
T1,T2热源恢复原状,
T2
W=Q Q’=Q2+W
环境损失W功,得到Q热
W= Q
自发Q2
W
冷冻机 Q2 T1
要使环境也恢复原状,则取决 于在不引起其他变化条件下, 热能否全部转变为功。
结论:在不引起其他变化条件下,热能不能全部 转变为功,所以环境未能复原,因此这种自发过 程是不可逆过程。
第二节
热力学第二定律
通过上述的讨论,我们可得如下结论。 [结论] 一切热机,都必须至少在二个热源之间工作。 一般的低温热源都是——大气。 热机是指:能将热转化为功的机器。 热机工作时,从高温热源吸收热量,将其中一部 分的热转化为功,其余部分的热则传入低温 热源。
Kelven
转下节!
Clausius
第二节
热力学第二定律
[证明]克氏说法不成立,则开氏说法也不成立
如果克氏说法不成立,则可以将热量Q1从 低温热源T1自动地传给高温热源T2 ,而不留下 任何变化。 那么使一机器在T2—T1之 间工作(如图),从T2吸热Q2, 并使它传给T1的热量等于Q1; 并对外做功W(其数值为Q2- Q1)。其结果是:
第一节
自发过程的特征
解决变化的方向性和限度是热力学第二 定律的任务,热力学第二定律引入了S,F, 和G等状态函数,作为特定条件下预测变化 方向和限度的判据。 第二定律是实践经验的总结,它的正确 性不能用数学逻辑证明,它的推论与事实完 全符合。
第一节
自发过程的特征
自发过程(spontaneous process) 是指任其自然、无需人为施加任何外力,就能自动 发生的过程。 自发过程的特征: 1.自发过程具有确定的方向和限度 2.自发过程具有不可逆性 3.自发过程具有作功的能力
Kelven
第一节
自发过程的特征
Clausius
第一节
自发过程的特征
热力学第一定律只说明了当一种形式的能量转变为 另一种形式的能量时,总能量是守恒的,但不能回 答为什么许多并不违反热力学第一定律的变化,却 未能自动发生。 (1 ) (2 ) 气体 真空 高温 低温 低压 低温 高压? 高温?
1 (3) 化学反应: H 2 O H 2 (g) O 2 (g) 2
第二节
热力学第二定律
在理解热力学第二定律上应注意:
1.是指在不引起其它变化的条件下,热不能完全 转化为功;或热不能无条件的完全转化为功;或热 在完全转化为功时,必然会引起一些变化。
如:理想气体的等温膨胀过程,ΔU=0(因是理 想气体的定温过程),所以W=Q(体系从环境 吸热全部变为功),但气体的体积发生变化, 即体系的状态改变了。如果使体系复原,则环 境一定不能复原。
自发过程---举例 例1 理想气体向真空膨胀
Q 0,Байду номын сангаас 0, U 0, T 0
若膨胀后的气体通过恒温压缩过程变回原状,则需 要环境对系统做功W。 W 0 p1V1
p
同时系统向环境放热Q,系统 回复原状。 结论:要使环境也恢复原状, 则取决于在不引起其他变化条 件下,热能否全部转变为功。
Kelven
第二节
热力学第二定律
Clausius
第二节
热力学第二定律
1.克劳修斯(Clausius)表述: “热量由低温物体传给高温物体而不引起其他变化 是不可能的” 2.开尔文(Kelvin)表述: “从单一热源取热使之完全变为功,而不发生其他 变化是不可能的。” “第二类永动机是不可能制成的” 这二种说法是等效的。所谓等效就是指:如果一种 说法不成立,则可以推论出另一种也一定不成立。
