工艺验证方案模板
工艺验证方案(范例)
制药有限公司制药有限公司1.目的根据注射用头孢西丁钠的工艺规程及岗位标准操作规程,制定工艺验证方案以评价注射用头孢西丁钠工艺的各要素及生产全过程可能出现影响到该产品质量的各种生产工艺变化因素,通过工艺验证结果,以确定本工艺是否可行,确保在正常的生产条件下,生产出质量能符合注射用头孢西丁钠质量标准的产品。
2.适用范围适用于注射用头孢西丁钠生产工艺验证的全过程。
3.责任范围公司验证委员会、注射用头孢西丁钠生产工艺验证小组。
4.内容4.1引言4.1.1背景注射用头孢西丁钠生产用设备、设施及公用系统已进行了全面的验证,验证报告由相应的验证小组整理完成。
随后又进行了三次培养基灌装试验,“培养基灌装试验报告”也由相应的验证小组整理完成。
注射用头孢西丁钠是第一次在本公司生产的无菌粉针剂,此验证方案的设计有助于证明注射用头孢西丁钠产品生产过程的稳定性及生产系统的可靠性。
4.1.2方案目标本产品工艺验证方案的目的在于为评价该产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺变化因素提供系统的验证计划,以保证实现在正常的生产条件下,生产出符合产品质量标准及局颁标准的注射用头孢西丁钠无菌粉针剂的宗旨。
C B-ZG-307/00 第1 页共34 页4.1.3方案概要本产品工艺验证方案计划在注射用头孢西丁钠无菌粉针剂在本公司最初生产的前3批产品的生产过程中实施。
本方案的第一部分是对本方案的介绍,其中包括必要的相关资料的介绍以助于对本方案的理解及本方案的实施。
第二部分包括阐述无菌生产准备、无菌粉针分装及包装生产工艺工艺流程并说明关键的生产步骤。
第三部分为注射用头孢西丁钠无菌粉针剂的生产文件包括生产处方和生产工艺规程。
第四部分为质量检验标准,其中包括产品质量标准即注射用头孢西丁钠无菌粉针剂成品质量检验内控标准、原料质量、包装材料质量标准及它们的检验操作规程。
第五部分阐述工艺过程的评价方法,具体分为3个生产过程。
(1)无菌生产准备和灭菌过程;(2)无菌分装过程;(3)包装过程。
工艺验证方案模板

Verification department (department):验证科室(部门):Verify completion date:验证完成日期:Validity:有效期:Index 目录1.Purpose目的 (5)2.Scope范围 (5)3.Responsibility职责 (5)3.1 AAA responsibilities AAA的职责 (5)3.2 XXX responsibilities XXX的职责 (5)4.Regulation and Guidance 法规和指南 (7)5.Abbreviations缩略语 (8)6.Protocol Description方案说明 (10)7.Product And Process Description产品和工艺描述 (12)7.1 Product specification (12)7.2 Drug approval No. (12)7.3 Standard Followed: (12)7.4 Raw Materials and Adjuvants原辅料情况 (12)7.5 Process description: (14)7.6 Process Recipe工艺处方: (18)7.7 List of Production Plants生产车间一览 (23)7.8 List of Production Equipment 生产设备一览 (25)7.9 Process Flow Diagram 工艺流程图 (28)7.10 CPP Identification CPP确认 (28)7.11 Validation Plan验证计划 (42)8.Validation prerequisite验证先决条件 (44)8.1 Personal Identification人员确认 (44)8.2 Process Documentation Verification 生产文件确认 (44)8.3 Training Verification 培训确认 (45)8.4 System and Equipment Instruments Calibration Verification 系统和设备仪表校验确认.. 458.5 System and Equipment Instruments Calibration Verification 生产相关验证状态确认 (46)8.6 Test Instruments Calibration Verification 测试仪器和仪表校验确认 (46)8.7 Testing Method Validation Verification检验方法验证的确认 (46)8.8 Raw Material and Excipient Verification原辅料确认 (47)9.Sampling Plan and Evaluation Criteria取样计划及评估标准 (49)10.Sample Coding Method样品编码原则 (62)11.Process Validation Test Execution 工艺验证执行 (64)11.1 Liquid Preparation 液体配制 (64)11.2 Cell Resurrection and Passage细胞复苏及传代 (66)11.3 Harvest liquid test 收获液检测 (72)11.4 Clarification Filtration Efficacy Test 澄清过滤效果检测 (73)11.5 UF Concentration 1 Efficacy Test超滤浓缩1效果检测 (74)11.6 Ammonium sulfate precipitation efficacy test 硫酸铵沉淀效果检测 (75)11.7 Potassium bromide extraction efficacy test 溴化钾提取效果检测 (76)11.8 First density gradient centrifugation efficacy test 一次密度梯度离心效果检测 (77)11.9 Second density gradient centrifugation efficacy test 二次密度梯度离心效果检测 (78)11.10 UF Concentration 2 Efficacy Test 超滤浓缩2效果检测 (79)11.11 Chromatography purification product test 层析纯化产物检测 (80)12.Bulk Determination原液检验 (82)13.Process Validation Summarization工艺验证总结 (83)14.PV Report工艺验证报告 (83)14.1 Process Validation Report 工艺验证报告 (83)14.2 Process Validation Analysis and Evaluation 工艺验证分析与评价 (84)15.Requirements on Execution Records 执行记录要求 (84)16.Deviation Handling 偏差处理 (84)17.Change Handling 变更处理 (85)18.Test Form测试表 (86)表格1 缩略语 (8)表格2原辅料质量标准表 (10)表格3物料消耗表1 (18)表格4物料消耗表2 (18)表格5所用液体配料表 (19)表格6生产车间一览表 (23)表格7主要生产设备一览表 (25)表格8工艺风险分析表 (33)表格9工艺时间表 (42)表格10取样计划表 (49)表格11样品编码原则 (62)表格12配液取样检测信息表 (64)表格13复苏和传代取样表 (66)表格14复苏和传代样品编码 (72)表格15收获液标准 (73)表格16澄清过滤标准 (74)表格17超滤浓缩1标准 (74)表格18硫酸铵沉淀标准 (75)表格19溴化钾提取标准 (76)表格20一次密度梯度离心标准 (77)表格21二次密度梯度离心标准 (78)表格22超滤浓缩2标准 (79)表格23纯化产物标准 (80)表格24原液标准 (82)表格25测试表列表 (86)1. Purpose目的This purpose of this process validation is to provide documented evidence to show that the combination of the personnel, materials, equipment, methods, environmental conditions and the other related utilities XXX Co., LTD (XXX) can ensure the consistent production of products conforming to the enterprise internal standards and the national standards, and the processes are reliable and conforming to the GMP requirements. The process validation and the test results are to be documented based on this validation protocol.本工艺验证用于提供文件化的证据,证明XXX疫苗一室生产XXX原液的人员、材料、设备、方法、环境条件以及其它有关公用设施的组合可以始终如一的生产出符合企业内控标准及国家法定标准的产品,工艺稳定可靠,符合GMP要求,工艺验证的过程和检查的结果将按照该验证方案进行记录。
工艺验证方案模板
XXXX工艺验证方案文件编码:XXXXXXX目录1.目的 (3)2.围 (3)3.职责 (3)4.参考文件 (4)5.概述 (4)6.验证前准备 (7)6.1人员培训确认 (7)6.2文件确认 (9)6.3验证用仪器/设备确认 (8)6.4环境与介质确认 (9)7.验证实施 (11)7.1原辅料/包材确认 (11)7.2XX工序 (12)7.3。
................................................................................ 错误!未定义书签。
7.4。
(16)7.5总混工序 (16)7.6。
(16)7.7产品抽检 (22)7.8偏差管理 (22)7.9变更控制 (22)8 确认总结 (23)9 附件清单 (23)1.目的根据XXXX产品扩大批量的需求,本企业将原容积为的混合机变更为容积为的型混合机,并根据混合机的容量准备将XXXX的批量由kg/批扩大到kg/批。
为确保XXXX产品的质量,需要对扩大批量后的XXXX生产工艺进行验证,以证明经过变更的生产工艺依然能稳定地生产出符合预定规格及质量标准的产品,生产工艺具有可靠性和重现性,能始终如一的生产出合格的产品。
本工艺验证是在厂房空调净化系统、工艺用纯化水系统、检验方法、关键生产设备及辅助设施、混合机等验证合格的基础上进行的。
2.围适用于XXXX产品的工艺验证。
3.职责生产车间●参与编写验证方案;●实施验证方案,并确保确认顺利进行;●负责验证方案和报告的审核;质量保证部●参与编写验证方案;●负责验证方案和报告的审核;●负责过程监督,确保质量管理的原则体现在验证过程之中;●参与及指导验证的实施、结果评价;●协调验证中各相关部门;质量控制部●负责对验证方案的实施过程中与检测有关的活动;●参与审核验证方案及报告;●质量负责人负责验证文件的批准;●生产负责人负责验证文件的批准;4.参考文件●药品生产质量管理规(2010版)●药品生产验证指南2003版5.概述在生产过程中,厂房设施、设备、公用系统,相关的规程及人员对规程的理解及操作方面的不足均会对产品质量产生很大的影响。
生产工艺验证方案

ⅩⅩⅩ有限公司GMP管理文件目的:为评价水针剂生产系统要素和生产过程中可能影响产品质量的各种生产工艺变化因素提供系统的验证计划。
以保证实现在正常的生产条件下,生产出符合厂控质量标准及《中国药典》标准的×××水针剂。
适用范围:内容:2背景生产区及水针生产用设备、设施及分用系统于×年×月×日至×年×月×日完成了全面的验证。
验证报告由×××主笔。
继上次模拟分装试验成功之后,于×年×月×日又进行了第二次超负荷运转和模拟分装试验,“水针模拟分装试验报告”由×××主笔。
×××产品生产工艺验证方案的设计有利于证明×××产品生产过程的稳定及生产系统的可靠性。
同时此方案为即将进行的产品生产工艺验证和将来进一步的验证工作奠定了基础。
3产品及其生产质量管理文件本验证方案仅适用于根据下述文件进行生产和检验的产品:产品×××水针生产指令书号×××号分装生产处方×××水针分装处方号×年×月×日生效生产工艺规程×××号文件×年×月×日生效×××号文件×年×月×日生效质量标准×××号文件×年×月×日生效×××号文件×年×月×日生效4术语与定义工艺过程验证工艺过程验证即建立可靠的系统的文字依据,以充分证实和保证某种特定的工艺过程稳定地生产出完全符合已确定的产品属性和质量标准的产品。
焊装工艺验证模板
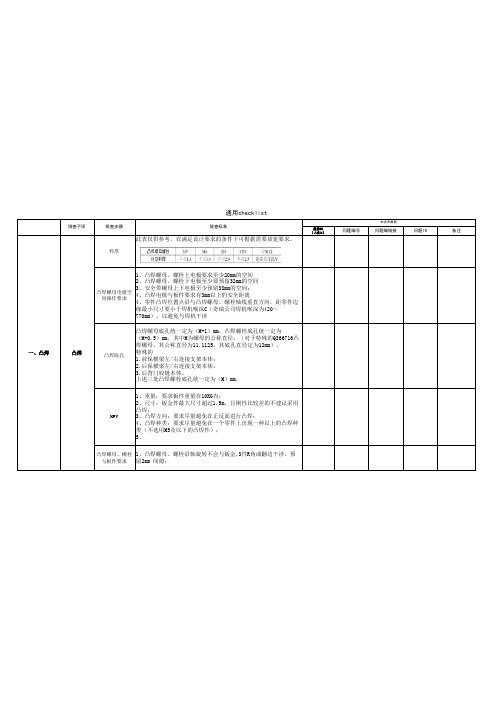
是否OK(√或×)问题编号问题编链接问题ID备注料厚此表仅供参考,在满足设计要求的条件下可根据需要放宽要求。
凸焊螺母电极空间操作要求1、凸焊螺母、螺栓上电极要求至少20mm的空间2、凸焊螺母、螺栓下电极至少要预留32mm的空间3、安全带螺母上下电极至少预留38mm的空间;4、凸焊电极与板件要求有3mm以上的安全距离4、零件凸焊位置点沿与凸焊螺母、螺栓轴线垂直方向,距零件边缘最小尺寸要小于焊机喉深C(奇瑞公司焊机喉深为420~770mm),以避免与焊机干涉凸焊底孔凸焊螺母底孔统一定为(M+1)mm,凸焊螺栓底孔统一定为(M+0.5)mm,其中M为螺母的公称直径;(对于特殊的Q366716凸焊螺母,其公称直径为11.1125,其底孔直径定为12mm)。
特殊的1.前保横梁左/右连接支架本体;2.后保横梁左/右连接支架本体;3.后背门铰链本体。
上述三处凸焊螺栓底孔统一定为(M)mm,HPV 1、重量:要求钣件重量在10KG内;2、尺寸:钣金件最大尺寸超过1.5m,且刚性比较差的不建议采用凸焊;3、凸焊方向:要求尽量避免在正反面进行凸焊;4、凸焊种类:要求尽量避免在一个零件上出现一种以上的凸焊种类(不选用M5及以下的凸焊件);5、凸焊螺母、螺栓与板件要求1、凸焊螺母、螺栓沿轴旋转不会与钣金,3件R角或翻边干涉,预留2mm 间隙;通用checklist排查子项排查步骤排查标准M1发布数据一、凸焊凸焊(√或×)问题编号问题编链接问题ID备注零部件形状搬运性,工位器具性1、三级以下总成避免出现过长、过大的零件以及刚性不好的零件;2、零件在工位器具上能够稳定的位置放置。
约束过多1、零件的搭接关系复杂,搭接面型面过于复杂,难以保证装配到位,建议产品设计局部贴合,在点焊的地方做贴合其他位置放开2、避免4面搭接以上的搭接面出现。
装配过程中零件是否干涉零件相互安全距离1、分析零件在沿定位孔法向运动时,是否会与其他零件干涉。
xxxx工艺验证方案(模板)

XXXX工艺验证方案目录1产品概述2验证目的3验证范围4验证小组成员及职责5工艺过程描述5.1各工序生产过程5.2生产工艺流程图5.3生产投料量、关键工艺参数及控制标准、检查方法5.4主要生产设备一览表6、系统要素的确认与评价(验证前确认)6.1 相关设施设备的验证6.2 生产系统要素的确认6.2.1计量器具校验情况确认6.2.2生产相关操作文件系统的确认6.2.3人员情况确认6.2.4 生产环境的确认6.2.5 原辅料、包装材料的质量确认6.2.6 生产指令的正确性确认7、生产工艺变量的评价7.1XXX工序7.2—7.4(略)7.5结晶工序7.6干燥工序7.7内包装工序7.8外包装工序7.9总物料平衡7.10质量保证7.10.1文件完整7.10.2正确的检验方法7.10.3检验结果正确8成品质量检验9进度安排9.1验证批次9.2验证时间安排10偏差情况概述及采取措施11适用的验证总计划12变更情况概述及处理结果13再验证周期14验证结果总结评价与建议15附表1产品概述XXXX原料药为?(性状)。
XXXX原料药是?剂,其药理作用特性是?。
临床主要?。
现在我们按照XXXX的工艺流程,分工序对本产品生产的每个操作过程和技术参数进行具体的确认和分析,在此基础上,进一步完善和确定关键技术参数,并对生产工艺规程及岗位标准操作规程的技术参数提出确定或修订,确保产品质量稳定均一。
2验证目的XXXX工艺验证是为了证明在现有生产环境、生产设备条件下,以现有的生产条件和工艺参数为前提,所生产的产品在确定的环境、工艺和操作下能够生产出符合质量标准的产品。
同时,通过工艺验证能够明确以下几点:1 通过验证,确定工艺参数范围的可控性与重现性,确定工艺规程及岗位标准操作规程的合理性,并分析出生产全过程可能出现影响到产品质量的各种生产工艺变化的关键因素,纠正偏差,建立明确的控制参数及控制标准,从而使生产过程可控,生产工艺持续稳定。
工艺验证模板

标准技术程序-验证文件(宋体五号居中)XXXX验证方案(黑体三号居中)此处空两行方案批准:(黑体小四)此处空一行你的签名证明了你已清楚了解本文件及附件内容,并理解认可本文件的所有条款此处空两行此处空两行文件目录(黑体小四)1. 验证概述(宋体小四)3...2. 验证目的 (3)3. 验证范围 (3)4. 职责 (3)5. 文件及资料3...6. 验证时间与计划3...7. 人员培训 (3)8. 验证的实施3...9. 总结报告 (4)10. 最终审批结果5...11. 再验证 (5)12. 附件清单 (5)13. 附件 (6)1. 验证概述(宋体小四)正文宋体小四(没有特殊要求,下方正文均为宋体小四)2. 验证目的3. 验证范围4. 职责4.1. 验证组长职责:4.1.1.4.1.2.4.1.3.42 QA职责4.2.1.4.2.2.4.2.3.4.3. 其他验证员职责4.3.1.4.3.2.4.3.3.5. 文件及资料5.1.6. 验证时间与计划本次XX设备XX确认计:划于XXX)年XX月XX日-XXXX年XX月XX日实施7. 人员培训验证过程中,确认方案以及验证中应该掌握的技能应该进行培训,培训应遵循《人员培训考核管理规程》。
8. 验证的实施8.1. XX确认8.1.1. 目的8.1.2. 方法8.1.3. 接受标准8.1.4. 本项要附的附件例如:附表 7.1 表头名称8.1.5.结果测试结果[] 通过[] 带有偏差,执行《偏差处理管理规程》()和《纠正和预防措施管理规程》(),纠正后通过[] 失败,执行《偏差处理管理规程》(),填与偏差号9. 总结报告9.1. 目的总结报告的目的是文件性证明在执行本 XX确认过程中获得的结论,总结已经完成的确认讨论结果和对偏离规格说明书、方案程序或接受标准的解释。
总结报告圆满完成并被批准之后,可以完成本 XX确认报告。
10. 最终审批结果10.1. 签字人员必须检查本方案中所有内容的完成情况,只有在所有内容都完成并符合要求, 或有偏差但经过分析或纠正,确认不影响系统预期功能的情况下,才能签字。
3QIQOQPQ验证方案模版

3QIQOQPQ验证方案模版简介:3QIQOQPQ验证方案是一种常用的验证方案模板,适用于药品生产企业进行生产设备、工艺和操作工艺参数的验证。
该验证方案的目的是确保生产过程的准确性、稳定性和一致性,以满足药品质量的要求。
本文将详细介绍3QIQOQPQ验证方案的具体内容和步骤。
一、验证目标和范围1.1验证目标:确保生产设备、工艺和操作工艺参数的准确性、稳定性和一致性,以保证药品质量满足要求。
1.2验证范围:本次验证主要针对以下方面进行验证:-清洁验证-设备操作验证-工艺参数验证-生产过程验证-数据记录验证二、验证方法和步骤2.1清洁验证:在验证清洁过程时,需验证清洁剂的效力、清洁方法和清洁程序的适用性,确保生产设备在使用前能够彻底清洁。
2.2设备操作验证:设备操作验证主要包括设备的安装验证、设备各个功能模块的操作验证、设备的启动停止验证等。
通过验证确保设备的操作正常、准确。
2.3工艺参数验证:工艺参数验证主要验证生产工艺过程中的各项参数是否合理、稳定和准确。
如温度、时间、速度等。
通过验证确保工艺参数能够保证药品质量的稳定。
2.4生产过程验证:生产过程验证主要验证各个环节的生产过程的准确性和一致性,包括原材料投入、操作过程、输出物验证等。
通过验证确保生产过程的可控性和稳定性。
2.5数据记录验证:数据记录验证主要验证记录数据的准确性和完整性,包括生产设备操作记录、工艺参数记录和生产过程记录等。
通过验证确保数据记录的可靠性和可追溯性。
三、验证计划和安排3.1验证计划:根据验证目标和范围,制定详细的验证计划,明确验证的时间、地点、人员和资源等。
确保验证工作按计划进行。
3.2验证安排:根据验证计划,安排相应的验证任务和责任人,明确每个验证步骤的具体操作和执行时间,确保验证过程顺利进行。
3.3验证结果分析:根据验证数据和结果,进行数据分析和统计,评估验证结果是否符合要求。
如果不符合要求,则需采取相应的纠正和改进措施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Verification department (department):验证科室(部门):Verify completion date:验证完成日期:Validity:有效期:Index 目录1.Purpose目的 (5)2.Scope范围 (5)3.Responsibility职责 (5)3.1 AAA responsibilities AAA的职责 (5)3.2 XXX responsibilities XXX的职责 (6)4.Regulation and Guidance 法规和指南 (8)5.Abbreviations缩略语 (9)6.Protocol Description方案说明 (11)7.Product And Process Description产品和工艺描述 (14)7.1 Product specification (14)7.2 Drug approval No. (14)7.3 Standard Followed: (14)7.4 Raw Materials and Adjuvants原辅料情况 (14)7.5 Process description: (16)7.6 Process Recipe工艺处方: (21)7.7 List of Production Plants生产车间一览 (26)7.8 List of Production Equipment 生产设备一览 (29)7.9 Process Flow Diagram 工艺流程图 (33)7.10 CPP Identification CPP确认 (34)7.11 Validation Plan验证计划 (49)8.Validation prerequisite验证先决条件 (51)8.1 Personal Identification人员确认 (51)8.2 Process Documentation Verification 生产文件确认 (51)8.3 Training Verification 培训确认 (52)8.4 System and Equipment Instruments Calibration Verification 系统和设备仪表校验确认.. 528.5 System and Equipment Instruments Calibration Verification 生产相关验证状态确认 (53)8.6 Test Instruments Calibration Verification 测试仪器和仪表校验确认 (53)8.7 Testing Method Validation Verification检验方法验证的确认 (54)8.8 Raw Material and Excipient Verification原辅料确认 (54)9.Sampling Plan and Evaluation Criteria取样计划及评估标准 (56)10.Sample Coding Method样品编码原则 (70)11.Process Validation Test Execution 工艺验证执行 (72)11.1 Liquid Preparation 液体配制 (72)11.2 Cell Resurrection and Passage细胞复苏及传代 (74)11.3 Harvest liquid test 收获液检测 (81)11.4 Clarification Filtration Efficacy Test 澄清过滤效果检测 (83)11.5 UF Concentration 1 Efficacy Test超滤浓缩1效果检测 (83)11.6 Ammonium sulfate precipitation efficacy test 硫酸铵沉淀效果检测 (84)11.7 Potassium bromide extraction efficacy test 溴化钾提取效果检测 (85)11.8 First density gradient centrifugation efficacy test 一次密度梯度离心效果检测 (86)11.9 Second density gradient centrifugation efficacy test 二次密度梯度离心效果检测 (87)11.10 UF Concentration 2 Efficacy Test 超滤浓缩2效果检测 (88)11.11 Chromatography purification product test 层析纯化产物检测 (90)12.Bulk Determination原液检验 (92)13.Process Validation Summarization工艺验证总结 (93)14.PV Report工艺验证报告 (94)14.1 Process Validation Report 工艺验证报告 (94)14.2 Process Validation Analysis and Evaluation 工艺验证分析与评价 (94)15.Requirements on Execution Records 执行记录要求 (95)16.Deviation Handling 偏差处理 (95)17.Change Handling 变更处理 (95)18.Test Form测试表 (96)表格1 缩略语 (9)表格2原辅料质量标准表 (11)表格3物料消耗表1 (21)表格4物料消耗表2 (21)表格5所用液体配料表 (22)表格6生产车间一览表 (26)表格7主要生产设备一览表 (29)表格8工艺风险分析表 (33)表格9工艺时间表 (49)表格10取样计划表 (56)表格11样品编码原则 (70)表格12配液取样检测信息表 (72)表格13复苏和传代取样表 (74)表格14复苏和传代样品编码 (80)表格15收获液标准 (81)表格16澄清过滤标准 (83)表格17超滤浓缩1标准 (83)表格18硫酸铵沉淀标准 (85)表格19溴化钾提取标准 (86)表格20一次密度梯度离心标准 (87)表格21二次密度梯度离心标准 (88)表格22超滤浓缩2标准 (89)表格23纯化产物标准 (90)表格24原液标准 (92)表格25测试表列表 (96)1. Purpose目的This purpose of this process validation is to provide documented evidence to show that the combination of the personnel, materials, equipment, methods, environmental conditions and the other related utilities XXX Co., LTD (XXX) can ensure the consistent production of products conforming to the enterprise internal standards and the national standards, and the processes are reliable and conforming to the GMP requirements. The process validation and the test results are to be documented based on this validation protocol.本工艺验证用于提供文件化的证据,证明XXX疫苗一室生产XXX原液的人员、材料、设备、方法、环境条件以及其它有关公用设施的组合可以始终如一的生产出符合企业内控标准及国家法定标准的产品,工艺稳定可靠,符合GMP要求,工艺验证的过程和检查的结果将按照该验证方案进行记录。
2. Scope范围This protocol is applicable to the process validation of XXX produced by the equipment located XXX.本方案适用于XXX原液生产的工艺验证。
由于工作细胞库制备的过程并非常规生产过程,因此,不在本次验证中进行考察。
The labeling and packaging processes are not within the scope of this document since these processes have been validated per PQ protocol (labeling) and PQ protocol (packaging), and these processes have minimal impact on finished product quality.贴标签和包装也不在此文件范围内,因为这些工艺已经按照PQ方案(贴标签)和PQ方案(包装)验证过,并且这些工艺对产品质量极少有影响。
3. Responsibility职责3.1 AAA responsibilities AAA的职责✓Compile Protocol方案的编写✓Guide Protocol execution, data collection/ Provide test data for review upon request by customer指导方案的实施,数据的收集/在客户要求时提供测试数据供其审核✓Final report Review/ Analyze and compile data into the summary report最终报告的审核/对数据进行分析并将其编辑入总结报告之中3.2 XXX responsibilities XXX的职责⏹Production department 生产部✓Review and approve protocol审核并批准验证方案✓Assure all the equipment used for validation can be maintained timely保证验证用所有设备均能按SOP进行及时的维护和保养✓Assure all the raw materials used for validation can be supplied timely and comply with domestic quality criteria of enterprise保证验证用原辅包装材料能按时到货,并符合企业内控标准⏹Research and development department 研发部✓Provide product registration criteria and review whether recipe and process step described in the protocol is complying with registered criteria提供产品的注册工艺,审核方案中生产处方、工艺与注册资料的一致性✓Review and make assurance the compliance of raw material supplier with registered supplier审核原辅料供应商和注册资料的一致性✓Review relevant quality criteria including raw material, intermedia and finished product 审核原辅料标准、中控质量标准和成品的质量标准⏹Vaccine one Plant 疫苗一室✓Coordination and implementation of this validation protocol协调、实施本验证方案✓Training of personnel based on this validation protocol按验证方案对有关人员进行培训✓Collection, sorting and reviewing of validation data and drafting of validation reports (including the deviation report, if there are any deviations)收集、整理和审核验证数据,起草验证报告(如方案执行有偏差,要完成偏差报告)。
