书写化学方程式竞赛试题
高中化学方程式比赛试题

高中化学方程式比赛试题work Information Technology Company.2020YEAR高中化学方程式书写比赛题目班级姓名能用离子方程式表示的要写出离子方程式1.大理石与盐酸反应2.电解饱和食盐水3.钠在氯气中燃烧4.铜丝在氯气中燃烧5.铁在氯气中剧烈燃烧6.氢气在氯气中燃烧7.氟气与氢气反应8.氯气溶于水9.次氯酸见光分解10.工业制漂白粉的原理11.漂白粉失效的原因12.氯气的实验室制法:13.新制氯水注入盛溴化钠溶液的试管中14.新制氯水注入盛碘化钾溶液的试管中15.单质溴与碘化钾溶液反应16.溴化钠溶液与硝酸银溶液反应17.碘化钠溶液与硝酸银溶液反应18.钠在空气中燃烧19.钠块在空气中变暗20.钠与水反应21.碱性氧化物氧化钠与水的反应22.氧化钠与盐酸的反应23.过氧化钠与水的反应24.过氧化钠与二氧化碳反应25.小苏打受热分解26.碳酸钠溶液与氢氧化钙溶液反应27.二氧化碳通入碳酸钠溶液中28.电解熔融氯化钠29.氯化镁溶液与氢氧化钙溶液反应30.镁与氮气反应31.镁与二氧化碳反应32.氧化铝与硫酸反应33.氧化铝与氢氧化钠反应34.电解熔融氧化铝35.高温灼烧氢氧化铝36.氢氧化铝与盐酸反应37.氢氧化铝与氢氧化钠反应38.偏铝酸钠溶液与二氧化碳反应39.氯化铝与氨水反应40.明矾的电离方程式41.铝与盐酸反应42.铝与氢氧化钠溶液反应43.铝热反应,铝与氧化铁反应44.氯化铝与少量的氢氧化钠溶液反应45.氯化铝与过量的氢氧化钠溶液反应46.偏铝酸钠与少量的盐酸溶液反应47.偏铝酸钠与过量的盐酸溶液反应48.CO还原三氧化二铁49.铁与硫的反应50.用硫氰化钾溶液检验三价铁离子的离子反应方程式51.铜与氯化铁溶液反应52.铁与氯化铁溶液反应53.新制氯水与氯化亚铁溶液反应54.二氧化硅与氢氧化钠溶液反应55.二氧化硅与碳酸钠反应(制取玻璃)56.二氧化硅与氢氟酸反应57.碳在高温下还原二氧化硅58.水玻璃与二氧化碳反应59.在澄清石灰水中通入少量二氧化硫60.在氢氧化钡溶液中通入过量二氧化硫61.在亚硫酸钠中通入氧气62.在亚硫酸钠溶液中逐滴滴入硫酸63.氢氧化钡溶液与硫酸混合64.浓硫酸与铜混合加热65.浓硫酸与炭混合加热66.氮气与氧气反应67.二氧化氮溶于水68.氮气与氢气合成氨69.氨气遇浓盐酸70.氯化铵分解71.氯化铵溶液与氢氧化钠溶液在加热条件下反应72.铜与浓硝酸反应73.铜与稀硝酸反应74.炭与浓硝酸反应75.浓硝酸见光分解76.甲烷与氯气发生取代反应77.乙烯与Br2的CCl4溶液反应78.乙烯与HBr发生加成反应79.乙烯与H2O发生加成反应80.乙烯的加聚反应。
初中化学方程式书写比赛

初中化学方程式书写比赛
化合反应
1、铁在氧气中燃烧:
2、红磷在空气中燃烧:
3、碳在氧气中不充分燃烧:
4、二氧化碳通过灼热碳层:
分解反应
5、加热高锰酸钾:↑
6、高温煅烧石灰石:
置换反应
7、氢气还原氧化铜:
8、焦炭还原氧化铁:
9、石灰石与稀盐酸反应↑
五.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)
10. 铁和稀硫酸:
11、自写一个:
(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐
12. 铁和硫酸铜溶液反应:
13、自写一个:
(3)碱性氧化物+酸-------- 盐+ 水
14. 氧化铁和稀盐酸反应:
15、自写一个:
(4)酸性氧化物+碱-------- 盐+ 水
16.苛性钠暴露在空气中变质:
17、自写一个:
(5)酸+ 碱-------- 盐+ 水
18. 硫酸和氢氧化铁反应:
19、自写一个:
(6)酸+ 盐-------- 另一种酸+ 另一种盐
20.硫酸和氯化钡溶液反应:
21、自写一个:
(7)碱+ 盐-------- 另一种碱+ 另一种盐
22. 氢氧化钙与碳酸钠:
23、自写一个:
(8)盐+ 盐----- 两种新盐
24.硫酸钠和氯化钡:
25、自写一个:
感谢您的阅读,祝您生活愉快。
化学方程式书写竞赛

新启新班化学方程式听写竞赛(2019-05-23)班级:学号:姓名:一、教材是基础,你可以的!(2*21=42分)1.实验室制氯气的离子方程式2. 过量的铁在氯气中燃烧3.工业制漂白粉4.钠与水反应离子方程式5.向饱和碳酸钠溶液中通入CO2(化学方程式)6.硫酸氢钠熔融状态电离方程式7.工业制金属镁8.氮化镁与盐酸反应(化学方程式)9.镁在二氧化碳中燃烧10.铝和氢氧化钠溶液反应(化学方程式)11.偏铝酸钠溶液中通入过量二氧化碳(离子方程式)12.氯化铝与氨水反应离子方程式13.氧化亚铜与稀硫酸反应离子方程式14.硫酸亚铁溶液中滴加酸化的双氧水溶液(离子方程式)15.氯化铁溶液中通入二氧化硫(离子方程式)16.硅酸钠溶液中通入过量的二氧化碳(离子方程式)17.工业制硅第一步化学方程式18.碳与浓硫酸反应化学方程式19.氯气与水反应离子方程式20.一氧化碳还原磁铁矿化学方程式21.漂白粉溶液中通入少量二氧化碳(化学方程式)二.众里寻她千百度难忘初见那一幕(写出化学方程式)(2*5)22.溶液中弱酸制取强酸:23.发生复分解反应,但既没有沉淀生成,又没有气体和水生成:24.金属与盐溶液反应,反应类型不是置换反应:25.酸性氧化物与酸反应:26.金属单质与碱溶液反应:二.陌生反应走套路氧化还原是归宿(3*16)27.双氧水的浓度可在酸性条件下用KMnO4溶液滴定测定。
该反应的离子方程式为:28.MnO2可与KOH、KClO3在高温下反应制取锰酸钾:(写出化学方程式)锰酸钾在稀硫酸中歧化,又可以得到MnO2:(写出化学方程式)29.将H2S气体通入酸性高锰酸钾(硫酸酸化)溶液中,有浅黄色沉淀生成。
(写出化学方程式)30.Na2S2O3还原性较强,常用作脱氯剂,它可以除去水中溶解的Cl2。
该反应的离子方程式为:31.ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取。
该反应的离子方程式为:32.NaBH4是一种重要的储氢材料,它与水反应生成NaBO2,发生反应的化学方程式为:33.向酸性高锰酸钾(H2SO4酸化)溶液中滴加Na2C2O4溶液,溶液紫色褪去。
初三化学方程式书写竞赛

初三化学方程式书写竞赛班级:姓名:得分:1、氢气在氧气中燃烧;2、生石灰与水反应;;3、铝丝在氧气中燃烧;4、白磷在空气中燃烧;5、实验室用高锰酸钾制取氧气;6、实验室用常用锌粒和稀硫酸制取氢气;7、铜丝插入硝酸银溶液中;8、氢气还原氧化铜;9、实验室常用氢氧化钠吸收多余的二氧化碳;10、实验室用大理石和稀盐酸制取二氧化碳;11、甲烷在空气中燃烧;12、二氧化碳使石蕊溶液变红的原因;13、铝丝与硫酸铜溶液反应;14、用澄清石灰水检验二氧化碳;15、铁与稀盐酸反应;16、过氧化氢在催化剂条件下分解;17、铁在氧气中燃烧;18、氧化铜能溶于稀硫酸;19、一氧化碳还原氧化铁;20、熟石灰中和废液中的硫酸;21、丙烷(C3H8)能在空气中燃烧生成二氧化碳和水;22、苏打能与稀硝酸反应;23、木炭还原氧化铜;24、纯碱中加入氢氧化钙可制取氢氧化钠;25、氢氧化铝能治疗胃酸过多;26、氨水能与稀硫酸发生中和反应;27、食盐溶液中滴加硝酸银溶液,会有白色沉淀产生;28、水在通电条件下分解;29、硫酸钠能与硝酸钡反应;30、钠能与水反应生成一种强碱和氢气;31、乙酸与火碱中和;32、乙醇在空气中燃烧;33、氮气和氢气在高温、高压、催化剂条件下反应生成氨气;34、三氧化硫与水反应35、硫酸铜溶液能与氢氧化钡溶液反应;36、小苏打能治疗胃酸过多;37、铁在氯气中燃烧生成氯化铁;38、铝和稀硫酸反应;39、醋酸出锅垢(主要成分CaCO3);40、在碳酸钠溶液中滴加稀硝酸;41、碳酸铵与氢氧化钠反应;42、木炭还原氧化铜43、二氧化硅与碳在高温条件下反应生成硅单质和一氧化碳;44、氯气与水反应生成次氯酸(HClO)和盐酸;45、干粉灭火器的原理是小苏打在加热条件下分解成苏二氧化碳和水;46、氯化铁溶液与氢氧化钠的反应;47、过氧化钠(Na2O2)与二氧化碳反应生成碳酸钠和氧气;48、一氧化氮在空气中变成二氧化氮49、一氧化碳和二氧化氮在催化剂作用下转化为空气中无污染的两种气体;50、加热氯化铵和氢氧化钙固体的混合物,会生成氨气、水和一种盐;。
高一化学方程式书写比赛试题答案(初赛)

高一化学方程式书写比赛试题答案(初赛)1、向氢氧化钠溶液中通入少量CO2:2NaOH + CO2 ==== Na2CO3+ H2O离子方程式:CO2+2 OH-CO32-+ H2O2、过量CO2通入NaOH溶液中:CO2+NaOH NaHCO3离子方程式:CO2+ OH-HCO3-3、烧碱溶液中通入过量二氧化硫:NaOH +SO2==NaHSO3离子方程式:OH- +SO2 HSO3-4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2离子方程式:CO2+ OH-HCO3-5、氨水中通入少量二氧化碳:2NH3•H2O+CO2== (NH4)2 CO3+ H2O离子方程式:2NH3•H2O+CO2== 2NH4++2H2O+CO326、用碳酸钠溶液吸收少量二氧化硫气体:Na2CO3+ SO2Na2SO3+ CO2离子方程式:CO32-+ SO2SO32-+ CO27、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3离子方程式:CO32-+ CO2 +H2O══2HCO3-8、氯化铁溶液中通入碘化氢气体:2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl离子方程式:2Fe3++2I-2Fe 2++ I29、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4 离子方程式:ClO-+SO2+ H2O══Cl-+2 H++SO42-10、氯气通入水中:Cl2+H2O HCl+HclO离子方程式:Cl2+H2O H++Cl-+HClO11、氟气通入水中:2F2+2H2O 4HF+O2离子方程式:2F2+2H2O 4HF+O212、氯气通入冷的氢氧化钠溶液中:Cl2+2 NaOH══NaClO+NaCl+ H2O离子方程式:Cl2+ 2OH-══ ClO-+ Cl-+ H2O13、FeBr2溶液中通入过量Cl2:2FeBr2+ 3Cl2══2FeCl3+2 Br2离子方程式:2Fe 2++4 Br-+ 3Cl2══2Fe3+++2 Br2+6Cl-14、足量氯气通入碘化亚铁溶液中:3Cl2+2FeI22FeCl3+2I2离子方程式:3Cl2+2Fe 2++4I-2Fe3++2I2 +6Cl-15、在FeI2溶液中滴入少量溴水:FeI2 +Br2FeBr2+ I2离子方程式:Br2+2I-2Br-+ I216、氯化亚铁溶液中滴入溴水:6FeCl2 + 3Br2══4FeCl3+2 FeBr3离子方程式:2Fe 2++ Br2══2Fe3++2Br-17、钠与水反应:2Na+2H2O 2NaOH +H2↑离子方程式:2Na+2H2O 2Na++2OH- +H2↑18、铝片投入氢氧化钠溶液:2Al+ 2NaOH +2H2O 2 NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O 2AlO2-+3H2↑19、氯化铁溶液中加入铁粉:2FeCl3+ Fe 3 FeCl2离子方程式:2Fe3++Fe 3 Fe 2+20、FeCl3溶液与Cu反应:2FeCl3+ Cu CuCl2+2FeCl2离子方程式:2Fe3++Cu Cu2++2Fe 2+21、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑离子方程式:2Na2O2+2H2O=4 Na++4OH- +O2↑22、铜与浓硝酸:Cu+4HNO3(浓)Cu(NO3)2+ 2NO2↑+ 2H2O离子方程式:Cu+4H++2NO3-Cu2++ 2NO2↑+ 2H2O23、铜与稀硝酸:3Cu+8HNO3(稀)3Cu(NO3)2+ 2NO↑+ 4H2O离子方程式:3Cu+8H++2NO3-3Cu2++ 2NO↑+ 4H2O24、稀硝酸与过量的铁屑反应3Fe+8HNO3(稀)3Fe(NO3)2+ 2NO↑+ 4H2O离子方程式:3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O25、电解饱和食盐水:2 NaCl+2H2O C12↑+ H2↑+2NaOH离子方程式:2Cl-+2H2O C12↑+ H2↑+ 2OH-26、在硫酸铜溶液中加入过量氢氧化钡溶液: CuSO4+ Ba(OH)2══Cu(OH)2↓+ BaSO4↓离子方程式:Cu2++SO42-+ Ba2++2OH-══Cu(OH)2↓+ BaSO4↓27、少量氢氧化钙溶液与碳酸氢钙溶液混合:Ca(HCO3)2+ Ca(OH)22CaCO3↓+2H2O离子方程式:Ca 2++ HCO 3-+OH -══CaCO 3↓+H 2O 28、向Ca(HCO 3)2溶液加入足量的氢氧化钠溶液: Ca(HCO 3)2+ 2NaOH ═CaCO 3↓+ Na 2CO 3+2 H 2O 离子方程式:Ca 2++ 2HCO 3-+2OH -══CaCO 3↓+2H 2O +CO 32- 29、少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca (OH )2+ 2NaHCO 3══CaCO 3↓+ Na 2CO 3+2 H 2O离子方程式:Ca 2++ 2HCO 3-+2OH -══CaCO 3↓+2H 2O +CO 32- 30、NH 4HCO 3溶液与过量的NaOH 溶液微热反应:NH 4HCO 3+2NaOH (过量)===△Na 2CO 3+ NH 3↑+2 H 2O离子方程式:NH 4++HCO 3-+2OH -===△CO 32-+ 2H 2O +NH 3↑ 31、在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH 4HSO 3+ 2NaOH Na 2SO 3+ NH 3·H 2O+ H 2O离子方程式:NH 4++HSO 3-+2OH -══SO 32-+ NH 3·H 2O+ H 2O 32、硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:2Na HSO 4+ Ba (OH )2══Na 2 SO 4 +BaSO 4↓+2 H 2O离子方程式:2H ++SO 42-+ Ba 2++2OH -══BaSO 4↓ + 2H 2O 33、大理石与盐酸反应制CO 2气体:CaCO 3+ 2HCl ══ CaCl 2+ CO 2↑+ H 2O 离子方程式:CaCO 3+ 2H +══Ca 2++CO 2↑+ H 2O 34、碳酸钙中滴入醋酸溶液:CaCO 3+ 2CH 3COOH==(CH 3COO )2Ca +CO 2↑+ H 2O离子方程式:CaCO 3+ 2CH 3COOH==2CH 3COO -+Ca 2++CO 2↑+ H 2O 35、碳酸氢钙溶液和盐酸反应: Ca(HCO 3)2+ 2HCl CaCl 2+ 2CO 2↑+2H 2O 离子方程式:HCO 3-+H +CO 2↑+H 2O 36、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:Na 2CO 3+ HCl NaCl+ NaHCO 3 离子方程式:CO 32-+H +HCO 3- 37、实验室制备氢氧化铁胶体:FeCl 3+3H 2O ===△Fe(OH)3(胶体)+ 3HCl离子方程式:Fe 3++3H 2O ===△Fe(OH)3(胶体)+ 3H +38、氨气的实验室制取法:2NH4Cl + Ca(OH)2CaCl2 + 2H2O + 2NH3↑39、铁与水蒸气反应:3Fe + 4H2O(g) Fe3O4 + 4H240、常温下钠与氧气反应:4Na + O2 = 2Na2O41、钠在空气中燃烧:2Na + O2Na2O2(淡黄色)42、氮气与氧气在放电下反应:N2 + O22NO43、二氧化硫与氧气反应:2SO2+O22SO344、氢氧化亚铁被氧化成氢氧化铁(用氯化铁溶液):4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)345、二氧化硅与氧化钙高温反应生成硅酸钙SiO2 + CaO CaSiO346、次氯酸光照分解:2HClO2HCl + O2↑47、电解Al2O3制金属铝: 2Al2O3(熔融) 4Al+3O2↑48、浓硫酸与铜发生的还原反应Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑49、氯气与消石灰反应制漂白粉:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O50、二氧化氮与水反应制硝酸:3NO2 + H2O = 2HNO3 + NO51、氯气的实验室制法:MnO2+4HCl(浓)MnCl2+Cl2↑+H2O52、Al(OH)3与氢氧化钠溶液反应:Al(OH)3 + NaOH =NaAlO2 + 2H2O53、工业合成氨反应:N2+3H22NH3。
1-6单元化学方程式书写竞赛

1-6单元化学方程式竞赛
班级姓名
1、碳在充足的氧气中燃烧:
2、在氧气中燃烧发出蓝紫色火焰,生成有刺激性气味的气体,放出热量:
3、在氧气中燃烧发出耀眼的白光,放热,生成大量白烟
4、在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体
5、在空气中剧烈燃烧发出耀眼的白光,放热,生成白色粉末状固体:
6、氢气中空气中燃烧:
7、水在直流电的作用下分解:
8、用过氧化氢制氧气:
9、用高锰酸钾制氧气:
10、用氯酸钾制氧气:
11、碳在氧气中不充分燃烧:
12、木炭还原氧化铜:
13、焦炭还原氧化铁:
14、焦炭还原四氧化三铁:
15、焦炭还原二氧化碳:
16、二氧化碳溶解于水:
17、碳酸不稳定而分解:
18、熟石灰放在空气中变质:
19、高温煅烧石灰石:
20、实验室制二氧化碳:
21、泡沫灭火器反应原理:
22、一氧化碳燃烧:
23、一氧化碳还原氧化铜:
24、一氧化碳还原氧化铁:
25、一氧化碳还原四氧化三铁:
26、甲烷燃烧:
27、乙醇燃烧:
28、实验室制取氢气:
29、氢气还原氧化铜:
30、镁和稀盐酸:
31、铁和硫酸铜溶液反应:
32、三氧化硫溶于水:
33、二氧化硫溶于水:。
人教版必修一化学方程式书写竞赛试题

《化学必修1》化学方程式测试题班级_______ 姓名________一、钠及其化合物1. 钠在空气中表面变暗:________________2. 钠在氧气中燃烧:________________3. 钠与水反应:______________________离子方程式:__________________________ 4.钠长期露置在空气中最后物质是涉及到的有关化学方程式:5.钠投入到硫酸溶液中:6.钠投入到硫酸铜溶液、FeCl3溶液、NaHSO4溶液、NaHCO3溶液中反应的离子方程式:7. NaHCO3受热分解__________________________8. NaHCO3和盐酸:_________________________离子方程式:__________________9. NaHCO3和NaOH:_______________________ 离子方程式:____________________ 10.向Na2CO3溶液中滴加盐酸:11.向盐酸中滴加N a2CO3溶液:12.NaHCO3溶液中加入少量Ca(OH)2溶液:13.NaHCO3溶液中加入足量Ca(OH)2溶液:14.过氧化钠与二氧化碳反应过氧化钠与水反应离子方程式:____________________________15.氧化钠与水反应___________________________16.过氧化钠加入到硫酸铜溶液中:17.过氧化钠和NaHCO3的混合物加热:二、铝及其化合物1.铝和稀硫酸:_____________________ 离子方程式:_________________________2. 铝和NaOH溶液:_______________________ 离子方程式:____________________3. 氧化铝和稀硫酸:_________________________ 离子方程式:__________________4. 氧化铝和NaOH溶液:______________________ 离子方程式:_________________5.氢氧化铝和盐酸:____________________ 离子方程式:______________________6. 氢氧化铝和NaOH溶液:_________________ 离子方程式:____________________7. 氢氧化铝受热分解:___________________8.向AlCl3溶液加入过量氨水_____________________离子方程式:__ _________ 9.向AlCl3溶液逐滴加入NaOH溶液至过量:;离子方程式:。
书写化学方程式竞赛试题

书写化学方程式竞赛试题1、盐酸(HCl)+镁→氯化镁+氢气2、盐酸+铝→氯化铝+氢气3、盐酸+锌→氯化锌+氢气4、盐酸+铁→氯化亚铁+氢气5、硫酸(H2SO4)+镁→硫酸镁+氢气6、硫酸+铝→硫酸铝+氢气7、硫酸+锌→硫酸锌+氢气8、硫酸+铁→硫酸亚铁+氢气9、盐酸+氧化镁→氯化镁+水10、盐酸+氧化铝→氯化铝+水11、盐酸+氧化铜→氯化铜+水12、盐酸+氧化铁→氯化铁+水13、硫酸+氧化镁→硫酸镁+水14、硫酸+氧化钠→硫酸钠+水15、硫酸+氧化铜→硫酸铜+水16、硫酸+氧化铁→硫酸铁+水17、盐酸+氢氧化镁→氯化镁+水18、盐酸+氢氧化铝→氯化铝+水19、盐酸+氢氧化钙→氯化钙+水20、盐酸+氢氧化铜→氯化铜+水21、盐酸+氢氧化铁→氯化铁+水22、硫酸+氢氧化镁→硫酸镁+水23、硫酸+氢氧化钠→硫酸钠+水24、硫酸+氢氧化铜→硫酸铜+水25、硫酸+氢氧化铁→硫酸铁+水26、硝酸(HNO3)+氢氧化镁→硝酸镁+水27、硝酸+氢氧化铝→硝酸铝+水28、硝酸+氢氧化钙→硝酸钙+水29、盐酸+硝酸银→硝酸+氯化银沉淀30、硫酸+氯化钡→盐酸+硫酸钡沉淀31、硫酸+硝酸钡→硝酸+硫酸钡沉淀32、盐酸+碳酸钙→氯化钙+水+二氧化碳33、硫酸+碳酸钠→硫酸钠+水+二氧化碳34、盐酸+碳酸钠→氯化钠+水+二氧化碳35、盐酸+碳酸镁→氯化镁+水+二氧化碳36、氢氧化钠+二氧化碳→碳酸钠+水37、氢氧化钠+三氧化硫→硫酸钠+水38、氢氧化钙+二氧化碳→碳酸钙沉淀+水39、氢氧化钠+盐酸→氯化钠+水40、氢氧化铝+盐酸→氯化铝+水41、氢氧化铜+盐酸→氯化铜+水42、氢氧化铁+盐酸→氯化铁+水43、氢氧化镁+盐酸→氯化镁+水44、氢氧化钠+硫酸→硫酸钠+水45、氢氧化铜+硫酸→硫酸铜+水46、氢氧化铁+硫酸→硫酸铁+水47、氢氧化锌+硫酸→硫酸锌+水48、氢氧化铝+硝酸→硝酸铝+水49、氢氧化铜+硝酸→硝酸铜+水50、氢氧化铁+硝酸→硝酸铁+水51、氨气(NH3)+硫酸→硫酸銨52、氨气+盐酸→氯化銨53、氢氧化钠+硫酸铜→硫酸钠+氢氧化铜沉淀54、氢氧化钠+氯化铜→氯化钠+氢氧化铜沉淀55、氢氧化钠+硝酸铜→硝酸钠+氢氧化铜沉淀56、氢氧化钠+氯化铁→氯化钠+氢氧化铁沉淀57、氢氧化钠+硫酸铁→硫酸钠+氢氧化铁沉淀58、氢氧化钠+硝酸铁→硝酸钠+氢氧化铁沉淀59、氢氧化钙+碳酸钠→氢氧化钠+碳酸钙沉淀60、氢氧化钙+碳酸钾→氢氧化钾+碳酸钙沉淀61、氢氧化钡+硫酸钠→氢氧化钠+硫酸钡沉淀62、氢氧化钡+硫酸铜→氢氧化铜沉淀+硫酸钡沉淀63、氢氧化钡+硫酸铁→氢氧化铁沉淀+硫酸钡沉淀64、氢氧化钡+硫酸镁→氢氧化镁沉淀+硫酸钡沉淀65、氢氧化钠+氯化铵→氯化钠+水+氨气66、氢氧化钙+硫酸铵→硫酸钙+水+氨气67、硫酸铜+铁→硫酸亚铁+铜68、硫酸铜+锌→硫酸锌+铜69、硫酸铜+镁→硫酸镁+铜70、硫酸铜+铝→硫酸铝+铜71、硝酸银+铜→硝酸铜+银72、硝酸银+镁→硝酸镁+银73、硝酸银+铁→硝酸亚铁+银74、硝酸银+锌→硝酸锌+银75、硫酸亚铁+锌→硫酸锌+铁76、硫酸亚铁+铝→硫酸铝+铁77、硝酸汞+铜→硝酸铜+汞78、氯化钡+硫酸→硫酸钡沉淀+盐酸(HCl)79、硝酸钡+硫酸→硫酸钡沉淀+硝酸(HNO3)80、碳酸钠+硝酸→硝酸钠+水+二氧化碳81、铁丝在氧气中燃烧82、镁条在氧气中燃烧83、红磷在氧气中燃烧84、硫磺在氧气中燃烧85、氢气在氧气中燃烧86、甲烷(CH4)在氧气中燃烧87、酒精(C2H5OH)在氧气中燃烧88、木炭在氧气中燃烧89、一氧化碳在氧气中燃烧90、碳酸钙高温生成氧化钙和二氧化碳91、生石灰+水→氢氧化钙92、电解水93、一氧化碳+氧化铜→铜+二氧化碳94、一氧化碳+氧化铁→铁+二氧化碳95、氢气+氧化铜→铜+水96、加热高锰酸钾97、加热氯酸钾和二氧化锰98、过氧化氢中加入二氧化锰99、乙炔(C2H2)+氧气(点燃)→二氧化碳+水100、一氧化碳+四氧化三铁(高温)→铁+二氧化碳。
化学方程式书写竞赛

化学方程式书写竞赛
一、用化学方程式表示各图涉及的化学变化:
(1)(2)(3)
(4)(5)、(6)、(7)
(8)、(9)(10)
(11)(12)(13)
(14)(15)(16)
此方程式不用配平
(17)(18)(19)(20)
(21)(22)
(23)
(24)
(25)
(26)
(27)(28)(29)(30)(31)(32)
(33)(34)(35)
二、综合应用题
1、请用线段连接有对应关系的相邻两列间的点.
2、
现象依次为:
A:B:
C:D:
3、A~H都是初中化学中的常见物质,它们之间的转化关系如图所示.A是天然气的主要成分,E是一种
常见的食品干燥剂.
(1)请分别写出A~H的化学式:
A B C D E F G H
(2)写出①②③④的化学方程式:
①②
③④
4、A、B、C、D、E五种物质有如下所示的转化关系:
若A为单质,E为红褐色沉淀,则A为,C为;
请写出B→D的化学方程式:。
5、据下图在“□”处写出A、B、C、D的化学式:
6、为鉴别碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]三种化肥,分别取少量样品编号为A、B、C,并进行如下实验(“→”表示得出实验结论)
则三种化肥的名称依次为:A ;B 、
、在空格里填入适宜的化学式(水除外)。
初三化学方程式大赛--总决赛

初三化学方程式大赛——总决赛 班级 姓名 分数1、实验室用高锰酸钾制取氧气,化学方程式为 ;基本反应类型为 。
2、写出过氧化氢分解的化学方程式 ;基本反应类型为 ;加入二氧化锰的作用是 。
3、我国是最早使用天然气的国家,它在燃烧时的化学方程式为____________________。
4、红磷燃烧的化学方程式为___________ ___________________;基本反应类型为 ;红磷燃烧时最明显的现象是______________________________。
5、氢能是理想的清洁能源。
科学家正研究在使用催化剂和光照条件下.........将水分解得到氢气的方法,该化学方程式为______________________;基本反应类型为 。
6“嫦娥一号”月球探测卫星的燃料是液氢和液氧,燃烧时的化学方程式为 。
7、铁在氧气中燃烧的化学方程式为 ;基本反应类 ;燃烧时最明显的现象是______________________________。
8、钢铁是用量最大的合金。
工业高炉炼铁的主要原理是用一氧化碳将铁从铁矿石里还原出来。
若选用的铁矿石是赤铁矿(主要成分是氧化铁),请写出主要反应的化学方程式 。
9、将生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出。
①写出发生反应的化学方程式 、 。
②氯化铁溶液可以作净水剂。
欲将上述所得溶液中的含铁的物质以氯化铁的形式回收,加入过氧化氢溶液反应可生成氯化铁和水。
已知每生成162.5 g 的氯化铁,就同时生成18 g 的水。
则该反应的反应物的化学式为 。
10、燃烧含硫.的煤会向空气中排放的污染物是______,该物质是形成________的主要物质;写出硫在空气中燃烧的化学方程式_______________ ______ ,该反应属于基本反应类型中_______反应。
11、纯碱受热不易分解,但小苏打受热后容易分解,其受热变质的化学方程式 ;12、检验二氧化碳的方法用化学反应方程式表示 ;13、为体现绿色奥运的理念,北京奥运会采用丙烷(C 3H 8)作火炬燃料。
初三化学方程式竞赛试题

初三科学化学方程式背诵酸的性质化学方程式练习(1)金属单质 + 酸→盐 + 氢气(置换反应)1. 实验室用锌和稀硫酸反应制氢气:2. 铁和稀硫酸反应:(溶液变成色)3. 镁和稀硫酸反应:4. 铝和稀硫酸反应:5. 锌和稀盐酸反应:6. 铁和稀盐酸反应:(溶液变成色)7. 镁和稀盐酸反应:8. 铝和稀盐酸反应:(2)金属氧化物 +酸→盐 + 水(复分解反应)9. 氧化铁和稀盐酸反应:(溶液变成色)10. 氧化铁和稀硫酸反应:(溶液变成色)11. 氧化铜和稀盐酸反应:(溶液变成色)12. 氧化铜和稀硫酸反应:(溶液变成色)(3)酸 + 碱→盐 + 水(复分解反应;中和反应)18. 盐酸和烧碱起反应:19. 盐酸和氢氧化镁反应:20. 盐酸和氢氧化铜反应:(溶液变成色)21. 盐酸和氢氧化钙反应:22. 盐酸和氢氧化铁反应:(溶液变成色)23. 盐酸和氢氧化钡反应:24. 氢氧化铝药物治疗胃酸过多:25. 硫酸和烧碱反应:26. 硫酸和氢氧化铜反应:(溶液变成色)27. 硫酸和氢氧化铁反应:(溶液变成色)28. 硫酸和氢氧化镁反应:29. 硫酸和氢氧化钡反应:(生成色沉淀)(4)酸 + 盐→新酸 + 新盐(复分解反应)30. 实验室用大理石与稀盐酸反应制二氧化碳:31. 碳酸钠与稀盐酸反应:32. 碳酸钠与稀硫酸反应:33. 碳酸钡与稀盐酸反应:34. 碳酸钡与稀硫酸反应:(生成色沉淀)35. 盐酸和硝酸银溶液反应:(生成色沉淀)36. 硫酸和氯化钡溶液反应:(生成色沉淀)37. 硫酸和硝酸钡溶液反应:(生成色沉淀)碱的性质化学方程式练习(1)碱 + 盐→新碱 + 新盐(复分解反应)38. 氢氧化钠与硫酸铜溶液反应:(生成色沉淀)39. 氢氧化钠与氯化铁溶液反应:(生成色沉淀)40. 氢氧化钠与氯化镁溶液反应:(生成色沉淀)41. 氢氧化钠与氯化铜溶液反应:(生成色沉淀)42. 氢氧化钙与氯化铁溶液反应:(生成色沉淀)43. 氢氧化钙与碳酸钠溶液反应:(生成色沉淀)44. 氢氧化钡与硫酸铜溶液反应:(生成色沉淀)45. 氢氧化钡与硫酸钠溶液反应:(生成色沉淀)46. 氢氧化钡与碳酸钠溶液反应:47 氯化铵与氢氧化钙反应:(生成有气味的气体)48 硝酸铵与氢氧化钠反应:(生成有气味的气体) (2)非金属氧化物 + 碱→盐 + 水49. 苛性钠暴露在空气中变质:50. 火碱吸收二氧化硫气体:51. 烧碱吸收三氧化硫气体:52. 石灰水久置在空气中变浑浊:(生成色沉淀)盐的性质化学方程式练习(1)金属 + 盐→新盐 + 新金属(置换反应)53. 铁和硫酸铜反应:54. 铜和硝酸银反应:55. 铝和硫酸铜反应:56. 锌和硫酸亚铁反应:57. 锌和硫酸铜反应:(2)盐 + 盐→新盐 + 新盐(复分解反应)58. 硝酸银和氯化钡反应:59. 硫酸钠和氯化钡反应:60. 碳酸钠和氯化钙反应:。
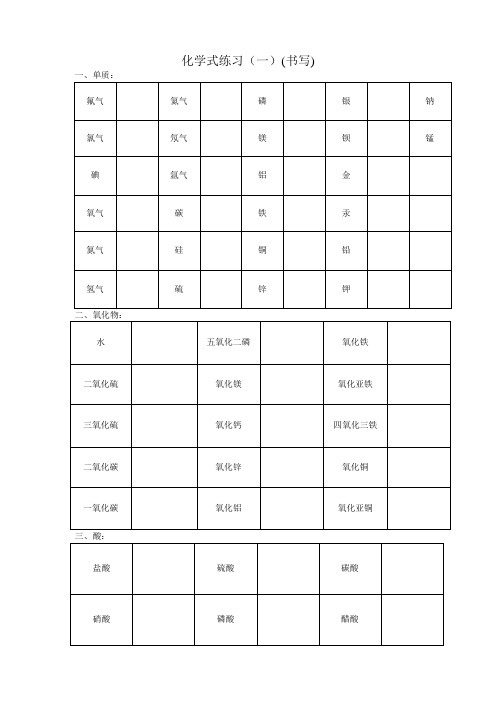
九年级化学式书写竞赛题
溶液颜色
溶质化学式
溶液名称
溶液颜色
溶质化学式
硫酸铜溶液
稀盐酸
氯化铁溶液
稀硫酸
氯化亚铁溶液
硝酸溶液
硫酸亚铁溶液
硝酸银溶液
石灰水
氯化钡溶液
烧碱溶液
硝酸汞溶液
纯碱溶液
石蕊试液
————
酚酞试液
————
二、写出下列难溶的碱和盐的化学式和颜色:
名称
颜色
化学式
名称
颜色
化学式
氯化银
氢氧化铜
硫酸钡
氢氧化铁
碳酸钙
水银
烧碱、火碱、苛性钠
生石灰
小苏打
二、写出下列物质的主要成分或有效成分的化学式
物质
主要或有效成分名称
主要或有效成分化学式
物质
主要或有效成分名称
主要或有效成分化学式
石灰水
生铁、钢
盐酸
铁锈
水煤气
赤铁矿
天然气、沼气
磁铁矿
大理石、石灰石
菱铁矿
碘酒中的溶剂是_____。
化学式练习(三)颜色、溶解性
一、写出下表中溶液的颜色合溶液中溶质的化学式:
硫粉
碳酸钠
碳酸铁
高锰酸钾
碳酸钡
碳酸亚铁
锰酸钾
碳酸钙
碳酸铜
亚硫酸钠
碳酸镁
碳酸银
亚硝酸钠
碳酸铝
碳酸铵
碳酸氢钙
硫酸氢钠
碳酸氢铵
氯酸钾
六、有机物
甲烷
甲醇
乙醇
乙酸
尿素
化学式练习(二)俗称
一、写出下列物质的名称和化学式
名称
俗称
化学式
高一化学方程式书写竞赛试题

高一化学方程式测试题一、完成下列化学方程式1铝和氧气________________________________________2.氯化亚铁溶液中通入氯气__________________________3.铜加入氯化铁溶液_______________________________________4.NaAlO2溶液中滴入少量盐酸______________________________5. SiO2和焦炭高温加热_______________________________________6. Fe2O3与CO加热____________________________________________7.过氧化钠与H2O__________________________________________8.氢氧化铁加热分解__________________________________________9.氢氟酸刻蚀玻璃_______________________________________10.镁在二氧化碳中点燃_______________________________二、反应条件不同,产物会不同。
根据要求完成下列化学方程式1.氢氧化钠溶液中通入少量的CO2____________________________________2.氢氧化钠溶液中通入过量的CO2____________________________________3.氯化铝溶液中加入少量氢氧化钠溶液____________________________________4.氯化铝溶液中加入过量氢氧化钠溶液____________________________________5.钠与氧气加热反应_________________________________6.钠与氧气不加热反应_______________________________7.澄清石灰水与少量碳酸氢钠的反应_______________________________________8.澄清石灰水与过量碳酸氢钠的反应_______________________________________9.碳酸钠溶液中滴入少量盐酸_____________________________________10.盐酸中滴入少量碳酸钠溶液____________________________________三、完成下列离子方程式1.碳酸氢钠溶液中加入氢氧化钠溶液_______________________________2.氯化铁溶液和氢氧化钠溶液_____________________________________3.SiO2和氢氧化钠溶液__________________________________________4.纯碱溶液中加入氯化钙溶液_____________________________________5.氯化铁溶液中加入碘化钾溶液_____________________________________6.铁红溶于稀硫酸_____________________________________7.铝加入硝酸铜溶液_____________________________________8.钠投入水中_____________________________________9.氢氧化镁与盐酸_____________________________________10. FeCl2溶液中滴入稀硝酸_____________________________________四、对比学习完成下列方程式1.铁在氧气中点燃______________________________________________2.铁与高温水蒸气______________________________________3.铝与氢氧化钠溶液____________________________________4.硅与氢氧化钠溶液____________________________________5.氧化铝与稀硫酸__________________________________________6.氧化铝与氢氧化钠溶液____________________________________7.氧化钠与二氧化碳____________________________________8.过氧化钠与二氧化碳____________________________________9.氢氧化铝与盐酸____________________________________10.氢氧化铝与氢氧化钠溶液__________________________________五、用化合反应完成下列给定物质的制备1.氢氧化铁:_____________________________2.氯化亚铁:____________________3.小苏打: ____________________________4.氢氧化钠:_____________________六、按要求完成下列化学方程式1.铜器表面有时会生成铜绿[Cu2(OH)2CO3]这层铜绿可用化学方法除去。
化学方程式竞赛

初三化学竞赛——书写化学方程式班级学号姓名得分一、写出下列反应的化学方程式,并指出反应类型:(32分)1、实验室制氧气:(1)用一种固体加热制氧气(2)用两种固体加热制氧气(反应)(3)用一种固体和一种液体制氧气(反应)2、实验室制氢气:(反应)3、实验室制二氧化碳:(反应)4、工业上制取二氧化碳,同时生产生石灰5、工业上用赤铁矿炼铁:6、湿法炼铜(曾青得铁化为铜)7、火法炼铜(用木炭还原氧化铜)8、工业上电解熔融的氧化铝制取金属铝9、工业上电解熔融的氯化镁制取金属镁10、工业上生产水煤气11、实验室检验二氧化碳12、实验室吸收二氧化碳二、写出符合下列情况的化学方程式:(20分)1、有沉淀生成的中和反应2、酸和盐反应有气体生成3、酸和盐反应有沉淀生成4、碱和盐反应有气体生成5、碱和盐反应生成的碱是沉淀6、碱和盐反应生成的盐是沉淀7、盐和盐反应8、有蓝色沉淀生成9、有红褐色沉淀生成10、无色溶液变成黄色三、根据信息书写化学方程式练习:(28分)1、镁条在空气中燃烧,不仅生成氧化镁、氮化镁,还有少量镁与二氧化碳反应生成另一种单质和镁的氧化物。
(1)写出生成氮化镁的化学方程式。
(2)写出镁与二氧化碳反应的化学方程式。
2、铝能与氢氧化钠和水发生反应,生成偏铝酸钠(NaAlO2)和一种气体单质,则该反应的化学方程式为。
3、发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气和水蒸气组成。
试写出反应的化学方程式。
4、用粮食作原料酿酒时,往往发现制得的酒发酸,这实际上是因为酒精(C2H5OH)在酶的作用下与空气中的氧气作用,生成了醋酸(CH3COOH)和水,请你写出该反应的化学方程式。
5、工业上常用接触法制硫酸(H2SO4),所使用的原料是硫铁矿(主要含FeS)。
在高温下,将硫铁矿的粉末与氧气充分反应生成三氧化二铁和二氧化硫,再经过一系列转化可生成硫酸。
试写出硫铁矿与氧气反应的化学方程式。
化学方程式竞赛辅导试题

化学方程式竞赛辅导试题可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 S-32 Ca-40 Zn-65一、正确书写下列化学方程式:1.木炭在氧气中燃烧2.硫在氧气中燃烧3.铁丝在氧气中燃烧4.红磷在空气中燃烧5.氢气在空气中燃烧6.氢气在氯气中燃烧7.铝箔在氧气中燃烧8.氯酸钾和二氧化锰混合加热9.加热分解高锰酸钾10.氧化汞受热分解11.电解水12.碱式碳酸铜受热分解13.锌跟稀硫酸反应14.镁跟稀硫酸反应15.铁跟稀硫酸反应16.铝跟稀硫酸反应17.锌跟稀盐酸反应18.镁跟稀盐酸反应19.铁跟稀盐酸反应20.铝跟稀盐酸反应21.二氧化碳与澄清的石灰水反应22.甲烷(CH4)在空气中燃烧生成二氧化碳和水24.照明弹燃烧时所发生的反应是23.发令枪打响后冒出一屡白烟,则其中发生的主要反应是二、填空题25.配平下列化学方程式:(1)____Al + _____Fe2O3−−→−高温_____ Fe +______Al2O3(2)_____C2H4 + _____O2−−点燃_____CO2 + _____H2O−→(3)_____FeS2 + _____O2−−高温______Fe2O3 + ____SO2−→26.用化学符号或名称表示:(1) 3个氢分子____________2个氧原子_________5个二氧化碳分子________________+2价的镁元素_________1个钠离子_________(2) N2的名称是__________ ZnS的名称是__________2个H2O的名称是__________27.从硫、水、氧化铜、氧气、氢气中选择适当的物质完成下列反应:(1)化合反应_________________________________________;(2)分解反应_________________________________________;(3)置换反应_________________________________________。
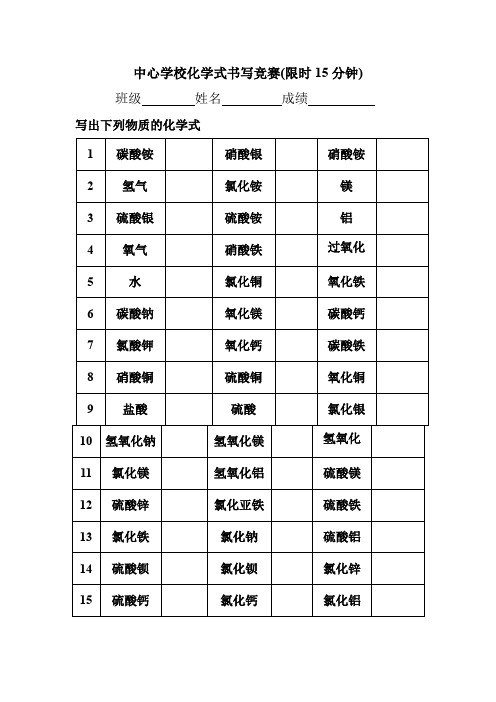
化学式书写、计算竞赛
1
H2O
KMnO4
Fe2O3
2
AgCl
HCl
NH4Cl
3
HNO3
Al2O3
CuO
4
NaOH
H2SO4
H2CO3
5
Na2CO3
FeCl2
Cu(OH)2
6
Ca(OH)2
Al(OH)3
H2O2
7
KClO3
Fe(OH)3
AgNO3
8
Fe2(SO4)3
AgCl
NH4NO3
9
NaCl
Na2SO4
FeCl3
10
Al(NO3)3
AlCl3
Al2(SO4)3
中心学校化学式计算竞赛(限时15分钟)
班级姓名成绩
可能用到的相对原子质量H=1,C=12,N=14,O=16,S=32,Cl=35.5,Al=27,Mg=24,Zn=65,Fe=56,Cu=64,K=39,
Ca=40,Na=23,Ba=137,Ag=108,Mn=55
计算出下列化学式的相对分子质量
1
H2O
18
KMnO4
158
Fe2O3
160
2
AgCl
143.5
HCl
36.5
AlCl3
133.5
3
HNO3
63
Al2O3
102
CuO
80
4
NaOH
40
H2SO4
98
H2CO3
62
5
Na2CO3
106
FeCl2
127
Cu(OH)2
98
6
Ca(OH)2
化学式化学方程式竞赛

化学式、化学方程式竞赛题班级姓名一、化学式铁;铜;汞;碳;硫;二氧化氮;水;白磷;氧气;氢气;氮气;二氧化硫;干冰;一氧化碳;氧化汞;氧化铜;氧化铁;氧化锌;氧化镁;氧化钙 ; 氧化钡;氧化钠;氧化钾;氧化铝;高锰酸钾氯化钠;氯化铜;氯化钾;氯化铁;氯化银;氯化钙;氯化钡;氯化镁;氯化锌;氯化铝;氯化铵;氯酸钾;锰酸钾;硝酸钠;硝酸铜;硝酸钾;硝酸;硝酸钡;硝酸铵;盐酸; 硫酸;硫酸亚铁;硫酸钠;硫酸铜;硫酸钾;硫酸钙;硫酸钡;硫酸锌;硫酸铝。
碳酸钠;碳酸钾;碳酸;碳酸钡;氢氧化铜;氢氧化钙 .二、化学方程式1、红磷燃烧:;2、通电分解水:;3、硫在氧气中燃烧:;4、镁带在空气中燃烧:;5、铁在氧气中燃烧:;6、加热高锰酸钾固体:;7、用固液常温型装置制氧气:;8、检验二氧化碳的反应:;9、向稀盐酸中加入硝酸银:;10、实验室制二氧化碳的化学方程式:;11、向烧碱溶液中加入硫酸铜;12、工业炼铁的反应原理(CO还原Fe2O3):;13、我国自行设计和制造的长征3号火箭用液氧和液氢作推进剂,点火时发生的反应:;14、写出有水生成的分解反应、化合反应:;;15、有二氧化碳生成的分解反应、化合反应:;;16、现有氯酸钾、锌粒、二氧化锰、稀硫酸、氢氧化钠、氢气、氧气等物质,从中选出适当的物质,按下列要求写出化学方程式:化合反应:;置换反应:;分解反应:;复分解反应:;17、除去下列物质中混有的少量杂质(括号内为杂质),写出反应的化学方程式:NaOH(Na2CO3):;CaO(CaCO3):;18、哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物作为固体燃料。
加热铝粉使其被氧气氧化,放出大量的热,促使混合物中高氯酸铵受热分解,同时生成四种气体:两种是空气中的主要成分,一种气体是氯气(Cl2),还有一种气体是化合物(常温下是液态),因而产生大巨大的推动力,写出其中涉及到的反应的化学方程式:(1)铝粉被氧气氧化成三氧化二铝:;(2)高氯酸铵受热分解:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
书写化学反应方程式竞赛试题(2014、11)
1、实验室制取二氧化碳
2、碳酸钠和盐酸反应
3、工业上制取二氧化碳(即:煅烧石灰石)
4、生石灰和水反应
5、加热高锰酸钾
6、加热氯酸钾和二氧化锰
7、将过氧化氢溶液中加入到二氧化锰中
8、将二氧化碳通入澄清石灰水中
9、将二氧化碳通入氢氧化钠溶液中
10、将氢气通入灼热的氧化铜中
11、将二氧化碳通入紫色石蕊溶液中
12、将二氧化碳通过灼热的炭层
13、将一氧化碳通入灼热的氧化铜
14、将一氧化碳通入灼热的氧化铁
15、将一氧化碳通入灼热的四氧化三铁
16、碳和氧化铜在高温下反应
17、碳和氧化铁在高温下反应18、碳和四氧化三铁在高温下反应
19、甲烷燃烧
20、酒精燃烧
21、氢气燃烧
22、镁在空气中燃烧
23、铁在氧气中燃烧
24、白磷在空气中燃烧
25、碳在氧气中完全燃烧
26、碳在氧气中不完全燃烧
27、丙烷(C3H8)在空气中燃烧
28、一氧化碳燃烧
29、硫在空气中燃烧
30、电解水
31、锌与稀硫酸反应制氢气
32、锌与稀盐酸反应制氢气
33、镁条在二氧化碳中燃烧
34、铁和硫酸铜溶液反应。
