第4章 烷基化反应和酰基化反应ppt课件
有机化学课件(邢其毅)-第04章

4 芳烃
4.3.2 芳烃的光谱特征 4.3.2.1 红外光谱
4.3 芳烃的物理性质
芳烃主要有三个特征吸收区域。在1600和1500 cm-1出现2个共轭双键伸缩振动吸收;在 3100~3000cm-1 出现苯环上 C―H 键伸缩振动吸收; 950~650cm-1 出现苯环上的 C―H 键面 外弯曲振动吸收。,苯环上的C―H键面外弯曲振动吸收峰的位置和个数与苯环上的氢被 取代位置和个数有关,而与取代基的类型无关,能被利用有效地确定苯环的取代类型, 区别各种位置异构体。 芳香族化合物δ外=CH频率与取代基位置的关系 取代类型 苯 单取代 1,2-二取代 1,3-二取代 1,4-取代 1,2,3-三取代 δ外=CH频率(cm-1 )(强度) 670(s) 770~730(s) 770~735(s) 810~750(s) 900~860(m) 800~770(s) 860~800(s)
芳环的吸收带
化合物 E1吸收带 λmax/nm εmax 苯 萘 180 47000 220 100000 E2吸收带 λmax/nm ε max 204 7900 275 5700 B吸收带 λmax/nm εmax 230 312 200 250
菲
蒽 苯并[ a]蒽 *B吸收带被掩盖
252 50000
4 芳烃
4.3.2 芳烃的光谱特征
4.3 芳烃的物理性质
4.3.2.2 质子核磁共振谱
Ha Hb
[18]-轮烯是芳香性分子,在1HNMR上环内的4个氢Hb 的化学位移值均为 -0.6ppm ,而环外的 10 个氢 Ha 的化学 位移值为7.6ppm。
NH N
N HN
卟吩环是自然界存在的重要芳香环结构。在1HNMR上环内 的4个吡咯氢的化学位移值均为-2.8ppm ,而环外的12个氢 Ha的化学位移值在7.0-8.2ppm之间。
-傅克反应ppt课件

被酰化物:包括各种电子云密度较高的取代芳环、芳杂环类化 合物。 催化剂:包括Lewis酸(如AlCl3、SnCl4、BF3、ZnCl2)或质子酸。 反应的溶剂:一般为醚类、卤代烷类、苯及其同系物、乙酸乙 酯等。
.
反应机理
酰化剂在催化剂的作用下生成活性中间体-碳正离子,由正离子攻 击电子密度较大的芳环,取代氢原子,形成芳酮和氢离子。
.
注意几点
(1)酰基是一个间位定位基,当一个酰基取代苯环的氢后,使苯环的 活性降低,反应终止,产物一般为一元取代苯,而不会生成多元取代 苯的混合物,因此芳烃的烷基化反应的产率一般比较好。 (2)酰基化反应是不可逆的,也不发生重排,因此酰基化反应在合成 上很有价值。 (3)由于酰基化反应的产物单纯,可以用此反应先生成酮,再来还原 制备芳烃的烷基衍生物。
.
四、傅克反应的操作方法
一般操作法 把无水氯化铝和干燥溶剂放置在装有搅拌器、滴液漏斗和回流冷凝管的
三口瓶中。 在冷却下加入芳环化合物搅拌。 卤化物或酰卤慢慢滴入,产生的氯化氢,由冷凝管末端,经过氯化钙管,
通道气阱。 滴完后搅拌、温热直到反应完全。 把反应物慢慢滴加到浓盐酸与冰水的混合物(1:5-10)中。分出有机层,
傅克反应原理及实验技巧
.
目录
✓ 简介 ✓ Friedel–Crafts 烷基化反应 ✓ Friedel–Crafts 酰基化反应 ✓ 傅克反应的操作方法 ✓ 烷基化与酰基化的异同
.
一、简介
傅里德-克拉夫茨反应,简称傅-克反应,英文Friedel–Crafts reaction,是 一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C) 和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
04-烷基化与酰基化反应

4.3.4 用环氧乙烷的O-烷基化
环氧化合物易与醇发生开环反应,生成羟基醚。开环 反应可用酸或碱催化,但往往生成不同的产品。酸及碱催 化开环的反应过程是不相同的:
RHC O
CH2
H+
RCHCH2OH
R'OH
RCHCH 2OH OR'
RHC O RCHCH 2OR' OH CH2
H+
R'O-
RCHCH2OR' O-
2. 用卤代烷烷基化
R Cl AlCl3
慢 R AlCl4
σ+ σ- R Cl : AlCl3 分子络合物
H R σ络合物
R AlCl4 离子对或离子络合物
AlCl4
快
R HCl + AlCl3
一般认为,当R为叔烷基或仲烷基时,比较容易生 成R+或离子对,当R为伯烷基时,往往不易生成R+, 而是以分子络合物参加反应。
R R N R H+
R R N R
H2, CuO, Cr2O3 RNH2 + CH3OH 200℃, -H2O
R R+ R N R
CH3OH -H2O
R
RNHCH3
RN(CH3)2
甲醚是合成甲醇时的副产物,也可用作烷基化 剂,其反应式如下:
NH2 (CH3)2O Al2O3 230℃ NHCH3 + CH3OH
NHCH3
(CH3)2O
N(CH3)2 + CH3OH
此烷基化反应可在气相中进行,使甲醚和苯胺的 蒸气在230℃,通过氧化物催化剂(三氧化二铝、二氧 化钛等)。使用醚类烷基化剂的优点是反应温度可以 较使用醇类的为低。
有机化学课件
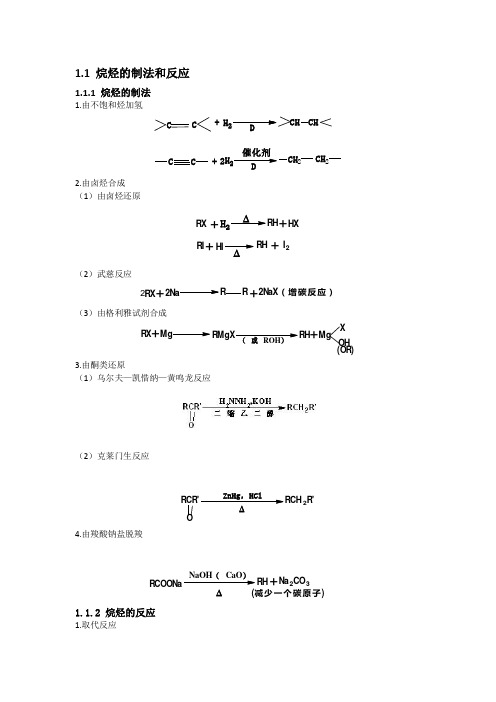
1.1 烷烃的制法和反应1.1.1 烷烃的制法1.由不饱和烃加氢C C+H 2CHCHCC+H 22D DCH 2CH 22.由卤烃合成 (1)由卤烃还原RX+H 2RHHX +RI HI+∆RH +I 2∆(2)武慈反应R X2+2N aRR2N aX (增碳反应)+ (3)由格利雅试剂合成RX+MgRMgX(或ROH )RH +MgX OH (OR)3.由酮类还原(1)乌尔夫—凯惜纳—黄鸣龙反应(2)克莱门生反应RCR'O2R'4.由羧酸钠盐脱羧NaOH (CaO )∆RH +Na 2CO 3(减少一个碳原子)1.1.2 烷烃的反应1.取代反应RH +X2光RX +HX (反应活性3'H>2'H>1'H>CH 4)例CH 3CH 2CH 3Cl 2光CH 3CH CH 3Cl+CH 3CH 2CH 2Cl(57%)(43%)2.氧化反应 (1)完全氧化CH 4+2O CO 2+2H 2O +热能(2)部分氧化RCH 2CH 2O 2,锰盐RCOOH +R'COOH (可制肥皂)4CH 4+O 21500C CH CH+2CO +7H 2O(3)裂化反应CH 3CH 2CH 2CH 3C H 2CH 2+C H 3CH 3+CH 3CH 2CH=CH 2+H 2+CH 4+CH 2CH 3(4)异构化反应CH 3CH 2CH 2CH 3AlBr 3 HBrCH 3CHCH 3CH 320%80%1.2 烯烃的制法和反应1.2.1烯烃的制法1 烷烃脱氢C C H H催化剂∆-H2C C (适合于简单烯烃,通常得混合物)CH3CH2CH2CH3Pt,500C CH3CH2CH=CH2+CH3CH3HH+CH3CH3H H+CH2=CHCH=CH2+H22.卤烷脱卤化氢C CX碱,热-HXC CHHHCl(CH3)3CO-K+3.醇脱水4.霍夫曼消除5.由炔烃加氢6.魏梯希反应1.2.2烯烃的反应1.烯烃的亲电加成(2)加水直接水合间接水合以上都符合马氏规律硼氢化-氧化反应(3)加卤素(4)加次卤酸2.烯烃的催化氢化CH3CH2H2,Pt CH3CH2CH33与碳烯加成CC+CC CC (X,Y=H,Cl,Br,I 或COOEt)+CHCl 3(CH 3)3COK+Cl4烯烃的氧化(1) 烯烃的环氧化C C+21O2CC OCH 2CH 2+21O 2O环氧丙烷C C+RCOOH C C O+RCOHCH 3CH CH 2+CH3OCH 2H 3CHCO+CH 3COOH(2) 高锰酸钾氧化C C稀KMnO OH C C (或OsO 4,H 2O 2)RCHCH KMnO R CO +CO 2+H 2OCH 3CH 2CH CH 2KMnO CH 3CH 2C O+CO 2+H 2OCR O+CR'OHORC RR C R'KMnOCH 3CHCCH 3CH 3KMnO 4CH 3COHO+CH 3CH 3O5烯烃的臭氧化反应C RR C R'+O 3OO COC RRR'H H 2ORO +CR'H ORCH 3CHCH CH 32Zn ,H 2OCH 3CHO +CH 3CH 3O6聚合反应nCH 2CH2>100℃,100MPaCH 2CH 2nn>100nCH 3CH CH 2烷基铝-三氧化钛50℃,1MPaCH3CH 2n7烯烃的a 氢原子反应(1) 卤代C Ha 氢+X 2C X+HX(或NBS)+NBSBr(2) 氧化烯烃的a氢易被氧化,在不同条件下,得到不同产物:CH 3CHCH 2+O 2CuO 370℃CH 2CHCHOCH 3CH CH 2+23O 磷钼酸铋 0.7~1.4MPa CH 2CHCOOHCH 3CHCH 2+NH 3+23O 2磷钼酸铋470℃2CHCN +3H 2O1.3 炔烃的制法和反应1.3.1 炔烃的制法1.金属炔化合物与卤烷反应RCC -Na ++R'XS N 2RCCR'+X -(1。
酰化反应-碳原子上的酰化反应

3. 熟悉羰基α 位碳酰化反应的相关内容,掌握Claisen
反应和Dieckmann反应的特点和应用 (重点) 。
碳原子上的酰化反应
被酰化物 (R-H)
酰化剂 (R1CO-)
制备醛、酮 (RCOR1)
按碳原子 的类型分 按碳原子 的类型分
不饱和碳原子的酰化
饱和碳原子的酰化
芳烃(重点)、烯烃的碳酰化
四 个 酮 酸 酯 的 混 合 物
(2)常用的酯缩合形式
(a) 含活泼氢相同羧酸酯之间的缩合,制备得到单一 的β-酮酸酯产物。
(b) 含活泼氢的羧酸酯与不含活泼氢的羧酸酯之间 的缩合,制备得到单一的β-酮酸酯产物
常用的不含活泼氢的羧酸酯: 甲酸酯 (HCO-OR)、 苯甲酸酯 (PhCO-OR)、 草酸酯 (ROOC-COOR)、 碳酸酯 (RO-CO-OR)
应用实例
2-氯苯乙酮 (氯喘通的合成中间体)的制备
(氯喘通)
2. Claisen反应 (重点)
Claisen 反应:羧酸酯与另一分子含-活泼氢的酯进
行缩合得到β-酮酸酯的反应。
(1)同时含两个活泼氢不同酯之间的缩合
含有两个活泼氢的酯之间的缩合理论上得到四个β酮酸酯的混合物,在实际合成中没有应用价值。
发生类似反应。
应用
二、烯烃的碳酰化反应(自学)
三、羰基α位的碳酰化反应
1. 活性亚甲基化合物的碳酰化 -二酮类、 -羰基酸酯类、丙二酸酯类、丙二腈类、 氰基乙酸酯类等活性亚甲基化合物在碱催化下与酰化
剂 (一般多用酰氯)反应,很容易发生碳酰化反应。
活性亚甲基的化合物的碳酰化反应可以用于合成新的 二羰基化合物。
对比Freidel-Crafts烷基化反应,进一步掌握酰基化反应的 特点与影响因素。 (2) 间接的亲电酰化反应 掌握 Hoesch反应、 Vilsmeier-Haack反应和Reimer-
(精品课件)烷基化反应

4 烷基化反应定义:一般而言,有机分子中的氢原子(包括某些官能团上的,如羟基和氨基等)被烷基取代,可称为烷基化反应。
意义:在药物分子中引入烷基可增加其脂溶性,或形成新的官能团赋予药物以特殊性能。
如丁卡因药效为普鲁卡因的10倍。
本章内容:醇、酚的氧烷化,胺的氮烷化,活泼亚甲基及芳烃的碳烷化等反应。
4.1 氧原子上的烷基化反应在氧原子上烷基化是获得醚,尤其是不对称醚的通用方法。
4.1.1 以卤代烃为烷基化试剂醇、酚的钠盐或醇、酚在碱(钠、氢氧化钠以及氢氧化钾等)的存在下与卤代烷生成醚的反应称为Williamson反应,是合成不对称醚的最常用方法。
(1) 反应机理Williamson反应是典型的SN2反应。
此外,醇、酚与卤代烷的反应也可按SN1机理进行。
(2) 影响因素底物的影响:①伯卤代烷一般为SN2机理;叔卤代烷一般为SN1机理;而仲卤代烷可SN1也可SN2。
②由于芳环的吸电子作用,使得酚的活性一般弱于醇。
③底物的空间位阻对反应速率影响较大。
溶剂的影响:极性溶剂可促进反应。
SN2反应一般在碱性条件下进行;而SN1反应一般在酸性或近中性(可为弱碱性)条件下进行。
(3) 反应示例①苯海拉明的合成反应机理:双分子亲核取代(SN2)。
②糖环6-伯羟基的保护在极性溶剂中,Ph3CCl可形成非常稳定的碳正离子Ph3C+,此步为控制步骤,该碳正离子形成后迅速与伯羟基结合,生成醚。
反应机理:碳正离子历程(SN1)。
③卤代烃为芳卤的情况:对硝基苯乙醚(非那西丁中间体)的合成反应机理:加成-消除机理。
反应活性:I<Br<Cl<F;芳环上一定要有吸电子基。
4.1.2 以芳磺酸酯为烷基化试剂氧原子的吸电子作用使得芳磺酸酯成为很好的离去基团,当与其相连的碳原子受到醇的进攻时,芳磺酸基很容易离去。
常见的芳磺酸酯包括苯磺酸酯、对甲苯磺酸酯、对硝基苯磺酸酯、对卤苯磺酸酯以及对三氟甲基苯磺酸酯等。
反应示例:鲨肝醇的合成(SN2反应)。
精细有机合成单元反应_04烷基化反应

以采用气-固相接触催化烷化法。
• 1.液相烷化法 • 用甲醇或乙醇液相N-烷化,最常用的催化剂是硫酸。此外,也可
以用盐酸、三氯化磷等。
• 2.气-固相接触催化烷化法 • 液相N-烷化法需要用到耐腐蚀高压釜,设备投资大,改用更先进
的气-固相接触催化反,其优点是反应可在接近常压下进行,连续 化生产,生产能力大,副产物少,收率高,产品纯度高,废水少。
返回
4.2 N-烃化
• 4.2.2用卤烷的N-烷化 • 1.烷化剂 • 当卤烷比相应的醇更易获得时,当然用卤烷作烷化剂,如氯苄和氯
乙酸等。
• 卤烷是比醇类活泼的烷化剂,对于某些难烷化的芳胺,常常需用卤
烷作烷化剂。如间氨基苯磺酸的N,N-二乙基化,N-酰基芳胺的N-烷 化等。
• 当烷基相同时,各种卤烷的活泼性次序是:R—I>R—Br>R—Cl • 当烷基不同时,卤烷的活泼性随烷基碳链的增长而减弱。 • 2.主要影响因素 • (1) 烷化剂用量 ;(2) 缚酸剂 ;(3) 温度和压力 ;(4) 相转移催化剂。
25~75℃、常压或微压下进行,但为了安全,尽可能不用。其他酸、 碱催化剂的催化活性较弱。羟乙基化要在较高的温度和压力下进行。
• C1~C4低碳醇的单羟乙基化和二羟乙基化也可以采用气-固相接触催
化法,催化剂可以是硅胶、三氧化二铝等。酚羟基的羟乙基化只采
用碱催化法。
• 醇或酚在羟乙基化时,生成的一乙二醇单醚中的醇羟基还可以与环
HO3S NH
NH2 浓H2S O 4
• (3) N-苯基-2-氨基-5-萘酚-7-磺酸(N-苯基J酸)
HO3S
NH2 +
NH2 NaHSO4催化 HO3S
烷基化反应ppt课件

2.1.3 用醇作烷化剂的C-烷化反应
反应历程
质 子 化 + +
R O H + H
R O H 2
解 离 +
R + H O 2
实例
(1)芳胺的C-烷化
N H 2
+ C H O H ,H O 4 9 2 Z n C l 2 2 1 0 C ,0 . 8 M P a
o
N H C H 4 9
异 构 化 Z n C l 2 o 2 4 0 C ,2 . 2 M P a
A r H 慢 离 子 对 烷 基 正 离 子
• 回顾
在Lewis酸催化作用下,芳烃及其衍生物与烯 烃、卤烷、酰卤、酸酐等活性组分反应形成新的 C-C键的反应,叫做傅氏反应。 引入烷基的反应叫做傅氏烷基化反应; 引入酰基的反应叫做傅氏酰基化反应。
反应的影响因素 (1)烷基化试剂的活性
1 R 1 R
O
O
(5)烯烃和炔烃:CH2=CH2, CH3CH=CH2, R-CH=CH2, CH2=CHCN, CH2=CHCOOCH3, CH≡CH; (6)羰基化合物:HCHO, CH3CHO, C3H7CHO, Ph-CHO, CH3COCH3, O
2.1 C-烃化
有机化合物分子中碳原子上的氢被烃 基所取代的反应叫做C-烃化反应。 F-C烷基化反应: R R 烃化剂:烯烃; 卤烷; H O H N 2 R 醇、醛、酮。 反应历程:酸催化的亲电取代反应。
A l C l 3
C C l
二 氯 二 苯 甲 烷
+ 2 H C l
2.1.2 H = C H + H 2
C H C H 2 3
第四章 烷基化反应

苄氯活性最大少量少量氯化锌等就可反应,氯甲烷活性最差,需 大量氯化铝并加热才可以反应。氯代烷是最常见的烷基化试剂。
4.1.1 卤代烷用做C-烷基化试剂
C-烷基化反应是在催化剂作用下进行的。通常工业上使用的有两 大类:一类是路易斯酸,主要金属卤化物,如AlCl3 、FeCl3、SbCl5 等树脂;。另此一类外是还质有子其酸他,类其型中的最催重化要剂的,是如H酸F性、氧H2化SO物4、、阳有离机子铝交化换物等。
O N a
O C H 3
7 0 - 1 2 0 o C , 1 . 5 M P a
+ 2 C H 3 C l N a O H + N a C l
O N a
O C H 3
在氢氧化钾和相转移催化剂聚乙二醇-400的作用下,酚类与卤代烷的 反应非常顺利,如:
O H O C H 3 聚 乙 二 醇 — 4 0 0
Z n C l 2 水 解 液
H 2 C
7 0 o C - 7 5 o C
用氯乙酸的C-烷化反应可在芳环上引入羧甲基,用铝粉作催化剂
铝 粉 + C l C H 2 C O O H 1 8 5 - 2 1 8 o C
C H 2 C O O H +H C l
用四氯化碳进行C-烷化可用于制备二苯甲烷和三苯甲烷的衍生物。
在有机化合物分子中的碳、氮、氧、硫等原子上引入脂肪族或芳 香族酰基的反应称为酰基化反应。酰基引入氮原子上合成酰胺类化 合物;酰基引入碳原子上合成芳酮或芳醛;硫原子上引入酰基主要 是合成硫酸酯类化合物;氧原子上引入主要是合成酯类化合物,习 惯上把这种氧酰化称为酯化反应。
有机合成:Chapter 4 有机金属化合物的反应

H3C
C CH2 Ph
(85%)
(返回)
30
羰基化合物中,只有酰卤能与有机铜(I)试剂作用,反 应生成醛/酮:
- 78 C (CH3)2CuLi + CH3(CH2)4CO(CH2)4COCl
15 min
CH3(CH2)4CO(CH2)4COCH3 (95%)
产物酮不能再参与反应。又如:
( H2C
CH3(CH2)3COCH3 (80%)
(2)产物有空间位阻,例如:
(CH3)3CCH2MgCl + (CH3)3CCOCl
O (CH3)3CCH2 C C(CH3)3 (87%)
(返回)
20
对一级和二级酰胺,格氏试剂主要是从氢上除去质子, 生成烃,例如:
δδ XMg R
H NHCOR'
RH + R'CONHMgX
9
4.2.3 有机铜(I)试剂
制备:
RLi +
Cu2X2
RCu or R2CuLi
有机铜(I)试剂反应特点: (1)特别容易取代卤素生成烃; (2)在羰基化合物中只与酰卤作用,生成醛/酮; (3)与α,β-不饱和羰基化合物反应得到共轭加成产物;
(4)在加热或氧化剂存在时,特别容易发生偶联反应。
10
2 R C CH + Cu2Cl2
2 R C CCu + 2 HCl
炔基铜(I)化合物易制备,并且比烷基或芳基铜(I) 化合物要稳定得多,主要反应有:
(1)从不活泼的位置取代卤素; (2)将酰氯转变为酮;
(3)偶联反应生成共轭二炔。
12
4.4 总结
4.4.1 切断与合成等价物 合成某种化合物,可以有不同的切断方式,而同一种切
第四章 烷基化反应

三、碳原子上的烷基化 1、芳环上碳原子的烷基化(Friedel—Cralfs反应)
Ar—H + RX AlCl3 Ar—R + HX
烯烃是好的烷基化试剂,可看成芳烃对烯烃的加成:
Ar
Ar—H
+
C
C
AlCl3
H
—C
C—
OH
+ CH2=CH2
AlCl3
OH C 2H 5
Friedel—Cralfs反应最常用的催化剂:无水三氯化铝
C6H5CH2Cl
(CH3)3COCH2C6H5 70—78%
一般来说,1°卤代烃与醇钠反应,可以得到 良好产率醚。2°、3°卤代烃反应时由于发生 脱卤化氢副反应,因此,生成醚的产率不高
2、烷基—芳基混合醚
RCHX R’
+ R
OH
OH
R
OCHR + R’
H 3O
由于酚具有一定酸性,因此一般用NaOH形成芳 烃氧阴离子,甚至用 K2CO3即可
CH2CHOH C13H27N CH2CHOH CH3
CH3
H2SO4 180 ℃
C13H27N
CH2CH O CH2CH CH3
三、重氮化合物作为烷基化试剂 重氮甲烷(CH2N2)是重要的甲基化试剂,反 应一般在乙醚、甲醇或氯仿中进行,在室温或低 温条件下进行。能够定量地将甲基引入酚、酸、 烯醇的羟基,形成碳氧键。
68%~72%
在氨基化反应中,卤代烷的活性次序为: RI>RBr>RCl>RF R的结构: 伯卤代烷>仲卤代烷>叔卤代烷。 叔卤代烷常常发生消除反应,生成大量的烯烃。 二卤代烷的氨基化反应 :
Br(CH2)5Br + NH3
第4章 烷基化反应和酰基化反应ppt课件

C H C l 4 9 亲 核 取 代 C H 4 9 C H C O O C H 2 5
H
C O O C H 2 5 C O O C H 2 5
C O O C H 2 5
4.1.2 卤代烷烃作为N-烷基化剂
NH3 + R-Z R'NH2 + R-Z R'NHR'' + R-Z RNH2 + HZ R'NHR + HZ R'NRR'' + HZ
R、R`、R``代表烷基,Z则代表-OH,-Cl、-OSO3H等基团。
N-烷基化剂的种类很多,常用的烷基化试剂有卤代烷、醇、 醚、酯、环氧化合物、烯烃、醛和酮等。卤代烷烃是N-烷基化 常用的烷基化试剂,其反应活性较醇强。 卤代烷进行的N-烷基化反应是不可逆的。烷化反应时生 成的卤化氢会与芳胺成盐,而芳胺的盐难于烷化,为了避免 这个不利影响,在N-烷化时通常要加入与卤烷等当量的缚酸 剂,例如NaOH、Na2CO3, NaHCO3、Fe (OH)2、Ca (OH)2和 MgO等。
+ N
C H C H C l2 6 5
C H 3
4.1.3 卤代烷作为O-烷基化试剂
O-烷基化反应是制备醚的方法之一。许多芳醚的制备不宜采 用烷氧基化的合成路线,而需要采用酚羟基化(即O-烷基化)的合 成路线。 对于被烷基化的醇或酚来说,它们的负离子R-O-的反应活性 远远大于醇或酚本身的活性。因此,通常都是先将醇或酚与氢 氧化钠、氢氧化钾或金属钠相作用生成醇钠或酚钠,然后再与 卤代烷反应。
4.第4章 芳烃

近代物理方法证明,苯分子的六个碳原子和六个氢原子都在
同一平面上,其中六个碳原子构成平面正六边形,碳碳键键长均
为0.139 nm,比碳碳单键0.154nm短,比碳碳双键0.134 nm长,碳 氢键键长均为0.108 nm,各键角都是120°。由此提出了关于苯结 构的现代理论。
轨道杂化理论认为,在苯分子中, 每个碳原子以sp2杂化轨道与相邻碳原
两个碳原子稠合而成的芳烃,称为稠环芳烃。例如:
4.1芳烃的构造异构和命名
4.1.1构造异构
苯及其同系物的通式为CnH2n-6。
苯和一取代苯(不包括取代基自身的异构)各只有一种;但当苯 环上的取代基(亦称侧链)含有三个或更多碳原子时,与脂肪烃相似, 因碳链构造不同,也可以产生构造异构。例如:
苯的二元取代物,因取代基在环上的相对位次不同,有三种
若在较高温度下,硝基苯可继续与混酸作用,则主要生成间
二硝基苯。
烷基苯在混酸的作用下,也发生环上取代,反应比苯容易,主 要生成邻和对位取代物。例如:
硝基甲苯进一步硝化可以得到2,4,6–三硝基甲苯,即炸药TNT。
3.磺化
苯与浓硫酸或发烟硫酸作用,环上的一个氢原子被磺(酸)基
(一SO3H)取代,生成苯磺酸。若在较高温度下继续反应,则主要生
第4章 芳烃
一般把苯及其衍生物总称为芳香族化合物。芳烃是芳香族碳
氢化合物的简称,亦称芳香烃。
C6H6
芳烃按其结构可分为三类: 单环芳烃
芳烃
多环芳烃
稠环芳烃
①单环芳烃:分子中含有一个苯环的芳烃,称为单环芳烃。例如:
②多环芳烃:分子中含有两个或两个以上独立苯环的芳烃,称为多 环芳烃。例如:
③稠环芳烃:分子中含有由两个或多个苯环彼此间通过共用相邻的
烷基化反应

F-C 烷基化反应
全名叫福瑞德―克拉夫反应、就是苯环上发生的酰基化或烷基(乙、丙稀等)化 反应 。
在苯环上引入酰基或 者烷基,常用路易士酸或质子酸催化,最长用的无水三氯化铝(A1C13)催化剂,是苯环衍生化的 重要 反应。
烷基化反应∶1、把烃基引入有机化合物分子中的C、N、O(氢、氮等)原子上的反应称为烷基化反应,也可简
称烷化。
2、利用加成或置换反应将烷基引入有机物分子中的反应过程。
烷基化反应作为一种重要的合成手
段广泛应用的于许多化学工生产过程。
3、烷基—即饱和烃基、是烷烃分子中失掉一个氢原子后剰余的烃基(如甲基、乙基等),烯烃是
最便宜和活泼的烷基化剂,常用的烯烃有乙烯、丙烯等。
重要。
11-2 胺的烷基化反应和酰基化反应

【复习回顾】胺类化合物如何消除得到烯烃?内容:学习目标:掌握消除反应产物的判断烷基化反应季铵碱——Hofmann 消除反应酰基化反应叔胺Cope 消除反应磺酰化反应1烷基化反应——季铵化合物相转移催化剂相转移催化剂1)季铵碱的制备August Wilhelm von Hofmann (1818–1892)德国化学家彻底甲基化2季铵碱——Hofmann 消除反应(好的离去基团)2)Hofmann消除反应Hofmann规则:具有几种β-H季铵碱的热分解产物主要消除含氢较多的β-H合成端基烯烃!Hofmann消除产物为什么不符合Zaitsev规则?Hofmann消除反应机理——E2A. W. Hofmann, Justus Liebigs Ann. Chem. 1851, 78, 253.A. C. Cope, E. R. Trumbull, Org. React. 1960, 11, 317.B.M. Novak, et.al., J. Am. Chem. Soc., 2001, 123, 11083.位阻小位阻大Hofmann消除反应的实质是空间位阻问题!❷β碳原子上是芳基时,Hofmann 规则不适用!【注意】❶当季铵碱的N 原子上连有两个以上可变为烯烃的基团时,主要生成分子量较小的烯烃。
主要产物❸Hofmann消除反应的立体化学——反式消除❹Hofmann消除反应可测定胺基结构己-1,5-二烯Arthur C. Cope (1909–1966)美国化学家A. C. Cope, et.al., J. Am. Chem. Soc . 1949, 71, 3929.A. C. Cope, E. R. Trumbull, Org. React . 1960, 11, 317.R.D. Bach; M.L. Braden, J. Org. Chem., 1991, 56, 7194.N.J. Cooper; D.W. Knight, Tetrahedron , 2004, 60, 243.3叔胺Cope 消除反应Cope消除的E2反应机理【注意】当氧化胺的一个烃基上有两种β-H时,产物以霍夫曼产物为主4酰基化反应1) 一、二级胺能象氨一样,作为亲核试剂跟酰氯、酸酐、酯作用生产酰胺2) 三级胺氮原子上没有氢原子,所以不能生产酰胺3) 应用: 药物合成氨基的保护三溴代产物【注意】该鉴定方法只对六碳以下的胺适用O. Hinsberg, Ber. Dtsch. Chem. Ges., 1890, 23, 2962. R.S. Schreiber, et. al., J. Am. Chem. Soc., 1934, 56, 114. W. Seamen, et.al., J. Am. Chem. Soc., 1945, 67, 1571.Oscar H. D. Hinsberg (1857-1939) 德国化学家5磺酰化反应——兴斯堡(Hinsberg)反应(鉴别伯、仲、叔胺)N HS O O H 2NO N N S O O H 2NN N Ag磺胺类药物磺胺嘧啶银(烧伤、烫伤创面的抗感染)磺胺甲恶唑(复方新诺明)(呼吸道、泌尿道感染)细菌代谢必需小结一、二级胺的酰基化反应可以用来保护氨基或用于药物合成Hofmann 消除反应是反式E2消除反应,Cope 消除反应是顺式E2消除反应,产物选择性都遵循Hofmann 规则Hinsberg 反应可用来鉴定六碳以下的一、二、三级胺下节课内容重氮化和重氮盐反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
用氯乙酸做烷基化剂可用于制备苯氧乙酸类的化合物。
O H
_ 甲 苯 水 , P T C + C l C H C O O H + 2 N a O H 2 8 5 ℃ , 6 h
OCH2COONa
4.2 常用的烷基化试剂——硫酸酯和磺酸酯
4.2.1 硫酸酯和磺酸酯用作N-烷基化试剂 硫酸二烷基酯、芳磺酸烷基酯和磷酸三烷基酯等强酸的烷基 酯都是活泼的N-烷化剂,主要用于制备价格贵、产量小的N-烷 化产物。
R—Cl + AlCl3 δδ+ R—Cl:AlCl3
分子配 合物
R+…AlCl4离子对或离子配合物
芳烃的亲电烷基化反应历程:
H +R
+
…AlCl4- 慢
+
R AlCl4-
快
R + HCl + AlCl3
苄基氯分子中的氯比较活泼,在酸性催化剂的存在下, 可向芳环引入苄基。例如,在苯和氯化锌水溶液滴加苄基 氯,可得到医药中间体二苯甲烷:
N H 2 + C H C l 2 5
N a O H 1 2 0 ~ 2 2 0 ℃
N ( C H ) 2 5 2 +H C l
N,N-二甲基十八胺的苄基化产物是重要的阳离子表面活性 剂,制备的反应式如下:
C H 3 C H l C H C H 1 8 3 7 N +C 2 6 5 C H 3
C H 1 8 3 7 C H 3
一般不直接采用叔卤代烷进行反应,因叔卤代烷常常会发生 严重的消除反应,生成大量的烯烃。 芳香族卤代烷反应活性较差,较难进行烷基化反应,往往要 在强烈的反应条件下或芳环上有其他活化取代基存在时,才能 进行。 如:用苯胺和氯乙烷置于装有氢氧化钠溶液的高压釜中,升 温至120℃,压力为1.2MPa时,靠反应热可自行升温至 210~230℃,压力4.5~5.5MPa,反应3h,即可完成烷基化反应。
ROH + NaOH RO-Na+ + XAlk RO-Na+ + H2O ROAlk + NaX
在氢氧化钾和相转移催化剂聚乙二醇-400存在下,酚类与卤 代烷的反应非常顺利,如:
O H
乙 二 醇 + C H I + K O H聚 3 C H C l , H O 2 2 2
OCH3
+ KI + H 2 O
R'NH OS O OC H 2 +CH 3 2 3 R'NH OS O ONa 2 +CH 3 2 CH O CH SO O H R'NH 3 +3 2 N H CH H S Na O R' 3+ 4
硫酸的中性酯很容易释放出第一个烷基,而要释放出第二个 烷基则比较困难。当分子中有多个氮原子时,可以根据各氮原 子的碱性不同,选择性地只对一个氮原子进行N-烷基化。 使用硫酸二甲酯的N-甲基化,一般是在水介质中缚酸剂存在下 进行,或者在无水有机溶剂中进行。硫酸二甲酯的优点是它可 以只让氨基烷化而不影响芳环中的羟基。 例如:对甲苯胺与硫酸二甲酯于50~60℃时,在碳酸钠、 硫酸钠和少量水存在的条件下,烷基化生成N,N-二甲基对甲苯 胺,收率可达95%。
第4章 烷基化 反应和酰基化 反应
烷基化反应是指在有机化合物分子中的碳、氮 、氧等原子上引入烃基的反应,包括引入烷基、烯 基、炔基、芳基等。
在有机化合物分子中的碳、氮、氧、硫等原子上 引入脂肪族或芳香族酰基的反应称为酰化反应。
4.1 常用的烷基化试剂——卤烷烃
卤代烷是一类比较活泼的烷化剂,比醇的活性高许多。 卤代烷烃中烷基相同时,活性大小顺序为:
C H C l+ 2 Z n C l 水 解 液 2 7 0 ℃ ~ 7 5 ℃
C H 2
用氯乙酸的C-烷化反应可在芳环上引入羧甲基,用铝 粉作催化剂。例如,精萘、氯乙酸和铝粉在185~218℃ 搅拌5h,即得到农药和医药中间体萘乙酸:
C H O O H 2C
+ C l C H C O O H 2 1 8 5 ℃ ~ 2 1 8 ℃
NH3 + R-Z R'NH2 + R-Z R'NHR'' + R-Z RNH2 + HZ R'NHR + HZ R'NRR'' + HZ
R、R`、R``代表烷基,Z则代表-OH,-Cl、-OSO3H等基团。
N-烷基化剂的种类很多,常用的烷基化试剂有卤代烷、醇、 醚、酯、环氧化合物、烯烃、醛和酮等。卤代烷烃是N-烷基化 常用的烷基化试剂,其反应活性较醇强。 卤代烷进行的N-烷基化反应是不可逆的。烷化反应时生 成的卤化氢会与芳胺成盐,而芳胺的盐难于烷化,为了避免 这个不利影响,在N-烷化时通常要加入与卤烷等当量的缚酸 剂,例如NaOH、Na2CO3, NaHCO3、Fe (OH)2、Ca (OH)2和 MgO等。
C O O C H + N a 2 5 脱 质 子 C C H O N a + C 2 5 O O C H 2 5 H C H
C H C l 4 9 亲 核 取 代 C H 4 9 C H C O O C H 2 5
H
C O O C H 2 5 C O O C H 2 5
C O O C H 2 5
4.1.2 卤代烷烃作为N-烷基化剂
R-I>R-Br>R-Cl;
卤代烷中卤素原子相同,反应活性大小顺序为:
X > R3CX > R2CHX > RCH2X > CH3X
各种卤代烷中,氯代烷是最常用的烷化剂,价廉易得, 例如氯甲烷和氯乙烷等。当氯代烷不够活泼时,才使用溴 代烷。
4.1.1 卤代烷用作C-烷基化试剂
卤代烷的烷基化反应一般采用路易斯酸(如AlCl3、 ZnCl2)等作为催化剂。 用三氯化铝进行催化,其活泼亲电试剂的生成:
铝 粉
+ H C l
C-烷基可发生重排,反应中的烷基正离子可重排 成较为稳定形式的烷基正离子。例如:
+ CH3 CH2 CH2Cl AlCl3 CH(CH3)2 70% + 30% CH2CH2 CH3
含活泼亚甲基氢的化合物如乙酰乙酸乙酯、丙二酸 二乙酯、2,4-戊二酮等与卤代烷的C-烷化反应可用于制 备其α-H C H C l2 6 5
C H 3
4.1.3 卤代烷作为O-烷基化试剂
O-烷基化反应是制备醚的方法之一。许多芳醚的制备不宜采 用烷氧基化的合成路线,而需要采用酚羟基化(即O-烷基化)的合 成路线。 对于被烷基化的醇或酚来说,它们的负离子R-O-的反应活性 远远大于醇或酚本身的活性。因此,通常都是先将醇或酚与氢 氧化钠、氢氧化钾或金属钠相作用生成醇钠或酚钠,然后再与 卤代烷反应。
