原子的构成习题
经典初中化学原子结构(练习题)

经典初中化学原子结构(练习题)
下面是一些关于经典初中化学原子结构的练题,希望能帮助您巩固和提高对这一知识领域的理解。
1. 原子是物质的最小单位,它由什么组成?
答案:原子由质子、中子和电子组成。
2. 请问原子核中质子和中子的区别是什么?
答案:质子带有正电荷,中子不带电荷。
3. 原子核的质量是由质子和中子的质量之和决定的,请问原子核外的电子贡献了什么?
答案:原子核外的电子贡献了负电荷,使得原子整体处于电中性状态。
4. 请问在原子模型中,电子是如何排布的?
答案:根据原子模型,电子是按能级分布在原子的不同轨道上。
5. 在氢原子中,质子数和电子数相等吗?
答案:是的,氢原子中质子数和电子数相等,都是1。
6. 原子团和化合物中的原子是如何结合的?
答案:原子团和化合物中的原子通过化学键结合在一起。
7. 请问原子的核外电子是如何参与化学反应的?
答案:原子的核外电子通过与其他原子的核外电子进行共享、
转移或接受电子等方式参与化学反应。
这些练习题旨在帮助您回顾和巩固对经典初中化学原子结构的
理解,希望对您有所帮助。
如果您还有其他问题,请随时提问。
九年级化学 - 原子的结构(练习+答案)

九年级化学- 原子的结构1.原子是由居于原子中心的原子核和__核外电子__构成的,原子核是由__质子__和__中子__构成的。
2.由于原子核内质子所带电荷与核外电子的电荷数量__相等__,电性__相反__,因此原子不显电性。
3.在原子中,核电荷数=核内__质子数__=核外__电子数__。
4.原子中的核外电子是分层排布的,可以用__原子结构示意图__表示。
5.相对原子质量是以__一种碳原子质量的1/12__作为标准,其他原子的__质量__与它相比较所得到的比。
6.原子结构示意图的含义:小圆圈和圈内的数字表示__原子核__和__核电荷数__,弧线表示__电子层__,弧线上的数字表示该电子层上的__电子数__。
7.稀有气体最外层有__8__个(除氦外)电子,形成相对稳定的结构;金属的原子最外层电子一般少于__4__个,在化学反应中易__失去__电子;非金属的原子最外层电子一般多于__4__个,在化学反应中易__得到__电子。
9.构成物质的的粒子除了原子、分子之外,还有__离子__,__带电__的原子叫做离子。
其中带正电的原子叫做__阳__离子,带负电的原子叫做__阴__离子。
9.原子的质量主要集中在__原子核__上,因此相对原子质量≈__质子数__+__中子数__。
小节练习题1.原子核中一定含有的粒子是(B)A.中子B.质子C.电子D.质子和中子2.锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)A.1 B.3C.4 D.73.下列粒子不显电性的是(D)A.质子B.电子C.原子核D.分子4. 氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是(A)A.离子B.分子C.原子D.中子5. 下列关于原子结构的认识错误的是(C)A.原子内部有相对较大的空间B.原子由原子核和核外电子构成C.原子由质子和中子构成D.原子核带有正电荷6.下列有关离子的认识错误的是(D)A.原子失去电子,形成了阳离子B.原子得到电子,形成了阴离子C.离子也是构成物质的粒子D.原子失去电子后带负电荷7.下列结构示意图中,表示阴离子的是(D)8.下图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。
原子的结构练习题

3.2原子的结构一.选择题1.下列粒子结构示意图,表示阴离子的是()A.B.C.D.2.下列有关分子、原子、离子的说法正确的是()A.分子大,原子和离子小B.原子都是由质子、中子、电子构成的C.分子在不停的运动,原子不运动D.分子、原子、离子都可构成物质3.我国科学家利用“天眼”在银河系内发现了9颗中子星。
在中子星,巨大的压力将核外电子压缩到原子核中,电子与质子“中和”为中子,整个中子星就是由这样的原子核紧挨在一起形成的。
以下对中子星和中子的猜想错误的是()A.中子星不显电性B.中子星上存在丰富的氢离子C.中子的质量大于电子D.中子星的密度远大于地球4.某原子的相对原子质量为201,中子数为121,其对应的离子为R2+,则该离子核外电子数为()A.121B.80C.78D.825.下列有关分子、原子的说法正确的是A.原子得到电子后形成阳离子B.分子是化学变化中的最小粒子C.原子核是由质子和电子构成D.原子的质量主要集中在原子核6.下图是铁原子的结构示意图,有关说法正确的是()A.铁原子核内含有26个中子B.图中x=14C.铁原子易得到2个电子D.Fe原子与Fe2+质子数不同7.下列物质由原子直接构成的是A.金刚石B.水蒸气C.氯化钠D.碳酸钠8.证据推理是化学学科核心素养重要组成部分,下列推断合理的是()A.原子核由质子和中子构成,所以原子核中都含有质子和中子B.制取氧气必须检查装置气密性,所以制取气体都要检查装置的气密性C.元素的化学性质与最外层电子数有关,所以最外层电子数相同的元素化学性质一定相似D.阴离子带负电,所以带负电的粒子都是阴离子二、非选择题1.在以下粒子中找出符合下列条件的粒子,将序号填在横线上:①分子②原子③离子④阳离子⑤阴离子⑥原子核⑦质子⑧中子⑨电子(1)质量最小的粒子:;(2)带正电荷的粒子:;(3)带负电荷的粒子:;(4)不显电性的粒子:;(5)决定原子质量的粒子:;(6)与氢原子相对原子质量接近的:;(7)同一原子中数目相等的粒子:;(8)能直接构成纯净物的粒子:;(9)化学变化中最小的粒子:。
初三化学 原子的构成习题精选及标准答案

精品文档原子的构成习题精选含答案一、选择题1.原子和分子的区别是:( )A.分子在化学反应中分成原子,但在化学反应中原子不可再分B.分子一定比原子大C.分子能构成物质,而原子只能构成分子D.在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化的碳原子的质量是千克,则一个氧原子的.已知一个质子数和中子数都是26( ) 质量是:16.16克 BA..千克 D C.千克3.在原子中,质子数等于:( )A.中子数B.核外电子总数C.相对原子质量D.中子数和电子数之和4.下列原子各1克,所含原子个数最多的是:( )A.氧原子B.铁原子C.氢原子D.氯原子5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A.水分子B.构成水分子的原子C.中子和质子D.电子6.原子和分子的根本区别是()A.是否能直接构成物质B.是否能保持物质的化学性质C.是否在化学反应中发生种类的变化D.是否能构成单质7.下列关于原子的说法错误的是()A.原子是化学变化中的最小微粒B.原子是最小的微粒C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能精品文档.精品文档8.原子中决定相对原子质量大小的是()A.质子数和中子数B.质子数和电子数C.中子数和电子数D.核电荷数和电子数9.下列各种原子各1克,所含原子个数最多的是()A.氧原子B.铁原子C.氢原子D.氯原子10.下列各式中,表示两个氢原子的是(). 2H B.. C DA.11.碳的原子量是().千克D.1/12克 12A.克B.12C )12.在原子中(.质子数一定等于中子数A .质子数一定等于电子数B C.质子数、中子数、电子数三者都相等 D.原子核所带电量跟核外电子的电量相等 13.下列关于原子的叙述正确的是() A.物质都是由原子直接构成的B.原子是由质子和电子构成的 D.原子是由原子核和核外电子构成的C.原子是由质子和中子构成的二、填空题,,电子数是______质子数是1.硫原子的相对原子质量(原子量)为32,16,则中子数是______ ______。
原子结构练习题

原子结构练习题一、选择题1. 原子由______组成。
A. 电子和质子B. 电子和中子C. 质子和中子D. 电子、质子和中子2. 原子核中的质子数决定了原子的______。
A. 质量B. 电荷C. 原子序数D. 电子排布3. 原子中电子的排布遵循______原则。
A. 泡利不相容原理B. 能量最低原理C. 洪特规则D. 所有上述4. 原子的电子排布中,第一能级最多可容纳的电子数是______。
A. 2B. 8C. 16D. 325. 原子中电子的能级用主量子数n表示,主量子数n=1的电子层称为______。
B. L层C. M层D. N层6. 原子的电子排布中,s轨道最多可容纳的电子数是______。
A. 1B. 2C. 3D. 47. 原子的电子排布中,p轨道最多可容纳的电子数是______。
A. 1B. 2C. 3D. 68. 原子的电子排布中,d轨道最多可容纳的电子数是______。
A. 5B. 7C. 9D. 109. 原子的电子排布中,f轨道最多可容纳的电子数是______。
A. 7B. 9C. 14D. 1510. 原子的电子排布中,电子云的形状与轨道类型有关,s轨道的电子云形状是______。
B. 哑铃形C. 双叶形D. 四叶形二、填空题11. 原子核中的质子数和中子数之和称为原子的______。
12. 原子中电子的排布遵循泡利不相容原理,即在一个轨道中最多只能容纳______个电子。
13. 原子的电子排布遵循能量最低原理,电子会优先占据能量最低的轨道。
14. 原子的电子排布中,主量子数n=2的电子层称为______。
15. 原子的电子排布中,电子云的形状与轨道类型有关,p轨道的电子云形状是______。
三、简答题16. 描述原子核的结构,并解释质子和中子在原子核中的作用。
17. 解释为什么原子的电子排布遵循泡利不相容原理和洪特规则。
18. 描述原子中电子的能级和轨道的概念,并解释它们如何影响原子的化学性质。
原子结构练习题(含参考答案)

原子结构练习题(含参考答案)题目一1. 原子核由哪两种粒子组成?2. 电子的属性是什么?3. 原子的质量数由什么决定?4. 如何计算一个原子的电子数?5. 请列举五种不同元素的符号和原子序数。
参考答案:1. 原子核由质子和中子组成。
2. 电子具有负电荷和质量很小的特性。
3. 原子的质量数由其质子数和中子数之和决定。
4. 一个原子的电子数等于其质子数。
5. 例如:氢(H) - 1,氧(O) - 8,氮(N) - 7,铜(Cu) - 29,铁(Fe) - 26.题目二1. 什么是元素周期表?2. 哪个元素是元素周期表中的第一元素?3. 元素周期表是如何组织的?4. 元素的周期性特点是什么?5. 元素周期表中有多少个主要分组?参考答案:1. 元素周期表是一种排列化学元素的表格,按照一定规则组织元素信息。
2. 氢元素是元素周期表中的第一元素。
3. 元素周期表按元素的原子序数和化学性质进行组织,相似化学性质的元素分在同一垂直列(组)中。
4. 元素周期表中的元素周期性特点表现为周期性变化的原子半径、电离能和电负性等。
5. 元素周期表中有18个主要分组。
题目三1. 排列下列元素按原子升序:铜、氧、铁、钠。
2. 哪个元素的电子云最靠近原子核?3. 一个元素的原子序数是其原子中有多少个什么?4. 请列举两种气体元素。
5. 化合物是由什么组成的?参考答案:1. 氧、钠、铁、铜。
2. 电子云最靠近原子核的元素是氧。
3. 一个元素的原子序数是其原子中有多少个质子。
4. 例如:氢(H)和氧(O)。
5. 化合物是由两种或更多不同元素结合而成的。
原子的结构练习题

原子的结构练习题一、选择题1. 原子由哪几个基本粒子组成?A. 质子、中子、电子B. 质子、电子、光子C. 质子、中子、原子核D. 原子核、电子、光子2. 原子核中不包含以下哪种粒子?A. 质子B. 中子C. 电子D. 反质子3. 电子在原子中如何运动?A. 直线运动B. 旋转运动C. 随机运动D. 量子化轨道运动4. 以下哪个是原子的量度单位?A. 千克B. 米C. 原子质量单位D. 秒5. 原子的哪个属性决定了元素的化学性质?A. 原子核B. 电子数C. 中子数D. 质子数二、填空题6. 原子由____、____和____组成。
7. 原子核由____和____组成。
8. 原子的____决定了元素的化学性质。
9. 原子的____数等于其核电荷数。
10. 电子云模型描述了电子在原子中的____。
三、简答题11. 描述原子核的组成,并解释其对原子质量的贡献。
12. 解释为什么电子不能被直接观测到。
13. 描述电子云模型,并解释它如何帮助我们理解电子在原子中的运动。
14. 什么是同位素?请给出一个例子并解释其化学性质。
四、计算题15. 假设有一个氢原子,其原子核包含一个质子,没有中子。
已知质子的质量为1.6726 × 10^-27 kg。
计算该氢原子的质量。
(忽略电子的质量)五、论述题16. 讨论原子结构理论的发展,从汤姆逊的“布丁模型”到卢瑟福的“原子核模型”,再到现代的量子力学模型。
17. 阐述原子结构对物质性质的影响,包括但不限于原子的化学性质、物理性质和原子间的相互作用。
六、实验设计题18. 设计一个实验来观察原子的光谱线,并解释实验结果如何帮助我们了解原子结构。
七、案例分析题19. 分析一个实际案例,说明原子结构如何影响化学反应的速率和产物。
八、综合应用题20. 假设你是一名化学老师,需要为学生设计一堂关于原子结构的课程。
请列出课程大纲,并提供至少三种教学方法来帮助学生更好地理解原子结构的概念。
原子的结构练习题

第三单元第二节原子的构成一、原子的构成1.原子是________中的最小粒子,是指在________中不可再分,不等于原子不可再分。
原子是由居于原子中心的带________电的________和核外带________电的________构成的,而原子核又可以再分,它是由________和________两种粒子构成的。
2.在原子中,一个质子带________,中子不带电,一个电子带______,由于原子核内的质子数与核外的电子数___,但电性___,所以整个原子不显电性。
在原子中,原子核所带的电荷数(即核电荷数)由质子决定,所以核电荷数=质子数=_____。
不同的原子,______不同,由此可见,______决定了原子的种类。
3.绝大多数原子的原子核中含有( )A.质子、中子、电子B.质子、电子C.中子、电子D.质子、中子4.原子不显电性是因为 ( )A.原子不能得失电子 B.原子中没有带电微粒C.原子中的中子数与质子数相等 D.原子中核电荷数等于核外电子总数5.下列粒子(微粒)中不能直接构成物质的是( )A.原子B.分子C.离子D.电子6.1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔(AhmedHzewail)开创了化学研究新领域,他使运用激光光谱技术观测化学反应时分子中原子运动成为可能。
你认为该技术不能观察到的是()。
A.原子中原子核的内部结构B.化学反应中原子的运动C.化学变化中生成物分子的形成D.化学反应中反应物分子的分解7.反质子、正电子都属于反粒子,它们分别与质子、电子的质量、电量相等,但电性相反。
欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是()A.由一个带正电的质子和一个带负电的电子构成B.由一个带负电的质子和一个带正电的电子构成C.由一个带负电的质子和一个带负电的电子构成D.由一个带负电的质子和两个带负电的电子构成二、原子核外电子排布1. 如右图是某原子结构示意图,有关它的说法错误的是 ( )A.它的核内有12个质子B.它属于非金属元素C它有3个电子层D.它的最外层有2个电子2.下列粒子在化学反应中容易得到电子的是( )A.B.C.D.3.根据下列各组元素的原子结构示意图分析,具有相似化学性质的一组是( )4.下列粒子中,最外电子层不是稳定结构的是()A.氖原子B.氯原子C.钠离子D.硫离子5.某元素原子的核外电子排由时,第二层电子数是第一层与第三层电子数之和,则该元素属于()A.金属元素B.非金属元素C.稀有气体元素D.不能确定6.原子失去最外层电子后,会改变的是()A.元素种类B.相对原子质量C.中子数D.化学性质7.根据下列粒子的结构示意图回答问题(1)写出以上结构示意图所代表的粒子的符号:①②③④⑤⑥(2)一共表示种元素,属于非金属元素的是。
原子的构成练习题。doc

原子的构成练习题1、下列粒子中,质量最小的是()A.分子B.原子C.中子D.电子2.分子和原子的主要区别是()A.分子大原子小 B.是否能构成物质C.在化学变化中本身是否发生了变化 D.是否在不断地运动3.原子的质量主要集中在()A.质子上 B.中子上 C.电子上 D.原子核上4、2002年初,美国制成了第一台磁冰箱,其效率比普通冰箱效率高30%以上,生产磁冰箱所用的材料中含稀土元素钆(Gd),钆元素的一种原子的相对原子质量为157,核电荷数为64,则其原子中子数为()A.64B.57C. 93D.1285.有一个原子核内有8个中子和8个质子,另一个原子的核内有10个中子,核外有8个电子,则它们不相同的是()A.核电荷数B.核外电子数C.质子数D.相对原子质量6. 决定元素化学性质的是()A.质子数B.核外电子数C.最外层电子数D.核电荷数7.下列粒子在化学反应中容易得到电子的是().D.A B C D8.据报道,上海某医院正研究用放射性碘治疗肿瘤,这种碘原子的质子数是53,相对原子质量是125,下列关于这种原子的说法错误的是()A.核电荷数是53 B.核外电子数是53C.中子数是53 D.质子数与中子数之和是1259.2007年10月24日,“嫦娥一号”发射成功。
其主要任务之一是探测月球上的氦(He-3),其原子核内的质子数为2,中子数为1,每一百吨氦(He-3)核聚变所释放的能量相当于目前人类一年消耗的能量。
下列关于氦(He-3)元素的说法正确的是()A.原子核外电子数为3B.相对原子质量为2C. 原子结构示意图为D. 原子结构示意图为10.一个氧分子是由两个氧原子构成的,则一个氧分子内含有的质子数是()A.8B.16C.32D.6411.由分子参加的化学反应,反应前后一定发生变化的是()。
A.分子种类B.分子数目C.原子种类D.原子数目12.关于分子、原子、离子的叙述中,正确的是()A.只有带电的粒子才叫离子B.原子是最小的粒子C.分子是化学变化中的最小微粒 D.分子、原子、离子都是构成物质的粒子13.下列关于相对原子质量的说法中正确的是()A、它是原子的实际质量B、它可以用千克作单位C、它是以碳12原子质量为标准D、它约等于质子数与中子数之和。
原子的构成 习题精选

原子的构成习题精选一、选择题1.原子和分子的区别是:A.分子在化学反应中分成原子,但在化学反应中原子不可再分B.分子一定比原子大C.分子能构成物质,而原子只能构成分子D.在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化2.已知一个质子数和中子数都是6的碳原子的质量是千克,则一个氧原子的质量是:A.16克B.16C.千克D.千克3.在原子中,质子数等于:A.中子数B.核外电子总数C.相对原子质量D.中子数和电子数之和4.下列原子各1克,所含原子个数最多的是:A.氧原子B.铁原子C.氢原子D.氯原子5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A.水分子B.构成水分子的原子C.中子和质子D.电子6.原子和分子的根本区别是()A.是否能直接构成物质B.是否能保持物质的化学性质C.是否在化学反应中发生种类的变化D.是否能构成单质7.下列关于原子的说法错误的是()A.原子是化学变化中的最小微粒B.原子是最小的微粒C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能8.原子中决定相对原子质量大小的是()A.质子数和中子数B.质子数和电子数C.中子数和电子数D.核电荷数和电子数9.下列各种原子各1克,所含原子个数最多的是()A.氧原子B.铁原子C.氢原子D.氯原子10.下列各式中,表示两个氢原子的是()A.2H B.C.D.11.碳的原子量是()A.12克B.12 C.千克D.1/12克12.在原子中()A.质子数一定等于中子数B.质子数一定等于电子数C.质子数、中子数、电子数三者都相等D.原子核所带电量跟核外电子的电量相等13.下列关于原子的叙述正确的是()A.物质都是由原子直接构成的B.原子是由质子和电子构成的C.原子是由质子和中子构成的D.原子是由原子核和核外电子构成的二、填空题1.硫原子的相对原子质量(原子量)为32,质子数是16,则中子数是______,电子数是______,核电荷数是______。
原子的构成练习题
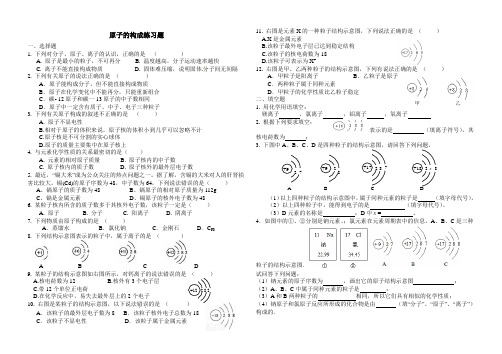
原子的构成练习题一、选择题 1. 下列对分子、原子、离子的认识,正确的是 ( ) A. 原子是最小的粒子,不可再分 B. 温度越高,分子运动速率越快 C. 离子不能直接构成物质 D. 固体难压缩,说明固体分子间无间隔 2. 下列有关原子的说法正确的是 ( ) A .原子能构成分子,但不能直接构成物质 B .原子在化学变化中不能再分,只能重新组合 C .碳- 12原子和碳一13原子的中子数相同 D .原子中一定含有质子、中子、电子三种粒子 3. 下列有关原子构成的叙述不正确的是 ( ) A. 原子不显电性 B.相对于原子的体积来说,原子核的体积小到几乎可以忽略不计 C.原子核是不可分割的实心球体 D.原子的质量主要集中在原子核上 4. 与元素化学性质的关系最密切的是( ) A. 元素的相对原子质量 B. 原子核内的中子数 C. 原子核内的质子数 D. 原子核外的最外层电子数 5. 最近,“镉大米”成为公众关注的热点问题之一。
据了解,含镉的大米对人的肝肾损害比较大。
镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( ) A 、镉原子的质子数为48 B 、镉原子的相对原子质量为112g C 、镉是金属元素 D 、镉原子的核外电子数为48 6. 某粒子核内所含的质子数多于其核外电子数,该粒子一定是( ) A. 原子 B. 分子 C. 阳离子 D. 阴离子 7. 下列物质由原子构成的是 ( ) A .蒸馏水 B .氯化钠 C .金刚石 D .C 60 8. 下列结构示意图表示的粒子中,属于离子的是 ( )A B C D9. 某粒子的结构示意图如右图所示,对钙离子的说法错误的是A.核电荷数为12B.核外有3个电子层C.带12个单位正电荷D.在化学反应中,易失去最外层上的2个电子 10. 右图是某粒子的结构示意图,以下说法错误..的是 ( A .该粒子的最外层电子数为8 B .该粒子核外电子总数为18C .该粒子不显电性D .该粒子属于金属元素11. 右图是元素X 的一种粒子结构示意图,下列说法正确的是 ( ) A.X 是金属元素B.该粒子最外电子层已达到稳定结构C.该粒子的核电荷数为18D.该粒子可表示为X + 12. 右图是甲、乙两种粒子的结构示意图,下列有说法正确的是 ( ) A .甲粒子是阳离子 B .乙粒子是原子 C .两种粒子属于同种元素 D .甲粒子的化学性质比乙粒子稳定 二、填空题1. 用化学用语填空: 镁离子 ,氯离子 ,铝离子 ,氧离子2. 根据下列要求填空: 表示的是 (填离子符号),其 核电荷数为 ;3. 下图中A 、B 、C 、D(1)以上四种粒子的结构示意图中,属于同种元素的粒子是 (填字母代号)。
原子的构成习题

原子的构成习题(总3页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--1.原子的质量主要集中在( )。
A.质子B.中子C.电子D.原子核2.下列关于原子核的叙述中,正确的是( )。
①通常由中子和电子构成②通常由质子和中子构成③带负电荷④不显电性⑤不能再分⑥体积大约相当于原子⑦质量大约相当于原子A.①⑤B.②⑦C.③④D.②⑥⑦3.下列叙述中,正确的是( )。
A.相对原子质量就是原子质量的简称B.相对原子质量可用千克或克作单位C.相对原子质量是一个没有单位的比值D.原子质量约等于原子核内质子质量和中子质量之和4.下列粒子中带正电荷的是。
(填序号)①电子②质子③中子④原子核⑤原子⑥分子5.下列叙述中错误的是()。
①原子是化学变化中的最小粒子②原子是不能再分的粒子③一切物质都是由原子直接构成的④一切原子核都是由质子和中子构成的⑤原子不显电性⑥原子之间有间隔A.①和②B.②③和④C.③和⑤D.③和⑥6.有两种不同的原子,一种原子核内有6个中子和6个质子另一种原子有7个中子和6个质子,则它们不相等的是()。
A.核电荷数B.核外电子数C.原子的质量D.相对原子质量7.已知核内有6个质子和6个中子的碳原子的质量为m kg,一个钼原子的质量为8mkg,则钼的相对原子质量为()。
A.96B.72C.48D.368.据中央电视台2001年6月对云南抚仙湖湖底古城考古的现场报道,考古学家通过测定古生物遗骸中的碳14原子的含量来推测古生物的年代。
碳14原子的质子数是6,相对原子质量是14,下列有关碳14原子的叙述正确的是()A.其核外有8个电子B.其核内有6个中子C.核电荷数为6D.质子数和中子数之和为149.一个碳原子(原子核内有6个质子和6个中子)的质量是5.4mkg,R原子的相对原子质量是n/3,则一个R原子的质量应是。
10.已知一个碳12原子的质量为1.993×10-26 kg,一个氧原子的质量为2.657×10-26 kg,求氧原子的相对原子质量。
原子的结构练习题

原子的结构练习题题目一:选择题1. 原子的基本组成部分是:a) 电子b) 质子和中子c) 中子d) 电子和质子2. 质子的电荷为:a) 正电荷b) 负电荷c) 中性d) 都有可能3. 一个原子的中子数目等于:a) 质子数目b) 电子数目c) 原子核数目d) 都有可能4. 具有相同质子数,但中子数不同的原子称为:a) 同位素b) 异位素c) 同位中子d) 异位质子5. 具有相同中子数,但质子数不同的原子称为:a) 同位素b) 异位素c) 同位质子d) 异位中子题目二:判断题1. 原子核由质子和中子组成,质子带正电荷,中子带负电荷。
()2. 元素的化学性质由其质子数决定。
()3. 同位素具有相同的原子序数和质子数。
()4. 电子的质量约为质子和中子的1/1836。
()5. 原子的直径大约为10^-10米。
()题目三:简答题请简要介绍原子的结构。
题目四:填空题1. 具有相同原子序数但不同质子数的原子称为_____________。
2. 一个原子的质子数等于其原子核中_____________的数目。
3. 具有相同中子数但不同质子数的原子称为_____________。
4. 原子核由_____________和_____________组成。
5. 在原子结构中,电子以_____________的形式存在。
题目五:解答题1. 解释同位素和异位素的概念,并给出一个例子。
2. 为什么原子的直径通常用10^-10米来表示?3. 为什么电子的质量可以忽略不计?题目六:应用题1. 根据以下数据回答问题:元素X的原子核中有16个质子和18个中子,请回答以下问题:a) X元素的原子序数是多少?b) X元素的质量数是多少?c) X元素的核外电子数为多少?2. 通过填写下面的填空题,来画出氧原子的示意图:a) 原子序数:8b) 质子:8c) 中子:8答案及解析:题目一:选择题1. b) 质子和中子解析:原子的基本组成部分包括了质子和中子构成的原子核,以及环绕原子核的电子。
初中化学 原子的结构 练习题(含答案)

初中化学原子的结构练习题(含答案)一、选择题1. 下列不属于原子的基本组成部分的是()。
A. 质子B. 中子C. 电子D. 胶子答案:D2. 原子的电子构型是()。
A. 1B. 2C. 3D. 4答案:B3. 下列不属于物质的基本性质的是()。
A. 原子数B. 元素符号C. 原子量D. 原子序数答案:B4. 原子的最外层电子数目决定了()。
A. 元素的化学性质B. 元素的物理性质C. 元素的原子量D. 元素的原子序数答案:A5. 下列元素中,原子结构相同的是()。
A. 氧、硫、硒B. 氮、氧、氟C. 硅、磷、硫D. 氢、碳、氮答案:C二、判断题1. 原子的质子数等于元素的原子序数。
答案:正确2. 电子是带正电荷的,质子是带负电荷的。
答案:错误3. 一个原子的质子数和中子数之和等于它的原子量。
答案:正确4. 在原子核外围能容纳的最多电子数目等于2n^2(n为层数)。
答案:错误5. 原子的质子和中子都存在于原子核中。
答案:正确三、填空题1. 一个氧原子包含()个质子。
答案:82. 原子的质量数等于()。
答案:质子数+中子数3. 具有相同质子数,但质量数不同的原子叫做()。
答案:同位素4. 正电荷的质子和负电荷的电子的数量是()。
答案:相等5. 原子核的直径是原子直径的()倍。
答案:约1/10四、简答题1. 什么是同位素?请举例说明。
答案:同位素是指具有相同的质子数,但质量数不同的原子。
例如,氢的三种同位素分别是氘(质子数为1,中子数为1),氢(质子数为1,中子数为0),氚(质子数为1,中子数为2)。
2. 原子的结构由哪些基本组成部分构成?各有何作用?答案:原子由质子、中子和电子构成。
质子和中子集中成核,在原子核中,质子带正电荷,中子是中性的;电子绕核而行,带负电荷。
质子和中子决定了原子的质量和核的稳定性,电子决定了原子的化学性质。
3. 为什么说原子是宇宙中最微小的物质单位?答案:原子是宇宙中最微小的物质单位,因为原子是由基本粒子构成的,而基本粒子是所有物质的最基本单位,无法再分解为更小的单位。
原子的构成练习题

原子的构成练习题一、选择题;1、在化学变化中可分的微粒是()A、原子B、分子C、质子D、电子2、下列关于原子的叙述,错误的是()A、能构成物质,也能构成分子B、一定含有质子、中子和电子C、原子不显电性D、是比分子小的粒子3、下列说法正确的是()A、在化学反应中,发生改变的只是原子核外的电子,而原子核没有改变B、在化学反应中,金属元素的原子容易失去电子变为带正电荷的阴离子C、在化学反应中,氯原子易失去1个电子,形成带1个单位负电荷的氯离子D、原子失去电子或得到电子后,一定会变成离子4、钠原子由11个质子和12个中子构成,下列说法错误的是()A、钠原子核所带电荷数为11B、钠的相对原子质量为23gC、钠原子核外电子数为11D、钠的相对原子质量为235、原子中,一定含有的微粒是()A、质子、中子、电子B、质子、中子C、中子、电子D、质子、电子6、碳的相对原子质量为()A、1.66×10-27kgB、 1.993×10-26kgC、12 kgD、127、构成氯化钠的粒子是()A、氯化钠分子B、钠原子和氯原子C、钠离子和氯离子D、氯化钠离子8、已知镁原子核内质子数为12,而且质子数与中子数相等,则该原子核内所含粒子总数为()A、12B、24C、36D、 489、下列关于原子核的叙述:①通常是由中子和电子构成②通常是由质子和中子构成③带正电荷④不显电性⑤不能再分⑥跟原子比较体积很小,但却集中了原子的主要质量。
其中正确的是()A、①③⑥B、②③⑥C、②③⑤D、①④⑥10、某原子中共有34个粒子,其中12个粒子不带电,则它的相对原子质量约为()A、34B、46C、23D、1211、某元素一个单位负电荷的阴离子结构示意图为,则x、y的值分别为()A、18和8B、17和8C、19和8D、14和412、某种氧原子的原子核内有8个质子和8个中子,另一种氧原子的原子核内有8个质子和10个中子,则这两种氧原子中不同的是()A、核电荷数B、核外电子数C、原子的质量D、原子的带电量13、美国“9.11事件”发生以后,美国政府扬言要用中子弹攻击恐怖分子,中子弹爆炸是()A、分子分解成原子B、原子得失电子C、原子核破裂D、中子运动或变化14、根据下列原子结构示意图判断,化学性质最稳定的是()15、根据粒子结构示意图:下列判断正确的是()A、它们都带有电荷B、它们原子的核外电子数相同C、它们都具有稳定结构D、它们表示同一种元素16、下列各组粒子的结构示意图中所表示的元素的化学性质相似的一组是()17、某粒子的结构示意图为,则它所带电荷数可能是()A、8-nB、n-8C、10-nD、n-1018、已知原子核内有6个质子和6个中子的碳原子质量为a克,若另一种原子的质量为b 克,则另一种原子的相对原子质量为()A、a/bB、b/aC、12b/aD、12a/b19、已知一种锶原子的相对原子质量为88,其质子数为38,则这种锶原子的核外电子数为()A、38B、50C、88D、12620、居里夫妇在1898年从几吨铀盐废料中提炼0.3%镭。
原子的结构习题(含答案及解析)

原子的结构习题一、单选题(本大题共25小题,共50.0分)1.等电子体具有原子数目相同、电子数目相同的特征。
下列各组属于等电子体的是()A. NO和O22−B. CO和N2 C. NO2和CO2 D. SO2和ClO22.镨(Pr)是一种稀土元素,已知镨原子的核电荷数为59,相对原子质量为141,该原子的质子数是()A. 141B. 92C. 59D. 823.汤姆森和卢瑟福都对现代原子结构理论做出了巨大贡献。
下列关于原子构成的论述中,不属于他们两人共同观点的是()A. 原子是可分的B. 原子呈球形C. 带正电荷的原子核居于原子的中心D. 电子带负电4.某原子R的原子核带x个正电荷,则R2+离子的核外电子总数()A. x−2B. x+2C. xD. 无法确定5.下表列出了几种原子中的粒子数:原子质子数中子数核外电子数氢101碳666氧888钾192019分析表中信息,下列说法正确的是()A. 原子核内质子数等于中子数B. 原子核都由质子和中子构成C. 原子只有质子和电子构成D. 原子中质子数等于核外电子数6.1934年,卢瑟福等科学家通过核反应发现氢的同位素原子−氚.氚可用“ 13H”表示(其中“1”表示核电荷数),氚原子的模型如图所示,图中“”表示的粒子是()A. 原子核B. 质子C. 中子D. 核外电子7.下列关于原子的叙述不正确的是()A. 原子可以构成物质的分子,有的原子能直接构成物质B. 相对于原子来说,原子核的体积很小,但原子的质量却主要集中在原子核上C. 在化学变化中分子发生变化,原子不发生变化D. 原子核都是由质子和中子构成的8.下列各种微粒,不带电的是()A. 原子B. 电子C. 质子D. 原子核9.已知两种不同的原子,一种原子核内有10个质子、10个中子,另一种原子核内有10个质子,9个中子,则它们不相等的是()A. 核外电子数B. 原子的核电荷数C. 原子的质量D. 原子核的带电量10.下列关于原子核的说法中,错误的是()A. 原子核位于原子的中心,带正电荷B. 原子核位于原子的中心,带负电荷C. 原子核在原子中所占的体积非常小D. 原子的质量主要集中在原子核上11.关于相对原子质量,下列说法正确的是()A. 相对原子质量约等于质子数加电子数B. 相对原子质量就是原子质量C. 两种元素原子质量之比等于它们的相对原子质量之比D. 通常情况下,相对原子质量是以“千克”为单位12.碳的相对原子质量是()A. 12gB. 12C. 1.66×10−27kgD. 1/12g13.下列说法正确的是()A. 由分子构成的物质在发生化学变化时,分子种类改变,原子种类不变B. 离子是带电的原子或原子团,所以带电的微粒一定是离子C. 构成固体物质的微粒都是静止不动的D. 与元素化学性质关系最密切的是原子的核外电子数14.原子、分子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是()A. 二氧化碳B. 金刚石C. 氯化钠D. 黄金15.下列物质由离子构成的是()A. 二氧化碳B. 水C. 金刚石D. 氯化钠16.下列关于四种粒子的结构示意图说法正确的是()A. ①、②的化学性质相似B. ②所示的粒子符号为NaC. ③在化学反应中易失去电子D. ④中x可能为817.铁元素是人体必需的元素.已知铁原子的核电荷数为26,中子数为30,则铁原子的核外电子数为()A. 56B. 30C. 26D. 418.根据下列各组元素的原子结构示意图分析,化学性质相似的一组是()A. B.C. D.19.如图是某原子的核外电子排布图,以下说法正确的是()A. 该原子的化学性质和氯原子相似B. 该粒子的相对原子质量是35C. 该粒子容易失去电子D. X的数值为520.图是Na和Na+两种粒子结构示意图,小明观察示意图后,作出以下判断.①核电荷数相同②核外电子数相等③Na+比Na稳定 ④质量几乎相等⑤质子数相等其中正确的是()A. ①③④⑤B. ②④C. ①②⑤D. 全部21.下列关于分子和原子的说法,正确的是()A. 由分子构成的物质,分子是保持物质性质的最小粒子B. 最外层电子数为8的粒子一定是稀有气体的原子C. 最外层电子数决定原子的种类D. 同种原子可以构成不同种分子22.原子的构成示意图如图,下列叙述正确的是()A. 原子是实心球体B. 质子、中子、电子均匀分散在原子中C. 质子与电子质量相等D. 整个原子的质量主要集中在原子核上23.下列粒子结构示意图中,表示阳离子是A. B.C. D.24.下列对原子、分子、离子的认识,错误的是()A. 原子的核内质子数等于核外电子数B. 相同元素的原子其核外电子数一定比相应离子的核外电子数多C. 相同原子可以构成不同的分子D. 分子、原子、离子都是构成物质的粒子25.下列说法正确的是()A. 相对原子质量就是原子的实际质量B. 湿衣服在阳光下比阴凉处干得快,原因是水分子受热后运动速率加快C. 气体比液体容易被压缩,原因是物质的气态分子小而液态分子大D. 过氧化氢分子能分解成水分子和氧分子,说明分子是化学变化中的最小微粒二、填空题(本大题共5小题,共5.0分)26.图为某粒子结构示意图(其中y不等于零),按下列要求回答各问题:(1)当x=10+y时,该粒子为__________(填原子或阳离子、阴离子)。
原子的构成习题精选及答案

原子的构成习题精选及答案一、选择题1、原子和分子的区别是:( )A、分子在化学反应中分成原子,但在化学反应中原子不可再分B、分子一定比原子大C、分子能构成物质,而原子只能构成分子D、在化学反应中分子和原子都可以变成另一种分子和原子,区别在于它们发生的是不同的变化2、已知一个质子数和中子数都是6的碳原子的质量是千克,则一个氧原子的质量是:( )A、16克B、16C、千克D、千克3、在原子中,质子数等于:( )A、中子数B、核外电子总数C、相对原子质量D、中子数和电子数之和4、下列原子各1克,所含原子个数最多的是:( )A、氧原子B、铁原子C、氢原子D、氯原子5、一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()。
A、水分子B、构成水分子的原子C、中子和质子D、电子6、原子和分子的根本区别是()A、是否能直接构成物质B、是否能保持物质的化学性质C、是否在化学反应中发生种类的变化D、是否能构成单质7、下列关于原子的说法错误的是()A、原子是化学变化中的最小微粒B、原子是最小的微粒C、原子核带正电荷,但原子不显电性D、分子能直接构成物质而原子不能8、原子中决定相对原子质量大小的是()A、质子数和中子数B、质子数和电子数C、中子数和电子数D、核电荷数和电子数9、下列各种原子各1克,所含原子个数最多的是()A、氧原子B、铁原子C、氢原子D、氯原子10、下列各式中,表示两个氢原子的是()A、2HB、C、D、11、碳的原子量是()A、12克B、12C、千克D、1/12克12、在原子中()A、质子数一定等于中子数B、质子数一定等于电子数C、质子数、中子数、电子数三者都相等D、原子核所带电量跟核外电子的电量相等13、下列关于原子的叙述正确的是()A、物质都是由原子直接构成的B、原子是由质子和电子构成的C、原子是由质子和中子构成的D、原子是由原子核和核外电子构成的二、填空题1、硫原子的相对原子质量(原子量)为32,质子数是16,则中子数是______,电子数是______,核电荷数是______。
原子的构成练习题

原子的构成练习题一、选择题1.原子的质量主要集中在()A.质子B.中子C.电子D.原子核2.下列叙述中错误的是()①原子是化学变化中的最小粒子②原子是不能再分的粒子③一切物质都是由原子直接构成的④一切原子核都是由质子和中子构成的⑤原子不显电性⑥原子之间有间隔A.①和②B.②③和④C.③和⑤D.③和⑥3.已知一个质子数和中子数都是6的碳原子的质量是千克,氧原子的相对原子质量是16,则一个氧原子的质量是()A.16克 B.16C.千克 D.千克4.在原子中,质子数等于()A.中子数B.核外电子总数C.相对原子质量 D.中子数和电子数之和5.一滴水能分成许许多多个水分子,分子又可分成原子,原子又由中子、质子、电子等构成,这些微粒中,一定能保持水的化学性质的是()A.水分子 B.构成水分子的原子 C.中子和质子 D.电子6.下列关于原子的说法错误的是()A.原子是化学变化中的最小微粒 B.原子是最小的微粒C.原子核带正电荷,但原子不显电性D.分子能直接构成物质而原子不能7.原子中决定相对原子质量大小的是()A.质子数和中子数 B.质子数和电子数 C.中子数和电子数 D.核电荷数和电子数8.碳的相对原子质量是()A.12克B.12 C.千克 D.1/12克9.在原子中()A.质子数一定等于中子数B.质子数一定等于电子数C.质子数、中子数、电子数三者都相等D.原子核所带电荷数跟核外电子的电荷数相等10.下列关于原子的叙述正确的是()A.物质都是由原子直接构成的 B.任何一种原子都含有质子、中子和电子C.原子是由质子和中子构成的 D.原子是由原子核和核外电子构成的11.美国铱星公司原计划发射77颗卫星以实现卫星通讯,发射卫星的数目与铱元素的原子核外电子数目恰好相等。
下列关于铱元素的各种说法中正确的是()A.铱原子的质子数为70 B.铱原子的相对原子质量为77C.铱原子的核电荷数为77 D.铱原子是金属原子12.绝大多数原子的原子核中含有()A.质子、中子、电子 B.质子、电子 C.中子、电子 D.质子、中子13.由我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测定核电荷数为63的铕元素的相对原子质量的新值为152。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子习题
一、填空题
1.在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子填在相应的横线上:
(1)能保持物质化学性质的粒子是________。
(2)化学变化中的最小粒子是________。
(3)带正电荷的粒子是________。
(4)不显电性的粒子是________。
(5)质量最小的粒子是________。
(6)在同一原子中数目相等的粒子是________。
(7)决定原子质量大小的粒子主要是________。
2.已知每个电子的质量约为每个质子(或中子)质量的1/1836,所以在科学上计算原子的质量时只计算质子和中子的质量,电子质量忽略不计,下表是部分原子
(1)_______________________________________________________________。
(2)_______________________________________________________________。
(3)_______________________________________________________________。
二、选择题
1.某些花岗岩石材中含有放射性元素氡。
一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为()
A.50
B.86
C.136
D.222
2.下列说法正确的是()
A.原子不能再分
B.原子核都是由质子和中子构成的
C.相对原子质量只是一个比,没有单位
D.原子可以构成分子,也可以直接构成物质
3.有两种原子,一种原子核内有17个质子和18个中子,另一种原子核内有17个质子和19个中子,则它们不相等的是()
A.核电荷数
B.核外电子数
C.原子质量
D.原子的带电荷量。
