u原子的构成
精英大视野丛书中考化学第7讲原子的构成2

第7讲原子的构成A. mB.n/12C.12m/nD.12n/m4.闪电时空气中有臭氧生成,下列说法中正确的是()A. 相同的分子数的O2和O3具有相同的质子数B. 等质量的O2和O3具有相同的原子数C. 由O2转变成O3的变化属于物理变化D. 由O2转变成O3的变化属于化学变化5.重水的主要用途是在核反应堆中作减速剂,一个重水分子是由两个重氢原子和一个氧原子构成的.重氢原子核电荷数为1,相对原子质量为2,下列说法中正确的是()A. 重氢原子核外有2个电子B. 重氢分子相对分子质量为2C. 重水的相对分子质量为20D. 重氢原子核内有2个质子6.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是()A. N4的摩尔质量是56B. N4与N2互为同素异形体C. N4比N2稳定D. 等质量的N4与N2所含原子个数比为2:17.法国里昂的科学家发现一种只有四个中子构成的粒子,这种粒子成为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似,有关该粒子的说法不正确的是()A. 不显电性 B. 相当于一个氦(He)原子的质量C. 失去一个中子后仍显电中性D. 在周期表中与氢元素占同一位置8.血红蛋白的式量为68000,含铁元素的质量分数为0.33%,则平均每个血红蛋白分子中铁原子的个数是()A. 1B. 2C. 3D. 49.生物体死亡后,体内含有的碳-14会逐渐减少(称为衰变)。
因此科学家可通过测量生物体遗骸中碳-14的含量,来计算它存活的年代,这种方法称为放射性碳测年法。
碳-14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核。
下列关于新原子核说法正确的是()A.碳原子核,含7个质子,8个中子B.氮原子核,含7个质子,7个中子C.碳原子核,含6个质子,7个中子D.氧原子核,含7个质子,8个中子10.硫隔绝空气加热后的蒸气中有一种物质的化学式为S8,关于S8的叙述不正确的有( )A. 它是一种新型的化合物B. 它是一种单质C. 它的一个分子中有8个硫原子D. 相对分子质量为25611.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子等这些粒子中:(1)能直接构成物质的粒子有_________;(2)能保持物质化学性质的粒子有___________ (3)显示电中性的粒子有___________(4)肯定带正电荷的粒子有___________(5)肯定带正电荷的粒子有___________ ;12.居里夫妇在1898年从几吨铀盐废料中提炼出0.3g镭.镭具有放射性,镭原子会分裂,变成一个质子数为86、中子数为136的氡原子和一个具有2个中子和2个电子的氦原子,并放出能量.试推测镭原子的核电荷数与相对原子质量分别是()A. 88、138B. 86、14C. 88、226D. 84、16813.近代著名化学家道尔顿在著作中说:“一切物质都是由数量巨大的、极微小的粒子(原子)构成的,这些粒子间通过引力互相结合,我们不能创造原子,不能分裂原子,我们能实现的变化,无非把原先结合在一起的原子分开,或原先分开的原子结合起来。
第4章 物质结构 元素周期律 -高中化学全册必背章节知识清单(新人教版必修第一册)(教师版)

第四章 物质结构 元素周期律第一节 原子结构与化学周期表一、原子结构 1、原子的构成原子由原子核和核外电子组成(原子核包括质子和中子),质子带 正电 ,电子带 负电 ,中子中立 不带电 。
2、质量数(1)概念:将核内所有 质子 和 中子 的相对质量取近似整数值相加,所得的数值。
(2)构成原子的粒子间的两个关系①质量数(A )= 质子数(Z ) + 中子数(N ) ②质子数= 核电荷数 =核外电子数 3、原子的表示方法如作为相对原子质量标准的12 6C 表示质子数为 6 ,质量数为 12 的碳原子。
4、粒子符号(A Z X ±bn ±m )中各数字的含义5、原子核外电子排布的表示方法 (1)原子结构示意图用小圆圈和圆圈内的符号及数字表示 原子核 及 核内质子数 ,弧线表示各电子层,弧线上的数字表示该电子层上的电子数。
以钠原子为例:(2)离子结构示意图①金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排的电子数也相同)。
如 Mg :→ Mg 2+:。
②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体元素原子相同的电子层结构。
如 F :→F-:。
Na+与稀有气体Ne的核外电子排布相同;Cl-与稀有气体Ar的核外电子排布相同。
二、元素在周期表1、周期的分类与包含元素216个族分为7 个主族、7 个副族、1个第Ⅷ 族和1个0 族。
3、元素周期表中的方格中各符号的意义注:元素周期表记忆口诀横行叫周期,现有一至七;三四分长短,四长副族现;竖行称作族,总共十六族;Ⅷ族最特殊,三列是一族;二三分主副,先主后副族;镧锕各十五,均属ⅧB族。
4、元素在周期表中的位置与原子结构的相互推断(1)元素的位置与原子结构的关系(2)短周期元素原子结构与位置的关系①族序数等于周期数的元素有H、Be、Al 。
②族序数是周期数2倍的元素有C、S 。
原子组成及相对原子质量

原子组成及相对原子质量教学分析:原子组成是物质可分基础上的对物质组成的更深层次的认识,因此思维方法还是分子概念建立的思维方法—物质是无限可分的。
认识原子的组成主要是从三个方面认识构成原子的微粒:①微粒种类(质子、中子、电子)和各种微粒的性质;②各种微粒在原子中的数量关系;③各种微粒在原子中的位置关系。
认识原子的组成,同样是实物认识,因此要充分让学生“观察”原子的组成,尽量让学生掌握多种原子的组成,通过数量的增加来巩固对原子认识的清晰度。
让学生凭借思维“观察”到质子、中子、电子,并对这些微粒的大小、质量,有个“感观”的认识,从而清晰地构建这些微粒的概念。
由于有关原子组成的知识是化学理论知识,教学过程中最主要的是讲授法。
相对原子质量是定义性概念,用来解决原子质量太小,不好表达也不好计算的问题。
相对原子质量的教学首先应引导学生形成问题,抓住问题的主要矛盾,然后引导学生导找解决问题的基本方法,这种基本方法一定要让学生自主去找、去探索,然后在学生探索到接近科学的方法后再将科学方法提出来,或是通过总结学生提出的方法而确定问题解决的方法,用此方法去解决问题,形成概念,而后是练习用此方法解决同类其他的问题,以巩固和熟悉知识。
此课可以分成两个学时教学,第一个学时教原子的组成,当一种原子的组成了解清楚后,可以引导学生按照教师所出示的思维模式去了解其他原子的组成及相应的有关原子组成的认识,即组成的微粒种类、各微粒数量及数量关系、各微粒的位置关系等。
第二课时,学习相对原子质量。
教学目标:继续发展物质可分的认识哲学思想。
认识组成原子的微粒及其性质。
认识各微粒在原子中的位置关系以及各微粒的数量关系。
认识常见原子的组成。
从质量的角度认识原子,掌握相对原子质量的概念,练习部分常见元素的相对原子质量教学程序:复习分子、原子的有关知识以氧原子为例,讲解原子构成:氧原子的组成微粒;各微粒的数量和性质;各微粒在原子中的空间位置;认识多种原子的组成。
高三化学一轮复习——原子结构与核素、同位素

高三化学一轮复习——原子结构与核素、同位素知识梳理1.原子结构(1)原子的构成(2)原子内的等量关系①质量数(A)=质子数(Z)+中子数(N);②质子数=原子序数=核电荷数=核外电子数;图示:③阳离子:质子数=核外电子数+电荷数;④阴离子:质子数=核外电子数-电荷数。
(3)原子符号2.元素、核素、同位素(1)“三素”概念的辨析:(2)几种重要的核素及其应用U21H31H18 8O 核素23592用途核燃料用于考古断代制氢弹示踪原子[名师点拨]①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.特征电子数粒子(1)2e-微粒H2←H-←→Li+→Be2+(2)10e-微粒(3)18e-微粒[考在课外]教材延伸判断正误(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(√)(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同。
(√)(3)核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化。
(×)(4)中子数不同而质子数相同的微粒一定互为同位素。
(×)(5)通过化学变化可以实现16O与18O间的相互转化。
(×)(6)3517Cl与3717Cl得电子能力几乎相同。
(√)(7)21H+核外电子数为2。
(×)(8)两种粒子,若核外电子排布完全相同,则其化学性质一定相同。
(×)(9)13C与C60互为同素异形体。
(×)(10)所有的原子中都含有质子和中子。
(×)拓展应用(1)①11H、21H、31H分别是氢元素的三种________,它们互称为________。
②5626Fe2+的质子数为________,中子数为________,核外电子数为________。
原子核的构成人教版高一年级化学课堂教辅PPT

质量数。
质量数(A)=质子数( Z )+中子数( N )
【微思考】某原子的相对原子质量与其质量数是什么关系?
提示
原子的相对原子质量是一个原子的质量与12C原子质量
1
12的比值,可
能会有小数部分;质量数是质子数与中子数的加和,只能是整数。质量数是
(2)同位素的特点是什么?
提示 同位素具有以下特点:①同一元素的不同核素互称同位素,其核内的
质子数相同而中子数不同。②同位素的化学性质几乎完全相同,但物理性
质不同。③在天然存在的某种元素中,不论是游离态还是化合态,各种核素
所占的原子百分比是不变的。
【深化拓展】
1.元素、核素和同位素的比较与联系
概念 元素
同位素,H2O、D2O、T2O均是氢元素和氧元素组成的,它们的化学性质
相同,但物理性质不同。因此,水和重水、超重水是不同的物质,大量混合
时为混合物。
【必备知识】
一、人类认识原子结构的历程
演变过程
主要论点
公元前5世纪,古希腊
物质由原子构成,且原子是不可再分的微粒,原子的结合
哲学家德谟克利特的
和分离是万物变化的根本原因
故化学性质基本相同。
(2)一种元素的各种核素所占的原子百分比(又叫丰度)基本不变。如:
核素 核素的相对原子质量
20世纪初,现代原子结构 揭示电子运动的波粒二象性运动规律,必须用量
学说(量子力学模型)
子力学模型描述核外电子的运动
二、原子核的构成
1.原子的构成:原子由原子核和核外电子构成,原子核由质子和中子构成。
2.原子中的相关关系式
(1)质子数( Z )=核电荷数=核外电子数=原子序数
2020化学新人教必修:核素含解析

提示
【点拨提升】
1.构成原子的粒子及相互关系
(1)构成原子的粒子
(2)有关粒子间的关系
①质量数(A)=质子数(Z)+中子数(N)
②质子数=核电荷数=中性原子的核外电子数
③阳离子:质子数=核外电子数+电荷数
④阴离子:质子数=核外电子数-电荷数
【典题例证1】 下列说法错误的是( )
A. H、 H、H+和H2是氢元素的四种不同粒子
B. Ca和 Ca、石墨和金刚石均为同素异形体
C. H和 H是不同的核素
D.12C和14C互为同位素、物理性质不同、但化学性质几乎完全相同
解析元素的存在形式有游离态和化合态两种、A项中的四种微粒是氢元素的四种不同粒子、 H和 H是质子数均为1、中子数不等的不同的氢原子、它们是不同的核素;12C和14C由于其质子数均为6、而中子数分别为6和8、故它们互为同位素、同理、 Ca和 Ca互为同位素、其物理性质不同但化学性质几乎完全相同;金刚石与石墨是由碳元素组成的不同的单质、它们互为同素异形体。
2020化学新人教必修:核素含解析
编 辑:__________________
时 间:__________________
第3课时 核 素
学习目标
核心素养建构
1.了解质量数的定义。
2.了解原子的表示方法。
3.了解核素和同位素的概念。
4.能识别不同概念间的相互关系。
[知 识 梳 理]
一、原子构成、质量数
答案D
2.有六种微粒、它们分别是 M、 N、 X、 Q+、 Y2+、 Z-、它们所属元素的种类为( )
A.3种 B.4种 C.5种D.6种
高一化学元素周期表

同一元素的
1个126C原子的质量
原子中,质 子数和中子
12 = 1.6726×10-27kg
1.993×10-26kg
数是否一定
12
相等呢?
≈1.007
1个中子的质量=1.6749×10-27kg
中子的相对质量=1.008
质子的相对质量取整数与中子的相对
质量取整数相加起来所得的数值叫做原子
质量数。用A表示。
第一节 元素周期表
复习: 1、元素: 具有相同核电荷数(即核内质子
数)的一类原子的总称。
2、原子的构成:
质子 每个质子带1个单位正
原子核
电荷相对质量为1
原子
中子 不带电,相对质量为1
核外电子 每个电子带1个单位负电荷 相对质量为1/1836
核电荷数=质子数=核外电子数,
因此,原子 呈电中性
质子的相对质量= 1个质子的质量
⑤ 天然存在的同位素,相互间保持一定的比率。元素的相对 原子质量,是按照该元素的各种核素原子所占的一定百分比 算出的平均值。
1、作核燃料:作制造核武器的动力性材料(235U) 2、金属探伤:利用γ射线的贯穿本领,可以检查金属内 部有没有沙眼和裂纹。 3、辐射育种:利用放射性同位素的射线对遗传物质产生 影响,提高基因突变频率,从而选育出优良品种。 4、临床治癌:利用放射性同位素的射线杀伤癌细胞或阻 止癌细胞分裂。 5、环保治污:利用放射性同位素的射线可消毒灭菌,杀 死各种病原体从而能保护环境是其少受污染。
2、核素:具有一定数目的质子和一定 数目的中子的一种原子。
3、同位素:质子数相同而中子数不同的 同一种元素的不同原子互称为同位素。 即:同一元素的不同核素之间互称为同位素
(1) Z同,N不同 (2)不同的原子
第14讲原子结构核外电子排布-2024-2025学年高考化学一轮复习课件

题组二 “三素”“两同”概念辨析 4.(2022 浙江 1 月选考)下列说法不正确的是( D ) A.32S 和 34S 互为同位素 B.C70 和纳米碳管互为同素异形体 C.CH2ClCH2Cl 和 CH3CHCl2 互为同分异构体 D.C3H6 和 C4H8 一定互为同系物
[解析] 32S 和 34S 是质子数相同、中子数不同的原子,互为同位素,故 A 正确;C70 和纳米碳管是由碳元素组成的不同单质,互为同素异形体,故 B 正确;CH2ClCH2Cl 和 CH3CHCl2 的分子式相同、结构不同,互为同分异构体,故 C 正确;C3H6 和 C4H8 可能为 烯烃或环烷烃,所以不一定是同系物,故 D 错误。
3.(2023 郑州模拟)现有下列几组粒子:①N2、CO、C2H2;②NH+4 、H3O+、OH -;③C22-、O22+、CN-;④PO34-、SO24-、ClO-4 。对上述四组粒子归类正确的是( D )
A.质子数相等、电子数和原子数不相等:① B.质子数和电子数相等、原子数不相等:② C.电子数相等、质子数和原子数不相等:③ D.原子数和电子数相等、质子数不相等:④ [解析] ①N2、CO、C2H2 的质子数和电子数都等于 14,原子数不相等;②NH+4 、 H3O+、OH-的原子数和质子数不相等,电子数都为 10;③C22-、O22+、CN-的原子数和 电子数都相等,质子数不相等;④P、S、Cl 所含的电子数分别为 15、16、17,酸根离 子中所含氧原子数均相等,所带负电荷数依次为 3、2、1,三种酸根离子所含的总电子 数相等(18+32)、原子数都为 5,但三种酸根离子的质子数不相等。
(2)原子轨道:量子力学把电子在原子核外的一个 空间运动状态 称为一个原子轨
道。
能级符号
沪教版化学高一上1 2《原子结构和相对原子质量》课件
Download prompt: This PPT courseware has been carefully prepared by our store. We hope that after downloading, it can help everyone solve practical problems. After downloading the PPT courseware, it can be customized and modified. Please adjust and use it according to actual needs. Thank you!
2、同位素:把质子数相同,中子数不同的同一类元 素中的不同原子互称为同位素。
思考
决定原子种上同一种元素中的不 同原子,你发现了什么?
3、放射性同位素的应用
探测金属 缺陷
放疗
研究化学 反应机理
放射性 同位素
育种
保存 食物
已知:
原子
质量(g)
氢
氧
碳
1.674×10-24 2.656×10-23 1.933×10-23
A
课堂例题
2、已知10B和11B的近似相对原子质量 为10.8,求其元素中各同位素的丰度。
课堂例题
❖ 3、由23Na跟35Cl和37Cl所生成的10g 氯化钠中含有37Cl的质量是 ________ (已知氯的平均相对原子质量为35.5)
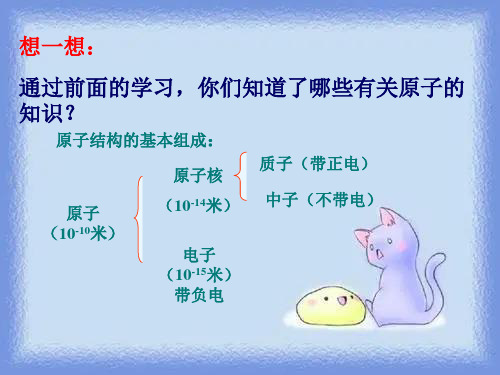
想一想:
通过前面的学习,你们知道了哪些有关原子的
知识?
Che_Les1原子结构和元素周期表

三、例题精讲
[分析与解答]
(A)的反例是H,原子核里没有中子 ; (B)的反例在第二周期,如:B 1s2 2s2 2p1; (C)正确。第3层可以容纳18个电子,但作为最 外层最多只容纳8个 ; (D)如“微粒”种类是离子,该命题错误。 答案: C。
[例2](上海01-2)
美国科学家将两种元素铅和氪的原子核对撞, 获得了一种质子数为118、中子数为175的超重元 素,该元素原子核内的中子数与核外电子数之差 是( ) (A) 57 (B) 47 (C) 61 (D) 293
[例8](05-23A)[分析与解答]
(1)金属元素与非金属元素的分界线在第ⅢA族~第ⅦA族中(答案如图)
Na
Cl
(2)在周期表中,最高正价与最低负价的绝对值相等的为ⅣA族。 (3)①3p亚层上有5个电子的是Cl元素,焰色反应呈黄色的是Na 元素,位置如图(答案)。 ②由于Cl元素与S元素在同一周期,氯元素在右,故氯元素 的非金属性较强,以下反应可验证: H2S + Cl2 →2HCl + S ↓(答案)。
各种同位素的 相对原子质量 与该元素各种 同位素丰度乘 积的加权平均 同位素的近似 相对原子质量
4、核外电子运动状态
核外电子运动的特征: 质量小、运动快、空间小,无法用牛顿力学加以描述。 电子云: 用小黑点的疏密表示电子在核外某空间出现可能性大 小的形象化图形。 核外电子运动状态: 电子层、电子亚层、电子云伸展方向和电子自旋。 电子运动能量: 由电子层、电子亚层决定。 原子轨道: 由电子层、电子亚层、电子云伸展方向决定。 原子轨道能量:1s < 2s < 2p < 3s < 3p < 4s
原子质量的 主体部分。
(必考题)初中化学九年级上册第三单元《物质构成的奥秘》测试(含答案解析)

一、选择题1.(0分)[ID:131853]关于氧气、过氧化氢、二氧化碳中的每个分子中都含有A.2个氧原子B.1个氧分子C.氧元素D.氧气2.(0分)[ID:131844]以下微观解释不正确的是()A.教室进行消杀后室内充满消毒液气味,说明分子在不断运动B.等质量的氧气和液氧,氧气体积比液氧大,说明分子间隔发生了变化C.氮气和氧气的化学性质不同,是因为构成这两种物质的分子不同D.和两种原子最外层电子数相同,所以它们具有相似的化学性质3.(0分)[ID:131829]建立宏观与微观的联系是化学独特的思维方式。
下列解释中错误的是A.花香四溢—一分子在不断地运动B.水蒸发属于物理变化一—分子种类没有改变C.氧化汞分解成汞和氧气一一化学变化中分子可以再分D.气体可压缩储于钢瓶中,所占体积明显变小一—分子数目变少4.(0分)[ID:131826]下列有关微观粒子的说法正确的是A.氯化钠是由氯化钠分子构成的B.分子可以分成原子而原子不能再分C.原子是由原子核和核外电子构成的D.分子是保持物质性质的最小粒子5.(0分)[ID:131815]用分子的知识解释下列现象,其中合理的是A.水银温度计测体温的原理,是因为温度升高,分子的间隔增大B.变瘪了的乒乓球放在热水中鼓起,是由于分子的体积变大C.加入糖的水变甜,是由于分子永不停息的做无规则运动D.1L大豆与1L水混合后总体积小于2L,是由于分子间有间隙6.(0分)[ID:131807]下列说法不正确的是A.燃烧、动植物的呼吸、金属锈蚀都是氧化反应B.硫在氧气中燃烧,集气瓶底要放少量的水,并在通风橱内进行C.发现元素周期律并编制元素周期表的化学家为道尔顿D.氮气的化学性质不活泼,食品包装中充氮气可以防腐7.(0分)[ID:131806]下列有关分子、原子和离子的说法正确的是A.分子是保持物质性质的一种粒子B.物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变C.分子、原子、离子都可以直接构成物质D.在化学反应中,任何粒子都不能再分8.(0分)[ID:131794]推理是学习化学的一种重要方法,下列推理合理的是()A.离子是带电荷的粒子,则带电荷的粒子一定是离子B.单质是由同种元素组成的,但只含一种元素的不一定是单质C.同种元素的粒子具有相同的质子数,所以具有相同质子数的粒子一定属于同一种元素D.催化剂在化学变化前后质量不变,则在化学变化前后质量不变的一定是催化剂9.(0分)[ID:131781]事物的宏观表象是由其微观性质决定的。
第1节原子结构带答案

物质结构 元素周期律 第一节原子结构一、原子结构、核素 1.原子的构成 (1)原子的微粒构成(2)原子构成的表示2.原子结构中的微粒关系 (1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数3.同位素 核素 (1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用※基础小题1.判断正误(正确的打“√”,错误的打“×”)。
(1)所有的原子中都含有质子和中子(×) (2)34S 原子核内中子数为16(×) (3)2H +核外电子数为2 (×)(4)13C 和15N 核内中子数相差1(√)(5)H 3O +和OH -中具有相同的质子数和电子数(×)(6)1H 182O 的摩尔质量为20 g·mol -1(√)(7)质量数就是元素的相对原子质量(×) (8)质子数相同的粒子一定属于同一种元素(×)(9)一种单质中可能含有多种核素,如O 2中含16O 、17O 、18O 三种核素(√)(10)11H +、21H +和31H +互称同位素(×)2.(1)在6Li 、7Li 、23Na 、24Mg 、14C 、14N 六种粒子中,包含___5___种元素,___6_____种核素,其中互为同位素的是____6Li 与7Li____,中子数相等的核素是_____23Na 与24Mg_____。
(2)D 3O +中的质子数为____11____,电子数为___10_____,中子数为____11____。
※常考题例1.下列说法正确的是( ) BA .235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变 9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10N AB .3517Cl 与3717Cl 得电子能力相同C .中子数为146、质子数为92 的铀(U)原子:146 92UD .235 92U 和238 92U 是中子数不同,质子数相同的同种核素例2.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。
2021版《三维设计》高考化学(人教版)复习教师用书:第五章 物质结构元素周期律 Word版含答案

第五章 物质结构 元素周期律考点一| 原子结构、核素(基础送分型——自主学习)[记牢主干学问]1.原子的构成 (1)原子的微粒构成(2)原子构成的表示2.原子结构中的微粒关系 (1)原子(2)离子的核外电子数核外电子数⎩⎪⎨⎪⎧阳离子:质子数-电荷数阴离子:质子数+电荷数3.同位素 核素 (1)概念辨析(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②自然 存在的同一元素各核素所占的原子百分数一般不变。
(3)常见的重要核素及其应用核素 235 92U14 6C 21H 31H 18 8O 用途核燃料 用于考古断代 制氢弹示踪原子[一、基础学问全面练1.推断正误(正确的打“√”,错误的打“×”)。
(1)全部的原子中都含有质子和中子(×) (2)34S 原子核内中子数为16(×)(3)2H +核外电子数为2 (×) (4)13C 和15N 核内中子数相差1(√)(5)H 3O +和OH -中具有相同的质子数和电子数(×) (6)1H 182O 的摩尔质量为20 g·mol -1(√) (7)质量数就是元素的相对原子质量(×) (8)质子数相同的粒子肯定属于同一种元素(×)(9)一种单质中可能含有多种核素,如O 2中含16O 、17O 、18O 三种核素(√)(10)11H +、21H +和31H +互称同位素(×)2.(1)在6Li 、7Li 、23Na 、24Mg 、14C 、14N 六种粒子中,包含______种元素,________种核素,其中互为同位素的是________,中子数相等的核素是__________。
(2)D 3O +中的质子数为________,电子数为________,中子数为________。
答案:(1)5 6 6Li 与7Li 23Na与24Mg(2)11 10 11 二、常考题点分组练题点(一) 原子的表示方法及各微粒数目之间的关系1.下列说法正确的是( )A .(2021·全国卷Ⅱ)235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10N AB .(2022·山东高考)3517Cl 与3717Cl 得电子力量相同C .(2021·江苏高考)中子数为146、质子数为92 的铀(U)原子:146 92UD .(2022·天津高考)235 92U 和238 92U 是中子数不同,质子数相同的同种核素解析:选B 核素235 92U 发生裂变反应,235 92U +10n ――→裂变9038Sr +136 54Xe +1010n ,净产生的中子(10n)数为10-1=9,235 g 核素235 92U 的物质的量为1 mol ,则发生裂变时净产生的中子数为9N A ;C 项中表示铀原子为238 92U ,错误;D项中235 92U和238 92U是不同核素,D 错误。
高一化学人教版2019必修第一册 4.1原子结构与元素 周期表(知识点)

第四章物质结构元素周期律第一节原子结构与元素周期表1.认识原子的构成,了解原子核外电子排布规律,能画出1~20号元素的原子结构示意图。
2.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导。
3.了解元素周期表的发展历程及现行元素周期表的结构。
4.知道元素、核素、同位素、A Z X的含义,并能比较它们的不同。
5.知道碱金属元素、卤族元素的结构和性质,能从原子结构角度解释同主族元素性质的递变规律。
6.能设计实验方案,探究同主族元素性质的递变性7.巩固原子的构成,加深对核素、同位素概念的理解,熟练掌握核电荷数、质子数、中子数、质量数之间的关系。
8.熟练掌握元素周期表的结构,能用原子结构理论解释同族元素性质的相似性和递变性。
知识点一原子的构成知识点二原子核外电子排布知识点三元素周期表的编排原则与结构知识点一原子的构成1.构成原子的微粒及其性质2.质量数(1)概念:将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数,常用A 表示。
(2)构成原子的粒子间的两个关系①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核电荷数=核外电子数。
3.元素(1)概念:具有相同质子数(核电荷数)的一类原子的总称。
(2)决定元素种类的是质子数。
4.核素(1)概念:具有一定数目质子和一定数目中子的一种原子。
表示方法:A Z X。
(2)实例原子符号(A Z X)原子名称氢元素的原子核质子数(Z)中子数(N)11H氕1021H或D氘1131H或T氚125.同位素(1)概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。
“同位”是指核素的质子数相同,在元素周期表中占有相同的位置。
例如:氢元素有11H、21H、31H三种核素;碳元素有126C、136C、146C等核素;氧元素有168O、178O和188O三种核素;铀元素有23492U、23592U、23892U等核素。
高一【化学(人教版)】原子结构与元素周期表(第一课时)-课件

任务四 发现并应用原子核外电子排布的规律 1. 当K层为最外层时,最多能容纳的电子数是多少?
除了K层,其他各层为最外层时,最多能容纳的 电子数是多少? 2. 次外层最多容纳的电子数是多少?
3. 你能归纳出第n层最多能容纳的电子数吗?
高中化学
高中化学
任务四 发现并应用原子核外电子排布的规律
核电 荷数
为同位素(即同一元素的不同核素互称为同位素)。
高中化学
同位素
• 氧元素有168O 、178O和188O三种核素; • 碳元素有126C 、136C和146C等核素; • 铀元素有23942U 、 23952U和23982U等核素。 • 用途:在能源、农业、医疗、考古等方面都有重
要应用。
二、原子的核外电子排布
23
12
11
37
20
17
高中化学
如果是离子,各微观粒子数如何变化?
粒子 符号
2131Na+ 3177Cl-
质子数
(Z)
11 17
质量数
(A)
23 37
中子数
(N)
12 20
电荷数
1 1
核外 电子数
10 18
阳离子:核外电子数=质子数-电荷数 阴离子:核外电子数=质子数+电荷数
高中化学
任务三
氢元素的原子核
元素 名称
氦 氖 氩 氪 氙 氡
元素 符号
He Ne Ar Kr Xe Rn
各电子层的电子数
KLMNOP 2 28 288 2 8 18 8 2 8 18 18 8 2 8 18 32 18 8
高中化学
任务四 发现并应用原子核外电子排布的规律
核电 荷数
医用化学-第3章-1.1原子结构

二、同位素
如氯
3517Cl 3717Cl
请用AZX表示下列原子
质子数 中子数 质量数
1
0
1
1
1
2
1
2
3
AZX
H 1
1
H 2
1
H 3
1
学名
氕
俗称
氘 重氢
氚 超重氢
试比较三种原子的核内粒子数的异同。
质子数相同
属同种元素
中子数不同,质量数不同
不同种原子
核素:具有一定质子数和一定中子数的一种原子(某一具体的原子) 同位素:质子数相同而中子数不同的核素互称为同位素。
练习:
1.
11H
2 1
H
3 1
H
H+、H2 是 (D )
A 氢的五种同位素 B. 五种氢元素 C 氢的五种同素异形体 D. 氢元素的五种不同微粒
练习:
2.氯的原子序数为17,35Cl是氯的一种同位素,下
列说法正确的是
BD
A.35Cl原子所含质子数为18
B.1/18mol的1H35Cl分子所含中子数约为6.02×1023
126C 136C
146C
1个氧原子的质量是2.657×10-26kg, 1个铁原子的质量是
9.288×10-26kg,这些数字很小,书写和计算都很不方便
已知:1个C-12原子的质量是1.9932×10-26kg,
C-12原子质量的1/12是1.661×10-27kg
原子的相对质量=
原子的真实质量
原子 AZ(X)
中子: N ,(A -Z)个(不显电性)
核外电子(e-):Z个(带有Z个单位负电荷
质量数(A) = 质子数 (Z)+ 中)子数(N)
原子的构成及其微粒间的数量关系

7 23 24 1.(RJ 必修 2· P115 改编)有以下六种原子:6 Li 、 Li 、 Na 、 3 3 11 12Mg、 14 14 C 、 6 7N,下列相关说法不正确的是(
)
7 A.6 3Li 和3Li 在元素周期表中所处的位置相同
B.
14 6C
和147N 质量数相等,二者互为同位素
[题组精练· 提考能]
题组一 原子的构成
3 1.据科学家预测,月球的土壤中蕴含着数百万吨的3 2He,每百吨2He
核聚变所释放出的能量相当于目前人类一年消耗的总能量。 在地 球上氦元素主要以4 2He 的形式存在。下列说法正确的是 ( A.4 2He 原子核内含有 4 个质子 B.3 2He 原子核内含有 3 个中子
)
解析
质量数是对核素而言的,A 错误;60 26Fe 的核内质子数(26)
60 58 比中子数(34)少 8,B 错误;只有当26 Fe 与26 Fe 均为 1 mol 时,前
者的质量才比后者的多 2 g,D 错误。
答案
C
【易错警示】
规避4个易失分点 (1)任何微粒中,质量数=质子数+中子数,但质子数与电子数 不一定相等,如阴、阳离子中; (2)有质子的微粒不一定有中子,如1H,有质子的微粒不一定有
) 质子数不同 239 (2)238 Pu 与 ) 研究对象为单质 94 94 Pu 互为同素异形体(
238 (3)238 Pu 与 94 92 U 具有完全相同的化学性质( 239 (4)238 Pu 与 94 94 Pu 具有相同的最外层电子数(
) )
质子数不同,是不同的原子,化学性质不同。
考题探源 源于教材RJ必修2 P9“核素”及其拓展 考查视角 核素、同位素、同素异形体等概念 高考启示 要对比分析并掌握核素、同位素、同素异形体的异同
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)说明:原子内部存在着带正电的组成部分 ,
α
粒子受到斥力而改变了原有的运动路径 (3)说明:原子内部存在着的带正电部分是实心的 , 且所占空间很小。
得出结论
1、 原子的构成
原 子 核
质子: 一个质子带一个单位 的正电荷 中子:中子不带电
原 子
电子:一个电子带一个单位的负电荷
根据a粒子散射实验,卢瑟福提 出了带核的原子结构模型,原子由原 子核和电子构成,电子在核周围做高 速运动,就像行星围绕太阳运转一样。
设计实验:1911年,英国科学家卢瑟福用一 束平行高速运动的α粒子轰击金箔。 观察现象: (1)大多数α粒子不改变原有的运动方向。 (2)有一小部分α粒子改变了原有的运动路径。 (3)极少数的α粒子被反弹回来。
课题1 原子的构成
信息:1897年,在英国科学家汤姆生发现了电子。
提出问题:原子内部具有怎样的结构 猜想假设:请以“我想像中的原子”为题,提 出 你的想法。
1803年,英国科学家道尔顿提出近代原子学说, 他认为原子是化学变化中不可再分的实心球体。
汤姆生认为原子是一个平均分布着
正电荷的粒子,其中镶嵌着许多 电子,中和了电荷,从而形成了 中性原子。
现代原子结构学说
电 子 云
原子结构模型的演变
道尔顿原子模型(1803年): 原子是实心球
“葡萄干面包式”原子结构模型 汤姆生原子模型(1897年): 卢瑟福原子模型(1911年):带核的原子结构模型 波尔原子模型(1913年): 分层模型 现代原子模型: 电子云模型
试一试:
1 .在 原 子 的 组 成 中, 质子 带 正 电, 电 子 带 负 电, 中 子 不 带 电, 电 子 绕 着 原 子 核 做 高 速 运 动。 电 子 占 据 原 子 的 绝 大 部 分 体 积, 原 子 核 集 中原 子 的 主 要 质 量 。
原子的质量主要集中在原子的原子核上
M(质子)×质子数+M(中子)×中子数 相 对 原 子 质 量=
ቤተ መጻሕፍቲ ባይዱ
一种碳原子真实质量×1/12
=
1.6726 ×10- 27 kg ×质子数+1.6748 ×10- 27 kg ×中子数 1.66×10- 27 kg
= 质子数+中子数
通过本节课的学习,你有哪些收获和体会?
2 .下列关于原子的叙述正确的是 ( ) ①一切原子都是由质子、中子和电子构成的 ②原子在不停地运动 ③原子是化学变化中的最小粒子 ④原子由原子核和核外电子构成 ⑤原子中不存在电荷.因而原子不带电 A.②③④ B.①②④ C.①③⑤ D.①②③④⑤
二、原子的质量
1、原 子 的 实 际 质 量
一 个 碳 原 子 的 质 量:
(2).同种原子的质量和性质是否一定相同?
2 .经测定某原子中共有40个粒子,其中14个粒子不显电性,则 它的相对原子质量为 ( ) A.40 B.54 C.26 D.27
3.英国科学家道尔顿(J.Dolton)于19世纪初提出
了近代原子学说。他认为物质是由原子构成的,这 些原子是微小不可分割的实心球体,同种原子的性 质和质量都相同。请你指出道尔顿原子学说中现代 科学实验证明的事实不相符的地方: ( 1) ; ( 2) ; ( 3) 。
练一练:
1.据中央电视台2001年6月3日对云南抚仙湖湖底古城考古的现 场报道,科学家曾通过对古生物遗骸中的碳-14含量来推断古城 的年代。碳-14原子的核电荷数为6,相对原子质量为14。下列关 于碳-14原子的说法中,错误的是( ) A.中子数为6 B.质子数为6 C.电子数为6 D.质子数和中子数之和为14 思考:(1).碳-12与碳-14 原子有哪些不同之处?
原子核所带的电荷数简称为核电荷数
原子是否显电性?为什么?
原子核
原子
构成原子的粒子的电性和质量
粒子种类 质子 中子 电性 质量
1个单位正电荷 1.6726×10-27 kg 不带电 1.6749×10-27 kg
电子
1个单位负电荷 质子质量1/1836
电子质量很小,可忽略不计。原子的质量主要 集中在原子原子核上,是所有质子和所有中子 的质量总和。
2、以碳原子为例描述原子的构成
已知一种碳原子的构成粒子是6个质子,6个 中子和6个电子。请描述原子的构成情况。 其中6个质子和6个中子构成了原子核作
为原子的中心,而6个电子在核外一定
空间内绕核做高速运动。
1913年,丹麦物理学家玻尔提出的原子结构模型, 他认为核外电子是分层排布的。
丹麦物理学家玻尔
(2)计算公式
一个原子的实际质量
相 对 原 子 质 量=
1.66×10-27 kg
练习题
氢原子的质量= 1.6726×10- 27 kg 氢原子的相对原子质量 = 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1
碳12的十二分 之一的质量
已知氧原子的质量是2.657×10- 26 kg,氮原子的质量 是2.325×10- 26 kg,铁原子的质量是9.288×10- 26 kg, 求它们的相对原子质量 ? 16 14 56 12 求一求碳原子的相对原子质量?
这样小的数字,书写、记忆和使用起来 都很不方便,就像用吨做单位来表示一粒稻 谷或小麦的质量一样,能不能用一种好写、 好记、好用的方法来表示原子的质量呢?
原子的质量非常小,使用起来很 繁琐,不方便,一般不采用。为方便 使用确定了原子的相对质量──相对 原子质量 (Ar)
2、 相 对 原 子 质 量
(1)定 义: 国 际 上 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。
碳12:是含有6个质子和6个中子的碳原子, 质量是1.993×10-26 kg,它的质量的1/12等于 1.66×10-27 kg
从下表中你能总结出什么规律?
原子的种类 氢 碳 氧 原 子 核 质子数 中子数 1 0 6 8 6 8 核外电子数 1 6 8
钠
铁
11
26
12
30
11
26
原子构成中的规律:
⑴、质子数 = 核外电子数
⑵、质子数不一定等于中子数
⑶、原子中不一定含有中子
(4)、构成原子的必要粒子是质子、电子,
决定原子种类的是核内质子数
1.993×10-2
6
kg
0.000000000000 00000000001993 kg
•
不同原子的质量各不相同,可以用 现代科学仪器精确地测量出来。如:
• 一个氢原子的质量是:1.67×10-27㎏, • 一个氧原子的质量是:2.657×10-26㎏, • 一个铁原子的质量是:9.288×10-26㎏。
