高一化学课件氧化还原反应
合集下载
人教版高一化学课件-氧化还原反应(共18张PPT)

一、氧化還原反應
化合價變化本質原因的分析:以NaCl為例
Na
+11
Na+
+11
+17
Cl
化合價升高,失去電子
2Na + Cl2 == 2NaCl
化合價降低,得到電子
+17
Cl-
Na+ Cl-
化合價的升降——電子的得失
一、氧化還原反應
化以合HC價l為變例化本質原因的分析:H0 2
+
0
Cl2
=
+1-1
非氧化還原反應
置換反應
化合反應化學反應分解反應 氧化還原反應
複分解反應
一、氧化還原反應
分層訓練1:必做題
1、下列反應屬於氧化還原反應的是( BC )
A. CuO+2HCl=CuCl2+H2O B. 2Na2O2+2H2O=4NaOH+O2↑ C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3↓ + H2O
化合
CaO + H2O === Ca(OH) 2 反應
高溫
CaCO3===CaO+CO2 ↑
分解反應
2KClO3==△=2KCl+3O2 ↑
Fe+CuSO4 == Cu+FeSO4 置換反應
NaOH+HCl==NaCl+H2O 複分解反應
一、氧化還原反應
結論3:氧化還原反應與四種基本反應類型 的關係
屬於哪種基本反應類型?
讓我 想一想?
一、氧化還原反應
思考與交流1:
1.請舉幾個氧化反應和還原反應的實例,指 出這類化學反應的分類標準是什麼?
高一化学氧化还原反应优秀课件 PPT

还原剂 KClO3 氧化产物 O2
氧化剂 KClO3 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物质是还 原剂以及氧化产物、还原产物。
(9) 4NH3 + 5O2 == 4NO + 6H2O
还原剂 NH3 氧化产物 NO
氧化剂 O2 还原产物 H2O NO
(10) 5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O
+1 -1
△ 2HCl
还原剂 氧化剂 既是氧化产物又是还原产物
化合价降低,被还原
H H +1
+17
Cl
电是 子还 偏原 离剂
电是 子氧 偏化 向剂
+1
+17
HCl
氯化氢形成示意图
氯化氢分子的形成过程:
氧化还原反应中,电子转移(得失或偏移)和化 合价升降关系,可以表示如下:
被氧化、失去e-,化合价升高 -4 –3 –2 –1 0 +1 +2 +3 +4 +5 +6 +7
小结
电子得失角度:
有电子转移的反应是氧化还原反应; 物质失去电子的反应就是氧化反应; 物质得到电子的反应就是还原反应。
化合价升降角度:
有元素化合价升降的反应是氧化还原反应; 物质所含元素化合价升高的反应就是氧化反应; 物质所含元素化合价降低的反应就是还原反应。
氧化剂、还原剂;氧化产物、还原产物概念:
失去氧,被还原
CuO + H2 △ Cu + H2O
氧化剂 还原剂
还原产物 氧化产物
得到氧,被氧化
CuO + H2 △ Cu + H2O
高一化学《氧化还原反应》PPT课件

化学反应有哪几种分类方法? 化学反应有哪几种分类方法? 它们之间有何关系? 它们之间有何关系? 布置作业
P.33
1(用双线桥表示) (用双线桥表示) 2 、3、4 、
教学目标 1、能从不同的角度认识氧化还原 、 反应; 反应; 2、学会用化合价升降来判断氧化 、 还原反应; 还原反应; 3、学会用双线桥表示氧化还原反 、 应。 难点: 难点:氧化还原反应的表示方法
1、你知道“天火”是怎样产生的吗? 、你知道“天火”是怎样产生的吗? 2、补充维生素为何能延缓皮肤老化? 、补充维生素为何能延缓皮肤老化? 都因为发生了氧化还原反应。 都因为发生了氧化还原反应。 什么是氧化还原反应 氧化还原反应呢 什么是氧化还原反应呢? △ 凡是有得氧 凡是有得氧 实验: 实验:CO+CuO=Cu+CO2 失氧的反应 失氧的反应 氧化还原反应的概念: 一、氧化还原反应的概念: 叫氧化还原 反应。 反应。 1、从得氧失氧角度分析:
来 自 反 应 物
2Na + Cl2 == 2NaCl 氢气能和氯气反应: 氢气能和氯气反应: 反应
0 0 得到电子,化合价降低 被还原 得到电子 化合价降低,被还原 化合价降低
Hale Waihona Puke +1 -1电子对远离,化合价升高 被氧化 电子对远离 化合价升高,被氧化 化合价升高
H2 + Cl2 == 2HCl
电子对靠近,化合价降低 被还原 电子对靠近 化合价降低,被还原 化合价降低
得氧,被氧化 氧化反应 得氧,被氧化,氧化反应
加热
CuO + CO == Cu + CO2
失氧,被还原 还原反应 失氧,被还原,还原反应
同时 发生
是不是所有的化学反应都有氧参加? 是不是所有的化学反应都有氧参加? 有氧参加的反应一定是氧化还原反应, 有氧参加的反应一定是氧化还原反应,而没有 氧参加的反应一定不是氧化还原反应呢? 氧参加的反应一定不是氧化还原反应呢?
高一化学必修1_氧化还原反应PPT课件

(本质)
(特征)
4.电子转移及氧化还原关系的表示方法 ---单线桥和双线桥
⑴用双线桥表示电子转移的结果和氧化还原反应的各种关系
失去 2×e-,化合价升高,被氧化
+2 –1 0 +3 -1
+4
化合价升高,被氧化,失 2×e-
2FeCl2 + Cl2 == 2FeCl3
得到 2×e-,化合价降低,被还原
2FeS+6H2SO4(浓)==Fe2(SO4)3+3SO2 +2S+6H2O
(1)氧化剂是H2SO4。(2)还原剂是FeS。
(3)氧化产物是Fe2(SO4)3和S。
(4)还原产物是SO2。
(5)被氧化的元素是Fe元素和S元素
(6)被还原的元素是H2SO4中的S元素。
(7)氧化过程是FeS →Fe2(SO4)3+S。
③ SO2 + 2H2S == 2H2O + 3S
④ 3Cl2 + 8NH3 == 6NH4Cl + N2 ⑤ Cl2 + 2NaOH = NaClO + NaCl + H2O ⑥ S + 2KNO3 + 3C = K2S + N2↑ + CO2↑
练习6.分别用双线桥和单线桥法标出氧化还原反 应电子转移的方向和数目 1.2Na2O2+2H2O=4NaOH+O2↑ 2.2Al+3H2SO4=Al2(SO4)3+3H2↑
同种元素相邻价态之间不发生氧化还原反应。
练习:用双线桥标出下列氧化还原反应的电子转移方 向和数目。 ⑴ KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O ⑵ H2S + H2SO4 = S + SO2↑ + 2H2O ⑶ 2Na2O2+2H2O=4NaOH+O2↑
氧化还原反应课件第1课时课件
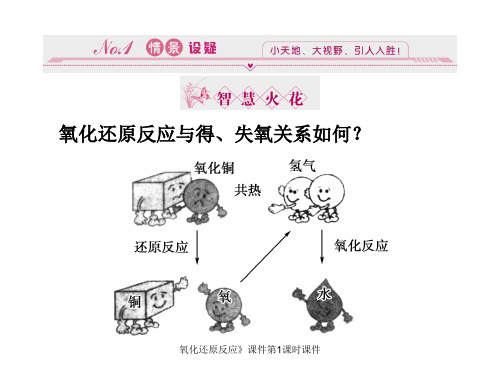
氧化还原反应》课件第1课时课件
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
氧化还原反应高一化学课件

(2)计算方法 ①找出氧化剂、还原剂及相应的还原产物和氧化产 物。 ②找准一个原子或离子得失电子数。(注意化学式 中粒子的个数) ③根据题中物质的物质的量和得失电子守恒列出等 式。 n(氧化剂)×变价原子个数×化合价变化值(高价-低 价)=n(还原剂)×变价原子个数×化合价变化值(高 价-低价)。
4.价态规律 (1)高低规律:最高价态只有氧化性,最低价态只有还 原性,中间价态既有氧化性又有还原性。 应用:判断元素或物质的氧化性、还原性。 (2)价态归中规律:同种元素不同价态的原子之间发生 氧化还原反应时,高价态+低价态―→中间价态;即 “只靠拢,不交叉”。 应用:判断元素在生成物中的价态。
性,中间价态既有氧化性又有还原性。
如:Fe只有还原性、Fe2+既有氧化性又有还原性、
Fe3+只有氧化性
2、同种物质,浓度越大,氧化性(或还原性)越强。
如:氧化性:浓H2SO4 > 稀H2SO4
3、反应条件越简单,氧化性(还原性)越强。
如:氧化性:KMnO4 > KClO3
(制氧气)
❖ 2.在Fe2+、Fe3+、Mg2+、S、 I-、H+中只有氧化性的是
1.下列变化过程中一定需要另加还原、 HNO3→NO D、 FeCl3→FeCl2
答案:C、D
2.下列变化需加入氧化剂的是( )
A、Zn→Zn2+ C、Fe2O3→Fe
B、CO2→CO D、CO→CO2
答案:A、D
氧化性还原性强弱的比较
1、金属活动性: 还原性:
常见还原剂:
(1)活泼的金属单质 K、Na、Li 、Ca 、 Mg 、 Fe 、 Zn 等
(2)某些非金属单质 C、H2 (3)元素处于低价态物质 CO、HI、HBr 、H2S 、SO2 、NH3及亚硫酸盐、 HCl、 FeCl2等
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
1.3氧化还原反应 课件(共19张PPT)高一上学期化学人教版(2019)必修第一册

2.元素化合价的升降
一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
0
+1
-1
- e-
+ e-
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,被氧化
得到2xe- ,化合价降低,被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
0
0
+1
-1
电子对偏离化合价升高,被氧化
电子对偏向化合价降低,被还原
+1
1
+17
2
8
7
你的电子借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )A.Cl2+2KOH=KCl+KClO+H2O B.3NO2+H2O=2HNO3+NOC.Na2O2+SO2=Na2SO4D.2NaHCO3 Na2CO3+CO2↑+H2O
一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
0
+1
-1
- e-
+ e-
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,被氧化
得到2xe- ,化合价降低,被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
0
0
+1
-1
电子对偏离化合价升高,被氧化
电子对偏向化合价降低,被还原
+1
1
+17
2
8
7
你的电子借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )A.Cl2+2KOH=KCl+KClO+H2O B.3NO2+H2O=2HNO3+NOC.Na2O2+SO2=Na2SO4D.2NaHCO3 Na2CO3+CO2↑+H2O
《氧化还原反应》PPT课件

4.氧化还原反应的特征和本质: (1)特征和本质
(2)两者关系
元素原子 被_氧__化__
元素原子 还原 _____
元素化合价_升__高__
物质
降低 元素化合价_____
物质被
二、氧化还原反应与四种基本反应类型的关系 1.图示关系
2.文字表述
(1)置换反应_一__定__是氧化还原反应。(填“一定”“不
(Fe2O3),由于三氧化二铁是红色,所以得到的就是红砖 瓦。待砖坯烧透后,从窑顶向下不断淋水,当水遇到红 热砖瓦变成水蒸气后,碳与水蒸气反应生成氢气和一氧 化碳。这些还原性气体能把砖瓦中红色的氧化铁还原 成黑色氧化亚铁或四氧化三铁。红砖、青砖烧制过程 中涉及哪些化学反应,是否是氧化还原反应?
提示:涉及二价铁被氧气氧化成Fe2O3、碳与水生成CO和 H2、CO和H2把Fe2O3还原成黑色FeO或Fe3O4三个反应,且 都是氧化还原反应。
古诗词是古人为我们留下的宝贵精神财富,思考下列诗 句是否都涉及氧化还原反应。 ①野火烧不尽,春风吹又生 ②粉身碎骨浑不怕,要留清白在人间 ③春蚕到死丝方尽,蜡炬成灰泪始干 ④爆竹声中一岁除,春风送暖入屠苏
提示:②不涉及。“粉身碎骨浑不怕,要留清白在人间” 实质是碳酸钙的分解和氧化钙与水的反应,都没有元素 化合价的变化,不属于氧化还原反应。
【规律方法】判断元素化合价的常用方法 (1)熟记常见元素的化合价 钠钾氢银正一价,钙镁锌钡正二价。 氟氯溴碘负一价,通常氧是负二价。 铜正一二铝正三,铁有正二和正三 。 碳有正二和正四,硫有负二、正四和正六。
(2)计算:依据化合物中元素的正负化合价的代数和为 零进行计算。步骤: ①标出熟悉元素的化合价。 ②根据化合物中正、负化合价的代数和为零的原则求 解其他元素的化合价。
高一化学必修1氧化还原反应PPT课件PPT(32页)

高一化学必修1氧化还原反应PPT课件P PT(32 页)
课堂练习
1.下列反应属于氧化还原反应的是
A、
C
+
H2O
高温
===
H2+
CO
B、NH4NO3 =△== N2O ↑+ 2H2O
C、2NaHCO3 =△== Na2CO3 + CO2↑+ H2O
D、3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
高一化学必修1氧化还原反应PPT课件P PT(32 页)
思考 ·交流
4、氧化还原反应是否一定存在得失氧? 请分析下面的反应。
化合价降低 被还原
Zn+2HCl==== ZnCl2+H2 化合价升高 被氧化
化合价降低 被还原 点燃
2Na+Cl2====2NaCl 化合价升高 被氧化
高一化学必修1氧化还原反应PPT课件P PT(32 页)
0
0 点燃 +1 -1
H2 + Cl2 === 2HCl
得电子,化合价降低,被还原
电子对偏向,化合价降低,被还原
电子的转移(得失或偏移)是化合价变化的实质, 也是氧化还原反应发生的实质。
氧化反应:物质失去电子(或电子对偏离)的反应。 还原反应:物质得到电子(或电子对偏向)的反应。
氧化还原反应:有电子转移(得失或偏移)的反应。
[巩固练习]
1 .实现下列变化,一定要加入其它物质作氧化剂
的是:(C)
A.CaCO3 → CO2 C.Zn → ZnCl2
B.NaCl → NaNO3 D.CuO → CuSO4
2.下列反应中,SO2作还原剂的是( C )
认识氧化还原反应-高一化学精品课件

第一章 物质及其变化
第3节 氧化还原反应
第一课时 认识氧化还原反应
学习目标
1.通过分析物质所含元素的化合价,认识氧化还原反应的特征,能够对 常见的化学反应进行分类。 2.认识到氧化还原反应在生产生活中的普遍存在,能够运用氧化还原反 应的有关理论解决有关问题。 3.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧 化剂和还原剂。
哪些是氧化反应?哪些是还原反应?
哪些是氧化产物?哪些是还原产物?
旧知 导入
概念
特征
本质
梳理 巩固
氧化还原反应中有化合价变化的原因?
旧知 导入
概念
电子转移
特征
本质
梳理 巩固
英国物理学家汤姆孙发现了电
子,人们把化合价的升降与原
子最外层电子的得失联系起来,
将原子失去电子(或电子对偏
离)的过程叫做氧化反应,把
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干 C.明月松间照,清泉石上流 D.爆竹声中一岁除,春风送暖入屠苏
旧知 导入
课堂小练
概念
特征
本质
梳理 巩固
4. 下列化学反应中,不属于氧化还原反应的是( A )
A.Na2O+CO2===Na2CO3 B.Fe+CuSO4===Cu+FeSO4 C.Fe2O3+3CO =高==温=2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2O
?为什么
提示:氧化还原反应的特征是有元 素化合价的变化
置换反应
复分解反应
化合 反应
分解反应
旧知 导入
课堂小结
化合价升高 反 应 物
化合价降低
概念
特征
第3节 氧化还原反应
第一课时 认识氧化还原反应
学习目标
1.通过分析物质所含元素的化合价,认识氧化还原反应的特征,能够对 常见的化学反应进行分类。 2.认识到氧化还原反应在生产生活中的普遍存在,能够运用氧化还原反 应的有关理论解决有关问题。 3.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧 化剂和还原剂。
哪些是氧化反应?哪些是还原反应?
哪些是氧化产物?哪些是还原产物?
旧知 导入
概念
特征
本质
梳理 巩固
氧化还原反应中有化合价变化的原因?
旧知 导入
概念
电子转移
特征
本质
梳理 巩固
英国物理学家汤姆孙发现了电
子,人们把化合价的升降与原
子最外层电子的得失联系起来,
将原子失去电子(或电子对偏
离)的过程叫做氧化反应,把
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干 C.明月松间照,清泉石上流 D.爆竹声中一岁除,春风送暖入屠苏
旧知 导入
课堂小练
概念
特征
本质
梳理 巩固
4. 下列化学反应中,不属于氧化还原反应的是( A )
A.Na2O+CO2===Na2CO3 B.Fe+CuSO4===Cu+FeSO4 C.Fe2O3+3CO =高==温=2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2O
?为什么
提示:氧化还原反应的特征是有元 素化合价的变化
置换反应
复分解反应
化合 反应
分解反应
旧知 导入
课堂小结
化合价升高 反 应 物
化合价降低
概念
特征
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对于任何氧化还原反应,都满足下列规律:
强氧化剂 + 强还原剂 = 弱还原剂 + 弱氧化剂 氧化性:氧化剂>氧化产物 还原性: 还原剂>还原产物
常见物质的比较
氧化性: KMnO4>Cl2(O2)>Br2>Fe3+>I2>SO2>S 还原性:Cl—<Br—<Fe2+<I—<SO32— <S2—
例. 根据下列反应判断有关物质还原性由强到弱的顺序是 ( ) C H2SO3 + I2 + H2O = 2HI + H2SO4; 2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2 3FeCl2 + 4HNO3 = 2FeCl3 + NO ↑+ 2 H2O + Fe(NO3)3 A. I- > Fe2+ > H2SO3 > NO B. B. Fe2+ > I- > H2SO3 > NO C. H2SO3 > I- > Fe2+ > NO D. NO > Fe2+ > H2SO3 > I-
+7
0
-1
+5
8 KMnO4 + 15 KI + 17 H2SO4 —8MnSO4+ 5I2+ 5KIO3+ 9 K2SO4+17H2O 5 8 10 30
401
+2 0 +5
-1
配平练习
11 P4+ 60 CuSO4+ 96 H2O — 20Cu3P+ 24 H3PO4+ 60 H2SO4
- -4 13 +5 Fe3C + 22 9 HNO3 — 113 131 3 Fe(NO3)3 + CO2↑+ 13NO2↑+
六、氧化还原反应方程式配平
1、什么是氧化还原反应?氧化还原反应的本质是? 有化合价升降的化学反应叫氧化还原反应 其本质是有电子的得失
2、氧化剂具有 氧化 性,化合价 降低 , 得 电子被 还原 ,生成 还原产物 还原剂具有 还原 性,化合价 升高 , 失 电子被 氧化 ,生成 氧化产物
3、氧化还原反应中化合价变化有什么特征?
的化学反应就是氧化还原反应。
判断化学反应是否属 于氧还反应的依据 氧—还反应中概念的判断依据:
失电子,化合价升高,被氧化
氧化剂
+ 还原剂 ===== 还原产物
得电子,化合价降低,被还原
+
氧化产物
二、氧化还原反应的有关基本概念(共5对):
得到电子的物质; 还原剂: 失去电子的物质; 被氧化: 指化合价升高的元素; 被还原: 指化合价降低的元素;
[例]对于司机酒后驾车,可对其呼出的气体 进行检验而查出,所利用的化学反应如下:
CrO3 + CH3CH2OH + H2SO4 Cr2(SO4)3 + CH3CHO + H2O
(1)配平; (2)被检测的气体成分是 ; (3)其中氧化剂是 ,氧化产物是 ; (4)若生成1molCr3+离子,转移电子数为 。
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O
氧化剂 HNO3 、还原剂 Cu、氧化产物 Cu(NO3)2、还原产物NO。
5KI+KIO3+3H2SO4 = 3K2SO4+3I2+3H2O 的反 应中,被氧化的碘元素和被还原的碘元素的质 量比是 C
( A) 1 ︰ 3 ( C) 5 ︰ 1 ( B) 1 ︰ 4 ( D) 4 ︰ 1
+4
Fe2O3
KMnO4
K2MnO4
K2Cr2O7
氧化还原反应方程式配平——化合价升降法配平
1、配平原则:
①化合价升降(得失电子)守恒 ②质量守恒
2、配平步骤: ① 标价态
练习
②列变化
③等升降
④平两边
配平下面方程式
3Cu+ 8HNO3-------3Cu(NO3)2+ 2NO+ 4H2O 3、注意: ①只有部分反应物参与反应
+5
+5
+4
S+ HNO3(浓) 6×1
H2SO4+ NO2 +H2O
S+6HNO3(浓)=H2SO4+6NO2 +2H2O
0
+5
Hale Waihona Puke +6+41×6
化合价升高6 ×1
1AsH3 + 6 AgNO3 + 3 H2O---- 1As(OH)3 + 6Ag + 6HNO3
-3
+1
+3
0
化合价降低1 × 6
2、重要的还原剂
(1)金属单质:IA、IIA、金属活动性顺序表 (2)非金属单质:H2、C、Si (3)变价元素中元素低价态氧化物:SO2、CO (4)变价元素中元素低价态的酸、阴离子 H2S、 S2—、H S—、HBr、Br—、HI、I—、 浓HCl、Cl—、H2SO3 、HSO3— (5)变价元素中元素低价态时的盐、碱 Na2SO3、Na2S、FeSO4、Na2S2O3、Fe(OH)2
氧化剂:
升失氧 降得还 若说剂 两相反
得电子的性质,其单质易得电子氧化性强; 氧化性:
还原性: 失电子的性质,其单质易失电子还原性强; 氧化反应: 物质失去电子的反应;
物质得到电子的反应; 还原反应:
还原剂在反应中失去电子后被氧化形成的生成物; 氧化产物:
还原产物: 氧化剂在反应中得到电子后被还原形成的生成物;
+3 +4 +4
4 3
H 11 2O
思考:能否有更简单的方法配平:
0
Fe3C + 131
+3
0
13 +5 22 9 HNO3 +4
— 113
+4
3 Fe(NO3)3 + CO2↑+ 13NO2↑+
H 11 2O
+4 0 0 +3 附注:Fe3C → Fe(NO3)3 + CO2
价升:3 x3 +4 = 13
233136
C2H5OH
CrO3 CH3CHO
3NA
配平练习
3 S + 6 KOH — 2 K2S + K2SO3 + 3 H2O 2 2 41
6 K2Cr2O7 + 14 8 HCl +3 +6 -1 0 -2 +4
—
0
2 KCl + 2 CrCl3 + 7 H2O + 3 Cl2↑ 3 2 1 123
配平练习 3 Cl2 + 6 KOH — 5 KCl + KClO3 + 3 H2O 15 51
练习
MnCl2+
Cl2 + 2 H2O
3P4+20HNO3+ 8H2O ------- 12H3PO4+ 20NO
氧化还原反应方程式配平——化合价升降法配平
1、配平原则:
小结
①化合价升降(得失电子)守恒 ②质量守恒
2、配平步骤: ① 标价态 ②列变化 ③等升降 ④平两边 3、注意: ①只有部分反应物参与反应 ②物质的下脚标:
四、中学常见的氧化剂和还原剂
1、重要的氧化剂
(1)活泼非金属单质:F2 、 Cl2、 Br2 、I2 、 O2、O3 (2)高价氧化物:MnO2、PbO2、 Bi2O5、 CO2(高温) (3)高价态酸:HNO3、HClO3、HClO4、浓H2SO4 (4)高价态盐:KNO3(H+)、 KMnO4(酸性、中性、碱性) KClO3、FeCl3、K2Cr2O7(酸性、中性、碱性) (5)过氧化物:H2O2、Na2O2、 CaO2、 BaO2、 K2O2 (6)其它:HClO、NaClO、漂白粉、NO2、KO2、 (7) 弱氧化剂:能电离出H+的物质、银氨溶液、新制的 Cu(OH)2
第三节 氧化剂和还原剂
得到氧,被氧化 H2 + CuO = Cu + H2O 还原剂 还原产物 氧化产物 氧化剂 失去氧,被还原 化合价升高(失电子) 被氧化 +1 H2 + CuO = Cu + H2O 还原剂 还原产物 氧化产物 氧化剂
0 +2 0
化合价降低(得电子) 被还原
一、定义:有元素化合价升降(电子得失或偏移)
三、电子转移的表示方法
1.双线桥法:表示同一元素的原子或离子得失电子的结果
失 2e
MnO2 + 4 HCl = MnCl2 + Cl2 + 2H2O
得 2e
失1e
+4
-1
+2
0
注 意
双箭号跨过等号, 从反应物指向生成物, 起止为同一元素
-1 +1
Cl2 + H2O = HCl + HClO
得 1e
化合价升降总数相等
氧化还原反应方程式配平——化合价升降法配平
1、配平原则:
①化合价升降(得失电子)守恒 ②质量守恒
2、配平步骤: ① 标价态 ②列变化 ③等升降 ④平两边
升4 ×1 1 C+ 4 HNO3 ----- 1CO2 + 4 NO2 + 2 H2O 降1 ×4
+3
+7 +6 +6
0
+5
+4
0
注明失去或得 到电子的总数,得 或失两字不能省略。
