1型多聚ADP核糖聚合酶激活NF—κB途径调节基质金属蛋白酶活性的机制研究
IL-33调控NF-κB

doi:10.3969/j.issn.1000-484X.2023.09.005IL-33调控NF-κB/Twist信号通路促进肺泡上皮细胞上皮-间质转分化的机制研究①高云星②付裕③陈晓李泽朋何晓伟李先伟(皖南医学院药学院药理学教研室,芜湖 241002)中图分类号R392.12 文献标志码 A 文章编号1000-484X(2023)09-1814-08[摘要]目的:探究IL-33是否通过激活NF-κB/Twist信号通路,进而诱导Ⅱ型肺泡上皮细胞发生上皮-间质转分化(EMT)而促进肺纤维化(PF)的进程。
方法:C57BL/6小鼠48只,随机分成对照(CON)组、博莱霉素(BLM)组、BLM+IL-33 (30 μg/kg)组和BLM+抗IL-33抗体(Anti-IL-33 Ab)(100 μg/kg)组,每组12只。
气管注射BLM(5 000 U/kg)诱导PF小鼠模型。
造模后每隔1 d腹腔注射1次重组IL-33和抗IL-33抗体,连续注射3周。
HE和Masson染色观察肺组织病理变化及胶原沉积情况。
ELISA检测血浆IL-33的水平。
免疫组化检测肺组织IL-33跨膜受体ST2L的表达。
体外培养小鼠Ⅱ型肺泡上皮细胞,实验设Control组、IL-33(100 ng/ml)组、IL-33+二甲基亚砜(DMSO)组及IL-33+吡咯烷二硫代氨基甲酸盐(PDTC, 100 μmol/L)组,每组设复孔6个。
细胞先用PDTC或DMSO预处理1 h,再用IL-33处理48 h。
RT-PCR检测肺组织或肺泡上皮细胞中Collagen Ⅰ、Collagen Ⅲ、E钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)和α-平滑肌肌动蛋白(α-SMA)mRNA的表达。
Western blot检测肺组织和(或)肺泡上皮细胞IL-33、Collagen Ⅰ、Collagen Ⅲ、E-cadherin、Vimentin、α-SMA、p-IκBα、p-NF-κB p65蛋白表达及细胞核内NF-κB p65和Twist的蛋白水平。
国家自然科学基金委员会生命科学部2014年度青年基金项目

国家自然科学基金委员会生命科学部2014年度青年基金项目第26卷第12期2014年12月生命科学Chinese Bulletin of Life SciencesV ol. 26, No. 12Dec., 2014文章编号:1004-0374(2014)12-1342-62国家自然科学基金委员会生命科学部2014年度青年基金项目项目名称申请人依托单位1微生物学植物乳杆菌激活NHE8信号通路并在炎症性肠病中发挥保护作用可能的机制探究刘畅上海交通大学南极乔治王岛土壤中产蛋白酶细菌和胞外蛋白酶的多样性以及细菌新种属和新型适冷蛋白酶资源周明扬齐鲁工业大学II类NAD-依赖型异柠檬酸脱氢酶的功能与进化机制研究王鹏安徽师范大学黄河三角洲盐生植物内生菌多样性差异及功能基因分析夏志洁山东师范大学活性污泥中稀有微生物类群BFB的多样性及其环境响应研究郗丽君中国石油大学(华东)北冰洋产多糖细菌多样性及多糖特性张炳照广州中国科学院先进技术研究所青海油田原油与采出液水相微生物差异机制及原油来源菌种资源多样性研究蔡曼中国科学院微生物研究所一个特殊新疆鹰嘴豆根瘤菌种群自然进化规律及其进化机制的研究张俊杰郑州轻工业学院新疆藜科5种盐生植物内生细菌多样性及耐盐促生菌株评价王宏飞中国科学院新疆生态与地理研究所红树林生态系统中弗兰克氏菌的多样性及其数量分布研究刘敏中国热带农业科学院中国发网菌科黏菌分类及分子系统学研究张波吉林农业大学中国座坚壳属真菌的分类与分子系统学研究马海霞中国热带农业科学院基于转录组测序的腹黏菌亚纲和发网菌亚纲黏菌核糖体序列测定及分子系统学研究亓宝吉林农业大学中国链格孢菌大孢子种的形态学与分子系统学研究邓建新长江大学中国假网衣科地衣系统分类学研究张璐璐山东师范大学松乳菇多糖(LDG-A)调控巨噬细胞免疫应答活性的分子机制侯怡铃西华师范大学茶树病原真菌和内生真菌的多样性及其分布规律刘芳中国科学院微生物研究所丝状子囊菌ITS分子进化研究李熠福建农林大学武夷山国家自然保护区凋落枯枝暗色丝孢真菌分类研究马立国山东省农业科学院中国菌寄生属资源、分类及该属的分子系统学研究曾昭清中国科学院微生物研究所不同生境条件下齿瓣石斛不同生长时期菌根真菌多样性研究邵士成中国科学院西双版纳热带植物园中国担子地衣的分类及分子系统研究王欣宇中国科学院昆明植物研究所中国珀扎若拉属和偏脚菇属分类及分子系统学研究何晓兰四川省农业科学院裂丝盖伞复合群的隐存多样性及生物地理学研究范宇光长白山科学研究院疫霉属(Phytophthora)DNA条形码的选择与评价兰成忠福建省农业科学院毛醌素生物合成途径解析及其调控殷华中国科学院天津工业生物技术研究所阴沟肠杆菌SDM中2,3-丁二醇手性形成及代谢调控机制研究李理想上海交通大学产碱假单胞菌中龙胆酸代谢直接水解途径的研究刘琨上海交通大学沙门氏菌DNA磷硫酰化修饰蛋白复合物的功能研究成秋香上海交通大学聚醚类盐霉素的生物合成机理解析姜春艳上海交通大学寡糖转运在嗜碱芽孢杆菌 N16-5 半纤维素利用中的作用研究宋亚囝天津科技大学SpTrz2调控粟酒裂殖酵母线粒体介导的细胞凋亡机制的研究商巾杰南京师范大学DOI: 10.13376/j.cbls/2014186第12期1343国家自然科学基金委员会生命科学部2014年度资助项目铜绿假单胞菌合成鼠李糖脂对环境胁迫条件的响应机制研究姜天翼山东建筑大学开发适用于链霉菌的新型诱导表达系统王为善中国科学院微生物研究所激活蛋白AP1参与茉莉酸甲酯诱导灵芝酸合成的调控机理任昂南京农业大学代谢产物调控碳降解物阻遏作用和蛋白质组资源分配尤从慧深圳大学温度对法夫酵母MK19虾青素合成调控机制的研究苗莉莉中国科学院微生物研究所高山被孢霉脂质合成与苯丙氨酸代谢相关性及调控机制研究王鸿超江南大学蛋白乙酰化修饰对天蓝色链霉菌发育分化的调控机制研究赵维中国科学院上海生命科学研究院枯草芽孢杆菌解聚酶YwtD调节γ-聚谷氨酸链长的结构基础研究曾菊梅中国科学院成都生物研究所大肠杆菌表达异源蛋白质时的多态性研究赵云中国科学院生物物理研究所全局性调控子GacA对假单胞菌L-肉碱生物合成的调控机制研究黄娇芳中国科学院上海高等研究院hmsT 3'非翻译区介导的mRNA稳定性研究朱慧中国医学科学院病原生物学研究所微生物细胞外还原制备纳米粒子过程中的电子传递机制研究王敏聊城大学基于次级代谢产物活性和结构的重楼内生菌多样性及与宿主方晓梅中国医学科学院医药生物技术研究所植物相关性研究肠出血性大肠杆菌效应分子NleF通过抑制caspase-4参与其致病宋婷中国人民解放军军事医学科学院的分子机制研究微生物菊粉酶C末端结构域的功能研究刘光磊中国海洋大学谷氨酰胺蓝靛素合成酶的催化机制研究秦华中国科学院微生物研究所槐糖脂的结构修饰及其联合依托泊苷对食管癌细胞增殖马晓静合肥工业大学的影响和机制研究氨基糖苷类抗生素核糖开关翻译调控机制的深入研究张静复旦大学多烯聚酮细胞色素P450的区域及立体特异性研究季俊杰中国科学院过程工程研究所Thienodolin中噻唑并吲哚环的生物合成机制研究马宏敏武汉大学维生素K2合成关键酶的结构解析与基于结构的抑制剂设计徐铮南京工业大学集胞藻PCC6803中sll1981基因编码蛋白的功能研究李志敏中国科学院青岛生物能源与过程研究所沙雷氏菌灵菌红素的前体MBC合成途径中相关蛋白结构解析冉婷婷南京农业大学及反应机制的研究粘细菌新型β-1,3-葡聚糖酶的催化机制研究黄彦南京农业大学恶臭假单胞菌YL19产2种环脂肽的结构鉴定及合成机制研究孙燕陕西师范大学Bacillus subtilis双精氨酸转运系统中信号肽定向识别的分子机制崔文璟江南大学电子歧化转氢酶NfnAB的分子进化及结构与功能关系的研究黄海燕山东省医学科学院极端嗜热细菌Caldicellulosiruptor中双功能纤维素水解酶吕明中国科学院青岛生物能源与过程研究所作用机制的研究里氏木霉内切葡聚糖酶EGI催化纤维素水解的机理研究宋乡飞中国科学院青岛生物能源与过程研究所毕赤酵母转录因子Fhl1p功能鉴定及其促进外源蛋白表达的机理梁书利华南理工大学莱茵衣藻膜蛋白Cr-FAX在脂肪酸跨叶绿体膜运输过程中的作用研究李楠楠西南大学镉胁迫下MAPKs对通道蛋白的调控机理张丽琳天津大学构巢曲霉Calcineurin和CchA参与菌丝极性生长的分子调控机制王莎湖州师范学院blaOKP β-内酰胺酶耐药基因进化研究邹立扣四川农业大学多基因协同调控里氏木霉高效分泌表达蛋白的研究苏小运中国农业科学院饲料研究所潘多拉菌中氯苯代谢的两个基因簇的转录调控研究晁红军中国科学院武汉病毒研究所ClpX ATPase在蜡样芽孢杆菌生物防治小麦土传病害中的作用张颖河南大学酿酒酵母耐受玉米秸秆水解液抑制物基因的功能鉴定刁刘洋中国科学院上海生命科学研究院病原细菌受体激酶PcrK特异识别寄主植物激素分子信号的机制王芳芳中国科学院微生物研究所深海链霉菌SCSIO ZJ46来源的抗菌环肽desotamides的生物合成研究李青连中国科学院南海海洋研究所稻瘟菌可长距离移动的效应蛋白MoSDT1在与水稻互作中杨静云南农业大学的分子鉴定寒地根瘤菌III型效应因子对大豆宿主特异性的影响辛大伟东北农业大学1344生命科学第26卷RAS-2调控粗糙脉孢菌生物钟的分子机制研究胡启文中国人民解放军第三军医大学固氮施氏假单胞菌非编码RNA crcZ和crcY在碳代谢抑制中战嵛华中国农业科学院生物技术研究所的协同作用机制利用CRISPR/Cas系统建立新型乳酸菌基因组编辑技术郭婷婷山东大学纳豆激酶高效分泌表达系统的构建与最适pH偏酸性改造刘中美江南大学普鲁兰酶的理性设计及其在枯草芽孢杆菌中的分泌表达研究谢能中广西科学院建立土曲霉高效基因打靶平台的研究黄雪年中国科学院青岛生物能源与过程研究所大肠杆菌人工合成功能寡糖2-岩藻化乳糖的系统研究黄笛南开大学组合调控解淀粉芽孢杆菌胞内辅因子NADH/NAD+强化2,3-丁二醇杨套伟江南大学生物合成的分子机制磷霉素生物合成中Fom3催化的sp3碳原子甲基化机制研究陈允亮中国科学院上海生命科学研究院肠杆菌中以葡萄糖为原料利用苯丙酮酸途径合成苯乙醇张海波中国科学院青岛生物能源与过程研究所的代谢调控研究基于微流控液滴的放线菌高通量筛选培养和分离何湘伟北京林业大学基于双底物平行标记实验的13C代谢通量分析的新方法姚瑞莲上海交通大学微流控芯片上微生物培养的溶氧梯度控制方法与基因表达研究甘明哲中国科学院苏州纳米技术与纳米仿生研究所基于单细胞拉曼分选的新型酵母突变株筛选方法研究王婷婷中国科学院青岛生物能源与过程研究所单细胞拉曼技术在微生物群落动态监测中的方法学研究黄适中国科学院青岛生物能源与过程研究所新型宿主免疫调节抗菌化合物的作用机制研究崔金辉中国科学院微生物研究所根际微生物在壶瓶碎米荠超积累硒过程中的作用及其机制袁林喜中国科学技术大学Aquamicrobium sp. hun6降解皮考啉酸及其衍生物的机理研究吴志国天津科技大学喜温嗜酸硫杆菌中sigma因子对硫代谢和环境压力适应性的调控陈林旭山东大学铜绿假单胞菌胞外多糖和鼠李糖脂交互调控的分子机理王世伟中国科学院微生物研究所一株鞘脂菌多环芳烃降解代谢网络的转录组学研究丁国春中国农业大学天然来源腐殖质作为电子媒介体促进多氯联苯生物降解的研究章春芳浙江大学双启动子级联调控荧光蛋白基因表达载体的构建及环境监测应用李琴中国环境科学研究院Sphingobium sp.MEA3-1降解烷基取代苯胺类化合物2-甲基-6-乙基侯颖河南科技大学苯胺分子机理研究芽孢杆菌B1菌株降解4-羟基苯甲酸途径中NIH重排反应研究冯昭中江苏师范大学磷酸激酶slt2调控黄曲霉毒素产生的分子机制张峰福建农林大学中国桦木属植物外生菌根真菌多样性及分布格局研究王琴辽宁省林业科学研究院海洋枯草芽孢杆菌C01抗菌物质合成调控的信号通路研究穆大帅山东大学沉水植物与磷细菌的联合对水-沉积物间磷循环的作用规律研究李海峰河南工业大学生物阴极加速氯代烃污染物还原脱氯及作用机制李智灵哈尔滨工业大学菌株Pigmentiphaga sp.H8对3,5-二溴-4-羟基苯甲酸的降解陈凯南京农业大学及脱溴机制大兴安岭地区火山口湖好氧不产氧光合菌群落多样性及系统分类李爱华中国科学院微生物研究所海洋弧菌菌群感应信号分子N-acyl homoserine lactones对NK 细胞付凯飞中国人民解放军海军总医院的调控作用研究基于噬菌体随机肽库研制新型酿酒酵母表面吸附剂张海燕河南大肠道微生物组在转基因鲤糖代谢中的作用及调控机制研究颜庆云中国科学院水生生物研究所特殊生境中地衣内生菌次生代谢产物及其抗辐射作用研究元超中国医学科学院药用植物研究所基于“质粒宏基因组”研究饲料中铜、锌、砷对猪粪细菌耐药邓祖军广东药学院质粒的选择与转移微生物协同利用石油烃作用的机理研究胡冰北京大学氧调控奥奈达希瓦氏菌降解偶氮染料的机理研究杨玉义中国科学院武汉植物园假诺卡氏菌CB1190降解四氢呋喃的代谢机理及关键酶研究方倜中国科学院武汉病毒研究所Cupriavidus basilensis B-8对木质素降解机制的研究石岩河南师范大学第12期1345国家自然科学基金委员会生命科学部2014年度资助项目嗜酸微生物协同作用浸出黄铁矿的分子机制韩一凡中国科学院天津工业生物技术研究所c-di-GMP受体Filp与PXO_02715蛋白互作及其对水稻白叶枯杨凤环中国农业科学院植物保护研究所病菌毒性的共调控作用结核分枝杆菌LrpA蛋白调控基因转录的机制研究宋宁宁中国农业科学院哈尔滨兽医研究所控制致病性大肠杆菌DegP表达的调控蛋白及其调控机制研究李兆利中国农业科学院哈尔滨兽医研究所水貂铜绿假单胞菌强弱毒菌株差异表达基因的鉴定及其与毒力齐静山东省农业科学院的相关性研究一株糖霉菌属放线菌抑菌活性成分及作用机理研究张越锋塔里木鱼类病原菌迟钝爱德华氏菌功能RNA组研究杨敏俊上海人类基因组研究中心福氏志贺菌2a新毒力蛋白Pic细胞毒性的分子机理研究张俊琪复旦大学巴尔通体效应蛋白BepC与宿主p53蛋白互作诱导细胞凋亡机制研究袁聪俐上海交通大学malS-5'UTR调节伤寒沙门菌耐酸力和侵袭力的作用机制研究张盈江苏大学噬菌体裂解酶细胞壁结合域抑制金黄色葡萄球菌生物膜形成杨航中国科学院武汉病毒研究所的机理与应用结核分枝杆菌耐药相关非编码基因区的系统发现和耐药新机制研究张泓泰中国科学院生物物理研究所血红素氧化酶独特的ND9/14位点促进空肠弯曲菌感染定植张睿中国人民解放军第三军医大学及机制研究头束霉及其近似属的分子系统学分析耿月华河南农业大学水稻纹枯病菌诱导水稻程序化死亡的作用机制郑爱萍四川农业大学SreE介导的铁调节对皮炎外瓶霉形态发生、药物敏感性高露娟复旦大学及致病性的影响钙信号系统介导白念珠菌形态发生分子机制的研究喻其林南开大学隐球菌转录因子Frt1功能和调控机理研究刘同宝山东大学烟曲霉Rho1蛋白对其细胞壁生物学特性、致病力及诱发宿主田曙光中国人民解放军军事医学科学院天然免疫应答的调控机制研究白念珠菌开关蛋白S?1和S?2在菌丝发育和致病过程中的调控戴宝娣中国科学院上海生命科学研究院机制研究昆虫RNAi抗病毒免疫途径调控南方水稻黑条矮缩病毒与不同贾东升福建农林大学介体间存在亲和性差异的机制研究细胞自噬在伪狂犬病毒复制感染中的作用孙明霞中国农业科学院哈尔滨兽医研究所口蹄疫病毒基因组3'非编码区通过DDX21诱导I型干扰素产生杨德成中国农业科学院哈尔滨兽医研究所的分子机制GCRV内衣壳的自组装及与细胞相互作用机制研究张付贤中国科学院武汉病毒研究所杆状病毒核心基因gp41在BV和ODV形成过程中的作用机制研究沈姝中国科学院武汉病毒研究所质型多角体病毒衣壳蛋白VP5参与病毒RNA复制机制的研究杨洁武汉大学杆状病毒ODV表面刺突的组分鉴定和功能研究侯典海中国科学院武汉病毒研究所蝙蝠正呼肠孤病毒对实验动物的致病性研究杨兴娄中国科学院武汉病毒研究所应激颗粒对新城疫病毒复制与先天性免疫的调控机制研究孙英杰中国农业科学院上海兽医研究所日本乙型脑炎病毒逃逸神经系统CD8+ T细胞免疫清除的机制刘珂中国农业科学院上海兽医研究所猪瘟兔化弱毒疫苗株适应家兔的关键基因定位李永锋中国农业科学院哈尔滨兽医研究所基于HIV-1病毒感染必需因子Vif和其相互作用宿主蛋白的高通量周小红吉林大学小分子药物筛选体系Hedgehog信号通路在人呼吸道合胞病毒感染过程中作用机制研究邹罡中国科学院上海巴斯德研究所纤毛杆影响嵌合型腺病毒感染T淋巴细胞效率的机制研究张文峰广东药学院I型单纯疱疹病毒UL2蛋白核质转运信号的鉴定及其在病毒蔡铭升广州医科大学感染中功能的研究流感NS1蛋白通过改变细胞骨架帮助病毒释放姜威中国科学院微生物研究所内质网蛋白SEC62调控登革病毒感染的新机制研究柳恒中国科学院上海生命科学研究院1346生命科学第26卷PI3K/Akt信号通路在DHEA衍生物抗EV71中的作用研究魏艳红湖北工业大学中东呼吸综合征冠状病毒刺突蛋白N-端结构域及S1亚基的结构逯光文中国科学院微生物研究所与功能研究麻疹病毒N蛋白诱导细胞自噬及其分子机理研究刘鑫武汉大学人腺病毒E1B55K与E4orf6蛋白相互作用的型特异性研究及应用邹小辉中国疾病预防控制中心病毒病预防控制所乙型脑炎病毒入侵环节中包膜糖蛋白关键氨基酸残基和肽段刘海滨中国科学院武汉病毒研究所的识别与功能分析受MicroRNA调控的重组EV71在恶性神经胶质瘤模型上的溶瘤研究张晓玮中国科学院武汉病毒研究所肠道病毒71型(EV71)诱导线粒体自噬的分子机制研究王蓓中国医学科学院病原生物学研究所来自丙型肝炎亚基因组复制子的外体活化炎症小体的机制研究徐咏芬中国科学院上海巴斯德研究所霍乱弧菌分型噬菌体VP2吸附和注入分子机制的研究徐嘉良北京工商大学同一原噬菌体在两株希瓦氏菌中的作用及H-NS对其切离调控的研究刘晓晓中国科学院南海海洋研究所ORF48催化铜绿假单胞菌噬菌体PaP1甲基化的作用与机制卢曙光中国人民解放军第三军医大学猪肺炎支原体果糖二磷酸醛缩酶的致病机制研究华利忠江苏省农业科学院靶向单基因模型构建与新型小分子化合物CB抗衣原体分子包小峰南通大学作用机制研究2植物学龙胆属植物中雌雄异位和雌雄异熟的功能分异和进化式样研究李肖夏中国林业科学研究院百合属的花进化和传粉生态学刘长秋中国科学院昆明植物研究所拟南芥RSU3调控花粉管顶端生长的分子机理周利明河北联合大学水稻CRC2蛋白在减数分裂联会复合体形成中的分子机理研究纪剑辉淮阴师范学院玉米胚胎发生相关基因EMB4的功能研究李翠玲山东大学双靶向半胱氨酸蛋白酶抑制剂NtCYS调控胚柄细胞程序性死亡赵鹏武汉大学的分子机理研究野生大豆/栽培大豆胚胎发生的比较研究及其重要经济性状刘媛中国科学院东北地理与农业生态研究所的分子调控机制探讨暖温带不同功能型植物的水分利用策略及对降水变化的响应杜宁山东大学TBL在植物细胞壁多糖乙酰化修饰中的功能研究刘香玲中国科学院遗传与发育生物学研究所一个新的水稻每穗粒数主效QTL Gn2的图位克隆和功能分析朱金燕江苏省农业科学院拟南芥MUP24.5基因维持种子黏液质结构的功能研究于丽中国科学院青岛生物能源与过程研究所拟南芥AtFH14与微丝及微管骨架的相互作用机制王姣姣北京师范大学中国紫珠属(唇形科)的分类修订马仲辉广西大学中国千金藤属(防己科)的分类学研究张紫刚南京农业大学虾脊兰属及其近缘类群(兰科)的系统分类学研究翟俊文福建农林大学广义九里香属的分类修订及系统学研究牟凤娟西南林业大学中国山矾属(山矾科)的分类学修订刘博中央民族大学中国蛛毛苣苔属的分类学研究许为斌广西壮族自治区中国科学院广西植物研究所爵床科恋岩花属的系统位置及其物种分化研究高春明滨州学院中国淡水隐藻类的分类学研究夏爽中南民族大学中国海洋绿藻门刚毛藻目的分子系统发育学及其DNA条形码库构建黄冰心汕头大学木腐菌对粗木质残体附生苔藓植物多样性的影响及其机制闫晓丽中国科学院成都生物研究所木灵藓属(Orthotrichum hedw.)的形态演化、系统发育和分类王庆华中国科学院植物研究所拟蕨藓属的分类修订及其与近缘属的关系于宁宁中国科学院植物研究所中国细鳞苔属(Lejeunea)植物的分类修订韦玉梅广西壮族自治区中国科学院广西植物研究所耐旱复苏植物旋蒴苣苔的分子谱系地理学研究李晶首都师范大学小叶栒子复合体谱系地理及物种界定研究李飞飞中央民族大学卫矛科南蛇藤属(Celastrus L.)分子系统学与生物地理学研究沐先运北京林业大学国家自然科学基金委员会生命科学部2014年度资助项目第12期1347基于RAD-Tag技术:特提斯孑遗洲际间断分布植物穗菝葜祁哲晨浙江理工大学(菝葜科)的亲缘地理学研究伞形科山芹属的系统发育与生物地理学研究廖晨阳四川大学世界凤尾蕨属及凤尾蕨亚科的系统学研究张良中国科学院成都生物研究所中国—喜马拉雅特有属蓝钟花属的系统进化与生物地理研究周卓中国科学院昆明植物研究所花柱二型性水生植物莕菜的适应性遗传进化研究岳晓丽湖北工业大学番荔枝科独子木属的分子系统发育研究:探索高分化速率薛彬娥中国科学院华南植物园与性状演化及生物地理的相关性东亚特有药用植物玄参复合种系统发育和物种形成机制研究陈川杭州植物园植物RPW8-NBS-LRR类抗病信号传导基因的起源、演化邵珠卿南京大学及功能化机制水稻亚种间新合成四倍体早期世代基因组变异徐春明东北师范大学特异响应冷胁迫的DREB1/CBF基因亚家族在陆生植物中的演化康菊清陕西师范大学黑种草属植物中AP3-3基因表达量的调控进化及其对花瓣形态张睿中国科学院植物研究所多样性的贡献栽培大豆茎杆直立驯化性状的分子机制研究董阳中国科学院植物研究所南果梨花发育分子机制研究张吉斯鞍山师范学院蕨类植物叶绿体RNA编辑及其适应性进化研究高磊中国科学院。
ERAP1结构与功能研究进展

ERAP1结构与功能研究进展郭爱华;徐沪济【摘要】Endoplasmic reticulum aminopeptidase 1 (ERAP1) is a multifunctional enzyme belonging to the M1 family of aminopeptidases with roles in the regulation of blood pressure, angiogenesis, ectodomain shedding of several cytokine receptors, and processing of antigenic peptides presented to MHC class I molecules. Allelic variants of ERAP1 have been linked to a number of human diseases, including the autoimmune disease ankylosing spondylitis (AS), diabetes, some forms of cervical cancer, and hypertension.% 内质网氨基肽酶1(endoplasmic reticulum aminopeptidase 1,ERAP1)是氨基肽酶 M1家族中的一个多功能的酶,在血压调节、血管发生、细胞因子受体的胞外区脱落,以及对递呈至 I 型主要组织相容性抗原复合物(major histocompatibility complex class I,MHC I)的抗原肽的加工中发挥作用.ERAP1等位基因变异体与多种人类疾病相关,包括自身免疫性强直性脊柱炎(ankylosing spondylitis,AS)、糖尿病、子宫颈癌以及高血压等.【期刊名称】《分子诊断与治疗杂志》【年(卷),期】2013(000)002【总页数】6页(P128-133)【关键词】内质网氨基肽酶 1;I型主要组织相容性抗原复合物;免疫反应;抗原加工【作者】郭爱华;徐沪济【作者单位】第二军医大学长征医院风湿免疫科,上海 200433; 中国航天员科研训练中心航天医学基础与应用国家重点实验室,北京 100094;第二军医大学长征医院风湿免疫科,上海 200433【正文语种】中文MHC I型分子对与之高亲和力结合的肽配基长度有严格要求,典型的肽配基长度为8~10个氨基酸残基,因此,被MHC I型分子递呈的肽必须在装载前进行精细剪切[1]。
NF-κB信号通路在大骨节病等骨关节病中的研究进展

NF-κB信号通路在大骨节病等骨关节病中的研究进展王晨; 熊咏民【期刊名称】《《国外医学(医学地理分册)》》【年(卷),期】2019(040)004【总页数】5页(P466-469,474)【关键词】大骨节病; NF-κB; 信号通路; 细胞凋亡【作者】王晨; 熊咏民【作者单位】西安交通大学医学部公共卫生学院地方病研究所国家卫健委微量元素与地方病重点实验室陕西西安 710061【正文语种】中文【中图分类】R739大骨节病(kashin-Beck disease,KBD)是一种地方性、慢性、变形性骨关节疾病,好发于5~13岁的儿童青少年[1]。
其主要病理特征为患者四肢管状骨关节软骨和骺板软骨深层软骨细胞的变性和多发性、灶性坏死,中层以上软骨细胞表现出坏死性凋亡和凋亡并存,患者临床表现为多发性关节疼痛、增粗、变形、活动受限、肌肉萎缩,严重者出现短指、短肢或身材矮小畸形甚至终生残疾,给患者带来巨大痛苦,严重危害病区人民群众身体健康[2-3]。
KBD至今病因未明,目前主要有以下几种病因假说:①地球生物化学病因学说,以硒元素缺乏为主;②饮水中有机物中毒学说,以水中有机物和腐殖酸中毒为主;③粮食中真菌毒素中毒学说,以镰刀菌毒素中毒为主。
核转录因子κB(nuclear factor-kappa B,NF-κB)是一种核转录因子,能够结合某些基因启动子区的固定核酸序列,从而发挥对基因转录的启动、调节等功能。
该因子广泛参与机体的胚胎发生,细胞增殖、分化、凋亡,介导免疫与炎症反应等过程,是生命活动的重要调节因子之一。
近年来NF-κB信号分子在骨与软骨发育及相关疾病中的作用研究较多,结果表明NF-κB信号通路在调控骨细胞、软骨细胞增殖分化和凋亡过程中发挥重要作用[10-12]。
且在KBD,骨关节炎,风湿性关节炎,骨质疏松等骨关节疾病中均可观察到该通路上关键信号分子的异常改变。
因此研究NF-κB信号通路在KBD中发挥的作用对于阐明KBD的发病机制具有重要意义,本文拟对NF-κB信号通路在KBD发生发展中的相关机制进行综述。
基质金属蛋白酶1

基质金属蛋白酶1介绍基质金属蛋白酶1(MMP1)是一种重要的酶类分子,属于基质金属蛋白酶家族。
它能够分解基质蛋白质,并在许多生物学过程中发挥关键作用。
本文将对MMP1的结构、功能、调控以及其在疾病中的作用进行综述。
结构MMP1是一种细胞外酶,由包括信使RNA、预肽和成熟形式的多肽链组成。
成熟的MMP1分子约有54 kDa,并由一个N-末端信号序列、一个催化结构域、一个纤维连接结构域和一个C-末端的血红素结构域组成。
催化结构域是MMP1的主要功能部位,其中包含Zn2+和Ca2+离子。
这些金属离子对于催化结构域的稳定性和活性都至关重要。
功能MMP1主要功能是降解基质蛋白质。
它通过切割基质蛋白质的肽键,降解胶原蛋白、纤维连接蛋白和凝血酶原等基质分子。
MMP1在胚胎发育、组织修复和解剖学重塑等过程中起着重要的调节作用。
此外,MMP1还参与肿瘤侵袭和转移、炎症反应、免疫调节等生理和病理过程中的调节。
调控机制MMP1的活性受到严格的调控,以维持正常的基质平衡。
MMP1的调控机制有多个层面。
首先,MMP1的表达受到转录水平的调控。
许多炎症因子、生长因子和细胞因子能够上调MMP1的转录,促使其表达增加。
其次,MMP1的活性受到组织抑制物的调控。
组织抑制物能够与MMP1结合,阻止其催化作用。
最后,MMP1的活性受到组织纤维蛋白酶激活物(tPA)的调控。
tPA能够活化MMP1,增强其降解基质的能力。
在疾病中的作用MMP1在多种疾病的发生和发展中起着重要的作用。
首先,MMP1被发现与肿瘤侵袭和转移密切相关。
肿瘤细胞产生大量的MMP1,破坏周围基质结构,促进肿瘤细胞的侵袭和转移。
其次,MMP1参与心血管疾病的发展。
心肌梗死、动脉粥样硬化等疾病中,MMP1介导的基质降解导致血管结构的破坏,加速病变的进展。
此外,MMP1在关节炎和炎症性肠病等炎症性疾病中也发挥重要作用。
应用前景由于MMP1在多种疾病中的重要作用,成为潜在的治疗靶点。
cGAS-STING通路的调控机制及其相关药物研究进展

综㊀㊀述cGAS ̄STING通路的调控机制及其相关药物研究进展张旭飞ꎬ吴秀文综述ꎬ任建安审校㊀㊀[摘要]㊀鸟苷酸 ̄腺苷酸合成酶(cGAS)㊁干扰素基因刺激因子(STING)均为细胞内受体ꎬ参与细胞对双链DNA的识别ꎮ由cGAS激活的STING通路是近年来研究较为热门的信号通路ꎬ可介导细胞自噬㊁细胞死亡ꎬ发挥促炎㊁抗病毒㊁抗肿瘤等多种效应ꎮ随着研究深入ꎬ对cGAS ̄STING通路相关分子机制的了解逐渐增多ꎬ调控该通路有了较强的理论基础ꎮ鉴于cGAS ̄STING通路参与多种病理生理学功能ꎬ故针对cGAS ̄STING通路相关抑制剂㊁激动剂的研发具有潜在的临床应用价值ꎮ文章就cGAS ̄STING通路的各调控位点及其相关抑制剂㊁激动剂进行综述ꎮ㊀㊀[关键词]㊀鸟苷酸 ̄腺苷酸合成酶ꎻ干扰素基因刺激因子ꎻ环化二核苷酸ꎻ抑制剂ꎻ激动剂㊀㊀[中图分类号]㊀R91㊀㊀[文献标志码]㊀A㊀㊀㊀[文章编号]㊀1008 ̄8199(2021)03 ̄0303 ̄06㊀㊀[DOI]㊀10.16571/j.cnki.1008 ̄8199.2021.03.017基金项目:国家自然科学基金(81772052ꎬ81801971)作者单位:210002南京ꎬ南京医科大学金陵临床医学院(东部战区总医院)全军普通外科研究所[张旭飞(医学硕士研究生)㊁吴秀文㊁任建安]通信作者:任建安ꎬE-mail:jiananr@gmail.comResearchprogressonthemechanismandrelateddrugsofregulatingcGAS ̄STINGpathwayZHANGXu ̄feiꎬWUXiu ̄wenreviewingꎬRenJian ̄anchecking(ResearchInstituteofGeneralSurgeryꎬJinlingHospitalꎬNanjingMedicalUniversity/GeneralHospitalofEasternTheaterCommandꎬPLAꎬNanjing210002ꎬJiangsuꎬChina)㊀㊀[Abstract]㊀BothcyclicGMPAMPsynthase(cGAS)andstimulatorofinterferongenes(STING)areintracellularreceptors.TheSTINGpathwayactivatedbycGASisamuchpopularsignalingpathwayinrecentyearsꎬwhichcanmediateautophagyandcelldeathandexertvariouseffectsꎬincludinginflammatoryresponseꎬantiviraleffectꎬandanti ̄tumoreffect.Withthedeepeningofre ̄searchꎬthemolecularmechanismrelatedtothecGAS ̄STINGpathwayhasbeengraduallyimprovedꎬprovidingastrongtheoreticalbasisforregulatingthecGAS ̄STINGpathway.SincethecGAS ̄STINGpathwayisinvolvedinmultiplepathophysiologicalfunctionsꎬthede ̄velopmentofinhibitorsandagonistsforthecGAS ̄STINGpathwayhaspotentialclinicalapplicationvalue.ThereforeꎬwewilldiscussthemechanismofregulatingcGAS ̄STINGpathwayandtheinhibitorsoragonistsrelatedtothecGAS ̄STINGpathway.㊀㊀[Keywords]㊀cyclicGMP ̄AMPsynthaseꎻstimulatorofinterferongenesꎻcyclicdinucleotidesꎻinhibitorsꎻagonists0㊀引㊀㊀言㊀㊀病原微生物感染宿主释放的病原相关分子模式(pathogen ̄associatedmolecularpatternsꎬPAMPs)和细胞损伤释放的损伤相关分子模式(damage ̄associatedmolecularpatternsꎬDAMPs)一直是固有免疫研究中的热点[1-2]ꎮ模式识别受体(pattern ̄recognitionre ̄ceptorsꎬPRRs)是固有免疫中不可或缺的成分ꎬ可识别PAMPs和DAMPsꎬ激活固有免疫ꎬ诱导炎症因子或趋化因子的分泌ꎬ故PRRs在监测病原微生物的入侵和组织细胞的损伤中起到关键作用[3]ꎮ早期的研究已对细胞表面的PRRs进行了详细阐述ꎮ然而ꎬ近年来细胞内PRRs在病原微生物识别系统中的作用越来越受到重视ꎮ鸟苷酸 ̄腺苷酸合成酶(cyclicGMP ̄AMPsyn ̄thaseꎬcGAS)㊁干扰素基因刺激因子(stimulatorofinterferongenesꎬSTING)均是细胞内PRRsꎮcGAS可识别并结合细胞质内的双链DNA(double ̄strandedDNAꎬdsDNA)ꎬ激活状态的cGAS可将三磷酸腺苷(adenosinetriphosphateꎬATP)和三磷酸鸟苷(guanosinetriphosphateꎬGTP)合成2ᶄ3ᶄ ̄环化鸟苷酸 ̄腺苷酸(cyclicGMP ̄AMPꎬcGAMP)ꎮ2ᶄ3ᶄ ̄cGAMP可直接激活内质网上的STING蛋白ꎬSTING激活后由内质网向高尔基体上转移[4]ꎮ激活的STING在高尔基体上招募并激活TANK结合激酶1(TANKbindingkinase1ꎬTBK ̄1)ꎮ一方面ꎬTBK ̄1可直接激活NF ̄κB信号通路ꎬ诱导炎症因子的产生ꎻ另一方面ꎬTBK ̄1招募并磷酸化下游干扰素调节因子3(in ̄terferonregulatoryfactor3ꎬIRF3)ꎬ磷酸化的IRF3可入核启动干扰素相关基因的表达ꎬ促进Ⅰ型干扰素的合成ꎬ从而增强免疫反应[5]ꎬ见图1ꎮ此外ꎬcGAS ̄STING通路还参与调控细胞代谢㊁自噬㊁死亡ꎬ在肠道炎症㊁非酒精性脂肪肝㊁胰腺㊁肾纤维化等损伤中发挥着作用[6]ꎮ故调控cGAS ̄STING通路对于组织细胞内稳态的维持㊁相关疾病的治疗具有重要意义ꎮ本文针对cGAS ̄STING通路中各环节的干预机制及相关药物作一综述ꎮ图1㊀STING通路及其调控机制和药物Figure1㊀OverviewofthemechanismandtheinhibitorsoragonistsrelatedtotheSTINGsignaling1㊀cGAS的调控㊀㊀cGAS是细胞质内dsDNA的感受器ꎬcGAS与dsDNA结合后ꎬcGAS催化位点的构象由无序变为有序ꎮ最新的研究发现ꎬcGAS激活后会形成二聚体ꎬcGAS二聚体与外侧两条dsDNA形成梯形结构ꎬ并促进后续cGAS二聚体与两条dsDNA结合ꎬdsD ̄NA的链越长ꎬ结合的cGAS二聚体则越多ꎬ故cGAS的激活数量是取决于dsDNA的长度[7]ꎮ我们发现ꎬ给予盲肠结扎穿孔的小鼠腹腔注射脱氧核糖核酸酶Ⅰꎬ会明显减少造模小鼠血循环线粒体DNA和炎症因子含量ꎬ改善脓毒症介导的肠道损伤[8]ꎮ此外ꎬ线粒体转录因子A(mitochondrialtranscriptionfactorAꎬTFAM)或高迁移率族蛋白1(HighMobilityGroupBox1ꎬHMGB1)参与装配cGAS ̄dsDNA形成的梯形结构ꎬ促进cGAS的激活[7]ꎮ所以促进细胞质内ds ̄DNA的降解ꎬ减少细胞质内TFAM㊁HMGB1的释放可从根本上抑制cGAS ̄STING通路的始动环节ꎮ1.1㊀cGAS的抑制剂㊀Hall等[9]发现一种具有生物活性的小分子PF ̄06928215可抑制cGAS活性ꎬ并且这种试剂本身对细胞活性影响很小ꎮ深入研究发现ꎬPF ̄06928215可结合于cGAS的活性位点ꎬ这种结合可能会影响ATP与cGAS的结合以及下游cGAMP的合成ꎮ既往已发现羟化氯喹㊁奎纳克林等抗疟疾药物具有抑制cGAMP合成的作用ꎬ但深入研究发现这些药物作用机制并不是与cGAS活性位点结合ꎬ而是与细胞质内DNA结合ꎬ从而阻止了DNA与cGAS的结合[10]ꎮ据此ꎬAn等[11]设计㊁合成了一种类抗疟疾药物ꎬ命名为 X6 ꎬ能够阻止DNA与cGAS的结合ꎬ并且X6对cGAS ̄STING通路的抑制作用要强于羟化氯喹ꎮsuramin是WHO推荐治疗河盲症和非洲昏睡病药物清单上的基本药物ꎮ最近ꎬSintim团队通过筛选分析发现suramin是潜在的cGAS抑制剂ꎬ其作用机制较为独特ꎬ能够将dsDNA从cGAS解离下来ꎬ减少cGAMP的生成ꎬ缓解cGAS ̄STING通路的激活ꎬ降低Ⅰ型干扰素的合成[12]ꎮ1.2㊀cGAS的转录后修饰㊀cGAS转录后修饰可调控cGAS的活性ꎮ2015年ꎬSeo等[13]发现Akt激酶可通过磷酸化cGAS的Ser291或Ser305位点抑制cGAS的酶活性ꎬ给予Akt1/2特异性抑制剂Ⅷ或突变该磷酸化位点可促进dsDNA诱导的干扰素合成释放ꎮ此外ꎬcGAS的泛素化修饰亦可调控cGAS的活性ꎮRNF185是一种E3泛素化连接酶ꎬ在单纯疱疹病毒 ̄1感染细胞期间ꎬRNF185可于cGAS的K173和K384位点上介导K27泛素链形成ꎬ促进cGAS的酶活性ꎻ而沉默RNF185可抑制cGAS的酶活性ꎬ限制干扰素应答效应[14]ꎮTRIM56也是一种E3泛素化连接酶ꎬ早期研究认为TRIM56是通过泛素化STING蛋白促进STING通路激活ꎬ然而后期发现TRIM56的敲除并不影响cGAMP直接激活STINGꎮ有研究深入探索ꎬ发现TRIM56是通过介导cGAS的K335位点泛素化ꎬ促进cGAS二聚化以及cGAMP的产生ꎬ加强cGAS ̄STING通路[15]ꎮ尽管如此ꎬcGAS的活性是否受泛素 ̄蛋白酶体系统的其他成分动态调控仍是一个有待解决的问题ꎮ2㊀STING的激动剂和抑制剂㊀㊀STING是位于内质网上的跨膜蛋白ꎮ在人STING蛋白结构中ꎬ其N末端有5个跨膜结构域ꎬC末端是TBK1/IRF3连接结构域ꎬ此外还有一段CDNs连接结构域[16]ꎮ虽然STING激活后通过NF ̄κB㊁IRF3通路诱导炎症反应ꎬ损伤组织器官ꎬ但这种免疫应答亦可介导免疫防御ꎬ抵抗病原微生物感染ꎬ或监测肿瘤来源的dsDNAꎬ产生固有的抗肿瘤免疫ꎮ除了经典通路ꎬSTING也有许多非经典通路ꎮ最新的研究发现ꎬSTING被激活后ꎬ其TM5㊁TM2结构域负责招募并激活NLRP3炎性小体ꎬ促进抗病毒反应[17]ꎮ2.1㊀STING的核苷酸类激动剂㊀环化二核苷酸(cyclicdinucleotidesꎬCDNs)是STING的直接激动剂ꎮ在经典通路中ꎬcGAS产生的是2ᶄ3ᶄ ̄cGAMPꎬ2ᶄ3ᶄ ̄cGAMP也是CDNs的一种ꎮ而在细菌感染宿主细胞过程中ꎬ会释放其他种类的CDNsꎬ如2ᶄ2ᶄ ̄cGAMP㊁3ᶄ3ᶄ ̄cGAMP㊁c ̄diAMP以及c ̄diGMP[5]ꎮ这些环化二核苷酸可直接激活STINGꎬ诱导STING相关免疫应答ꎮ尽管CDNs种类众多ꎬ但既往研究发现cGAMP激活STING诱导Ⅰ型干扰素产生的能力高于c ̄diAMP和c ̄diGMP[18-19]ꎻ但在cGAMP中ꎬ2ᶄ3ᶄ ̄cGAMP结合STING的能力更强ꎬ诱导干扰素产生的能力也更强[18-19]ꎮ为对抗STING的激活ꎬ细胞内存在水解2ᶄ3ᶄ ̄cGAMP的固有机制ꎮ核苷酸外焦磷酸酶/磷酸二酯酶1(Ectonucleotidepyrophos ̄phatase/phosphodiesterase1ꎬENPP1)是一种跨膜糖蛋白ꎬ位于细胞膜和内质网膜中ꎬ在人体中广泛表达ꎬ包括胃肠道㊁肺㊁肝㊁脂肪组织等ꎮ研究发现EN ̄PP1可将细胞外和细胞内2ᶄ3ᶄ ̄cGAMP水解成AMP和GMPꎬ从而抑制2ᶄ3ᶄ ̄cGAMP激活STING[20]ꎮ此外ꎬENPP1的催化结构域中含两个锌离子结合位点ꎬ并且锌离子与ENPP1的水解活性密切相关[21]ꎮ尽管CDNs是STING的直接激动剂ꎬ但单纯的CDNs实际利用起来有诸多缺点ꎬ如:稳定性差㊁细胞膜穿透性较差等ꎮ鉴于此ꎬ许多研究致力于CDNs的修饰ꎬ从而改善CDNs的性能ꎮCDNs修饰的方法有很多ꎬ如为对抗磷酸酶可进行硫代磷酸化修饰㊁为增加膜穿透性可进行脂肪酸/氟修饰㊁为改善与STING的结合能力可进行核苷酸替换等ꎬ修饰的位点常在于磷酸二酯键的部位以及2ᶄ3ᶄ ̄OH部位[22-24]ꎮ尽管修饰可改善CDNs部分性能ꎬ但也可能会影响CDNs对STING的激活能力ꎮ2.2㊀STING的非核苷酸类激动剂㊀为克服CDNs的缺点ꎬ也为适合工业化生产和低成本保存的需求ꎬ许多团队试图寻找取代CDNs的分子ꎮ当前ꎬ主要有6种STING的非核苷酸类激动剂:5ꎬ6 ̄二甲基黄体酮 ̄4 ̄乙酸(5ꎬ6 ̄dimethylxanthenone ̄4 ̄aceticacidꎬDMXAA)㊁黄酮乙酸(flavoneaceticacidꎬFAA)㊁10 ̄羧甲基 ̄9 ̄吖啶酮(10 ̄carboxymethyl ̄9 ̄acridanoneꎬCMA)㊁α ̄倒捻子素(α ̄Mangostin)㊁BNBC以及[25-30]ꎮ在以上6种分子中ꎬ并不是全部都对人类STING蛋白有效ꎬ只有α ̄倒捻子素㊁BNBC㊁diABZ能够激活人类STING蛋白ꎻ此外ꎬ只有BNBC对鼠STING无效ꎬ其余5种都对鼠STING有效ꎮDMXAA和FAA是黄酮类化合物ꎬ它们被发现可通过破坏肿瘤血管系统和诱导细胞因子分泌来抑制小鼠模型下的黑素瘤㊁胶质瘤以及非小细胞肺癌[26ꎬ31-32]ꎮZhang等[29]发现α ̄倒捻子素对人类STING的激活能力要强于鼠STINGꎮ此外ꎬα ̄倒捻子素干预后ꎬ能促进巨噬细胞向M1型转变ꎬ而M1型巨噬细胞可参与抗肿瘤免疫[29]ꎮRamanjulu等[25]通过高通量筛选发现diABZI能够与cGAMP竞争结合于STING上ꎬ并且diABZI与STING的结合亲合力是2ᶄ3ᶄ ̄cGAMP的18倍ꎬ同时diABZI激活STING诱导干扰素产生的效果亦强于2ᶄ3ᶄ ̄cGAMPꎮ改良后的diABZI在静脉注射后对CT26结直肠肿瘤有显著的抑制作用作用[25]ꎮ尽管上述6种STING激动剂相比于CDNsꎬ具有较强的稳定性㊁适合商业化生产ꎬ但细胞膜穿透性仍较差ꎮ2.3㊀STING的抑制剂㊀近年来ꎬ关于STING抑制剂的研究主要围绕STING的棕榈酰化ꎮ在2016年ꎬMukai等[33]发现STING激活后从内质网转移到高尔基体上ꎬ并在高尔基体上发生棕榈酰化ꎬ其棕榈酰化位点是位于STING半胱氨酸88/91上ꎮSTING发生棕榈酰后ꎬ能够促进STING的二聚化形成ꎬ招募下游TBK1ꎮ故STING的棕榈酰化修饰对于STING下游的激活至关重要ꎮ2018年ꎬHaag等[34]通过筛选发现两种硝基呋喃衍生物(C ̄176㊁C ̄178)能够明显抑制干扰素的应答ꎬ其机制是抑制STING半胱氨酸91位点的棕榈酰化ꎻ但C ̄176㊁C ̄178只能抑制鼠STINGꎬ对人STING无效ꎮ研究者又根据C ̄176㊁C ̄178结构ꎬ得到另两种衍生物 C ̄170㊁C ̄171ꎮC ̄170和C ̄171亦可抑制STING半胱氨酸91位点的棕榈酰化ꎬ并且C ̄170和C ̄171可同时抑制人STING和鼠STINGꎮ此外ꎬ研究者也筛选出另一种衍生物H ̄151ꎬ通过同样机制负调控人STING和鼠STINGꎮ同年ꎬHansen等[35]发现3种硝基脂肪酸 硝基共轭亚油酸㊁9 ̄硝基油酸和10 ̄NO2 ̄OAꎬ这3种硝基脂肪酸可抑制STING半胱氨酸88/91位点的棕榈酰化ꎬ同时抑制人STING和鼠STINGꎮSTING也存在一些竞争性抑制剂ꎮ2018年ꎬLi等[36]从环肽数据库里筛选出了能抑制cGAS ̄STING通路的AstinCꎬ其为从药用植物紫菀中提取的环肽ꎮ研究发现AstinC可结合于STING的C末端结构域ꎬ从而抑制IRF3的招募[36]ꎮ并且给予AstinC可显著缓解小鼠Trex1敲除所诱导的自发性炎症反应[36]ꎮ2019年ꎬSiu等[37]通过自动配体识别系统ꎬ筛选出Compound18ꎮCompound18可连接STING结构域上cGAMP结合的位点ꎬ抑制STING的激活ꎻ并且Compound18具有较好的口服生物利用度ꎮ2.4㊀STING的转录后修饰㊀2013年ꎬKonno等[38]发现cGAS产生的2ᶄ3ᶄ ̄cGAMP除可直接激活STING外ꎬ也可通过负反馈轴介导STING的磷酸化ꎬ抑制干扰素应答ꎮ具体机制而言ꎬcGAMP可使腺苷酸活化蛋白激酶(AMPactivatedproteinkinaseꎬAMPK)去磷酸化ꎬ去磷酸化的AMPK丧失了对UNC ̄51样激酶(UNC ̄51 ̄likekinaseꎬULK1)的抑制作用ꎮ活化的ULK1可磷酸化STING的S366位点ꎬ从而抑制STING介导的干扰素应答效应ꎮ值得注意的是ꎬ活性抑制的STING将通过自噬途径被细胞降解ꎮSTING的泛素化修饰也参与调控下游的活性ꎮ线粒体E3泛素蛋白连接酶(mitochondrialE3ubiq ̄uitinproteinligase1ꎬMUL1)可催化STING的K224位点发生泛素化ꎬSTING的泛素化参与调控IRF3的招募与激活[39]ꎮ而阻断K224位点的泛素化可明显抑制IRF3介导的干扰素表达ꎬ但不影响NF ̄κB通路的激活[39]ꎮ此外ꎬ有研究发现使用泛素蛋白特异性蛋白酶13(ubiquitin ̄specificprotease13ꎬUSP13)可使STING去泛素化[40]ꎮ去泛素化的STING招募TBK1的能力大大减弱ꎬ从而抑制了炎症反应[40]3㊀TBK1的调控㊀㊀TBK1是一种丝氨酸/苏氨酸蛋白激酶ꎬ并且是STING的关键下游ꎬSTING通过招募TBK1可介导NF ̄κB㊁IRF3激活ꎮ在经典通路中ꎬcGAS ̄STING ̄TBK1介导的下游激活更偏重于IRF3通路[41]ꎮ但在依托泊苷诱导的核损伤中ꎬ共济失调 ̄毛细血管扩张突变蛋白(ataxiatelangiectasiamutatedꎬATM)和干扰素γ诱导因子16(interferon ̄g ̄induciblefactor16ꎬIFI16)共同介导STING ̄TBK ̄1的激活ꎬ此时的TBK1主要激活的是NF ̄κB通路[42]ꎮ目前ꎬTBK1对两种下游的选择机制尚不清楚ꎮ故在不同方式激活STING的过程中ꎬ抑制TBK1可能会有不同的效应ꎮ据报道ꎬBX795是TBK1/IKKε通路强力的抑制剂[43]ꎮ也有研究发现ꎬ使用BX795治疗原代外周血单核细胞(来源于STING基因突变㊁干扰素效应阳性的儿童患者)ꎬ治疗后可明显抑制IRF3的磷酸化以及干扰素的产生[44]ꎮMclever等[45]设计合成了4 ̄二氨基 ̄5 ̄环丙基嘧啶ꎬ这种分子能够弥补BX795的部分性能以及激酶选择性ꎮ2019年ꎬThomson等[46]发现了GSK8612是一种强效㊁高选择性TBK1抑制剂ꎬ并且具有较好的细胞膜穿透性ꎮ研究者使用dsDNA或cGAMP刺激THP1细胞ꎬ给予GSK8612治疗后可明显抑制干扰素的产生ꎮ值得注意的是ꎬ如果长期使用TBK1抑制剂ꎬ可能会导致抗病毒免疫缺陷ꎬ增加感染病毒的风险ꎮ4㊀结㊀㊀语㊀㊀cGAS ̄STING通路参与多种疾病的发生发展ꎬ阻断cGAS ̄STING通路可抑制炎症反应㊁减轻组织损伤ꎬ而激活cGAS ̄STING通路可促进抗病毒㊁抗肿瘤效应ꎮ了解cGAS ̄STING通路各环节的调控机制ꎬ可利用现有的药物或研发新药物干预cGAS ̄STING通路ꎬ为临床相关疾病治疗提供新的思路和方法ꎮ随着研究的深入ꎬcGAS下游不依赖STING㊁STING上游不依赖cGAS以及STING下游不依赖IRF3等非经典cGAS ̄STING通路逐步被发现ꎬ使得关于该通路的调控位点的研究更引人入胜ꎮʌ参考文献ɔ[1]㊀张旭飞ꎬ吴秀文ꎬ任建安.线粒体DNA在危重症中的研究进展[J].中华危重症医学杂志(电子版)ꎬ2018ꎬ11(5):353 ̄356.[2]㊀胡琼源ꎬ任建安ꎬ吴秀文.线粒体DNA在固有免疫调节中的研究进展[J].医学研究生学报ꎬ2019ꎬ32(4):432 ̄435.[3]㊀蔡炳冈ꎬ朱㊀进ꎬ汪茂荣.Toll样受体4信号通路研究进展[J].医学研究生学报ꎬ2015ꎬ28(11):1228 ̄1232. [4]㊀AblasserAꎬChenZJ.cGASinaction:Expandingrolesinimmu ̄nityandinflammation[J].Scienceꎬ2019ꎬ363(6431):eaat8657.[5]㊀MarinhoFVꎬBenmerzougSꎬOliveiraSCꎬetal.TheEmergingRolesofSTINGinBacterialInfections[J].TrendsMicrobiolꎬ2017ꎬ25(11):906 ̄918.[6]㊀GuiXꎬYangHꎬLiTꎬetal.AutophagyinductionviaSTINGtraffickingisaprimordialfunctionofthecGASpathway[J].Na ̄tureꎬ2019ꎬ567(7747):262 ̄266.[7]㊀AndreevaLꎬHillerBꎬKostrewaDꎬetal.cGASsenseslongandHMGB/TFAM ̄boundU ̄turnDNAbyformingprotein ̄DNAlad ̄ders[J].Natureꎬ2017ꎬ549(7672):394 ̄398. [8]㊀HuQꎬRenHꎬLiGꎬetal.STING ̄mediatedintestinalbarrierdysfunctioncontributestolethalsepsis[J].EBioMedꎬ2019ꎬ41:497 ̄508.[9]㊀HallJꎬBraultAꎬVincentFꎬetal.DiscoveryofPF ̄06928215asahighaffinityinhibitorofcGASenabledbyanovelfluorescencepolarizationassay[J].PLoSOneꎬ2017ꎬ12(9):e0184843. [10]㊀AnJꎬMinieMꎬSasakiTꎬetal.AntimalarialDrugsasImmuneModulators:NewMechanismsforOldDrugs[J].AnnuRevMedꎬ2017ꎬ68:317 ̄330.[11]㊀AnJꎬWoodwardJJꎬLaiWꎬetal.InhibitionofCyclicGMP ̄AMPSynthaseUsingaNovelAntimalarialDrugDerivativeinTrex1 ̄DeficientMice[J].ArthritisRheumatolꎬ2018ꎬ70(11):1807 ̄1819.[12]㊀WangMꎬSooreshjaniMAꎬMikekCꎬetal.Suraminpotentlyin ̄hibitscGAMPsynthaseꎬcGASꎬinTHP1cellstomodulateIFN ̄betalevels[J].FutureMedChemꎬ2018ꎬ10(11):1301 ̄1317. [13]㊀SeoGJꎬYangAꎬTanBꎬetal.AktKinase ̄MediatedCheckpointofcGASDNASensingPathway[J].CellRepꎬ2015ꎬ13(2):440 ̄449.[14]㊀WangQꎬHuangLꎬHongZꎬetal.TheE3ubiquitinligaseRNF185facilitatesthecGAS ̄mediatedinnateimmuneresponse[J].PLoSPathogꎬ2017ꎬ13(3):e1006264.[15]㊀SeoGJꎬKimCꎬShinWJꎬetal.TRIM56 ̄mediatedmonoubiquit ̄inationofcGASforcytosolicDNAsensing[J].NatCommunꎬ2018ꎬ9(1):613.[16]㊀IshikawaHꎬBarberGN.STINGisanendoplasmicreticulumada ̄ptorthatfacilitatesinnateimmunesignalling[J].Natureꎬ2008ꎬ455(7213):674 ̄678.[17]㊀WangWꎬHuDꎬWuCꎬetal.STINGpromotesNLRP3localiza ̄tioninERandfacilitatesNLRP3deubiquitinationtoactivatetheinflammasomeuponHSV ̄1infection[J].PLoSPathogꎬ2020ꎬ16(3):e1008335.[18]㊀ZhangXꎬShiHꎬWuJꎬetal.CyclicGMP ̄AMPcontainingmixedphosphodiesterlinkagesisanendogenoushigh ̄affinitylig ̄andforSTING[J].MolCellꎬ2013ꎬ51(2):226 ̄235. [19]㊀LiuHꎬMoura ̄AlvesPꎬPeiGꎬetal.cGASfacilitatessensingofextracellularcyclicdinucleotidestoactivateinnateimmunity[J].EMBORepꎬ2019ꎬ20(4):e46293.[20]㊀LiLꎬYinQꎬKussPꎬetal.Hydrolysisof2ᶄ3ᶄ ̄cGAMPbyEN ̄PP1anddesignofnonhydrolyzableanalogs[J].NatChemBiolꎬ2014ꎬ10(12):1043 ̄1048.[21]㊀KatoKꎬNishimasuHꎬOikawaDꎬetal.StructuralinsightsintocGAMPdegradationbyEcto ̄nucleotidepyrophosphatasephos ̄phodiesterase1[J].NatCommunꎬ2018ꎬ9(1):4424. [22]㊀GaffneyBLꎬVeliathEꎬZhaoJꎬetal.One ̄flasksynthesesofc ̄di ̄GMPandthe[RpꎬRp]and[RpꎬSp]thiophosphateana ̄logues[J].OrgLettꎬ2010ꎬ12(14):3269 ̄3271.[23]㊀ZhouJꎬWattSꎬWangJꎬetal.Potentsuppressionofc ̄di ̄GMPsynthesisviaI ̄siteallostericinhibitionofdiguanylatecyclaseswith2ᶄ ̄F ̄c ̄di ̄GMP[J].BioorgMedChemꎬ2013ꎬ21(14):4396 ̄4404.[24]㊀WangCꎬSinnMꎬStifelJꎬetal.SynthesisofAllPossibleCanon ̄ical(3ᶄ ̄5ᶄ ̄Linked)CyclicDinucleotidesandEvaluationofRi ̄boswitchInteractionsandImmune ̄StimulatoryEffects[J].JAmChemSocꎬ2017ꎬ139(45):16154 ̄16160.[25]㊀RamanjuluJMꎬPesiridisGSꎬYangJꎬetal.Designofamidoben ̄zimidazoleSTINGreceptoragonistswithsystemicactivity[J].Natureꎬ2018ꎬ564(7736):439 ̄443.[26]㊀CorralesLꎬGlickmanLHꎬMcWhirterSMꎬetal.DirectActiva ̄tionofSTINGintheTumorMicroenvironmentLeadstoPotentandSystemicTumorRegressionandImmunity[J].CellRepꎬ2015ꎬ11(7):1018 ̄1030.[27]㊀KimSꎬLiLꎬMaligaZꎬetal.Anticancerflavonoidsaremouse ̄selectiveSTINGagonists[J].ACSChemBiolꎬ2013ꎬ8(7):1396 ̄1401.[28]㊀CavlarTꎬDeimlingTꎬAblasserAꎬetal.Species ̄specificdetec ̄tionoftheantiviralsmall ̄moleculecompoundCMAbySTING[J].EMBOJꎬ2013ꎬ32(10):1440 ̄1450.[29]㊀ZhangYꎬSunZꎬPeiJꎬetal.Identificationofalpha ̄MangostinasanAgonistofHumanSTING[J].ChemMedChemꎬ2018ꎬ13(19):2057 ̄2064.[30]㊀ZhangXꎬLiuBꎬTangLꎬetal.DiscoveryandMechanisticStudyofaNovelHuman ̄Stimulator ̄of ̄Interferon ̄GenesAgonist[J].ACSInfectDisꎬ2019ꎬ5(7):1139 ̄1149.[31]㊀BahrOꎬGrossSꎬHarterPNꎬetal.ASA404ꎬavasculardisrup ̄tingagentꎬasanexperimentaltreatmentapproachforbraintumors[J].OncolLettꎬ2017ꎬ14(5):5443 ̄5451.[32]㊀DowneyCMꎬAghaeiMꎬSchwendenerRAꎬetal.DMXAAcau ̄sestumorsite ̄specificvasculardisruptioninmurinenon ̄smallcelllungcancerꎬandliketheendogenousnon ̄canonicalcyclicdinucleotideSTINGagonistꎬ2ᶄ3ᶄ ̄cGAMPꎬinducesM2macro ̄phagerepolarization[J].PLoSOneꎬ2014ꎬ9(6):e99988. [33]㊀MukaiKꎬKonnoHꎬAkibaTꎬetal.ActivationofSTINGre ̄quirespalmitoylationattheGolgi[J].NatCommunꎬ2016ꎬ7:11932.[34]㊀HaagSMꎬGulenMFꎬReymondLꎬetal.TargetingSTINGwithcovalentsmall ̄moleculeinhibitors[J].Natureꎬ2018ꎬ559(7713):269 ̄273.[35]㊀HansenALꎬBuchanGJꎬRuhlMꎬetal.Nitro ̄fattyacidsareformedinresponsetovirusinfectionandarepotentinhibitorsofSTINGpalmitoylationandsignaling[J].ProcNatlAcadSciUSAꎬ2018ꎬ115(33):E7768 ̄E7775.[36]㊀LiSꎬHongZꎬWangZꎬetal.TheCyclopeptideAstinCSpecif ̄icallyInhibitstheInnateImmuneCDNSensorSTING[J].CellRepꎬ2018ꎬ25(12):3405 ̄3421.[37]㊀SiuTꎬAltmanMDꎬBaltusGAꎬetal.DiscoveryofaNovelcGAMPCompetitiveLigandoftheInactiveFormofSTING[J].ACSMedChemLettꎬ2019ꎬ10(1):92 ̄97.[38]㊀KonnoHꎬKonnoKꎬBarberGN.CyclicdinucleotidestriggerULK1(ATG1)phosphorylationofSTINGtopreventsustainedinnateimmunesignaling[J].Cellꎬ2013ꎬ155(3):688 ̄698. [39]㊀NiGꎬKonnoHꎬBarberGN.UbiquitinationofSTINGatlysine224controlsIRF3activation[J].ScienceImmunologyꎬ2017ꎬ2(11):eaah7119.[40]㊀SunHꎬZhangQꎬJingYYꎬetal.USP13negativelyregulatesan ̄tiviralresponsesbydeubiquitinatingSTING[J].NatCommunꎬ2017ꎬ8:15534.[41]㊀DobbsNꎬBurnaevskiyNꎬChenDꎬetal.STINGActivationbyTranslocationfromtheERIsAssociatedwithInfectionandAu ̄toinflammatoryDisease[J].CellHostMicrobeꎬ2015ꎬ18(2):157 ̄168.[42]㊀DunphyGꎬFlannerySMꎬAlmineJFꎬetal.Non ̄canonicalActi ̄vationoftheDNASensingAdaptorSTINGbyATMandIFI16MediatesNF ̄kappaBSignalingafterNuclearDNADamage[J].MolCellꎬ2018ꎬ71(5):745 ̄760.[43]㊀ClarkKꎬPlaterLꎬPeggieMꎬetal.UseofthepharmacologicalinhibitorBX795tostudytheregulationandphysiologicalrolesofTBK1andIkappaBkinaseepsilon:adistinctupstreamkinasemediatesSer ̄172phosphorylationandactivation[J].JBiolChemꎬ2009ꎬ284(21):14136 ̄14146.[44]㊀FremondMLꎬUggentiCꎬVanEyckLꎬetal.BriefReport:BlockadeofTANK ̄BindingKinase1/IKKvarepsilonInhibitsMu ̄tantStimulatorofInterferonGenes(STING) ̄MediatedInflamma ̄toryResponsesinHumanPeripheralBloodMononuclearCells[J].ArthritisRheumatolꎬ2017ꎬ69(7):1495 ̄1501. [45]㊀McIverEGꎬBryansJꎬBirchallKꎬetal.Synthesisandstructure ̄activityrelationshipsofanovelseriesofpyrimidinesaspotentin ̄hibitorsofTBK1/IKKepsilonkinases[J].BioorgMedChemLettꎬ2012ꎬ22(23):7169 ̄7173.[46]㊀ThomsonDWꎬPoeckelDꎬZinnNꎬetal.DiscoveryofGSK8612ꎬaHighlySelectiveandPotentTBK1Inhibitor[J].ACSMedChemLettꎬ2019ꎬ10(5):780 ̄785.(收稿日期:2020 ̄07 ̄04ꎻ㊀修回日期:2020 ̄08 ̄11)(责任编辑:缪㊀琴ꎻ㊀英文编辑:徐家宝)。
【国家自然科学基金】_parp-1抑制剂_基金支持热词逐年推荐_【万方软件创新助手】_20140803
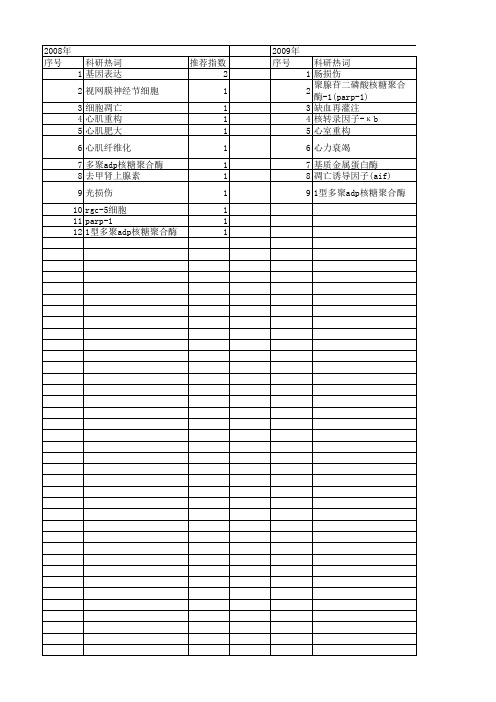
2013年 序号 1 2 3 4 5 7 8 9 10 11 12 13 14 15 16 17 18 19
科研热词 推荐指数 靶向治疗 1 重症急性胰腺炎 1 肾上腺皮质细胞 1 聚adp核糖聚合酶类 1 抑制剂 1 多聚腺苷二磷酸核糖聚合酶-1 1 多柔比星 1 增殖 1 基因表达 1 合成致死策略 1 前列腺癌 1 依托泊苷 1 乳腺肿瘤 1 三阴性乳腺癌 1 parp-1抑制剂 1 parp 1 nf-κ b 1 brca1蛋白 1 5-氨基异喹啉酮 1
2009年 序号 1 2 3 4 5 6 7 8 9
科研热词 肠损伤 聚腺苷二磷酸核糖聚合酶-1(parp-1) 缺血再灌注 核转录因子-κ b 心室重构 心力衰竭 基质金属蛋白酶 凋亡诱导因子(aif) 1型多聚adp核糖聚合酶
推荐指数 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4
科研热词 推荐指数 脑室周围白质软化 1 聚腺苷二磷酸核糖聚合酶 1 热休克蛋白60 1 少突胶质前体细胞 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
2011年 科研热词 推荐指数 黄酮 1 阿尔茨海默病 1 自噬 1 肝癌细胞 1 聚adp-核糖聚合酶-1 1 细胞凋亡 1 糖原合酶激酶-3 1 磷酸化 1 磷酰化 1 白杨素 1 标记 1 放射性核素 1 抗肿瘤药物 1 扫描电镜 1 微绒毛 1 基因,肿瘤抑制 1 半胱氨酸天冬氨酸蛋白酶3 1 凋亡 1 tau蛋白 1 parp-1抑制剂 1
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
七叶皂苷钠调控SIRT1

七叶皂苷钠调控SIRT 1/NF-κB 信号通路对帕金森病大鼠的神经保护作用Δ周慧敏*,陈静,欧诒丹,王御林,钟纯正 #(儋州市人民医院神经内科,海南 儋州 571700)中图分类号 R 965 文献标志码 A 文章编号 1001-0408(2024)06-0689-06DOI 10.6039/j.issn.1001-0408.2024.06.09摘要 目的 探究七叶皂苷钠通过调控沉默信息调节因子1(SIRT 1)/核因子κB (NF-κB )信号通路发挥对帕金森病大鼠的神经保护作用。
方法 采用6-羟基多巴胺注射法构建帕金森病大鼠模型,将建模成功的48只大鼠随机分为模型组、七叶皂苷钠低剂量组(1.8 mg/kg )、七叶皂苷钠高剂量组(3.6 mg/kg )、七叶皂苷钠+EX 527组(七叶皂苷钠3.6 mg/kg+SIRT 1抑制剂EX 527 5 mg/kg ),每组12只;另取12只健康大鼠作为假手术组。
各药物组大鼠腹腔注射相应药液,每天1次,持续21 d 。
末次给药结束24 h 后,检测大鼠运动及认知功能,观察其黑质区和海马组织CA 1区神经元形态,检测其黑质纹状体中多巴胺(DA )含量和黑质区酪氨酸羟化酶(TH )、α突触核蛋白(α-Syn )表达水平,检测其血清中促炎因子[白细胞介素6(IL-6)、IL-18]、抗炎因子(IL-10)水平及黑质纹状体中SIRT 1、磷酸化NF-κB p 65(p-NF-κB p 65)、NF-κB p 65蛋白表达水平。
结果 与假手术组比较,模型组大鼠黑质区和海马组织CA 1区神经元损伤严重;其旋转圈数、逃避潜伏期、黑质区α-Syn 蛋白表达水平、血清中促炎因子水平、黑质纹状体中p-NF-κB p 65与NF-κB p 65蛋白的相对表达量之比均显著升高或延长(P <0.05),目标象限停留时间、黑质纹状体中DA 含量及黑质区TH 蛋白表达水平、血清中抗炎因子水平、黑质纹状体中SIRT 1蛋白表达水平均显著缩短或降低(P <0.05)。
体外诱导内质网应激的常用方法和机制探讨

体外诱导内质网应激的常用方法和机制探讨敖娜【摘要】Endoplasine retirulum stress( ERs )is the basis of the pathophysiology of many diseases. In the cardiovascular, endocrine and metabolic*, neurological and other systems development and progression of the diseases, it has played an important role. In this context, in vitro induction of ERs is the key for further research. In recent years, lots of ERs indurers have been applied to the researchs, but their mechanisms are different. Understanding and mastering the mechanism and application of some common indurers can help to the studies of diseases which is associated with ERs.%内质网应激(ERs)是多种疾病的病理生理基础,在心血管、内分泌及代谢、神经等多种系统疾病的发生、发展过程中都扮演着重要角色,在此背景下,体外诱导ERs成为进一步研究的关键.近年来各项相关研究应用到的ERs诱导剂很多,其作用机制各不相同.了解及掌握一些常用ERs诱导剂的作用机制及适用范围,对与ERs相关疾病的体外研究有重要意义.【期刊名称】《医学综述》【年(卷),期】2012(018)022【总页数】4页(P3727-3730)【关键词】细胞;内质网应激;衣霉素;毒胡萝卜素;蛋白酶体抑制剂;非酯化脂肪酸【作者】敖娜【作者单位】中国医科大学附属第一医院内分泌科,沈阳,110001【正文语种】中文【中图分类】R34内质网应激(endoplasmic reticulum stress,ERs)是细胞内一种适应性机制,持续或过强的ERs则诱导细胞凋亡,造成组织损伤。
NF_B信号转导通路与胰岛素抵抗_薛冰

第14卷 第8期 2012 年 8 月辽宁中医药大学学报JOURNAL OF LIAONING UNIVERSITY OF TCMV ol. 14 No. 8 Aug .,2012胰岛素抵抗(insulin resistance,IR)是指外周组织(骨骼肌、脂肪和肝脏)对胰岛素的敏感性降低,表现为外周组织对葡萄糖的摄取和利用障碍,是2型糖尿病、代谢综合征、血脂紊乱和动脉粥样硬化的主要病理生理学机制。
目前研究认为,胰岛素抵抗是一个慢性亚临床炎症过程,在此过程中,炎症和胰岛素抵抗相互促动,导致机体内环境的一系列改变。
核因子-κB(nuclear factor-kappaB,NF-κB)在多种组织细胞中广泛存在,在细胞信号传导及基因表达调控中起重要作用,是炎症启动、调节的关键核因子,其介导的炎症反应是近年来有关胰岛素抵抗机制研究的热点之一。
本文就NF-κB 信号转导通路与胰岛素抵抗的研究进展做简要综述。
1 NF-κB信号转导通路概述NF-κB 信号转导通路主要包括NF-κB、NF-κB 抑制蛋白( inhibitory nuclear factor-kappa B,IκB)和IκB 激酶( IκB kinase,IKK)。
1986年,Sen 和Baltimore 应用凝胶电泳迁移率分析实验,首先报道了在B 细胞核提取物中,存在一种能与免疫球蛋白κ轻链基因的增强子κB 序列(GGGACTTTCC)特异结合的核蛋白因子,称之为NF-κB [1]。
NF-κB 属于Rel 蛋白家族,目前在哺乳动物细胞中已发现有5种成员,它们分别是RelA (p65)、RelB、c-Rel、NF-κB1(p50)、NF-κB2(p52),在其氨基末端均含有一个由300个氨基酸组成的Rel 同源结构域,内含DNA 结合域、二聚化域、IκB 结合域和核定位信号域,其中RelA、RelB 和c-Rel 的C 端还含有转录活化结构域。
TNIP1在人自身免疫疾病中的功能及作用机制

TNIP1在人自身免疫疾病中的功能及作用机制肿瘤坏死因子诱导蛋白3相互作用蛋白1(TNIP1),又称A20结合抑制NF-κB 激活因子(ABIN1)。
TNIP1既能结合抑制跨膜受体如TNF-αR、EGFR和TOLL 样受体,又能结合抑制核受体如PPAR、RAR。
现在,TNIP1的研究主要集中于TNIP1在炎症和自身免疫疾病如银屑病、系统性红斑狼疮和类风湿性关节炎等疾病中的作用机制研究,本文综述TNIP1在人自身免疫疾病中的功能、作用机制及研究进展。
[Abstract]TNFAIP-interacting protein 1 (TNIP1)also called A20-binding inhibitor of NF-κB ctivation (ABIN1),and TNIP1 can combine and inhibit transmembrane receptors,such as TNF-αR,EGFR and TOLL sample receptor,and it can combine and inhibit nuclear receptor,such as PPAR and RAR.Current studies mainly focus on function and molecular pathways of TNIP1 on inflammation and autoimmune diseases,such as psoriasis vulgaris,rheumatoid arthritis and systemic lupus erythematosus.This view summarized recent studies following the function and mechanism of TNIP1 in human autoimmune diseases.[Key words]TNIP1;A20;TNFα;NF-κB;Autoimmune disease自身免疫的疾病(autoimmune disease)是指自身組织或器官与自身的抗原发生应答反应造成自身器官或组织的损害,如银屑病(psoriasis vulgaris)、系统性红斑狼疮(systemic lupus erythematosus,SLE)和类风湿性关节炎(rheumatoid arthritis,RA)等许多疾病相继被列为自身免疫性疾病。
多黏菌素B通过下调NF-κB抑制HBV转录复制的机制研究

多黏菌素B 通过下调NF -κB 抑制HBV 转录复制的机制研究*孟凡荣1, 陈琛2, 潘红丽2, 李雪冰2△(1天津医科大学总医院妇产科,天津市女性生殖健康与优生重点实验室,天津 300052;2天津市肺癌转移与肿瘤微环境重点实验室,天津市肺癌研究所,天津医科大学总医院肺部肿瘤外科,天津 300052)[摘要] 目的:研究多黏菌素B 通过下调核因子κB (nuclear factor -κB , NF -κB )对乙型肝炎病毒(hepatitis Bvirus , HBV )转录和复制的影响。
方法:通过MTT 法检测多黏菌素B 在HepG2-NTCP 、HepAD38、HepG2.2.15、HepG2、Huh -7和PLC/PRF/5细胞中的细胞毒性;使用10、50和100 nmol/L 的多黏菌素B 处理HBV 感染的HepG2-NTCP 细胞和HBV 稳定复制的HepG2.2.15细胞,通过RT -qPCR 方法检测细胞中HBV RNA 和HBV DNA 水平,ELISA 方法检测细胞上清中乙型肝炎表面抗原(hepatitis B surface antigen , HBsAg )和乙型肝炎e 抗原(hepatitis B e antigen , HBeAg )水平,明确多黏菌素B 对HBV 的调控作用。
利用转录组测序筛选多黏菌素B 调控HBV 转录复制的效应分子NF -κB ;同时检测敲减及过表达NF -κB 对HBV 的调控作用;利用双萤光素酶报告基因实验检测NF -κB 对Cp 、Xp 、Sp1和Sp2启动子活性的影响;利用回补实验探究多黏菌素B 调控HBV 转录复制是否依赖于NF -κB 。
结果:MTT 实验结果显示,浓度低于100 µmol/L 时,多黏菌素B 对HepG2-NTCP 、HepAD38、HepG2.2.15、HepG2、Huh -7和PLC/PRF/5细胞无明显毒性。
APE1通过NF-κB通路调节结直肠癌PD-L1表达和细胞增殖

APE1通过NF-κB通路调节结直肠癌PD-L1表达和细胞增殖吉祖进; 张志云; 高燕; 雷新益【期刊名称】《《华中科技大学学报(医学版)》》【年(卷),期】2019(048)004【总页数】7页(P393-399)【关键词】结直肠癌; 脱嘌呤/脱嘧啶核酸内切酶1; 程序性死亡配体-1; 细胞增殖【作者】吉祖进; 张志云; 高燕; 雷新益【作者单位】国药东风总医院结直肠肛门外科十堰442008; 湖北省十堰市太和医院湖北医药学院附属医院PET中心十堰442008【正文语种】中文【中图分类】R73.35结直肠癌(colorectal cancer)在我国发病率和死亡率仅次于肺癌、胃癌、食管癌等常见恶性肿瘤,居癌症相关死因第5位[1]。
近年来随着居民饮食结构的变化,结直肠癌发病率呈显著上升趋势[1]。
结直肠癌的发生、进展是一个多步骤演进过程,包括上皮细胞的增殖、迁移、分化,其涉及的调控基因以及介导的信号通路异常复杂。
脱嘌呤/脱嘧啶核酸内切酶1(apurinic/aprimidinic endonuclease 1,APE1)为一种核蛋白,在DNA损伤修复过程中发挥重要作用。
APE1又称为氧化还原因子(redox factor 1,Ref-1),多种转录因子与DNA的结合活性受其调控,APE1参与肿瘤细胞凋亡、氧化应激、转移等过程[2],在骨肉瘤[3]、宫颈癌[4]、结肠癌[5]等多种肿瘤组织中呈高表达,并对患者预后造成影响。
研究发现,APE1可通过调节转录因子活性参与程序性死亡配体-1(programmed death ligand-1,PD-L1)的表达调控[6],调节肿瘤细胞免疫逃逸进程。
虽然目前对APE1调控PD-L1的机制依然不清楚,但有研究显示NF-κB活性受到抑制时,PD-L1的表达下降,提示NF-κB信号通路可能与PD-L1有关。
本研究分别观察结直肠癌组织和细胞APE1表达,并从NF-κB通路分析APE1在结直肠癌中对PD-L1的可能调控机制,旨在为结直肠癌发病机制的研究提供参考。
【国家自然科学基金】_nf-κb抑制剂_基金支持热词逐年推荐_【万方软件创新助手】_20140730

2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
科研热词 核因子-κ b nf-κ b 脂多糖 肿瘤坏死因子-α 细胞凋亡 巨噬细胞 细胞间粘附分子-1 睾酮 核转录因子κ b 核转录因子-κ b 无再流现象 急性心肌梗死 基质金属蛋白酶 信号转导 p-选择素 nf-kb bay11-7082 黏附分子 黏蛋白-2 骨桥蛋白质 靶向治疗 阿托伐他汀 钠通道 过氧化物酶增殖体激活受体γ 跟腱损伤 调控 补阳还五汤 衔接蛋白质类,信号转导 血管紧张素转换酶 血管紧张素ⅱ1型受体 血管内皮细胞 蟾蜍灵 蛋白激酶cα 自细胞介素1 膜蛋白 脑肿瘤 脂细胞 脂多糖类 胰岛β 细胞 胃癌 肿瘤坏死因子 肿瘤 肾脏近端小管上皮细胞 肺泡上皮细胞 肠上皮化生 肝星状细胞 聚合酶链反应 缺氧诱导因子1 缺氧 细菌脂多糖 细胞间黏附分子1 细胞增殖
53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106
烧伤 炎症介质 炎症 激活蛋白-1 淫羊藿总黄酮 淋巴细胞 氧化应激 气道上皮细胞 棕榈酸 核转录因子-κ b(nf-κ b) 核转录因子-κ b 核因子kb 核因子-κ b 新靶点 放射疗法 成骨细胞 慢性肾功能衰竭 急性肺损伤 心肌梗死 巨噬细胞 大鼠肾小球系膜细胞株hbzy-1 大鼠 大豆蛋白酶抑制剂 增殖 基质金属蛋白酶9 喉肿瘤 吡咯烷类 吡咯烷二硫氨基甲酸酯 吡咯烷二硫代氨基甲酸盐 卵巢肿瘤 单核细胞趋化蛋白1 半胱天冬蛋白酶-3 前列腺素e类 前列腺素e2 冠状病毒属 内毒素 免疫衰老 二硫代氨基甲酸吡咯烷 二氧化硫 主动脉 严重急性呼吸综合征 丝裂原活化蛋白激酶 ⅰ型多聚adp核糖合成酶 s蛋白 pkcε pi3k/akt p38丝裂原活化蛋白激酶类 p38丝裂原活化蛋白激酶 p38 nf-к b受体活化凶子配体 nf-κ b通路 nf-kb/ikb nf-kb mapk信号转导通路
26429413_丹酚酸B的药理作用研究进展

㊀基金项目:华北理工大学博士科研启动基金项目(No.28418499)ꎻ∗同为通信作者㊀作者简介:魏西羽ꎬ女ꎬ研究方向:药物检测与分析ꎬE-mail:873664257@qq.com㊀通信作者:李伟ꎬ男ꎬ博士研究生ꎬ研究员ꎬ研究方向:药物分析与药物代谢动力学ꎬTel:0315-8805806ꎬE-mail:liwei@ncst.edu.comꎻ于德红ꎬ女ꎬ博士研究生ꎬ副教授ꎬ研究方向:中药药效物质基础ꎬTel:0315-8819008ꎬE-mail:ydh613@163.com丹酚酸B的药理作用研究进展魏西羽ꎬ杨婷ꎬ刘厚汝ꎬ孙越ꎬ张臻臻ꎬ李伟∗ꎬ于德红∗(华北理工大学药学院ꎬ河北唐山063200)摘要:丹酚酸B作为丹参的有效水溶性成分ꎬ是当前丹参中研究最多的成分之一ꎮ研究发现ꎬ丹酚酸B在心脑血管方面的药理作用机制较为广泛ꎮ近年来ꎬ随着深入的研究与拓展ꎬ丹酚酸B在抗氧化㊁抗肝脏纤维化㊁降血压㊁降血糖㊁抗衰老㊁抗肿瘤等方面可能具有广阔的应用前景ꎮ本文鉴于近些年来发表的文献ꎬ对丹酚酸B的药理作用进行总结分析ꎬ旨在为其进一步研究提供思考ꎮ关键词:丹酚酸Bꎻ药理作用ꎻ研究进展中图分类号:R285㊀文献标识码:A㊀文章编号:2095-5375(2021)11-0748-005doi:10.13506/j.cnki.jpr.2021.11.011ResearchprogressonpharmacologicaleffectsofsalvianolicacidBWEIXiyuꎬYANGTingꎬLIUHouruꎬSUNYueꎬZHANGZhenzhenꎬLIWei∗ꎬYUDehong∗(SchoolofPharmacyꎬNorthChinaUniversityofScienceandTechnologyꎬTangshan063200ꎬChina)Abstract:SalvianolicacidBꎬasaneffectivewater-solublecomponentofSalviamiltiorrhizaꎬisoneofthemoststudiedcomponentsinSalviamiltiorrhiza.StudieshavefoundthatsalvianolicacidBhasawiderangeofpharmacologicalmechanismsincardiovascularandcerebrovascularaspects.Inrecentyearsꎬwithin-depthresearchanddevelopmentꎬsalvian ̄olicacidBmayhavebroadapplicationprospectsinantioxidantꎬantiliverfibrosisꎬantihypertensiveꎬhypoglycemicꎬanti-ag ̄ingꎬanti-tumorandotheraspects.InviewoftheliteraturepublishedinrecentyearsꎬthispapersummarizesandanalyzesthepharmacologicaleffectsofsalvianolicacidBꎬaimingtoprovidesomethoughtsforitsfurtherresearch.Keywords:SalvianolicacidBꎻPharmacologicaleffectsꎻResearchprogress㊀㊀丹参是我国的一种传统中药ꎬ是唇形科植物丹参(SalviamiltiorrhizaBge.)的干燥根及根茎ꎬ丹参始载于«神农本草经»被列为上品ꎮ丹酚酸B是丹参的主要水溶性复合物之一ꎬ是丹参总酚酸含量最高㊁活性最强的成分ꎮ丹酚酸B又称为丹参酚酸乙ꎬ是由三分子3ꎬ4-二羟基苯基乳酸和一分子咖啡酸缩合而成的一低聚体型化合物ꎬ是目前研究最多的酚酸之一ꎮ丹酚酸B的药理活性已经得到了多方面的证实ꎬ现就丹酚酸B的主要药理作用进行综述ꎬ为后续临床应用及研究提供参考ꎮ1㊀心血管保护1.1㊀抗氧化㊀研究表明丹酚酸B能够清除氧自由基㊁抑制脂质过氧化反应ꎬ是已知的具有较强抗氧化作用的天然产物之一ꎮQuan等[1]发现丹酚酸B可以改善大鼠组织病理学损害ꎬ防止血清肌酸激酶(CK-MB)㊁心肌肌钙蛋白(cTnI)和乳酸脱氢酶(LDH)的渗漏ꎬ还能显著提高大鼠过氧化氢酶(CAT)㊁谷胱甘肽过氧化物酶(GSH-Px)和还原型谷胱甘肽(GSH)活性ꎮ在体外实验中ꎬ丹酚酸B还降低了培养上清液中LDH的活性和心肌细胞内活性氧(ROS)和丙二醛(MDA)水平ꎬ对心肌细胞凋亡起到一定的保护作用ꎬ也有助于提高其抗氧化性能ꎮ刘晓龙等[2]通过建立大鼠脓毒血症模型ꎬ采用酶联免疫吸附测定(ELISA)检测肌钙蛋白T(TnT)㊁肌酸激酶同工酶(CK-MB)㊁白介素-6(IL-6)水平ꎬ比色法检测超氧化物歧化酶(SOD)的活性和MDA的含量ꎬ观察各组心肌组织病理变化ꎬ检测凋亡相关蛋白半胱氨酸蛋白-3(caspase-3)㊁B淋巴细胞瘤-2(Bcl-2)㊁Bcl-2相关X蛋白(Bax)等表达水平ꎮ发现丹酚酸B通过影响自噬蛋白ꎬ抑制大鼠体内氧自由基的释放ꎬ增强抗氧化应激的能力ꎮ1.2㊀抗心肌缺血再灌注损伤㊀Liu等[3]通过建立大鼠心肌缺血再灌注模型ꎬ检测其心功能㊁梗死面积㊁心肌损伤标志物水平㊁炎症反应㊁心肌细胞凋亡及Bcl-2㊁Bax㊁磷酸化蛋白激酶B(P-Akt)㊁高迁移率组蛋白1(HMGB1)㊁Toll样受体4(TLR4)的表达发现丹酚酸B可以通过激活磷酸肌醇3-激酶(PI3K)㊁蛋白激酶B(PKB)信号的通路来抑制HMGB1和TLR4的表达保护心脏ꎮ夏杨等[4]发现大鼠心肌缺血再灌注损伤(MI/RI)的模型组与丹酚酸B预处理给药组相比ꎬ丹酚酸B预处理给药组增强了心肌细胞中Ca2+-Mg2+-ATP酶和Na+-K+-ATP酶活性ꎬ丹酚酸B通过纠正心肌细胞内外离子失衡尤其是调整Ca2+稳态ꎬ改善了心肌细胞的能量代谢障碍ꎬ阻止了MI/RI的进一步加重ꎮ1.3㊀对心脏微血管内皮细胞的保护㊀心脏处于缺血缺氧状态时ꎬ心脏微血管内皮细胞最易受到损害ꎮ大鼠MI/RI过程中ꎬ丹酚酸B可以抑制各种炎症因子释放ꎬ降低内皮细胞间的黏附分子的表达ꎬ起到了保护内皮细胞的作用ꎮWang等[5]采用脂多糖(LPS)作用于大鼠心肌细胞ꎬ使其产生炎症ꎬ然后用丹酚酸B处理ꎬ结果表明与模型组相比ꎬ该处理组LDH㊁HMGB1和TLR4㊁核因子-κB(NF-κB)和肿瘤坏死因子-α(TNF-α)表达水平均下降ꎬ提示丹酚酸B可以通过发挥抗炎功能来保护心脏内皮细胞ꎬ保护心脏免受损伤ꎮ1.4㊀抗动脉粥样硬化㊀丹酚酸B能够有效抑制铜离子诱导的低密度脂蛋白(LDL)氧化修饰作用ꎬ对预防治疗动脉粥样硬化具有重要的意义[6]ꎮ张扬等[7]用高脂饮食制备家兔动脉粥样硬化模型ꎬ经丹酚酸B给药后ꎬ家兔主动脉肿瘤坏死因子相关激活蛋白(CD40L)ꎬ血清可溶性血管细胞黏附分子-1(sVCAM-1)㊁及金属基质蛋白酶-9(MMP-9)的蛋白表达降低ꎬ主动脉内膜与中膜厚度的比值也降低ꎬ其机制可能与抑制CD40-CD40配体信号通路有关ꎮXu等[8]将人脐静脉内皮细胞用丹酚酸B预处理ꎬ然后与二磷酸腺苷(ADP)活化的血小板共培养ꎬ观察了血小板与内皮细胞的黏附程度ꎮ结果表明ꎬ丹酚酸B剂量依赖性地抑制ADP或促凝血酶诱导的人血小板在富血小板血浆(PRP)样本中的聚集ꎮ丹酚酸B除了对血小板的活化有抑制作用外ꎬ即使血小板已经被激活ꎬ也能减弱内皮细胞中血小板介导的炎症反应ꎬ因此推断丹酚酸B可能是治疗各种动脉粥样硬化疾病的潜在候选药物ꎮ1.5㊀抗细胞凋亡㊀研究发现ꎬ丹酚酸B能诱导心血管内膜的细胞凋亡ꎬ防止心血管内皮的增厚ꎮXu等[9]对急性心肌梗死(AMI)大鼠给予丹酚酸B治疗后发现丹酚酸B可以抑制多聚腺苷二磷酸核糖聚合酶-1(PARP-1)通路ꎬ改善大鼠心肌组织线粒体和细胞核的完整性ꎬ抑制心肌细胞凋亡ꎮ王翅遥等[10]通过建立糖尿病(DM)模型发现丹酚酸B可能通过激活烟酰胺腺嘌呤二核苷酸依赖性酶(SIRT1)表达ꎬ抵抗由高糖培养诱导的心肌细胞氧化应激性损伤ꎬ以及心肌细胞凋亡ꎮ2 脑保护2.1㊀抗脑缺血损伤㊀王国军等[11]建立大脑中动脉局灶性栓塞模型ꎬ经丹酚酸B治疗后ꎬ大鼠的神经功能缺损症状得到缓解ꎬ大鼠后脑组织梗死体积减小ꎬ脑含水量和脑指数降低ꎮWang等[12]采用体外缺氧缺糖/复氧复糖(OGD/R)模型和大脑中动脉闭塞(MCAO)模型ꎬ发现丹酚酸B能显著提高OGD/R损伤后PC12细胞和初级皮质神经元的存活率ꎬ改善了原代皮层神经元核心抗原(NeuN)的释放ꎬ阻断TLR4也抑制NF-κB转录活性和促炎细胞因子反应ꎮZhu等[13]建立大鼠脑缺血再灌注损伤模型发现丹酚酸B的新衍生物可以增加促红细胞生成素(EPO)㊁促红细胞生成素受体(EPOR)㊁磷酸化非受体型酪氨酸蛋白激酶(P-JAK2)㊁磷酸化信号转导子和转录激活子3(P-STAT3)水平ꎬ从而减轻脑缺血再灌注损伤对脑的影响ꎬ改善神经功能ꎬ增加神经元存活率ꎬ促进血管生成ꎬ这种保护机制可能归因于JAK2/STAT3通路中VEGF表达的增加ꎬ该通路被脑内EPO/EPOR表达的增加激活ꎮ2.2㊀神经保护㊀丹酚酸B的神经保护作用是通过抗炎ꎬ抗氧化作用发挥的[14]ꎮLee等[15]发现丹酚酸B改善了Aβ25-35肽诱导的记忆障碍ꎬ减少了炎症过程中胶质细胞的数量ꎬ挽救了胆碱乙酰转移酶和脑源性神经营养因子蛋白水平的下降ꎬ从而对Aβ25-35肽诱导的阿尔兹海默氏病的小鼠具有神经保护作用ꎮWang等[16]发现丹酚酸B通过抑制TLR4/髓系分化因子88(MyD88)途径ꎬ可以缓解小鼠脊髓损伤后的神经痛ꎬ降低足爪机械阈值和退出热潜伏期ꎬ抑制炎性细胞因子TNF-α和神经肽P物质的释放ꎬ减轻脊髓损伤后神经性疼痛和机械性痛觉过敏ꎮWang等[17]发现丹酚酸B预处理减弱了活化的小胶质细胞对共培养神经元的细胞毒性ꎬ结果表明丹酚酸B可通过抑制小胶质细胞的活化来保护神经元ꎮ2.3㊀抗抑郁㊀丹酚酸B可能通过抑制神经炎症从而发挥抗抑郁的作用[18]ꎮZhang等[19]发现丹酚酸B可以通过神经炎性途径改善慢性轻度应激(CMS)诱导的小鼠抑郁样行为ꎬ给予丹酚酸B后可以降低CMS小鼠的蔗糖偏爱率ꎬ显著缩短小鼠强迫游泳试验和尾吊试验的静止时间ꎬ结果表明丹酚酸B对CMS诱导的抑郁小鼠具有较强的抗抑郁作用ꎮLiao等[20]通过连续28d给予丹酚酸Bꎬ成功地纠正了CMS大鼠抑郁模型的抑郁样行为ꎬ结果发现丹酚酸B逆转了CMS对Nrf2(调控细胞氧化应激反应的重要转录因子)信号通路的抑制ꎬ同时增加了醌氧化还原酶(NQO-1)和血红素加氧酶1(HO-1)的mRNA表达ꎮ在内质网应激标记物方面ꎬ经丹酚酸B处理后ꎬ葡萄糖调节蛋白78(GRP78)的表达也显著降低ꎮ此外ꎬSIRT1/磷酸化腺苷酸活化蛋白激酶(pAMPK)信号通路的表达也明显增加ꎬ说明补充pAMPK可以有效地激活腺苷酸激活蛋白激酶(AMPK)信号通路的表达ꎮ丰毅等[21-22]发现丹酚酸B在强迫游泳㊁糖水偏好㊁尾吊实验中都表现出了抗抑郁的作用ꎬ抑制了皮层促炎症细胞因子ꎬ减小了小胶质细胞介导的神经炎症ꎮ2.4㊀改善学习记忆功能㊀鞠爱春等[23]建立脑缺血模型ꎬ经丹酚酸B鼻腔给药后能降低脑缺血损伤大鼠的平均逃避潜伏期ꎬ延长了脑缺血损伤大鼠在原平台象限停留时间ꎬ增加了脑缺血损伤大鼠跨越原平台的次数ꎬ结果表明丹酚酸B鼻腔给药在大脑的海马组织有一定的药物分布ꎬ能显著改善脑缺血损伤导致的学习记忆能力ꎮ吴甜莺等[24]发现电针联合丹酚酸B治疗有助于抑制由D-半乳糖引发的中枢神经系统免疫炎性反应ꎬ改善衰老大鼠的学习记忆能力ꎮ3㊀抗纤维化3.1㊀抗肝纤维化㊀各种慢性肝病向肝硬化发展都要经过肝纤维化这一阶段ꎬ这是所有肝脏疾病的常见病理特征ꎮ研究发现丹酚酸B可以抑制肝星状细胞的增殖与分化ꎬ抑制转化生长因子在肝星状细胞中信号的转导ꎮ王育红等[25-26]建立大鼠的肝纤维化模型ꎬ经丹酚酸B治疗后大鼠血清谷丙转氨(ALT)㊁谷草转氨酶(AST)降低ꎬ大鼠肝脏胶原纤维减少ꎬ大鼠的肝组织SOD活性及GSH含量升高ꎬMDA和转化生长因子β1(TGF-β1)含量降低ꎬ结果表明丹酚酸B具有抗四氯化碳诱导大鼠肝纤维化及氧化损伤的作用ꎮ刘建国等[27]将大鼠随机分为3组采用自动生化分析仪检测肝功能ꎬ用放射免疫法和基质染色法测定血清和血浆中内毒素含量ꎬ采用RNA的反转录(RT)和cDNA的聚合酶链式扩增(PCR)相结合的技术(RT-PCR)和免疫组化法检测大鼠肝组织CD14mRNA和蛋白的表达ꎬ比较各组肝组织病理改变ꎬ结果显示ꎬ丹酚酸B抗大鼠肝纤维化的作用机制可能与其降低肝组织CD14的表达㊁阻滞内毒素信号转导通路有关ꎮ3.2㊀抗肺纤维化㊀肺纤维化是一类以间质性炎症和肺间质纤维化为主要病变的间质性肺疾病ꎮTGF-β1是一种多功能生长因子ꎬ影响细胞增殖㊁分化等重要生理过程ꎮLiu等[28]发现丹酚酸B是中药处方中重要的抗纤维化成分ꎬ其通过抑制炎症细胞的浸润ꎬ抑制肺泡结构的破坏ꎬ抑制在体内和体外TGF-β1信号传导途径来减轻实验性肺纤维化ꎮLiu等[29]发现丹酚酸B对TGF-β1诱导的人胚肺成纤维细胞(MRC-5)具有保护作用ꎬ其机制之一可能是丹酚酸B能在蛋白和mRNA水平上调节Nrf2的表达ꎬ并在体外诱导Nrf2核易位ꎮZhang等[30]发现丹酚酸B可抑制血清转化生长因子(STGF-β1)诱导的细胞增殖㊁I型胶原的表达㊁内源性TGF-β1的产生和肺成纤维细胞中α-平滑肌肌动蛋白(α-SMA)的表达ꎬ其机制可能是丹酚酸B抑制肝星状细胞(HSC)增殖和胶原生成ꎬ降低细胞TGF-β1自分泌和丝裂原活化蛋白激酶(MAPK)活性ꎮ3.3㊀抗肾纤维化㊀肾纤维化是各种病因引起的进行性肾病的重要病症ꎬ也是各种慢行肾病最终发展到肾衰竭的共同通路[31]ꎮ蔡洲等[32]发现经丹酚酸B治疗后ꎬ大鼠肾纤维化程度减轻㊁炎性细胞浸润减少ꎬ其作用机制可能与下调肾组织中TGF-β1㊁结缔组织生长因子(CTGF)表达ꎬ调节TGF-β1/CTGF信号通路相关ꎮ黄小娟等[33-34]发现在输尿管梗阻导致的肾组织纤维化中ꎬ丹酚酸B可通过下调雷帕霉素靶蛋白(mTOR)ꎬ进一步激活自噬ꎬ减轻肾组织损伤ꎬ降低UUO(单侧输尿管结扎)小鼠血肌酐和尿素氮水平ꎬ也可减轻肾组织病理性损伤ꎬ减少胶原纤维沉积ꎮ4㊀降血压丹酚酸B通过降低血浆肾素(PRC)㊁血管紧张素Ⅱ(AngⅡ)㊁甘油三酯(TG)㊁MDA的含量ꎬ升高心素钠含量[35]来降低血压ꎮ徐斌等[36]发现与模型组比较ꎬ丹酚酸B组大鼠血压显著降低(P<0.05)且大鼠病变血管的数量也显著降低ꎬ病变程度较轻ꎬ表明丹酚酸B可以改善高血压大鼠的病情ꎬ且能够抑制高血压血管重塑ꎮLing等[37]发现口服丹酚酸B可逆转AngⅡ诱导的小鼠动脉收缩压升高ꎬ增强灌注小鼠的主动脉和肾动脉的内皮依赖性舒张作用ꎬ并减弱了过度的内皮依赖性收缩作用ꎮ此外ꎬ丹酚酸B的治疗使AngⅡ灌注小鼠动脉中AT1受体㊁NADPH氧化酶亚基(NOx-2和NOx-4)和硝基酪氨酸水平的升高正常化ꎬ从而达到降血压的效果ꎮ5㊀降血糖研究发现丹酚酸B对多种低剂量链脲佐菌所诱导的大鼠糖尿病具有抵抗作用ꎬ其作用机制可能与丹酚酸B减轻氧化应激和细胞凋亡ꎬ增强抗氧化系统有关[38]ꎮShi等[39]发现丹酚酸B能改善肥胖症小鼠的糖耐量ꎬ降低血清ALT㊁AST和碱性磷酸酶(ALP)水平以及免疫球蛋白结合蛋白(BiP)和C/EBP同源蛋白(CHOP)的转录㊁胰岛素敏感性胰岛素受体底物1(IRS-1)的磷酸化ꎮ陶善珺等[40]用糖尿病血糖波动建立的模型观察到大鼠的空腹血糖㊁糖化血红蛋白及血清和胰腺组织MDA水平显著升高ꎬ糖尿病大鼠的胰岛数量减少ꎬ其作用机制可能与丹酚酸B上调胰十二指肠同源框因子-1(PDX-1)蛋白表达水平ꎬ抑制胰岛细胞凋亡有关ꎮ周才杰等[41]用高糖高脂加链脲佐菌素建立实验性2型糖尿病的大鼠模型ꎬ采用胰岛素耐量和葡萄糖耐量等实验评价模型动物的胰岛素敏感性ꎬ发现丹酚酸B对实验性2型糖尿病大鼠模型有降低血糖ꎬ调节血脂ꎬ改善胰岛素抵抗的作用ꎮ6㊀其他作用6.1㊀抗衰老㊀徐艺丹[42]发现H2O2诱导的细胞经丹酚酸B处理后ꎬ提取其RNAꎬ采用实时荧光定量实验检测的方法测定SOD1㊁SOD2㊁编码维生素D3的核激素受体(VDR)和视黄酸受体基因(RARG)等抗氧化基因的表达量ꎬ结果发现丹酚酸B虽不抑制人类永生化表皮细胞(HaCaT)的增殖ꎬ但丹酚酸B通过上调SOD1㊁SOD2㊁VDR的表达来抑制H2O2诱导的HaCaT细胞衰老ꎮ6.2㊀皮肤保护㊀周湘君等[43]同时建立小鼠皮肤体外细胞培养紫外线损伤模型和紫外照射所致皮肤衰老的小鼠模型ꎬ给予不同剂量的丹酚酸B后ꎬ发现可以有效缓解紫外线引起的细胞致死性损伤ꎬ结果证实丹酚酸B能起到抑制皮肤光老化的作用ꎮGuo等[44]建立以咪喹莫特诱导的银屑病样皮肤模型ꎬ经丹酚酸B微乳液治疗后ꎬ减轻了银屑病的严重程度ꎬ减少了棘皮症ꎬ并且抑制了IL-23㊁IL-17细胞因子和表皮增生ꎬ增强了皮肤的水合作用ꎬ也可治疗银屑皮肤病ꎮ6.3㊀抗肿瘤㊀丹酚酸B作为一种有效㊁安全的天然抗肿瘤药物ꎬ在对肿瘤的预防和治疗中具有重要意义ꎮWang等[45]发现经丹酚酸B治疗后可以显著降低人胶质瘤细胞U87细胞的存活率ꎬ其对U87胶质瘤细胞生长的抑制作用可能与p38活化介导的ROS生成有关ꎮKatary等[46]观察到丹酚酸B可以减少人乳腺癌细胞的增殖ꎬ经丹酚酸B治疗后可以减小肿瘤的体积㊁增加了凋亡标志物caspase-3和人体抑癌基因P53的表达ꎬ结果表明丹酚酸B是通过增强细胞凋亡和减少氧化应激㊁炎症和血管的生成来减缓乳腺癌细胞的生长过程ꎬ证实了其抗肿瘤作用ꎮ7 总结与展望丹参是一种广泛应用于治疗慢性血管病的中草药ꎬ是国内外中药研究的热点之一ꎬ它含有多种具有广泛生物活性的化学复合物ꎮ丹酚酸B是其主要活性成分之一ꎬ对心㊁脑㊁肝㊁肺㊁肾等多个器官都具有保护作用ꎬ但由于其生物利用度较低ꎬ近年来对其制剂ꎬ含量测定以及临床应用的研究成了研究热点ꎬ如何将理论研究更多的转化为临床实际应用ꎬ是需要共同破解的难题ꎮ丹酚酸B在心脑血管的药理作用研究较为广泛ꎬ并且效果显著ꎬ作为注射用丹酚酸的主要成分已广泛应用于临床ꎬ关于对其他方面的药理作用还需要大量㊁规范的科学指导及临床试验ꎬ去深入探讨其作用机制ꎬ为以后开发新药及临床研究奠定基础ꎮ参考文献:[1]㊀QUANWꎬYINYꎬXIMMꎬetal.Antioxidantpropertiesofmagnesi ̄umlithospermateBcontributetothecardioprotectionagainstmyo ̄cardialischemia/reperfusioninjuryinvivoandinvitro[J].JTraditChinMedꎬ2013ꎬ33(1):85-91.[2]刘晓龙ꎬ崔子林ꎬ李阳ꎬ等.丹酚酸B对脓毒症大鼠心肌损伤的保护作用[J].中国实验方剂学杂志ꎬ2019ꎬ25(14):112-118. [3]LIUHQꎬLIUWꎬQIUHLꎬetal.SalvianolicacidBprotectsagainstmyocardialischaemia-reperfusioninjuryinratsviainhibitinghighmobilitygroupbox1proteinexpressionthroughthePI3K/Aktsig ̄nallingpathway[J].NaunynSchmiedebergsArchPharmacolꎬ2020ꎬ393(8):1527-1539.[4]夏杨ꎬ张惠军ꎬ聂亚莉.丹酚酸B预处理对心肌缺血/再灌注损伤能量代谢的影响[J].药物评价研究ꎬ2018ꎬ41(12):84-87. [5]WANGJꎬZHANGYꎬGUOLLꎬetal.SalvianolicacidBinhibitstheTLR4-NFκB-TNFαpathwayandattenuatesneonatalratcardio ̄myocyteinjuryinducedbylipopolysaccharide[J].ChinJIntegrMedꎬ2011ꎬ17(10):775-779.[6]YANGTLꎬLINFYꎬCHENYHꎬetal.SalvianolicacidBinhibitslow-densitylipopr-oteinoxidationandneointimalhyperplasiainendothelium-denudedhypercholesterolaemicrabbits[J].JSciFoodAgricꎬ2011ꎬ91(1):134-141.[7]张扬ꎬ薛凌.丹酚酸B对动脉粥样硬化CD40-CD40配体信号通路的影响[J].中国医学工程ꎬ2012ꎬ20(11):6-7.[8]XUSXꎬZHONGAQꎬBUXK.SalvianolicacidBinhibitsplatelets-mediatedinflammatoryresponseinvascularendothelialcells[J].ThrombResꎬ2015ꎬ135(1):137-145.[9]XULLꎬDENGYPꎬFENGLXꎬetal.Cardio-ProtectionofSalvi ̄anolicAcidBthroughInhibitionofApoptosisNetwork[J].PLoSOneꎬ2011ꎬ6(9):e24036.[10]王翅遥ꎬ张传朋ꎬ张会涛ꎬ等.丹酚酸B改善糖尿病心肌损伤的机制研究[J].山西医科大学学报ꎬ2020ꎬ51(4):320-326. [11]王国军ꎬ张琳成ꎬ陈冰ꎬ等.丹参中丹酚酸B对脑缺血再灌注损伤大鼠的保护作用研究[J].中华中医药学刊ꎬ2019ꎬ37(7):1566-1568.[12]WANGYJꎬGUANGCꎬYUXꎬetal.SalvianolicAcidBAmelioratesCerebralIschemia/ReperfusionInjuryThroughInhibitingTLR4/MyD88SignalingPathway[J].Inflammationꎬ2016ꎬ39(4):1503-1513.[13]ZHUHBꎬZOULBꎬTIANJWꎬetal.SMND-309ꎬanovelderivativeofsalvianolicacidBꎬprotectsratbrainsischemiaandreperfusioninjurybytargetingtheJAK2/STAT3pathway[J].EurJPharmacolꎬ2013ꎬ714(1-3):23-31.[14]FANYꎬLUOQPꎬWEIJJꎬetal.MechanismofsalvianolicacidBneuroprotectionagainstischemia/reperfusioninducedcerebralinjury[J].BrainResꎬ2018(1679):125-133.[15]LEEYWꎬKIMDHꎬJEONSJꎬetal.NeuroprotectiveeffectsofsalvianolicacidBonanAβ25–35peptide-inducedmousemodelofAlzheimerᶄsdisease[J].EurJPharmacolꎬ2013ꎬ704(1-3):70-77.[16]WANGYFꎬXUXQꎬHUPPꎬetal.EffectofToll-LikeReceptor4/MyeloidDifferentiationFactor88InhibitionbySalvianolicAcidBonNeuropathicPainAfterSpinalCordInjuryinMice[J].WorldNeurosurgꎬ2019(132):e529-e534.[17]WANGSXꎬHULMꎬGAOXMꎬetal.Anti-inflammatoryActivityofSalvianolicAcidBinMicrogliaContributestoitsNeuroprotectiveEffect[J].NeurochemResꎬ2010ꎬ35(7):1029-1037.[18]FENGYꎬYOUZLꎬYANSꎬetal.Antidepressant-likeeffectsofSalvianolicacidBinthemouseforcedswimandtailsuspensiontests[J].LifeSciꎬ2012ꎬ90(25/26):1010-1014.[19]ZHANGJQꎬWUXHꎬFENGYꎬetal.SalvianolicacidBamelioratesdepressive-likebehaviorsinchronicmildstress-treatedmice:involvementoftheneuroinflammatorypathway[J].ActaPharmacolSinꎬ2016ꎬ37(9):1141-1153.[20]LIAODHꎬCHENYꎬGUOYJꎬetal.SalvianolicAcidBImprovesChronicMildStress-InducedDepressiveBehaviorsinRats:In ̄volvementofAMPK/SIRT1SignalingPathway[J].JInflammResꎬ2020(13):195-206.[21]丰毅.丹酚酸B的抗抑郁作用研究[D].成都:电子科技大学ꎬ2013.[22]张静.丹酚酸B通过减少神经元凋亡以改善抑郁样行为的研究[D].成都:电子科技大学ꎬ2017.[23]鞠爱春ꎬ耿诗涵ꎬ杨欣鹏ꎬ等.丹酚酸B鼻腔给药对脑缺血损伤大鼠学习记忆能力及神经再生的影响[J].中草药ꎬ2017ꎬ48(12):2481-2485.[24]吴甜莺ꎬ张雄ꎬ郑永克ꎬ等.电针联合丹酚酸B治疗对衰老模型大鼠记忆障碍的影响[J].中华物理医学与康复杂志ꎬ2015ꎬ37(6):467-469.[25]王育红ꎬ宋明ꎬ李时ꎬ等.丹酚酸B对四氯化碳诱导大鼠肝纤维化的防治作用[J].中国现代医学杂志ꎬ2014ꎬ24(2):24-28. [26]GAOHYꎬLIGYꎬLOUMMꎬetal.HepatoprotectiveeffectofMa ̄trinesalvianolicacidBsaltonCarbonTetrachloride-InducedHe ̄paticFibrosis[J].JInflammꎬ2012ꎬ9(1):16.[27]刘建国ꎬ丁艳蕊ꎬ杨胜兰ꎬ等.丹酚酸B对实验性肝纤维化大鼠肝组织CD14表达的影响[J].中国中西医结合杂志ꎬ2011ꎬ31(4):547-551.[28]LIUQMꎬCHUHYꎬMAYYꎬetal.SalvianolicAcidBAttenuatesExperimentalPulmonaryFibrosisthroughInhibitionoftheTGF-βSignalingPathway[J].SciRepꎬ2016(6):27610.[29]LIUMꎬXUHYꎬZHANGLꎬetal.SalvianolicacidBinhibitsmyofi ̄broblasttransdifferentiationinexperimentalpulmonaryfibrosisviatheup-regulationofNrf2[J].BiochemBiophysResCommunꎬ2018ꎬ495(1):325-331.[30]ZHANGMꎬCAOSRꎬZHANGRꎬetal.TheinhibitoryeffectofsalvianolicacidBonTGF-β1-inducedproliferationanddifferenti ̄ationinlungfibroblasts[J].ExpLungResꎬ2014ꎬ40(4):172-185. [31]KRAMANNRꎬDIROCCODPꎬMAAROUFOHꎬetal.Matrix-pro ̄ducingcellsinchronickidneydisease:originꎬregulationꎬandacti ̄vation[J].CurrPathobiolRepꎬ2013ꎬ1(4):301-311.[32]蔡洲ꎬ李道ꎬ吴际ꎬ等.丹酚酸B对肾间质纤维化大鼠的肾保护作用及其机制[J].山东医药ꎬ2017ꎬ57(20):34-37.[33]黄小娟ꎬ贺雨ꎬ刘碧好ꎬ等.丹酚酸B通过调控自噬改善UUO小鼠肾纤维化[J].中药材ꎬ2018ꎬ41(9):2201-2205.[34]HEYꎬLURRꎬWUJBꎬetal.SalvianolicacidBattenuatesepithe ̄lial-mesenchymaltransitioninrenalfibrosisratsthroughactivatingSirt1-mediatedautophagy[J].BiomedPharmacotherꎬ2020(128):110241.[35]周才杰ꎬ刘江琦ꎬ高晗ꎬ等.丹酚酸B对原发性高血压大鼠的降压作用机制研究[J].中药新药与临床药理ꎬ2013ꎬ24(4):374-379.[36]徐斌ꎬ王辉ꎬ许中友.丹酚酸B及隐丹参酮对自发性高血压大鼠血管重塑的影响及机制研究[J].中药材ꎬ2017ꎬ40(11):2681-2685.[37]LINGWCꎬLIUJꎬLAUCWꎬetal.TreatmentwithsalvianolicacidBrestoresendothelialfunctioninangiotensinII-inducedhyperten ̄sivemice[J].BiochemPharmacolꎬ2017(136):76-85.[38]RAOUFISꎬBALUCHNEJADMOJARADTꎬROGHANIMꎬetal.An ̄tidiabeticpotentialofsalvianolicacidBinmultiplelow-dosestrep ̄tozotocin-induceddiabetes[J].PharmBiolꎬ2015ꎬ53(12):1803-1809.[39]SHIYNꎬPANDꎬYANLHꎬetal.SalvianolicacidBimprovedin ̄sulinresistancethroughsuppressionofhepaticERstressinob/obmice[J].BiochemBiophysResCommunꎬ2020ꎬ526(3):733-737. [40]陶善珺ꎬ任尤楠ꎬ赵梦秋ꎬ等.丹酚酸B对糖尿病血糖波动模型大鼠胰岛细胞的保护作用[J].中草药ꎬ2016ꎬ47(17):3058-3063.[41]周才杰ꎬ黄鸣清ꎬ陈长青ꎬ等.丹酚酸B改善2型糖尿病大鼠糖脂代谢及胰岛素抵抗的实验研究[J].中国实验方剂学杂志ꎬ2012ꎬ18(13):233-237.[42]徐艺丹.丹酚酸B对H2O2诱导的HaCaT细胞衰老作用的影响及机制研究[J].齐齐哈尔医学院学报ꎬ2018ꎬ39(10):1117-1120.[43]周湘君ꎬ叶才果ꎬ杨广丽ꎬ等.丹酚酸B对小鼠皮肤光老化的保护效应[J].中国组织工程研究ꎬ2013ꎬ17(2):275-279.[44]GUOJWꎬCHENGYPꎬLIUCYꎬetal.SalvianolicAcidBinMi ̄croemulsionFormulationProvidedSufficientHydrationforDrySkinandAmelioratedtheSeverityofImiquimod-InducedPsoriasis-LikeDermatitisinMice[J].Pharmaceuticsꎬ2020ꎬ12(5):457.[45]WANGZSꎬLUOPꎬDAISHꎬetal.SalvianolicAcidBInducesAp ̄optosisinHumanGliomaU87CellsThroughp38-MediatedROSGeneration[J].CellMolNeurobiolꎬ2013ꎬ33(7):921-928. [46]KATARYMAꎬABDELSAYEDRꎬALHASHIMAꎬetal.SalvianolicAcidBSlowstheProgressionofBreastCancerCellGrowthviaEn ̄hancementofApoptosisandReductionofOxidativeStressꎬInflam ̄mationꎬandAngiogenesis[J].IntJMolSciꎬ2019ꎬ20(22):5653.(上接第720页)参考文献:[1]㊀吴结枝ꎬ鄢然ꎬ刘湘琳ꎬ等.骨质疏松病因病机的研究进展[J/OL].实用中医内科杂志:1-5[2021-07-01].ht ̄tp://kns.cnki.net/kcms/detail/21.1187.R.20210401.0858.002.html.[2]王在君ꎬ李树海ꎬ刘庆斌ꎬ等.内蒙古农区饮砖茶型氟中毒流行病学调查[J].疾病监测与控制杂志ꎬ2011ꎬ5(4):205-206.[3]吴峰ꎬ潘文玲ꎬ郭峰ꎬ等.CT对氟骨病患者骨密度的观察运用分析[J].中国地方病防治ꎬ2020ꎬ35(5):585-586.[4]史炜镔.骨质疏松症的药物治疗[J].国际医学(老年医学分册)ꎬ1996ꎬ17(4):177-180.[5]孟克布和ꎬ斯钦图.初探蒙医诊治骨质疏松症[J].中国民族医药杂志ꎬ2011ꎬ17(1):70-71.[6]赵云山ꎬ李紫岩ꎬ那木汉ꎬ等.内蒙古地区中蒙药药材生态种植现状分析及建议[J].中国现代中药ꎬ2017ꎬ19(7):901-906.[7]赵军.蒙医药抗骨质疏松研究进展[J].中国民族医药杂志ꎬ2019ꎬ25(6):40-42.[8]赵军ꎬ师建平ꎬ董重阳ꎬ等.蒙药蓝刺头对绝经后骨质疏松症大鼠瘦素㊁β2肾上腺素受体的影响[J].西部中医药ꎬ2021ꎬ34(3):72-76.[9]韩林静ꎬ吴克亮ꎬ王宏波ꎬ等.基于网络药理学探讨黄芪治疗骨质疏松症的分子机制[J].中国骨质疏松杂志ꎬ2020ꎬ26(8):1119-1125.[10]赵军.蒙药蓝刺头抗骨质疏松研究进展[J].中国民族医药杂志ꎬ2019ꎬ25(9):43-45.[11]彭珊ꎬ欧阳厚淦ꎬ赵志冬ꎬ等.去卵巢大鼠骨质疏松模型的制备与评价[J].中国骨质疏松杂志ꎬ2017ꎬ23(10):1327-1329.。
IRF1对LPS诱导的小鼠巨噬细胞凋亡和自噬的调节作用及其机制研究

IRF1对LPS诱导的小鼠巨噬细胞凋亡和自噬的调节作用及其机制研究一、本文概述本文旨在深入探究干扰素调节因子1(IRF1)对脂多糖(LPS)诱导的小鼠巨噬细胞凋亡和自噬的调节作用及其潜在机制。
通过系统地研究IRF1在LPS刺激下对巨噬细胞生物学行为的影响,本文期望为理解巨噬细胞在炎症和感染过程中的复杂反应提供新的视角,并为相关疾病的预防和治疗提供理论依据。
本文将概述IRF1和LPS的基本生物学特性及其在巨噬细胞中的功能。
随后,通过构建适当的实验模型,观察IRF1在LPS诱导的巨噬细胞凋亡和自噬过程中的表达变化,并探讨其与凋亡和自噬关键分子的相互作用。
本文还将深入剖析IRF1调节LPS诱导的巨噬细胞凋亡和自噬的分子机制,包括但不限于信号转导通路、基因表达调控等方面。
通过本研究的实施,我们期望能够为理解IRF1在巨噬细胞凋亡和自噬调控中的作用提供新的证据,并为未来开发针对相关疾病的干预策略提供理论基础。
本文还将为其他研究者在巨噬细胞生物学及相关领域的研究提供有益的参考和启示。
二、材料与方法本实验使用的小鼠巨噬细胞系(RAW7)购自中国科学院细胞库。
细胞在含有10%胎牛血清(FBS)和1%抗生素(青霉素/链霉素)的RPMI 1640培养基中,于37°C、5% CO2的恒温培养箱中培养。
LPS(脂多糖,来自大肠杆菌O111:B4)、IRF1(干扰素调节因子1)特异性抑制剂、细胞凋亡检测试剂盒(Annexin V-FITC/PI双染法)、自噬检测试剂盒(LC3B抗体)、Western Blot相关试剂(蛋白裂解液、蛋白Marker、PVDF膜等)均购自Sigma-Aldrich公司。
流式细胞仪(BD Biosciences)、Western Blot电泳及转膜设备(Bio-Rad)、倒置显微镜(Olympus)、CO2恒温培养箱(Thermo Fisher Scientific)等。
RAW7细胞以每孔1×10^6个细胞的密度接种于6孔板中,待细胞贴壁后,用不同浓度的LPS(100 ng/ml)刺激细胞,同时加入或不加入IRF1特异性抑制剂。
代谢调节

代谢调节生物体是一个完整的统一体。
糖、脂肪、蛋白质以及核酸等代谢在体内构成新陈代谢的整体网络。
代谢途径的相互途径一、糖代谢与脂类代谢的相互联系二、糖代谢与蛋白质代谢的相互联系三、脂类代谢与蛋白质代谢的相互联系四、核酸代谢与糖、脂肪及蛋白质代谢的相互联系ATP 能量和磷酸基团的供应UTP 单糖的转变和多糖的合成CTP 参与卵磷脂的合成核酸核苷酸GTP 供给蛋白质合成的能量CAMP 激素的第二信使CoA、NAD(P+)、FAD等参与代谢甘氨酸、天冬氨酸、谷氨酰胺嘌呤、嘧啶合成糖代谢的磷酸戊糖途径磷酸戊糖酶和蛋白质因子核酸的合成综上所述,糖、脂肪、蛋白质及核酸在代谢过程中形成网络。
见图14-1 P361其中三羧酸循环是各类物质代谢的共同途径,也是它们之间相互联系的枢纽。
代谢调节代谢是一个完整统一的过程,它存在着复杂而精确的调节机制。
生物体在长期进化过程中建立了四级水平的调节:神经水平调节是生物进化发展而完善起来的调节机制,是通过细胞水平和激素水平调节酶水平变化来实现细胞水平调节是最基本的调节方式酶水平调节一、酶水平的调节:是生物体内最基本、最普遍的调节方式〈一〉酶定位的区域化各代谢反应的酶定位于不同的细胞区域中,见表14-1 P364〈二〉酶活性的调节1、酶原激活⑴酶原:酶的无活性前体。
⑵酶原激活(不可逆的共价修饰):某些酶先以无活性的酶原形式合成或分泌,然后在到达作用部位后由其它酶作用,使其失去部分肽链,从而形成或暴露活性中心,形成有活性酶分子的过程。
⑶酶原激活的实例:例:胃蛋白酶原(胃黏膜)胃蛋白(N—末端切去42个氨基酸残基)胰蛋白酶原(胰)胰蛋白酶胰凝乳蛋白酶原—胰凝乳蛋白酶3单性蛋白酶原—3单性蛋白酶羧肽酶原——羧肽酶2、酶活性的前馈和反馈调节前馈调节(feed forward):前面的底物对其后某一反应的酶的调节。
前馈激活(feed forward activation):使代谢过程加快前馈抑制(feed forward inhibition):使代谢过程减慢反馈调节(feed back):代谢产物对前面的某一酶的调节反馈激活(feed back activation)反馈抑制(feed back inhibition)前馈和反馈调节都是通过酶的别构效应来实现的。
基质金属蛋白酶-1

基质金属蛋白酶-1基质金属蛋白酶-1(matrix metalloproteinase-1,MMP-1),是一种在生物学中广泛存在的蛋白酶。
它属于金属依赖性蛋白酶家族,是一种外泌酶,可在细胞外基质中水解和降解一系列蛋白质,并参与细胞迁移、组织重塑等生理和病理过程中的调控。
这使其成为治疗肿瘤、心血管疾病、炎症和组织修复具有潜在的药物靶点。
MMP-1基因位于人类染色体11q22.3-q23,由10个外显子编码出一种含585个氨基酸的酶。
它的基础结构包括一个信号肽、一个质量约为25 kDa的所谓的“前序”部分、一个质量约为16 kDa的“活性”主体和一个过渡肽带。
MMP-1是一种既氧化又还原的金属蛋白酶,其催化区域是由几个严格保守的氨基酸残基组成,包括Zn2+、Ca2+和水分子。
MMP-1的活性主体中的均匀耦合区域与其他细胞外矩阵金属蛋白酶相似,其中包括外泌反式肽酰-His-Pro-NH2,也称为接合剂。
MMP-1通常是由成纤维细胞、滑膜细胞、星状细胞、平滑肌细胞、血管平滑肌细胞和肿瘤细胞等多种细胞类型合成和分泌的。
炎症和某些生长因子如TNF-α、IL-1、PDGF和TGF-β等可以从细胞和外部刺激中诱导MMP-1的表达和活性。
MMP-1在肿瘤细胞的浸润和转移中发挥着关键的作用。
研究表明,MMP-1的基因表达与许多恶性肿瘤的发生和发展有关,如乳腺癌、前列腺癌、结直肠癌、肺癌和口腔癌等。
MMP-1参与多种生理和病理过程,包括组织重塑、细胞迁移、血管新生、细胞外基质降解和细胞外基质-细胞相互作用等。
它可降解基质蛋白质如胶原、η-纤维蛋白原和elastin等,这些基质蛋白是组织和器官刚性、弹性和可塑性的重要组成部分。
在心脏、肺和动脉病变中,MMP-1的活动促进了病理性心肺重构并导致肺气肿、动脉硬化和动脉瘤等疾病的发生。
此外,MMP-1的活性还参与了许多炎症性和自身免疫性疾病的病理过程,如风湿性关节炎、类风湿性关节炎、溃疡性结肠炎、肌萎缩性侧索硬化症和带状疱疹等。
NF-κB信号通路

1.IKK复合物
IKK复合物的组成:
*IKKα(又称IKK1),85kD *IKKβ(又称IKK2),87kD
具有较高的序列同源性和相似的 结构。 在N-末端均含有蛋白激 酶区,靠近中间区域的亮氨酸拉链 区(LZ) 及螺旋-环-螺旋(HLH)
*NEMO(又称IKKγ),48kD
包括大段的卷曲螺旋(coiled-coil) 及靠近C-末端的亮氨酸拉链区
☆ 与RIP1相似, RIP2的激酶区域对IKK的激活也不是必需的, 在NF-κB 经典信号通路中, RIP2与TAK1和TRAFS作用,直接诱导NEMO的泛素 化,和下游信号通路激活。
RIP3
在NF-κB信号通路中, RIP3由于和RIP1具有同型作用基序 (RHIM),所以与RIP1具有同等功能。但是在信号通路中, RIP3的重 要性远远比不上RIP1,因为当RIP3缺失时,大多数的NF-κB信号通路是 正常的。在特殊情况下, RIP3可能影响和阻碍RIP1诱导的NF-κB信号 通路的激活。
★ 在一些情况下, TRAF3可以诱导NIK的泛素化和降解,抑制信 号通路的激活。但是这时候,其他 TRAF家族成员可以介导TRAF3的降 解,结果造成NIK的积累和活化,促进非经典信号通路正向激活。
因此,不管在经典还是非经典信号通路中, TRAF蛋白 在诱导IKK激活方面发挥着很重要的作用。
2. RIPS——受体作用蛋白
NF-κB家族由P50、P52、P65、 c-Rel和RelB五个成员组成。它们 分别由NFKB1, NFKB2, RELA, REL和RELB基因进行编码。
它们都具有一个N端Rel同源结构 域(RHD),负责其与DNA结合 以及二聚化。
另外,在P65、c-Rel和RelB中,存 在着转录激活区域——TAD,对 基因表达起正向调节的作用。 P50和P52不存在转录激活区域, 它们的同型二聚体可以抑制转录。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
t am n r 4h u s r u 6  ̄ NE : r t a m n i ee tr l k r ea c( 0/ lL o eh u a- r t e t o o r.G o p ( + e f 2 ) p e e t e t t 8rc p o o e tl 1 , / ) n o r r r w h b c b o mo e
p erame twi e e tr bo k r p e tlmie( 0 mo/ rte t n t a rc po lc e h noa n 1 > lL)o e h u a l r fl we y NE ( 0 > lL) h n o r eri ol d b e o 1 mo/
NF K -B的 D NA结 合 能 力 调 控 MMP 2和 MMP 9酶 活 性 。 ~
[ 键 词 ] 心 力 衰 竭 ; 多 聚 AD 关 1型 P核糖 聚合 酶 ; , 一 室重 构 ; 转 录 因子 一B 基 质 金属 蛋 白酶 l f 核 x;
[ 图分 类 号 ] R 4 . 中 516 [ 献标志码] A 文 [ 章编 号] 10 —49 2 0 ) 60 7—4 文 0 11 3 (0 90 —4 20
近 年来 , 心血 管疾 病 发 病率 迅 速增 加 , 中心 其
认 为心 肌在重 构 中扮 演主要 角 色 , 目前 认 为心肌 细 胞 外基 质纤 维 胶原 合 成 和 降解 之 间动 态 失衡 在 心
脏 重构 过 程 的作 用 也 十 分 重 要 ∞ , 日益 受 到 重 且
力 衰竭的发 病率和 病死率 居高 不下 , 已经严 重危 害 到人 民的生 命 健 康n 。心 室重 构 是 导 致 心 力 衰 竭 发生发展 的关 键 。在 激 活 的神 经 内分 泌 系 统 作
( AB)o eh u al rf l we y NE ( 0“ lL)te t n o 4 h u s 3 n o reri ol e o db 1 mo/ r ame tfr2 o r .Gr u ( i o p 4 vt C):p erame twih rte t n t vtmi ( . i n C 1 4mmo/ a lL)o eh u a l rf l we yNE ( 0/ lL)te t n o 4h us Gr u 5 a Nr2 o r.; o p ( + :
PA RP nhbior3 B,v t , l c e i iia l r ve e E—n c d i r a e n i r c lu a i i t A iC, B b o k rsgnfc nty p e nt d N i du e nc e s si nta el l rROS l v l he e e ,t e pr s in o x e so fPA Rp- 1,t c i iy ofM M P一 he a tvt 2,M M P一 n c r ic fb ob a t. Co lso Ac ia i n a v r — 9 i a da r l s s i ncu i n: tv to nd o e ex pr s i n ofPA RP- i r a e he e z m i a tvt f M M P一 e so 1 nc e s s t n y c ci iy o 2. M M P一 i E~ r a e a di i oba t hr gh 9 nN te t d c r ac fbr ls s t ou p omotng N F— r i KB DN A ndng a tviy bi i c i t .
P l ( o y ADP—i o e o y r s 一 n r a e h n ma i c iiis0 r b s )p l me a e1 i c e s st e e y t a tv t f c e
M M Ps v a NF- a hwa n c l u e a d a i r b a t i KB p t y i u t r d c r i c fb o l s s
wi t NE ( 0 l lL)fr 2 o r ln . Gr u ( AB) p erame twi 5 mmo/ - mio e z mie h 1 t / mo o 4 h u s ao e op3 3 : rtet n t 1 h lL 3 a n b n a d
用下, 心脏 细胞外 基质胶 原合 成和 降解 之 间 的动态
视 。然而其 调节 机制还 有待进 一步深 入研究 。1型
多 聚 AD 核 糖 聚 合 酶 ( oy AD _ioe oy P p l ( P r s )p l- b meae1 P P 1 是广 泛 存 在 于真 核 细胞 内的一 r s- , AR 一 )
FAN G i gr H UAN G n X n ui K H U_ NG n W_ A Da ANG Y LI A0 Yuhu a
( p rm e to r ilg De a t n fCa do o y,Uno s ia o a h n ie st f ce c in Ho ptl fHu z o g Unv r i o in e& Te h oo y y S c n lg ,
Wu a h n,4 0 2 ,C i a 30 2 hn )
Abtat Obetv : n e t aeter l fp l ADP rb s )p lmea e1i e uain o h n mai sr c jcie Toiv si t h oeo oy( g —io e oy r s一 n rg lt ftee y t o c
ba t r i i e n o 6 g o p . Gr u ( o t o ) c n r l r u t o tt e t n s Gr u ( l ss we e dv d d i t r u s o p 1 c n r 1 : o to o p wih u r a me t. g o p 2 NE) r a me t :t e t n
*
房兴锐 黄 恺 黄 丹 王妍 廖 玉华
[ 要 ] 目的 : 讨 1 多 聚 A P核 糖 聚合 酶 ( AR -) 过 激 活 N -B调 节 体 外 培 养 乳 鼠心 脏 成 纤 维 细 摘 探 型 D P P1 通 F ̄ 胞 基 质 金属 蛋 白酶 ( MMP ~ , )2 MMP9酶 活性 的机 制 。方 法 : 用 1 m lL去 甲 肾上 腺 素 ( ) 激 体 外 培 养 一 使 0 ̄ o/ NE 刺
的乳 鼠 心脏 成 纤 维 细 胞 2 , 用荧 光 基 团 D FD 检 测 心 脏 成 纤 维 细 胞 内 活性 氧 ( O ) 平 , 用 明胶 酶 谱 4h利 C —A R S水 使
法 检测 M MP2 MMP9的 酶活 性 水 平 , 胶 阻 滞 实 验检 测 N -B的 D -, - 凝 Fx NA 结 合 能 力 , s r-l 检 测 P R - Wet nbo e t A P1 蛋 白表 达水 平 ; 用 P R - 抑 制 剂 3氨基 苯 甲酰 胺 ( AB ,、 使 A P1 一 3 ) a8受 体 阻滞 剂 及 抗 氧 化 剂 vt 干 预 后 , 察 上 述 i C 观 指标 的变 化 。结 果 : E诱 导心 脏 成 纤 维 细胞 内 R N OS产 生 增 加 , A _ P RP1蛋 白表 达 增 加 , -B 的核 转 录 能 力 明 NF ̄ 显增强 , MMP 2 MMP9 活性 明显 增 加 。使 用 3 -、 一酶 AB抑 制 P P 1 性 , 使 用 抗 氧 化 剂 vt AR - 活 或 i C及 a口受 体 阻 滞 、
a t iiso M P h o g — B p t wa n c lu e a a d a i r b a t .Me h d: l r d r t a da i r — c i t fM v e s t r u h NF K a h y i u t r d r tc r icfb o ls s t o Cu t e a r ic f o u c b
・ 47 ・ 2
J Cl r il( ia ,J n 2 0 Vo 5,No6 i Ca do Chn ) u 0 9, l2 n
合 J c 1型 多 聚 A DP 核 糖 聚 酶 激 活 N F— B 途 径 调 节
基 质 金 属 蛋 白 酶 活 , 的 机 制 研 究 陡
Ke r s h a tf i r ;p l ( y wo d e r al e o y ADP rb s ) p l me a e 1 e t iu a e d l g;NF n u — i o e o y r s 一 ;v n rc l rr mo e i n - B;M MP
失 衡导致 了 心脏 结 构 和 功 能发 生 显 著 变化 。以前
基 金 项 目: 家 自然 科 学 基金 资助 项 目( : 0 7 8 1 国 No 3 7 0 8 ) 华 中科技 大 学协 和 医院 心 内科 ( 汉 ,3 0 2 武 40 2 ) 通 信 作者 : 恺 , — i h a g al y h o c m 黄 E mal u n k i@ a o . o :
剂等 预 先 处 理后 可显 著 抑 制 NF ̄ -B的 D NA结 合 能 力 , 而 减 少 NE诱 导 的 MMP 2 MMP9酶 活 性 。结 论 : E 进 一, 一 N
诱 导 心 脏 成 纤 维 细胞 内 R OS产 生 明显 增 多 , S激 活 P P 1 促 使 其 蛋 白 表 达 显 著 增 高 ,P P1通 过 增 强 RO AR 一 并 AR 一
