酶活性的测定
酶活测定方法

、酶活测定方法还原法酶与底物在特定的条件下反应,酶可以促使底物释放出还原性的基团。
在此反应体系中添加化学试剂,酶促反应的产物可与该化学试剂发生反应,生成有色物质。
通过在特定的波长下比色,即可求出还原产物的含量,从而计算出酶活力的大小。
色原底物法通过底物与特定的可溶性生色基团物质结合,合成人工底物。
该底物与酶发生反应后,生色基团可被释放出来,用分光光度法即可测定颜色的深浅,在与已知标准酶所做的曲线比较后,即可求出待测酶的活力。
粘度法该法常用于测定纤维素酶、木聚糖酶和β-葡聚糖酶的活力。
木聚糖和β-葡聚糖溶液通常情况下可形成极高的粘度,当酶作用于粘性底物时木聚糖和β-葡聚糖会被切割成较小的分子使其粘度大为降低。
基于Poiseuille定律我们知道,只要测定一定条件下溶剂和样品溶液的运动粘度,便可计算特性粘数,并以此来判断酶的活力。
高压液相色谱法酶与其底物在特定的条件下充分反应后,在一定的色谱条件下从反应体系中提取溶液进行色谱分析,认真记录保留时间和色谱图,测量各个样的峰高和半峰高,计算出酶促反应生成物的含量,从而换算出酶活力的数值。
免疫学方法常用于酶活性分析的免疫学方法包括:免疫电泳法、免疫凝胶扩散法。
这两种方法都是根据酶与其抗体之间可发生特定的沉淀反应,通过待测酶和标准酶的比较,最终确定酶活力。
免疫学方法检侧度非常灵敏,可检侧出经过极度稀释后样品中的酶蛋白,但其缺点是不同厂家生产的酶产品需要有不同特定的抗体发生反应。
琼脂凝胶扩散法将酶作用的底物与琼脂混合熔融后,倒入培养皿中或载波片上制成琼脂平板。
用打孔器在琼脂平面上打出一个约4-5mm半径的小孔。
在点加酶样并培养24h以后,用染色剂显色或用展开剂展开显出水解区,利用水解直径和酶活力关系测定酶活力。
蛋白酶活力测定法本方法适用于酿造酱油时在制品菌种、成曲的蛋白酶活力测定。
1 福林法1.1 试剂及溶液: 以下试剂都为分析纯1.1.1 福林试剂(Folin试剂):于2000mL磨口回流装置内,加入钨酸钠(Na2WO4·2H2O)100g,钼酸钠(Na2MoO4·2H2O)25g,蒸馏水700mL,85%磷酸50mL,浓盐酸100mL,文火回流10h。
蛋白酶活性的测定方法

蛋白酶活性的测定方法
蛋白酶活性的测定方法有多种,常见的方法包括:
1. 比色法:基于酶催化底物的产物与染色剂之间发生化学反应的原理。
测定过程中,酶水解底物产生的产物与染色剂发生反应形成有色产物,通过测定产物的吸光度来估计酶活性的强弱。
2. 荧光法:利用荧光底物的酶催化产物发出的荧光信号来测定酶活性。
荧光强度与酶催化产物的浓度成正比,通过测定荧光强度来分析酶活性。
3. 放射性标记法:将底物标记上放射性同位素,使其具有放射性。
通过测定底物放射性崩解的程度来估计酶活性的大小。
4. 免疫学方法:利用特异性抗体与酶结合形成抗原-抗体-酶复合物,测定抗原-抗体-酶复合物的活性来检测酶活性的强弱。
5. 吸收光谱法:利用特定的酶底物,通过测量其吸收光谱的变化来分析酶活性的强弱。
需要根据具体实验目的和条件选择适合的测定方法。
酶活性测定实验室标准操作规程

酶活性测定实验室标准操作规程
1. 引言
本标准操作规程旨在确保酶活性测定实验室操作的准确性和一
致性。
该实验室用于测定酶的活性,以评估其催化反应速率,为进
一步研究和应用提供依据。
2. 实验室准备
- 确保实验室环境清洁整洁,排除干扰因素。
- 准备所需试剂、仪器和设备,并进行校准和验证。
3. 样品准备
- 按照实验要求准备待测酶样品。
- 保持样品的完整性和稳定性,避免污染和损伤。
4. 实验步骤
4.1 样品稀释
- 使用适当的缓冲液稀释待测酶样品,以达到合适的测试范围。
4.2 酶活性测定
- 将稀释后的样品与适当的底物混合,并按照预定的反应时间进行反应。
- 使用光谱仪、荧光仪或其他相关仪器测定反应产物的生成情况。
4.3 数据处理
- 记录实验过程中所有操作的详细信息。
- 根据实验结果计算酶的活性,并进行数据统计和分析。
5. 质量控制
- 定期进行实验室内部质量控制,包括使用质检样品进行标准曲线校准和验证。
- 确保实验操作符合质量管理体系要求。
6. 安全注意事项
- 遵守实验室的安全规定,包括佩戴适当的个人防护装备。
- 确保试剂的正确使用和储存,避免有害物质的暴露和泄漏。
7. 结论
本标准操作规程为酶活性测定实验室提供了一套明确的操作指南,用于确保实验操作的准确性和一致性。
遵循该规程可提高实验结果的可靠性,并为进一步研究和应用提供有力支持。
酶活性的测定

式中
A—对照KMnO4滴定毫升数; B—酶反应后KMnO4滴定毫升数;
VT—酶液总量(ml); V1—反应所用酶液量(ml);
W—样品鲜重(g);
1.7mg
1.7—1ml H2O2。
0.1mol/L旳KMnO4相当于
紫外分光光度法:
H化测2O氢量2在,吸2使光40反率nm应旳波溶变长液化下吸速有光度强度即烈可(吸A测2收40出),随过过反氧氧应化化时氢氢间酶酶而旳能降活分低性解。。过根氧据 以1min内A240降低0.1旳酶量为1个酶活单位(u)。
硫酸盐缓冲液,盐酸羟胺,黄嘌呤,黄嘌 呤氧化酶,醋酸等。
试验环节:
计算措施:
每毫升反应液中SOD 抑止率达50%时相应 旳SOD 量为一种SOD 活力单位(U),待测 样品中旳SOD 活力由下式计算:
SOD克制率(%)=(A2-A1)/A2×100% SOD 活力(U/ml)=(A2-A1)
据此,可根据H2O2旳消耗量或O2旳生成量测定该酶活力大小。 在反应系统中加入一定量(反应过量)旳H2O2溶液,经酶促反 应后,用原则高锰酸钾溶液(在酸性条件下)滴定多出旳H2O2
。
即可求出消耗旳H2O2旳量。
酶表活达性 :用每克鲜重样品1min内分解H2O2旳毫克数
酶活(mgH2O2/gFW·min)=
测定茶树鲜叶APX活性旳最佳条件
PVPP旳加入量为鲜叶重旳1.5倍,提取液pH 为7.8,反应液pH为7.0,底物AsA浓度为 0.5mmol/L。
注意事项:
(1)因为测定反应是经过加液量控制在60s内,使产生旳A290光值下 降呈良好旳线性关系。
1.试剂: 0.1mol/L Tris-HCl 缓冲液
(pH8.2
探究酶活性的实验设计

探究酶活性的实验设计酶活性是指酶在一定条件下催化反应的能力,影响酶活性的因素有很多,如温度、pH值、底物浓度等。
本文将探究酶活性的实验设计,通过实验方法和步骤的讲解,展示如何准确、科学地研究酶活性。
一、实验目的探究不同条件下酶活性的变化规律,分析影响酶活性的因素。
二、实验材料和设备1. 反应物料:酶溶液、底物溶液2. 实验器材:试管、移液管、计时器、恒温水浴、pH计、离心机等三、实验步骤1. 准备工作:a. 将酶溶液和底物溶液置于恒温水浴中,使其温度稳定在实验需要的温度(如37°C)。
b. 准备一系列不同pH值的缓冲液,确保在实验中能控制pH值。
c. 测量底物的浓度,并调整为实验所需的浓度。
2. 温度对酶活性的影响实验设计:a. 取若干试管,并标记好温度,如20°C、30°C、40°C等。
b. 向每个试管中加入相等体积的酶溶液和底物溶液。
c. 将试管放入恒温水浴中,分别加热或冷却到所标注的温度并保持一段时间。
d. 在预定时间间隔内,取出试管,通过添加某种试剂停止反应,并用比色法或浊度计等设备测定产物的生成量。
3. pH值对酶活性的影响实验设计:a. 取若干试管,并加入等体积的酶溶液和底物溶液。
b. 分别向每个试管中加入不同pH值的缓冲液,如pH=5、pH=7、pH=9等。
c. 将试管放置于恒温水浴中,保持一定时间。
d. 在适当时间内,用某种试剂停止反应,并通过测定反应产物的生成量来研究酶活性的变化。
4. 底物浓度对酶活性的影响实验设计:a. 在试管中加入等体积的酶溶液,且底物浓度分别设为1mol/L、0.5mol/L、0.2mol/L等。
b. 将试管放于恒温水浴中,反应一定时间。
c. 使用某种试剂停止反应,并测定生成的产物浓度。
d. 通过产物浓度的变化,探究底物浓度对酶活性的影响。
四、数据处理和分析1. 温度对酶活性的影响:a. 绘制反应速率随温度变化的曲线图,分析酶活性与温度的关系。
酶活性的测定方法

酶活性的测定方法
酶活性的测定方法有多种。
以下列举了常见的几种方法:
1. 酶动力学法:通过测定酶催化底物转化为产物的速率,来确定酶活性。
常用的酶动力学方法有初始速率法、双重倒数法、利用酶反应速率与底物浓度的关系等。
2. 比色法:利用酶与底物反应后产生的色素变化进行酶活性测定。
例如,过氧化物酶活性可通过测量其催化产生的有色产物浓度的变化来确定。
3. 荧光法:利用酶与底物反应后产生的荧光变化进行酶活性测定。
荧光法的灵敏度高,操作简便。
例如,酯酶活性可通过测量底物转化为产物后产生的荧光强度的变化来确定。
4. 放射性同位素法:将放射性同位素标记在底物上,通过测量酶催化底物与同位素的结合来确定酶活性。
例如,放射性同位素法可用于测定DNA聚合酶活性。
5. 电化学法:利用酶与底物反应后产生的电流变化进行酶活性测定。
常用的电化学方法包括循环伏安法和电化学阻抗法。
例如,葡萄糖氧化酶活性可通过测量产生的电流与葡萄糖浓度之间的关系来确定。
值得注意的是,不同酶具有不同的理化性质和催化机制,因此需要根据具体酶的
特性选择适合的测定方法。
酶活性的测定方法

生物样品预处理预冷解剖用具,采用颈后断头的方法将鱼杀死,立即取肝脏、腮、脑,操作均在4℃下进行,用预冷的0.15 mol/L KCl 溶液洗去血丝,用滤纸吸干后称重。
将肝、脑组织放入预冷的Tris-HCl缓冲液(0.1 mol/L Tris-HCl, pH 7.4, 0.15 mol/L KCl)匀浆(匀浆比(W/V)1:5),腮组织放入组织匀浆(匀浆缓冲液含40mmol/L咪唑,250mmol/L蔗糖,5mmol/L EDTA,pH7.0),匀浆比为1:40,匀浆速率为10000g,以15s为周期,重复3次。
分别取1ml匀浆液放入1.5ml离心管进行离心,4℃下离心(9000g,20min),取上清液-80℃下保存,待测。
(1)250mL 0.15 mol/L KCl:取2.7956g(2)Tris-HCl缓冲液:125mL 0.1 mol/L Tris(1.5143g)+ 105mL 0.1 mol/L HCl+ KCl(0.15*0.23*74.55=2.5720g)(Na++K+)-ATPase活性的测定1、试剂(1)匀浆液(250ml):40mmol/L咪唑0.6808g+250mmol/L蔗糖21.3931g +5mmol/LEDTA 0.3653g(2)反应缓冲液(250ml):80mmol/L咪唑 1.3616g+4mmol/LMgCl2 0.2033 g+40mmol/LKCl 0.7455g(3)16mmol/L Na2ATP(10ml):0.0988g(4)30%三氯乙酸(TCA)9g TCA+21mlH2O(5)定磷试剂(硫酸亚铁-钼酸胺试剂100ml):10ml 5mol/LH2SO4+1.3556 g钼酸铵+90mlH2O每10ml加入FeS040.5g(FeS04·7H2O 0.0941g),25ml加入FeSO4·7H2 O 0.2353g,临用前配制。
酶活性测定方法

体系一酶和蛋白质提取消过毒的打孔器进行伤口处理后,在每个伤口处添加50μL以下处理:(1)无菌水,对照;(2)浓度为1000μg/mlGA3;(3)浓度为1 ×104 spores/ml P. expansum孢子悬浮液;(4)浓度为1000μg/mlGA3+浓度为1 ×104 spores/ml P. expansum孢子悬浮液。
处理后湿纱布覆盖并用PE塑料膜密封作保湿处理。
贮藏于常温(20-25℃)下。
分别在0、12、24、36和48小时取样进行测定酶活性。
取样时沿伤口用刀小心切下1g果实组织,加入10 mL冷(4℃)的50 mmol/L磷酸缓冲液(PBS)内含1.33 mmol/L EDTA和1% PVPP缓冲液(pH 7.8)。
研钵加入少量液氮预冷后,在冰浴中碾磨,破碎组织,然后在冷冻离心机12000rpm离心15分钟。
取上清液供酶活性和蛋白质含量用。
蛋白质含量测定试验材料和试剂:牛血清白蛋白标准溶液:准确称取100mg 牛血清白蛋白,溶于100mL 蒸馏水中,即为1 000μg/mL的原液。
8.1.2 蛋白试剂考马斯亮蓝G-250:称取100mg 考马斯亮蓝G-250,溶于50mL90%乙醇中,加入85%(W/V)的磷酸100mL,最后用蒸馏水定容到1 000mL。
8.1.3 乙醇;磷酸(85%)。
试验方法:分别取牛血清白蛋白标准溶液(1000μg/mL)0,、10μL、20μL、40μL、60μL、80μL、100μL,无菌水补至100μL,加入考马斯亮蓝G-250试剂5mL,作为标准溶液;分别取标准溶液和上清液(试验7中得到)400μL加到酶标板,以无菌水置零,测定OD595;酶活的测定9.1 试验材料和试剂9.1.1 氮蓝四唑;甲硫氨酸;核黄素;过氧化氢;愈创木酚;邻苯二酚。
9.1.2 Na2HPO4-12H2O;NaH2PO4-2H2O。
9.1.3 磷酸缓冲液PBS配制母液:0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水;0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水。
酶工程第1章酶活性单位及其测定方法

1 分光光度法
(spectrophotometry)
硝酸还原酶将NO3- 还原成NO2-,NO2- 与加
入的显色剂对-氨基苯磺酸和α -萘胺反应生成玫 瑰红色的偶氮化合物,在520nm处比色可测定产物 的生成量。一些脱氢酶以NAD+或NADP+为辅酶, NAD+ 或NADP + 在340nm处光吸收很少,而其还原
1000 0.3 15 μmol/min/mg protein 20
U/mg protein
二、酶活性测定的主要方法
温度、pH、离子强度(I=(1/2)Σ CZ 2 )等因 素对酶活性有很大的影响,测定酶活性时一般采 用最适环境条件。若酶催化反应时需要辅助因子, 应加入最适量的辅助因子。底物浓度应采用零级 反应时的底物浓度,这时反应速度只与酶浓度有 关,而与底物浓度无关。随着反应的进行,产物 浓度越来越高,而底物浓度越来越低,导致反应 速度下降,所以测酶活性时应测反应的初速度, 即反应开始后较短一段时间内的反应速度(反应 了的底物不超过5%)。
物,测产物的放射性强度。此法灵敏度高,但分
离产物较麻烦。若底物或产物中有一种是气体或
沉淀,就易于分离。
5 电化学方法
(electrochemistry)
① pH测定:对于某些酶促反应过程中会产生H+ 或减少H+的反应来说,用1/1000 pH单位精度的pH 计测定反应液的pH变化,或为保持pH不变而加入 酸或碱,记录一段时间内加入的酸碱量。 ② 电位测定:在一些酶促氧化还原反应中,底物 和产物具有不同的氧化还原电位,可用由一恒定微 电流极化的两个铂电极之间的电位差来测定电位变 化。 ③ 电流测定:以恒定电压的两个铂电极测电流 变化。
1 katal=6×107 IU
酶活性的检测方法

DNS 还原糖 显色反应
比色法
蔗糖转化酶的活性检测: 光谱学检测
蛋白酶活性的检测:
BBA - Proteins and Proteomics, 1864 (1), 2016, 130-142
酶活性的检测方法
(二) HPLC检测法
植酸酶的活性检测方法: (植酸酶催化的脱磷酸反应的探针)
Soil Biology & Biochemistry 41 (2009) 192-200
酶活性的检测方法
酶活性的检测方法
(五) 耦合反应法(可耦合脱氢酶反应) 脱氢酶以NADH/NADPH为辅酶
NADH/NADPH的转换可耦 合340nm吸光度变化:
酶活性的检测方法
葡萄糖激酶的活性检测:
3.反应条件应有利于指定反应方向的进行,可以移除生成 物,或接上耦合反应。
二、酶活性的检测方法
直接测定生成物
耦合反应法 (可耦合脱氢酶反应)
光谱学检测法 HPLC检测法 化学测定法 电极检测法
酶活性检测的具体方法
(一) 光谱学检测法
• 生成物有特定的紫外或荧光吸收
木聚糖酶、纤维素酶活性检测:
木聚糖 羧甲基纤维素
主要内容
酶催化反应原理 酵素产品部分酶活性的检测
一、酶催化反应原理
把催化反应转化成可测量的模式
Juang RH (2005) EPA
测量酶催化活性应注意的事项
酶活性的检测通常是指催化活性的检测,建立活性检测步 骤时,应注意:
1.测定生成物的产生量比测定反应物的消失量),回 馈抑制酶反应。
酶活性的检测方法
(三) 化学测定法
• 如果生成物不具有光谱学特性,可以通过化学反应使之转化成 具有特定光谱吸收的物质,进而进行测定。
酶活测定原理

酶活测定原理酶活测定是通过测定酶反应产物生成的物质量或反应速率来确定酶活性的一种方法。
这种测试被广泛应用于生物、医学、环境和食品科学领域。
本文将重点介绍酶活测定的原理和方法。
一、酶的定义和分类酶是一类具有催化生物反应能力的蛋白质,在生物体内担任调节代谢过程的重要角色。
酶的活性被认为是其特异性、选择性和效率的关键因素。
酶根据其催化反应类型,可以分为六类:1. 氧化还原酶:例如过氧化物酶和葡萄糖氧化酶,可以将还原剂氧化成相应的氧化物。
2. 转移酶:例如乙醛酸酯酶和谷氨酰胺转移酶,可以将一个基团从一个分子转移到另一个分子。
3. 加水酶:例如酯酶和葡萄糖苷酶,可以加入水分子切断化学键。
4. 合成酶:例如DNA聚合酶和RNA聚合酶,可以将单体结合成聚合物。
5. 裂解酶:例如蛋白酶和纤维蛋白溶解酶,可以降解大分子化合物。
6. 引导酶:例如酰基载体蛋白,可以在代谢过程中向该蛋白基团上结合或从该基团上解离。
二、酶活测定的原理酶活性通常通过测量酶反应的速率来评估。
酶反应速率与底物浓度、酶浓度、反应温度和pH值等条件有关。
在酶活测定中,这些条件必须被控制和标准化。
测量酶活性可以通过直接测量酶反应产物生成的量或测量反应底物消耗的量来进行。
下面介绍常用的酶活测定方法。
1. 进行光学密度测定酶活测定可以通过光学测量来实现。
在酯类水解反应中,酶催化酯水解为醇和羧酸。
在这种反应中,测量分离的醇透过率或吸光度变化,可以计算出相应的反应产物含量。
这种方法可以适用于其他酶反应,例如测定酒精脱氢酶催化的乙醛氧化反应。
2. 进行电化学测定另一种常用的酶活测定方法是电动势测定。
该方法用于测量电位差的变化以检测酶催化反应过程中电子的流动。
在氧化还原酶催化的反应中,测量体系中的电位差可以告诉我们酶的活性程度。
3. 进行放射性测定有些酶活性测定需要使用放射性示踪剂。
在DNA聚合酶催化下进行DNA复制实验中,可以使用放射性示踪剂来测量酶反应产物的数量。
测定酶活性的方法

测定酶活性的方法
测定酶活性的常用方法有以下几种:
1. 吸光测定法:利用酶催化底物反应产生的产物对特定波长的光的吸收变化进行测定,常见的方法有比色法和荧光法。
2. 浊度测定法:在酶催化底物反应中,产生的沉淀、胶束或团聚物等形成浑浊或沉淀,通过测定反应溶液的浊度变化来确定酶活性。
3. 冷凝法:利用酶催化底物反应产生的产物,通过与特定试剂发生反应产生气体或形成沉淀,在特定条件下进行冷凝,并通过测定冷凝物的质量或体积变化来确定酶活性。
4. 离子选择性电极法:利用通过酶催化底物反应产生或消耗的离子浓度变化,通过检测特定离子选择性电极反应电位的变化来测定酶活性。
5. 标记物测定法:将底物或产物标记上特定的分子或放射性核素,通过测定标记物在反应中的变化来测定酶活性,如放射性测定法、荧光标记物测定法等。
这些方法根据不同的实验要求和酶的特性可以选择不同的测定方法来进行酶活性的测定。
测定酶活性浓度的两大类方法
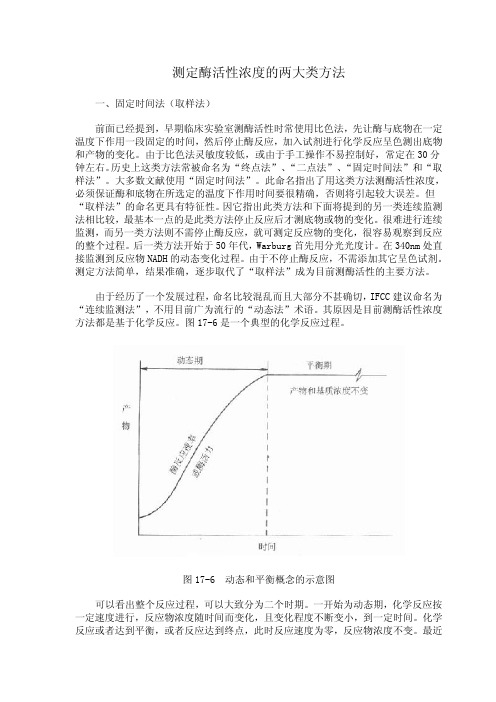
理论上的 V0 在实际工作中是不存在的,必须让酶和底物作用一段时间,消耗掉一 定量的底物,才能测出反应速度,一般说,如消耗底物在 5%内所测到的反应速度都 可认为是初速度,如底物浓度很高时,底物消耗在 20%以内的反应往往还在线性反应 期。
是不是所有类型的酶偶联反应都可用来测酶活性浓度?回答是否定的。因为测酶 的活性浓度是依据测定酶反应速度——△A/△t 或△B/△t 求出。在酶偶联法,此值 无法直接求出,而是通过测定指示酶反应△C/△t 间接求出,要使酶偶联法测得的酶 活性浓度准确可靠,则 Vind=Vx。换言之,指示酶的最大反应速度必须等于或接近测 定酶的最大反应速度。
只有当反应如曲线 A 时,用“固定时间法”才能测出真实的酶活性,实际工作中 是很少见的,图中曲线 B 代表了最常见的反应情况,在一个很短的线性反应期后在大 部分测定期间内主要为非线性反应期。曲线 C 说明在测定期间包括了延滞期,曲线 D 则不仅包括了延滞期,还包括非线性期,在这些反应中如用固定时间法来测定,结果 是不够准确的,一般是偏低的,而且酶浓度愈高,偏离程度愈大。
从理论上说,用酶偶联反应测酶活性浓度时,最好条件应是测定酶反应为限速反 应。动力学上为零级反应,而指示酶为一级反应,酶反应速度与指示酶底物浓度相关。
(二)指示酶、辅助酶的种类和浓度
指示酶、辅助酶的种类:常规化验中常用的酶偶联法中,多以脱氢酶为指示酶, 在常规化验中的自动分析仪几乎无一例外都有 340nm 波长,通过 NAD(P)H 系统可以很 方便地监测到指示酶反应。但从理论上说,往往可以有不止一种偶联方法,只要设法 使偶联反应中最后一个是指示酶反应,前面已提到测 CK 可以正向逆向二个方向建立 二种不同酶偶联的反应。又如在丙氨酸转氨基酶(ALT)测定法中,正向反应后产生 丙酮酸和谷氨酶,目前最常用的是用乳酸脱氢酶与丙酮酸偶联反应,伴有 NADH 下降。 但也可以用谷氨酸脱氢酶与谷氨酸作用,伴有 NADH 生成。
酶活性的测定

低温酶学
五、pH 对酶反应的影响
最适pH时的酶 最适 时的酶 活力最大
•最适 因酶而异, 最适pH因酶而异 最适 因酶而异, 多数酶在7.0左右 多数酶在 左右 •是酶的特性之一 是酶的特性之一
连续监测法所需仪器
仪器 722s型分光光度计、电子分析天平、 高速冷冻离心机、微量移液器等
过氧化物酶活力的测定
操作步骤
一、酶液提取
分别精确 分别精确称取不同部位的植物样品0.2g左右,加入预冷的酶提取缓冲液约 精确 5ml,于研钵中研磨成匀浆(冰浴),匀浆转入2支离心管,用少量(约1ml)缓 冲液冲洗研钵一并转入,托盘天平平衡后于8000转/分钟离心15分钟(低温)。 将上清液倒入刻度试管,定容至10ml,插入冰浴待测。
酶活性单位(U 酶活性单位 )
按照国际酶学会议 的规定,1个酶活 力单位是指在25℃ 、测量的最适条件 (指最适pH、温 度等)下,1分钟 内能引起1微摩尔 底物转化的酶量。
术语酶活力指的是 溶液或组织提取液 中总的酶单位数。
在酶的纯化过程中 常用到另一个术语 (specific activity) )
比活
是指每毫克蛋白含有的酶单位数。 是指每毫克蛋白含有的酶单位数。随着 毫克蛋白含有的酶单位数 酶纯化的进行,比活会越来越高, 酶纯化的进行,比活会越来越高,当酶 已被纯化至纯酶时,比活是个恒定值。 已被纯化至纯酶时,比活是个恒定值。 所以比活是酶纯化程度的指标 指标。 所以比活是酶纯化程度的指标。
双分子反应、 双分子反应、一级反应
酶促反应的动力学方程式
1、米氏方程 、
1913年Michaelis和Menten提出反应速度与底 年 和 提出反应速度与底 物浓度关系的数学方程式,即米- 物浓度关系的数学方程式 ,即米 - 曼氏方程 简称米氏方程(Michaelis equation)。 式,简称米氏方程 。
各种酶活性测定方法

各种酶活性测定方法第一超氧化物歧化酶SOD测定一、原理超氧物歧化酶〔superoxidedismutase,SOD〕普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶.本实验依据超氧物歧化酶抑制氮蓝四唑〔NBT〕在光下的还原作用来确定酶活性大小.在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生O2,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收.而SOD可清除O2,从而抑制了甲腙的形成.于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高.据此可以计算出酶活性大小.二、材料、仪器设备与试剂〔一〕材料;水稻或小麦叶片〔二〕仪器设备:1.高速台式离心机;2.分光光度计;3.微量进样器;4.荧光灯〔反应试管处照度为4000Lx〕;5.试管或指形管数支.〔三〕试剂 1. 0.05mol/L 磷酸缓冲液〔pH7.8〕;2. 130mmol/L 甲硫氨酸〔Met〕溶液:称1.9399gMet用磷酸缓冲液定容至100ml;3.750μmol/L 氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存;4. 100μmo l/L EDTA-Na2溶液:称取0.03721gEDTA-Na2用磷酸缓冲液定容至1000ml;5. 20μmol/L 核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml避光保存.三、实验步骤1. 酶液提取取一定部位的植物叶片〔视需要定,去叶脉〕0.5g于预冷的研钵中,1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5ml.取 1.5~2ml于1000rpm下离心20min,上清液即为SOD粗提液.2. 显色反应取5ml指形管〔要求透明度好〕4支,2支为测定管,另2支为对照管,按下列加入各溶液:试剂〔酶〕用量〔ml〕终浓度〔比色时〕0.05mol/L 磷酸缓冲液1.5130mmol/L Met 溶液0.313mmol/L 750μmol/L NBT溶液0.375μmol/L 100μmol/L EDTA-Na2液0.310μmol/L 20μmol/L 核黄素0.320μmol/L 酶液0.052支对照管以缓冲液代替酶液蒸馏水0.25总体积3.0混匀后将1支对照管置暗处,其它各管于4000Lx日光下反应20min〔要求各管受光情况一致,温度高时间缩短,低时延长〕.3. SOD活性测定与计算至反应结束后,以不照光的对照管做空白,分别测定其它各管的吸光度.四、结果计算已知SOD活性单位以抑制NBT光化还原的50%为一个酶活性单位表示,按下式计算SOD活性.SOD总活性=<A ck-A E>×V/<A ck×0.5×W×V t>上式中,SOD比活力=SOD总活性蛋白质含量式中SOD总活性以每克鲜重酶单位表示;比活力单位以酶单位/mg蛋白表示Ack照光对照管的吸光度AE样品管的吸光度V样品液总体积〔ml〕Vt测定时样品用量〔ml〕W样鲜重〔g〕蛋白质含量单位为:mg蛋白/g鲜重. SOD、POD、CAT、MDA的测定方法-非试剂盒法缩写:SOD:超氧化物歧化酶; CAT:过氧化氢酶; POD:过氧化物酶; MDA:丙二醛;PVP:聚乙烯吡咯烷铜K-30;L-Met:甲硫氨酸;NBT:氮蓝四唑;TBA:硫代巴比妥酸;TCA:三氯乙酸;PBS: 磷酸缓冲液1. SOD的测定方法加样顺序:〔V=3ml〕磷酸缓冲液:1.5ml L-Met: 0.3mlNBT: 0.3mlEDTA-Na2: 0.3ml 核黄素:0.3ml 酶液:0.05ml 蒸馏水:0.25ml试剂配制:<1> 0.05mol/L PBS:pH7.8<2> 130mmol/L L-Met: 1.9399g Met用PBS定容至100ml<3> 750mmol/L NBT: 0.06133g用PBS定容至100ml<避光保存><4> 100umol/L EDTA-Na2: 0.03721g用PBS定容至1000ml<5> 20umol/L核黄素: 0.0753g用蒸馏水定容至1000ml<避光保存>注:〔1〕对照:以加缓冲液、不照光为空白;照光的为最大还原管<2> 照光后至显蓝色要立即避光放置、迅速测定A560值2.MDA的测定方法试剂配制:〔1〕5% TCA: 5g用蒸馏水定容至500ml〔2〕0.5% TBA:2.5g用TCA定容至500ml方法:酶液1ml—3ml0.5%TBA和5%TCA—混合后在100度水浴煮沸15min—迅速冷却,10000r/min 离心10min—用蒸馏水调零分别测定上清液在532nm、600nm处的吸收值3.POD的测定方法试剂配制:〔1〕0.1mol/L的醋酸缓冲液:8.8mlA+41.2mlB得到100mlph5.4的醋酸缓冲液A<0.2mmol/L的HAc溶液>—6ml冰醋酸溶到494ml蒸馏水中〔2〕0.25%愈创木酚溶液—125um愈创木酚溶于50ml 50%乙醇中〔临用前配制〕〔3〕0.75%H2O2溶液:1.25ml 30% H2O2定容至50ml〔临用前配制〕方法:比色杯中依次加入2ml 0.1mol/L的醋酸缓冲液—1ml 0.25%愈创木酚溶液—xml酶液〔5min值为500-800即可〕—0.1ml 0.75%H2O2溶液—迅速巅到混匀把A460调零并开始计时—1次/30s,连续读取3min4.CAT的测定方法试剂配制:<1> 50mmol/L的PBS〔pH7.0〕 <2> 0.3% H2O2—1ml H2O2定容至100ml方法:<1>以不加H2O2的50mmol/L的PBS〔pH7.0〕为空白把A240调零<2>50ul酶液—3ml 50mmol/L的PBS〔pH7.0〕—0.2ml 0.3% H2O2—迅速颠倒混匀,开始计时—1min后在240nm下比色,1次/1min<连续读取5min>.20XX06月22日星期二 19:331 叶绿素含量测定:80%的丙酮液的配制:4L丙酮+ 1L蒸馏水.称0.5g左右的叶片放在50ml的离心管〔做三个重复〕,加入25ml浓度为80%的丙酮液,放在黑暗处浸提大约36小时后取出,稀释4倍后分别在波长663nm、645nm、652nm和470nm 下测定光密度,以80%的丙酮液为空白.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P35~36〕也可用95%乙醇溶液,在665、649、470nm处有最大吸收峰649Cx.c=<1000D470-2.05Ca-114Cb>/2452 抗氧化酶活性的定:〔2.5g样〕0.05mol/L磷酸缓冲溶液<PBS>〔pH=7.8〕溶液的配制:65.5506g Na2HPO4·12H2O + 2.65285g NaH2PO4·2H2O, 定容到4L.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P134〕. 取低温保存的鲜样,称2g左右的叶片〔或根〕放在50ml的离心管,加入20ml浓度为0.05mol/L 磷酸缓冲溶液〔pH=7.8〕〔最好是较冷的磷酸缓冲溶液,防止研磨时温度过高使酶失活〕,研磨〔用磨碎机磨〕,8000r/min的冷冻离心机下离心20分钟,上清液为粗酶液.2.1丙二醛〔MDA〕的测定:20%三氯乙酸〔TCA〕溶液的配制:称200g三氯乙酸,用蒸馏水定容到1000ml.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P124〕;0.5% 硫代巴比妥酸〔TBA〕溶液的配制:称5g硫代巴比妥酸〔TBA〕,用20%三氯乙酸〔TCA〕溶液溶解并定容到1000ml.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P124〕〔先加少量的氢氧化钠1mol/L溶解〕;0.5ml酶液〔对照用0.5ml的0.05mol/L pH=7.8的磷酸缓冲液代替酶液〕〔做三个重复〕+ 3mlTBA――振荡――沸水浴上反应30min――冷却〔至少30min〕――比色〔OD600、OD532、OD450〕.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P124〕2.2超氧化物歧化酶〔SOD〕的测定:NBT<400ml>混合反应液:392mlPBS<Ph=7.8>,+0.0206g NBT+ 0.776g甲硫酸铵+8ml核黄素溶液+0.4ml EDTA-Na溶液〔100mlPBS缓冲溶液中含0.01204g核黄素〕.〔另配〕100ml PBS溶液加EDTA-Na 3.7224gEDTA-Na测试时:取3ml反应液+0.05ml<根>或0.02 ml<叶>粗酶液,于光照培养箱中6-10分钟,OD650下测定吸光度.2.3过氧化物酶〔POD〕的测定:0.05mol/L磷酸缓冲溶液<PBS>〔pH=7.0〕溶液的配制:10.9251g Na2HPO4·12H2O + 3.042975g NaH2PO4·2H2O,定容到1000ml.0.3%H2O2溶液的配制:吸2.5ml 30%H2O2,用0.05mol/L pH=7.0磷酸缓冲溶液<PBS>定容到250ml.0.2%愈创木酚溶液的配制:称0.5g愈创木酚,用0.05mol/L pH=7.0磷酸缓冲溶液<PBS>定容到250ml.2ml 0.3%H2O2溶液+ 0.95ml 0.2%愈创木酚溶液+ 1ml 0.05mol/L pH=7.0磷酸缓冲溶液<PBS> + 0.02ml??〔原来为0.01〕酶液〔根加0.05ml酶液〕〔对照用0.05mol/L磷酸缓冲溶液代替酶液〕〔做三个重复〕,记录470nm处OD降低速度.将每分钟OD增加0.01定义为1个活力单位.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》P121〕比色时加酶液,混合后即刻计时.2.4 脯氨酸的测定标准曲线的制作:编号1234567标准脯氨酸的量〔ml〕00.10.20.40.60.81.0H2O〔ml〕1.00.90.80.60.40.20冰乙酸〔ml〕2222222显色液〔ml〕3333333脯氨酸含量〔µl〕012468100.5ml酶液〔对照用0.5ml 80%乙醇代替〕〔做三个重复〕+ 1ml冰乙酸+ 1.5ml显色液―――混匀,沸水浴15min,冷却后测OD520.2.5可溶性蛋白的测定〔参考赵志杰,史国安,董新纯编的《植物生理学实验指导》〕牛血清白蛋白:配成100µg/ml和1000µg/ml.90%乙醇:90ml乙醇+ 10ml蒸馏水.???85%〔W/V〕磷酸:170ml磷酸+ 30ml蒸馏水.考马斯亮蓝G-250:称0.2g考马斯亮蓝G-250溶于100ml 90%乙醇中,加入85%〔W/V〕磷酸200ml,用蒸馏水定容到2L.常温下可保存一个月.标准曲线的制作:配制0~100µg/ml血清白蛋白血液管号123456100µg/ml牛血清白蛋白<ml>00.20.40.60.81.0蒸馏水量<ml>1.00.80.60.40.20蛋白质含量〔ml〕00.020.040.060.080.10配制0~1000µg/ml血清白蛋白血液管号789101112100µg/ml牛血清白蛋白<ml>00.20.40.60.81.0蒸馏水量<ml>1.00.80.60.40.20蛋白质含量〔ml〕00.20.40.60.81.00.1ml 酶液〔做三个重复〕+ 5ml考马斯亮蓝G-250―――混匀,放置2min后在595nm下比色.2.6过氧化氢酶〔CAT〕的测定:0.3%H2O2溶液的配制:吸5ml 30%H2O2,用0.05mol/L pH=7.0磷酸缓冲溶液<PBS>定容到500ml.1 ml 0.3%H2O2溶液+ 1.9ml H2O + 0.1 ml 酶液,测定240nm处OD降低速度.将每分钟OD 减少0.01定义为1个活力单位.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》P121〕2.7 抗坏血酸〔ASA〕的测定:〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P125〕5%三氯乙酸〔TCA〕溶液的配制:25g三氯乙酸,用蒸馏水定容到500ml.10%三氯乙酸〔TCA〕溶液的配制:25g三氯乙酸,用蒸馏水定容到250ml.150mmol/L NaH2PO4〔pH 7.4〕溶液的配制:100ml.44%H3PO4溶液的配制:250ml.4%2,2-二联吡啶溶液的配制:250ml.3%FeCl3溶液的配制:100ml.首先标制作准曲线.粗酶液的提取:取低温保存的鲜样,称0.5g左右的叶片〔或根〕放在50ml的离心管,加入15m 5%三氯乙酸〔TCA〕溶液〔最好是较冷的三氯乙酸〔TCA〕溶液,防止研磨时温度过高使酶失活〕,研磨〔用磨碎机磨〕,15000r/min的冷冻离心机下离心10分钟,上清液为粗酶液,用于抗坏血酸〔ASA〕含量的测定.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》P125~126〕测定:0.2ml 粗酶液+ 0.2ml 150mmol/L NaH2PO4〔pH 7.4〕溶液+ 0.2ml H2O,混匀〔振荡〕,至少30秒后,再依次分别加入:0.4 ml 10%三氯乙酸〔TCA〕溶液+ 0.4 ml 44%H3PO4溶液+ 0.4 ml 4%2,2-二联吡啶溶液+ 0.2ml 3%FeCl3溶液,混合后在37℃水浴中保温60min,测定OD525处的值.〔参考陈建勋,王晓峰主编的《植物生理学实验指导》P125~126〕2.8 谷胱甘肽的测定:4g新鲜材料+ 2ml 0.3mol/L醋酸汞+ 2ml 30%醋酸钠后研磨匀浆,转移到离心管中,以蒸馏水冲洗残渣,并以玻璃棒搅拌,净置10min,使之充分沉淀,离心后弃去上清液,沉淀以水〔每次10ml〕在摇动情况下冲洗2次.向沉淀中加入10ml 1mol/L盐酸以溶解其中的谷胱甘肽,以玻璃棒搅拌5min后加入1ml 20%的碘化钾溶液,混匀,离心.上清液转入供滴定用的100ml玻璃管中,沉淀在搅动情况下以10ml水冲洗.离心后溶液与第一次离心液合并.向得到的溶液中加入0.5ml淀粉液,用1mmol/L KIO3滴定,直至出现不消失的蓝色为止.1ml 1 mmol/L 的KIO3相当于0.307mg谷胱甘肽.〔参考《现代植物生理学实验指南》,中国科学院##植物生理研究所编〕.2.9天冬酰胺合成酶〔AS〕的测定:2.10 天冬酰胺转氨酶〔AspAT〕的测定:3 硝酸还原酶<NR>的测定采用离体法:〔1g样〕〔参考陈建勋,王晓峰主编的《植物生理学实验指导》,P27~29〕亚硝酸钠标准溶液〔1µg/ml〕:称NaNO2 0.9857g ,定容到1000ml,再吸5ml定容到1000ml.0.1 mol/L pH7.5的磷酸缓冲溶液:30.0905g Na2HPO4·12H2O + 2.4965g NaH2PO4·2H2O,加蒸馏水定容到1000ml.3mol/L HCl:125ml浓盐酸加蒸馏水定容到500ml.1%磺胺溶液:5.0g磺胺溶于500ml 3mol/L HCl中.0.2%a-萘胺溶液:1.0g a-萘胺溶于125ml冰醋酸后用蒸馏水定容到500ml,贮于棕色瓶中.0.1mol/L KNO3溶液:5.055g KNO3溶于500mln 0.1 mol/L pH7.5的磷酸缓冲溶液.0.025mol/L pH8.7的磷酸缓冲溶液:Na2HPO4·12H2O 8.8640g + NaH2PO4·2H2O 0.0570g,加蒸馏水定容到1L.提取缓冲液:1.211g半胱氨酸+ 0.372g EDTA,溶于1L 0.025 mol/L pH8.7的磷酸缓冲溶液. 2mg/ml NADH 溶液:0.5g NADH溶于250ml 0.1 mol/L pH7.5的磷酸缓冲溶液〔临用前配制〕. 首先标制作准曲线:取7支洁净烘干的15ml刻度试管加试剂,即配成0~2.0μg的系列标准亚硝态氮溶液.摇匀后在30℃保温箱或恒温水浴中保温30min,然后在540nm波长下比色.以亚硝态氮〔μg〕为横坐标〔x〕,光密度值为纵坐标〔y〕绘标准曲线或建立回归方程.各试剂加入顺序管号1234567亚硝酸钠标准液<ml>00.20.40.81.21.62.0蒸馏水<ml>2.01.81.61.20.80.401%磺胺溶液<ml>44444440.2%α-萘胺<ml>4444444每管含NO2- <μg>00.20.40.81.21.62.01g 材料+15ml提取缓冲液后研磨匀浆,转移到离心管中于4℃、4000r/min下离心15min,上清液即为粗酶提取液,用于硝酸还原酶<NR>的测定.0.4ml+1.2ml 0.1mol/L KNO3溶液+ 0.4mlNADH溶液后混匀〔对照不加NADH溶液,而以0.4ml 0.1mol/L pH 7.5磷酸缓冲液代替〕,在25℃水浴中保温30min.保温结束后立即加入1ml 磺胺溶液终止酶反应,再加1ml 0.2%a-萘胺溶液,显色反应15min后于4000r/min下离心5min,取上清液在540nm下比色测定吸光度.根据回归方程计算.。
各种酶活性测定方法

抗坏血酸过氧化物酶(APX)活性的测定过氧化氢酶(CAT)活性测定过氧化物酶(POD)测定方法超氧化物歧化酶(SOD)活性测定小组第一次讨论结果:一、抗坏血酸过氧化物酶(APX)活性的测定1.原理APX 是植物体内重要的抗氧化酶, 主要功能是分解H2O2, 此过程通过抗坏血酸- 谷胱甘肽循环来完成。
此外, 它还直接参与抗坏血酸的氧化还原代谢, 而抗坏血酸能有效地清除多种活性氧自由基。
因此,APX被认为与果实的抗热性直接相关。
2.所用方法(1)采用碘液滴定法:称取新鲜材料1 g,剪碎置研钵中,加少量石英砂及pH值6.0 的磷酸盐缓冲液,迅速研磨成浆,20 ℃下浸提30 min,中间摇动数次,3000 r /min 离心后保留上清液即为酶液。
反应底物为抗坏血酸,加入酶液2 mL,20 ℃下反应10 min 后,立即加入偏磷酸1 mL,终止酶的活动,抗坏血酸被消耗的量,可用碘液滴定剩余的抗坏血酸来进行测定,加淀粉溶液几滴作指示剂,以碘液滴定出现浅蓝色为止,记录滴定值,用底物被消耗的量来表示APX 的活性。
每个处理设3 个重复。
(2)紫外吸收法:称取1g芥蓝叶片组织,加入1.6 mL预冷的磷酸缓冲液(PBS-K)(pH 7.8)提取液(含1 mmol·L-1 AsA,3 mmol·L-1β-巯基乙醇,0.5 mmol·L-1PMSF,2% PVP,1 mM EDTA)。
用液氮研磨,提取液于4℃,12000×g离心20 min,上清液用于酶活性的测定。
取0.10 ml 酶液(可视情况调整),加入1.70 ml 含0.1 mM EDTA-Na2的PBS(0.05 mol/L,pH7.0),再加入0.10 ml 5 mM的AsA,最后加入0.10 ml 20mM H2O2,立即在20℃下测定D290(紫外)值在一定时间内的变化,计算单位时间内AsA减少量,并求酶活性(室温下测定,缓冲液调零)。
酶活性测定的主要影响因素及控制要点

和 K 可用校准物定期校正。
3.2 校准物
可用作酶活性测定用的校准物分两类。 一类是产物的基准物质,
如对硝基酚、对硝基苯胺等, 用于校准仪器的 值(摩尔吸光系数)。
另一类称酶校准物(Enzyme calibrator),
指样品先与缺乏某种底物的试剂1预孵育一定时 间后,再加入内这种底物的试剂2,开始启动样 品中的待测酶的酶促反应。
好处是在待测酶酶促反应开始之前,可以除去某 些干扰物,包括内源性干扰物和外源性干扰物。
这种模式需要双试剂剂型。
样品启动模式。
指反应所需的试剂先混合在一起,然后加入样品, 依靠样品中的待测酶来启动酶促反应;
酶的测定方法分为绝对定量法和相对定量法两大类,以后者 为主。
酶催化化学反应的能力称为酶活性(activity)。 酶活性浓度的测定受许多因素的影响。
酶活性浓度测定的主要影响因 素
1. 标本及标本采集和处理因素 2. 试剂及方法学因素 3. 仪器因素的影响 4. 测定条件与参数设置
1.标本及标本采集和处理因素 的影响及控制
常见的影响因素
2.1 定时法与连续监测法 2.2 检测底物或检测产物 2.3 底物启动模式与样品启动模式 2.4 正向反应与逆向反应 2.5 试剂的干扰作用
2. 影响因素的控制
选购试剂盒时
要仔细阅读试剂盒说明书; 了解试剂盒所用方法的原理、试剂配方等; 选择IFCC或中华医学会检验学会推荐的常规方
检测系统
光度计的准确性、重复性、线性范围和杂散光等 均会造成结果的偏差。
3 仪器影响因素的控制
在日常工作中,除常规做好仪器和设备的 正确使用和维护外,
酶活性检测

④分光光度法利用底物和产物光吸收性质的不同,可直接测定反应混合物中底物的减少量或产物的增加量。
几乎所有的氧化还原酶都使用该法测定。
如还原型辅酶Ⅰ(NADH2)和辅酶Ⅱ(NADPH2)在340nm有吸收,而NAD和NADP在该波长下无吸收,脱氢酶类可用该法测定。
该法测定迅速简便,自动扫描分光光度计的使用对酶活力的快速准确的测定提供的极大的方便。
酶在食品加工中的作用就像一把双刃剑,我们要趋利避害。
酶的积极作用我们要加强,在食品加工过程中添加酶制剂,使其作用充分发挥;消极作用我们要尽量避免,可以通过加热等方法将酶灭活,消除其不利影响。
为了将酶更好地应用于食品加工,研究酶的性质是十分必要的。
而紫外-可见分光光度法是研究酶性质的重要方法之一。
下面我们来介绍用-可见分光光度计测定酶活的具体方法。
紫外-可见分光光度法测定酶活:1. β一半乳糖苷酶β一半乳糖苷酶,又称乳糖酶(Lactase)。
能水解乳糖来降低乳制品的乳糖含量,从而提高乳制品的可消化性,用于低乳糖牛奶和非结晶型浓缩牛奶的生产及奶酪风味的改变,同时还可用于生产低聚半乳糖。
【酶活测定】以ONPG为底物测定β-半乳糖苷酶活力。
【酶活定义】以ONPG为底物,37℃保温酶解,每分钟释放lμmol/L邻硝基酚的酶量,定义为1个酶活力单位。
2. 超氧化物歧化酶超氧化物歧化酶(Superoxide Dismutase,简称SOD)是一种十分重要的生物体防止氧化损伤的酶类,是生物体内超氧阴离子清除剂,保护细胞免受损伤。
SOD广泛存在于各类生物体内,所有好氧微生物细胞中都含有SOD。
自1969年Mccord等人首次发现了SOD 生物活性后,医学界对其医疗作用做了许多研究,证明它具有抗衰老、抗肿瘤、抗辐射、抗缺血、提高人体免疫力等作用,被专家称为21世纪最有前途的药用酶。
欧美国家已开始将其应用于医疗、食品、保健、化妆品等领域。
【酶活测定】在25℃4.5ml 50mmol/L pH8.3的K2HPO4- KH2PO4缓冲液中加入待测SOD样液,再加入10ul 50mmol/L的连苯三酚,迅速摇匀,倒人光径lcm 的比色杯,在325nm波长下每隔30s测一次A值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
准确称取天山云杉种子0.1 g,先加入1 ml 预冷的50 mmol/ L的磷酸缓冲液(pH 7.0,内含1 mmol/ L EDTA),研磨成匀浆,然后用4.5 ml 分两次冲洗研钵至试管中,4 ℃,10000 r/min 离心20 min,上清液即为酶提取液,4 ℃保存用于ROS系统酶活性分析。
3 酶活性的测定
3.1 过氧化物酶(POD,EC 1.11.1.7) 活性的测定。
按照Chance 和Maehly[6]的方法,并作如下修改:反应混合液为50 mmol/ L的磷酸缓冲液(pH 7.0,内含0.1 mmol/ L EDTA) 2.9 mL,2 % H2O2 1.0 mL,50 mmol/ L 愈创木酚1.0 mL。
测定时,反应混合液先在25 ℃水浴中预热,立即加入0.1 mL酶液以启动反应,以缓冲液调零,测定OD470值,每隔30 s读数一次。
取0 — 60 s 时间段,即1 min 反应时间来计算酶活性。
以每分钟OD470增加0.01的酶量为一个酶活单位,U·g-1。
计算公式: POD活性= ΔA470 × V t × (0.01× t × FW × V1) -1
注: ΔA470:反应时间内吸光度的变化;V t:酶提取液总体积,ml;V1:测定用酶提取液体积,ml;FW:样品鲜重,g;t: 反应时间,1 min
3.2 过氧化氢酶(CAT,EC 1.11.1.6) 活性的测定。
按照Aebi[7]的方法,并作如下修改:反应混合液为酶液0.2 mL (空白管以失活的酶液代替),50 mmol/ L的磷酸缓冲液(pH 7.0,内含0.1 mmol/ L EDTA) 1.5 ml,蒸馏水 1.0 ml。
测定时,反应混合液和0.1 mol/ L H2O2预先在25 ℃水浴中预热。
取反应混合液,加入0.1 mol/ L H2O2 0.3 ml,终体积为3 ml,测定OD240值,每隔1 min读数一次,共读4 min。
以每分钟OD240减少0.1的酶量为一个酶活单位,U·g-1。
计算公式:CA T活性= ΔA240 × V t × (0.1× t× FW × V1) -1
注: ΔA240:A0-(A1+ A2) / 2;A0:对照管的吸光度;A1,A2:样品管的吸光度;V t:酶提取液总体积,ml;V1:测定用酶提取液体积,ml;FW:样品鲜重,g;t: 反应时间,1 min 3.3 超氧化物歧化酶(SOD,EC 1.15.1.1) 活性的测定。
按照Giannopolitis 和Ries[8]的方法,并作如下修改:反应体系: 50 mmol/ L,pH 7.8 磷酸缓冲液3.0 ml,130 mmol/L甲硫氨酸0.6 ml,750 μmol/L氮蓝四唑0.6 ml,0.1 mmol/ L EDTA 0.6 ml,酶提取液0.2 ml(对照管以失活的酶液代替),蒸馏水1.0 ml,20 μmol/ L核黄素0.6 ml。
混匀后,将一支对照管放置暗处,其他各管置于30 ℃光照为4000 lx 日光灯下反应20 min(要求照光情况一致,视酶活性高低适当调整反应时间)。
至反应结束后,用黑布遮住试管,终止反应。
以避光的对照管作为空白,测定各管OD560值。
以抑制NBT光化还原的50 % 为一个酶活单位,U·g-1。
计算公式:SOD活性= (A0-A s) × V t × (0.5 × A0 × FW × V1) -1
注: A0:照光对照管的吸光度;A s:样品管的吸光度;V t:酶提取液总体积,ml;V1:测定用酶提取液体积,ml;FW:样品鲜重,g
3.4 抗坏血酸过氧化物酶(APX,EC 1.11.1.11) 活性的测定。
按照Nakano 和Asada[9]的方法,并作如下修改:反应混合液为50 mmol/ L 磷酸缓冲液(pH 7.0,内含0.1 mmol/ L EDTA),0.5 mmol/ L ASA。
测定时,反应混合液和6 mmol / L H2O2预先在25 ℃水浴中预热。
取反应混合液2.9 ml,加入酶液50 μl,加入6 mmol / L H2O2 50 μl (终浓度为0.1 mmol/ L) 以启动反应,终体积为3 ml,以不加H2O2作空白调零,测定OD290值,每隔10 s读数一次。
取0 — 30 秒时间段,即30 秒反应时间来计算酶活性。
以每分钟氧化1 μmol ASA的酶量为一个酶活单位,U·g-1·min-1。
计算公式: APX活性= ΔA290 × V t × (2.8 × t × FW × V1) -1
注: ΔA290:反应时间内吸光度的变化;V t:酶提取液总体积,ml;V1:测定用酶提取液体积,ml;2.8: 1 mmol ASA在290nm波长的消光系数;FW:样品鲜重,g;t: 反应时间,0.5min 3.5 谷胱甘肽还原酶(GR,EC 1.6.4.2) 活性的测定。
按照Halliwell 和Foyer[10]的方法,并作如下修改:反应混合液为50 mmol/ L 磷酸缓冲液, (pH 7.5,内含0.1 mmol/ L EDTA),5 mmol/ LMgCl2。
测定时,反应混合液、10 mmol/ LNADPH2和10 mmol/ L GSSG 预先于25℃水浴中预热。
取反应混合液2.34 ml,加入酶液450 μl、10 mmol/ L NADPH2 60 μl ( 终浓度为0 . 2 mmol/L ) 及10 mmol/ L GSSG 150 μl (终浓度为0.5 mmol/ L ) 以启动反应,终体积为3 ml,以缓冲液代替酶液调零,测定OD340值,每隔30 s读数一次。
取0 — 3.5 min 时间段,即 3.5 min 反应时间来计算酶活性。
以每分钟消耗1 μmol NADPH的酶量为一个酶活单位,U·g-1·min-1。
计算公式: GR活性= ΔA340 × V t × (6.22 × t× FW × V1) -1
注: ΔA340:反应时间内吸光度的变化;V t:酶提取液总体积,ml;V1:测定用酶提取液体积,ml;6.22: 1 mmol NADPH在340nm波长的消光系数;FW:样品鲜重,g;t: 反应时间,3.5min
3.6 谷胱甘肽过氧化物酶(GPX,EC.1.11.1.9) 活性的测定。
按照黄爱缨[3]、Flohe[4,5]等的方法,并作如下修改:反应体系由1.0 mmol/ L GSH 0.2 ml (含2.5 mmol/ L NaN3),酶液0.2 ml组成,由37 ℃预热的1.5 mmol/L H2O2 0.1ml启动反应,立即于37 ℃水浴中反应3 min后,加1.67 % 的偏磷酸沉淀液(含2 % EDTA-2Na, 28 % NaCl) 2 ml 沉淀蛋白质,5000 r/min离心20 min,保留上清液。
取上清液1 ml (空白管加入双蒸水0.2ml和1.67%的偏磷酸沉淀液0.8 ml),加入0.32 mol/L Na2HPO4 1.25 ml 及DTNB (5,5’-二硫对二硝基苯甲酸) 0.25 ml,反应5 min,测OD422值。
必要时也要测定样品本身的GSH (及其他-SH) 的值。
以单位鲜重(g) 的植物样品,在37 ℃下,每分钟使GSH的改变为总量的0.001时为一个酶活性单位(扣除非酶反应的GSH) ,U·g-1·min-1。
计算公式: GPX活性= (A0-A s) × V t × (0.001 × A0 × t × FW × V1) -1
注: A0:照光对照管的吸光度;A s:样品管的吸光度;V t:酶提取液总体积,ml;V1:测定用酶提取液总体积,ml;FW:样品鲜重,g;t:反应时间,5min。
