化学选修4影响化学平衡移动的因素习题参考word
人教版高中化学选修四第二章第三节第3课时影响化学平衡移动的因素(二)

人教版高中化学选修四第二章第三节第3课时影响化学平衡移动的因素(二)( )A .升高温度B .加大X 的投入量C .缩小体积D .增大体积 答案 C解析 由于该反应是等体积反应,缩小体积,平衡不移动,但能缩短达到平衡所用时间。
题组3 化学平衡定向移动的判断6.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H 2O(g)=====催化剂CO 2(g)+H 2(g) ΔH <0反应达到平衡后,为提高CO 的转化率,下列措施中正确的是( )A .增加压强B .降低温度C .增大CO 的浓度D .更换催化剂 答案 B解析 一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但本身的转化率降低,故C 项错误。
A 项因该反应为反应前后气体物质的量相等的反应,故增加压强只能缩短反应达到平衡的时间,并不能使该平衡发生移动,因而无法提高CO 的转化率。
B 项因该反应为放热反应,降低温度能使平衡向右移动,从而提高CO 的转化率。
D 项催化剂只能影响化学反应的速率,改变可逆反应达到平衡的时间,不能提高CO 的转化率。
7.COCl 2(g)CO(g)+Cl 2(g) ΔH >0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO 浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,其中能提高COCl 2转化率的是( )A.①②④B.①④⑥C.②③⑤D.③⑤⑥答案 B解析②恒容通入惰性气体,平衡不移动,③增加CO浓度,平衡左移,⑤加入催化剂,平衡不移动。
题组4条件改变对化学反应速率、化学平衡的综合影响8.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)下列叙述错误的是()A.使用Cu-Zn-Fe催化剂可大大提高生产效率B.反应需在300 ℃下进行可推测该反应是吸热反应C.充入大量CO2气体可提高H2的转化率D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率答案 B解析B项,加热可以加快化学反应速率,放热反应也可能在加热条件下进行,故不正确。
人教版高中化学选修四高二化学每课一练2.3.2影响化学平衡状态的因素.docx

高中化学学习材料2.3 化学平衡第2课时影响化学平衡状态的因素每课一练(人教版选修4)1.已知反应A2(g)+2B2(g)ƒ2AB2(g) ΔH<0,下列说法正确的是( )A.升高温度,正反应速率增加,逆反应速率减小B.升高温度有利于反应速率增加,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动2.有一处于平衡状态的反应:X(s)+3Y(g)ƒ2Z(g) ΔH<0。
为了使平衡向生成Z的方向移动,应选择的条件是( )①高温②低温③高压④低压⑤加正催化剂⑥分离出ZA.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥3.对于反应:2X+Yƒ2Z(正反应为放热反应),若升高温度则能使( )A.反应速率不变,Z的产量减少B.反应速率增大,Z的产量增大C.反应速率增大,Y的转化率降低D.反应速率减小,Z的产量增大4.在密闭容器中发生下列反应:a A(g)ƒc C(g)+d D(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )A.平衡向正反应方向移动B.a<c+dC.D的体积分数增大D.A的转化率变大5.对于密闭容器中的可逆反应:m X(g)+n Y(s)ƒp Z(g)ΔH <0,达到平衡后,改变条件,下列表述不正确的是( )A .增大压强,化学平衡不一定移动B .通入氦气,化学平衡一定不发生移动C .增加X 或Y 的物质的量,化学平衡一定发生移动D .其它条件不变,升高温度,化学平衡一定发生移动6.现有反应:m A(g)+n B(g)ƒp C(g),达到平衡后,当升高温度时,B 的转化率变大;当减小压强时,混合体系中C 的质量分数减小,则:(1)该反应的逆反应为__________热反应,且m +n ________p (填“>”、“=”或“<”)。
化学选修4第二章 训练4影响化学平衡移动的因素【VIP专享】

二、浓度对化学平衡移动的影响
3. 在一密闭容器中发生反应:2A(g)+2B(g)C(s)+3D(g)
ΔH<0,达到平衡时采取下列措施,可以使正反应速率 v 正增大、D 的物质的量浓度
c(D)增大的是
A.移走少量 C
B.扩大容积,减小压强
C.缩小容积,增大压强
D.体积不变,充入“惰”气
4. 在容积为 2 L 的密闭容器中,有反应 mA(g)+nB(g)pC(g)+qD(g),经过 5 min 达到 平衡,此时各物质的变化为 A 物质的量浓度减少 a mol·L-1,B 的平均反应速率 v(B)
B.1∶3∶2∶2
D.1∶1∶1∶1
+D(g),5 min 后达到平衡。若温度不变时将容器的体积扩大为原来的 1=2
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线生高0不产中仅工资2艺料22高试2可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料2荷试2,下卷而高总且中体可资配保料置障试时2卷,32调需3各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看工且25作尽52下可22都能护可地1关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编试求5写、卷技重电保术要气护交设设装底备备置。4高调、动管中试电作线资高气,敷料中课并设3试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
高中化学每日一题影响化学平衡移动的因素(1)新人教版选修4(2021学年)

2017-2018学年高中化学每日一题影响化学平衡移动的因素(1)新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学每日一题影响化学平衡移动的因素(1)新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学每日一题影响化学平衡移动的因素(1)新人教版选修4的全部内容。
影响化学平衡移动的因素(1)高考频度:★★★★☆难易程度:★★★☆☆典例在线Mg(OH)2在水中存在溶解平衡Mg(OH)2(s)Mg2+(aq)+2OH-(aq),要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是A.NH4Cl B.NaOHC.MgCl2 D.Fe【参考答案】A解题必备浓度、压强对化学平衡的影响1.浓度对化学平衡的影响(1)增大反应物浓度,正反应速率加快,平衡向正反应方向移动;增大生成物浓度,逆反应速率加快,平衡向逆反应方向移动。
(2)减小反应物浓度,正反应速率减小,平衡向逆反应方向移动;减小生成物浓度,逆反应速率减小,平衡向正反应方向移动。
(3)从v。
t图象认识浓度对平衡的影响化学平衡a A+b Bc C+d D (A、B、C、D为非固体)体系浓增大反应增大生成减小生成减小反应度变化物浓度物浓度物浓度物浓度速率变化v正瞬间增大,v逆瞬间不变,v′正〉v′逆v逆瞬间增大,v正瞬间不变,v′逆〉v′正v逆瞬间减小,v正瞬间不变,v′正>v′逆v正瞬间减小,v逆瞬间不变,v′逆>v′正平衡移动方向正向移动逆向移动正向移动逆向移动v.t图象规律在其他条件不变的情况下,增大反应物的浓度或减小生成物的浓度,都可以使平衡向正反应方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆反应方向移动。
高中化学影响化学平衡移动的因素后达标检测新人教版选修4

影响化学均衡挪动的要素[ 基础牢固 ]1.可确认发生化学均衡挪动的是()A.化学反应速率发生了改变B.有气态物质参加的可逆反应达到均衡后,改变了压强C.可逆反应达到均衡,使用了催化剂D.因为某一条件的改变,使正、逆反应速率不再相等分析:选D。
化学均衡挪动的本质是正、逆反应速率不相等。
A 中速率发生了改变,但可能正、逆反应速率相同程度地改变,使二者速率再次相等;对于气体体积相等的反应,压强的改变对正、逆反应速率的影响相同; C 中催化剂相同程度地改变了正、逆反应速率。
2.已知反应 A2(g) + 2B2(2AB(g)H<0,以下说法正确的选项是()A.高升温度,正反应速率增大,逆反应速率减小B.高升温度有益于反应速率增大,从而缩短达到均衡的时间C.达到均衡后,高升温度或增大压强都有益于该均衡正向挪动D.达到均衡后,降低温度或减小压强都有益于该均衡正向挪动分析:选 B。
高升温度,正、逆反应速率都增大, A 项错。
高升温度,均衡逆向挪动, C 项错。
减小压强,均衡逆向挪动, D 项错。
3.必定温度下,可逆反应a X(g)+ b Y c Z(g)在一密闭容器内达到均衡后, t 0时辰改变某一外界条件,化学反应速率 ( v) 随时间 ( t ) 的变化以以下图。
则以下说法正确的选项是()A.若a+b=c,则t0时辰只好是增大了容器的压强B.若a+b=c,则t0时辰只好是加入了催化剂C.若a+b≠c,则t0时辰只好是增大了容器的压强D.若a+b≠c,则t0时辰只好是加入了催化剂分析:选 D。
t0时辰正、逆反应速率相同程度增大,均衡不挪动。
若a+ b=c,则 t 0时辰可以是增大压强或使用催化剂,A、B 错;若+≠,则t0 时辰只好是使用催化剂,C错,Da b c对。
4.以下图中曲线a表示放热反应X(g) +Z(g) + N(s) 进行过程中 X 的转变率随时间变化的关系,若只改变一个初步条件,使反应过程按 b 曲线进行,可采纳的措施是()A.高升温度B.加大X 的投入量C.使用催化剂D.减小体积分析:选C。
化学平衡移动-影响因素及练习

2 高考安徽卷 )一定条件下,通过下列反应可实现燃煤 4.(2012· 烟气中硫的回收: SO2(g)+2CO(g)
催化剂
2CO2(g)+ S(l)
ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是 (
D
)
A.平衡前,随着反应的进行,容器内压强始终不变 B.平衡时,其他条件不变,分离出硫,正反应速率加快 C.平衡时,其他条件不变,升高温度可提高 SO2 的转化率 D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
N2O4(g) △H=-56.9kJ/mol
-1S-1) 升高温度 V ( molL 速 升高温度对吸热方向速 率 V’逆 率增加得快?还是放热 | V”正 = V”逆 方向增加得快呢?这决 时 定了哪边的反应速率增 间 V正 大的更多呢? V正= V逆 V’正 关 系 图
V逆
0
t1
t2
t(s)
升 温 对 吸 热 反 应 有 利 , 故 吸 热 一 方 速 率 较 大
T(s)
0
t2
四、温度对化学平衡的影响(P51)
实验探究
2NO2(g) Co2+
N2O4(g) △H<0
(无色) (红棕色 ) 在其它条件不变的情况下:
(粉红色)
升高温度,平衡向吸热反应方向移动; + 4Cl- CoCl42- △H>0 降低温度,平衡向放热反反应方向移动。 (蓝色)
结 论
2NO2(g)
在其他条件不变时: 增大反应物或减小生成物的浓度 QC<KC
化学平衡向 正反应方向 移动 减小反应物或增大生成物的浓度 QC>KC 化学平衡向 逆反应方向 移动
注意:对于离子反应,只能改变实际参加反 应的离子浓度才能改变平衡。
人教版高中化学选修4导学案2.3化学平衡第2课时 影响化学平衡移动的因素Word版含答案
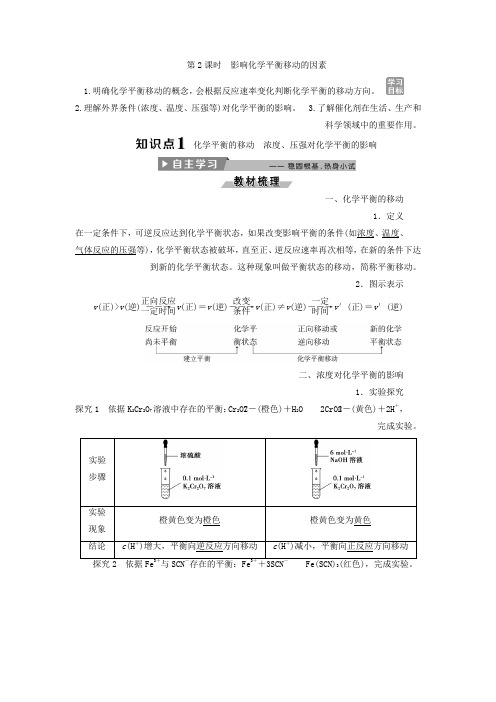
第2课时 影响化学平衡移动的因素1.明确化学平衡移动的概念,会根据反应速率变化判断化学平衡的移动方向。
2.理解外界条件(浓度、温度、压强等)对化学平衡的影响。
3.了解催化剂在生活、生产和科学领域中的重要作用。
化学平衡的移动 浓度、压强对化学平衡的影响一、化学平衡的移动1.定义、温度、浓度如(如果改变影响平衡的条件,可逆反应达到化学平衡状态,在一定条件下次相等,在新的条件下达直至正、逆反应速率再,化学平衡状态被破坏,)等气体反应的压强到新的化学平衡状态。
这种现象叫做平衡状态的移动,简称平衡移动。
2.图示表示v (正)>v (逆)――→正向反应一定时间v (正)=v (逆)――→改变条件v (正)≠v (逆)――→一定时间v ′(正)=v ′(逆)二、浓度对化学平衡的影响1.实验探究探究1 依据K 2Cr 2O 7溶液中存在的平衡:Cr 2O2-7(橙色)+H 2O2CrO2-4(黄色)+2H +,完成实验。
3高中化学专题,优选资源精品化学资料2对可逆反应Fe 3++3SCN-Fe(SCN)3,分别增大c (Fe 3+)和c (SCN -)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动; 滴加NaOH 溶液,由于3OH -+Fe 3+===Fe(OH)3↓,减小了Fe 3+的浓度,Fe(SCN)3的浓度也减小了,即化学平衡向逆反应方向移动(1)其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动。
(2)其他条件不变时,增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
三、压强对化学平衡(有气体参与的反应)的影响 1.2.对于反应前后气体分子数不变的反应[如H 2(g)+I 2(g)2HI(g)],改变压强,化学平衡不发生移动。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)平衡移动的原因是v (正)≠v (逆)。
( )(2)若外界条件改变引起平衡中v (正)>v (逆),则平衡正向移动。
人教版高中化学选修四第二章第三节第2课时影响化学平衡移动的因素(一).docx

高中化学学习材料唐玲出品第2课时影响化学平衡移动的因素(一)[经典基础题]题组1 化学平衡移动的判断1.能引起化学平衡移动的是( ) A.化学反应速率发生了变化B.有气态物质参加的反应达到平衡后,改变了压强C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的变化D.改变了反应物浓度答案 C解析对于等体积反应,体积改变时,压强、反应速率、浓度均发生变化,但平衡不移动。
2.对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知 ( ) A.化学反应速率变化时,化学平衡一定发生移动B.化学平衡发生移动时,化学反应速率一定变化C.正反应进行的程度大,正反应速率一定大D.改变压强,化学反应速率一定改变,平衡一定移动答案 B解析A项,如果正、逆速率改变幅度一样大,则平衡不移动,A错;B项,化学平衡发生移动,则速率一定改变,B对;C项,反应进行的程度与速率无关,C错;D项,改变压强,化学反应速率不一定改变(如固液反应或容器体积不变的反应体系中充入“惰性”气体),平衡也不一定移动。
题组2 浓度对化学平衡移动的影响3.下图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。
下列叙述与示意图不相符合的是( )A.反应达到平衡时,正反应速率和逆反应速率相等B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态ⅡC.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态ⅡD.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等答案 C解析本题主要考查有关化学平衡的建立及速率的改变对化学平衡状态的影响等内容,化学平衡已经建立,其正、逆反应的速率必定相等,A正确;在平衡状态Ⅰ的基础上瞬时增大了反应物浓度,生成物浓度在瞬时不增大,此时正反应速率瞬时增大,逆反应速率瞬时不变,随后又在新的基础上达到平衡,B正确;对于平衡状态Ⅰ减小反应物的浓度,正反应速率必然减小,显然与所给图示不符,C不正确;对同一种反应物而言只要平衡移动,该物质的量一定会发生变化,D正确。
人教版高中化学选修四《影响化学平衡的因素》word课后作业

人教版高中化学选修四《影响化学平衡的因素》word课后作业一、选择题(每小题4分,每小题有1-2个正确选项)1.对可逆反应2A(s)+3B(g)C(g)+2D(g);ΔH<0,在一定条件下达到平稳,下列有关叙述正确的是()①增加A的量,平稳向正反应方向移动②升高温度,平稳向逆反应方向移动,v(正)减小③压强增大一倍,平稳不移动,v(正)、v(逆)不变④增大B的浓度,v(正)>v(逆)⑤加入催化剂,B的转化率提高A.①②B.④C.③D.④⑤解析:A是固体,其量的变化对平稳无阻碍;而增大B的浓度,正反应速率增大,平稳向正反应方向移动,v(正)>v(逆);升温v(正)、v(逆)均应增大,但v(逆)增大的程度大,平稳向逆反应方向移动;压强增大平稳不移动,但v(正)、v(逆)都增大;催化剂不能使化学平稳发生移动,B的转化率不变。
2.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)Z(g)+W(s);ΔH>0下列叙述正确的是()A.加入少量W,逆反应速率增大B.当容器中气体压强不变时,反应达到平稳C.升高温度,平稳逆向移动D.平稳后加入X,上述反应的ΔH增大解析:W为固体,改变其用量不阻碍化学反应速率,也不阻碍化学平稳;该可逆反应正方向进行时气体压强减小,若气体压强不变,证明反应达到平稳;正反应为吸热反应,升高温度平稳正向移动;ΔH由反应物、生成物能量决定,与加入反应物多少无关。
3.一定条件下,向一带活塞的密闭容器中充入2molsO2和1mol O2,发生下列反应:2SO2(g)+O2(g)2SO3(g),达到平稳后改变下述条件,SO3气体平稳浓度不改变的是() A.保持温度和容器体积不变,充入1molsO3(g)B.保持温度和容器内压强不变,充入1molsO3(g)C.保持温度和容器内压强不变,充入1mol O2(g)D.保持温度和容器内压强不变,充入1mol Ar(g)解析:A中充入1molsO3气体,平稳向逆反应方向移动,新平稳时SO3浓度变大;C 中充入1mol O2气体,平稳向正反应方向移动,新平稳时SO3浓度变大;D中充入1mol Ar 气体,且保持压强不变,则容器的体积扩大,平稳向逆反应方向移动,新平稳时SO3浓度变小;B中尽管充入1molsO3,但因容器内压强保持不变,体积必定相应扩大,因此新平稳与原平稳体系中各物质浓度分不相等,SO3浓度不变。
2021-2022学年高中化学选修4作业:2.3.2影响化学平衡移动的因素

课时分层作业(八)(建议用时:40分钟)1.某一化学反应,反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是()A.增大反应物浓度B.减小反应容器的体积C.增大生成物浓度D.升高反应温度A[增大反应物浓度,化学平衡一定向正反应方向移动,增大生成物浓度,化学平衡向逆反应方向移动,A正确,C错误;对于反应前后气体物质的量不变的反应,减小体积,增大压强,化学平衡不移动,B错误;升高温度,平衡向吸热反应方向移动,D错误。
]2.对处于平衡状态的反应2A(g)+B(g)2C(g)ΔH=-Q kJ·mol-1(Q>0),下列叙述正确的是()A.增大压强,v(正)增大,v(逆)减小B.升高温度,v(正)减小,v(逆)增大C.增大A浓度的瞬间,v(正)增大,v(逆)不变D.增大A浓度的瞬间,v(正)增大,v(逆)减小C[该反应正反应是气体体积减小的反应,增大压强,正、逆反应速率都增大,正反应速率增大的多,反应正向进行,A错误;该反应是放热反应,升高温度,正、逆反应速率都增大,逆反应速率增大的多,反应逆向进行,B错误;增大A浓度的瞬间,正反应速率增大,此时逆反应速率不变,随反应进行正反应速率减小,逆反应速率增大,最后达到平衡状态,正、逆反应速率相同,C正确,D 错误。
]3.一定条件下,二氧化氮和四氧化二氮之间存在下列平衡:2NO 2(g)N2O4(g)ΔH<0,在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是()A.温度130 ℃、压强3.03×105 PaB.温度25 ℃、压强1.01×105 PaC.温度130 ℃、压强5.05×104 PaD.温度0 ℃、压强5.05×104 PaC[要测定NO2的相对分子质量,需使平衡逆向移动,因正反应为放热反应,采用升温的措施;正反应为气体物质的量减小的反应,采用减压的措施,因此,采用的测定条件是高温、低压。
化学选修4影响化学平衡移动的因素习题

影响化学平衡移动的因素练习浓度、压强对化学平衡移动的影响[根底过关]一、化学反应速度改变与平衡移动的关系1.对处于化学平衡的体系,由化学平衡与化学反应速度的关系可知 ( )A.化学反应速度转变时,化学平衡必然发生移动B.化学平衡发生移动时,化学反应速度必然转变C.正反应进展的程度大,正反应速度必然大D.改变压强,化学反应速度必然改变,平衡必然移动2.某温度下反应N2O4(g)⇋2NO2(g)(正反应吸热)在密闭容器中抵达平衡,以下说法不正确的选项是〔〕A.加压时(体积变小),将使正反应速度增大B.维持体积不变,参加少量NO2,将使正反应速度减小C.维持体积不变,参加少量N2O4,再抵达平衡时,颜色变深D.维持体积不变,通入He,再达平衡时颜色不变二、浓度对化学平衡移动的影响3.在一密闭容器中发生反应:2A(g)+2B(g)⇋C(s)+3D(g)ΔH<0,抵达平衡时采取以下办法,可使正反应速度v正增大、D的物质的量浓度c(D)增大的是〔〕A.移走少量C B.扩大容积,减小压强 C.缩小容积,增大压强 D.体积不变,充入“惰〞气4.在容积为2 L的密闭容器中,有反应m A(g)+n B(g)⇋p C(g)+q D(g),通过5 min抵达平衡,此时各物质的转变为A物质的量浓度减少a mol·L-1,B的平均反应速度v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时假设增大系统压强,发现A与C的百分含量不变,那么m∶n∶p∶q为〔〕A.3∶1∶2∶2 B.1∶3∶2∶2 C.1∶3∶2∶1 D.1∶1∶1∶1三、压强对化学平衡移动的影响5.某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:a A(g)+B(g)⇋C(g)+D(g),5 min 后抵达平衡。
假设温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生转变,那么〔〕A.a=2 B.a=1 C.a=3 D.无法肯定a的值6.恒温下,反应a X(g)⇋b Y(g)+c Z(g)抵达平衡后,把容器体积存缩到原来的一半且抵达新平衡时,X的物质的量浓度由0.1 mol·L-1增大到0.19 mol·L-1,以下判断正确的选项是〔〕A.a>b+c B.a<b+c C.a=b+c D.a=b=c7.在一密闭容器中,反应a A(g)⇋b B(g)达平衡后,维持温度不变,将容器体积增加一倍,当抵达新的平衡时,B的浓度是原来的60%,那么 ( )A.平衡向逆反应方向移动了B.物质A的转化率减少了C.物质B的质量分数增大了D.a>b8.以下表达及解释正确的选项是 ( )A.2NO2(g)(红棕色)⇋N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的办法,因为平衡向正反应方向移动,故体系颜色变浅B.H2(g)+I2(g)⇋2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的办法,因为平衡不移动,故体系颜色不变C.FeCl3+3KSCN⇋Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅D.对于N2+3H2⇋2NH3,平衡后,压强不变,充入O2,平衡左移[能力提升]9.现有m A(s)+n B(g)⇋q C(g) ΔH<0的可逆反应,在必然温度下达平衡时,B的体积分数φ(B)和压强p的关系如下图,那么有关该反应的以下描述正确的选项是 ( )A.m+n<q B.n>q C.x点的混合物中v正<v逆D.x点比y点的混合物的正反应速度小10.NO2和N2O4可以彼此转化:2NO2(g)⇋N2O4(g)ΔH<0。
训练5影响化学平衡移动的因素(二)同步配套练习Word含答案高中化学选修4

训练 5 影响化学均衡挪动的因素 (二)温度、催化剂对化学均衡挪动的影响[ 基础过关 ]一、勒夏特列原理的应用1. 以下事实不可以用勒夏特列原理解说的是()A .光照新制的氯水时,溶液的pH 渐渐减小B .加催化剂,使 N 2 和 H 2 在必定条件下转变为 NH 3C .可用浓氨水和氢氧化钠固体迅速制取氨气D .增大压强,有益于 SO 2 与 O 2 反响生成 SO 32. 以下事实不可以用勒夏特列原理解说的是()A .翻开汽水瓶时,有大批气泡溢出B .在配制硫酸亚铁溶液时常常要加入必定量铁粉C .氨水应密闭保留于低温处D .实验室用排饱和食盐水的方法采集氯气 二、温度对化学均衡挪动的影响3. 对于任何一个化学均衡系统,采纳以下举措,必定会使均衡发生挪动的是()A .加入一种反响物B .增大概系的压强C .高升温度D .使用催化剂4. 以下图的直型石英玻璃封管中充有 CO 气体,左端搁置不纯的镍 (Ni) 粉。
在必定条件下, Ni 能够与 CO(g) 发生以下反响: Ni(s) + 4CO(g) 323~ 353 K453~ 473 K Ni(CO) 4(g) ,但 Ni 粉中的 杂质不与 CO(g) 发生反响。
玻璃管内左右两头的温度分别稳固在 350 K 和 470 K ,经过 足够 长 时间后 ,右端的 主要物质 是()A .纯 Ni(s) 和 Ni(CO) 4 (g)B .纯 Ni(s) 和 CO(g)C .不纯 Ni(s) 和 CO(g)D .不纯 Ni(s) 和 Ni(CO) 4(g) 5. 以下图,三个烧瓶中分别充满NO 2 气体并分别搁置在盛有以下物质的烧杯(烧杯内有水 )中:在 (1) 中加入 CaO ,在 (2) 中不加其余任何物质, 在(3) 中加入 NH 4Cl 晶体,发现 (1) 中红棕色变深, (3)中红棕色变浅,以下表达正确的选项是 ()A . 2NO 2N2O4是放热反响B.NH 4Cl 溶于水时放出热量C.烧瓶 (1)中均衡混淆气的均匀相对分子质量增大D.烧瓶 (3)中气体的压强增大三、采纳举措使化学均衡定向挪动6.利用反响: 2NO(g) + 2CO(g) 2CO2(g) + N2(g)- 1,可净化汽车H =- 746.8 kJ ·mol尾气,假如要同时提高该反响的速率和NO 的转变率,采纳的举措是( )A .降低温度B.增大压强同时加催化剂C.高升温度同时充入N 2D.实时将 CO2和 N2从反响系统中移走7. COCl2 (g) CO(g) + Cl 2(g) H>0,当反响达到均衡时,以下举措:①升温②恒容通入惰性气体③增添 CO 浓度④减压⑤加催化剂⑥恒压通入惰性气体,此中能提高COCl 2 转化率的是( )A .①②④B .①④⑥C.②③⑤D.③⑤⑥8.右图曲线 a 表示放热反响 2X(g) Z(g) + M(g) + N(s) 进行过程中 X 的转变率随时间变化的关系。
训练4影响化学平衡移动的因素(一)同步配套练习Word含答案高中化学选修4

训练 4影响化学均衡挪动的要素(一)浓度、压强对化学均衡挪动的影响[ 基础过关 ]一、化学反响速率改变与均衡挪动的关系1.对处于化学均衡的系统,由化学均衡与化学反响速率的关系可知() A.化学反响速率变化时,化学均衡必定发生挪动B.化学均衡发生挪动时,化学反响速率必定变化C.正反响进行的程度大,正反响速率必定大D.改变压强,化学反响速率必定改变,均衡必定挪动2.某温度下反响N2O4(g)2NO 2(g)( 正反响吸热 )在密闭容器中达到均衡,以下说法不正确的是()A .加压时 (体积变小 ),将使正反响速率增大B.保持体积不变,加入少量NO 2,将使正反响速率减小C.保持体积不变,加入少量N2O4,再达到均衡时,颜色变深D.保持体积不变,通入He,再达均衡时颜色不变二、浓度对化学均衡挪动的影响3.在一密闭容器中发生反响:2A(g) + 2B(g) C(s)+ 3D(g)H <0,达到均衡时采纳以下举措,能够使正反响速率v 正增大、 D 的物质的量浓度c(D)增大的是( )A .移走少量 CB.扩大容积,减小压强C.减小容积,增大压强D.体积不变,充入“惰”气4.在容积为 2 L 的密闭容器中,有反响mA(g) + nB(g) pC(g) +qD(g) ,经过 5 min 达到均衡,此时各物质的变化为 A 物质的量浓度减少 a mol ·L-1,B 的均匀反响速率 v(B) =-1 - 1 -1a/15 mol L· ·min ,C 物质的量浓度增添2a/3 mol L·,这时若增大系统压强,发现 A 与 C 的百分含量不变,则m∶ n∶ p∶q 为( ) A.3∶1∶2∶2 B.1∶3∶2∶2C.1∶ 3∶ 2∶1 D.1∶1∶1∶1三、压强对化学均衡挪动的影响5.某温度下,将 2 mol A 和 3 mol B 充入一密闭容器中,发生反响:aA(g) + B(g) C(g) + D(g) ,5 min 后达到均衡。
高中化学影响平衡移动的因素

影响化学平衡移动的因素习题1.下列能确认化学平衡发生了移动的是()A.化学反应速率发生改变B.有气态物质参加的可逆反应达到平衡后,改变压强C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变D.可逆反应达到平衡后,使用催化剂2.在密闭容器中进行反应:H2(g)+Br2(g)2HBr(g)ΔH<0,达到平衡后,欲使颜色加深,应采取的措施是()A.升高温度B.降低温度C.增大H2浓度D.减小压强3.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0反应达到平衡后,为提高CO的转化率,下列正确的是()A.增加压强B.降低温度C.增大CO的浓度D.更换催化剂4.下图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是()A.升高温度,同时加压B.降低温度,同时减压C.增大反应物浓度,同时减小生成物浓度D.增大反应物浓度,同时使用催化剂5.对处于平衡状态的反应:2A(g)+B(g)2C(g)(已知反应为放热反应),下列叙述正确的是()A.增大压强,v(正)增大,v(逆)减小B.升高温度,v(正)减小,v(逆)增大C.增大A浓度的瞬间,v(正)增大,v(逆)不变D.增大A浓度的瞬间,v(正)增大而v(逆)减小6.已知反应:A(g)+3B(g)2C(g)是放热反应,达到平衡后,将气体混合物的温度降低,下列叙述中正确的是()A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动C.正反应速率和逆反应速率都变小,平衡向正反应方向移动D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动7.已知:C(s)+CO2(g)2CO(g);∆H>0。
该反应达到平衡后,下列条件有利于反应向正方向进行的是( )A升高温度和减小压强 B降低温度和减小压强C降低温度和增大压强 D升高温度和增大压强8.已知反应A2(g)+2B2(g) 2AB2(g)ΔH<0,下列说法正确的是()A.升高温度,正反应速率增加,逆反应速率减小B.升高温度有利于反应速率增加,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动9.有一处于平衡状态的反应:X(s)+3Y(g) 2Z(g)ΔH<0。
影响化学平衡的条件同步配套练习Word含答案高中化学选修4

第 2 课时影响化学均衡的条件[目标要求 ] 1.知道浓度、温度、压强等条件改变时,化学均衡状态将会被打破。
2.掌握浓度、温度、压强等条件对化学均衡影响的结果以及有关的理论解说。
3.理解勒夏特列原理。
一、浓度对化学均衡的影响在其余条件不变时(1)增大反响物浓度,化学均衡向正反响方向挪动。
(2)减小生成物浓度,化学均衡向正反响方向挪动。
(3)增大生成物浓度,化学均衡向逆反响方向挪动。
(4)减小反响物浓度,化学均衡向逆反响方向挪动。
二、压强对化学均衡的影响在其余条件不变时增大压强,化学均衡向气体体积减小的方向挪动,减小压强,化学均衡向气体体积增大的方向挪动。
三、温度对化学均衡的影响在其余条件不变时,高升温度,化学均衡向吸热反响方向挪动,降低温度会使化学均衡向放热反响方向挪动。
四、催化剂与化学均衡催化剂能同样程度地改变正、逆反响速率,能改变达到化学均衡的时间,但不可以使化学均衡发生挪动。
五、勒夏特列原理假如改变影响均衡的条件之一 (如温度,压强,以及参加化学反响的化学物质的浓度 ),均衡将向着减弱这类改变的方向挪动。
知识点一影响化学均衡的因素1.在新制的氯水中存在均衡:Cl 2+H 2O H++Cl -+HClO ,若向氯水中投入少许碳酸钙粉末,溶液中发生的变化是 ( )A . H+浓度减小, HClO 浓度减小B. H+浓度增大, HClO 浓度增大C.H +浓度减小, HClO 浓度增大D. H+浓度增大, HClO 浓度减小答案 C分析碳酸的酸性弱于盐酸而强于次氯酸,向氯水中投入少许碳酸钙粉末后,它与盐酸反响,而不与次氯酸反响。
又因为H +浓度减小,均衡Cl 2+ H2O H ++ Cl-+HClO 向正反应方向挪动,故HClO 浓度增大。
2.关节炎是因为在关节滑液中形成了尿酸钠晶体,特别是在严寒季节易引发关节痛苦,其化学机理以下:①HUr + H2O Ur -+ H3O+,尿酸尿酸根离子-+② Ur (aq)+ Na (aq) NaUr(s) 。
高中化学 每日一题 影响化学平衡移动的因素(2)新人教版选修4

影响化学平衡移动的因素(2)高考频度:★★★★☆难易程度:★★★☆☆典例在线已知反应A2(g)+2B2(g) 2AB2(g) ΔH<0,下列说法正确的是A.升高温度,A2的转化率增大B.升高温度有利于反应速率增大,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动B【参考答案】解题必备温度、催化剂对化学平衡的影响1.温度对化学平衡的影响(1)温度对v放、v吸的影响规律升温,v放、v吸均增大,但v吸增大程度大;降温,v放、v吸均减小,但v吸减小程度大。
(2)温度对化学平衡移动的影响规律当其他条件不变时:温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。
(3)从vt图像认识温度对化学平衡的影响c2.催化剂对化学平衡的影响(1)规律:当其他条件不变时,催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。
(2)vt图象:学霸推荐1.下列因素不可能影响化学平衡移动的是A.温度B.催化剂C.反应物的浓度D.压强2.在密闭容器中进行反应:H2(g)+Br2(g)2HBr(g) ΔH<0,达到平衡后,欲使颜色加深,应采取的措施是A.升高温度B.降低温度C.增大H2浓度D.减小压强3.对于合成氨反应,达到平衡后,以下分析正确的是A.升高温度,对正反应的反应速率影响更大B.增大压强,对正反应的反应速率影响更大C.减小反应物浓度,对逆反应的反应速率影响更大D.加入催化剂,对逆反应的反应速率影响更大4.反应2X(g)+Y(g)2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。
下列判断正确的是A.T1<T2,p1<p2B.T1<T2,p1>p2C.T1>T2,p1>p2D.T1>T2,p1<p25.在容积不变的密闭容器中,一定条件下发生反应:2A B(g)+2C(g),且达到平衡。
人教版高中化学选修4练习:第二章第三节第2课时影响化学平衡的条件 Word版含答案_最新修正版

第二章化学反应速率和化学平衡第三节化学平衡第2课时影响化学平衡的条件1.下列因素不可能影响化学平衡移动的是()A.温度B.催化剂C.反应物的浓度D.压强解析:催化剂只能改变化学反应速率,不会影响化学平衡的移动。
答案:B2.在一定条件下的溶液中,反应FeCl 3+3KSCN Fe(SCN)3+3KCl达到平衡后,在其他条件不变的情况下,改变下列条件,能使平衡正向移动的是()A.加水稀释B.加入少量FeCl3固体C.加入少量KCl溶液D.加入少量氢氧化钠固体解析:加水稀释、加入少量KCl溶液,Fe3+、SCN-、Fe(SCN)3的浓度都减小,平衡逆向移动,A、C不正确;加入少量FeCl3固体,Fe3+的浓度增大,平衡正向移动,B正确;加入少量NaOH固体,Fe3+的浓度减小,平衡逆向移动,D不正确。
答案:B3.反应A(g)+3B(g)2C(g)ΔH<0,达平衡后,将反应体系的温度降低,下列叙述中正确的是()A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动C.正反应速率和逆反应速率都减小,平衡向正反应方向移动D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动解析:降低温度,v(正)、v(逆)均减小,平衡向放热反应方向移动,即平衡正向移动。
答案:C4.已知化学反应2A(?)+B(g)2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列情况可能的是() A.A是气体,C是固体B.A、C均为气体C.A、C均为固体D.A是固体,C是气体解析:增大压强、平衡逆向移动说明逆反应是气体物质的量减小的反应,故C为气体,A为非气态(如固体)。
答案:D(g)+C(s)2CO(g)5.在密闭容器中进行如下反应:COΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C,平衡________,c(CO2)________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
影响化学平衡移动的因素(一)
浓度、压强对化学平衡移动的影响
[基础过关]
一、化学反应速率改变与平衡移动的关系
1.对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知 ( ) A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.正反应进行的程度大,正反应速率一定大
D.改变压强,化学反应速率一定改变,平衡一定移动
2.某温度下反应N2O4(g)2NO2(g)(正反应吸热)在密闭容器中达到平衡,下列说法不正确的是 ( ) A.加压时(体积变小),将使正反应速率增大
B.保持体积不变,加入少许NO2,将使正反应速率减小
C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D.保持体积不变,通入He,再达平衡时颜色不变
二、浓度对化学平衡移动的影响
3.在一密闭容器中发生反应:2A(g)+2B(g)C(s)+3D(g)
ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是 ( ) A.移走少量C
B.扩大容积,减小压强
C.缩小容积,增大压强
D.体积不变,充入“惰”气
4.在容积为2 L的密闭容器中,有反应m A(g)+n B(g)p C(g)+q D(g),经过5 min达到平衡,此时各物质的变化为A物质的量浓度减少a mol·L-1,B的平均反应速率v(B)=a/15 mol·L-1·min-1,C物质的量浓度增加2a/3 mol·L-1,这时若增大系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2 B.1∶3∶2∶2
C.1∶3∶2∶1 D.1∶1∶1∶1
三、压强对化学平衡移动的影响
5.某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:a A(g)+B(g)C(g)+D(g),5 min后达到平衡。
若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
( )
A.a=2 B.a=1
C.a=3 D.无法确定a的值
6.恒温下,反应a X(g)b Y(g)+c Z(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1 mol·L-1增大到0.19 mol·L-1,下列判断正确的是
( ) A.a>b+c B.a<b+c
C.a=b+c D.a=b=c
7.在一密闭容器中,反应a A(g)b B(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则 ( ) A.平衡向逆反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增大了
D.a>b
8.下列叙述及解释正确的是 ( ) A.2NO2(g)(红棕色)N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.H2(g)+I2(g)2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.FeCl3+3KSCN Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D.对于N2+3H22NH3,平衡后,压强不变,充入O2,平衡左移
[能力提升]
9.现有m A(s)+n B(g)q C(g) ΔH<0的可逆反应,在一定温度下达
平
衡时,B的体积分数φ(B)和压强p的关系如图所示,则有关该反应
的下列描述正确的是
( )
A.m+n<q
B.n>q
C.x点的混合物中v正<v逆
D.x点比y点的混合物的正反应速率小
10.已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)
ΔH<0。
现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是 ( )
A.如混合气体的压强不再发生改变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4的浓度
11.在一定条件下,可逆反应:m A+n B p C达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是
________________________________________________________________________。
(2)A、C是气体,增加B的量,平衡不移动,则B为____态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是
____________。
12.在密闭容器中进行如下反应:CO2(g)+C(s)高温2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度及平衡如何变化。
(1)增加C,平衡________,c(CO2)________。
(2)缩小反应容器的容积,保持温度不变,则平衡______________________________,
c(CO2)__________。
(3)保持反应容器的容积和温度不变,通入N2,则平衡________,c(CO2)____________。
13.在10 ℃和2×105 Pa的条件下,反应a A(g)d D(g)+e E(g)建立平衡后,再逐步增大体系的压强(温度不变)。
下表列出了不同压强下平衡时物质D的浓度。
压强(Pa)2×1055×1051×106
浓度(mol·L-1)0.0850.200.44
根据表中数据,回答下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡移动方向是__________,理由是
________________________________________________________________________
________________________________________________________________________。
(2)压强5×105 Pa增加到1×106 Pa时,平衡移动的方向是__________,理由是
________________________________________________________________________
________________________________________________________________________。
14.在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时
时间(s)012345
n(NO)(mol)0.0200.0100.0080.0070.0070.007
(1)如图中表示NO2的变化的曲线是________。
(2)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v(NO)逆=2v(O2)正
d.容器内的密度保持不变
(3)能够使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体
b.增大O2的浓度
[拓展探究]
15.反应A(s)+D(g)E(g) ΔH<0,其逆反应速率随时间的变化情形如图所示。
时刻时间可能采取的
人为措施
体系中平衡
移动方向
3
3~4 5
5~6 7
答案
1.B 2.B 3.C 4.A 5.B 6.A 7.C 8.D 9.D 10.D
11.(1)m+n<p(2)固或液(3)逆反应方向
12.(1)不移动不变(2)向左移动增大(3)不移动不变
13.(1)左D浓度增大的倍数小于压强增大的倍数
(2)右D浓度增大的倍数大于压强增大的倍数,此时压强增大可能使E液化,使生成
物的气体体积减小
14.(1)b (2)bc (3)b
(注:可编辑下载,若有不当之处,请指正,谢谢!)。
