络合计算
第四章(3)络合滴定法计算

Al的测定 的测定 Al3+ pH3~4 ~ Pb2+
Y(过) ,∆ 过
Zn2+ AlY
pH5~6 ~
黄→红 红
AlY PbY ZnY
PbY+ Y(剩) 冷却 剩 冷却,XO Zn2+ AlF63PbY
冷却
黄→红 红
2011-10-3 NWNU-Department of Chemistry 6
注意: 注意: 1. 掩蔽剂与干扰离子络合稳定 掩蔽剂与干扰离子络合稳定:
αN(A)=1+[A]β1+[A] β2 ---β大、cA大且 pH合适 -, pH>4; CN-, pH>10) 合适(F 合适
CN- 掩蔽 2+, Co2+, Ni2+, Zn2+, Cd2+… 掩蔽Cu F- 掩蔽 3+; 三乙醇胺 3+, Fe3+… 掩蔽Al 三乙醇胺Al
2011-10-3
NWNU-Department of Chemistry
8
络合滴定的方式及应用
水硬度的测定: 例 水硬度的测定 Ca2+、 Mg2+ lgKCaY=10.7 lgKCa-EBT=5.4 lgKMgY=8.7 lgKMg-EBT=7.0 的氨性缓冲溶液中, 为指示剂, 在pH=10的氨性缓冲溶液中,EBT为指示剂, 的氨性缓冲溶液中 为指示剂 总量; 测Ca2+、 Mg2+总量; pH>12,Mg(OH)2 , 用钙指示剂 测Ca2+量 钙指示剂, , 例 Bi3+、Pb2+的连续滴定 • Bi3+: pH ~1,二甲酚橙作指示剂 • Pb2+ : pH 5~6,二甲酚橙作指示剂
络合滴定法

pCa=7.68
影响滴定突跃大小的因素
1. 络合物的条件稳定常数 K’MY
在浓度一定时,值越大,突跃越大;当 K’MY
< 108 时,突跃已很小,影响 K’MY 的因素
首先是其绝对稳定常数 KMY ,而溶液的酸
度、掩蔽剂及辅助络合剂的络合作用等,都
对 K’MY 有影响。
2. 金属离子 M 的浓度
α
Y(N)
=1+KNY[N]
KNY 为与络合的稳定常数,其值可
由表 5-2 查得;[N] 为溶液中反应 达平衡后,游离 N 平衡浓度。
(三) Y 的总副反应系数 α Y: 当溶液中酸效应和共存离子效应同 时存在时,则 Y 的总副反应系数 α Y 为:
α Y=α
Y(H)
+α
Y(N)-1
二、金属离子 M 的副反应和副反应系数
有机络合剂: 分子中常含有两个以上可键合 的 原子,因此,与金属离子络合 时形成具有环状结构的螯合 物,稳定性大。螯合物的稳定 性与成环数目有关,当配位原 子相同时,环越多,螯合物越 稳定,螯合物的稳定性还与 五螯环的大小有关,通常以五 员环和六员环最稳定。
第二节 EDTA 的性质及其络合物
EDTA的性质: (1) EDTA 在水中的溶解度很小。通常使 用的是 EDTA 二钠盐(Na2H2Y•2H2O),一 般也将之简称为 EDTA。 (2)当 H4Y 溶于高酸度的溶液中时,它的 两个羧基可再接受 H+,形成 H6Y2+, 此时EDTA 相当于六元酸。 (3)EDTA 分子中含有两个氨氮和四个羧 氧,因此具有六个配位原子,通常均 按 1:1 络合,生成稳定的螯合物。
(cV ) EDTA M A A% 100 试样质量( g ) 1000
第三章络合滴定法

3.6 络合滴定中的酸度控制 1.络合滴定中为何要使用缓冲溶液? P114
(1)随着EDTA与M反应生成MY, 溶液中不断有H+ 释放 出, 使得溶液的PH降低, K′MY减小, 突跃减小,误差 增加.
(2)指示剂的变色点 K′MIn与pH有关, 指示剂需 要在一定的酸度介质中使用 。
2. 单一离子测定时 的酸度控制
影响k′MY的因素? K′MY增大10倍,滴定突跃增加一个单位. (2)M与 EDTA的浓度愈大,滴定突跃愈大。 CM增大10倍,滴定突跃增加一个单位。
4. 终点误差
如M、Y均有副反应
Et 10 pM ' 10 pM '
K C '
SP
MY M
10pM 10pM
K
' MY
C
SP M
ep与sp接近,当 M有副反应时Msp Mep ∴ pM pM′ △PM= PMep - PMsp
3.4金属离子指示剂
1.金属离子指示剂变色原理: P104 此为金属离子无色时的颜色变化. 即终点时由
MIn的颜色变为In的颜色.
如M有颜色,终点颜色变化为:MIn+MY的颜色变为 In+MY的颜色
2.变色点---主要用于终点误差的计算
① 如M无副反应:
pM ep
lg
K' MIn
lg
K MIn
lg In(H)
PH多大合适?
解:
pCa
lg
K' CaY
lg [Y ' ] [CaY ]
[Y′]=[CaY]缓冲 容量最大.
PCa
log
K' CaY
log KCaY
第3章 络合(配位)滴定法

(1) 溶液在pH>12时进行滴定时:
酸效应系数αY(H)=1; K 'MY = K MY = [MY] /([M] [Y4-]
1)滴定前:溶液中Ca 2+离子浓度: [Ca 2+ ] = 0.01 mol / L , pCa = -lg [Ca 2+ ] = -lg0.01 = 2.00
2)化学计量点前:已加入19.98mL EDTA(剩余0.02mL钙 溶 液 , 此 时 CaY 中 的 Ca2+ 浓 度 忽 略 , 因 为 与 剩 余 游 离 的 Ca2+比相差2个数量级。) [Ca2+] = 0.01000×0.02 / (20.00+19.98)= 5×10-6 mol/L, pCa =5.3
3)化学计量点:此时 Ca 2+几乎全部与EDTA络合, [CaY]=0.01/2=0.005 mol/L ;[Ca 2+]=[Y4-]=X ;KCaY=1010.69
由稳定常数表达式[Ca2+]2=CCaY,sp/KCaY,得:0.005/X2 = 1010.69 , 所以 [Ca 2+]=3.2×10-7 mol/L ;pCa=6.49
5.络合滴定中的副反应及条件稳定常数
络合滴定中的副反应:
滴定主反应:
Mn+ + Y4- = MY
⑴考虑酸效应影响:
由:
Y (H )
[Y' ] [Y]
得: [Y 4- ] [Y' ]
Y (H )
KMY
[MY] [M n ][Y 4- ]
带入稳定常数表达式得:
KMY
Y (H )
[MY] [M n ][Y ' ]
络合反应

络合反应分子或者离子与金属离子结合,形成很稳定的新的离子的过程就叫络合。
生成络合物络合物之一络合物通常指含有络离子的化合物,例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3C l3]等。
配合物又称络合物。
络合物的组成以[Cu(NH3)4]SO4为例说明如下:(1)络合物的形成体,常见的是过渡元素的阳离子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
(2)配位体可以是分子,如NH3、H2O等,也可以是阴离子,如CN-、SCN-、F-、C l-等。
(3)配位数是直接同中心离子(或原子)络合的配位体的数目,最常见的配位数是6和4。
络离子是由中心离子同配位体以配位键结合而成的,是具有一定稳定性的复杂离子。
在形成配位键时,中心离子提供空轨道,配位体提供孤对电子。
络离子比较稳定,但在水溶液中也存在着电离平衡,例如:[Cu(NH3)4]2+=Cu2++4NH3因此在[Cu(NH3)4]SO4溶液中,通入H2S时,由于生成CuS(极难溶)络合物之二含有络合离子的化合物属于络合物。
我们早已知道,白色的无水硫酸铜溶于水时形成蓝色溶液,这是因为生成了铜的水合离子。
铜的水合离子组成为[Cu(H2O)4]2+,它就是一种络离子。
胆矾CuSO4〃5H 2O就是一种络合物,其组成也可写为[Cu(H2O)4]SO4〃H2O,它是由四水合铜(Ⅱ)离子跟一水硫酸根离子结合而成。
在硫酸铜溶液里加入过量的氨水,溶液由蓝色转变为深蓝。
这是因为四水合铜(Ⅱ)离子经过反应,最后生成一种更稳定的铜氨络离子[Cu(NH3)4]2+而使溶液呈深蓝色。
如果将此铜氨溶液浓缩结晶,可得到深蓝色晶体[Cu(NH3)4]SO4,它叫硫酸四氨合铜(Ⅱ)或硫酸铜氨,它也是一种络合物。
又如,铁的重要络合物有六氰合铁络合物:亚铁氰化钾K4[Fe(CN)6](俗名黄血盐)和铁氰化钾K3[Fe(CN)6](俗名赤血盐)。
高中化学题型之络合反应的平衡常数计算

高中化学题型之络合反应的平衡常数计算在高中化学学习中,络合反应是一个重要的概念。
络合反应是指两种或多种物质之间发生的配位键形成过程。
在络合反应中,通常会形成一个配位化合物,其中一个或多个配体与中心金属离子形成配位键。
而平衡常数是评价反应进行程度的指标,也是判断反应方向的依据之一。
本文将重点讲解如何计算络合反应的平衡常数,并通过具体题目进行分析和说明。
首先,我们需要了解络合反应的平衡常数是如何定义的。
在一个络合反应中,可以用以下方程式表示:M + L ⇌ ML其中,M代表中心金属离子,L代表配体,ML代表配位化合物。
平衡常数Kc可以表示为:Kc = [ML] / ([M] * [L])其中,[ML]表示配位化合物的浓度,[M]表示中心金属离子的浓度,[L]表示配体的浓度。
平衡常数Kc的值越大,表示反应进行得越完全;而Kc的值越小,表示反应进行得越不完全。
接下来,我们通过一个具体的题目来说明如何计算络合反应的平衡常数。
假设有一个络合反应的方程式如下:Fe3+ + 3OH- ⇌ Fe(OH)3现在我们需要计算该反应的平衡常数Kc。
首先,我们需要知道反应物和生成物的浓度。
假设反应开始时,Fe3+的浓度为0.1 mol/L,OH-的浓度为0.2 mol/L。
根据反应方程式,Fe(OH)3的浓度为0 mol/L,因为反应还没有进行。
接下来,我们可以根据平衡常数的定义,计算反应进行到平衡时Fe(OH)3的浓度。
假设在平衡时,Fe(OH)3的浓度为x mol/L。
根据反应方程式,Fe3+的浓度为0.1 - x mol/L,OH-的浓度为0.2 - 3x mol/L。
将上述浓度代入平衡常数的公式中,得到:Kc = [Fe(OH)3] / ([Fe3+] * [OH-])= x / ((0.1 - x) * (0.2 - 3x)^3)接下来,我们可以通过求解上述方程,得到平衡常数Kc的值。
首先,我们将方程两边取倒数,得到:1 / Kc = ((0.1 - x) * (0.2 - 3x)^3) / x然后,我们可以将方程两边化简,并移项,得到:x = 0.1 / (1 + 0.2 * (0.2 - 3x)^3)接下来,我们可以通过迭代法求解上述方程。
分光光度法测定络合物的组成及稳定常数

本实验采用等摩尔连续变化法测定络合物的组成,其原理如下:在保持总摩尔数不变的情
况下,依次改变体系中两组分摩尔分数的比值,配制一系列摩尔分数不同的溶液,测量这 一系列溶液的光密度D值。做光密度D-摩尔分数x曲线如图5-2所示,从曲线上光密度 的极大之Dmax所对应的摩尔分数值,即可求出n值。
解上述方程可得x,然后即可计算络合物稳定常数K
移液管(50ml)
1
支
(250ml)
2
(25ml)
1
支
烧杯(250ml)
1
(10ml)
2
支
(100ml)
2
仪器和试剂
72型分光光度计1套
容量瓶(100ml)
钛鉄试剂(1,2-二羟基苯,3,5-二黄酸钠)分析纯0.005M
硫酸高铁铵(NHFe(SQ)212HC)分析纯0.005M
2、做最大吸收峰曲线D-■。
3、作两组溶液的光密度D对溶液组成x的D-x曲线。
4、 按上述方法进行校正,求出两组溶液中络合物的校正光密度数值二D-D。。
5、作两组溶液的厶D -x图,于同一坐标上。
6、 找出曲线最大值下相应于二n的数值,从n的数值即可得到络合物组成MLn。
1—X
7、 从图上找出二组溶液中任意相同光密度的二点所对应的溶液组成(即求出a, b,,a2b2数值)。
移取0.005M硫酸高铁铵溶液50ml于100ml容量瓶中,用蒸馏水稀释至刻度。同样方法配 制0.0025M钛鉄试剂溶液100ml。
5、用0.0025M钛鉄试剂溶液和0.0025M的硫酸高铁铵溶液按实验步骤1配制第二组待测 溶液,并测定其在波长’max下的光密度值。
数据记录和处理
1、将所得数据列表。
络合滴定法

HY3- = H+ + Y4Ka6 = 10-10.34
b. EDTA 的各级酸离解常数、质子化 常数及累积质子化常数之间的关系 H6Y2+ = H+ + H5Y+
Ka1= 10-0.9
K6H= 100.9
6H= 1023.9
H5Y+ = H+ + H4Y
Ka2= 10-1.6 Ka3= 10-2.07 K5H = 101.6 5H= 1023.0 K4H= 102.07
1 K不稳n= K
M+L
ML
ML2
[ ML ] K1 [ M ][ L]
1
1 K不稳n-1= K
1 K不稳1= Kn
2015/11/14
ML+L
2
[ ML 2 ] K2 [ ML ][ L]
[ MLn ] [ MLn1 ][ L]
MLn MLn-1+L Kn
各级累积稳定常数为:
b.EDTA 的各级酸离解常数、质子化 常数及累积质子化常数之间的关系 H3Y- = H+ + H2Y2K3H= 102.75
Ka4= 10-2.75 3H = K1H K2H K3H = 1019.33 K2H = 106.24
H2Y2- = H+ + HY3Ka5 = 10-6.24
2H = K1H K2H = 1016.58 K1H = 1010.34 1H = K1H = 1010.34
2 n
这里,1,2,…,n 是 M-A配合物的各级 累积稳定常数,[A] 是 A 的平衡浓度。
若A 是弱碱,易与质子相结合,如将这一
反应看作是A的副反应,则:
络合常数

5.6提高络合滴定选择性的途径5.6.1选择滴定的可能性对混合离子的选择性滴定是络合滴定的重要问题。
设溶液中含有M、N两种金属离子,KMY>KNY时能否准确地选择性地滴定。
可以计算络合剂的总副反应系数,求得K'MY之后,按处理滴定一种金属离子的方法处理有共存离子时的络合滴定问题。
溶液中含有共存离子N时,Y可能有两种副反应——共存离子效应及酸效应,其总副反应系数αY为αY=αY(H)+αY(N)-1(1)设溶液的酸度比较高,酸效应是主要的,αY(H)>>αY(N),则共存离子效应可以忽略。
如果N与指示剂不起反应,则与单独滴定M的情况一样。
(2)如果溶液的酸度比较低,以致EDTA的酸效应可以忽略,αY(N)>>αY(H),此时可只考虑共存离子的影响。
根据副反应系数的计算公式,得到αYN=1+β1[N]+……+1+KNY[N]求得αY(N)之后,即可计算出K'MY,在滴定过程中,如果共存离子影响较大,则有:Log K'MY=log KMY-log KNY+pN=△log K +pN可见,当αY(N)>>αY(H)时,M的条件稳定常数只与共存离子N的浓度及其与M的稳定常数的比值有关,与溶液的pH值无关。
在一般情况下,检测滴定终点的不确定性△pM=±0.2,要求误差≈0.1%,此时,根据K'MY及cM,可利用logcMK'MY≥6的原则来判断能否准确进行滴定。
另一种情况是αY(H)≈αY(N),这时,EDTA的酸效应和共存离子效应都应考虑,将αY(H)及αY(N)相加,求得αY之后,再计算logK'MY。
5.6.2共存离子存在时溶液酸度的控制有共存离子存在时,可按照同样的原则来确定溶液的最高酸度、最低酸度及最佳酸度。
(1)在滴定单一金属离子M时,如果除酸效应之外,没有其他副反应,则K'MY将随着溶液酸度的降低而增大,直至达到最低酸度为止。
络合滴定计算公式

络合滴定计算公式络合滴定是一种常用的化学分析方法,通过形成络合物来测定溶液中金属离子的浓度。
在这个过程中,涉及到一些重要的计算公式,咱们今天就来好好唠唠。
我记得有一次在实验室里,我带着一群学生做络合滴定的实验。
那场景,可真是热闹非凡。
学生们一个个既兴奋又紧张,都想把实验做好。
其中有个叫小李的同学,特别积极,一双大眼睛紧紧盯着滴定管,手里还不停地记录着数据。
咱们先来说说络合滴定中的一个关键公式——条件稳定常数(K')的计算公式。
这公式是K' = K / αM(αY) 。
其中 K 是稳定常数,αM是金属离子的副反应系数,αY 是 EDTA 的副反应系数。
这个公式就像是一把钥匙,能帮咱们打开准确测定金属离子浓度的大门。
比如说,在测定钙离子浓度的时候,如果溶液中有其他离子会与钙离子发生反应,影响测定结果,这时候就要通过计算副反应系数来修正,从而得到更准确的条件稳定常数。
再来讲讲络合滴定的终点误差计算公式。
这可是判断咱们实验结果准不准的重要依据。
终点误差(TE)的计算公式是TE = [ 10^ΔpM' -10^(-ΔpM') ] / √(cMsp·K') 。
这里的ΔpM' 是终点时金属离子浓度的对数差值,cMsp 是计量点时金属离子的浓度。
举个例子,如果在滴定锌离子时,终点时的ΔpM' 计算有误,那最终得出的终点误差就会偏差很大,可能导致整个实验结果都不靠谱。
还有一个很重要的公式,就是金属离子能被准确滴定的判别式。
当cM·K' ≥ 10^6 时,金属离子才能被准确滴定。
这个判别式就像是一个门槛,达不到的话,实验结果的准确性可就没保障啦。
就像那次实验中的小王同学,因为没搞清楚这个判别式,着急忙慌地就开始实验,结果可想而知,数据乱七八糟,还得重新来过。
在实际应用中,咱们要根据具体的实验条件和要求,灵活运用这些公式。
可别死记硬背,得理解其中的原理。
分析化学络合滴定

2014.04.30
Chap 7
络合滴定法
第一节 络合反应
1、络合反应是金属离子作为中心(具有空的价电轨道)与络 合剂(具有孤对电子)以配位键结合,形 成配位化合物(络合物)的一种反应。 M + L M—L 中心离子 络合剂 络合物 有空的价电轨道 具有孤对电子 配位键结合 络合剂 无机络合剂 物 有机络合剂 螯合物 络合物 单配位络合
pL lg K3 , lg K3 lg 3 lg 2 5.8
[ AlL] [ AlL2 ] 时, pL lg K 2 lg 2 lg 1 6.9
pL 8.6
pL lg 1 lg K1 8.6, pL 10.0 ∴ Al3+为主要型体。
由于副反应的发生,没有生成MY的金属离子为 [M'],EDTA为[Y']。
K MY
K MY [MY] [MY] (条件形成常数) [M'][Y'] M [M] Y [Y] M Y
lg K MY lg M lg Y lg K MY
18、计算pH=1时的草酸根的lg C O
络合 酸效应、共存离子效应
H6Y
水解
1、对滴定剂Y的副反应
(1)酸效应
Y (H)
[Y] [HY] [H2 Y] [H6 Y] [Y] 1 β1[H ] β2 [H ] β6 [H ]
1 [H ]
H i i
2
6
cCu 2
0.020 0 . 28 1 1 0.010 mol L c NH 0.14 mol L 3 2 2
1
EDTA计算范文

EDTA计算范文EDTA(乙二胺四乙酸)是一种强螯合剂,广泛应用在化学分析和工业生产中。
它可以与许多金属离子形成稳定的络合物,因此被广泛用于金属离子的测定和分离。
本文将对EDTA的计算方法进行详细介绍,以帮助读者更好地理解和应用EDTA计算。
一、EDTA的化学性质EDTA具有以下化学性质:1.EDTA与金属离子的络合反应是可逆的。
EDTA与金属离子形成的络合物在酸性条件下稳定,可以通过加酸来将金属离子从络合物中释放出来。
2.EDTA的络合反应是可逆的。
当EDTA与金属离子发生络合反应时,有可能形成1:1、1:2(金属离子:EDTA)等多种配位比例的络合物。
3.EDTA与不同金属离子的络合能力不同。
一般来说,过渡金属离子容易与EDTA形成稳定的络合物,而碱金属离子则不容易与EDTA发生络合反应。
二、EDTA的计算公式在实际应用中,我们通常使用EDTA的计算公式来确定样品中金属离子的含量。
EDTA的计算公式如下:M1V1=M2V2其中,M1是金属离子的浓度(mol/L),V1是金属离子的体积(L),M2是EDTA的浓度(mol/L),V2是EDTA消耗的体积(L)。
三、EDTA滴定的步骤EDTA滴定是一种常用的金属离子测定方法,通常包括以下步骤:1.准备试样。
将待测金属离子溶解在适当的溶液中,使其达到理想的反应状态。
2. 加入指示剂。
为了观察滴定过程的终点,通常使用一种指示剂来指示滴定的终点。
常用的指示剂有Eriochrome Black T(EBT)和Murexide等。
3.开始滴定。
将EDTA溶液加入待测溶液中,开始进行滴定。
滴定过程中,金属离子与EDTA反应形成络合物。
当反应进行到一定程度时,指示剂发生颜色变化,表示滴定终点。
4.记录滴定体积。
记录滴定开始到滴定终点需要的EDTA消耗体积。
5.计算金属离子的浓度。
根据EDTA的计算公式,计算样品中金属离子的浓度。
四、EDTA计算的注意事项进行EDTA计算时需要注意以下几点:1.指示剂的选择。
第五章 络合滴定法

2、例 Fe3+ + Y4–
FeY–
为简化起见,常省去电荷,写成:
Fe + Y FeY
写成通式: M + Y
MY
由于配位比简单,为定量计 算带来了方便。
H
H
5、例
ZnY2 (无色 ) MnY2 (紫红) NiY2( 蓝绿) CrY( 深紫) CuY2( 深蓝) FeY( 黄)
]
10 0.9
H H4Y
Ka2
[H ][H 4Y] [H5Y ]
101.6
H H3Y
Ka3
[H ][H 3Y ] [H 4Y]
102.0
H H2Y2
Ka4
[H ][H 2Y2 ] [H 3Y ]
102.67
H HY3
Ka5
[H ][HY 3 ] [H 2Y2 ]
106.16
H Y4
k1
[ML] [M][L]
1
k1
[ML] [M][L]
ML L
ML2
k2
[ML2 ] [ML][L]
称总最稳后定一常2级数累k1积k2稳M定+[[MnM常]LL[L2数]]2 (MβLnn)又
k k k (见附录Ⅶ-1p604) n 12
[MLn ] n [M][L]n
(3)各型体平衡浓度的计算p102
Cu(NH3)22 NH3 Cu(NH3)32 K3 8.0103
Cu(NH3)32 NH3 Cu(NH3)24 K4 1.3102
络合滴定对反应的要求: 1、反应进行完全,生成物稳定 2、反应速度快 3、按一定的反应式进行 4、有适当确定终点的方法
第六章 络合滴定法

[ MY ] [ M ][Y ]
碱金属离子: 碱土金属离子: 过渡金属离子: 高价金属离子:
lgKMY﹤3 lgKMY 8~11 lgKMY 15~19 lgKMY﹥20
EDTA螯合物的模型
有色EDTA螯合物
螯合物 CoY2颜色 紫红 螯合物 颜色
CrY-
深紫
Fe(OH)Y2- 褐 (pH≈6) FeY黄 紫红 蓝绿
[Y'] α Y(H) [Y] [Y]+[HY]+[H 2 Y]+[H3 Y]+ +[H 6 Y] 1 [Y]
[ Y′]表示络合反应达平衡时 ,未与M络合的 EDTA的总浓度 可见:在副反应中Y型体的分布系数δY与酸 效应系数αY(H)成倒数关系。
第四级累积稳定常数:β4=K1×K2×K3×K4
一级累积稳定常数
ML 1 K1 M L
2 K1 K2
二级累积稳定常数
M L 2
M Ln
ML
2
总累积稳定常数
n K1 K2 K n
ML
n
可知
β K
θ n
θ 总
OH
“NN”型
乙二胺 - Cu2+
H2 N H2C
Cu
三乙撑四胺 - Cu2+
H2 N
CH2 CH2
H2 N
H2 N CH2
Cu
H2C H2C NH H2C NH CH2
H2C N H2 N H2
CH2
lgK1=10.6, lgK2=9.0 lgK总=19.6
lgK=20.6
3.“NO”型
4.“SS”型
第六章 络合滴定法
K n [ML][L] ML+ L
[ML2]
ML2
K2
[ML2] [ML][L]
==
K
[MLn 1][L] [MLn]
MLn-1+
L
MLn
Kn
[MLn] [MLn 1][L]
络合物的形成常数(对MLn型来讲),其一般规律是 K1>K2>K3… 原因:随着络合体数目的增多, 配体间的排斥作用增强,稳定性下降。
M=M(L)+M(OH)-1
(三)络合物MY的副反应 pH<3,形成酸式络合物,MHY; pH>6,形成碱式络合物,MOHY。 由于这两种络合物不稳定,一般情况
下,可忽略不计。
二、MY络合物的条件形成常数
条件形成常数亦叫表观稳定常数或有效稳定
常数,它是在有副反应发生的情况下络合物的 实际稳定常数。
[HY] [Y][H+
]
=
1 Ka
6
β1H=K1H
HY+H+=H2Y ︰
K
H 2
=
[H2Y] [HY][H+
]
=
1 Ka5
︰
β2H=K1H K2H ︰
:
︰
︰
H5Y+H+=H6Y
K6H
=
[H6Y] [H5Y][H+
]
=
1 Ka1
β6H=K1H K2H … K6H
累积质子化常数的应用: 由各级累积质子化常数计算溶液中 EDTA各型体的平衡浓度。
因此,根据上述各式,只要知道β值,就 可以计算出在不同游离氨的浓度下,各型 体的δ值。如图所示。
锌氨络合物各型体的δ- lg [NH3] 相邻两级络合物分布曲线 的交点处有:
第6章-络合滴定法

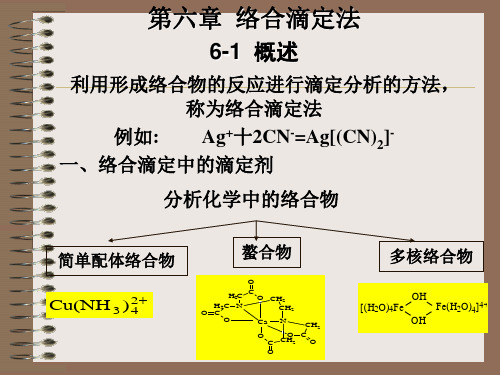
分析化学中的络合物
简单配体络合物 螯合物
O C
多核络合物
Cu(NH )
2 3 4
H2C H2C N O C O
O CH2 CH2 Ca CH2 O C O O C CH2 O N
[(H 2O)4Fe
OH OH
Fe(H2O)4]4+
滴定剂、沉淀剂、掩蔽剂、显色剂、萃取剂
6.1.1简单络合物
特点:单基配位体(一个键合原子) 1.形成高络合比的简单络合物(MLn型) 2.络合物不稳定(稳定常数小,且逐级络合) 3.多数不能用于滴定(用于掩蔽) 例:汞量法(?)、氰量法(?), 毒性大,应用范围窄。
K 4H =
H 5
3H
H = K 1H K 2 K 3H = 1019.09
H3Y- + H+ = H4Y H4Y + H+ = H5Y+ H5Y+ + H + = H6Y2+
1 = 102.00 Ka3 1
H H 4H = K 1H K H K 3 K = 4 2
1021.09
K
Ka2 1 H K 6H= K 6H= 1023.59 · · = 10 0.90 6 = K 1H K 2H · Ka1
H2Y2HY3Y4-
EDTA的性质
HOOCH2C -OOCH2C
H6Y2+ pKa1=0.9 1.0 H Y+ 2+5
H N CH2 CH2 +
+ N H
CH2COO
-
CH2COOH
pKa2=1.6
H2Y 2-
0.8
H6 Y
HY
pKa3=2.07 H4Y H3Y43Y
第六章络合滴定法

●● ●
δMLn=[MLn]/CM = n[L]n/(1+1[L]+2[L]2+…+n[L]n) = δMn[L]n
酸可看成质子络合物
Y4- + H+ = HY3HY3- + H+ = H2Y2H2Y2- + H+ = H3YH3Y- + H+ = H4Y H4Y + H+ = H5Y+ H5Y+ + H + = H6Y2+
EDTA
MY + HIn 色B
要求: 指示剂与显色络合物颜色不同(合适的pH); 显色反应灵敏、迅速、变色可逆性好;
稳定性适当,K MIn<KMY
常用金属离子指示剂
指示剂
铬黑T (EBT) 二甲酚橙 (XO) 酸性铬蓝K
pH 范围 8~10
<6
8~13
颜色变化 In MIn 蓝红
直接滴定离子 Mg2+, Zn2+,Pb2+
1
K6= Ka1 = 10 0.90 6=K1K2..K6 = 1023.59
EDTA的有关常数
离解 常数
Ka1 10-0.90
Ka2 10-1.60
Ka3 10-2.00
Ka4 10-2.67
Ka5 10-6.16
Ka6 10-10.26
逐级 常数
K1 1010.26
K2 106.16
K3 102.67
1
K1= Ka6 = 1010.26 1=K1= 1010.26
配位滴定法(络合滴定法)

一、定义以络合反应为基础的容量分析法,称为络合滴定法二、原理1.基本原理乙二胺四乙酸二钠液(EDTA)能与许多金属离子定量反应,形成稳定的可溶性络合物,依此,可用已知浓度的EDTA滴定液直接或间接滴定某些药物,用适宜的金属指示剂指示终点。
根据消耗的EDTA滴定液的浓度和毫升数,可计算出被测药物的含量。
(1)EDTA络合物的稳定性M + Y →←MY[MY]络合物的稳定常数K MY = ———[M][Y](2)酸度对稳定性的影响酸效应系数(α)C EDTAα= ——或 C EDTA =α[Y][Y](3)络合物的表观稳定常数[MY] [MY] K MY络合物的表观稳定常数K MYˊ = ———- = ———— = ——[M]C EDTA [M][Y]αα或lgK MYˊ= lgK MY- lgα2.滴定方式(1)直接滴定法Me n++ H2Y2-→←MeY(n-4)+ 2H+与金属离子化合价无关,均以1:1的关系络合。
(2)回滴定法Me n++ H2Y2-(定量过量)→←MeY(n-4)+ 2H+H2Y2-(剩余)+ Zn2+→←ZnY2-+ 2H+(3)间接滴定法利用阴离子与某种金属离子的沉淀反应,再用EDTA滴定液滴定剩余的金属离子,间接测出阴离子含量。
三、滴定条件在一定酸度下能否进行络合滴定要用络合物的表观稳定常数来衡量。
一般来说,K MYˊ要在108以上,即lgK MYˊ≥8时,才能进行准确滴定。
(1)络合滴定的最低pH值lgα= lgK MY- 8在滴定某一金属离子时,经查表,得出相应的pH值,即为滴定该离子的最低pH值。
(2)溶液酸度的控制在络合滴定中不仅在滴定前要调节好溶液的酸度,在整个滴定过程中都应控制在一定酸度范围内进行,因为在EDTA滴定过程中不断有H+释放出来,使溶液的酸度升高,因此,在络合滴定中常须加入一定量的缓冲溶液以控制溶液的酸度。
在pH<2或pH>12的溶液中滴定时,可直接用强酸或强碱控制溶液的酸度。
络合滴定法

. . .
. . .
HY H2 Y H6 Y
酸效 应
MHY
. . .
共存 离 子 效 应
混合 成 配 效 应
一、副反应系数
(一)Y的副反应及副反应系数 1. 酸效应与酸效应系数Y(H) 由于H+的存在,使络合剂Y参加主反应能力 降低的现象称为酸效应。 H+引起副反应发生的程度可用 酸效应系数 Y(H)表示,即未与金属离子螯合 的EDTA的总浓度与平衡浓度之比:
1[L]
1 i [L]i
i 1 n
ML
n
[MLn ] cM
n [ L ]n
1 i [L]i
i 1 n
第三节 副反应系数和条件稳定常数
M OH MOH M(OH)2 M(OH)n
水 解效应
+
L ML ML2 MLn
配位 效应
Y H
+
MY N NY HML ML ML n 1
1 2 n
例 3. 在 0 .1mol/LAl3+ 溶 液 中 , 加入 过 量的 F-, Al3+ 被络合成 AlF63-,此时溶液中游离 F- 的浓度 为 0.01mol/L,求溶液中 Al3+ 的浓度,并指出溶 液中络合物的主要存在形式。 解:查表得AlF63- : lg1=6.15 lg2=11.15 lg3=15.0 lg 4=17.75 lg5=19.36 lg6=19.84
3.EDTA的总副反应系数 若两种因素同时存在存在,则
[Y'] H4Y H3Y H2Y HY Y NY
[Y '] Y Y(H) Y(N) 1 [Y]
络合滴定法——精选推荐

第六章 络合滴定法络合滴定法是以络合反应为基础的滴定分析方法。
从路易斯酸碱理论来说,络合反应也是路斯酸碱反应,所以络合滴定与酸碱滴定法有许多相似之处,学习时可对照比较,但络合滴定中也有自身的特点,内容更复杂。
络合反应在分析化学中应用广泛,有关理论和实践知识是分析化学重要的内容之一。
6.1 络合滴定分析中常用的络合剂和络合平衡 6.1.1 常用的络合剂络合反应中常用的络合剂很多,如测定金属离子的络合滴定剂、掩蔽剂、指示剂和金属缓冲溶液等等。
络合剂的分类方式也很多,按络合剂中的键合原子分类,可分为:(1)氧配位螯合剂:如磺基水扬酸、酒石酸、柠檬酸、乙酰丙酮等;2.氮配位络合剂:如氨、乙二胺、联吡啶、邻二氮菲等;(3)氧、氮配位络合剂:8-羟基喹啉、氨三乙酸及EDTA 氨羧络合剂等;(4)硫配位螯合剂:如铜试剂、2-巯基苯并噻唑等。
1. 氨羧络合剂络合滴定中重要的滴定剂是具有-N(CH 2COOH)2基团氨羧络合剂,常见的氨羧络合剂见下表。
2. 乙二胺四乙酸的性质:(1) 乙二胺四乙酸结构:(ethylenediaminetetreacetic acid )简称EDTA ,具有结构如图所示。
一个分子中含有二个-N(CH 2CO OH)2基团,与金属离子结合时有六个配位原子,可形成五个五元螯合环,具有很强的络合性能,是常用的络合滴定剂和掩蔽剂。
(2) EDTA 性质:EDTA 在水中的溶解度不大,EDTA 的二钠盐溶解度较大,EDTA 是六元酸,可用H 6Y 2+表示,有六级离解常数。
各级解离常数与对应的质子化常数如后。
,,,++++=Y H H Y H 5269.0a H69.02Y 6H Y 5H H a 101,10)()()(11====-+++K K c c c K Y H H Y H 45+=++6.1a H56.1Y 5H Y 4H H a 101,10)()()(22====-++K K c c c K -++=Y H H Y H 340.2H40.2Y 4(H )Y 3(H )(H a 10 ,10)3===--+K c c cK,,,各组分的分布分数如上图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例: 用2×10-2 mol. l-1 EDTA滴定同浓度的Zn2+,若溶液的pH=10.00,游离氨浓度为0.20 mol .l-1计算化学计量点时的pZn/ = ?解:pZn/=1/2(pC SP Zn+lg K /Zn Y )C SP Zn=C Zn/2=1×10-2 mol l-1lg K /ZnY =lg k znY - lgαzn- lgαYpH=10.00时查表:lg K ZnY =16.5αY=αY(H),lgαY(H)=0.45, αZn(OH)=102.4αZn=αZn(OH)+αZn(NH3)-1 [NH3]=0.1 αZn(NH3)=1+β1[NH3]+β2[NH3]2+β3[NH3]3 +β4[NH3]4=105.1∴αZn=105.1+102.4-1= 105.1lg K /ZnY =16.5 - 5.1 - 0.45 = 10.95pZn/ = 1/2(2+10.95 )= 6.48例:pH =10 的氨性中,[NH3]= 0.2 mol/L, 用0.02mol/L EDTA滴定0.02mol/L Cu2+,计算sp 时pCu',若滴定的是0.02mol/L Mg2+, sp 时pMg'又为多少?解:sp 时C cu sp = 0.01 mol/L, [NH3] = 0.1 mol/LαCu(NH3) = 1+β1[NH3]+ ⋅⋅⋅ + β5[NH3]5=109.36α Cu(OH) = 101.7αCu = αCu(NH3) + αCu(OH) -1 = 109.36pH = 10, lg αY(H) = 0.45lg K'CuY = lg K CuY - lgαY(H) - αCu= 18.80 - 0.45 -9.36 =8.99pCu' =1/2 (pC Cu sp + lg K'CuY )= 1/2 (2.00 + 8.99) =5.50对于Mg2+, lgαMg =0lg K'MgY =lg K MgY -lgαY(H)= 8.70 - 0.45 =8.25pMg ' =1/2(pC Mg sp + lg K'MgY )= 1/2(2.00 + 8.25) =5.13 例:铬黑T与Zn2+的lgK ZnIn= 12.9,铬黑T的PKa1= 6.3PKa2 = 11.6计算:PH = 10.0时的PZn t解:3.116.19.126.1lg;40101010101][][1lglg)(203.66.11106.112122)()(=-==∴=⨯+⨯+=++=-=-+-++tHInHInHInZnIntPZnKaKaHKaHKPZnααα.0.7lg,4.5lg,6.11,3.645.0lg10;7.8lg;7.10lg,?,.102,)(1021)(2212========⨯=--++--EBTMgEBTCaHYMgYCaYKKpKapKaEBTpHKKMgCaEDTAlm olEBTTpH的;时已知:误差又为多少?如在相同的条件下测计算终点误差滴定同浓度的用为指示剂络黑的氨性缓冲溶液中,以例:在α%5.1%1001010101033.213.68.38.36.14.5lglg101010113.6)0.225.10(2125.1045.07.10lg0.225.1033.233.2)(6.13.66.11206.1110)(2-=⨯⨯-=-=-=∆=-=-=∴=++==+=∴=-='---++-+-+EtpCaKpCapCaKCaHEBTEBTCaepHEBTspCaYαα时,解:测%11.0%100101010103.01.54.54.56.10.7lglg1.5)0.225.8(2125.845.07.8lg0.225..83.03.0)()(2=⨯⨯-==-=∆=-=-=∴=+=∴=-='---+EtpMgKpMgpMgKMgHEBTEBTMgepHEBTspMgYαα不变;酸度没变时,测例:在pH=10的氨性溶液中,以络黑T为指示剂,用0.02mol.l-1EDTA滴定0.02mol.l-1Zn2+,终点时游离氨的浓度为0.2mol.l-1,计算终点误差.已知: pH=10时45.0lg;4.2lg)()(==HYO HZnαα5.16lg;2.12==ZnYepZnKP413lg~lgββ的NHZn-分别是2.37,4.81,7.31,9.46解:%;1001010⨯'⨯-='∆-'∆MYspMMPMPKCEt必须先求出K′MY73.945.068.65.16lg1011010110)2.0(10...2.0101][...][1lglglglg68.64.268.6)()(68.6446.937.243431)(33=--='∴=-+=-+==⨯++⨯+=+++=--='MYOHZnNHZnZnNHZnYZnMYMYKNHNHKKαααββααα17.069.552.552.568.62.12lg69.5)37.92(21)lg(21-=-='-'='∆=-=-='=+='+='spepZntepMYspMspZnpZnpZnppZnZnpKpCZnpα%02.0%10010101010%;100101037.9217.017.0-=⨯⨯-=⨯'⨯-=--'∆-'∆MYspMMPMPKCEt例:在PH=5.0,用4×10-4mol.l-1EDTA滴定同浓度的Pb2+;以XO为指示剂(PMt=7.0);求终点误差(1)用六次甲基四胺为缓冲溶液,( 不与Pb2+络合)(2)用乙酸为缓冲溶液,[HAc]=0.2mol.l-1,[Ac-]=0.4mol.l-1(乙酸铅络合物的β1=101.9; β2=103.3 )解:%;1001010⨯'⨯-='∆-'∆MYspMMPMPKCEt其中2/;lglglglgMspMspepYMMYMYCCMpMpMpKK='-'='∆--='αα(1)用六次甲基四胺为缓冲溶液%1.0%1001010101078.078.70.70.7)(78.7)55.114(21)lg(2155.1145.60.18lglglg0.18lg,0lg,45.6lg:555.11478.078.0)()()(-=⨯⨯-=-=-='-'='∆=='=+='+='=-=-='∴====--EtbpPbpPbpPPbpPbbpPKPCbpPKKKpHspeptepPbYspPbspHYPbYPbYPbYOHPbHY所以:没有付反应时ααα(2)用乙酸为缓冲溶液%10%1001010101078.178.60.50.50.20.7lg78.6)55.94(21)lg(2155.90.245.60.18lglglglg102.0102.0101][][155..9478.178.1)()()(0.223..39.1221)(-=⨯⨯-=-=-='-'='∆=-=-='=+='+='=--=--='∴=⨯+⨯+=++=----EtbpPbpPbpPpPbbpPKpCbpPKKAcAcspepAcPbtepPbYspPbspAcPbHYPbYPbYAcPb所以:这时:αααββα例:某含Pb2+、Ca 2+的溶液,用同浓度的EDTA 滴 定,浓度均为2×10-2mol.l -1, E t = 0.3%,△PH = 0.2 问:1)能否分步滴定,2)滴定的酸度范围。
解:1)△lgK= lgk PbY -lgk CaY =18.0-10.7=7.3﹥5有可能在Ca 2+存在下滴定Pb 2+, 2)最小pH 值:αY(H) = αY(Ca) ≈K CaY C Ca= 10 10.7 × 10–2 = 108.7lg αY(H )= 8.7,查表:pH = 4.06.6~0.46.6104.2102102.1][][:72152)(2==⨯=⨯⨯==---+-PH PH Pb Ksp OH PH O H Pb 酸度范围:值最大例:用EDTA 滴定Al 3+ Zn 2+ 混合溶液中的Zn 2+,若浓度均为2×10-1mol.l -1,以KF 掩蔽Al 3+,终点时 C F =10-1mol.l -1 , PH=5.5 求: lgK /ZnY ? 在这个溶液里, Al 3+是EDTA 的副反应,而F 又是Al 3+的副反应。
解:Zn + Y = ZnY ;H + Y = HY , Al + F - = AlF lgK /ZnY =lgK ZnY -lg αY ;αY =αY(H) +αY(Al)PH=5.5 ,lg αY(H ) = 5.5,αZn(OH ) = 0 ,αY(Al ) =1+K AlY [Al +3], [Al +3]=C Al /αAl(F),C Al =1×10-2mol.l -1,∴αY(Al ) =1+K AlY C AL /αAL(F)αAL(F )=1+β1[F -]+β2[F -]2+β3[F -]3+β4[F -]4+ β5[F -]5+β6[F -]6=1+106.13×(10-1) +1011.15×(10-1)2 +1015×(10-1)3 +1017.75×(10-1)4 + 1019.37×(10-1)5 + 1019.84× (10-1)6 = 1014.5655.11010101156.143.162)()(3=⨯+=+=--+F Al AlYAl Al Y K C αα 由于 αY(H)﹥ αY(Al)Al +3的影响可以不考虑所以 lgK /ZnY = lgK ZnY - lg αY(H) =16.5 - 5.5 = 11例:某溶液中含有Fe 3+、Zn 2+、 Mg 2+, 浓度分别为10-3、10-3、10-2 ;lgK ′MY 分别为25.1、16.5、8.7;能否用控制酸度的方法用EDTA 分别测定各自浓度? 要求:E t = 0.3%, △pM=0.2 解:NM MY M C C K C K lg lg lg -'≥∆3.5lg ;100.1%1001010%3.0%;100101052.02.0='⨯='⨯'-=⨯'⨯-=--'∆-'∆MY M MYsp MMYspM MYspM M P M P K C K C K C K C EtFe 3+、Zn 2+之间:331010lg 3.56.85.161.25lg ---〉=-=∆K 可以分步滴定; Zn 2+ 、Mg 2+之间:也可以分步滴定;5.2~0.2;5.2104.310104][0.2101010112333835.135.163)()(3酸度范围的最低酸度:查表:的最高酸度:=⨯=⨯===⨯+==----+-+PH OH Fe PH Fe Zn Y H Y αα7~4.5;7101.110102.1][4.51010101731727.57.83)()(2酸度范围的最低酸度:查表:的最高酸度:=⨯=⨯===⨯+==----+-+PH OH Zn PH Zn Mg Y H Y αα10~7.9;10102.410108.1][7.97.00.87.8lg lg lg lg lg lg 52112)()(2酸度范围的最低酸度:查表:的最高酸度:=⨯=⨯===-='-=∴-='----++PH OH Mg PH K K K K Mg MgYMgY H Y H Y MgY MgY αα45.0lg 10.7.8lg ;0.7lg ,6.11,3.6,2.7lg ,0.13,2.6,;.100.2,10)(2121213=========⨯=--+--H Y MgY EBT Mg EBA Mg pH K K pKa pKa T K pKa pKa A Mg EDTA l m ol pH α时已知:度更高?问:用那种指示剂灵敏的络黑的络黑有两种指示剂可选滴定同浓度的用的氨性溶液中例:在42.162.52.4;2.40.32.7lg lg 101010162.5)0.325.8(2125.845.07.8lg )()()(0.32.60.130.200.130.10)(-=-=∆∴=-=-=∴=++==+==-='-++-+-EBA H EBA EBA Mg EBA ep H EBA sp MgYpMg K pMg pMg K αα解:..22.062.54.5;4.56.10.7lg lg 1010101lg )()()()()(6.13.66.110.206.110.10)(的灵敏度高比络黑所以络黑由于不变和相同条件A T pMg pMg pMg K pMg pMg K EBA EBT EBT H EBT EBT Mg EBT ep H EBT sp MgY∆〈∆-=-=∆∴=-=-=∴=++='-++-+-αα231010lg 3.58.77.85.16lg ---〉=-=∆K例:用0.020mol/l EDTA 滴定同浓度的Pb 2+.Al 3+混合溶液中的Pb,用HAc-NaAc 缓冲溶液控制酸度pH=5.5,用NaF掩蔽Al,终点时[Ac -]=0.1mol/l,[F -]=0.1mol/l,以XO 为指示剂时终点误差为多少? (P Pbt =7.6)已知:F-Al 的lg β1~ lg β6 分别为6.13, 11.55, 15.00,17.75, 19.37, 19.84;Ac-Pb 的lg β1~ lg β2 分别为1.9, 3.3解: Pb + Y = PbYPb + OH -=Pb(OH) ,Pb + Ac + = PbAc Y + H + =YH , Al 3+ + F - = AlF%;1001010⨯'⨯-='∆-'∆PbYspPb b PP b PP K C Et查表:pH = 5.5时 αPb(OH )= 0,αY(H )= 105.51lgK ′PbY = lgK PbY –lg αPb –lg αYαPb(Ac ) = 1 +β1[Ac -]+β2[Ac -]2=1 + 101.9 ×10-1 + 103.3 × 10-2 = 101.46 αY = αY(H) +αY(Al) αY(Al)=1+[Al 3+]K AlY ; ;[Al 3+]=C Al / αAl(F)αAl(F) =1+β1[F -]+…+β6[F -]6 = 1014.56[Al 3+]=C Al /αAl(F ) = 10-2/1014.56=10-16.56αY(Al ) =1+[Al 3+]K AlY =1+10-16.56×1016.3 = 1.55αY = αY(H) +αY(Al)≈ αY(H )= 105.51;lgK ′PbY = lgK PbY –lg αPb –lg αY=18.40 - 1.46 - 5.51 = 11.07 ΔpPb= p ′Pb ep –p ′Pb sp p ′Pb ep =pPb t -lg ;αPb(Ac ) = 7.6 -1.46 = 6.14p ′Pb sp = ½(pC sp Pb +lgK ′PbY )=½(2+11.07)=6.53 Δp ′Pb ep = 6.14 -6.53 = -0.39%006.0%;1001010101007.11239.039.0-=⨯⨯-=--Et例:在某含铜的试样中有铝存在,其浓度均为 2.0×10-2mol.l -1,加 入NH 4F 掩蔽Al 3+,用六次甲基四胺为缓冲溶液(PH=5.5),用EDTA 滴定Cu 2+,终点时[F -]=0.10mol.l -1,问:若是终点误差不超过0.1%, pCu t =9.3的指示剂是否合适 .解: pH=5.5时: lg αY(H )=5.5,αCu(OH)=0%;1001010⨯'⨯-='∆-'∆CuYsp Cuu PC u PC K CEt用pCu t (9.3)- pCu sp 与△pCu 比较即可; 若小于△pCu 就合适,大于△pCu 就不合适. Cu +Y=CuYCu+OH - =Cu(OH) ;Y + H += YH ;Al 3+ + F - = AlF lgK ′CuY = lgK CuY –lg αY ; αY = αY(H) +αY(Al)αY (Al ) =1 + [A l3+]K AlY ; ;[Al 3+]=C Al / αAl(F)αAl(F ) =1+β1[F -]+…+β6[F -]6 = 1014.56[Al 3+]=C Al / αAl(F) = 10-2/1014.56 =10-16.56αY(Al) =1+[Al 3+]K AlY =1+10-16.56×1016.3 = 1.55αY = αY(H) +αY(Al)≈ αY(H)= 105.51;lgK ′CuY = lgK CuY –lg αY =18.80 - 5.51 = 13.3%;10010101010%1.03.132⨯⨯-=-'∆-'∆u PC u PC代入误差公式,求得△pCu=2.65 而pCusp=1/2(2+13.3)=7.659.3-7.65=1.65< △PCu 指示剂很合适。
