载表柔比星的PEG化壳聚糖纳米粒对鼻咽癌细胞的增殖抑制作用
载抗肿瘤药物的壳聚糖纳米粒氨基化靶向修饰物的研究进展

载抗肿瘤药物的壳聚糖纳米粒氨基化靶向修饰物的研究进展目的:为寻找或开发更优的载抗肿瘤药物的壳聚糖纳米粒靶向修饰物提供参考。
方法:以“壳聚糖”“纳米粒”“氨基”“靶向修饰”“抗肿瘤”“Chitosan”“Nanoparticles”“Amino”“Targeting modification”“Antitumor”等为关键词,组合查询2005年1月-2018年3月在中国知网、万方、维普、PubMed、Web of Science、Elsevier、SpringerLink等数据库中的相关文献,对载抗肿瘤药物的壳聚糖纳米粒氨基化靶向修饰物从大分子和小分子配体两方面进行论述。
结果与结论:共检索到相关文献300篇,其中有效文献36篇。
对壳聚糖纳米粒表面的氨基进行修饰,可以获得具有主动寻靶作用的壳聚糖纳米粒,现有的靶向修饰配体有小分子的叶酸、生物素、乳糖酸、甘草酸等,大分子的透明质酸、鱼精蛋白、转铁蛋白、缬氨酸-精氨酸-甘氨酸-天冬氨酸-谷氨酸环肽、CD59特异性配体肽、促黄体生成素释放激素及MUC1等。
未来研究重点应利用壳聚糖纳米粒氨基這一表面特性,寻找或开发出更优的壳聚糖纳米粒的靶向修饰物,进一步提高壳聚糖纳米粒对肿瘤细胞的靶向效率。
关键词壳聚糖;纳米粒;氨基;靶向修饰;抗肿瘤主动靶向纳米给药系统,即对纳米粒表面进行靶向特异性修饰,使其靶向于细胞表面特异性表达或过表达的某种受体而实现靶向,该靶向系统可将药物定向递送于病变部位,达到降低毒副作用、增强疗效的目的[1-2]。
壳聚糖是目前自然界中发现的唯一一个碱性多糖[3],含量仅次于维生素。
壳聚糖纳米粒作为一种新型的给药系统,能够保护药物的稳定性,延长药物在体内的循环时间,有效提高药物利用度,并且具有良好的生物相容性和生物可降解性,因此,在药剂学中备受青睐[4]。
此外,壳聚糖分子结构中的氨基使其具有许多特殊功能,可进行多功能基化学反应和立体结构修饰,如将具有主动寻靶作用的单抗或配体通过化学修饰与之相结合,可获得具有定位传输功能的主动靶向制剂[5]。
整合素β3通过激活MAPK

第 63 卷第 2 期2024 年 3 月Vol.63 No.2Mar.2024中山大学学报(自然科学版)(中英文)ACTA SCIENTIARUM NATURALIUM UNIVERSITATIS SUNYATSENI整合素β3通过激活MAPK/ERK途径促进鼻咽癌细胞转移*李飞1,李超怡1,何越1,陈佩玲1,陈俊汝1,王家胜1,李春谋2,曾茂桢1,宋琳3,张擎1,41. 中山大学生命科学学院,广东广州 5102752. 中山大学附属第七医院,广东深圳 5181073. 惠州学院生命科学学院,广东惠州 5160074. 中山大学深圳研究院,广东深圳 518057摘要:鼻咽癌(NPC, nasopharyngeal carcinoma)作为我国南方及东南亚地区高发的一种头颈部恶性肿瘤,远端转移和局部复发是导致其治疗失败的主要原因。
本研究通过对不同转移能力的鼻咽癌细胞进行分析,发现整合素β3(ITGB3, integrin β3)在高转移鼻咽癌细胞中的表达明显高于低转移鼻咽癌细胞。
随后的研究表明ITGB3的上调表达促进了鼻咽癌细胞迁移、侵袭、克隆形成以及黏附能力,同时促进了鼻咽癌细胞增殖并抑制其凋亡水平。
进一步地,本研究发现,ITGB3主要通过激活MAPK/ERK途径,进而促进鼻咽癌细胞迁移、侵袭、克隆形成以及黏附。
因此,研究揭示了ITGB3对鼻咽癌细胞转移的调控作用及其分子机制,为鼻咽癌细胞转移防治与治疗提供了新的理论基础。
关键词:鼻咽癌;整合素β3;肿瘤转移;MAPK/ERK途径中图分类号:Q257 文献标志码:A 文章编号:2097 - 0137(2024)02 - 0139 - 11Integrin β3 promotes metastasis of nasopharyngeal carcinoma cells byactivating the MAPK/ERK pathwayLI Fei1, LI Chaoyi1, HE Yue1, CHEN Peiling1, CHEN Junru1, WANG Jiasheng1,LI Chunmou2, ZENG Maozhen1, SONG Lin3, ZHANG Qing1,41. School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China2. The Seventh Affiliated Hospital, Sun Yat-sen University, Shenzhen 518107, China3. School of Life Sciences, Huizhou University, Huizhou 516007, China4. Institute of Sun Yat-sen University in Shenzhen, Shenzhen 518057, ChinaDOI:10.13471/ki.acta.snus.2023E045*收稿日期:2023 − 08 − 31 录用日期:2023 − 11 − 03 网络首发日期:2023 − 12 − 04基金项目:广东省自然科学基金(2021A1515011209);广东省基础与应用基础研究项目(2022A1515140100);广州市科技计划项目(202002030416);深圳市科技创新委会基础研究计划(JCYJ20210324120812035)作者简介:李飞(1992年生),男;研究方向:肿瘤生物学;E-mail:*****************李超怡(1996年生),女;研究方向:肿瘤生物学;E-mail:*********************.cn何越(1994年生),男;研究方向:生物与医药;E-mail:******************(李飞、李超怡、何越并列第一作者)通信作者:宋琳(1975年生),女;研究方向:中医药防治痴呆机制;E-mail:*****************张擎(1966年生),男;研究方向:分子药理学;E-mail:***************(宋琳、张擎为共同通信作者)第 63 卷中山大学学报(自然科学版)(中英文)Abstract:Nasopharyngeal carcinoma (NPC) is a prevalent head and neck malignancy in South China and Southeast Asia, often leading to treatment failure due to distal metastasis and local recurrence. This study showed a significant increase in the expression of integrin β3 (ITGB3) in highly metastatic NPC cells compared to poorly metastatic NPC cells. This study further elucidates that upregulation of ITGB3 expression not only enhances the migratory, invasive, clonogenic, and adhesive capacities of NPC cells, but also promotes their proliferation and inhibiting apoptosis. Mechanistically, ITGB3 primarily acti‐vates the MAPK/ERK pathway, as a result, enhancing the migratory, invasive, clonogenic, and adhesive capabilities of NPC cells. These findings in the study reveal the regulatory effect and molecular mecha‐nism of ITGB3 on NPC cell metastasis, providing a new theoretical basis for the prevention and treat‐ment of NPC cell metastasis.Key words:nasopharyngeal carcinoma; integrin β3; tumor metastasis; MAPK/ERK pathway鼻咽癌(NPC, nasopharyngeal carcinoma)作为鼻咽部上皮组织高发的头颈部恶性肿瘤,具有明显的地域分布特征,主要分布于东南亚、北非以及我国南方等地区(Lei et al., 2020)。
负载表柔比星壳聚糖微球瘤内注射治疗小鼠肝移植瘤疗效观察

采用 W/ O
型乳化一 固化 法制备表柔 比星一壳聚糖微球 , 扫描电镜观察壳 聚糖 微球 的表 面形 态 、 径大小 。紫外 分光光度 计 粒 分析载药微球 的包封率 、 载药量及药物累积释放率 。将 1 8只 1 2皮下 肝癌荷瘤小 鼠分成 3组 , - 1 2 分给予 以下治疗 : 瘤内注射 生理 盐水 、 瘤内注射表柔 比星 、 内注射载药微球 , 瘤 监测荷瘤 小 鼠肿瘤体 积变化 , 计算抑瘤 率。结果 瘤 内注射表柔 比星 、 负载表柔 比星 的壳聚糖微球组 的平 均抑瘤率分别为 1% 、1 。结论 0 3% 关键 词 : 壳聚糖 ; 表柔 比星 ; 载药缓释微 球 ; 肝癌 ; 鼠 小
中图分类 号 :7 5 7 R 3 . 文献标志码 : B 文章编号 :0226 2 1 )20 3 - 10 -6 X(0 0 2 - 10 0 2
壳
聚糖微球平均粒径约为 l5pn 粒径 大小较一致 , 0 l, 包封率 约为 8% , 0 载药率约为 1% , 的累积释 放率为 8 % 。 1 2周 4 表明壳聚糖 微球是 一 种有 效的表柔 比星局部缓释剂型 , 内注射负载表柔 比星 的壳聚糖微球治疗肝癌有较强的抑瘤作用 。 瘤
基金项 目: 广东省 自然科学基金 资助项 目( 2 0 60 。 A 0 7 8 )瘤质量 一 =( 治疗组 平均瘤 质量 ) 生理 盐水组 平均瘤 质量 × 0 % 。 / 10
12 3 统计学方法 .. 采用 S S 1. 统计软件。计 P S30
,
11 材料 .
盐 酸表柔 比星 , 聚糖 ( 壳 分子量 约 2 0万
D 脱乙酰度 8 %) 其余试剂均为分析纯。H 2肝 , 8 , 2 癌细胞 株 购 自中 山 大 学 。雌 雄 各 半 的 5—6周 龄 SF级昆明小 鼠3 P 6只, 体质量 1 — 2g 8 2 。 12 方法 . 121 负载表柔 比星壳聚糖微球 的制备与鉴定 . J 采用 W/ O型乳化一固化法。取负载表柔 比星壳 聚糖微 球 少 量 放 置 在 细 胞 计 数 板 上 , 加 少 量 的 滴
负载青蒿素类药物纳米递送系统在肿瘤治疗中的应用进展

负载青蒿素类药物纳米递送系统在肿瘤治疗中的应用进展李珊珊,闫晓林,闫海英,林晓晴,黄欣,刘凤喜山东第一医科大学第一附属医院(山东省千佛山医院)临床药学科山东省儿童药物临床评价与研发工程技术研究中心山东省医药卫生临床药学重点实验室,济南250014摘要:青蒿素类药物可通过多种机制发挥抗肿瘤作用,但该类药物存在半衰期短、稳定性差和生物利用度低等缺点,限制了其治疗效果。
与游离药物相比,负载青蒿素类药物的纳米递送系统不仅可提高药物的溶解度和稳定性,延长体内循环时间,还可增强药物运输的肿瘤靶向性,具有更显著的抗肿瘤效果。
目前,青蒿素类药物的纳米递送体系包括脂质体、纳米粒、纳米结构脂质载体、聚合物胶束、囊泡、自微乳以及纳米前药等,每种纳米递送体系均具有各自的优点及待改进之处,对其进行总结可为其在抗肿瘤治疗中的应用提供参考。
关键词:青蒿素类药物;药物递送系统;纳米技术;抗肿瘤药物doi:10.3969/j.issn.1002-266X.2023.35.022中图分类号:R945 文献标志码:A 文章编号:1002-266X(2023)35-0088-04青蒿素(ART)是从植物青蒿中分离提取的具有过氧基团的倍半萜内酯类化合物,是我国惟一获得国际承认的、具有自主知识产权的抗疟新药[1]。
研究发现,ART类药物除具有抗疟作用外,还有免疫调节以及抗肿瘤等药理作用。
研究表明,ART类药物可以选择性杀伤多种肿瘤细胞但对正常细胞影响轻微,能逆转肿瘤细胞的多药耐药,且与传统化疗药物联合使用可起到协同、增效的作用[2-5]。
鉴于ART及其衍生物的特异抗肿瘤作用,美国国家癌症研究所已将其纳入抗癌药物筛选与抗癌活性研究计划之中[6]。
为了改善ART的理化性质,科学家经过不断探索,在原有ART 分子结构的基础上研究出ART的醚类、酯类等衍生物,包括双氢青蒿素(DHA)、青蒿琥酯(ATS)、蒿乙醚和蒿甲醚(ARM)等[7-8]。
ART具有抗肿瘤谱广、不良反应小、安全性高的特点,但其半衰期短、生物利用度低,影响其抗肿瘤效果。
Juglone对人鼻咽癌细胞株CNE-2Z细胞增殖及细胞周期的抑制作用

( u n dn dcl o ee Z aj n 2 0 , .R hn ) G a g ogMei lg , h ni g5 4 2 P .C i aC l a a
a d a r se elc ce i i o n re t d c l y l n vt . r
Ke r s u ln y wo d :J go e;p oi r t n;c l c ce a o h rn e ln o l s r l e ai f o el y l ;n s p ay g a e p a ms
摘要 : 目的
测定 Pn 抑制剂 (ul e 对人鼻咽癌细胞株 C E2 il Jgo ) n N -Z细胞 生长增 殖及 细胞周期 的影响 , 论 J. 讨 u 体外培养 人鼻 咽癌 C E2 N 一Z细胞 , 采用 M Y实验观察 细胞 生长增 殖状 T M F测定结 果显示 ,uln T Jg e对人鼻 咽癌 细胞 株 C E2 o N 一Z细胞 生长有 明显 的 Jgoe ul 有 n
山东 医药 2 1 第 5 0 2年 2卷第 1 6期
Jg n 对 人 鼻 咽癌 细胞 株 C E2 ul e o N 一Z 细胞 增 殖 及 细 胞周 期 的抑 制 作 用
崔 平, 李 蓉 , 英霞 , 康 荣 , 志巍 刘 蔡 何 ( 东医学 院 , 东湛 江 5 4 2 ) 广 广 2 0 3
frn cn e t t n f u ln rd ee t ua o s h rleai f N 一Z cl a d t t y m t h i o l ee t o cnr i s g ef i rn d rt n .T e poi rt n o E 2 e sw s e ce b e y ha l ao oj o o f i f o C l e d h zy
多西他赛PELGE纳米粒的处方优化、表征及其体外释放和抗肿瘤活性的初步评价
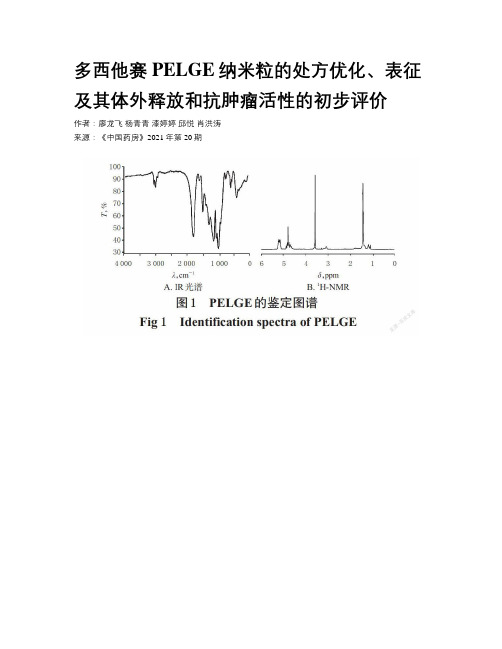
多西他赛PELGE纳米粒的处方优化、表征及其体外释放和抗肿瘤活性的初步评价作者:廖龙飞杨青青漆婷婷邱悦肖洪涛来源:《中国药房》2021年第20期中图分类号 R943;R944.9 文献标志码 A 文章编号 1001-0408(2021)20-2492-07DOI 10.6039/j.issn.1001-0408.2021.20.10摘要目的:优化多西他赛(DTX)-聚乙二醇-(聚乳酸-羟基乙酸)-聚乙二醇三嵌段共聚物(PELGE)-纳米粒(NPs)的处方,对其进行表征,并评价其体外释放特性及抗肿瘤活性。
方法:采用开环共聚法合成PELGE,采用乳化溶剂挥发法制备DTX-PELGE- NPs;采用高效液相色谱法测定DTX-PELGE-NPs中DTX的含量;以DTX用量、PELGE用量、泊洛沙姆188浓度为自变量,包封率为因变量,采用Box-Behnken设计-响应面法优化处方;采用激光粒度仪和透射电镜测定DTX-PELGE-NPs的粒度和Zeta电位;以DTX注射液为参照,采用离心超滤法测定体外释放率;以DTX注射液不含DTX的PELGE-NPs为参照,采用噻唑蓝法考察体外细胞毒性。
结果:最优处方为DTX用量2.80 mg,PELGE用量20.60 mg,泊洛沙姆188浓度6%。
优化所得DTX-PELGE-NPs的包封率为(86.79±1.32)%,载药量为(10.21±0.78)%,平均粒度为(78.4±2.9)nm,多分散性指数(PDI)为(0.187±0.018),Zeta电位为(-20.6±1.5)mV;电镜下DTX-PELGE-NPs呈类球形,分布均匀。
相较于DTX注射液(4 h时的累积释放率约为92.3%),DTX-PELGE-NPs有明显的缓释效果(36 h时的累积释放率约为78.6%)。
0.1~50 μg/mL的PELGE-NPs对人乳腺癌细胞MCF-7无明显细胞毒性(P>0.05),而0.5~10 μg/mL的 DTX-PELGE-NPs能够显著抑制人乳腺癌细胞MCF-7的生长,且作用(DTX-PELGE- NPs 10 μg/mL组除外)显著强于同浓度DTX注射液(P关键词多西他赛;聚乙二醇-(聚乳酸-羟基乙酸)-聚乙二醇三嵌段共聚物;Box-Behnken设计-响应面法;高效液相色谱法;处方优化Formulation Optimization and Characterization of Docetaxel PELGE Nanoparticles and Preliminarily Evaluation of Its Drug Release and Antitumor Activity in vitroLIAO Longfei1,YANG Qingqing2,QI Tingting1,QIU Yue1,XIAO Hongtao1(1. Dept. of Clinical Pharmacy, Sichuan Cancer Hospital/Sichuan Cancer Prevention and Control Center/the Affiliated Cancer Hospital of University of Electronic Science and Technology of China, Chengdu 610041, China; 2. Patent Examination Cooperation Sichuan Center, the Patent Office of CNIPA,Chengdu 610200, China)ABSTRACT OBJECTIVE: To optimize the formulation of docetaxel (DTX)-mPEG-PLGA-mPEG (PELGE)-nanoparticles (NPs), and to characterize it and evaluate its in vitro drug release and antitumor activity. METHODS: PELGE were synthesized by ring-opening polymerization. DTX-PELGE-NPs were prepared by using emulsion solvent evaporation method. The content of DTX in DTX-PELGE-NPs was determined by HPLC. Box-Behnken design-response surface methodology was applied to optimize the formulation of the nanoparticles using the amount of DTX, PELGE and poloxamer 188 as independent variable, using entrapped efficiency as dependent variable. The particle size and Zeta-potential of DTX-PELGE-NPs were characterized by laser particle size analyzer and transmission electron microscope. The in vitro release of the DTX-PELGE-NPs was investigated by ultra-filtered centrifugation, using DTX injection as reference. In vitro cytotoxicity of the DTX-PELGE-NPs was investigated by MTT assay, using DTX and PELGE-NPs without DTX as reference. RESULTS: The optimal formulation included 2.80 mg DTX, 20.60 mg PELGE and 6% poloxamer 188. The entrapped efficiency of optimized DTX-PELGE-NPs was (86.79±1.32)%; drug-loading amount was (10.21±0.78)%, and average particle size was (78.4±2.9)nm; polydispersity coefficient was (0.187±0.018) and Zeta potential was (-20.6±1.5) mV. Furthermore, DTX- PELGE-NPs showed a regular spherical and uniform distribution under scanning electron microscopy. Compared with DTX injection (accumulative release rate of 92.3% at 4 h), DTX- PELGE-NPs had a significant sustained-release effect (accumu- lative release rate of 78.6% at 36 h). 0.1-50 μg/mL PELGE-NPs had no obvious cytotoxicity to human breast cancer cells MCF-7 (P>0.05). 0.5-10 μg/mL DTX-PELGE-NPs could significantly inhibit the growth of human breast cancer cells MCF-7, and its inhibitory effect (except for DTX-PELGE-NPs 10 μg/mL group) was significantly stronger than that of DTX injection (PKEYWORDS Docetaxel; mPEG-PLGA-mPEG; Box-Behnken design-response surface methodology; HPLC; Formulation optimization多西他赛(docetaxel,DTX)为紫杉烷类微管抑制型抗肿瘤药物,主要作用于处在有丝分裂阶段的肿瘤细胞[1]。
壳聚糖纳米粒子在肿瘤治疗中的潜力研究

壳聚糖纳米粒子在肿瘤治疗中的潜力研究近年来,癌症的发病率不断增加,成为全球公共卫生领域的一大挑战。
尽管经过多年的研究,治疗方法和药物不断进步,但肿瘤治疗仍面临许多难题,如药物的选择性和生物利用度、低生物利用度、药物耐受性和副作用等。
因此,科学家们一直在寻找更有效和安全的治疗方法。
壳聚糖纳米粒子因其独特的性质和多功能性成为了肿瘤治疗领域的研究热点,有望在癌症治疗中发挥重要作用。
壳聚糖是一种生物可降解的聚合物,具有良好的生物相容性和生物降解性。
壳聚糖纳米粒子由壳聚糖制备而成,其结构稳定且可以调控,因此被广泛研究,用途潜力巨大。
在肿瘤治疗中,壳聚糖纳米粒子可以通过不同途径实现药物的传递和释放,同时还可以用于肿瘤成像、光热治疗和基因治疗。
首先,壳聚糖纳米粒子可以作为靶向药物传递系统,在肿瘤细胞中实现药物的高效传递。
与传统的药物输送系统相比,壳聚糖纳米粒子可以通过改变其粒子大小、表面功能化修饰和壳聚糖的附加物等方式,提高药物的稳定性和选择性释放。
临床研究表明,壳聚糖纳米粒子可以增加药物在肿瘤组织中的积累,并减少对正常组织的毒性。
其次,壳聚糖纳米粒子可以被用作肿瘤成像的载体。
在诊断和治疗过程中,准确了解肿瘤生长、扩散和治疗效果对于选择合适的治疗方案至关重要。
壳聚糖纳米粒子可以通过荧光标记或放射性同位素标记等方式,作为成像剂用于肿瘤成像。
这种成像方法不仅可以提供定量和定位的信息,还可以实时掌握肿瘤动态变化,为治疗方案的调整提供依据。
此外,壳聚糖纳米粒子还可以用于光热治疗。
光热治疗是一种利用纳米材料对肿瘤进行局部加热的方法,可以有效杀灭肿瘤细胞。
壳聚糖纳米粒子在光热治疗中具有广泛应用前景。
通过将壳聚糖纳米粒子与光敏材料结合,可以实现对特定波长的光的吸收,并产生局部加热,进而杀灭肿瘤细胞。
光热治疗具有创伤小、治疗时间短、无毒副作用等优点,有望成为肿瘤综合治疗的重要手段。
最后,壳聚糖纳米粒子也可以用于基因治疗。
基因治疗是一种通过引入特定的基因修复、调节或替代异常基因的方法,用于治疗肿瘤和其他遗传性疾病。
同时性原发性直肠癌并肺癌多发转移1例

[ ] P R A A K M J N M YS e a E e pl e m l u 3 A K , I H, A , t 1 f c o o m r o c— . t f y e
l e itetm ragt gc aatrt so l—asmbe a w i Ol o ren h c i i s f se l r  ̄t u t i h r e sc f e d g cl htsnn nprce[ ] ot l R l s ,20 l o ci a ao at l J .JC nr l ee e 0 7,12 y o i s o a 2
[ ] S R E T , I ER V I A F e a ee p et d 6 A M N O B R B IO A, E G , t 1 vl m n a .D o n
本实验利用 P G上带 负 电的氧 基 与壳 聚糖 上带 E 正 电的氨基 通过 分子 间氢 键结 合 , 成 C T P阴离 子发 生 P 分子 间或分 子 内交联 反应而 制得纳米 粒 , 体外 检测 发
现, 所制备 的载药纳米粒具有 良好 的载药 性能 , 物的 药
动物实验研究正在进行 中。
参 考 文 献
[ ] MA h— i S U I i- o U G RF e a ytes ca c r 1 OS iu, H A Xnt , N E , t 1 nhs , hr t - r a .S i ae
i tnadctoit o o (ty n l o) rt r e y ci z i n y t cy fpl e l eg c1 一g f—tm t l h— ao o x i y h e y a i h
( ) 35—34 3 :0 1.
壳聚糖纳米粒制备及表征与其抗肿瘤的生物学效应

0 引言
生物相容性好、可降解、对 组 织 和 细 胞 无 毒副作用的生物材料一直是生物医学领域研 究的热点。壳聚糖(α(1-4)2- 氨基 2- 去氧 β-D 葡聚糖)是甲壳素脱乙酰得到的天然多糖中惟 一的碱性多糖,具有很多优良的特性。壳聚糖 不溶于普通有机溶剂, 在碱液中稳定, 有很强 的亲水性。在稀酸性溶液中能够膨胀并形成凝 胶, 依此特性可制成各种缓释和控释制剂。壳 聚糖因含有游离氨基, 在酸性条件下能结合氢 离子, 从而使壳聚糖成为带正电荷的物质, 具 有选择性吸附和电中和作用。壳聚糖的氨基亦 能 与 芳 香 醛 或 脂 肪 醛 反 应 生 成 希 夫 碱(S chiff
壳聚糖纳米粒制备及表征与其抗肿瘤的生物学效应 **★
周少华, 洪 艳, 房国坚, 蒋玉燕, 毕忆群, 杨连华, 陈 勇
Biologica l Engine e ring
Ins titute , Zhe jia ng
Aca de my of Me dica l
S cie nce s , Ha ngzhou
Zhe jia ng P rovince ,
China
cyong93@ya hoo.com.
cn
S upporte d by: Ke y
P rogra m of Zhe jia ng
P rovincia l S cie nce
and
Te chnology
Bure a u,
No.
2005F11010*;
Corre s ponde nce to:
Chen
Yong,
Inve s tiga tor, Tutor of
ma s te r, Biologica l
Engine e ring Ins titute ,
表柔比星超顺磁性氧化铁纳米粒(EPI-SPION)经皮递药抗肿瘤作用研究

表柔比星超顺磁性氧化铁纳米粒(EPI-SPION)经皮递药抗肿瘤作用研究皮肤癌是人类最常见的恶性肿瘤,每年的新患人数超过100万,尤其在浅色人种中,皮肤癌的发病率日趋增高。
传统的肿瘤化疗及放疗普遍存在靶部位药物浓度低、药物毒副作用大等缺陷,治疗的效果不理想。
目前对类似恶性黑色素瘤这一类浅表性皮肤癌仍欠缺有效的药物治疗手段。
在纳米药物抗肿瘤研究中,磁性靶向递药系统的给药方式一般采用静脉注射,要求药物粒子能自由通过最小的毛细血管,粒子易被肾脏排泄或聚积到骨髓中,导致抗肿瘤药物的毒性加大。
另一方面磁性药物靶向治疗的磁场装置设计和实施也是一个限制磁性靶向递药系统发展和应用的关键问题。
本研究尝试采用经皮递药系统克服上述不利限制,探索皮肤肿瘤治疗的新途径。
超顺磁氧化铁纳米粒(SPION)的研究从最初侧重于MRI造影发展到目前的靶向给药、治疗和造影等。
具有肿瘤靶向SPION由于其在MRI诊断、热疗及靶向给药中潜能,是目前靶向药物研究中很热门的课题。
本研究以表面具有功能基团的γ-Fe2O3纳米粒为内核,将具有伯氨基的肿瘤化疗药物表柔比星(EPI)嫁接于γ-Fe2O3纳米粒,得到直径十几个纳米、具有超顺磁性的表柔比星超顺磁性纳米粒(EPI-SPION),以磁导向经皮靶向递药技术和色素瘤细胞模型为主要研究对象,阐述在外加磁场作用下,EPI-SPION经皮给药穿透皮肤角质层及靶向皮肤肿瘤细胞的能力和作用机制。
结合肿瘤药物治疗学、分子生物药剂学和材料化学的思路和技术方法,从组织及细胞水平探讨超顺磁性纳米粒经皮吸收靶向肿瘤细胞的转运机制和动力学行为。
首先通过共沉淀-交联耦合法制备功能化γ-Fe2O3纳米粒,经仿生化表面修饰后将药物嫁接至纳米粒表面,得到性质稳定的EPI-SPION递药系统,并试图通过调控外磁场作用方式和强度,高效递送抗肿瘤药物至肿瘤局灶区。
我们前期得到的载药SPION水合粒径大小为16±2nm,主要理化性质研究表明,该纳米粒具有类球形单畴晶格形貌,保持良好磁性效能,饱和磁化强度大于70 emu/g,矫顽力几乎为零,具有良好的超顺磁性能。
壳聚糖纳米颗粒在癌症治疗中的应用潜力探究

壳聚糖纳米颗粒在癌症治疗中的应用潜力探究引言:癌症是当今世界的一大威胁,其治疗一直是科学家们努力追求的目标。
近年来,纳米技术的快速发展为癌症治疗带来了新的希望。
壳聚糖纳米颗粒作为一种新型的治疗载体,具有较好的生物相容性和低毒性,被广泛应用于癌症治疗中。
本文将探究壳聚糖纳米颗粒在癌症治疗中的应用潜力,并简要介绍其原理和具体应用情况。
壳聚糖纳米颗粒的制备及特性:壳聚糖纳米颗粒是由壳聚糖材料制备而成,其制备方法多种多样,主要包括自组装法、化学还原法和磁性共沉淀法等。
壳聚糖材料具有天然、生物相容性和可降解性等优点,适合用于纳米颗粒的制备。
而制备得到的壳聚糖纳米颗粒具有较小的颗粒尺寸、较大的比表面积和较佳的稳定性,能够有效提高药物的靶向递送效果。
壳聚糖纳米颗粒在癌症治疗中的应用潜力:1. 靶向递送:壳聚糖纳米颗粒可以通过改变其表面的化学结构,实现药物的靶向递送。
通过适当的修饰,壳聚糖纳米颗粒可以选择性地结合癌细胞表面的特异性分子,提高药物的选择性释放,减少对正常细胞的损伤。
2. 缓释效果:壳聚糖纳米颗粒可以作为药物的载体,在其内部包裹药物,并通过缓慢释放的方式将药物逐渐释放到目标组织。
这种缓释效果可以有效延长药物在体内的滞留时间,增加药物的生物利用度,提高治疗效果。
3. 联合治疗:除了作为药物的载体,壳聚糖纳米颗粒还可以与其他治疗手段相结合,实现联合治疗。
例如,将化疗药物与光热疗法相结合,壳聚糖纳米颗粒可以在光照条件下产生局部高温,增加药物的渗透性,提高治疗效果。
具体应用案例:1. 靶向递送:研究人员通过将壳聚糖纳米颗粒修饰为靶向癌细胞表面的抗体,实现了抗癌药物的靶向递送。
实验证明,与未修饰的纳米颗粒相比,修饰后的壳聚糖纳米颗粒在癌细胞中的药物积累量明显增加,治疗效果得到显著提高。
2. 缓释效果:研究人员将常用的化疗药物包裹在壳聚糖纳米颗粒内部,通过缓慢释放的方式将药物逐渐释放到肿瘤组织中。
研究结果显示,与直接使用化疗药物相比,使用壳聚糖纳米颗粒包裹的药物能够延长药物在体内的滞留时间,减少毒副作用,并有效提高治疗效果。
鼻咽癌的药物治疗与耐药机制

鼻咽癌的药物治疗与耐药机制鼻咽癌,又称鼻咽鳞状细胞癌,是一种起源于鼻咽部的恶性肿瘤。
目前,药物治疗是鼻咽癌的主要治疗方法之一,但长期使用药物容易导致耐药性的产生。
本文将介绍鼻咽癌的药物治疗方法以及耐药机制。
一、鼻咽癌的药物治疗方法1. 化疗化疗是目前最常用的鼻咽癌药物治疗方法之一。
常用的化疗药物包括紫杉醇、顺铂、多西他赛等。
化疗的原理是通过抑制癌细胞的分裂和增殖,达到抑制肿瘤生长和扩散的目的。
化疗常常与放疗联合应用,以提高治疗效果。
2. 靶向治疗靶向治疗是一种针对肿瘤特定基因或蛋白靶点的治疗方法。
对于鼻咽癌,HER2和EGFR是常见的靶点。
靶向治疗药物包括曲妥珠单抗、厄洛替尼等。
靶向治疗具有针对性强、副作用较小等优点,但其疗效仍需进一步研究。
3. 免疫治疗免疫治疗是利用激活患者自身免疫系统来攻击肿瘤细胞的治疗方法。
重要的免疫治疗方法包括PD-1抑制剂和PD-L1抑制剂。
免疫治疗对提高患者的生存率和生活质量有积极的影响,但并非适用于所有患者。
二、鼻咽癌的耐药机制1. 基因突变肿瘤细胞在长时间的药物治疗过程中,往往会出现基因突变,从而导致对药物的耐药性增加。
举例来说,EGFR基因突变会导致靶向治疗药物厄洛替尼的耐药。
2. 药物转运蛋白细胞膜上的药物转运蛋白是药物进入细胞的关键通道。
某些肿瘤细胞可以通过调节药物转运蛋白的表达和活性来排出药物,从而降低药物的疗效。
3. 肿瘤干细胞肿瘤干细胞具有高度耐药的特性,它们能够通过自我更新和无限增殖来维持肿瘤的持续生长。
同时,肿瘤干细胞表达的药物转运蛋白也可能引起耐药性。
4. 环境因素细胞外环境的改变也可能导致鼻咽癌细胞对药物的耐药性产生。
例如,肿瘤微环境中的低氧状况和酸性环境会降低化疗药物的疗效。
5. 组织内异质性鼻咽癌组织内存在异质性,不同部位的肿瘤细胞可能对药物具有不同的敏感性。
一些药物可能只能抑制某些区域的肿瘤细胞,而对其他区域的肿瘤细胞无效,从而导致耐药性的产生。
fes-peg载药纳米颗粒对肿瘤细胞杀伤作用的研究

Nanostructured FeS was synthesized by high temperature synthesisꎬ and FeS ̄PEG was obtained by crosslinking modi ̄
of apoptosis promoted by free DOX culture was (5 1 ± 0 72) % ꎬ while that by the drugs loaded with FeS ̄PEG was
(31 28 ± 2 28) % . Conclusion FeS ̄PEG nanomaterials can carry small molecule drugsꎬ change the retention site
loaded by FeS ̄PEG nanomaterials was 134% . The loaded drugs were released by 7 13% if pH = 7 4ꎬ by 10 94%
if pH = 6ꎬ by 24 53% if pH = 5. The drugs loaded by FeS ̄PEG could retain DOX in the cytoplasm. The percentage
例(31 28 ± 2 28) % ꎮ 结论 FeS ̄PEG 纳米材料可载带小分子药物ꎬ改变小分子药物在细胞内的停留部位ꎬ将
小分子药物滞留于细胞质中ꎬ另外ꎬ该纳米材料载带药物后可明显促进细胞凋亡ꎬ从而达到增强药物对肿瘤细
胞的持久杀伤作用ꎬ在药物载带输送方面具有很大应用前景ꎮ
壳聚糖抗肿瘤缓释药物的特征☆

壳聚糖抗肿瘤缓释药物的特征☆令亚琴【摘要】BACKGROUND: Tumor is serious harmful to human health, andthe application of effective chemical drug therapy has great significance. OBJECTIVE: To analyze the mechanism and the therapeutic effect of drug-loaded chitosan sustained-release system on the treatment of tumor. METHODS: The mechanism and the therapeutic effect of drug-loaded chitosan sustained-release system on the treatment of tumor was analyzed, as wel as the characteristics and anti-tumor effect of chitosan and various chitosan-loaded anti-tumor drugs, such as doxorubicin, epirubicin, epirubicin, 5-fluorouracil and paclitaxel. RESULTS AND CONCLUSION: Chitosan anti-tumor-sustained release drug materials have good drug release properties and anti-tumor properties, it can load variety of commonly used antitumor drugs, control the drug release rate, extend the drug action time, maintain the effective drug concentration and decrease the toxicity and side effects of drugs, it also has targeting effect on tumor and tissues and organs, and it can increase the therapeutic effect of chemotherapeutic drugs on tumor significantly.% 背景:肿瘤严重危害人类的健康,应用有效的化学药物治疗具有重要的意义。
壳聚糖载药纳米微球对人肝癌细胞的杀伤作用及AFM探测

壳聚糖载药纳米微球对人肝癌细胞的杀伤作用及AFM探测刘媚;张建莹;杨培慧;蔡继业【期刊名称】《电子显微学报》【年(卷),期】2009(28)2【摘要】本文以5-氟尿嘧啶(5-Fu)为抗肿瘤药物模型,壳聚糖为载体,制备平均粒径约为250nm的5-氟尿嘧啶/壳聚糖(5-Fu/Cs)载药纳米微球.采用MTT法评价载药纳米微球在体外对人肝癌细胞BEL7402的杀伤率,并采用原子力显微镜探测用药处理前后的肿瘤细胞表面超微结构的变化.结果表明,载药纳米微球对肿瘤细胞的杀伤率在量效和时效上明显比同剂量单独5-Fu作用的杀伤率高;AFM结果显示5-Fu 与载药纳米微球对人肝癌细胞BEL7402作用后的细胞膜表面超微结构的变化存在较大差异,载药纳米微球在肿瘤细胞表面的吸附作用或内吞作用,导致载药纳米微球在细胞表面的释药机制不同于单独药物的扩散模型.【总页数】4页(P146-149)【作者】刘媚;张建莹;杨培慧;蔡继业【作者单位】暨南大学化学系,广东,广州,510632;暨南大学化学系,广东,广州,510632;暨南大学化学系,广东,广州,510632;暨南大学化学系,广东,广州,510632【正文语种】中文【中图分类】TN16;R730.21;Q336【相关文献】1.金纳米棒标记HepG2人肝癌细胞的荧光成像及其AFM探测 [J], 孙桂敏;杨培慧;孙俊环;蔡继业2.载汉防己甲素壳聚糖纳米微球的制备及其对人翼状胬肉细胞增殖的抑制作用 [J], 黄智;周怀胜;许扬扬;胡丹;郑霄;张弛3.羧甲基壳聚糖载药纳米微球的制备及其对喉肿瘤细胞的杀伤及靶向作用的探测[J], 姚述光;张文豪;杨培慧;蔡继业4.人源化抗肝癌scFv融合RC-RNase在大肠埃希菌中的表达及对人肝癌细胞SMMC-7721的体外杀伤作用 [J], 付勇;刘彦仿;苏勤;赵君;李锴男;杨守京5.SN-38载药纳米微球对人胃癌细胞BGC-823的抑制作用 [J], 孙国庆;胡勇;李晓林;孙昊因版权原因,仅展示原文概要,查看原文内容请购买。
壳聚糖纳米微球作为化疗药物载体的研究进展

壳聚糖纳米微球作为化疗药物载体的研究进展
李晶;汪森明
【期刊名称】《广东医学》
【年(卷),期】2011(32)6
【摘要】@@ 随着肿瘤发病率的不断上升,恶性肿瘤已成为威胁人类生命的第一杀手.目前治疗肿瘤的主要方法有手术、放疗、化疗.化疗是唯一的全身性整体治疗方法,但是传统的化疗药物对正常细胞和肿瘤细胞缺乏选择性,在杀伤肿瘤细胞的同时往往也会损伤人体的正常细胞.
【总页数】3页(P806-808)
【作者】李晶;汪森明
【作者单位】南方医科大学珠江医院肿瘤中心,广州,510282;南方医科大学珠江医院肿瘤中心,广州,510282
【正文语种】中文
【相关文献】
1.壳聚糖作为药物载体的缓释机理的研究进展 [J], 罗华丽;鲁在君
2.壳聚糖及其衍生物在药物载体方面的研究进展 [J], 王竞男;罗嘉浩;杨立群;邓宇斌
3.壳聚糖作为基因药物载体的研究进展 [J], 苏惠霜;王一飞
4.壳聚糖作为药物载体的研究进展 [J], 王志强;范玉玲;孟祥宇;刘通;季宇彬
5.作为药物载体金属有机框架的功能化材料研究进展作为药物载体金属有机框架的功能化材料研究进展 [J], 韩莎莎;赵僧群;刘冰弥;刘宇;李丽
因版权原因,仅展示原文概要,查看原文内容请购买。
改性载顺铂磁性纳米药物治疗鼻咽癌的体外实验

改性载顺铂磁性纳米药物治疗鼻咽癌的体外实验李仲汉;谢民强;陈帅君;王蕾【期刊名称】《中国组织工程研究》【年(卷),期】2009(013)029【摘要】背景:近年来载抗癌药物磁性纳米微粒作为一种新型靶向给药系统,利用其高载药量、靶向定位输送、以及磁粒的热效应、可生物降解等优点,为高效、低毒副作用的化疗带来了新的希望.目的:观察顺铂耦合海藻酸钠改性磁性纳米球载体后对人鼻咽癌CNE2细胞的体外毒性效应.设计、时间及地点:体外对比观察实验,于2005-03 在中山大学北校区药理实验室完成.材料:顺氯氨铂(CDDP)由山东齐鲁制药厂提供,海藻酸钠改性载顺铂四氧化三铁磁性纳米球(CDDP-SAMNP),粒径大小43-52 nm,可逆释放的CDDP量(或利用率)约65%.鼻咽癌CNE2细胞株由中山大学肿瘤医院细胞病理实验室提供.方法:实验分药物处理组及对照组,药物处理组分为CDDP组和CDDP-SAMNP组,CDDP和CDDP-SAMNP均用RPMI-1640培养液稀释,加药浓度按CDDP的含量计.对照组分别为RPMI-1640培养液组和单纯SAMNP组(加入四氧化三铁,磁核质量浓度为7 g/L,以培养液稀释).主要观察指标:采用MTT法分别观察1.89-11.34 mg/L的CDDP及相应剂量的CDDP-SAMNP 对鼻咽癌CNE2细胞作用24,48 h后的杀伤率;并通过透射电镜观察CNE2对CDDP-SAMNP的摄取.结果:①单纯SAMNP对鼻咽癌CNE2细胞无杀伤作用,与培养液组相似(P>0.05).②随着CDDP和CDDP-SAMNP药物浓度的增加,药物对CNE2细胞的杀伤率呈明显的量效关系.同一药物相同浓度下,随着作用时间的延长,杀伤率提高,呈明显的时效关系.作用24 h,CDDP-SAMNP对鼻咽癌CNE2的杀伤率与CDDP相似(P>0.05).作用48 h,中低浓度(1.89~5.04 mg/L)时,CDDP-SAMNP的杀伤率低于CDDP(P<0.05),当达到6.93 mg/L时,杀伤率接近同浓度的CDDP.③CNE2细胞能够摄取CDDP-SAMNP和SAMNP.结论:在高浓度下阴离子海藻酸钠改性载顺铂磁性纳米球对鼻咽癌CNE2细胞的体外毒性与同浓度单纯顺铂相近,杀伤作用来源于载体释放的顺铂.改性后顺铂的稳定性提高,药效没有降低.%BACKGROUND:Anticancer drugs-loaded magnetic nanopartides,as a novel targeting drug delivery system,are characterized by high drug loading dose,targeting location transport,heat effect of magnetic grains,and biological degradation.Thus,this system brings new hopes for chemical therapy with high efficiency and low toxic and sideeffects.OBJECTIVE:To observe in vitro toxic effects of complexing cis-diaminedichloroplatinum (CDDP)-loaded magnetic nanopartides on human nasopharyngeal carcinoma (NPC) CNE2 cells.DESIGN,TIME AND SETTING:The in vitro controlled study was performed at the Laboratory of Pharmacology,Northern Region,Sun Yet-sen University in March2005.MATERIALS:CDDP was provided by Shandong Qilu Pharmaceutical factory.CDDP-loaded magnetic nanoparticles (CDDP-SAMNP),43-52 nm in particle diameter.Utilization rate of CDDP was about 65%.NPC CNE2 cell line was supplied by the Laboratory of Cell Pathology,Cancer Hospital,Sun Yat-sen University.METHODS:This study contained medication and control groups.The medication group was assigned to CDDP and CDDP-SAMNP groups.CDDP and CDDP-SAMNP were diluted by RPMI-1640 medium.Drug concentration was in accordance with CDDP content.The control group was divided into RPMI-1640 medium and SAMNP groups (adding ferroso-ferric oxide,magnetic nucleus concentration was 7 g/L,diluted by themedium).MAIN OUTCOME MEASURES:MTT assay was used to observe kill and wound rate of 1.89-11.34 mg/L CDDP and corresponding dose of CDDP-SAMNP on NPC CNE2 cells following 24 and 48 hours.Uptake of CDDP-SAMNP by CNE2 cells was investigated under a transmission electron microscope.RESULTS:SAMNP as the medium group had no effect on killing or wounding CNE2 cells (P>0.05).With the increment of CDDP and CDDP-SAMNP dose,the kill and wound rate presented an obvious dose-effect relationship.At the same dose,the same medicine showed an increasing kill and wound rate with the extension of reactiontime,presenting an obvious time-effect relationship.At 24 hours after reaction,the kill and wound rate of CDDP-SAMNP and CDDP were similar (P>0.05).At 48 hours,at the dose from 1.89 to 5.04 mg/L,the kill and wound rate of CDDP-SAMNP was lower than that of CDDP (P<0.05),but when increased to 6.93 mg/L,the kill and wound rate of CDDP-SAMNP was dose to that of CDDP.SAMNP and CDDP-SAMNP could be easily taken into CNE2 cells.CONCLUSION:Effect of CDDP-SAMNP on killing and wounding NPC CNE2 cells is close to that of cis-diaminedichloroplatinum at the same high dose.The active sources are the cis-diaminedichloroplatinum released from the nano-camers.The stability of modified CDDP-SAMNP has been increased and its therapy effect has not been influenced.【总页数】4页(P5637-5640)【作者】李仲汉;谢民强;陈帅君;王蕾【作者单位】中山大学附属第三医院耳鼻咽喉头颈外科,广东省,广州市,510630;南方医科大学珠江医院耳鼻咽喉头颈外科,广东省,广州市,510282;南方医科大学珠江医院耳鼻咽喉头颈外科,广东省,广州市,510282;中山大学附属第三医院耳鼻咽喉头颈外科,广东省,广州市,510630【正文语种】中文【中图分类】R318【相关文献】1.改良原子吸收光谱法测定组织中载顺铂磁性纳米药物中的顺铂含量 [J], 王蕾;谢民强;陈帅君2.改性载顺铂磁性纳米药物联合放疗靶向治疗鼻咽癌裸鼠移植瘤的研究 [J], 龙镇;谢民强;张涛;沈辉;徐雪青;郭灵3.磁性纳米介孔材料携载尿激酶的体外溶栓实验研究 [J], 杨文芝;吴强;宋蓓雯;杜新华4.载顺铂磁性纳米药物在鼻咽癌裸鼠移植瘤组织内的分布及靶向性研究 [J], 黄水仙;谢民强;李勇;袁晓阳;陈帅君5.改性载顺铂磁性纳米药物靶向治疗鼻咽癌的实验研究 [J], 黄水仙;谢民强;李仲汉;张宏征;龙镇因版权原因,仅展示原文概要,查看原文内容请购买。
载阿霉素红细胞膜壳聚糖靶向纳米粒的制备及评价

载阿霉素红细胞膜壳聚糖靶向纳米粒的制备及评价洪伟勇;周旭晖;金陈浩;王金明;郭钫元;杨根生【期刊名称】《中国药房》【年(卷),期】2022(33)13【摘要】目的制备靶向肿瘤细胞叶酸(FA)受体的载阿霉素红细胞膜壳聚糖靶向纳米粒(FA-RBC-DOX-CS-NPs),并进行评价。
方法采用离子交联法制备载阿霉素壳聚糖纳米粒(DOX-CS-NPs),将FA和氨基聚乙二醇磷脂(NH2-PEG2000-DSPE)通过共价连接后修饰红细胞膜,然后构建FA-RBC-DOX-CS-NPs,并对其进行表征,考察其体外释药特性、抗肿瘤活性、入胞能力(以人乳腺癌MCF-7细胞进行考察)。
结果FA-RBC-DOX-CS-NPs平均粒径为(254.200±2.651)nm,多分散性指数为0.199±0.031,Zeta电位为(-10.100±0.213)mV;其在肿瘤微环境(pH6.5)中的释放速率较快。
细胞实验表明,该纳米粒可抑制MCF-7细胞的增殖活力,且可提高药物的入胞效率。
结论本研究成功制备了FA-RBC-DOX-CS-NPs。
该纳米粒具有较好的肿瘤细胞靶向性和入胞能力,可实现药物在肿瘤细胞内富集。
【总页数】6页(P1594-1599)【作者】洪伟勇;周旭晖;金陈浩;王金明;郭钫元;杨根生【作者单位】台州学院附属市立医院药剂科;浙江工业大学药学院【正文语种】中文【中图分类】R944【相关文献】1.叶酸-壳聚糖载地西他滨纳米粒的制备及对舌癌细胞的靶向抑制作用2.人转铁蛋白修饰载阿霉素海藻酸钠纳米粒的制备与评价3.载姜黄素/阿霉素叶酸偶联壳聚糖纳米粒的制备4.氢化咖啡酰壳聚糖-铜-阿霉素三元配位超分子的制备及肾靶向评价5.超临界CO_(2)一步法制备载盐酸阿霉素和紫杉醇壳聚糖纳米粒因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
咽癌 细胞株 的增殖抑 制作用。方法
制 作 用 。结 果
径, 透射 电镜观察其形 态特征 , 通过 MT Y法测定 和研 究 P G C E / S—E IN s 5—8 P P 对 F鼻咽癌 细胞株 的体 外增 殖抑
临床应用受 到 限制 , 将表柔 比星制 成纳米 剂型 可达到
0 8m / L的溶液 , . g m 并依次过 04 m和 0 2 m的滤 .5 .2 纸 。取 4m E / S A 溶液 , LP G C —H c 加入 07 gE I持 .5m P ,
续磁力搅拌下 , 缓慢滴入 12m . L的 r P溶液 , r P 继续 搅拌 3 i, 0mn 自发生成包封有 E I P G C P 。 P 的 E / SN s
13 2 P G C . . E / S—E IN s的 粒 径 和 形 态 学检 测 取 P P P G C E I P 悬 液 适 当 稀 释 后 , 加 在 覆 盖 碳 膜 E / S— P s N 滴
药物传递和缓释的载体 , 由于其超微小体 积 , 可通过靶 向定位 及缓释作 用进入 肿瘤细 胞 内, 但提高 了药物 不
的疗效 , 同时也大大减少了药物的不 良反应 , 因而在肿 瘤的 治 疗 方 面 得 到 了广 泛 的研 究 … 。壳 聚 糖 ( h— Ci tsn C ) oa , S 是一种 广泛 存 在于 自然 界 的聚 阳离 子 多糖
滤, 并加入一定量的 P G, E 制成 C 和 P . , g m E / S—H c溶 液 , 节 p 至 A 调 H 5 5 取 适 量 T P 溶 解 于 双 蒸 水 中 得 到 浓 度 为 .; P
物, 然而该 药的骨髓 抑制 、 脏毒性 等 不 良反 应 , 其 心 使
so fp r x r d x n 4 i a g d ts e y a t c a r p o e i — in o e o ie o i n d ma e e t s b ri ilc y t r h d i f
f m t nd n g sen oeei o a [ ] E rJ Bohm, o ai u n p rfgn s frt J . u i e r o i s s c
衍生物 , 具有 良好 的生物相容性 和生物可 降解性 , 成膜
成粒 性好 , 近年来 常应 用于 药物 缓释 载体 。表柔 比星( p u i n E I 是临床上常用的蒽环类抗肿瘤药 e i bc , P ) r i
( A) H c 溶液 中, 次用 04 m和 0 2 m 的滤纸 过 依 .5 .2 t x
2 0 ,28 1 ) 303— 6 . 0 1 6 ( 0 : 5 30 1
i [ ] eo e , 0 2, 5 26— 7 . s J .R dxR p 2 0 7( ): 7 2 8 m ( 收稿 日期 :0 8—1 2 编辑 : 20 0— 1 祝华 )
[5] MA S K , A AG WA I U HI e a.I a e xrs 1 T U IS S S A ,IC Y, t 1 mpi depe— r
广 东医学
20 09年 3月 第 3 O卷第 3期
Gu n d n dcl o r a Ma.20 V 1 3 No a g o gMe i u n l aJ r 0 9, o. 0, .3
.3 61.
me to e me rn n ft mb a e—b u d f r o e o ie o i n a r s ne h o n o m f r xr d x n 4 i e o o l p
PG C E / S—E I P 呈 圆形 或 椭 圆形 , 径 分 布 均 匀 , 均 粒 径 3 2 1n 对 5—8 P s N 粒 平 2 . m, F细 胞 株 的 增 殖
抑制作 用具有 浓度 和时间依 赖性 , 随药物作 用时间的延 长和浓度 的增大 , 抑制 率逐 渐提 高。结论 Ns P 性能 良好 , 制备 工艺简单, 有望成为化疗 药物 的新 型制剂。
机 ( 国 L boc 公 司 ) 酶标 仪( 国 L i ) 美 a cno 、 德 e a。 e
1 3 方 法 .
1 3 I P G C P 的制备及 负载 E I 参考文献 [ ] . . E / SN s P 4
的方法 , 略加改动。精密称取 1 gC 5m S溶于 1 %的乙酸
PGC E / S—E I P
【 关键 词】 壳聚糖 ; 柔比星 ; 米粒 表 纳
近年来 , 纳米技术在医学领域得到 了广泛 的应用 ,
其 中引人注 目的是利用纳米级聚合物粒子作 为抗肿瘤
苏) u 、 V一25 W 型紫 外分 光光 度 计 (日本 岛 津 ) 透 6F 、
射 电子显 微镜 (日立 一H 0 ) 激 光 衍 射粒 度 分 析仪 60 、 ( e zr 0 0H , 国 M l n 司) 低温冷冻干燥 Z t s e 3 0 S 英 ai ae 公 v 、
载 表 柔 比星 的 P G化 壳 聚糖 纳米 粒 对 E 鼻 咽癌 细 胞 的增 殖 抑 制 作 用
郭立 文 ,汪森 明 ,胡喜 钢 ,曹漫 明 ,张积仁
南 方 医科 大 学 珠 江 医院 肿 瘤 中心 ( 州 50 8 ) 广 12 2
【 要】 目的 摘
探讨 包裹抗 癌药物表 柔比星( P) P G化壳聚糖纳 米粒( E / S— P N s 对 5— F E I的 E P G C E I P) 8 鼻
