理想气体分子的平均平动动能与温度
分子动理论气体分子平均动能
32 103 26 m 5 . 31 10 kg 23 N A 6.02 10 (3)
3 3 k kT 1.38 10 23 ( 27 273) 6.21 10 21 J 2 2
3 – 3 理想气体分子的平均平动动能与温度的关系
第三章气体动理论
子数相等。
分子数 密度
k=R/NA=1.38×10-23J· K-1
称为玻耳斯曼常量
3 – 3 理想气体分子的平均平动动能与温度的关系
第三章气体动理论
二、理想气体分子的平均平动动能与温度的关系
阿伏加德罗定律:
p nkT
2 1 2 理想气体压强公式 p n mv 3 2 1 3 2 k m v kT 分子平均平动动能 2 2
容器内不同气体的温度相同分子的平均平动动能也相同即kknkk?????????????????21而分子数密度满足????inn故压强为??????????????????????????????????????????????ikiikikikpnnnnp????????32323232即容器中混合气体的压强等于在同样温度体积条件下组成混合气体的各成分单独存在时的分压强之和
例 利用理想气体的温度公式说明Dalton 分压定律。
解:容器内不同气体的温度相同,分子的平均平动动能也 相同,即
k1 k 2 kn k
而分子数密度满足
n ni
故压强为 2 2 2 2 P n k ni k ni k ni ki Pi 3 3 3 3 即容器中混合气体的压强等于在同样温度、体积条件下组成 混合气体的各成分单独存在时的分压强之和。这就是Dalton 分压定律。
描述理想气体的统计规律

描述理想气体的统计规律
对单个分子来说,每个气体分子的运动都可视为质点运动, 遵从牛顿运动定律,只是由于受到其他分子极其频繁而又无法 预测的碰撞,其运动状态瞬息万变,显得杂乱无章,具有很大 的偶然性.但总体而言,在一定条件下,大量分子的热运动却遵从 确定的规律.这种大量偶然事件的总体所显示的规律性称为统计 规律性.显然,统计规律性不适用于少数或个别的分子,从而就 能对与其热运动相关联的宏观现象做出微观解释.
(3)利用压强的定义式
及大量分子热运动的统计
规律,推导出压强公式.
描述理想气体的统计规律
二、 温度的微观本质 1. 温度公式
根据理想气体的压强公式和状态方程,可以得到气 体的温度与分子的平均平动动能之间的关系,从而揭示 温度这一宏观量的微观本质.
将式(6- 2)与理想气体的压强公式
(6- 8)
描述理想气体的统计规律
可见,这个能量很大.
描述理想气体的统计规律
2. 气体分子的方均根速率
根据理想气体分子平均平动动能与温度的关系,可以求 出理想气体分子的方均根速率v2,它是气体分子速率的一种 统计平均值.
描述理想气体的统计规律
上式表明,气体分子的方均根速率与温度的平方根成正比, 与气体摩尔质量的平方根成反比.同一种气体,温度越高,方均根 速率越大;不同气体在同一温度下,分子质量或摩尔质量越大, 方均根速率越小.例如,在0 ℃时,虽然氢分子和氧分子的平均平 动动能相等,均为
描述理想气体的统计规律
利用式(6-8),可以计算出任何温度下理想气体分子的平均平动 动能εk.计算表明,εk一般是很小的.例如,当T=300 K时,εk约为 6.21×10-21J,即使理想气体的温度高达108 K,εk也只有2.07×10- 15J.但因为气体的分子数密度很大,因而气体分子的平均平动动能的 总和还是很大的.例如,当T=300 K,p=1.013×105 Pa时,由式( 12- 2)可得分子数密度为
气体方程与状态方程:气体状态方程与理想气体行为的关系

气体方程与状态方程:气体状态方程与理想气体行为的关系气体方程是描述气体性质的数学方程,而状态方程是用来描述气体在不同压力、温度和体积下的物理状态的方程。
气体状态方程描述的是气体在一定条件下的状态,其中最常用的方程是理想气体状态方程。
理想气体状态方程是描述理想气体性质的方程,也叫做理想气体定律。
它是理想气体行为的一个近似模型,假设气体分子之间不存在吸引力和排斥力,分子之间的碰撞完全弹性,从而使得气体分子运动服从一些简单的物理规律。
理想气体状态方程可以用来描述气体在不同条件下的状态变化,以及计算气体的压强、体积和温度等物理量的关系。
理想气体状态方程的数学形式为 PV = nRT,其中 P 代表气体的压强,V 代表气体的体积,n 为气体的物质量(一般用摩尔表示),R 为气体常数,T 代表气体的绝对温度。
根据这个方程,我们可以推导出其他一些气体性质的关系。
理想气体状态方程的推导基于以下几个假设:气体是由大量非常小的分子组成的,分子之间不断自由运动,彼此之间会发生碰撞;气体分子之间不存在吸引力和排斥力,碰撞是完全弹性的;气体分子的体积可以忽略不计,分子间距较大,相对于有效体积可以忽略不计。
根据这些假设,我们可以推导出理想气体状态方程。
首先考虑一个气体分子,它的动量可以用动能定理表示为FΔt = Δp,其中 F 为分子受到的作用力,Δt 为时间间隔,Δp 为动量的变化量。
由于气体分子之间的碰撞完全弹性,它们在碰撞过程中动量守恒。
考虑一个气体容器,里面有 N 个气体分子,由这些分子所受到的所有碰撞力的总和可以表示为F_total = N Δp / Δt。
这样,我们可以得到理想气体的状态方程为 F_total/A = P =NΔp / ΔtA,其中 A 为气体容器的面积。
根据动能定理,我们有Δp = 2mv,其中 m 为气体分子的质量,v 为分子的速度。
代入这个表达式,我们有P = 2 mv N / ΔtA。
考虑到 N = nNA,其中 n 为气体的物质量(摩尔数),NA 为阿伏伽德罗常数,我们可以得到 P = 2 nmNANA / ΔtA。
气体分子的总平动动能公式

气体分子的总平动动能公式1.理论推导根据经典力学的动能公式,一个物体的动能等于其质量乘以速度的平方的一半。
对于气体分子而言,其动能公式为K = 1/2 mv^2 ,其中K表示平动动能,m表示分子的质量,v表示分子的速度。
考虑到大量气体分子之间的碰撞,根据最小理论,分子速度趋于均匀分布,即符合麦克斯韦尔-波尔兹曼速度分布定律。
因此,气体分子的平动动能公式可以进一步表示为:K=3/2kT其中k表示玻尔兹曼常数,T表示气体的温度。
这个公式表明气体分子的平动动能和温度成正比,并且与分子的质量无关。
2.实验验证实验上,可以通过测量气体热容来验证气体分子的平动动能公式。
按照热力学理论,热容是容器中的气体在温度上升1度时所吸收或释放的热量。
根据理论推导,气体分子的平动动能与温度成正比。
因此,当气体温度升高1度时,其内能增加,从而吸收热量。
通过测量气体的热容,可以计算出气体分子的平动动能与温度之间的关系。
3.应用(1)理解气体的物理性质:气体分子的平动动能公式可以帮助我们理解气体的热力学性质。
例如,当温度升高时,气体分子的平动动能也会增加,导致气体的压强增大。
(2)研究气体扩散和扩散速率:气体分子的平动动能决定了其在空间中的扩散速率。
通过研究气体分子的平动动能公式,可以预测和解释气体在空气中的扩散行为。
(3)研究气体反应动力学:在化学反应中,气体分子的碰撞引起反应的发生。
气体分子的平动动能公式可以帮助我们理解气体反应的速率和动力学过程。
(4)热力学计算:在工程和化学领域,平动动能公式可以用于热力学计算和设计。
例如,在工业生产中,通过控制气体温度和压力,可以调节和优化气体的能量传输和转化。
总结来说,气体分子的平动动能公式是K=3/2kT,其中K表示平动动能,k表示玻尔兹曼常数,T表示气体的温度。
这个公式揭示了气体分子平动动能和温度之间的关系,在理论推导、实验验证和应用等方面都有广泛的应用。
理想气体分子的平均平动动能与温度的关系
§12-4 理想气体分子的平均平动动能 与温度的关系
§12-4
理想气体分子的平均平动动能与温度的关系
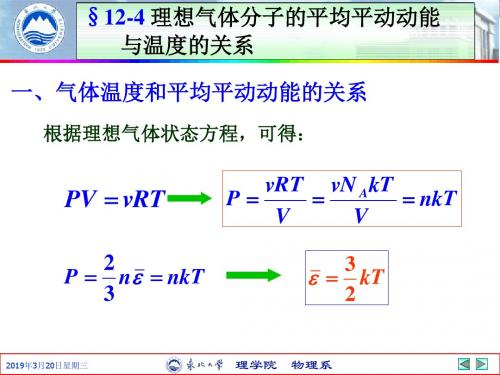
一、气体温度和平均平动动能的关系
根据理想气体状态方程,可得:
PV vRT
2 P n nkT 3
2019年3月20日星期三
vRT vN A kT P nkT V V
3 kT 2
2019年3月20日星期三
理学院 物理系
2019年3月20日星期三
理学院 物理系
大学物理
§12-4
理想气体分子的平均平动动能与温度的关系来自三、气体分子的方均根速率
3 1 2 kT m v 2 2
3kT 3 RT v m
2
00C时气体分子的方均根速率 气体种类 方均根速率(m/s) O2 4.61×102 N2 4.93×102 H2 1.84×103 CO2 3.93×102 H2O 6.15×102
理学院 物理系
大学物理
§12-4
理想气体分子的平均平动动能与温度的关系
3 二、 2 kT
的物理意义
1.平均平动动能只与温度有关。 2.温度具有统计的意义,只能用于大量分子,对单个 分子谈温度是无意义的。 3.当两种气体具有相同的温度时,它们相应的平均平 动动能相等。 若使这两种气相接触,两种气体间将没有宏观的能量 传递,它们各自处于热平衡状态。即温度是表征气体 处于热平衡状态的物理量。这也就是热力学第零定 律的微观解释。
物理学教程(第二版)上册课后答案7

物理学教程(第二版)上册课后答案7第七章 气体动理论7 -1 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们( )(A) 温度,压强均不相同 (B) 温度相同,但氦气压强大于氮气的压强(C) 温度,压强都相同 (D) 温度相同,但氦气压强小于氮气的压强分析与解 理想气体分子的平均平动动能23k /kT =ε,仅与温度有关.因此当氦气和氮气的平均平动动能相同时,温度也相同.又由物态方程nkT p =,当两者分子数密度n 相同时,它们压强也相同.故选(C).7-2 三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,方均根速率之比()()()4:2:1::2/12C 2/12B 2/12A =v v v ,则其压强之比C B A ::p p p 为( )(A) 1∶2∶4 (B) 1∶4∶8(C) 1∶4∶16 (D) 4∶2∶1 分析与解 分子的方均根速率为M RT /3=2v ,因此对同种理想气体有3212C 2B 2A ::::T T T =v v v ,又由物态方程nkT ρ,当三个容器中分子数密度n 相同时,得16:4:1::::321321==T T T p p p .故选(C).7 -3 在一个体积不变的容器中,储有一定量的某种理想气体,温度为0T 时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ ,当气体温度升高为04T 时,气体分子的平均速率v 、平均碰撞频率Z 和平均自由程λ分别为( ) (A)04,4,4λλZ Z ===0v v (B) 0022λλ===,,Z Z 0v v (C) 00422λλ===,,Z Z 0v v (D) 00,2,4λλ===Z Z 0v v 分析与解 理想气体分子的平均速率M RT π/8=v ,温度由0T 升至04T ,则平均速率变为0v 2;又平均碰撞频率v n d Z 2π2=,由于容器体积不变,即分子数密度n 不变,则平均碰撞频率变为0Z 2;而平均自由程n d 2π21=λ,n 不变,则λ也不变.因此正确答案为(B).7 -5 有一个体积为35m 1001⨯.的空气泡由水面下m050.深的湖底处(温度为C 0.4o )升到湖面上来.若湖面的温度为C 017o .,求气泡到达湖面的体积.(取大气压强为Pa 10013150⨯=.p )分析 将气泡看成是一定量的理想气体,它位于湖底和上升至湖面代表两个不同的平衡状态.利用理想气体物态方程即可求解本题.位于湖底时,气泡内的压强可用公式gh pp ρ+=0求出, 其中ρ为水的密度( 常取33m kg 100.1-⋅⨯=ρ).解 设气泡在湖底和湖面的状态参量分别为(p 1 ,V 1 ,T 1 )和(p 2 ,V 2 ,T 2 ).由分析知湖底处压强为gh ρp gh ρp p+=+=021,利用理想气体的物态方程222111T V p T V p =可得空气泡到达湖面的体积为()3510120121212m 1011.6-⨯=+==T p V T gh p T p V T p V ρ 7 -6 一容器内储有氧气,其压强为Pa 100115⨯.,温度为27 ℃,求:(1)气体分子的数密度;(2) 氧气的密度;(3) 分子的平均平动动能;(4) 分子间的平均距离.(设分子间均匀等距排列)分析 在题中压强和温度的条件下,氧气可视为理想气体.因此,可由理想气体的物态方程、密度的定义以及分子的平均平动动能与温度的关系等求解.又因可将分子看成是均匀等距排列的,故每个分子占有的体积为30d V=,由数密度的含意可知n V /10=,d 即可求出.解 (1) 单位体积分子数325m 1044.2⨯==kTp n (2) 氧气的密度3-m kg 30.1/⋅===RTpM V m ρ (3) 氧气分子的平均平动动能J 102162321k -⨯==./kT ε(4) 氧气分子的平均距离m 10453193-⨯==./n d通过对本题的求解,我们可以对通常状态下理想气体的分子数密度、平均平动动能、分子间平均距离等物理量的数量级有所了解.7-7 2.0×10-2 kg 氢气装在4.0×10-3 m 3 的容器内,当容器内的压强为3.90×105Pa 时,氢气分子的平均平动动能为多大?分析 理想气体的温度是由分子的平均平动动能决定的,即23k /kT =ε.因此,根据题中给出的条件,通过物态方程pV =Mm 'RT ,求出容器内氢气的温度即可得kε. 解 由分析知氢气的温度mRMpV T =,则氢气分子的平均平动动能为J 1089.3232322k -⨯='==Rm pVMk kT ε7 -8 某些恒星的温度可达到约1.0 ×108K ,这是发生聚变反应(也称热核反应)所需的温度.通常在此温度下恒星可视为由质子组成.求:(1) 质子的平均动能是多少? (2) 质子的方均根速率为多大?分析 将组成恒星的大量质子视为理想气体,质子可作为质点,其自由度 i =3,因此,质子的平均动能就等于平均平动动能.此外,由平均平动动能与温度的关系2/32/2kT m =v,可得方均根速率2v .解 (1) 由分析可得质子的平均动能为 J 1007.22/32/152k-⨯===kT m v ε (2) 质子的方均根速率为1-62s m 1058.13⋅⨯==mkT v 7 -9 日冕的温度为2.0 ×106K ,所喷出的电子气可视为理想气体.试求其中电子的方均根速率和热运动平均动能.解 方均根速率16e 2s m 105.93-⋅⨯==m kT v 平均动能J 10142317k -⨯==./kT ε7-10 在容积为2.0 ×10-3 m 3 的容器中,有内能为6.75 ×102J 的刚性双原子分子某理想气体.(1)求气体的压强;(2) 设分子总数为5.4×1022个,求分子的平均平动动能及气体的温度.分析 (1) 一定量理想气体的内能RT i M m E 2=,对刚性双原子分子而言,i =5.由上述内能公式和理想气体物态方程pV =νRT 可解出气体的压强.(2)求得压强后,再依据题给数据可求得分子数密度,则由公式p =nkT 可求气体温度.气体分子的平均平动动能可由23k /kT ε=求出.解 (1) 由RT i E 2ν=和pV =νRT 可得气体压强 Pa 1035.125⨯==iVE p (2) 分子数密度n =N/V ,则该气体的温度()()K 1062.3//2⨯===nk pV nk p T 气体分子的平均平动动能为J104972321k -⨯==./kT ε 7 -11 当温度为0C 时,可将气体分子视为刚性分子,求在此温度下:(1)氧分子的平均动能和平均转动动能;(2)kg 100.43-⨯氧气的内能;(3)kg 100.43-⨯氦气的内能.分析 (1)由题意,氧分子为刚性双原子分子,则其共有5个自由度,其中包括3个平动自由度和2个转动自由度.根据能量均分定理,平均平动动能kT 23kt =ε,平均转动动能kT kT ==22kr ε.(2)对一定量理想气体,其内能为RT i M mE 2'=,它是温度的单值函数.其中i 为分子自由度,这里氧气i =5、氦气i =3.而m '为气体质量,M 为气体摩尔质量,其中氧气13mol kg 1032--⋅⨯=M ;氦气13mol kg 100.4--⋅⨯=M .代入数据即可求解它们的内能.解 根据分析当气体温度为T=273 K 时,可得(1)氧分子的平均平动动能为J 107.52321kt -⨯==kT ε 氧分子的平均转动动能为J 108.32221kr -⨯==kT ε (2)氧气的内能为J 10 7.1J 27331.8251032100.42233⨯=⨯⨯⨯⨯⨯='=--RT i M m E (3)氦气的内能为J 10 3.4J 27331.823100.4100.42333⨯=⨯⨯⨯⨯⨯='=--RT i M m E 7 -12 已知质点离开地球引力作用所需的逃逸速率为gr v 2=,其中r 为地球半径.(1) 若使氢气分子和氧气分子的平均速率分别与逃逸速率相等,它们各自应有多高的温度;(2) 说明大气层中为什么氢气比氧气要少.(取r =6.40 ×106 m) 分析 气体分子热运动的平均速率M RTπ8=v ,对于摩尔质量M 不同的气体分子,为使v 等于逃逸速率v ,所需的温度是不同的;如果环境温度相同,则摩尔质量M 较小的就容易达到逃逸速率. 解 (1) 由题意逃逸速率gr 2=v ,而分子热运动的平均速率M RTπ8=v .当v v = 时,有RMrg T 4π= 由于氢气的摩尔质量13H mol kg 10022--⋅⨯=.M,氧气的摩尔质量12O mol kg 10232--⋅⨯=.M ,则它们达到逃逸速率时所需的温度分别为 K10891K,101815O 4H 22⨯=⨯=..T T (2) 根据上述分析,当温度相同时,氢气的平均速率比氧气的要大(约为4倍),因此达到逃逸速率的氢气分子比氧气分子多.按大爆炸理论,宇宙在形成过程中经历了一个极高温过程.在地球形成的初期,虽然温度已大大降低,但温度值还是很高.因而,在气体分子产生过程中就开始有分子逃逸地球,其中氢气分子比氧气分子更易逃逸.另外,虽然目前的大气层温度不可能达到上述计算结果中逃逸速率所需的温度,但由麦克斯韦分子速率分布曲线可知,在任一温度下,总有一些气体分子的运动速率大于逃逸速率.从分布曲线也可知道在相同温度下氢气分子能达到逃逸速率的可能性大于氧气分子.故大气层中氢气比氧气要少.7-13 容积为1 m 3 的容器储有1 mol 氧气,以v =10-1s m ⋅的速度运动,设容器突然停止,其中氧气的80%的机械运动动能转化为气体分子热运动动能.试求气体的温度及压强各升高了多少. 分析 容器作匀速直线运动时,容器内分子除了相对容器作杂乱无章的热运动外,还和容器一起作定向运动.其定向运动动能(即机械能)为221mv .按照题意,当容器突然停止后,80%定向运动动能转为系统的内能.对一定量理想气体内能是温度的单值函数,则有关系式:T R M m v m E Δ25%8021Δ2'=⋅'=成立,从而可求ΔT .再利用理想气体物态方程,可求压强的增量.解 由分析知T R M m m E Δ2528.0Δ2⋅'='=v ,其中m '为容器内氧气质量.又氧气的摩尔质量为12m ol kg 1023--⋅⨯=.M ,解得ΔT =6.16 ×10-2 K当容器体积不变时,由pV =M mRT 得Pa 51.0ΔΔ==T VRM m p7-14 有N 个质量均为m 的同种气体分子,它们的速率分布如图所示.(1) 说明曲线与横坐标所包围的面积的含义;(2) 由N 和0v 求a 值;(3) 求在速率0v /2到30v /2 间隔内的分子数;(4) 求分子的平均平动动能.题 7-14 图分析 处理与气体分子速率分布曲线有关的问题时,关键要理解分布函数()v f 的物理意义.()υd d N Nf =v ,题中纵坐标()v v d /d N Nf =,即处于速率v 附近单位速率区间内的分子数.同时要掌握()v f 的归一化条件,即()1d 0=⎰∞v v f .在此基础上,根据分布函数并运用数学方法(如函数求平均值或极值等),即可求解本题.解 (1) 由于分子所允许的速率在0 到20v 的范围内,由归一化条件可知图中曲线下的面积()N Nf S v ==⎰v v d 020即曲线下面积表示系统分子总数N .(2 ) 从图中可知,在0 到0v 区间内,()0/v v v a Nf =;而在0 到20v 区间,()αNf =v .则利用归一化条件有vv v vv ⎰⎰+=0020d d v v a a N(3) 速率在0v /2到30v /2间隔内的分子数为12/7d d Δ2/3000N a a N =+=⎰⎰v v v v v v v(4) 分子速率平方的平均值按定义为()v v f v v v d /d 0222⎰⎰∞∞==N N故分子的平均平动动能为20220302k 3631d d 212100v v v v v v v v v v m N a N a m m =⎥⎦⎤⎢⎣⎡+==⎰⎰ε 7-15 一飞机在地面时,机舱中的压力计指示为Pa100115⨯.,到高空后压强降为Pa101184⨯..设大气的温度均为27.0℃.问此时飞机距地面的高度为多少?(设空气的摩尔质量为2.89 ×10-2kg·mol -1) 分析 当温度不变时,大气压强随高度的变化主要是因为分子数密度的改变而造成.气体分子在重力场中的分布满足玻耳兹曼分布.利用地球表面附近气压公式()kT mgh p p /ex p 0-=,即可求得飞机的高度h .式中p 0 是地面的大气压强. 解 飞机高度为()()m 1093.1/ln /ln 300⨯===p p MgRT p p mg kT h7 -16 目前实验室获得的极限真空约为1.33×10-11Pa ,这与距地球表面1.0×104km 处的压强大致相等.而电视机显像管的真空度为1.33×10-3Pa ,试求在27 ℃时这两种不同压强下单位体积中的分子数及分子的平均自由程.(设气体分子的有效直径d =3.0×10-8cm)解 理想气体分子数密度和平均自由程分别为n =k T p ;pd kT λ2π2=,压强为1.33×10-11Pa 时,-39m 1021.3/⨯==kT p nm 108.7π282⨯==pd kT λ 从λ的值可见分子几乎不发生碰撞.压强为1.33×10-3Pa 时,3-17m 1021.3⨯==kT p n ,m 8.7π22==pd kT λ此时分子的平均自由程变小,碰撞概率变大.但相对显像管的尺寸而言,碰撞仍很少发生. 7-17 在标准状况下,1 cm 3中有多少个氮分子?氮分子的平均速率为多大?平均碰撞次数为多少?平均自由程为多大?(已知氮分子的有效直径m 1076.310-⨯=d )分析 标准状况即为压强Pa 10013.15⨯=p ,温度K 273=T .则由理想气体物态方程nkT p =可求得气体分子数密度n ,即单位体积中氮分子的个数.而氮气分子的平均速率、平均碰撞次数和平均自由程可分别由公式MRTv π8=,n v d Z 2π2=和nd 2π21=λ直接求出.解 由分析可知,氮分子的分子数密度为325m 1069.2-⨯==kTpn 即3cm 1中约有191069.2⨯个.氮气的摩尔质量为M =28 ×10-3kg·mol -1,其平均速率为MRTv π8==454 1s m -⋅则平均碰撞次数为-192s 107.7π2⨯==n v d Z平均自由程为m 106π2182-⨯==nd λ 讨论 本题主要是对有关数量级有一个具体概念.在通常情况下,气体分子平均以每秒几百米的速率运动着,那么气体中进行的一切实际过程如扩散过程、热传导过程等好像都应在瞬间完成,而实际过程都进行得比较慢,这是因为分子间每秒钟上亿次的碰撞导致分子的自由程只有几十纳米,因此宏观上任何实际过程的完成都需要一段时间.7-18 在一定的压强下,温度为20℃时,氩气和氮气分子的平均自由程分别为9.9×10-8m 和27.5×10-8m.试求:(1) 氩气和氮气分子的有效直径之比;(2) 当温度不变且压强为原值的一半时,氮气分子的平均自由程和平均碰撞频率. 分析 ( 1 ) 气体分子热运动的平均自由程()p d kT nd 22π2/π21==λ,因此,温度、压强一定时,平均自由程2/1d λ∝.(2) 当温度不变时,平均自由程p λ/1∝.解 (1) 由分析可知67.1//r 22r A N N A ==λλd d(2) 由分析可知氮气分子的平均自由程在压强降为原值的一半时,有m 105.527N N22-⨯=='λλ而此时的分子平均碰撞频率22222N N N N N 2π/8λM RT λZ ='=v将T =293K ,M N2 =2.8×10-2kg·mol -1代入,可得-18N s 1056.82⨯=Z。
12-4 平均动能和温度的关系

12-3 理想气体的温度公式(The Temperature of An Ideal Gas)
热运动与宏观运动的区别:
温度所反映的是分子的无规则运动,它和物 体的整体运动无关,物体的整体运动是其中 所有分子的一种有规则运动的表现.
3
第十二章 气体动理学
12-3 理想气体的温度公式(The Temperature of An Ideal Gas)
(D)温度相同,但氦气的压强小于氮气的压强.
p nkT
m( N 2 ) m(He)
k T m
p( N 2 ) p(He)
12-3-2 一个具有活塞的容器中盛有一定量的气体。如果压缩 气体并对它加热,使它的温度从27 0 C升到177 0 C,体积减小 一半,问:(1)气体压强变化了多少? 这时气体分子的平均 (2) 平动动能变化了多少?3)分子的方均根速率变化多少? (
vrms
3kT 1.22 v T2 m v2 2
2
v12
T1
气体 氢 氮 摩尔质量
(103 kg / mol )
方均根速率 vrms / (m / s) 1920 517 645
(H2 )
2.02 28.0 18.0
( N2 )
水蒸汽 ( H 2O)
二氧化硫 ( SO2 )
44.0
412
原子质量单位—1.66 10-27 kg 单个分子的质量m 原子量(相对原子质量)1.66 10-27 kg
摩尔质量M N A m 6.02 1023 1.66 1027 原子量 =原子量 10-3
第十二章 气体动理学
12-3-1一瓶氦气和一瓶氮气密度相同,分子平均平动动能 相同,而且它们都处于平衡状态,则它们
理想气体分子平均平动动能与温度的关系

(2)M m 一 N A 32 10”6.02 1023-5.31 10 kg 四、理想气体分子平均平动动能与温度的关系 (可以用一个公式加以概括)1 ~ 3;k = mv kT 2 2 1 -2 3所以:-mv 2 = 3 kT2 2 这就是理想气体分子的平均平动动能与温度的关系,是气体动理论的另一个基本公式。
它表明分子的平均平动动能与气体的温度成正比。
气体的温度越高,分子的平均平动动能越 大;分子的平均平动动能越大, 分子热运动的程度越剧烈。
因此,温度是表征大量分子热运 动剧烈程度的宏观物理量,是大量分子热运动的集体表现。
对个别分子,说它有多少温度, 是没有意义的。
从这个式子中我们可以看出2.温度的统计意义该公式把宏观量温度和微观量的统计平均值(分子的平均平动动能)联系起来,从而揭示了温度的微观本质。
关于温度的几点说明 ,1 — 3^ _ 1 — 一一 亠1•由一mv kT 得T =0, ; = — mv 0 ,气体分子的热运动将停止。
然而事实上是绝2 2 2对零度是不可到达的(热力学第三定律),因而分子的运动是用不停息的。
2.气体分子的平均平动动能是非常小的。
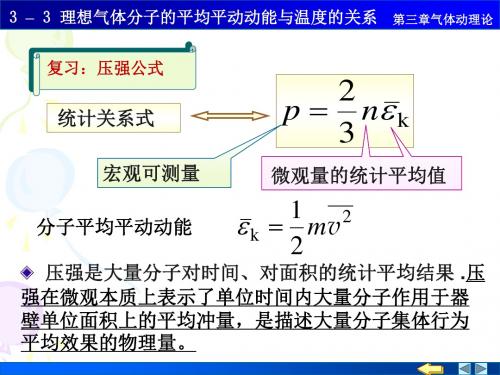
T =300K, .;. =10 ② JT =108K,I =10 45J 5例1. 一容器内贮有氧气,压强为 P=1.013 X 10 Pa ,温度t=27 C ,求(1 )单位体积内的分 子数;(2)氧分子的质量;(3)分子的平均平动动能。
解:(1 )有 P=nkT2.45 10 m kT 1.38 10寰 27 273 1.简单推导:理想气体的物态方程: PV RT NmN A E RT而 p ,n ^m/丄 mV 2 3 12 丿 3V 12 丿 n=N/V 为单位体积内的分子数,即分子数密度,k =RN A =1.38 X 10-23J K-1称为玻尔斯曼常量。
关键:1) 把m 与M 用单个分子的 质量表示; 2) 引入分子数密度; 3) 引入Boltzmann 常量1.013 1053 3 23 21(3)「尹 r 1.38 10一(27 273) =6.21 1°一J例2.利用理想气体的温度公式说明Dalton分压定律。
大学物理 部分公式

1.理想气体物态方程:pV=NkT 变形1:Pv=νRT (R=N A k)变形2:P=nkT (n=N/V为分子数密度)2.理想气体压强公式:P=(1/3)nmv^2 变形:P=2/3nεk (εk分子平均平动动能)3理想气体平均平动动能与温度关系:1/2mv^2=εk=3/2kT4方均根速率: Vrms=(3kT/m)^(1/2)= (3Rt/M)^(1/2)5自由度:单i=3 双刚=5 双非=7 三以上刚=6 ε =i1/2kT6理想气体内能:E=N A i1/2kT =i/2RT7三种统计速率:1)最概然速率V p=(2kT/m)^(1/2)= (2RT/M)^(1/2) 2)平均速率v =(8kT/πm)^(1/2) 3)4 8分子平均碰撞次数:Z,分子连续两次碰撞间的路程均值叫做平均自由程λλ=v/ Z Z =1.41πd ^2 vn 9准静态过程中体积变化做功:ΔW=PΔV=(Sv1v2)pdV10.摩尔定体热容:C v,m=dQ/dT dE=:C v,m* dT11热机效率:η=W/Q1 =(Q1-Q2)/Q1 =1-Q1/Q2 (Q1为吸热量 Q2为热源吸收量)12等体过程中V为常量,即dW=0 dQ=dE 吸收热量全部转化为内能13转动定理:M=Jα常见转动惯量1)中心轴细棒:ml^2 /12 2)圆柱体:mR^2 / 2 3)薄圆环J=mR24)端点轴细棒:J=ml2/14平行轴定理:J=J C+md215电容器电能:W=1/2 QU=1/2 CU216 电场能量密度:w=1/2εΕ217.磁场能量:W=1/2 LI2 密度w=W/V=B2/2μ19.毕奥撒法尔定律:dB=(μ0/4π)*(Idlsinθ/r^2)= (μ0/4π)*(Idl e r/r^2)20.运动电荷磁场:B=(μ0/4π)*(qvr/r^3)21.无限长直导线B=μ0I/2πr022.库伦定律 F=(1/4πε0)(q1q2/r^2)e r23圆形载流导线轴线上一点 B=(μ0/2)(R2I/(R2+x2)3/2) x>>R B=μ0IR2/2x3A-B 等温膨胀内能不变对外做功W1=从T1高温处吸热Q1W1=Q1=vRTT1ln(V2/V1)B-C 绝热膨胀对外做功等于气体减少的内能W2=vCv,m(T1-T2)C-D 等温压缩:外界对气体做功等于气体给低温热源的热量W3=Q2= vRTT2ln(V4/V3)。
(完整版)大学物理学(课后答案)第7章

第七章课后习题解答一、选择题7-1 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们[ ](A) 温度,压强均不相同 (B) 温度相同,但氦气压强大于氮气的压强 (C) 温度,压强都相同 (D) 温度相同,但氦气压强小于氮气的压强分析:理想气体分子的平均平动动能32k kT ε=,仅与温度有关,因此当氦气和氮气的平均平动动能相同时,温度也相同。
又由理想气体的压强公式p nkT =,当两者分子数密度相同时,它们压强也相同。
故选(C )。
7-2 理想气体处于平衡状态,设温度为T ,气体分子的自由度为i ,则每个气体分子所具有的[ ](A) 动能为2i kT (B) 动能为2iRT(C) 平均动能为2i kT (D) 平均平动动能为2iRT分析:由理想气体分子的的平均平动动能32k kT ε=和理想气体分子的的平均动能2ikT ε=,故选择(C )。
7-3 三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,而方均根速率之比为()()()1/21/21/222::2A B Cv v v =1:2:4,则其压强之比为A B C p :p :p[ ](A) 1:2:4 (B) 1:4:8 (C) 1:4:16 (D) 4:2:1=,又由物态方程p nkT =,所以当三容器中得分子数密度相同时,得123123::::1:4:16p p p T T T ==。
故选择(C )。
7-4 图7-4中两条曲线分别表示在相同温度下氧气和氢气分子的速率分布曲线。
如果()2p O v 和()2p H v 分别表示氧气和氢气的最概然速率,则[ ](A) 图中a 表示氧气分子的速率分布曲线且()()22p p O H /4v v =(B) 图中a 表示氧气分子的速率分布曲线且()()22p p O H /1/4v v =(C) 图中b 表示氧气分子的速率分布曲线且()()22p p O H /1/4v v =(D) 图中b 表示氧气分子的速率分布曲线且()()22p p O H /4v v =分析:在温度相同的情况下,由最概然速率公式p ν=质量22H O M M <,可知氢气的最概然速率大于氧气的最概然速率,故曲线a 对应于氧分子的速率分布曲线。
大学物理第二十三讲 气体温度 压强 能均分 内能

(i t r )
(t 3, r 0, i 3) (t 3, r 2, i 5) (t 3, r 3, i 6)
16
5 刚性双原子分子: k kT 2 6 刚性多原子分子: k kT 2
三、理想气体的热力学能(内能)
气体内能—气体分子各种形式的动能、原子间振动 势能、分子间的相互作势能之总和。
p p p
p nkT n n
kT n kT n kT
9
p p p
例:容器内有温度27C、压强为0.01mmHg的一定量 理想气体。问容器内1cm3中有多少个气体分子?这些 分子平动动能之总和为多少? 解: p 0.010mmHg 1.33Pa, T 300K
实际气体—非刚性,还有原子间振动的自由度。
13
二、能量按自由度均分定理
1 ___ 3 2 平均平动动能 t m v kT 2 2 1 ___ v v v v2 3 ___ __ 1 ___ 1 1 1 1 2 1 2 2 2 m v x m v y m v z ( mv ) kT 2 2 2 3 2 2 1 tx ty tz kT 2
3 2 t kT , p n t 2 3
p nkT 理想气体状态方程
8
道尔顿分压定律 ◎混合气体的压强等于同一平衡态下各组分气体单 独存在时的压强之和,即 证明: 混合气体各组分处于热平衡,因而温度相同。 各分压强 p n kT , p n kT , 混合气体分子数密度 n n n
决定其空间位置需要三个独立坐标 (x, y, z),有三个自由度。
y
o z
大学物理学(课后答案)第7章

第七章课后习题解答一、选择题7-1 处于平衡状态的一瓶氦气和一瓶氮气的分子数密度相同,分子的平均平动动能也相同,则它们[ ](A) 温度,压强均不相同 (B) 温度相同,但氦气压强大于氮气的压强 (C) 温度,压强都相同 (D) 温度相同,但氦气压强小于氮气的压强分析:理想气体分子的平均平动动能32k kT ε=,仅与温度有关,因此当氦气和氮气的平均平动动能相同时,温度也相同。
又由理想气体的压强公式p nkT =,当两者分子数密度相同时,它们压强也相同。
故选(C )。
7-2 理想气体处于平衡状态,设温度为T ,气体分子的自由度为i ,则每个气体分子所具有的[ ](A) 动能为2i kT (B) 动能为2iRT(C) 平均动能为2i kT (D) 平均平动动能为2iRT分析:由理想气体分子的的平均平动动能32k kT ε=和理想气体分子的的平均动能2ikT ε=,故选择(C )。
7-3 三个容器A 、B 、C 中装有同种理想气体,其分子数密度n 相同,而方均根速率之比为()()()1/21/21/222::2A B Cv v v =1:2:4,则其压强之比为A B C p :p :p[ ](A) 1:2:4 (B) 1:4:8 (C) 1:4:16 (D) 4:2:1=,又由物态方程p nkT =,所以当三容器中得分子数密度相同时,得123123::::1:4:16p p p T T T ==。
故选择(C )。
7-4 图7-4中两条曲线分别表示在相同温度下氧气和氢气分子的速率分布曲线。
如果()2p O v 和()2p H v 分别表示氧气和氢气的最概然速率,则[ ](A) 图中a 表示氧气分子的速率分布曲线且()()22p p O H /4v v =(B) 图中a 表示氧气分子的速率分布曲线且()()22p p O H /1/4v v =(C) 图中b 表示氧气分子的速率分布曲线且()()22p p O H /1/4v v =(D) 图中b 表示氧气分子的速率分布曲线且()()22p p O H /4v v =分析:在温度相同的情况下,由最概然速率公式p ν=质量22H O M M <,可知氢气的最概然速率大于氧气的最概然速率,故曲线a 对应于氧分子的速率分布曲线。
12-4理想气体分子的平均平动动能与温度的关系讲解

则 pV NkT 或 p nkT
温度的微观本质
p
nkT 与压强公式
P
2 3
n k
比较
得
k
1 2
v2
3 2
kT
处于平衡态的理想气体,分子的平均平 动动能与气体的温度成正比。
例1 计算标准状态下,任何气体在1cm3体积中 含有的分子数 。
1 2 3
若各种气体的分子数密度分别为 n1,n2,n3,…
则混合气体的分子数密度为
n=n1+n2+n3+…
将n代入 p 2n / 3 ,得
p
2 3
n
2 3
(n1
n2
n3
)
p
2 3
n11
2 3
n2 2
2 3
n3 3
即 p p1 p2 p3
—— 道尔顿分压定律。
其中
p1
2 3
n11,
p2
2 3
n2 2 ,
p3
2 3
n3 3 ,
例3 有一容积为 10 cm3 的电子管,当温度为
300 K时用真空泵抽成高真空,使管内压强为 5×10-6 mmHg。求 (1) 此时管内气体分子的
数目; (2) 这些分子的总平动动能。
解 (1) 由理想气体状态方程得
N
pV kT
5106 133.3105 1.381023 300
12.4 温度的微观本质
一、理想气体温度与分子平均平动动能的关系
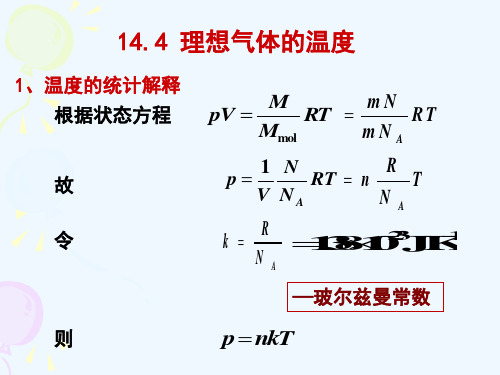
理想气体分子的平均平动动能为
1 v2 1 3kT
2
2
3 kT
2
大学物理(热学知识点总结)

7、bca为理想气体绝热过程,b1a和b2a是任意过程,则上述两 过程中气体作功与吸收热量的情况是: A) b1a过程放热,作负功;b2a过程放热,作负功. B) b1a过程吸热,作负功;b2a过程放热,作负功. C)b1a过程吸热,作正功;b2a过程吸热,作负功. D) b1a过程放热,作正功;b2a过程吸热,作正功.
[1]、有一定量的理想气体,从初状态 a (P1 、V1 )开始, 经过一个等容过程达到压强为P1 / 4 的 b 态,再经过一个等 压过程达到状态C ,最后经过等温过程而完成一个循环, 求:该循环过程中系统对外作的功A 和所吸收的热量Q。 解:由已知可得: a( P 1 ,V1 )
循环过程
E 0 Q A V V1 1) a b A 0 2) b c A p1 (4V1 V1 ) / 4 3 p1V1 / 4 3) c a A p1V1 ln( V1 / 4V1 ) p1V1 ln4
p (105 Pa) 3 2 1 O A 1 2 C V (103 m3) B
解:(1) A→B:
A1
ΔE1= CV (TB-TA)=3(pBVB-pAVA) /2=750 J Q=A1+ΔE1=950 J. B→C: A2 =0 ΔE2 = CV (TC-TB)=3( PCVC-PBVB ) /2 =-600 J. Q2 =A2 +ΔE2 =-600 J. C→A: A3 = PA (VA-VC)=-100 J.
解( : 1) 等 容 过 程 , A 0, 外 界 对 气 体 作 功 A 0 M i Q E CV T RT M mol 2 0.02 3 8.31 ( 300 290 ) 623 ( J ). 0.004 2 (2)等压过程, E 与 ( 1) 同 。
大学物理:理想气体的温度
1 2 3 t m v k T 2 2
v
2
3 kT m
3RT M m ol
在相同温度下,由两种不同分子组成的混合气 体,它们的方均根速率与其质量的平方根成反比。
1 1 2 2 mv mv 1 1 2 2 2 2
v 12 v 22
m2 m1
3 t kT 2
宏观可测量量
微观量的统计平均值
理想气体分子的平均平动动能与温度成正比。 或者说: 温度 T 是分子平均平动动能的量度。 温度是大量分子集体运动的宏观表现,它反 映了大量分子集体运动的剧烈程度。
注意:
①温度公式反映了宏观量T 与微观量 t 之间的关系 T ∝ t 与气体性质无关; ②温度是大量分子无规则运动的集体表现, 单个分子的温度无意义。 ③温度平衡过程就是能量平衡过程。
例 理想气体体积为 V ,压强为 p ,温度为 T , 一个分子 的质量为 m ,k 为玻尔兹曼常量,R 为摩 尔气体常量,则该理想气体的分子数为:
(A)
pV m
(B) pV( kT ) (D)pV( m T )
(C) pV (RT )
解:
p nkT
pV N nV kT
2、方均根速率 由
讨论
一瓶氦气和一瓶氮气密度相同,分子平均平动动 能相同,而且它们都处于平衡状态,则它们 (A)温度相同、压强相同。
(B)温度、压强都不同。 (C)温度相同,但氦气的压强大于氮气的压强。 (D)温度相同,但氦气的压强小于氮气的压强。
N k 解: p nkT kT T V m p ( N ) p ( He ) m ( N ) m ( He ) 2 2
14.4 理想气体的温度
高二物理竞赛理想气体的温度和分子平均平动动能课件

(1) 理想气体的内能只取决于分子运动的自由度 如质点被限制在平面或曲面上运动,则 i= 2;
试证:室温由 T1 升高到 T2,房间内气体的内能不变。
i
和热力
学温度T,或者说理想气体的内能只是温度T的单值函数, 如静止于地面的物体,相对于地面,它的机械能(包括动能和重力势能)等于零;
实验和理论证明,分子速率分布函数 f (v) 的具体形式依赖于系统的性质和宏观条件。
1、 理想气体的温度和分子平均平动动能
由
p
nkT
2 3
n t
t
3 2
kT
平均平动动能只与温度有关
理想气体温标或热力学温标
说明了温度的微观意义,即热力学温度是分子平均平动动 能的量度,气体的温度越高,分子的平均平动动能就越大; 分子的平均平动动能越大,分子热运动的程度越激烈。因 此, 可以说温度反映了物体内部分子无规运动的剧烈程度。
设总分子数N,其中速率分布在v ~ v+dv速率区间内的分
子数 dNv
速率分布函数
则
dNv = f (v) dv
N
速率 在v 附近的单位速率区间内的分子数占总分子数的百 分比。
用“概率”来解释
dNv
一个分子的速率在 v 附近 dv 区间内的概率
N
f (v)
一个分子的速率在 v 附近单位速率区间内的概率
单原子分子 经典励志短句(二)
不要志气高大,倒要俯就卑微的人。不要自以为聪明。
刚性双原子分子 刚性双多原子分子
与其当一辈子乌鸦,莫如当一次鹰。
k
3 kT 2
k
5 kT 2
k 3kT
理想气体的内能
气体的内能是指它的内动能,即它所包含的所有分子的动 能(相对于质心参考系)和分子间的相互作用势能的总和。
7-4理想气体分子的平均平动动能与温度的关系

8
p = nkT
物理学 教程
7-4 理想气体分子平均平动动能与温度的关系 理想气体分子平均平动动能与温度的关系
3 一容器内储有氧气,温度为 oC,其 一容器内储有氧气,温度为27 压强为1.02×105Pa,求: (1)气体分子数密 压强为 , ) 度 ; (2)氧气的密度 (3)分子的平均平动 )氧气的密度; ) 动能; 动能 (4)分子间的平均距离. )分子间的平均距离. 解 (1) n = p / kT = 2.44×1025 m−3
M = mN A ,
m ′ = mN
m′ N R ∴ pV = RT ⇒ p = T M V NA
理想气体状态方程可改写为: 理想气体状态方程可改写为: 其中: 其中:
p = nkT
n= N V
N A = 6.02 × 10 23 mol −1
玻尔兹曼常数
k=
R = 1.3806513 × 10 − 23 J ⋅ K −1 NA
2 p = nε k 3
( 平均平动动能只与温度有关)
2 2 2 ∴ p = n1 ε k + n2 ε k + K + nn ε k 3 3 3 p = p1 + p 2 + K + p n 于是有
这就是说, 总压强等于各气体分压强之和, 这就是说, 总压强等于各气体分压强之和,这就 是道尔顿分压定律。 是道尔顿分压定律。
6
物理学 教程
7-4 理想气体分子平均平动动能与温度的关系 理想气体分子平均平动动能与温度的关系
讨论
1 一瓶氦气和一瓶氮气密度相同,分子平均 一瓶氦气和一瓶氮气密度相同, 平动动能相同,而且都处于平衡状态, 平动动能相同,而且都处于平衡状态,则: (A)温度相同、压强相同 )温度相同、压强相同. (B)温度、压强都不同 )温度、压强都不同. (C)温度相同,氦气压强大于氮气压强 )温度相同,氦气压强大于氮气压强. (D)温度相同,氦气压强小于氮气压强 )温度相同,氦气压强小于氮气压强. N k 解 p = nkT = kT = ρ T V m
热力学理想气体的温度和分子速率

热力学理想气体的温度和分子速率热力学是研究物质在各种条件下热现象的科学。
而热力学理想气体则是理论模型中被广泛研究的对象。
在热力学理想气体中,温度和分子速率是两个重要的参数,它们之间存在着一定的关系。
本文将探讨热力学理想气体的温度与分子速率之间的关系。
1. 热力学理想气体的基本概念热力学理想气体是一个理想化的气体模型,假设气体分子之间没有相互作用,分子体积可以忽略不计。
这个模型简化了实际气体系统的复杂性,使得研究变得更加简便。
2. 温度的定义与热力学理想气体温度是一个描述物体热运动程度的物理量。
在热力学理想气体中,温度与分子的平均动能有关。
根据理想气体状态方程PV=nRT,其中P 为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的绝对温度。
从这个方程中可以看出,温度与分子的运动速率有关。
3. 分子速率的统计分布与温度热力学理想气体中,分子速率的分布符合麦克斯韦速率分布定律。
该定律表明,温度越高,分子速率分布图形越平缓,且高速分子占的比例越高;温度越低,分子速率分布图形越陡峭,且低速分子占的比例越高。
这是因为温度高时,气体内分子的动能更大,速率更高;而温度低时,分子动能较小,速率较低。
4. 温度与分子速率的关系根据麦克斯韦速率分布定律,可以推导出温度与分子速率之间的关系。
在热力学理想气体中,分子速率的平均值与温度成正比。
即温度升高,分子速率的平均值也随之增加;温度降低,分子速率的平均值也相应减小。
同时,温度还与分子速率的分布范围和峰值位置有关。
5. 热力学理想气体的温度测量在实际应用中,我们常常需要测量热力学理想气体的温度。
常见的温度测量方式有气压温标法和热力学温标法。
气压温标法利用气体的压强与温度之间的关系进行测量;热力学温标法则是利用两个系统之间的热平衡状态进行测量。
6. 应用和意义热力学理想气体的温度与分子速率的关系在许多领域中具有广泛的应用和意义。
例如在化学反应中,理解温度与分子速率的关系能够帮助我们理解反应速率与反应条件之间的联系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微观量的统计平均值
宏观可测量量
温度 T 的物理意义
1 2 3 k m v kT 2 2
1) 温度是分子平均平动动能的量度 (反映热运动的剧烈程度).
k T
2)温度是大量分子的集体表现,个别分子无意义. 3)在同一温度下,各种气体分子平均平动动能均 相等。 热运动与宏观运动的区别:温度所反 注意 映的是分子的无规则运动,它和物体的整 体运动无关,物体的整体运动是其中所有 分子的一种有规则运动的表现.
2 m' Nm 理想气体压强公式 p n k 3 M NAm m' 理想气体状态方程 pV RT M n N /V N pV RT p nkT NA
玻尔兹曼常数 分子平均平动动能
R k 1.38 1023 J K 1 NA
1 3 2 k m v kT 2 T , 一个分子 的质量为 m ,k 为玻尔兹曼常量,R 为摩 尔气体常量,则该理想气体的分子数为:
(A)
pV m
(B) pV (D)pV
(kT )
(m T )
(C) pV
( RT )
解
p nkT
pV N nV kT
讨论
一瓶氦气和一瓶氮气密度相同,分子平均平动动 能相同,而且它们都处于平衡状态,则它们 (A)温度相同、压强相同。
(B)温度、压强都不同。 (C)温度相同,但氦气的压强大于氮气的压强. (D)温度相同,但氦气的压强小于氮气的压强.
N k 解 p nkT kT T V m p( N 2 ) p(He) m( N 2 ) m(He)
