Chapter9 醇和醚
chap09醇和醚(3)

邻基参与机理的解释
CH3 H H CH3 Br OH H Br H H CH3 CH3 Br OH2 H3C OH2 H a Br H H3C Br Br CH3 a H b Br b H3C H H Br CH3 Br H3C H H H CH3 CH3 Br Br CH3 H H Br
Br作为亲核试剂
快
CH3迁移
O
CH3 HO HO CH3 H+ H2O HO
CH3 OH2 H3C H3C
慢
环重排
CH3
O
重排有利因素: 迁移基团与离去 基团处于反式
说明机理中消 除和迁移可能 是同步的
通过Pinacol重排合成螺环化合物
O Mg(Hg)
2
H+ OH OH O
O
Mg(Hg)
H OH OH
+
2
•分析:中性、碱性条件下
R Nu
O
R'
SN2 Nu R + O R'
难进行
差离去基
•分析:弱酸性条件下
H+ R O R' Nu R O H R'
难进行
Nu R + HO R'
(亲核能力弱及浓度稀时)
可离去,离去 能力比H2O差
醚键可被 HI 和 HBr 在加热下断裂
HX R O R' R X + HO R'
氧有碱性, 可与酸结合
较好的 离去基
1. 醚的自氧化(a氢的氧化)
H R' C H O R (空气) O2 R' H C OOH O R
提示:醚类试剂(乙醚、THF等)久置使用时要当心
化学第九章醇和醚

伯醇 CH3(CH2)3-OH ZnCl2-HCl CH3(CH2)3-Cl + H2O
20oC,1h不反应
由于生成的R-X不溶于水,使体系变浑浊 ,很易观察,用 于各类醇的定性鉴定。
反应机理
大多数1oROH均按SN2机理进行反应。 3oROH 、大多数2oROH和空阻大的 1oROH 按SN1机理进行反应。
一 物理性质
醇分子之间能形成氢键,沸点较相应分子量的烷烃高。 由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。 随着碳原子数的增大氢键减弱,沸点向相应的烷烃靠近;在 水中的溶解性也下降,甚至不溶,高级脂肪醇是表面活性剂。 由于醇分子间能形成氢键,固态缔合较为牢固。液态形成氢 键和氢键的解离均存在。气态或在非极性溶剂的稀溶液中, 醇分子可以单独存在。
1 醇与硝酸、亚硝酸的反应
CH3OH + HONO2 CH3OH + HONO
H+
CH3ONO2 + H2O 硝酸甲酯
CH3ONO + H2O 亚硝酸甲酯
CH3CH2CH2OH CH2=CH-CH2OH Ph-CH2OH
根据分子中含羟基的数目分为一元醇、二元醇和多 元醇。如:
CH3CH2OH
CH2-CH2 OH OH
CH2-CH-CH2 OH OH OH
一个碳原子上有两个或两个以上羟基就不稳定, 容易分子内脱水形成羰基。
3、醇的异构和命名
醇的异构主要来自碳链的异构和羟基位置的异构。 醇的系统命名如下: (1)选取含羟基的最长碳链为主链,按主链碳原子 数命名为“某”醇。 (2)从靠近羟基的一端开始编号,在“醇”之前标 出羟基的位次,羟基在末端时“1”字可以省略。
(1)与甲醛合成增加一个碳的伯醇
有机化学-第九章

9.3 酚的结构分类以及化学性质
苯酚是最简单且最重要的酚。酚有芳香性, 具有较高的热力学稳定性。
苯酚
9.3 酚的结构分类以及化学性质
苯酚主要的性质可表示如下:
由于酚环上的电子密度高,所以酚比芳烃和 醇都容易发生氧化反应。
9.3 酚的结构分类以及化学性质
二、酚的分类
按芳环的结构可分为常见的苯酚和萘酚两大类。 按芳环上连有的羟基的数目,又可分为一元酚和 多元酚。
9.3 酚的结构分类以及化学性质
苯酚是很弱的酸,其水溶液不能使石蕊试纸变色。 由于苯酚的酸性小于醋酸(pKa=4.76)和碳酸 (pKa=6.35),所以向苯酚盐的水溶液中通入 CO2 或加入醋酸时,可将苯酚游离。根据此反应可以分 离、提纯酚。
9.3 酚的结构分类以及化学性质
二、酚与FeCl3的显色反应
9.2 醇的化学性质
一、醇分子间脱水--生成醚
醇分子间脱水生成醚的反应是 SN 反应机理。制备单醚时, 一般以伯醇为宜;这时的脱水可以认为是 SN2 机理,如正 丁醚的合成:
9.2 醇的化学性质
二、醇分子内脱水--生成烯烃
醇分子内脱水生成烯烃的反应是一个消除反应。一般来说, 仲醇和叔醇是按 E1 机理进行;这一推论被下面的实验事 实所支持:
9.2
醇的化学性质
本章重点
9.2 醇的化学性质
醇的酸性与碱性
一、醇的弱酸性
醇分子中存在 H-O 极性键,其电离平衡中可以产生质子 和烃氧基负离子:
9.2 醇的化学性质
在醇的酸性电离平衡中,所形成的烃氧基负离子的溶剂化 作用越好,则它的热力学稳定性越高,相对应的醇的pKa 值就越小,即酸性较强。
9.4 醚的结构分类以及化学性质
醇和醚的介绍

丁、汞化-脱汞
trans-2-methylcyclopentanol
丁、 羟汞化-脱汞反应
RCH
O 羟汞化
CH2 + H2O + Hg (OCCH3)2
RCH
OH
O CH2 O + CH3COH Hg -OCCH3
RCH CH2 + OH + NaBH4 OH Hg -OCCH3 O
脱汞
O
RCH CH2 + Hg + CH3CO
4、 醛、酮、羧酸和酯的还原
CHO H2
Pd C
CHO H2, 压力
Pd C
① LiAlH4,乙醚 ② H+,H2O
CH2OH
CH2OH
① LiAlH4,乙醚
(CH3)3CCOOH ② H+,H2O
(CH3)3CCH2OH
H5C2OOC(CH2)8COOC2H5 Na,C2H5OH HOCCH2(CH2)8CH2OH
5-甲基二环[2.2.1]-2-庚烯-7-醇
5-methylbicyclo[2.2.1]-2-hepten-7-ol
二、醇的结构
H 0.1095nm C
H
109°
O 0.096nm
H
0.143nm
H
醇可以给出质子,也可以接受质子,是Bronsted 酸碱
醇可以给出电子,也是Lewis碱
三、 醇的制备:
第二节 醚( )
一. 醚的命名( ) 二. 醚的制备( ) 三. 醚的化学性质( ) 四. 环氧化合物的性质 ( )
Do you know alcohol?
If you drink 5 mL of methanol, you will be blinded!
有机化学第九章醇、酚、醚习题答案
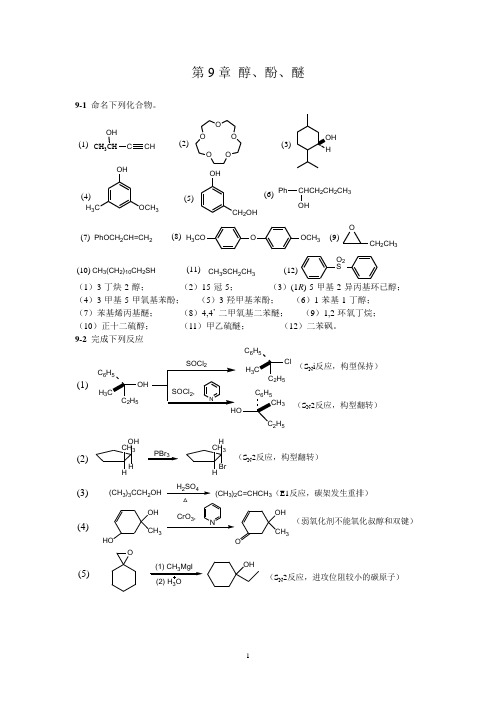
第9章 醇、酚、醚9-1 命名下列化合物。
CH 3CHOHCCHO OO OO OHH 3COCH 3OHCH 2OHPhCHCH 2CH 2CH 3OHPhOCH 2CH=CH 2OOCH 3H 3COOCH 2CH 3CH 3(CH 2)10CH 2SHCH 3SCH 2CH 3O 2S(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(1)3-丁炔-2-醇; (2)15-冠-5; (3)(1R )-5-甲基-2-异丙基环已醇; (4)3-甲基-5-甲氧基苯酚; (5)3-羟甲基苯酚; (6)1-苯基-1-丁醇; (7)苯基烯丙基醚; (8)4,4’-二甲氧基二苯醚; (9)1,2-环氧丁烷; (10)正十二硫醇; (11)甲乙硫醚; (12)二苯砜。
9-2 完成下列反应(1)25H 3C 6H525H 3C 6H 52H 53(S N i 反应,构型保持)(S N 2反应,构型翻转)HOH CH 3H PBr 3HH CH 3Br(S N 2反应,构型翻转)(CH 3)3CCH 2OHH 2SO 4CrO 3,(CH 3)2C=CHCH 3(E1反应,碳架发生重排)HOOH CH 3NOOHCH 3(弱氧化剂不能氧化叔醇和双键)O3OH(S N 2反应,进攻位阻较小的碳原子)(2)(3)(4)(5)HOH HCO 3H H 2O / H(6)OHH HOHOHH +(中间产物为环氧化物,亲核试剂进攻两碳原子的几率相等)CH 3AlCl 3(8)OH+CCH 3OOHCO CH 3(Fries 重排,热力学控制产物)(7)OH OHOOO (频哪醇重排)(邻二醇氧化)(2) ClCH 2Ch 2Cl 2(10)O CH 2CH=CHCH 2CH 3OH(1) NaOH (9)OHOHOO (亲核取代反应)H 3CCH 3*OHH 3C3CH 2CH=CHCH 2CH 3*(发生两次Claisen 重排)OH OHC +(Reimer-Tiemann 反应)(11)C 2H 5SH(13)CH 3CH 2CHCH 2CH 3(15)CH 3Br +(12)OCH 3+CH 3CH 2CHCH 2CH 3OH+(S N 2反应)OHOBrHBr(S N 1反应)(CH 3)2CHCH 2CH 2CH 2Br+OH(CH 3)2CHCH 2CH 2CH 2SVH 2CH 3(S N 2反应)OH HClH H OH H OHOHHOHH (1) OH (2) H 2O(14)9-3 将下列各组组化合物按酸性由强至弱排列成序。
有机化学Chapter醇和醚

X-
RX
1。醇:SN 2
差的离去基团 好的离去基团
R-OH H+ R-O+H2 -H2O R+ X- RX
正碳离子
3。、2。醇:SN 1
醇与HX反应时,常伴有重排现象
CH3 CH3-C-CH 2OH
HBr
CH3
CH3
CH3-C-CH2CH3 + CH3-C-CH2Br
CH3
Br
CH3
(主要产物) (次要产物)
R
R
R
H-O H-O H-O H-O H-O
思考:乙二醇和甘油的沸点高低?
答案: 乙二醇 197℃ 丙三醇 290 ℃
② 溶解度:
醇在水中有一定的溶解度。C3以下醇与水混溶, C4以上随C数↑,溶解度↓。
原因:
a. 醇与水可形成分子间氢键:
R
H
R
H
R
H-O H-O H-O H-O H-O
b. 随C数↑,R在ROH中比例↑,而R一般是疏水的。
H2
CC2l3HC5COHH2O+HNa>OCHlCH2CH2OHC2>HC5OHN3CaH+2HC2HO2OH
碱性 碱性:ROH + H
ROH2 钅羊离子
低级醇能与氯化钙形成络合物—结晶醇(CaCl2·4C2H5OH)
不能用氯化钙干燥醇 可用氯化钙去除少量杂质醇
2、与无机酸的作用
醇与酸失水生成酯。
较低温度
CH3CCHH22OOH-H+ 浓H2SO4 CHO H + 3HO-N
140oC
O
170oC
CH2O-H
O
CH3CHC2HO2COHN2OCH2 3 CH2=CCHH2 ONO 2 + 3H2O
有机化学第9章醇 酚 醚优秀课件

醇、酚、醚都是重要的有机含氧化合物,都可以看作 是水分子中的氢被烃基取代的衍生物。
H-O-H
R-OH Ar-OH
R-O-R Ar-O-R Ar-O-Ar
醇 酚
醚
§ 9.1 醇的分类、结构、命名和物理性质
烃基所连的饱和 碳原子的种类
伯醇 仲醇 叔醇
烃基的饱和程度
饱和醇
醇
不饱和醇
当醇的碳链增长时,羟基在整个分子中的影响减弱,在水中的溶 解度也就降低,以至于不溶于水。相反的,当醇中的羟基增多时, 分子中和水相似的部分增加,同时能和水分子形成氢键的部位也 增加了,因此二元醇的水溶性要比一元醇大。甘油富有吸湿性, 故纯甘油不能直接用来滋润皮肤,一定要掺一些水,不然它要从 皮肤中吸取水分,使人感到刺痛。
如:
F3CCH2OH H2O CH3CH2OH
pKa 12.2 pKa 15.7 pKa 15.9
醇中羟基上的氢较活泼,能被金属所取代,生成氢气和醇金属盐,醇 能和Na,Mg,Al等反应。
醇的酸性比水弱,活泼金属与醇的反应不如水剧烈,不同类型醇的活 性顺序为:伯醇>仲醇>叔醇。
醇钠是强碱,有机合成上常用作强碱和亲核试剂。
ห้องสมุดไป่ตู้
2. 取代反应
2.1 与氢卤酸反应
卤代烃的制备: ROH + HX → RX + H2O
H
H
H
O
C
H
H
C-H 109.5pm
H
H C-O 143pm
O-H 96pm
∠COH 108.9°
∠HCH 109°
H
∠HCO 110°
甲醇的偶极矩为1.7D,与水的偶极矩(1.8D)相近
课件有机化学第9章 醇酚醚

第九章醇酚醚
Alcohols,Phenols
and Ethers
2
醇的分类、结构、命名和物理性质醇的制备和来源醇的化学性质
酚的结构、命名、来源和物理性质(自学)CONTENT
1234酚的化学性质醚
56
1) 普通命名
中文:将相应烷烃名称中的烷→醇
CH3CH2CH2CH2OH(CH3)2CHCH2OH(CH3)3C OH 正丁醇异丁醇叔丁醇
8
9.2 醇的制备和来源
•由烯烃制备——水合,硼氢化-氧化•由羰基化合物制备——Grignard 反应,与炔化物反应,还原
•由卤代烃水解
强酸
9.4 酚的结构、命名、来源
和物理性质(自学)
•分类:根据分子中羟基的数目分为一元酚,二元酚和多元酚
•命名:一般以苯酚为母体命名
•物理性质:具有特殊气味,能形成分子间氢键,沸点较高,水中有一定溶解度。
有机化学醇和醚

* 同分异构 由于烃基的异构和官能团位置的
不同,可引起同分异构现象,另外相 同碳原子的醇和醚也互为构造异构体 ,这种异构体是属于官能团不同的构 造异构体。
2024/6/22
二、 醚的制法 * 醇分子间脱水(详见醇的性质)
此法适合于制取单醚 * 卤烷与醇金属作用(威廉森合成) ● 这是一个双分子亲核取代反应,叫做威廉森 合成法,可用于合成单醚或混醚,但主要用来 合成混醚。
2024/6/22
2024/6/22
* 醇的分类 ● 按羟基所连的碳原子类型: 伯醇(1°醇)
仲醇(2°醇) 叔醇(3°醇)
● 按羟基所连的烃基不同:饱和醇 不饱和醇 芳醇
● 按羟基数目: 一元醇 二元醇 多元醇
2024/6/22
* 异构和命名 ● 异构:醇的构造异构包括碳链异和官能团位
置异构。
2024/6/22
甘油三硝酸酯是一种炸药;磷酸三丁酯用 作萃取剂和增塑剂。
2024/6/22
* 氧化和脱氢(α—H的氧化)
叔醇无α—H,一般氧化剂不能氧化,上述反应 氧化剂可为KMnO4 + H2O、K2Cr2O7 + H2SO4。
由于伯、仲、叔醇氧化后所生成的产物不同,因 此根据氧化产物的结构,可以区别它们。
2024/6/22
* 化学性质 醚的化学性质比较不活泼,在常温下不与
金属钠发生作用,对碱、氧化剂和还原剂都十 分稳定,但能发生下列反应:
● 盐的生成 醚 R-O-R 的氧原子上有未共用电子对,它是
一个路易斯碱,在常温时能溶于强酸,形成 盐, 但醚的碱性很弱,所以生成的 盐遇水很快分解为 原来的醚。此反应可用于醚的提纯和分离。
2024/6/22
2024/6/22
有机化学第9章醇、酚、醚

RO–H + Na
C2H5ONa + 1/2 H2↑
说明醇的酸性比水弱, pKa(即 – ㏒ Ka)值: 醇 > 水
(∵ –R是给电子基团)
而RO–的碱性比OH–强. 因此醇钠遇水立即水解:
C2H5ONa + H2O
C2H5OH + NaOH
:
2. 酯化反应 (属于亲核取代反应)
醇与酸(无机酸和有机酸)之间脱水生成的产物 称为 酯.
R OR + NaX
醇钠
伯卤代烃
混合醚
5. 氧化和脱氢反应
• 常般用将的 伯氧 醇化直试接剂氧:化K为M羧nO酸4溶(很液难或停K留2C在r醛2O的7酸阶性段溶):液, 一
H
O
O
RCH–OH
RC–H
RC–OH
• 仲醇可被上述氧[O化] 剂氧化为酮[O(]酮不易继续被氧化):
OH
O
• R–CH–R′
只适用于碳数不多、结构简单的醇. (例子见书)
② 系统命名法:
命名原则(见书): 选主链、主链的编号
例: CH3CHCH2CHCH3
•不饱和醇的命名:
CH3 OH
4–甲基–2–戊醇
根据其不饱和键称为 某烯醇或某炔醇.
• 例: CH3CH=CHCH2OH 2–丁烯醇 (羟基位置为1时可省略) 多元醇的命名: CH3CHCH2CHCH3
R–C–R′
叔醇强醇的一氧般化不条被件上, 如[O述]与氧酸化性剂K所M氧nO化4溶(∵液无一α–起H加). 热但,如可果使用叔更
• 氧化断链, 生成小分子氧化产物. (反应式见书, 了解) 采氧用化特 停殊 留氧 在化醛剂的阶Cr段O:3–吡啶的CH2Cl2溶液, 可使伯醇的
第9章 醇酚醚

通常-OH与不饱和C相连不稳定,重排为羰基化合
物 C=C-OH
CH-C=O
同一碳上连2个或2个以上-OH时不稳定,自行脱水
成羰基化合物。
R-CH
O-H -H2O O-H
O
R-C-H 醛
==
RR'C
OH OH
-H2O
O R-C-R' 酮
=
=
O-H R-C OH -H2O
O
R-C-OH 羧酸
OH
O Cl3C-C-H+H2O
叔醇 CH3C-HCCC3-HH-O33CCCH-HHO33H
O H
OH R
OH R
不饱和醇 CH2=CHCH2OH
OH
C H- O H C 6H 5
H O C H 2 C H 2 O H H O C H 2 C H O H C H 2 O H ( H O C H 2 ) 4 C
第二节 醇的结构
醇分子中,C是SP3杂化,O是不等性SP3杂 化;C-O键和O-H键均为极性共键价;化学性质
三氯乙醛
Cl OH Cl-C- C-H
Cl OH
水合三氯乙醛
烯丙型醇和苯甲醇具有特殊的化学性质。
R - C H 2 = C H - C H 2 O H
C H 2 - O H
脂肪醇 脂环醇 芳香醇
伯醇 C H 3 C H 2 C H 2 C H 2 O H C H 2 O H C H 2 O H
仲醇 C H 3C H 2 CH - O H C H 3
取决于官能团-OH。
H
:
:
H
C
.
O
H sp3 H
HH 108.9° HCOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H H
C H
C
O
取 代 反 应
H
脱 水 反 应
二 醇羟基中氢的反应
亲核试剂 碱性试剂 2C2H5ONa + H2
1 2C2H5OH + 2Na
C2H5OH + NaOH
C2H5ONa +H2O 苯乙醇水 =74.118.57.4(64.9)
2 2(CH3)3COH + 2K
1 醇和氢卤酸的反应
反应式 ROH + HX 醇的活性比较: 苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH > CH3OH HX的活性比较: HI > HBr > HCl RX + H2O
反应机理
大多数1oROH均按SN2机理进行反应。
CH3CHCH2CH2CH3 + HBr
OH
4 与氯化亚砜的反应
(1) 反应方程式
ROH + SOCl2
b.p. 79oC
RCl + SO2 + HCl
该反应的特点是: 反应条件温和,反 应速率快,产率高, 没有副产物。
(2) 反应机理 (请同学完成并讨论)
醇制卤代烃的方法选择
1oROH
2oROH 3oROH 浓HCl (0oC)
SOCl2
1oROH 脱氢得醛。 2oROH脱氢得酮。 3oROH不发生脱氢反应。 Pd Cu (orAg)
小分子酸,酮 环醇 酮 、酸
酸性条件
醇各类氧化反应的总结-2
氧化剂 新制MnO2 沙瑞特试剂 CrO3吡啶 一级醇 烯丙位 苯甲位 一级醇 醛 二级醇 三级醇 醛 二级醇 酮 酮 酮 酮 特点和说明 中性 不饱和键不受影响
}
弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂
CrO3+稀H2SO4 费慈纳-莫发特试剂
H2O2 或 Ag + 空气 也能氧化 1oROH
2oROH。
CH 2OH CH 2OH
Ag , 空气 300oC
CHO CHO
CH 2OH CHOH CH 2OH
CHO
H2 O2 Fe3+
CHOH COH CH2OH
CH 2OH C=O CH 2OH
CHOH CH 2OH
甘油醛
二羟基丙酮
六 脱氢反应 总 述
+ C O P Br Br H CH 3
SN2
BrCH2CH3 + HO P Br
Br
2oROH , 3oROH (SN1)
H3C CH3 + Br- + C O P Br Br H CH3
Br (CH3)3C OH + Br P Br
SN2
SN1
(CH3)3C+ + HOPBr2
Br -
(CH3)3CBr
CH2–O –NO2
甘油三硝酸酯 (硝化甘油)
CH2–O –NO2
CH2–O –NO2
乙二醇二硝酸酯
2 磷酸酯的制备
3C4H9OH +
Cl Cl Cl P=O
C4H9O C4H9O C4H9O
P=O
+ 3HCl
O
CH2OH CHOH CH2OH + HO
O P OH OH
CH2O CHOH CH2OH
CH3CHCH2CH2CH3 + CH3CH2CHCH2CH3
Br Br
2o
2o, 氢重排
86%
14%
(CH3)2CHCH2OH + HBr
(CH3)2CHCH2Br + ( CH3)3CBr
80% 20%
1o
3o, 氢重排
(CH3)2CCH2CH3
(CH3)3CCH2OH + HBr
100%
Br
1o
P OH
OH
O
Ca++
甘油磷酸酯
CH 2O CHOH CH 2OH
P O
O Ca
甘油磷酸钙
3 硫酸酯、硫酸氢酯的制备和应用
2 HOSO2OH (硫酸) 2 CH3OH + 2 ClSO2OH(氯磺酸) 2 SO3(三氧化硫)
减压蒸餾 CH3OSO2OCH3 -H2SO4 C2H5OH NaOH
2 CH3OSO2OH
O
R2CHOH + CH3CCH3 反应方向的控制
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH
R2CH=O + CH 3CHCH 3
欧芬脑尔氧化法: 丙酮大大过量。 麦尔外因-彭道夫还原:异丙醇大大过量。一边反应,一边将丙酮蒸出。
特点:反应只在醇和酮之间发生H原子的转移,不涉及分子其它部分。 注意事项:对碱不稳定的化合物不能用此法。
2(CH3)3COK + H2
强碱性试剂 亲核性相对弱一些
3 2C2H5OH + Mg
(C2H5O)2Mg + H2 乙醇镁
(C2H5O)2Mg + H2O
2C2H5OH + MgO
乙醇镁可用来除去乙醇中的少量水,以制备无水乙醇
这两个反应在同一体系中完成。
4
6(CH3)2CHOH + 2Al
HgCl2 or AlCl3
在液相中,溶 剂化作用会对 醇的酸性强弱 产生影响。
溶剂化作用使 负电荷分散, 而使RO-稳定。
O H H R H C O H O H H H O H
CH 3 C CH 3
CH 3 O H O H
1oROH负离子空 阻小,溶剂化作 用大。
3oROH负离子空阻 大,溶剂化作用小。
三
碳氧键的断裂,羟基被卤原子取代
RCH=C-OH R'
三级醇(叔醇)
烯醇
R C R'
RCH
二 元 醇 三 元 醇
HOCH2CH2OH
乙二醇
OH OH
OH OH
-H2O
R R'
C O
-H2O
RCHO
HOCH2CHCH2OH 丙三醇(甘油) OH
OH R C OH OH
-H2O
RCOOH
第二节 醇的命名 一 衍生物命名法(看作甲醇的衍生物)
CH3 (CH3)2CHCHOH
甲基异丙基甲醇
二 普通命名法(烷基的习惯名称+醇)
CH3
(CH3)2CHOH
CH3CH2CHOH
异丙醇
二级丁醇
三 系统命名法(命名原则参见第一章)
几个实例
CH3CH=CHCH2CH2OH
CH3CHCH 2CH2CH2CHO OH
3-戊烯-1-醇
(CH3)3CCH2CH2CHCH3 OH
醛(产率不高, 不用。)
醛(产率很高)
稀酸,反应条件温和, 不饱和键不受影响。
酸性 (H3PO4) , 其它基团不受影响。 碱性,可逆,分子 内双键不受影响。
二环己基碳二亚 胺二甲亚砜
{
丙酮、甲乙酮等 醛(会发生醇醛缩 (欧芬脑尔氧化) 合付反应,不用。)
酮
费慈纳-莫发特试剂氧化的简单说明
Dicyclohexyl Carbodiimide
(2)反应方程式
3ROH + PBr3 5ROH + PX5 3RBr + H3PO4 RX + HX + POX3
(3)适用范围
主要应用于1oROH, 2oROH 转化为卤代烷。3oROH很少使用。
(4)反应机理
1oROH (SN2)
H H
Br CH3CH2 OH + Br P Br
SN2
Br- +
H CH 3
Br
+
Br
Br H CH 3
H
Br
H
CH 3
H CH 3
2. 经醇与磺酰氯反应为中间阶段来制卤代烃
(1)磺酰氯的制备
CH3 SO2OH + PCl5
CH3
SO2Cl + POCl 3 + HCl
对甲苯磺酸(TSOH)
对甲苯磺酰氯(TSCl)
(2)磺酰氯的应用
H C CH3CH2CH2 D OH
4 一般地说,相邻两个碳上最大的两个基团处 于对交叉最稳定,但当这两个基团可能以氢 键缔合时,则这两个基团处于邻交叉成为优 势构象。
第四节 醇的物理性质、光谱特征 一 物理性质
醇分子之间能形成氢键。
固态,缔合较为牢固。液态,形成氢键和氢键的解离 均存在。气态或在非极性溶剂的稀溶液中,醇分子可以单 独存在。 由于醇分子之间能形成氢键,沸点较相应分子量的烷 烃高。
H+
O RCR + HCOOH
R2C=CH2
氧化反应一般都是在溶剂中进行的。
醇各类氧化反应的总结-1
氧化剂 KMnO4 冷,稀,中性, 酸性,碱性 K2Cr2O7
40~50%H2SO4
一级醇
二级醇
三级醇
特点和说明
酸 醛 酸
酮 酮
小分子酸,酮 小分子酸,酮 酸性条件
稀 HNO3 浓
醛
酸
酸 环醇
酮 环酮
5-羟基己醛 5,5-二甲基-2-己醇
CH2OH HOCH2CH2CHCH2CH2CH2CH2OH
Cl OH COOH
3-羟甲基-1,7-庚二醇
3-羟基-4-氯环己甲酸
第三节 醇的结构特点
1 大部分醇的羟基与sp3杂化的碳原子相连。烯 醇中的羟基与sp2杂化的碳原子相连。 2 根据甲醇分子的键长、键角分析,醇羟基中 的氧是sp3杂化。 3 醇的偶极矩在2D左右。甲醇的偶极矩为 u=1.71D。
