成华区第一高级中学2018-2019学年高二上学期第一次月考试卷化学
2018-2019学年高二上学期第一次月考化学试题(附参考答案)

2018-2019学年度高二化学第一次月考卷一:单项选择题(每小题3分,共60分)1、下列有关化学用语的说法正确的是( )A. 氯原子的结构示意图:B. 中子数为8、质子数为6的碳原子:68CC. 1H与2H互称同位素D. 230Th和232Th的化学性质不相同2、四种短周期元素在周期表中的位置如右图,其中Y元素原子电子层数等于最外层电子数。
下列说法不正确的是()A. Z位于元素周期表中第三周期、第IVA族B. Y 的最高价氧化物不能和X 的简单氢化物反应C. M的非金属性比Z的弱D. 原子半径比较: X<M3、短周期主族元素X、Y、Z、W的原子序数依次增大。
X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构。
下列说法正确的是( )A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)B. X的最高价氧化物对应水化物的酸性比W的弱C. Y分别与Z、W形成的化合物中化学键类型相同D. W的气态简单氢化物的热稳定性比Y的强4、下面有关离子化合物的说法正确的是( )A.离子化合物中一定含有金属元素,含金属元素的化合物一定是离子化合物B.离子键只存在于离子化合物中,离子化合物中一定含有离子键C.离子化合物中不可能含有共价键D.离子化合物受热熔化破坏化学键,吸收热量,属于化学变化5、下列各组物质中,化学键类型不同的是()A. NaCl和K2SB. H2O和NH3C. CaF2和CsClD. CCl4和Na2O6、下列关于下图装置的说法中,正确的是()A. 该装置能将电能转化为化学能B. 铜棒上发生还原反应C. 该装置工作时溶液中SO42-向正极移动D. 正极反应为Zn-2 e-= Zn2+7、下图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是()A. 该金属腐蚀过程为析氢腐蚀B. 正极为C,发生的反应为氧化反应C. 在酸性条件下发生的是吸氧腐蚀D. 正极反应为:O2 + 2H2O + 4e →4OH8、在一定条件下,可逆反应:N2(g)+3H2(g)2NH3(g) △H<0,增加N2的浓度,平衡常数将()A. 增大B. 不变C. 减少D. 无法判断9、LiFePO4电池广泛用于电动车。
高二化学上学期第一次月考试题 人教 版(1)

2019学年度上学期月考考试化学学科考试说明:1.考试时间为90分钟,满分100分,选择题涂卡。
2.考试完毕交答题卡。
第Ⅰ卷(50分)一、选择题(本题包括25个小题,每小题只有一个正确选项,每小题2分,共50分)1.下列物质属于弱电解质的是A.二氧化碳B.水C.氢氧化钙D.碳酸氢钠2.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是A.加催化剂B.降温C.加压D.加大反应物浓度3.下列说法正确的是A.熵增大的反应一定可自发进行B.熵减小的反应一定可自发进行C.ΔH<0的反应可能自发进行D.ΔH>0的反应不可能自发进行4.反应2SO 2(g)+O2(g)2SO3(g),改变条件,该化学反应速率和化学平衡常数都变化的是A. 增大压强B. 升高温度C. 使用催化剂D. 多充O25.室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是A. 0.1 mol/L的盐酸15mLB. 0.15 mol/L的硫酸溶液8mLC. 0.4 mol/L的硝酸12mLD. 18 mol/L的浓硫酸15mL6.在0.1mol/L的CH 3COOH溶液中存在如下电离平衡CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是A.加入少量NaOH固体,平衡向正反应方向移动B.加水,反应速率增大,平衡向逆反应方向移动C.滴加少量0.1mol/L HCl溶液,溶液中C(H+)减少D.加入少量CH3COONa固体,溶液的pH不变7.下列事实,不能用勒夏特列原理解释的是A. 氨水中加酸,NH4+的浓度增大B. 合成氨工业中不断从反应混合物中液化分离出氨气C. 实验室中常用排饱和食盐水的方法收集Cl2D. 合成氨控制在500 ℃左右的温度8.下列有关实验操作或测量数据的说法正确的是A.用托盘天平称量食盐的质量为12.35克B.用碱式滴定管量取高锰酸钾溶液20.00mLC.用pH 试纸测量次氯酸钠溶液的pH为11.5D.中和热的测定实验中,NaOH溶液应该稍过量9.一定条件下(恒温、恒容的密闭容器中)合成氨反应处于化学平衡状态的是A. υ(N2生成)=3υ(H2消耗)B. H2、H2、HN3的分子数之比为1:3:2C. 单位时间内生成2molNH3,同时消耗1molH2D. 容器内的压强不再变化10.反应2A(g)⇌2B(g)+C(g);△H>0,达平衡时,要使v正降低、c(A)增大,应采取的措施是A.加压B.减压C.减小A的浓度D.降温11.将固体X置于密闭容器中,在一定温度下发生下列反应:①X(s)Y(g) +Z(g);②2Z(g) W(g)+G(g)。
成都市成华区2018-2019学年上学期期末质量检测化学试卷

成都市成华区2018-2019学年上学期期末质量检测化学试卷注意事项:1.本试卷分为第Ⅰ卷(选择题)第Ⅱ卷(非选择题)两部分。
全卷满分100分,考试时间60分钟。
2.请将答案写在答题卷的指定位置,答案书写时不能越界。
3.可能用到的相对原子质量:C—12 O—16 Cu—64第Ⅰ卷(选择题共36分)一、选择题(本题包括12小题,每小题3分,共36分。
每小题仅有一个选项符合题意)1.下列变化过程中属于化学变化的是A. 食物腐烂B. 干冰升华C. 分离空气制氧气D. 稀有气体通电后发光2.为了延缓食品变质,包装时不会采用A.充入氧气B.充入氮气C.真空包装D.放入一小包铁粉3.图是表示气体分子的示意图,图中“●”和“○”分别表示质子数不同的两种原子,其中表示化合物的是A.B.C.D.4.下列实验操作正确的是A.点燃酒精灯B.闻气体的气味C.检查气密性D.加热试管中的液体5.在氧气中燃烧,产生明亮的蓝紫色火焰,且有刺激性气味的气体产生的是A.木炭B.硫C.红磷D.铁丝6.防毒面具的滤毒罐中用来吸附毒气的物质是A.炭黑B.石墨C.金刚石D.活性炭7.鉴别下列物品方法不正确...的是A.酒和醋──闻气味B.软水和硬水──肥皂水C.N2和CO2──燃着的木条D.空气和氧气──带火星的木条8.砷化镓(GaAs)是一种“LED”绿色节能光源材料,镓元素的相关信息如图。
下列有关镓的说法正确的是A.属于非金属元素B.原子的核内质子数是31C.原子的核内中子数是31 D.1个镓原子的质量为69.72g9.下列关于水的净化说法正确的是A.过滤可以除去天然水中所有杂质B.沉淀可以使硬水软化为软水C.蒸馏可以使自来水转化为纯净水D.吸附是水的净化程度最高的方法10.下列有关化学用语说法正确的是A.氧化铝AlO B.两个氢原子H2C.两个铁离子2Fe2+D.钙离子Ca2+11.下列事故处理不恰当的是A.电器因短路起火时,用水浇灭B.酒精灯不慎打翻起火,用湿抹布扑盖C.炒菜时油锅着火,立即盖上锅盖D.用液态二氧化碳灭火器扑灭图书档案等火灾12.对下列现象的微观解释中错误的是A.非吸烟者受到被动吸烟的危害,是因为分子在不断地运动B.氧气加压后变成液氧,是因为分子间的间隔变小C.不同的花儿有不同的香味,是因为不同的分子性质不同D.变瘪的乒乓球放入热水中能鼓起来,是因为受热后分子会膨胀变大13.有关碳和碳的化合物描述错误的是A.干冰常用于人工降雨B.活性炭有较强的吸附性,常用于工业制白糖时脱色C.金刚石和石墨组成元素相同,物理性质和化学性质相似D.室内放一盆水不能防止一氧化碳中毒14.如图所示实验中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.下列能说明CO2密度大于空气且能与水反应的现象是A.①变红,③不变红B.④变红,③不变红C.①、④变红,②、③不变红D.④比①先变红,②、③不变红第II卷(非选择题共58分)二、(完成下列各题,本题包括1个小题,共9分)15.(9分)Ⅰ、结合我们学过的化学知识选择填空。
城区第一中学校2018-2019学年高二上学期第一次月考试卷化学
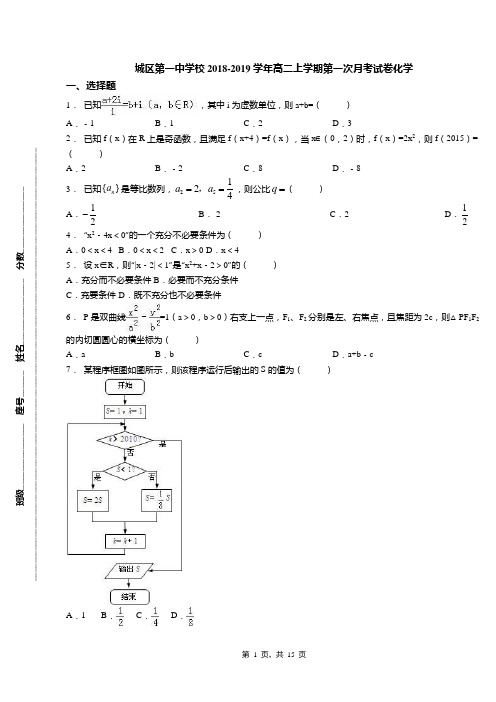
城区第一中学校2018-2019学年高二上学期第一次月考试卷化学一、选择题1.已知,其中i 为虚数单位,则a+b=( )A .﹣1B .1C .2D .3 2. 已知f (x )在R 上是奇函数,且满足f (x+4)=f (x ),当x ∈(0,2)时,f (x )=2x 2,则f (2015)=( ) A .2B .﹣2C .8D .﹣83. 已知{}n a 是等比数列,25124a a ==,,则公比q =( ) A .12-B .-2C .2D .124. “x 2﹣4x <0”的一个充分不必要条件为( ) A .0<x <4 B .0<x <2 C .x >0 D .x <45. 设x ∈R ,则“|x ﹣2|<1”是“x 2+x ﹣2>0”的( ) A .充分而不必要条件 B .必要而不充分条件 C .充要条件 D .既不充分也不必要条件 6. P是双曲线=1(a >0,b >0)右支上一点,F 1、F 2分别是左、右焦点,且焦距为2c ,则△PF 1F 2的内切圆圆心的横坐标为( )A .aB .bC .cD .a+b ﹣c7. 某程序框图如图所示,则该程序运行后输出的S 的值为( )A .1 B. C. D.班级_______________ 座号______ 姓名_______________ 分数__________________________________________________________________________________________________________________8. 有下列说法:①在残差图中,残差点比较均匀地落在水平的带状区域内,说明选用的模型比较合适.②相关指数R 2来刻画回归的效果,R 2值越小,说明模型的拟合效果越好.③比较两个模型的拟合效果,可以比较残差平方和的大小,残差平方和越小的模型,拟合效果越好.其中正确命题的个数是( ) A .0 B .1C .2D .39. 下列命题中正确的是( )A .若命题p 为真命题,命题q 为假命题,则命题“p ∧q ”为真命题B .命题“若xy=0,则x=0”的否命题为:“若xy=0,则x ≠0”C .“”是“”的充分不必要条件D .命题“∀x ∈R ,2x >0”的否定是“”10.已知双曲线(a >0,b >0)的右焦点F ,直线x=与其渐近线交于A ,B 两点,且△ABF 为钝角三角形,则双曲线离心率的取值范围是( )A .B .C .D .11.若命题p :∃x ∈R ,x ﹣2>0,命题q :∀x ∈R ,<x ,则下列说法正确的是( )A .命题p ∨q 是假命题B .命题p ∧(¬q )是真命题C .命题p ∧q 是真命题D .命题p ∨(¬q )是假命题12.已知A={﹣4,2a ﹣1,a 2},B={a ﹣5,1﹣a ,9},且A ∩B={9},则a 的值是( )A .a=3B .a=﹣3C .a=±3D .a=5或a=±3二、填空题13.已知x 是400和1600的等差中项,则x= .14.函数2()2(1)2f x x a x =+-+在区间(,4]-∞上递减,则实数的取值范围是 .15.已知函数f (x )=,g (x )=lnx ,则函数y=f (x )﹣g (x )的零点个数为 .16.如图,是一回形图,其回形通道的宽和OB 1的长均为1,回形线与射线OA 交于A 1,A 2,A 3,…,若从点O 到点A 3的回形线为第1圈(长为7),从点A 3到点A 2的回形线为第2圈,从点A 2到点A 3的回形线为第3圈…依此类推,第8圈的长为 .17.已知||2=a ,||1=b ,2-a 与13b 的夹角为3π,则|2|+=a b . 18.设全集U={0,1,2,3,4},集合A={0,1,2},集合B={2,3},则(∁U A )∪B= .三、解答题19.某城市100户居民的月平均用电量(单位:度),以[)160,180,[)180,200,[)200,220,[)220,240,[)240,260,[)260,280,[]280,300分组的频率分布直方图如图.(1)求直方图中的值;(2)求月平均用电量的众数和中位数.1111]20.已知正项等差{a n },lga 1,lga 2,lga 4成等差数列,又b n =(1)求证{b n }为等比数列.(2)若{b n }前3项的和等于,求{a n }的首项a 1和公差d .21.中国高铁的某个通讯器材中配置有9个相同的元件,各自独立工作,每个元件正常工作的概率为p (0<p <1),若通讯器械中有超过一半的元件正常工作,则通讯器械正常工作,通讯器械正常工作的概率为通讯器械的有效率(Ⅰ)设通讯器械上正常工作的元件个数为X ,求X 的数学期望,并求该通讯器械正常工作的概率P ′(列代数式表示)(Ⅱ)现为改善通讯器械的性能,拟增加2个元件,试分析这样操作能否提高通讯器械的有效率.22.如图,四棱锥P ABC -中,,//,3,PA BC 4PA ABCD AD BC AB AD AC ⊥=====,M 为线段AD 上一点,2,AM MD N =为PC 的中点.(1)证明://MN 平面PAB ;(2)求直线AN 与平面PMN 所成角的正弦值;23.已知函数f (x )=ax 2+bx+c ,满足f (1)=﹣,且3a >2c >2b . (1)求证:a >0时,的取值范围;(2)证明函数f (x )在区间(0,2)内至少有一个零点; (3)设x 1,x 2是函数f (x )的两个零点,求|x 1﹣x 2|的取值范围.24.已知函数,(其中常数m >0)(1)当m=2时,求f (x )的极大值;(2)试讨论f(x)在区间(0,1)上的单调性;(3)当m∈[3,+∞)时,曲线y=f(x)上总存在相异两点P(x1,f(x1))、Q(x2,f(x2)),使得曲线y=f(x)在点P、Q处的切线互相平行,求x1+x2的取值范围.城区第一中学校2018-2019学年高二上学期第一次月考试卷化学(参考答案)一、选择题1. 【答案】B【解析】解:由得a+2i=bi ﹣1,所以由复数相等的意义知a=﹣1,b=2,所以a+b=1另解:由得﹣ai+2=b+i (a ,b ∈R ),则﹣a=1,b=2,a+b=1.故选B .【点评】本题考查复数相等的意义、复数的基本运算,是基础题.2. 【答案】B 【解析】解:∵f (x+4)=f (x ), ∴f (2015)=f (504×4﹣1)=f (﹣1), 又∵f (x )在R 上是奇函数, ∴f (﹣1)=﹣f (1)=﹣2.故选B .【点评】本题考查了函数的奇偶性与周期性的应用,属于基础题.3. 【答案】D 【解析】试题分析:∵在等比数列}{a n 中,41,2a 52==a ,21,81q 253=∴==∴q a a . 考点:等比数列的性质.4. 【答案】B【解析】解:不等式x 2﹣4x <0整理,得x (x ﹣4)<0 ∴不等式的解集为A={x|0<x <4},因此,不等式x 2﹣4x <0成立的一个充分不必要条件,对应的x 范围应该是集合A 的真子集.写出一个使不等式x 2﹣4x <0成立的充分不必要条件可以是:0<x <2,故选:B .5. 【答案】A【解析】解:由“|x ﹣2|<1”得1<x <3,由x 2+x ﹣2>0得x >1或x <﹣2,即“|x ﹣2|<1”是“x 2+x ﹣2>0”的充分不必要条件,故选:A .6. 【答案】A【解析】解:如图设切点分别为M,N,Q,则△PF1F2的内切圆的圆心的横坐标与Q横坐标相同.由双曲线的定义,PF1﹣PF2=2a.由圆的切线性质PF1﹣PF2=F I M﹣F2N=F1Q﹣F2Q=2a,∵F1Q+F2Q=F1F2=2c,∴F2Q=c﹣a,OQ=a,Q横坐标为a.故选A.【点评】本题巧妙地借助于圆的切线的性质,强调了双曲线的定义.7.【答案】C【解析】解:第一次循环第二次循环得到的结果第三次循环得到的结果第四次循环得到的结果…所以S是以4为周期的,而由框图知当k=2011时输出S∵2011=502×4+3所以输出的S是故选C8.【答案】C【解析】解:①在残差图中,残差点比较均匀地落在水平的带状区域内,说明选用的模型比较合适,正确.②相关指数R2来刻画回归的效果,R2值越大,说明模型的拟合效果越好,因此②不正确.③比较两个模型的拟合效果,可以比较残差平方和的大小,残差平方和越小的模型,拟合效果越好,正确.综上可知:其中正确命题的是①③.故选:C.【点评】本题考查了“残差”的意义、相关指数的意义,考查了理解能力和推理能力,属于中档题.9.【答案】D【解析】解:若命题p为真命题,命题q为假命题,则命题“p∧q”为假命题,故A不正确;命题“若xy=0,则x=0”的否命题为:“若xy≠0,则x≠0”,故B不正确;“”⇒“+2kπ,或,k∈Z”,“”⇒“”,故“”是“”的必要不充分条件,故C不正确;命题“∀x∈R,2x>0”的否定是“”,故D正确.故选D.【点评】本题考查命题的真假判断,是基础题,解题时要认真审题,仔细解答.10.【答案】D【解析】解:∵函数f(x)=(x﹣3)e x,∴f′(x)=e x+(x﹣3)e x=(x﹣2)e x,令f′(x)>0,即(x﹣2)e x>0,∴x﹣2>0,解得x>2,∴函数f(x)的单调递增区间是(2,+∞).故选:D.【点评】本题考查了利用导数判断函数的单调性以及求函数的单调区间的应用问题,是基础题目.11.【答案】B【解析】解:∃x∈R,x﹣2>0,即不等式x﹣2>0有解,∴命题p是真命题;x<0时,<x无解,∴命题q是假命题;∴p∨q为真命题,p∧q是假命题,¬q是真命题,p∨(¬q)是真命题,p∧(¬q)是真命题;故选:B.【点评】考查真命题,假命题的概念,以及p∨q,p∧q,¬q的真假和p,q真假的关系.12.【答案】B【解析】解:∵A={﹣4,2a﹣1,a2},B={a﹣5,1﹣a,9},且A∩B={9},∴2a﹣1=9或a2=9,当2a﹣1=9时,a=5,A∩B={4,9},不符合题意;当a2=9时,a=±3,若a=3,集合B违背互异性;∴a=﹣3. 故选:B .【点评】本题考查了交集及其运算,考查了集合中元素的特性,是基础题.二、填空题13.【答案】 1000 .【解析】解:∵x 是400和1600的等差中项,∴x==1000.故答案为:1000.14.【答案】3a ≤- 【解析】试题分析:函数()f x 图象开口向上,对称轴为1x a =-,函数在区间(,4]-∞上递减,所以14,3a a -≥≤-. 考点:二次函数图象与性质.15.【答案】 3【解析】解:令g (x )=f (x )﹣log 4x=0得f (x )=log 4x∴函数g (x )=f (x )﹣log 4x 的零点个数即为函数f (x )与函数y=log 4x 的图象的交点个数, 在同一坐标系中画出函数f (x )与函数y=log 4x 的图象,如图所示, 有图象知函数y=f (x )﹣log 4 x 上有3个零点. 故答案为:3个.【点评】此题是中档题.考查函数零点与函数图象交点之间的关系,体现了转化的思想和数形结合的思想,体现学生灵活应用图象解决问题的能力.16.【答案】 63 .【解析】解:∵第一圈长为:1+1+2+2+1=7第二圈长为:2+3+4+4+2=15第三圈长为:3+5+6+6+3=23 …第n 圈长为:n+(2n ﹣1)+2n+2n+n=8n ﹣1 故n=8时,第8圈的长为63, 故答案为:63.【点评】本题主要考查了归纳推理,解答的一般步骤是:先通过观察第1,2,3,…圈的长的情况发现某些相同性质,再从相同性质中推出一个明确表达的一般性结论,最后将一般性结论再用于特殊情形.17.【答案】2【解析】解析:本题考查向量夹角与向量数量积的应用.a 与b 的夹角为23π,1⋅=-a b ,∴|2|+=a b 2==.18.【答案】 {2,3,4} .【解析】解:∵全集U={0,1,2,3,4},集合A={0,1,2}, ∴C U A={3,4}, 又B={2,3},∴(C U A )∪B={2,3,4}, 故答案为:{2,3,4}三、解答题19.【答案】(1)0.0075x =;(2)众数是230,中位数为224. 【解析】试题分析:(1)利用频率之和为一可求得的值;(2)众数为最高小矩形底边中点的横坐标;中位数左边和右边的直方图的面积相等可求得中位数.1试题解析:(1)由直方图的性质可得(0.0020.00950.0110.01250.0050.0025)201x ++++++⨯=, ∴0.0075x =.考点:频率分布直方图;中位数;众数.20.【答案】【解析】(1)证明:设{a n}中首项为a1,公差为d.∵lga1,lga2,lga4成等差数列,∴2lga2=lga1+lga4,∴a22=a1a4.即(a1+d)2=a1(a1+3d),∴d=0或d=a1.当d=0时,a n=a1,b n==,∴=1,∴{b n}为等比数列;当d=a1时,a n=na1,b n==,∴=,∴{b n}为等比数列.综上可知{b n}为等比数列.(2)解:当d=0时,S3==,所以a1=;当d=a1时,S3==,故a1=3=d.【点评】本题主要考查等差数列与等比数列的综合以及分类讨论思想的应用,涉及数列的公式多,复杂多样,故应多下点功夫记忆.21.【答案】【解析】解:(Ⅰ)由题意可知:X~B(9,p),故EX=9p.在通讯器械配置的9个元件中,恰有5个元件正常工作的概率为:.在通讯器械配置的9个元件中,恰有6个元件正常工作的概率为:.在通讯器械配置的9个元件中,恰有7个元件正常工作的概率为:.在通讯器械配置的9个元件中,恰有8个元件正常工作的概率为:.在通讯器械配置的9个元件中,恰有9个元件正常工作的概率为:.通讯器械正常工作的概率P′=;(Ⅱ)当电路板上有11个元件时,考虑前9个元件,为使通讯器械正常工作,前9个元件中至少有4个元件正常工作.①若前9个元素有4个正常工作,则它的概率为:.此时后两个元件都必须正常工作,它的概率为:p2;②若前9个元素有5个正常工作,则它的概率为:.此时后两个元件至少有一个正常工作,它的概率为:;③若前9个元素至少有6个正常工作,则它的概率为:;此时通讯器械正常工作,故它的概率为:P″=p2++,可得P″﹣P′=p2+﹣,==.故当p=时,P″=P′,即增加2个元件,不改变通讯器械的有效率;当0<p时,P″<P′,即增加2个元件,通讯器械的有效率降低;当p时,P″>P′,即增加2个元件,通讯器械的有效率提高.【点评】本题考查二项分布,考查了相互独立事件及其概率,关键是对题意的理解,属概率统计部分难度较大的题目..22.【答案】(1)证明见解析;(2)25【解析】试题解析:(2)在三角形AMC 中,由22,3,cos 3AM AC MAC ==∠=,得 2222cos 5CM AC AM AC AN MAC =+-∠=, 222AM MC AC +=,则AM MC ⊥,∵PA ⊥底面,ABCD PA ⊂平面PAD , ∴平面ABCD ⊥平面PAD ,且平面ABCD平面PAD AD =,∴CM ⊥平面PAD ,则平面PNM ⊥平面PAD ,在平面PAD 内,过A 作AF PM ⊥,交PM 于F ,连结NF ,则ANF ∠为直线AN 与平面PMN 所成角。
18—19学年上学期高二第一次月考化学试题(附答案)

成都外国语学校2018—2019学年度上期十月月考高二化学试卷注意事项:1、本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分,共10页。
2、本堂考试90分钟,满分100分。
3、答题前,考生务必先将自己的姓名、学号填写在答卷上,并使用2B铅笔填涂。
可能用到的相对原子质量:H -1 C-12 N-14 O-16 Si-28 S-32Cl-35.5Na-23 Mg-24 Al-27 K-39 Mn-55 Fe-56 Cu-64 Ba-137第Ⅰ卷(选择题,52分)一、选择题(每题只有一个正确答案,2分/个)1.化学与环境、工农业生产等密切相关,下列叙述正确的是( )A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关B.为防止臭氧空洞的扩大,联合国环保组织要求各国大量减少CO2的工业排放量C.棉花、蚕丝和锦纶的主要成分都是纤维素D.为了防止中秋月饼等富含脂食品氧化变质,延长保质期,可以包装袋中放入生石灰2.下列反应的离子方程式正确的是( )A. 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42- = BaSO4↓+2H2OB. 足量的CO2通入饱和碳酸钠溶液中:CO2+2Na++CO32-+H2O = 2NaHCO3↓C. 酸性高锰酸钾溶液与草酸反应:2MnO4—+8H++3C2O42—= 6CO2↑+2MnO2+4H2OD. 向碳酸氢钠溶液中滴入少量澄清石灰水:Ca2++OH-+HCO3- = CaCO3↓+H2O3.下列各组离子能大量共存的是( )①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+②加入KSCN 显红色的溶液:K+、NH4+、Cl-、S2-③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+④pH=2 的溶液中:NH4+、Na+、Cl-、Cu2+⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-A.②③④B.①③C.①②③④D.③④4.N A为阿伏伽德罗常数的值。
成华区高中2018-2019学年上学期高二期中化学模拟题

成华区高中2018-2019学年上学期高二期中化学模拟题班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.实现下列转化的反应方程式中,正确的是A.H2SO3→H2SO4:H2SO3+H2O2=H2SO4+H2OB.Fe→Fe3+:2Fe+6H+=2Fe3++3H2↑C.Brˉ→Br2:2Brˉ+I2=Br2+2IˉD.Cu→CuSO4:Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O2.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的是A.A B.B C.C D.D3.硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,乙溶液变成丙。
在丙里加入Na2S 生成气体丁,把丁通入乙得到沉淀戊。
甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是A.SO3、H2SO4、H2SO3、H2S、S B.SO2、H2SO3、H2SO4、S、H2SC.SO3、H2SO4、H2SO3、S、H2S D.SO2、H2SO3、H2SO4、H2S、S用勒夏特列原理解释的是4.下列事实不能..A. 实验室常用排饱和食盐水的方法收集氯气B. 在硫酸亚铁溶液中,加入铁粉以防止氧化C. 酯在碱性条件下水解的程度较为完全D. 氨水应密闭保存,放置低温处5.下列表示化学过程的化学用语书写正确的是A.BaSO4投入水中后建立的沉淀溶解平衡:BaSO4Ba2++SO42-B.AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O2Al(OH)3↓C.HCO3-的电离:HCO3-+H2O CO32-+H3O+D.Na2SO3的水解:SO32-+2H2O H2SO3+2OH-6.将纯水加热至较高温度,下列叙述正确的是A.水的离子积变大、pH变小、呈酸性B.水的离了积不变、pH不变、呈中性C.水的离子积变小、pH变大、呈碱性D.水的离子积变大、pH变小、呈中性7.下列表述正确的是A.硫离子的结构示意图:B.乙烯的结构简式为CH2CH2C. 过氧化氢的电子式:D.H2O分子的比例模型8.已知甲、乙、丙和X是4种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是A.甲为C,X是O2B.甲为CO2,X是NaOH溶液C.甲为Cl2,X为Fe D.甲为Na,X为O29.下列陈述Ⅰ10.下列对反应热的描述中,正确的是()A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H =-890.3 kJ·mol-1B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H =-2a kJ·mol-1C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则水分解的热化学方程式表示为:2H2O(l)=2H2(g)+O2(g)△H =+571.6 kJ·mol-1D.HCl和NaOH反应中和热△H =-57.3 kJ·mol-1,则CH3COOH和NaOH反应生成1mol水时放出的热量为57.3kJ11.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是A.c(HCN)<c(CN-)B.c(Na+)< c(CN-)C.c(HCN)-c(CN-)=c(OH-)D.c(HCN)+c(CN-)=0.1mol·L-112.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。
四川省成都市高二上学期第一次月考化学试卷

四川省成都市高二上学期第一次月考化学试卷姓名:________ 班级:________ 成绩:________一、选择题. (共20题;共40分)1. (2分)下列反应的离子方程式书写错误的是()A . 向氯化铝溶液中加入过量的氨水:Al3++3NH3·H2O= Al(OH)3↓+3NH4+B . 用氨水吸收过量的二氧化硫:NH3·H2O+SO2 = NH4+ +HSO3-C . 向偏铝酸钠溶液中加入过量的稀盐酸:AlO2-+H++H2O= Al(OH)3↓D . 向次氯酸钠溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO +CO32-2. (2分)为了避免电解质溶液中CuSO4因水解发生沉淀,符合题意的操作方法是()A . 加水稀释B . 加少量稀硫酸C . 加少量NaOH溶液D . 加热3. (2分) (2015高二上·沈阳月考) 下列说法正确的是()A . 向1mL 1mol/L的NaOH的溶液中滴加1~2滴2mol/LMgCl2溶液有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,出现红褐色沉淀,则证明Mg(OH)2的Ksp大于Fe(OH)3B . 由pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液显酸性C . 由0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后的溶液显酸性D . 某物质的溶液中由水电离出的c(H+)=1×10﹣a mol/L,若a>7,则该溶液的pH一定为14﹣a4. (2分)(2018·孝义模拟) 熔融碳酸盐燃料电池(Molen Cathomale Fuel Cell)简称MCFC,具有高发电效率。
工作原理示意图如图。
下列说法正确的是()A . 电极M 为负极,K+、Na+移向MB . 电池工作时,熔融盐中CO32-物质的量增大C . A 为CO2 ,正极的电极反应为:O2+4e-+2CO2= 2CO32-D . 若用MCFC给铅蓄电池充电,电极N接Pb极5. (2分)下图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是()A . 该金属腐蚀过程为析氢腐蚀B . 正极为C,发生的反应为氧化反应C . 在酸性条件下发生的是吸氧腐蚀D . 正极反应为O2+2H2O+4e-=4OH-6. (2分)下列各组粒子在指定溶液中可能大量共存的是()A . 无色透明溶液中:Na+、Fe2+、Cl-、SO42-B . c(Fe3+)=2.0 mol/L的溶液中:K+、Ca2+、SCN-、Cl-C . 加入酚酞显红色的溶液中:Na+、CO32-、NO3-、K+D . 加入铝粉能产生氢气的溶液中:Fe2+、NO3-、K+、SO42-7. (2分)区别CH4、CH2=CH2、CH≡CH的最简易方法是()A . 分别通入溴水B . 分别通入酸性高锰酸钾溶液C . 分别在空气中点燃D . 分别通入盛有碱石灰的干燥管8. (2分)下列说法正确的是()A . 质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量B . 核磁共振氢谱中,CH3COOH,CH3OH都可给出两种信号C . 的名称为2,2,4﹣三甲基﹣4﹣戊烯D . 、和互为同系物9. (2分) (2015高二下·周口期中) 下列各化合物的命名中正确的是()A . CH2═CH﹣CH═CH2 1,3﹣丁二烯B . CH3﹣CH2﹣CH═CH2 3﹣丁烯C . 对二甲苯D . 3﹣甲基丁烷10. (2分)常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。
成华区高中2018-2019学年高二上学期第一次月考试卷化学

成华区高中2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.【重庆理综化学】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:的是()下列叙述错误..A.X、Y和Z均能使溴水褪色B.X和Z均能与NaHCO3溶液反应放出CO2C.Y既能发生取代反应,也能发生加成反应D.Y可作加聚反应单体,X可作缩聚反应单体2.下列说法错误的是()A.钠的化学性质很活泼,所以需要将其放在煤油中保存B.铝制品在生活中非常普遍,这是因为铝不活泼C.镁因在空气中形成了一薄层致密的氧化膜,保护了里面的镁,故镁不需要像钠似的进行特殊保护D.铁在潮湿的空气中因生成的氧化物很疏松,不能保护内层金属,故铁制品往往需涂保护层3.类推的思维方法在化学学习与研究中常会产生错误的结论。
因此类推出的结论最终要经过实践的检验才能知道其正确与否。
下列几种类推结论中正确的是A.金属镁失火不能用二氧化碳灭火器扑灭,则金属钠失火也不能用二氧化碳灭火B.碳酸钠的溶解度比碳酸氢钠的大,所以碳酸钙的溶解度也比碳酸氢钙的大C.铁可以置换出硫酸铜溶液中的铜,所以钠也可以置换出氯化铜溶液中的铜D.铁制器皿在潮湿的空气中迅速生锈,所以家庭用的铝制品也要经过防腐蚀处理4.使溶液中的Al3+完全转化成Al(OH)3,应选择的最好试剂是A.NH3·H2O B.NaOH C.CO2 D.HCl5.已知异丙苯的结构简式如下,下列说法错误的是()A.异丙苯的分子式为C9H12B.异丙苯的沸点比苯高C.异丙苯中碳原子可能都处于同一平面D.异丙苯的和苯为同系物6. 今有一包铁粉和铜粉混合粉末,为确定其组成,现提供 4mol/L 的 FeCl 3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)( )A .第①组溶液中 c (Fe 3+B .第②组剩余固体是铜铁混合物C .第④组反应后的滤液中 c (Fe 2+)=6 mol/LD .原混合粉末中 n (Fe ):n (Cu )=3:27. 【浙江理综化学】下列说法不正确...的是( ) A .己烷有4种同分异构体,它们的熔点、沸点各不相同B .在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应C .油脂皂化反应得到高级脂肪酸盐与甘油D .聚合物(—[CH 2—CH 2—CH —|CH 3CH 2—]n )可由单体CH 3CH =CH 2和CH 2=CH 2加聚制得8. 有4种碳架..如图的烃(小黑球表示碳原子,黑球之间的连线表示共价键),下列说法正确的是( )①a 和e 互为同分异构体 ②b 是天然气的主要成分 ③d 为平面型分子,属于芳香烃 ④b 和c 互为同系物 ⑤a 、d 、e 的最简式相同A .①③⑤B .①②③C .②③④D .①④⑤9. 11.2g 铁粉与2.2g 硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标况下收集到的气体的体积是 A .11.2LB .5.6LC .4.48LD .2.24L10.【2017新课标3卷】下列说法正确的是( ) A .植物油氢化过程中发生了加成反应 B .淀粉和纤维素互为同分异构体 C .环己烷与苯可用酸性KMnO 4溶液鉴别 D .水可以用来分离溴苯和苯的混合物11.下列实验事实不能用平衡移动原理解释的是A.B.C.D.12.甲醇燃料电池体积小巧、洁净环保、理论比能量高,已在便携式通讯设备、汽车等领域应用。
2018_2019学年高二化学上学期第一次月考试题普通班word版本

高二普通班上学期第一次月考试卷化学第I卷(选择题)一、填空题(共18小题,共54分)1、已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1,P4(s)+10Cl2(g)=4PCl5(g)ΔH=bkJ·mol-1。
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1。
下列叙述正确的是()-1,PCl3中P-Cl键的键能为1.2ckJ·molA. P-P键的键能大于P-Cl键的键能B. Cl-Cl键的键能kJ·mol-1C.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔHD. P-P键的键能为kJ·mol-12、已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1 ;2 H2(g)+ O2(g)= 2H2O(g) △H2 ;C(s)+ O2(g)=CO2(g) △H3 .则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为 ( )A.12△H3-5△H2-2△H1 B.2△H1-5△H2-12△H3C.12△H3+5△H2 -2△H1 D.△H1-5△H2-12△H33、下列各组变化中,化学反应的反应热前者小于后者的一组是()① CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;② 2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+O2(g)═H2O(l)△H2;③S(g)+O2(g)=SO2(g) △H1 ;S(s)+O2(g)=SO2(g) △H2 ;④ CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.A. ②③④B. ②④C.①②③D. ③④4、下列食品添加剂中,其试用目的与反应速率有关的是( )A.调味剂 B.抗氧化剂 C.着色剂 D.增稠5、反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能够引起反应速率增大的是() A.将容器的体积缩小一半 B.增加C的量C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入Ar使容器容积变大6、设反应C(s)+CO2(g)═2CO(g)为吸热反应,反应速率为v1;N2(g)+3H2(g)2NH3(g)正反应为放热,正反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为()A.v1增大、v2减小 B.同时减小 C.同时增大 D.v1减小、v2增大7、一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是()A.溶液酸性越强,R的降解速率越小B.在0-50min时,pH=2和pH=7时R的降解百分率相等C.R的起始浓度越小,降解速率越大D.在20~25min之间,pH=10时R的平均降解速率为0.04 mol•L-1•min-18、已知:2H2(g)+ O2(g)=2H2O(l) △H=﹣572kJ•mol﹣1CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) △H=﹣890kJ•mol﹣1现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( ) A. 1∶2 B. 1∶3 C. 1∶4 D. 2∶39、已知3.6g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。
成华区第一中学2018-2019学年高二上学期第一次月考试卷化学
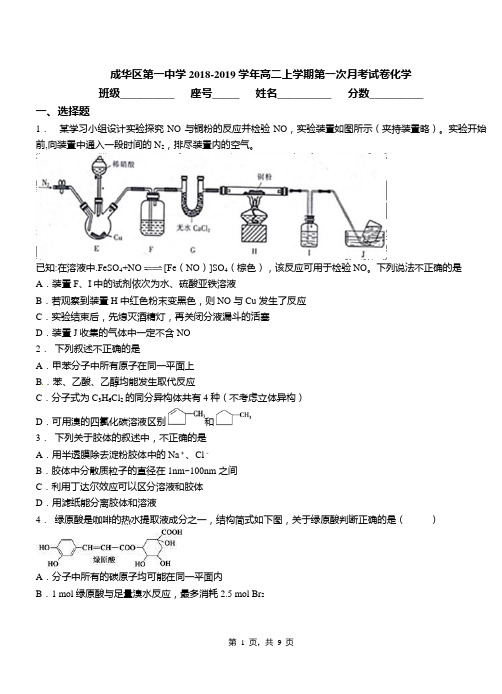
成华区第一中学2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。
实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
已知:在溶液中.FeSO4+NO[Fe(NO)]SO4(棕色),该反应可用于检验NO。
下列说法不正确的是A.装置F、I中的试剂依次为水、硫酸亚铁溶液B.若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应C.实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞D.装置J收集的气体中一定不含NO2.下列叙述不正确的是A.甲苯分子中所有原子在同一平面上B.苯、乙酸、乙醇均能发生取代反应C.分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)D.可用溴的四氯化碳溶液区别和3.下列关于胶体的叙述中,不正确的是A.用半透膜除去淀粉胶体中的Na+、Cl-B.胶体中分散质粒子的直径在1nm~100nm之间C.利用丁达尔效应可以区分溶液和胶体D.用滤纸能分离胶体和溶液4.绿原酸是咖啡的热水提取液成分之一,结构简式如下图,关于绿原酸判断正确的是()A.分子中所有的碳原子均可能在同一平面内B.1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2C .1 mol 绿原酸与足量NaOH 溶液反应,最多消耗4 mol NaOHD .绿原酸水解产物均可以与FeCl 3溶液发生显色反应5. 某化学兴趣小组对电解质溶液作如下的归纳总结(均在常温下)。
其中不.正确的是( ) A .pH=3的强酸溶液1mL ,加水稀释至100mL 后,溶液pH 升高2个单位 B .1L 0.50mol·L -1NH 4Cl 溶液与2L 0.25mol·L -1NH 4Cl 溶液含NH 4+物质的量后者大 C .pH=8.3的NaHCO 3溶液:c (Na +)>c (HCO 3-)>c (H 2CO 3)>c (CO 32-)D .pH=4、浓度均为0.1mol·L -1的CH 3COOH 、CH 3COONa 混合溶液中:c (CH 3COO -)-c (CH 3COOH )=2×(10-4-10-10) mol·L -16. 汽车发动机中生成NO 的反应为:N 2(g ) + O 2(g )2NO (g ), t ℃时,K = 0.09。
城区第一中学2018-2019学年高二上学期第一次月考试卷化学

城区第一中学2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.下列溶液中:①澄清石灰水②氯化钡溶液③KMnO4溶液④溴水⑤酸化的Ba(NO3)溶液⑥品红溶液⑦湿润的蓝色石蕊试纸⑧三氯化铁溶液⑨浓硫酸,不能用来区别SO2和CO2气体的是A.①②⑦⑨B.①③⑧C.①④⑤D.③④⑤⑥2.常温下,在下列溶液中可能大量共存的离子组是()A.pH=0的溶液:Fe2+、Mg2+、NO3﹣、SO42﹣B.由水电离出的c(H+)=1×10﹣13mol/L的溶液:Al3+、K+、SO42﹣、Cl﹣C.c(OH-)/c(H+)=1012的溶液中:NH4+、Al3+、NO3﹣、CO32﹣D.pH=14的溶液:Na+、K+、Al3+、S2﹣3.常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH 的关系如右图所示。
下列说法正确的是A. H3AsO4的第一步电离常数K a1>0.01B. pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0C. 0.1mol·L-1H3AsO4溶液的pH<2D. pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)4.已知在酸性介质中,MnSO4与(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82-→MnO4-+SO42-,下列说法正确的是,A.反应过程中,因消耗溶液中的H+反应后溶液pH增大B.氧化性:S2O82->MnO4-C.该反应中酸性介质可以为盐酸D.0.1mol氧化剂参加反应,转移电子0.5mol5.可逆反应:2NO22NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是()①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时生成2nmolNO③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部6.下列关于有机化合物的叙述正确的是A.乙酸和乙醇均能与NaOH溶液发生反应B.碘酒可使蛋白质变性,医疗上常用作消毒杀菌C.乙稀使溴水和酸性高锰酸钾溶液褪色均属于氧化反应D.糖类、油脂、蛋白质在一定条件下均能发生水解反应7.某化学兴趣小组同学对有关物质的分类进行讨论辨析:①生铁、氯水都属于混合物②AlCl3溶液、蛋白质溶液都属于溶液③SiO2、CO都属于酸性氧化物④含氢原子的盐不一定属于酸式盐。
成华区外国语学校2018-2019学年高二上学期第一次月考试卷化学

成华区外国语学校2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2 + 6C Li1-x CoO2+Li x C6。
示意图如右。
下列说法正确的是A.充电时,阳极的电极反应式为Li1-x CoO2 +xLi++xe-=LiCoO2B.该装置工作时涉及到的能量形式有3 种C.充电时锂离子由右向左移动D.放电时,正极质量增加2.用氯乙烷制1,2-二氯乙烷,下列转化方案中,最好的是()A.B.C.D.3.一定条件下,反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH= -a kJ/mol ,在5 L密闭容的是器中进行,10 s时,水蒸气的物质的量增加了0.60 mol,则下列说法不正确...A.10s内,NH3的平均反应速率为0.008 mol·Lˉ1·sˉ1B.该反应达到平衡时6v(O2)正=5v(H2O)逆C.10s内,反应放出的热量为0.1akJD.10s时,H2O的反应速率为0.012 mol·Lˉ1·sˉ14. 下列说法错误..的是( )A .石油主要是由烃组成的混合物B .③是加成反应,产物名称是二溴乙烷C .②包括裂化、裂解等过程D .①主要发生物理变化 5. 下列物质属于电解质且能导电的是A. 石墨B. 液态HClC. 葡萄糖D. 熔融的Na 2CO 3 6. 下列说法不正确...的是A .乙烯在空气中燃烧时有黑烟,因此可以用燃烧法区别甲烷和乙烯B .苯与浓硝酸在浓硫酸存在条件下加热发生取代反应C .蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性D .氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽7. 某同学设计下列实验装置进行卤素的性质实验.玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )8. 已知还原性Iˉ>Fe 2+>I 2,在水溶液中I 2可被Cl 2氧化为IO 3ˉ。
成华区高中2018-2019学年高二9月月考化学试题解析

成华区高中2018-2019学年高二9月月考化学试题解析班级__________ 座号_____ 姓名__________ 分数__________一、选择题1. 下列关于有机物的叙述错误的是 A .鉴别己烷、己烯和乙醇,可用溴水B .乙烯和植物油均能使溴的四氯化碳溶液褪色,且反应原理相同C .甲苯苯环上的一个氢原子被-C 3H 6Cl 取代,形成的同分异构体有9种D .1mol 分子式为C 18H 26O 5的酯完全水解生成l mol 羧酸和2 mol 乙醇,则该羧酸分子式为C 14H 18O 5 2. 25℃,已知K Sp (A g Cl )=1.8×10-10,将2×10-5mol/L 的A g NO 3溶液和2×10-5mol/L 的K Cl 溶液等体积混合,下列说法正确的是( )A .恰好形成A g Cl 饱和溶液B .能析出A g Cl 沉淀C .不能析出A g Cl 沉淀D .无法确定能否析出A g Cl 沉淀3. 混合动力汽车(HEV )中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。
关于镍氢电池,下列说法不正确...的是A .充电时,阴极附近pH 降低B .电动机工作时溶液中OH -向甲移动C .放电时正极反应式为: NiOOH +H 2O +e -Ni (OH )2+OH -D .电极总反应式为:M +Ni (OH )2 MH +NiOOH 4. 【2017届广东省普宁市第二中学高三上学期第一次月考】下列有关有机物性质的说法正确的是( ) A .蛋白质可以与酸、碱或重金属盐反应 B .芳香烃都不能使酸性KMnO 4溶液褪色 C .CH 3CH 2OH 与氢溴酸不能反应D .石油的分馏可获得乙烯、丙烯等不饱和烃5. 与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是 A .环丙烷 B .环丁烷 C .乙烯 D .丙烷 6. 下列有关有机物的结构说法不正确的是( ) A .溴苯中的所有原子处于同一平面中充电 放电B.氯乙烯中所有原子不可能处于同一平面中C.3-甲基戊烷的一氯代产物有4种(不考虑立体异构)D.分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)7.由铁、锌、铝、镁四种金属中的两种组成的混合物10g,与足量盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是()A.铁B.锌C.铝D.镁的是8.下列关于硅及其化合物的说法中,不正确...A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体B.二氧化硅既能与氢氧化钠溶液的反应,又能与氢氟酸反应,所以是两性氧化物C.制普通玻璃的原料主要是纯碱、石灰石和石英砂D.长石(KAlSi3O8)用氧化物形式可表示为K2O·Al2O3·6SiO29.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的是A.A B.B C.C D.D10.我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图的是()所示,下列有关说法不正确...A.化合物I分子式为C19H24O5B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应C.化合物Ⅱ一定条件下能发生取代、消去及加成反应D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液11.下列各组中的离子能在溶液中大量共存,且向溶液中加入氢氧化钠时产生白色沉淀,加入盐酸时放出气体的一组是A.Fe3+、Cl-、Na+、NO3-B.OH-、Ba2+、NO3-、K+C.Na+、SO42-、Cu2+、Cl-D.HCO3-、Cl-、Na+、Ca2+12.两种不同的烃CxHy和CaHb不论以什么比例混合,只要总质量一定,完全燃烧时消耗O2的质量和生成水的质量不变,下列叙述正确的是()A.CxHy和CaHb分子中氢原子数一定相等B.可能是C2H4和C3H6的混合物C.CxHy和CaHb一定是同分异构体D.CxHy和CaHb的最简式可能不同13.五种常见物质的转化关系如图所示(部分反应物及产物略去),其中Q、M、N含有某种相同的元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成华区第一高级中学2018-2019学年高二上学期第一次月考试卷化学班级__________ 座号_____ 姓名__________ 分数__________一、选择题1.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的是A.A B.B C.C D.D2.铁和铁合金是生活中常见的材料,下列说法正确的是A.铁与盐酸反应,铁合金不与盐酸反应B.一定条件下,铁粉可与水蒸气反应C.不锈钢是铁合金,只含金属元素D.纯铁的硬度和强度均高于铁合金3.仪器名称为“蒸发皿”的是A.B.C.D.4.下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是A.乙组操作时,C2做正极B.乙组操作时,C1上发生的电极反应为I2+2e-═2I-C.甲组操作时,电流表(G)指针发生偏转D.甲组操作时,溶液颜色变深5.中科大陈乾旺教授等人发明RTX合成金刚石的新方法,化学原理为:①223Na+CO C()+C()+Na CO −−−−→一定条件金刚石石墨(未配平) 该方法比1955年人工首次制得金刚石的旧方法容易得多。
②101800C 1.210Pa C()C()︒⨯−−−−−−→石墨金刚石。
以下表述正确的是 A .反应①中既有旧化学键的断裂又有新化学键的形成 B .新方法利用的是物理变化,旧方法利用的是化学变化 C .在反应①中每生成12g 金刚石需要消耗23g 金属钠 D .反应①和反应②中所得的金刚石都是还原产物6. 【2017年全国新课程高考仿真信息卷理科综合(二)】下图是一些常见的有机物的转化关系。
下列说法错误的是( )A .反应①、③均属于加成反应B .乙酸与甲酸甲酯互为同分异构体C .乙醇溶液可除去暖瓶中的水垢D .反应④、⑤、⑥、⑦均属于取代反应7. 钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径不正确的是( ) A 、经常晒太阳 B 、经常饮用钙离子含量高的硬水 C 、经常饮用牛奶、豆奶 D 、大量补充维生素D 8. 设N A 为阿伏加德罗常数,下列说法正确的是( ) A .标准状况下,5.6L CCl 4含有的分子数为0.25N A B .标准状况下,14 g 氮气含有的核外电子数为5N AC .标准状况下,22.4 L 任意比的氢气和氯气的混气中含有分子总数均为N AD .在标准状况下,18gH 2O 所含有的电子数不是10N A9. 【上海化学】已知咖啡酸的结构如右图所示。
关于咖啡酸的描述正确的是( )A .分子式为C 9H 5O 4B .1mol 咖啡酸最多可与5mol 氢气发生加成反应C .与溴水既能发生取代反应,又能发生加成反应D.能与Na2CO3溶液反应,但不能与NaHCO3溶液反应10.下列有关金属腐蚀与防护的说法不正确的是()A.钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一B.在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿C.金属制品在海水中比淡水中更容易发生腐蚀D.从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程11.球墨铸铁中含有一种铁碳化合物X。
实验小组为测定化合物X的组成设计实验如下:下列说法不正确的是A.固体2是氧化铁B.X的化学式可以表示为Fe3C2C.溶液甲加热、蒸发、灼烧也可得到24.0g固体D.X与足量的热浓硝酸反应有NO2和CO2生成12.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等。
为了确认溶液的组成,进行了如下实验:取200ml上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g。
向沉淀中加入过量的盐酸,有2.33g沉淀不溶。
的是关于原溶液组成的结论,不正确...A.一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种B.为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液C.c(HCO3-)=0.05mol/LD.4.88g沉淀中含有3种成分13.已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为A.60% B.91% C.84% D.42%14.某温度时,水的离子积常数K W=10−13,将此温度下pH=11的Ba(OH)2溶液a L与pH=1的H2SO4溶液b L 混合(设混合溶液体积为两者之和,固体体积忽略不计)。
下列说法中不正确的是A.若所得混合溶液为中性,则a∶b=1∶1B.若所得混合溶液为中性,则生成沉淀的物质的量为0.05b molC .若a ∶b =9∶2,则所得溶液pH 等于2D .若a ∶b =9∶2,则该混合溶液最多能够溶解铁粉0.28(a +b ) g15.废水脱氮工艺中有一种方法是在废水中加入过量NaClO 使NH 4+完全转化为N 2,该反应可表示为4222NH 3ClO N 3Cl 2H 3H O +--++=+++。
下列说法中,不正确的是A .反应中氮元素被氧化,氯元素被还原B .还原性NH 4+< Cl -C .反应中每生成1 mol N 2,转移6 mol 电子D .经此法处理过的废水不可以直接排放16.石墨烯锂硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,其工作原理如图所示,电池反应为2Li+nSLi 2Sn 。
下列说法错误的是A. 放电时,Li +向正极移动B. 充电时,a 电极连接直流电源的正极C. 充电时,每生成nmolS ,外电路中流过2nmol 电子D. 放电时,正极上可发生反应2Li ++Li 2S 4+2e -=2Li 2S 217.实验桌上放有托盘天平、研钵、三脚架、泥三角、蒸发皿、坩埚、干燥器、酒精灯、火柴、烧杯、量筒100 mL 、容量瓶、药匙、玻璃棒、石棉网、胶头滴管、坩埚钳。
从缺乏仪器和用具的角度来看,不能进行的实验项目是( )A .配制0.1 mol / L 100 mL 的CuSO 4溶液B .萃取 分液C .测定硫酸铜晶体中结晶水的含量D .蒸发18.2017年春节期间,一种“本宝宝福禄双全”的有机物刷爆朋友圈,其结构简式如下:(-CHO ,一种官能团,其名称为醛基),该物质的同分异构体中具有“本宝宝福禄双全”谐音且两个醛基位于苯环间位的有机物有( )A .4种B .6种C .7种D .9种19.有容积不同的X 、Y 两密闭容器,X 中充满CO 气体,Y 中充满CH 4、O 2、N 2的混合气体,同温同压下测得两容器中气体密度相同。
下列叙述中不正确的是( ) A .Y 容器中CH 4、O 2、N 2的质量之比可以为1∶6 ∶3B.Y容器中CH4、O2、N2的物质的量之比一定为1∶3∶6C.两容器中所含气体分子数一定不同D.两容器中所含气体的质量一定不同20.现有一组有机物,其转化关系如图所示,转化关系中部分反应物和产物省略,涉及的化学反应均源于教材。
甲乙丙丁戊己已知甲是天然高分子化合物,M r(己)-M r(戊)=28,下列有关推断正确的是()A.上述有机物的组成元素相同B.甲、乙、丁均能发生银镜反应C.戊发生消去反应生成己D.除去己中少量杂质戊的方法:加入NaOH溶液,蒸馏二、填空题21.目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进CHCO)CH(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v正________v逆(填“>”、“=”或“<”)。
22.氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:a.CH4(g)+H2O(g)CO(g)+3H2(g)△H=+216.4kJ/molb.CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.2kJ/mol则反应CH4(g)+2H2O(g)CO2(g)+4H2(g)△H=_________。
(2)起始时投入氮气和氢气分别为1mol 、3mol ,在不同温度和压强下合成氨。
平衡时混合物中氨的体积分数与温度关系如下图。
①恒压时,反应一定达到平衡状态的标志是______(填序号); A.N 2和H 2的转化率相等 B.反应体系密度保持不变C.比值保持不变D.=2②P 1_____P 2 (填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B 点____D 点;③C 点H 2的转化率____;在A 、B 两点条件下,该反应从开始到平衡时生成氨气平均速率:v (A )______ v (B )。
(3)N 2H 4可作火箭推进剂,NH 3和NaClO 在一定条件下反应可生成N 2H 4。
①写出NH 3和NaClO 反应生成N 2H 4的化学方程式__________; ②已知25℃时N 2H 4水溶液呈弱碱性: N 2H 4+H 2O N 2H 5++OH - K 1= 1×10-a ; N 2H 5++H 2ON 2H 62++OH - K 2=1×10-b 。
25℃时,向N 2H 4水溶液中加入H 2SO 4,欲使c (N 2H 5+)>c (N 2H 4),同时c (N 2H 5+)>c (N 2H 62+),应控制溶液pH 范围_________(用含a 、b 式子表示)。
23.纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用 。
(1)工业生产纯碱的第一步是除去饱和食盐水的中Mg 2+、Ca 2+离子,从成本角度考虑加入试剂的化学式为 、 。
某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:装置III装置II中反应的化学方程式 。
② 从平衡移动角度解释该反应发生的原因 。
③ 操作①的名称是 。
(3)写出装置II 中发生反应的化学方程式 。
(4)请结合化学用语说明装置III 中加入磨细的食盐粉及NH 3的作用 。
