22届省级竞赛试题
[整理]第22届全国初中物理知识应用能力竞赛试题及答案
![[整理]第22届全国初中物理知识应用能力竞赛试题及答案](https://img.taocdn.com/s3/m/10b7213503d8ce2f00662370.png)
第二十一届全国初中应用物理竞赛试题一、本题共10小题,每小题2分,共20分。
以下各小题给出的四个选项中只有一个是正确的,把正确选项前面的字母填在题后的括号内。
1.目前,很多汽车的驾驶室里都有一个叫做GPS(全球卫星定位系统)接收器的装置。
GPS 接收器通过接收卫星发射的导航信号,实现对车辆的精确定位并导航。
卫星向GPS接收器传送信息依靠的是( )A.红外线B.紫外线C.电磁波D.激光2.图1为工人师傅用于推车运送纯净水的图片,对于这两种方法中哪种方法比较省力的判断,下列说法中正确的是( )A.图甲的方法比较省力。
B.图乙的方法比较省力。
C.图甲和图乙两种方法所用力的大小相等。
D.无法判断。
3.如图2所示,教室里的天花板下面装有多挡位吊扇,当吊扇正常工作时,对于吊扇对天花板的拉力大小与其重力大小的判断,下列说法中正确的是( )A.吊扇在高挡位工作时,拉力等于重力。
B.吊扇在低挡位工作时,拉力大于重力。
C.电扇在任意挡位工作时,拉力等于重力。
D.电扇在任意挡位工作时,拉力小于重力。
4.在学校的田径运动会上,小亮注意到发令台上有一块“板子”,如图3所示;关于这块板子的作用,他做了如下猜想,其中正确的是( )A.主要用来反射发令枪的枪声,所以必须正对着终点计时裁判的方向。
B.主要用来衬托发令枪冒出的白烟,所以应该是深色或黑色的。
C.主要用来减弱噪声,所以要把它放在看台和发令枪之间。
D.主要用来遮阳,所以要把它放在裁判员的头的上方。
5.随着我国航天员在轨道舱内停留时间的增加,在轨道舱内进行体育锻炼必将成为航天员需要完成的一项重要工作;下列适合航天员在轨道舱中进行体育锻炼的运动项目是( )A.举哑铃B.跳绳 C .踢毯子 D.拉弹簧拉力器6.动车组列车进站前的减速过程分为两个阶段进行:第一阶段采用“再生刹车”技术,速度从250km/h减至90km/h,这期间停止动力供给,列车依靠惯性继续前行,并带动发电机发电;第二阶段采用机械刹车,速度从90km/h开始不断减小直至停止;关于列车进站过程中的能量转化,下列说法中正确的是( )A.第一阶段减小的动能全部转化为电能,即电能等于减小的动能。
浙江省杭州市2025届高考政治命题比赛试题31

浙江省杭州市2025届高考政治命题竞赛试题3试卷设计说明一、设计思路本试卷设计是在《学科教学指导看法》的基础上,通过对《2024年浙江省高考选考考试说明》的学习与探讨前提下,细心编撰形成。
整个试卷的结构与2024年11月份的高考选考试卷结构一样,从题型、分数的分布与内容的选择力求与其保持一样。
(文化生活主观题与政治生活主观题2选1考查,若考政治生活综合题的,其选择题削减一题)试题的题型和背景熟悉而常见,整体试题敏捷,思维含量较高.试卷内容上体现新课程理念,旨在使学生的政治认同、科学精神、法治意识和公共参加的核心素养落地。
有以下特点:(一)强调基础,凸显实力学问考查覆盖面广,基本覆盖6个模块的全部单元。
考查全面而又深刻。
此外,本届学生面临一个特殊问题:十九大召开之后,教材于2024年4月进行了重新修订。
《经济生活》第10课和第11课、《政治生活》第三单元、《文化生活》第四单元变更较大,而考试说明当中有提到:“下列考核条目所涉及的内容以靠前最新版本的教材为准”。
基于此,在客观题命题时,有选择性地考查一些学生熟悉的与十九大报告相关的新教材内容。
比如推断题第5题、第6题、第7题,选择题第14题、第24题等,旨在考查学生理解国内外重大时政热点的实力,(二)关注热点,彰显特色思想政治学科的特点是有显明的时代性和现实性。
在试卷素材的选用上,遵循了高考不回避时事政治热点的规律,选用了近1年来(特殊是2024年11月首考之后)国内外大事,让时政热点与学问考查有机融合。
在本卷中,既有“脱贫攻坚”、“改革开放40年的经济社会发展成就”、“首届国际进口博览会”、“新一轮个税改革”、“中美贸易战”…这样的国家大事,也有“英国脱欧”、“美国政府停摆”、“法国暴乱”等国际大事,还有贴近学生生活实际的“自动售货机”、“知否体走红网络”、“巨婴式公民”、“长生疫苗造假事务”、“雷锋志愿活动”…这样的生活实事,选择全新的时政素材,引导学生关注现实生活,以主动的看法、科学方法去分析思索社会热点问题。
2008年全国高中学生化学竞赛试题及参考答案

中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则题号 1 2 3 4 5 6 7 8 9 10 11 总分满分14 5 4 10 5 11 14 9 7 11 10 100第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?1-2氨和三氧化硫反应得到一种晶体,熔点205o C,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
1-3 Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
1-4 CaSO4• 2H2O微溶于水,但在HNO3 ( 1 mol L-1)、HClO4 ( 1 mol L-1)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
1-5取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
1-6X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
第2题 (5分) 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X 的原料,92%用于生产X —在酸性水溶液中用盐酸、二氧化硫或草酸还原。
湖州市第22届诺贝尔八年级科学竞赛试卷

湖州市第二十二届“诺贝尔杯”八年级科学竞赛试题卷考生须知:1.本卷共4 大题,29 小题。
考试时间120 分钟,满分150 分。
2.试卷分为试题卷(共8 页)和答题卷(共4 页)。
请在答题卷上写上考生姓名、学校、考号。
注意:所有答案必须写在答题卷上,否则无效。
3.可能用到的相对原子质量:H—1,C—12,O—16,Ba—137,Ti—48。
4.g 取10N/kg。
一、选择题(本大题有15 小题,每小题3 分,共45 分。
每小题只有一个符合题意的选项)1.“冥界之花”水晶兰是一种多年生,草本、腐生植物,全株无叶绿素、白色、肉质,靠腐烂的植物来获得养分。
一生经历种子的发芽、生长发育、开花、结果等过程。
下列关于水晶兰的说法不正确...的是A.水晶兰属于种子植物B.水晶兰能进行有性生殖C.水晶兰能通过光合作用制造有机物第1 题图D.水晶兰通过根能吸收外界的有机物2.“不得与朝菌言晦,与夏虫语冰”是形容对某些人讲道理就像对只在早晨出生到中午就死亡的菌说黄昏、对只在夏天出生到秋天就死亡的虫子说冬天一样,它们是无法理解的。
其中“朝”与“夏”用我们学的知识来分析,最恰当的理解应是A.早晨和夏天B.一个生命周期的时间长度C.生命周期的某一阶段D.早晨到中午与夏天到秋天3.如图所示,检查实验装置气密性,其中不正确...的是A.B.C.D.4.如图是一款新型无叶电风扇,与传统电风扇相比,具有易清洁、气流稳、更安全等特点。
工作时,底座中的电动机将空气从进风口吸入,吸入的空气经压缩后进入圆环空腔,再从圆环空腔上的缝隙高速吹出,夹带周边的空气一起向前流动,导致圆环空腔正面风速远大于背面风速。
下列说法中正确的是A.此电风扇可以在月球上正常使用B.电风扇正常运行时,主要是把机械能转化为电能C.底座中的电动机中是根据电磁感应现象的原理制成的D.相同时间内,圆缝口流出空气的质量等于进风口吸入空气的质量第4 题图5.下列有关显微镜使用的叙述中,正确的是A .物像的放大倍数=物镜的放大倍数+目镜的放大倍数B .调节反光镜对光时,光线较强时用凹面镜,光线较弱时用平面镜C .转动粗准焦螺旋的作用是使镜筒快速上升,转动细准焦螺旋的作用是使镜筒缓缓下降D .观察时发现目标在视野左上方,要将目标调到视野正中央,应将装片往左上方移 6.如图是从极地上空看地球自转的示意图,图中箭头表示地球自转的方 向,圆圈 a 、b 、c 分别代表观察到半球的极圈、回归线和赤道。
第22届北京市高一物理(力学)竞赛预赛试题

第22届北京市高一物理(力学)竞赛预赛试题(北京四中杯) (2009年)一、选择题 1.从地面竖直上抛一球,不计空气阻力,经时间t 到达最高点.则小球运动到1t -和1t +两个时刻( ) A .位移相同 B .加速度相同 C .速度相同 D .动能增量相同2.物块由静止开始沿直线运动,第1s 内、第2s 内、第3s 内的位移依次为2m 、4m 、6m .由此可判定( )A .物块做匀加速直线运动B .物块做变加速直线运动C .物块3s 内的平均速度为4m/sD .物块3s 内的平均速度为2m/s3.关于速度和加速度,下列说法正确的是( ) A .速度不变或加速度不变的运动都一定是直线运动 B .运动物体的加速度很大而速度大小保持不变是可能的 C .运动物体的加速度减小而速度增大是可能的D .物体做圆周运动时,加速度的方向可以不指向圆心4.水平抛出一物体,若不计空气阻力,则在运动相等的时间内,物体的速度变化( ) A .大小和方向都不同 B .大小相同,方向不同 C .大小不同,方向相同 D .大小和方向都相同5.如图1所示,过竖直圆的最低点A 引AB 和AC 两条弦,AB AC >,由弦的B C 、两端各有一质点由静止释放,不计一切摩擦,沿BA 弦和CA 弦下滑到A 端的时间分别为1t 和2t ,则( )A .12t t >B .12t t <C .12t t ≠D .以上都不对6.如图2所示,一开有V 型光滑槽的滑块,槽内放有一球,两者相对静止一起沿水平地面向右做匀加速直线运动,运动中槽的竖直壁AC 对球的作用力为1F ,另一槽壁BC 对球的作用力为2F .若增大滑块运动的加速度,则槽壁对球的作用力( )A .1F 增大,2F 减小B .1F 和2F 都增大C .1F 不变,2F 减小D .1F 增大,2F 不变7.如图3所示,A B 、两个木块质量分别为1m 和2m ,它们靠在一起沿斜面加速下滑.若A B 、与斜面间的动摩擦因数相同,则下滑中A B 、之间有无相互作用力?( )A .若12m m =,AB 、间无相互作用力 B .若12m m =,A B 、间有相互作用力C .若12m m >,A B 、间无相互作用力D .若12m m <,A B 、间有相互作用力8.如图4所示,一只船渡河时,沿一直线轨迹由一岸的A 处匀速驶向对岸B 处,直线AB 与河岸成37︒角.若河中水流速度处处相等,均为2m/s ,则船从A 处开出的最小速度为( )A .0.6m/sB .0.75m/sC .1.2m/sD .1.5m/s9.在倾角为30︒的斜面上,质量为1kg 的物块在平行斜面的力F 作用下处于静止状态.若斜面对物块静摩擦力的大小为7N ,取210m/s g =,则力F 的大小可能为( ) A .2NB .4NC .8ND .12N10.如图5所示,一航天器沿圆轨道绕地球运行,航天器上装有两个小型喷气发动机1P 和2P ,1P 的喷口指向航天器运行方向,2P 的喷口指向航天器运行反方向.现要调整航天器轨道的高度,为此需开动喷气发动机1P 或2P ,则( )A .要提升轨道高度,应开动1PB .要提升轨道高度,应开动2PC .要降低轨道高度,应开动1PD.要降低轨道高度,应开动2P11.在地球赤道某处地面上放有一小物块.设想如果地球只对这个小物块的引力突然消失,则在一段时间内处于该处的人看到小物块运动的情况是()A.水平向东飞去B.静止不动C.向上并逐渐偏向西运动D.向上并逐渐偏向东运动二、填空题12.万有引力定律的内容用文字表述是:___________________________________________________ _______________________________________________________________________________________.13.物块由A到B做匀加速直线运动,运动中物体通过AB,运动一半时间的速度为2m/s,则物体通过A点的速度为__________,通过B点的速度为_____________.14.对竖直下落的小球拍得一张如图6所示的闪光照片.已知闪光的时间间隔1s30t∆=,用刻度尺测出照片上球相邻位置间的距离17.70cmS=,213.09cmS=,由此可求出小球下落的加速度为______2m/s.15.将一石子竖直上抛,不计空气阻力,若把石子上升运动的位移三等分,则石子依次通过这三段位移的时间之比为______________________.16.一位同学向空中抛出一质量为m的球,抛出时手距水平地面的高度为h,球出手的速度为v,设球运动中受到空气阻力的大小恒为()mg1f k k=<,球落地弹起过程能量损失可忽略不计,则球最终在地面上停止运动前在空中通过的总路程S=_______________.17.如图7所示,原长为10cm的轻弹簧AO,竖直固定在水平地面上,上端跟一小球连在一起.当小球静止时,弹簧长度为BO.再用手向下按小球,使弹簧长度压缩至CO.然后突然松手,小球向上运动到最高点时,弹簧的长度为DO.在小球由位置C经位置B、位置A到达位置D的过程中,对小球弹簧系统来说,动能最大的位置是_______,重力势能与弹性势能之和最大的位置是___________.18.如图8所示,三角形木块B斜面倾角为37︒,斜面上放一质量为1kg的木块A,当A B、保持相对静止一起以25m/s的加速度向左匀加速运动时,斜面对木块A的支持力为______N,静摩擦力为______N.(210m/s g =,sin 370.6︒=,cos370.8︒=)19.甲、乙两辆汽车相隔栅状护栏分别在辅路和主路上同向匀速行驶.护栏栅的间隔约为20cm .甲车以30km/h 的速度行驶,车中的乘客透过栏栅观看乙车,发现乙车行驶的稍快,但其车轮(如图9所示)似乎“没有转动”.目测乙车的车轮半径约为30cm ,相同的辐条有8根.由此可计算出乙车的行驶速度约为________km/h .三、计算题20.从地面竖直向上发射一实验火箭,当燃料耗尽时火箭离地面的高度为28m ,之后再经16s 火箭落到地面上.不计空气阻力,210m/s g =.求:(1)燃料耗尽时火箭的速度.(2)火箭达到的最大高度.21.如图10所示,木板AB 沿水平地面始终以加速度a 做匀加速直线运动.当木板速度增至v 时,将一小物块无初速地放于木板A 端.物块与木板间的动摩擦因数为()g a μμ>,要使物块不会从木板上滑出,求木板的最小长度0L .22.用传送带往粮库上层运送粮食.已知传送带长20m ,水平仰角37︒,在电动机带动下以1.2m/s 的速度匀速运行.若每个粮包的质量为50kg ,粮包与传送带间的动摩擦因数为0.8.(210m/s g =) (1)现把一个粮包无初速地放在传送带下端,求将它运送到传送带上端电动机需做多少功?(不考虑电动机和传送装置的损耗)(2)若把传送带的运行速度增为2.4m/s ,传送一个粮包电动机又需做多少功? (3)对(1)、(2)做功情况作一对比,从功与能量变化的角度能看出什么问题?23.已知从地球上观看太阳的视角(人眼观看太阳直径边缘两点的视线所夹的角度,用弧度计量)与θ.地球每1︒经线的长度为l .地球表面处重力加速度为g .地球绕太阳运行的周期为T .试利用上述条件估算太阳的平均密度与地球的平均密度之比.第22届北京市高一物理(力学)竞赛预赛试题参考答案一、选择题二、填空题12.自然界中任何两个物体都相互吸引,引力的大小与物体的质量的乘积成正比,与它们之间距离的二次方成反比; 13.1m/s ,3m/s ; 14.9.70;15.)11∶或1; 16.2012v h K g ⎛⎫+ ⎪⎝⎭17.B ,CD 18.11,2; 19.35三、计算题20.解:(1)设燃料耗尽时火箭的速度为1v ,之后火箭以速度1v 做上抛运动2111128101678m/s 162v v -=⨯-⨯⨯=(2)火箭以速度1v 做上抛运动可上升的最大高度为221 3.010m 2m v h g==⨯火箭达到的距地面的最大高度 228 3.310m m m H h =+=⨯21.解:设物块的质量为m ,经时间t 物块运动到木板B 端,物块的位移和末速分别为1mgv t gt mμμ==2211122mg s t gt m μμ== 时间t 内木板的位移和末速分别为2v v at =+2212s vt at =+若物块刚好未从木板B 端滑出,则有12v v = 210s s L =+即 gt v at μ=+2201122vt at gt L μ+=+解得 ()202v L g a μ=-22.(1):传送中粮包被加速过程加速度 cos37sin37mg mg a mμ︒-︒=()2cos37sin370.4m/s g μ=︒-︒=加速时间 3s vt a== 粮包与传送带相对滑动产生的热量2cos37576J 2v Q mg vt a μ⎛⎫=︒-= ⎪⎝⎭粮包运送到传送带上端增加的机械能()21sin37600036J 6036J 2E mgL mv ∆=︒+=+=电动机做的功 36.610J W E Q =∆+=⨯ (2)传送带运行速度增为 2.4m/s u = 加速时间 6s ut a'== 产生的热量 2cos372304J 2u Q mg ut a μ⎛⎫'=︒'-= ⎪⎝⎭粮包增加的机械能()21sin376000144J 6144J 2E mgL mu ∆'=︒+=+=电动机做的功 38.410J W E Q '=∆'+'=⨯比较(1)(2)可以看出①电动机做功消耗的电能主要用来增加粮包的重力势能.②增大传送带运行速度,产生的热量和粮包增加的动能都增为原来4倍,仅从这个意义上讲,传送带的运行速度不宜过大.23.解:设地球质量为1M ,半径为1R ,绕太阳运行的轨道半径为r ;太阳质量为2M ,半径为2R . 由经线1︒的长度为l 有111802π360πlR lR ==由地面处重力加速度有2211221180πGM l g g M R G==地球平均密度为11314240π3M gGl R ρ== 由观看太阳的视角为θ有2222r R r R θθ==由地球绕太阳运行有2211224πM M G M r r T== 23224πr M GT =太阳平均密度为22233224π4π3M GT R ρθ== 太阳和地球平均密度之比为22315760πl gT ρρθ=。
全国第22届初中化学学生素质和实验能力竞赛“天原杯”复赛试题

全国第22届初中化学学生素质和实验能力竞赛“天原杯”复赛试题可能用到的相对原子质量H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Ca:40Fe:56 Cu:64 Zn:65 Ag:108 Cd:112 Sn:119 Ba:137 Pb:207 Si:28一、选择题(本题包括15个小题,每小题2分,共30分。
每小题有1个或2个选项符合题意。
1.我国“化学”一词最早出于《化学鉴原》(1871年)。
该书把一种元素翻译为“矽(xi)”。
在地壳里,“矽”的含量在所有元素含量中占第二位,现代把这种“矽”元素命名为A .锡 B.硒 C.氧 D.硅2.人们可从铁钛矿(主要成分FeTiO3)制取金属钛(Ti),其在一定条件下的主要反应有:①FeTiO3+H2 = Fe+TiO2+H2O;②TiO2+2C+2Cl2=TiCl4+2CO;③TiCl4+2Mg=2MgCl2+Ti下列叙述正确的是A . 反应①中的H2被氧化 B. 反应②中钛元素的化合价升高C. 反应③是复分解反应D. 反应②Cl2中的“Cl”得到电子3.正常人胃液的pH在0.3~1.2之间。
用以治疗胃酸过多的药物中常含MgCO3、NaHCO3、酒石酸钠等,这主要是由于A.碳酸、酒石酸都不是强酸B.酒石酸是营养品C.Na2+、Mg2+都是人体必需的元素D . MgCO3、NaHCO3与胃酸作用生成CO2,服药后有喝汽水的感觉4.下列制取物质的设计中,不可能...实现的是5.两个或多个同种含氧酸分子之间可以脱水形成相对分子质量更大的酸,如磷酸H3PO4可形成H4P2O7或H5P3O10等。
下列物质不属于硫酸(H2SO4)脱水后形成的是A. H2S2O7B. H2S3O10C. H2S2O8D. H2S4O136.“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。
[实用参考]高中物理竞赛第17届到26届预赛试题及答案.doc
![[实用参考]高中物理竞赛第17届到26届预赛试题及答案.doc](https://img.taocdn.com/s3/m/085c68630722192e4536f695.png)
第17届到第26届高中全国物理奥赛预赛试题汇集第17届全国中学生物理竞赛第18届全国中学生物理竞赛第19届全国中学生物理竞赛第20届全国中学生物理竞赛第21届全国中学生物理竞赛第22届全国中学生物理竞赛第23届全国中学生物理竞赛第24届全国中学生物理竞赛第25届全国中学生物理竞赛第26届全国中学生物理竞赛第十G届全国中学生物理竞赛预赛试卷全卷共八题,总分为140分。
一、(10分)1.(5分)1978年在湖北省发掘了一座战国早期(距今大约2400多年前)曾国国君的墓葬一一一曾侯乙墓,出土的众多墓葬品中被称为中国古代文明辉煌的象征的是一组青铜铸造的编钟乐器(共64件),敲击每个编钟时,能发出音域宽广、频率准确的不同音调。
与铸造的普通圆钟不同,圆钟的横截面呈圆形,每个编钟的横截面均呈杏仁状。
图1为圆钟截面的,图2为编钟的截面,分别敲击两个钟的A、B、C和D、E、F三个部位,则圆钟可发出___个基频的音调,编钟可发出___个基频的音调。
2、我国在1999年11月20日用新型运载火箭成功地发射了一艘实验航天飞行器,它被命名为____号,它的目的是为____作准备。
二、一半径为R=1.00m的水平光滑圆桌面,圆心为O,有一竖直的立柱固定在桌面上的圆心附近,立柱与桌面的交线是一条凸的平滑的封闭曲线C,如图所示。
一根不可伸长的柔软的细轻绳,一端固定在封闭曲线上的某一点,另一端系一质量为m=7.5×10-2Kg的小物块。
将小物块放在桌面上并把绳拉直,再给小物块一个方向与绳垂直大小为v0=4.0ms-1的初速度。
物块在桌面上运动时,绳将缠绕在立柱上。
已知当绳的张力为T0=2.0N时,绳即断开,在绳断开前物块始终在桌面上运动.1.问绳刚要断开时,绳的伸直部分的长度为多少?2.若绳刚要断开时,桌面圆心O到绳的伸直部分与封闭曲线的接触点的连线正好与绳的伸直部分垂直,问物块的落地点到桌面圆心O的水平距离为多少?已知桌面高度H=0.80m.物块在桌面上运动时未与立柱相碰.取重力加速度大小为10m/s2.三、(15分)有一水平放置的平行平面玻璃板H,厚3.0cm,折射率n=1.5。
第22届初中化学学生素质和实验能力竞赛“海桂杯”复赛试题

第22届初中化学学生素质和实验能力竞赛“海桂杯”复赛试题题号一二三四总分得分说明:1.本试卷共9页,满分108分.(附加题供选用)2.可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Si:28 S:32 Cl:35.5 K:39Ca:40 Fe:56 Cu:64 Zn:65 Ba:1373.考试时间:2小时得分评卷人一、选择题(本题包括15个小题,每小题2分,共30分.每小题有1个或2个选项符合题意.若有两个答案的错1个不得分,漏选1个扣1分.请将答案填在下题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 答案1.核电荷数为1~18的X、Y两元素,X元素原子的最外层电子数与次外层电子数差的绝对值等于电子层数;Y元素比X元素的原子多2个最外层电子,则X与Y不可能形成的化合物是……()A.XY B.XY2 C.XY5 D.X2Y2.某电镀厂排出的酸性污水中,含有有毒的Cu2+,欲除去Cu2+并降低污水的酸性,加入下列适量的物质时,不能达到目的的是………………………………………………………………………()A.纯碱 B.生石灰 C.食盐 D.氧化铁3.可以用水去扑灭着火的物质是……………………………………………………………………()①汽油、酒精;②煤气、天然气;③重要药品和实验记录资料;④金属钾和钠;⑤木桌、煤块;⑥电线线路A.仅①②⑤ B.仅③④⑤⑥C.①②③④⑤⑥D.仅⑤4.(08上海卷)已知气体的相对分子质量越小,扩散速度越快.右图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环.下列关于甲、乙的判断正确的是…………………………()A.甲是浓氨水,乙是浓硫酸B.甲是浓盐酸,乙是浓氨水C.甲是浓氨水,乙是浓盐酸D.甲是浓硝酸,乙是浓氨水5.在“绿色化学工艺”中,最好是反应物中原子全部转化为欲制得的产物,即原子的利用率为100%.在用C3H4(丙炔)合成C5H8O2(2-甲基丙烯酸甲酯)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是……………………………………………………………………()A.CO和CH3OH B.CO2和H2O C.H2和CO D.CH3OH和H26.向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正确的是【提示:NaOH由Na+和OH-构成,NaOH溶于水时Na+和OH-分散到水分子之间】………………()A.溶液中的Na+总数不变 B.单位体积内的OH-数目不变C.溶质的质量分数不变 D.溶液的质量不变7.在天平的两个托盘里,分别放上等重的两烧杯并分别加入等质量的稀硫酸,往左杯里放入0.44克氧化钙,要使天平重新达到平衡,可以往右杯里加入的适宜物质是().A.0.48克镁粉B.1.00克碳酸钙C.0.924克碳酸镁D.0.44克铜铝合金8.(09)—定质量某硝酸钾样品中不含可溶性杂质.在10℃时加蒸馏水使之充分溶解,残留固体的质量为250g.若该实验在40℃下进行时,残留固体质量为120g;70℃时为20g.已知KNO3在不同温度下的溶解度如下.A、该硝酸钾样品为纯净物B、40℃时溶于水的硝酸钾为130gC、70℃时KNO3溶液为饱和溶液D、55℃左右时KNO3完全溶解9.(2006年)把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应下列说法正确的是………………………………………………………………………………()A、物质C一定是化合物,物质D可能是单质B、反应后密闭容器中A的质量为19.7gC、反应过程中,物质B和物质D变化的质量比为87∶36D、若物质A与物质C的相对分子质量之比为194∶216,则反应中A和C的化学计量数之比为1∶210.t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4·5H2O晶体析出,则m的取值范围是………………………………………………( )A 18g≤m≤128gB 36g<m<180gC 18g<m<128gD 36g≤m≤180g11.向含AgNO3、Cu(NO3)2 、Mg(NO3)2混合液中,加入一定量的锌粒,充分反应后过滤,向滤液中加稀盐酸,没有白色沉淀产生.则滤渣可能是…………………………………………………………()A.只含有银;B.一定含有银,可能含有铜和锌;C.一定含有银和铜,可能含有锌;D.一定含有银、铜、锌,一定没有镁.12.某K2CO3样品,一定含Na2CO3、KNO3和Ba(NO3)2杂质中的一种或两种,将13.2g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀,对样品所含杂质的正确判断是( )A.肯定有KNO3B.肯定有KNO3,还可能有Na2CO3C.一定没有Ba(NO3)2,可能KNO3D.肯定没有Na2CO3和Ba(NO3)213.某城市有甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子):Ag+、Ba2+、Na+、C1-、SO42-、NO3-.若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便会变成无色澄清只含硝酸钠而排放,污染程度会大大降低.关于污染源的分析,你认为正确的是……………………………………………………………………………………( ) A.SO42-和NO3-可能来自同一工厂B.Cl-和NO3-一定不在同一工厂C.Ag+和Na+可能在同一工厂D.Na+和NO3-来自同一工厂14.(2011上海)草酸晶体(H2C2O4·2H2O) 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2.用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去) ( )15.为了发展低碳经济,最近有科学家提出“绿色自由”构想:把空气吹入饱和碳酸钾溶液中生成KHCO 3,然后利用KHCO 3受热易分解产生CO 2的性质,把CO 2从溶液中提取出来,再经化学反应使之变为可再生燃料甲醇.“绿色自由”构想的技术流程如下:则下列有关说法中,错误..的是……………………………………………………………………( ) A .吸收池发生的主要反应为CO 2+K 2CO 3+H 2O =2KHCO 3B .分解池发生的主要反应为2KHCO 3====K 2CO3+CO 2↑+H 2O C .由分解池分解后所得溶液X 可通入吸收池再利用,其主要成分是KHCO 3D .合成塔中发生反应的化学方程式为2H 2+CO 2====================CH 4O (甲醇)二、填空题(本题包括7个小题,共43分)16.(2009年)现有X 、Y 、Z 三种元素,其中X 原子核内只有一个质子;Y 原子L 层电子数是K 层电子数的2倍;X 与Z 形成的化合物的分子式为ZX 3,每个分子内有10个电子.请回答下列问题:(1)写出Z 元素的原子结构示意图__________;X 分别与Y 、Z 形成的化合物中,具有5个原子核的微粒的化学式为________________.(2)某些常见物质可用来合成新材料,如利用高温高压法使石墨转变为人造金刚石.科学家认为Y 、Z 元素可形成一种比金刚石更硬的化合物,后来人们在实验室成功合成了含有这些元素的化合物(制作晶体薄膜材料),这种化合物的化学式是________;试推测合成这种化合物所需的条件是________.17.由新型无机非金属材料制成的新型发动机,热效率高、寿命长.这类材料中研究较多的是化合物G.化合物G 的相对分子质量为140,含有硅元素,其质量分数为60%,另含有元素Y.化合物E(含两种元素)与NH 3反应制得G 和HCl. (1)G 和E 的化学式分别为_________、________.(2)粉末状G 能够与氧气在高温下反应,所得产物中有一种是空气的主要成分,另一种是氧化物,该过程的化学方程式为___________.(3)常压的条件下向G 中添加氧化铝,经高温烧结制成一种高强度、超硬度、耐磨损、抗腐蚀的陶瓷材料“赛伦”,化学式可表示为Si 6-x Al x O x Y 8-x .不同温度下x 的值不同,在1400℃时x 为2.0,则“赛伦”中Y 元素的化合价为___________.18.烟道气中含有CO 2、CO 、N 2、O 2和其他一些杂质.为测定其中各气体的含量,先把有害气体和其他杂质除得分 评卷人△ 2×105Pa 、300℃,铬锌触媒去,使气体仅为上述四种气体的混合物.在测定时,用不同的试剂按一定顺序从混合气中分别吸收各种气体,最后剩下的是不能吸收的N2,通过每次吸收前后气体体积变化的数据按一定的计算方法求出气体分别的含量.已知:①吸收O2用苯三酚的碱性溶液,它可以把O2吸收得相当完全.②用CuCl的氨溶液吸收CO,为防止CuCl的氧化,在该溶液中加一些铜丝.这样吸收CO效率很高.③用KOH吸收CO2,非常完全.④N2不被吸收,最后剩余的气体中有它.试回答:(1)为防止干扰,吸收的气体先后顺序为(2)若把吸收CO2与吸收O2的顺序颠倒,会引起的后果(3)若把吸收O2与吸收CO的顺序颠倒,会产生的后果(4)通过吸收CO2、CO、O2各试剂后剩余气体有三种,并检测得他们有三种元素,他们是(5)为准确测定剩余气体中N2的体积,还要将该气体用处理后,才能检测出N2的体积.19.若从H2SO4、Na2CO3、Na2SO4、NaCl、NaNO3、Cu(NO3)2、HNO3七种溶液中取出其中的两种,进行混合及有关实验,所观察到的现象记录如下表.试根据各步实验及其现象先进行分步推断,再推断所取的两种溶液的步骤实验操作实验现象推断(或结论)(1) 将取出的两种溶液混合混合溶液无色、澄清混合液中肯定不含:Cu(NO3)2无明显现象混合溶液肯定不是下列组合:(2) 用pH试纸测定混合溶液的pH 测定结果:pH=2(3) 向混合溶液中滴入足量Ba(NO3)2溶液有白色溶液出现(4) 向上述过滤所得的滤液中滴加AgNO3溶液无明显现象混合溶液的可能组合(写出溶质的化学式,有几组写几组) ①______________________________________②______________________________________③______________________________________④______________________________________20.某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案:试回答:(1)步骤①中锌粉必须过量的原因是 .(2)写出步骤①中任一反应的化学方程式 .(3)要检验步骤④中加入的稀硫酸是否足量的方法是.(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量 (填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量 的质量.21.(哈尔滨三中、东北育才、大连育明、天津耀华2011年四校第一次模拟)纯碱一直以来都是工业生产的重要原料,很长一段时间来纯碱的制法都被欧美国家所垄断.上个世纪初我国著名的工业化学家侯德榜先生,经过数年的反复研究终于发明了优于欧美制碱技术的联合制碱法(又称侯氏制碱法).并在天津建造⑴侯德榜选择天津作为制碱厂的厂址有何便利条件(举二例说明) 、 .⑵合成氨工厂需要向制碱厂提供两种原料气体,它们分别是: 、 .(填化学式)这两种气体在使用过程中是否需要考虑添加的顺序: (填“是”或“否”),原因是: .⑶在沉淀池中发生的反应的化学方程式是: . ⑷使原料水中溶质的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环.从母液中可以提取的副产品的应用是 (举一例).22.(2008年)某实验小组欲证明氧化铜能加快氯酸钾的分解,他们进行了如下实验: ① 称取x g 胆矾晶体,研细后加入10 mL 蒸馏水溶解;② 将足量的NaOH 溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀; ③ 将所得沉淀转移到坩埚中,均匀缓慢加热至完全变为黑色, 研细备用;④ 按下表中的质量混合好固体后,在相同条件下加热,并与MnO 2的催化效果做比较,实验时间均以生成50 mL 气体为准(见图甲),其他可能影响实验的因素均忽略.编号 KClO 3质量(g)其他物质质量(g) 待测数据1 2.0 ∕2 2.0 CuO 0.5 32.0MnO 2 0.5回答下列问题: (1)步骤①中的x 应至少称取 g (结果保留1位小数),上述实验步骤中需要使用玻璃棒的是(填序号).(2)表格中的“待测数据”是指 .(3)为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意 (填字母编号).a .视线与凹液面最低处相平b .读数前不能移动量气管和水准管c .保持水准管静止,待水准管中液面不再上升时,立刻读数XNa 2CO 3X 原料水循环II循环I母液煅烧炉合成氨厂沉淀池YY(提取副产品)d.读数前应上下移动水准管,待两管液面相平再读数(4)若50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A为20,则此时气体的读数为 .(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.(提示:可从催化剂的概实验步骤设计这一步骤的目的实验表明,加入CuO后产生O2的速率比未加入时快得多CuO能加快KClO3的分解三、实验题(本题包括3个小题,共17分)23.某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.(1)实验时除需测定粗锌的质量、氢气的体积之外,是否还需要其他物理量?如需要,请指出___________________________,否则,此空不填.(2)实验时在检查装置气密性后,如何将试剂加入试管并使反应开始?___________________________________________________________________________________________ _____________(3)以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积.这三步操作的正确顺序是:________________________(请填写步骤代号).(4)测量收集到气体体积(图中夹持仪器已省略)时,如何使量筒内外液面的高度相同?_____________________________.(5)如果实验中测得粗锌质量为a g,得到的氢气体积是b L(已折算成标准状况,H2密度为p g/ L),水蒸气的影响忽略不计,粗锌中锌的质量分数的计算式为(含a、b,不必化简):_____________________________________________.(6)试根据上述仪器,提出更简捷的实验方案:_______________________________________________________________________________________________________________________________.得分评卷人24.(福建)化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生.牙膏样品中碳酸钙的定量测定利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO沉淀质量,以3确定碳酸钙的质量分数.依据实验过程回答下列问题:(3)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有:________ (4)C中反应生成BaCO3的化学方程式是__________________.(5)下列各项措施中,不能提高测定准确度的是_________(填标号).a.在加入盐酸之前,应排净装置内的CO2气体b.滴加盐酸不宜过快c.在A-B之间增添盛有浓硫酸的洗气装置d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为__________.CO前后的质量差,一样可以确(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收2定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是________________.25.(全国新课标)氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.请回答下列问题:(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_________(请按正确的顺序填入下列步骤的标号).A.加热反应一段时间B.收集气体并检验其纯度C.关闭分液漏斗活塞D.停止加热,充分冷却(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH 2生成.① 写出CaH 2与水反应的化学方程式 ___________________ ②该同学的判断不正确,原因是_________________(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象__________. (5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________.四、计算题(本题包括2个小题,共10分)26.在25℃,101kPa 条件下,将15LO 2通入10LCO 和H 2的混合物中,使其完全燃烧,干燥后,恢复至原来的温度和压强.⑴若剩余气体的体积是15L,则原CO 和H 2的混合气体中V (CO )= L, V (H 2)= L. ⑵若剩余气体的体积是aL,则原CO 和H 2的混合气体中V (CO ):V (H 2)= ⑶若剩余气体的体积是aL,则a 的取值范围是 .27. 在100mL 稀盐酸中加入混合均匀的NaHCO 3和KHCO 3的固体粉末,使之充分反应,下图表示加入粉末的质量与产生气体的质量的关系.请计算:⑴若加入盐酸为140mL,加入粉末为67.5g,产生气体的质量; ⑵若加入盐酸为180mL,加入粉末仍为67.5g,产生气体的质量;五、附加题(8分)28.0.80gCuSO 4·5H 2O 样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示.45气体质量/g请回答下列问题:(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________.把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________.全国初中学生化学素质和实验能力竞赛(第二十届天原杯)复赛试题(海桂杯)答案一、选择题(本题包括15个小题,每小题2分,共30分.每小题有1个或2个选项符合题意.若有两个答案的错1个不得分,漏选1个扣1分.请将答案填在下表相应题号的空格内.)题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15答案 C CD D C AC BC A D AD C BC AB C D CD二、填空题(本题包括8个小题,每空1分,共43分)16.(1); CH4(NH4+也可)(2)C3N4;高温高压17.(1)Si3N4;SiCl4(2)Si3N4 + 3 O2 == 3 SiO2 + 2 N2(3)−318.参考答案:(1)CO2、O2、CO (2)在吸收O2的同时,CO2也被吸收;(3)在吸收CO的同时,O2可以氧化CuCl而被消耗;(4)N2、NH3、H2O (5)浓H2SO4吸收.19.步骤实验操作实验现象推断(或结论)(1) 将取出的两种溶液混合混合溶液无色、澄清混合液中肯定不含:Cu(NO3)2无明显现象混合溶液肯定不是下列组合:H2SO4与Na2CO3或HNO3与Na2CO3(2) 用pH试纸测定混合溶液的pH 测定结果:pH=2 溶液呈酸性,所以一定有酸性物质存在.如H2SO4或HNO3 (3) 向混合溶液中滴入足量Ba(NO3)2溶液有白色溶液出现H2SO4或Na2SO4或 (H2SO4和Na2SO4同时共存)(4) 向上述过滤所得的滤液中滴加AgNO3溶液无明显现象不含NaCl混合溶液的可能组合(写出溶质的化学式,有几组写几组) ① HNO3 H2SO4 ② HNO3 Na2SO4③ H2SO4 Na2SO4 ④ H2SO4 NaNO320.(1)将废液中的Cu和Fe全部置换出来(2)Zn+ CuSO4 = ZnSO4 +Cu (或Fe+CuSO4===Cu+FeSO4)(3)取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)(4)>固体D(或铜)21.答案:⑴原料丰富、运输便利 (其它合理答案均可) ⑵CO2、NH3是氨气在水中溶解度大,先通氨气后通CO2产生碳酸氢铵多,有利于碳酸氢钠析出⑶NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl ⑷循环I 作化肥 (其它合理答案均可)22.(1)1.6 ①②③(2)生成50mL气体所需时间(3)a d (4)20.8 mL(5实验步骤设计这一步骤的目的将加热后残留的固体溶于足量的水,过滤后称重CuO的质量CuO的质量在反应前后是否保持不变将过滤后的CuO重新与KClO3混合加热,观察是否依旧能加快KClO3的分解CuO的化学性质在反应前后是否保持不变三、实验题(本题包括3个小题,共17分)23.答案:11 (1)测定实验时的温度、压强(2)先向试管中加入适量稀硫酸,再将试管倾斜,用镊子将粗锌放在试管口附近,塞好单孔橡皮塞,然后将试管缓缓竖起,使粗锌沿着试管内壁缓缓滑到试管底部.(3)②①③(4)缓缓将量筒下移,使量筒内外液面相平.(5)b L×p g/ L ×65 /2a ×100%(6)使锌与足量稀硫酸充分反应,滤出剩余固体,洗涤、干燥,称量反应前后固体的质量.24.【解析】Ⅱ⑶从装置图分析可知为保证实验的准确性,应将装置内的空气排尽,防止空气中CO 2的干扰;同时要将反应产生的CO 2尽可能的全部被Ba(OH)2溶液吸收,因此需要持续通空气.⑷Ba(OH)2溶液过量,因此反应方程式为CO 2+Ba(OH)2=BaCO 3↓+H 2O(5)在加入盐酸之前,应排净装置内的CO 2气体,会影响测量,滴加盐酸不宜过快,保证生成的CO 2完全被吸收.在A —B 之间增添盛有浓硫酸的洗气装置,因为整个装置中不需要干燥,有水份不会影响CO 2吸收.在B —C 之间增添盛有饱和碳酸氢钠溶液的洗气装置,C 瓶中是足量Ba(OH)2,可以吸收CO 2中的HCl,而不影响CO 2吸收,所以不需要除去CO 2中的HCl,选cd.(6)BaCO 3质量为3.94g ,则m(CaCO 3)质量为2.00g,则样品中碳酸钙的质量分数为25%.此问计算比较简单.(7)Ba(OH)2溶液还吸收了水蒸气、氯化氢气体等,造成质量偏大,所以可以回答B 中的水蒸气、氯化氢气体等进入装置C 中.本题取材牙膏摩擦剂的探究实验,其中第(5)(7)小问出的不错,第(5)小问考查影响实验准确度的因素探讨,对学生的能力有较高的要求.第(7)小问设置有台阶,降低了难度,若将“结果明显偏高增加”设置成填空可能会更好.25.答案:(1)→e,f →d,c →j,k (或k,j )→a ;(2)BADC ;(3)①CaH 2+2H 2O=Ca(OH)2+H 2↑;②金属钙与水反应也有类似现象;(4)取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色.(5)氢化钙是固体,携带方便.四、计算题(本题包括2个小题,共10分)26.⑴5L 、5L ⑵(a-10)/(20-a) ⑶10<a<2027. ⑴粉末过量,气体为30.8g ⑵盐酸过量,气体为33g五、附加题(10分28.解析:(1)0.80gCuSO 4·5H 2O 中含有CuSO 4的质量为g 51.02501608.0=⨯.由图像可知当温度升高到102℃是时CuSO 4·5H 2O 开始部分脱水,在113℃~258℃时剩余固体质量为0.57g,根据原子守恒可计算出此时对应的化学式,设化学式为CuSO 4·nH 2O,则有51.01816016057.0=+⨯n,解得n =1,所以200℃时固体物质的化学式为CuSO 4·H 2O ;(2)由图像可知当温度超过258℃时,剩余物质恰好是CuSO 4,高温下分解的化学方程式是CuSO 4CuO +SO 3↑;CuO 溶于硫酸生成CuSO 4,结晶析出生成胆矾即CuSO 4·5H 2O ;由图像可知CuSO 4·5H 2O 存在的最高温度是102℃;570℃。
2008年第22届“大同杯”初中物理竞赛复赛试卷(解析版)【菁】

2008年上海市第二十二届初中物理竞赛复赛试卷(大同中学杯)参考答案与试题解析一、选择题(以下每题只有一个选项符合题意,每小题4分,共32分)3.(4分)如图所示,斜面上质量为m的物体受到方向沿斜面向上、大小为7N的力F作用物体静止在斜面上,则关于斜面对物体的静摩擦力,以下说法中正确的是()4.(4分)(2007•莆田)给一定质量的水加热,水的温度与时间的关系图象如图中a所示.若其他条件不变,仅将水的质量增加,则水的温度与时间的关系图象正确的是()5.(4分)在大楼电梯的箱顶上用绳悬挂一个物体,电梯静止时剪断悬绳,物体下落至电梯底板所需时间为故选B.点评:本题涉及到的知识面比较广,有串联电路的电流规律、电荷量和电阻率的概念、实际功率的判断.在判断功率时,一般的串联电路用P=I2R比较方便,并联电路用P=比较方便.7.(4分)如图a所示,在一个电阻均匀的金属圆环上有两A、B、C、D四点.其中O为圆心,AB、CD为圆环的两条互相垂直的直径.现把A、B两点接入电源电压保持不变的如图b所示的电路MN两端时,发现电流表示数为I0,当换接A、D两点,则此时电流表的示数应为()A.I/4 B.3I/4 C.I D.4I/3解答:解:设每圆周弧的电阻为R,电源的电压为U(1)把A、B两点接入电源时,ACB弧的电阻与ADB弧的电阻并联,则:R ACB=R ADB=2R,电路中的总电阻R总=R,电流表的示数I==,(2)当换接A、D两点时,ACBD弧的电阻与AD弧的电阻并联,则:R ACBD=3R,R AD=R,电路的总电阻R总′==R,电流表的示数I′===×=I.故选D.点评:本题考查了电阻的串联特点和欧姆定律的计算,关键是能把金属圆环不同的位置接入电路时看成并联8.(4分)如图所示电路,电源电压恒为U=8V,小灯泡上标有“6V,4W”字样,电阻R2=30Ω,闭合电键后,若滑动变阻器R1的滑臂P在离b端1/4处时,小灯泡的实际功率为1W.不考虑电阻随温度的变化,为了使滑臂P左、右移动时,灯泡两端电压不超过额定电压,变阻器R1阻值(有电流部分)的变化范围是()A.0﹣40ΩB.3.4Ω﹣40ΩC.7.5Ω﹣30ΩD.10Ω﹣30Ω解答:解:(1)由灯泡铭牌“6V 4W”知灯泡额定电压与额定功率分别为U额=6V,P额=4W,灯泡电阻R L===9Ω;(2)灯泡实际功率P L=1W时,由P=知:灯泡两端电压U L===3V,电路电流I= ==A,并联电路两端的电压U并=U﹣U L=8V﹣3V=5V,由题意知,滑动变阻器接入电路的阻值R1=R滑,由欧姆定律得:R并===15Ω,由并联电路的特点知:=+,即= +,解得:R滑=40Ω;(3)当灯泡正常发光时电路电流I′===A,并联电压U′并=U﹣U额=8V﹣6V=2V,I2===A,I1=I′﹣I1=A﹣A=A,R′1==≈3.4Ω.(4)变阻器R1阻值的变化范围是3.4Ω~40Ω.故选B.点评:本题考查了功率公式及其变形公式的应用、欧姆定律、串并联电路的特点等内容,计算量大,是一道二、填空题(每小题6分,共30分)9.(6分)有一根长度为L的弹簧,它能承受的最大拉力为F,在最大拉力F的作用下,弹簧伸长了△L.现用剪刀将弹簧剪成长度为L/3和2L/3的两段,则长度为2L/3的弹簧能承受的最大拉力为1F,在这个最大拉力作用下,弹簧伸长了△L.分析:因为弹簧受到拉力作用,各点受到的力大小相等,所以弹簧的伸长是均匀的.解答:解:弹簧能承受的最大拉力为F,各点受到的力大小相等都是F,当将弹簧剪成长度为L/3和2L/3的两段,弹簧能承受的最大拉力是不变的,大小仍为F.因为弹簧受到拉力作用,各点受到的力大小相等,所以弹簧的伸长是均匀的.当弹簧在最大拉力F的作用下,弹簧伸长了△L,所以长度为2L/3的弹簧在这个最大拉力作用下,弹簧伸长是△L.故答案为:1;.点评:解决此题的关键是要知道弹簧受到拉力作用,各点受到的力大小相等,弹簧的伸长是均匀的.10.(6分)一种家用灭蚊器中的电热元件是用钛酸钡材料制成的,它具有控温功能.图2中给出了这种电热元件的电阻随温度变化的曲线.请你根据这条曲线分析,灭蚊器稳定工作时发热元件处于哪个温度区间,环境温度在哪个区间时这种灭蚊器可以正常使用.:图析法.分析:由于家庭电路中的电源电压保持220V恒定不变,根据Q=可知当电阻变小时,单位时间内电流产生的热量变大,电蚊器温度上升加快;反之,当电阻变大时,单位时间内电流产生的热量变小,电蚊器温度上升较慢.所以电热驱蚊器通电后,在t0~t1阶段,随着温度上升,电阻变小,电热变大,温度上升较快;到t1~t2阶段,随着温度上升,电阻变大,电热变小,温度上升减慢,当电流单位时间内产生的热量与电蚊器向周围散发的热量达到平衡时,电蚊器的发热元件温度就不再上升.解答:解:(1)如图所示,当钛酸钡元件的温度T处于T<T<T时,随着温度的上升,电阻减小,电流增11.(6分)洗澡时将11°C的冷水与66°C的热水充分混合成550kg、36°C的温水,在混合的过程中有2.31×106J 的热量损失掉了,则所用冷水为290kg,所用热水为260kg.三、计算题(本题32分)14.(12分)水在热电厂的锅炉中变为水蒸气,通过涡轮机带动发电机发电,用过的水蒸气在液化器中凝结成水,再到锅炉,循环使用.液化器中的冷却水则流到冷却塔中降温,如图所示.水的比热为4.2×103J/(kg•℃),求:(1)夏天,来自冷却塔的水温为16℃,而回到冷却塔的水温为30℃.若冷却塔和液化器间水的流量为15×103kg/s,试求冷却塔的散热功率.(2)如果发电机的发电功率是5.6×105kW,发电机把机械能转化为电能的效率为80%,不计水蒸气通过涡轮机过程中由于热传递造成的能量损失及涡轮机的摩擦,试求水蒸气的能量转化为电能的效率.:计算题;应用题.分析:(1)解决此题,要掌握热量的计算公式:Q=cm△t,据此求出内能的变化量,再利用功率的公式可求出冷却塔的散热功率;(2)要搞清水蒸气的能量转化为电能的效率,是指转化为的电能与消耗水蒸气内能的比值.首先根据发电功率求出发电机的机械功率,总功率为散失的内能的功率和消耗的机械能的功率,而有用功率是转化所得的电能的功率,由η=计算出水蒸气的能量转化为电能的效率.解答:解:(1)冷却塔和液化器间水的流量为15×103kg/s,所以单位时间内,内能变化为:Q=cm(t﹣t0)=4.2×103J/(kg•℃)×15×103kg×(30℃﹣16℃)=8.82×108J;散热的功率:P内===8.82×108W.(2)发电机消耗的机械功率:P机=5.6×108W÷80%=7×108W;由(1)知,单位时间内消耗的内能是:P内=8.82×108W.所以水蒸气的能量转化为电能的效率为:η=×100%=×100%≈35.4%;答:(1)蒸气的能量转化为电能的功率8.82×108W;(2)水蒸气的能量转化为电能的效率为35.4%.点评:本题考查功率、热机效率及能量转化的效率,要求学生能熟练掌握相应公式.15.(10分)让液体在管道中流动,液体可以看作是由片液层组成的,各片液层之间存在着摩擦,产生液体内部的阻力,这就是液体的粘滞性.小王用长度相同的细管来研究液体的粘滞性,在温度相同的情况下,通过实验测得1s内通过细管的液体体积如下:40.5mm3,则细管两端的压强差是多少?(2)由于液体的粘滞性,使得在流体中运动的物体要受到流体阻力,在一般情况下,半径为R的小球以速度v运动时,所受的液体阻力可用公式f=6πηRv表示.一个密度为ρ、半径为R的小球,在密度为ρ0、粘滞系数为η的液体中由静止自由下落时的v﹣t图象如图所示,请推导出速度v r的数学表达式.式化简即可.解答:解:(1)设细管半径为amm,细管两端压强差为b,通过细管的液体体积为cmm3,则根据表中数据有以下规律:对水来说:a4×b×100=c对油来说:a4×b×2=c因此可以得出油细管两端的压强差的关系式是b=,将当细管半径是a=3mm,1s内通过细管的油的体积是c=40.5mm3,代入得b=.(2)小球受到的重力:G=mg=ρVg=43πR3ρg;小球所受浮力:F浮=ρ0Vg=43πR3ρ0g;小球所受流体阻力:f=6πηRv.由图象可知,当小球速度达到vr时便匀速下落,处于平衡状态,此时小球所受合力为零,则G=F浮+f.即:πR3ρg=πR3ρ0g+6πηRvr.化简可得:v r=故答案为:(1),(2).点评:本题是一道阅读信息题,主要是通过文字叙述,从实际情景中挖掘出物理问题,注意类比法的运用和16.(10分)如图所示是一种水闸,闸门的底部与铰轴O相连,厚度不计的闸门高为H、宽为a.AB为一根不计质量的杆,A端通过铰链与闸门相连,B端通过铰链与地面相连.杆AB与地面成60°角,A端距离地面高h.已知水的密度为ρ,试求杆AB对闸门的作用力.以此两力相等,得出水对闸门的推力就能得到杆对闸门的作用力.解答:解:闸门受到水的压强为p=ρgH,闸门受到水的压力为F=pS=ρgH×aH=.设杆对闸门的压力为F杆,闸门左右两边所受压力相同,将闸门看做以O为支点的杠杆,根据杠杆的平衡条件得F杆×H×cos60°=×,化简得F杆=.答:杆AB对闸门的作用力为.点评:解决此题运用的是转换法.此题中水对闸门的压力从上到下逐渐,其合力的作用点确定为本题的难点18.(6分)如图a所示是一个用不变形的硬纸片环(图中灰色部分)和橡皮筋(图中轮辐部分)制成的转盘,橡皮筋一端与转盘的中心轴相连且均绷紧.现将转盘的中心轴水平放置在支架上,如图b所示,使转盘处于竖直平面内.(1)通过怎样的操作,可以判断转盘的重心恰好在中心轴上?(2)将一个发光的白炽灯泡,靠近放在图a中转轴右侧水平橡皮筋附近,你会看到什么现象?并简述产生这一现象的原理.五、判断与说理题(本题共44分)19.(14分)(1)小王同学为了测量积雪的密度,设计了“根据雪地上的脚印深度进行估测”的方法.他采用的方法是:利用一块平整地面上的积雪,用脚竖直向下踩在雪上,形成一个向下凹的脚印.然后通过测量积雪原来的厚度H,用脚踩后在雪上形成脚印的深度h,就可以估测雪的密度.请通过推导得出雪的密度的计算表达式.(2)大雪过后,会造成路面积雪和积水,危及交通安全.为了尽快消除路面积水,可以通过撒盐和铺设防滑物以及组织扫雪等措施.下表反映的是盐的浓度与凝固温度之间的关系,利用这一表格,请你估计当桥面上某型号的履带式雪地车的每根履带宽为d,空载时与雪地接触的压强为p0.(a)当雪地车以速度v在雪地上匀速行驶时,在雪层上造成的雪沟深度为h.试估算此时雪地车克服雪层阻力做功的功率P.(b)假设雪地车挤压雪层形成的雪沟深度与压强成正比.当雪地车所载货物的重力为雪地车空载时自重的1/4,则仍以功率P在雪地上匀速行驶时的速度为多大?(2)已知冰雪的凝固温度和对应的盐水浓度,只要得出此时每平方米水的质量就能得出需要的食盐的质量.(3)(a)已知雪地车在雪地上的速度,可以知道在一定时间内行驶的距离;已知履带的宽度和行驶的距离,可以知道雪地车碾过雪地的面积;已知雪地车对雪地的压强和碾过雪地的面积,可以得到雪地车对雪地的压力;已知对雪地的压力和雪沟深度,可以得到雪地车对雪地所做的功;最后利用P=得出克服雪地阻力的功率.(b)在车轮与雪地接触面积一定时,雪地车对雪地的压强与物重成正比,所以压强增大的程度与车重增加的程度相同;根据前后两次功率一定列出方程,就能得出此时的速度.解答:解:(1)雪被踩后成为冰,密度是0.9g/cm3设脚印的面积为S,则雪的体积V雪=SH,冰的体积V冰=S(H﹣h)根据密度公式ρ=得==∴ρ雪=(2)由表格知:﹣3°C时应撒盐的浓度为5%,设每平方米的水的质量为m,则有m=ρ水V水=1000kg/m3×1m2×0.02m=20kg所以撒盐的质量为m盐=20kg×5%=1kg(3)(a)设雪地车在雪地行驶的时间为t则t时间内前进的距离L=vt压下雪的面积S=L2d=2vtd压力做功W=Fh=pSh=p0×2vtd×h=2p0vtdh∴功率P===2p0vdh(b)已知重力增加,所以雪地车对雪地的压强增大,雪地车克服雪地阻力的功率一定设此时雪地车行驶的速度为v′根据题意得2p0vdh=2(p0+)v'h解得v'=.答:(1)雪的密度表达式为ρ雪=;(2)每平方米需撒盐1kg;(3)(a)雪地车克服阻力的功率为2dp0hv;(b)雪地车仍以功率P在雪地上匀速行驶时的速度为.点评:此题是力学中的一道综合题,难度很大.解决的关键是在掌握基本物理规律的基础上找准等量关系,20.(6分)将一个电磁铁和白炽灯并联后接入电路,如图a所示,当闭合电键时,灯L1即刻点亮,随后熄灭;当断开电键时,灯会闪亮后熄灭.(1)此现象说明当闭合电键时,流过电磁铁的电流变化是逐渐增大;当断开电键时,流过电磁铁的电流变化是逐渐减小.(2)在图b中,当电磁铁中无电流时,铁质弹簧片的可动端与右侧接线柱接通;当电磁铁中有电流时,在电磁铁的吸引下,铁质弹簧片的可动端与左侧接线柱接通.试用笔线代替导线,完成电路连线,使电路中的电键闭合后,灯L1、L2会交替发光.点评:(1)了解电磁铁是一个特殊的储能元件,再根据并联电路电流的特点,才是顺利解答前两个问题的21.(12分)如图为一种电磁继电开关,图中L为电磁铁线圈.L不通电时,继电器不吸合,如图a所示,三对常闭接点A1与A1’接通,A2与A2’接通,A3与A3’接通;三对常开接点B1与B1’、B2与B2’、B3与B3’均不相通.L通电时,继电器吸合,如图b所示,三对常闭接点A1与A1’、A2与A2’、A3与A3’均不相通;三对常开接点B1与B1’、B2与B2’、B3与B3’均接通.某学校学生社团有一台用上述电磁继电开关成的智力竞赛的抢答显示系统(抢答机),如图c所示.图中S1、S2、S0是按钮式开关按下时接通,松手时自动弹起为断开,该抢答机可供两个参赛队使用.主持人宣布问题,然后说“现在开始”以后,最先按下按钮的队的指示灯点亮,其余任何一个队再按按钮则无任何反应,而亮灯的队松开按钮后其指示灯依然点亮.若在主持人说“现在开始”前任何一个队违规提前按按钮,导致自己的指示灯点亮,主持人即可判定该队犯规.为了解除某队指示灯点亮状态,主持人只需按一下自己操作台上的按钮S0,即可恢复初始的待命状态.(1)当按一下S2后,用若干个箭头标明电路中电流的走向.(2)现在为满足三个队参加比赛,必须增加一个供第三队使用的线路,为此需将原线路改装,技术人员已经将部分线路连好,如图d所示,请你将尚未完成的接线继续接妥,使其整体成为一台供三个队参赛的抢答机.当一个队按下开关时,要切断其他队的电磁铁线圈电路.解答:(1)根据电路中的电流方向是从电池的正极出来,回到负极,L通电时,继电器吸合,如图b所示,三对常闭接点A1与A1’、A2与A2’、A3与A3’均不相通;三对常开接点B1与B1’、B2与B2’、B3与B3’均接通,画出电流方向.如图:(2)根据抢答机的用途,当一个队按下开关时,其余任何一个队再按按钮则无任何反应,这就要求当一个队按下开关时,要切断其他队的电磁铁线圈电路.即每一个电磁铁线圈电路都要经过其他两个的常闭接点,当其中一个队的开关闭合时,其他两的常闭接点断开,使其他两个电磁铁线圈断路,所以连接如图:点评:本题考查了电流方向的判断及串、并联电路的设计,其中串、并联电路的设计是一个难点,需要明确22.(12分)有一根重1000N的均匀铁棒,平放在水平地面上,有一端要微微抬起一些,则所需的力是500 N.作用在一端,利用杠杆的平衡条件来分析即可.解答:解:由题意知,此时可以将铁棒看做是一个以铁棒没有离地端为支点的杠杆,阻力是铁棒的重力为1000N,由于铁棒是均匀的,所以动力臂等于铁棒长L.阻力臂是棒长的一半,根据杠杆的平衡条件F1=,即可求得动力F1为500N.故答案为:500.点评:将铁棒看做是一个杠杆是解决此题的关键.若抬起一个粗细不均匀的铁棒,抬起粗端与细端所用力的。
第22届国际生物学奥林匹克竞赛试题实验 4.植物解剖学、生理学和遗传学

的生 境 。在答 题 纸 正 确 答 案 上 画 X号 。
正 确 错 误
上 表 皮 有 几 个 或 没 有 气 L
下 表 皮 有 许 多 气 孔 水 生 植 物
植 物 V 和 W 茎 中维 管 束 的分 布 模 式 是 什 么 ? 在 答 题 纸 的 正 确答 案上 画 X 号 。
切片上 , 并 盖 上 盖 玻 片 。你 需 要 确 定 植 物 V 和 W
6 0
生
物
学
通
报
2 0 1 3年 第 4 8卷 第 1 1 期
是 单 子叶植 物 还 是双 子 叶植 物 , 再 回答 问题 。在 显 微镜 下 观察 , 并 回答 如下 问题 。 当你完 成 该部 分 后 , 将你 的装 片连 同切 片 置 于模 板纸 上 。举 牌 。 实验 室
切片 Z
Q. 1 . A. 2 . 根 中 初 生 木 质 部 成 熟 方 向是 什 么 ( 组 织 成 熟 较 早一 组 织 成 熟 较 晚 ) ? 在答 题 纸 上 正 确 答
案上 画 X号 。( 单 选题 , 4分 )
3 . 透 明 指 甲油 ( 盒子中 ) 4 . 在 装 片盒 K 中有植 物 K的根 部 的装 片 X、 Y 和Z
◎
介 绍
的 制 片 和 用 于 记 录
部 分 A: 植 物 根 的结 构 ( 1 0分 ) 介 绍
1 张
从 植 物 v 和 w 茎 段 仔 细 制 备 适 当厚 度 的横
切片 , 然 后 分 别 置 于不 同 的载 玻 片 上 。 加 1滴 水 到
有 3个 装 片 是植 物 K 的根 部 不 同 区域 的横 切
… ,
2009第22届中国化学会全国高中生化学竞赛(省级赛区)试卷及答案

第1题 (20分)1-1 F 4Si -N(CH 3)3 + BF 3 → F 3B -N(CH 3)3 + SiF 4 ; F 3B -N(CH 3)3 + BCl 3 → Cl 3B -N(CH 3)3 + BF 3BCl 3 > BF 3 > SiF 4 顺序错误不给分 (2分) 1-2 (1)BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分) sp 2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分) sp 3(0.5分)(2)CH 3H 3C H 3CFB FF B :sp 3 (1分)+ (1分)CH 3H 3C H 3CFFFFSi ,sp 3d (1分)+ (1分)1-3 BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5或BCl 3 +N=Cl 3N(1分)1-4BeCl Clsp结构简式和杂化轨道各0.5分 (1分)BeClBeClClCl结构简式1.5分sp 2杂化轨道0.5分 (2分)ClBeCl Be结构简式1.5分sp 3杂化轨道0.5分画成Cl BeCln 也得分(2分)1-5只有画出7配位的结构简式才能得满分,端基氮不配位得0分,二级氮不配位得1分 (2分)Cr 的氧化态为+4(1分)1-6MnOC CCH 3CO CO O3(1分)不要求配体的位置Mn 的氧化态为+1(1分)第2题 (6分) 下列各实验中需用浓HCl 而不能用稀HCl 溶液,写出反应方程式并阐明理由。
2-1 SnCl 2 + 2HCl = SnCl 42- + 2H +不配平不给分 (1分)浓HCl 的作用是形成SnCl 42-,可防止Sn(OH)Cl 的形成,抑制SnCl 2水解。
(1分) 写配平的水解方程式,加浓盐酸平衡向左移动,抑制水解 也得分2分2-2 MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2O不配平不给分 (1分)加浓HCl 利于升高MnO 2的氧化电位,降低Cl -的还原电位,使反应正向进行。
中国化学会全国高中学生化学竞赛省级赛区试题及答案

第27届中国化学奥林匹克(初赛)试题、解答、评分标准及评分细则第1题(12分) 写出下列化学反应的方程式1-1 加热时,三氧化二锰与一氧化碳反应产生四氧化三锰。
1-2 将KCN 加入到过量的CuSO 4水溶液中。
1-3 在碱性溶液中,Cr 2O 3和K 3Fe(CN)6反应。
1-4 在碱性条件下,Zn(CN)42?和甲醛反应。
1-5 Fe(OH)2在常温无氧条件下转化为Fe 3O 4。
1-6 将NaNO 3粉末小心加到熔融的NaNH 2中,生成NaN 3(没有水生成)。
1-1 3Mn 2O 3+CO =2Mn 3O 4+CO 2 2分 1-2 4CN ?+2Cu 2+=2CuCN +(CN)2 2分 1-3 Cr 2O 3+6Fe(CN)63?+10OH ? =2CrO 42?+6Fe(CN)64?+5H 2O 2分 1-4 Zn(CN)42?+4H 2CO +4H 2O =4 HOCH 2CN +Zn(OH) 42?? 2分 1-5 3Fe(OH)2=Fe 3O 4+H 2+2H 2O 2分 1-6 NaNO 3+3NaNH 2=NaN 3+NH 3+3NaOH 2分 1方程式正确才能得满分。
2若全部物质皆写对而未配平,可得1分。
第2题(23分) 简要回答或计算2-1 Bi 2Cl 82-离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi 原子的杂化轨道类型。
Bi 2Cl 82-的结构:ClClBiClClCl2-或ClClClClCl2- 2分.......未画成楔形键不扣分;不画电子对不扣分;若画了电子对且画成如上图(蓝)所示的连线,则与电子对相连的线不画成虚线(左)、虽画成虚线但远离Bi 原子,扣0.5分杂化轨道类型:sp 3d 2 1分2-2在液氨中,E θ(Na +/Na)=-1.89V ,E θ(Mg 2+/Mg)=-1.74V ,但可以发生Mg 置换Na 的反应:Mg +2NaI =MgI 2+2Na ,指出原因。
历年高中化学奥赛竞赛试题及答案

中国化学会第21届全国高中学生化学竞赛省级赛区试题2007年9月16日 9:00 - 12:00共3小时题号 1 2 3 4 5 6 7 8 9 10 11 总分满分12 6 10 7 10 12 8 4 10 12 9 100得分评卷人竞赛时间3小时;迟到超过半小时者不能进考场;开始考试后1小时内不得离场;时间到,把试卷背面朝上放在桌面上,立即起立撤离考场;试卷装订成册,不得拆散;所有解答必须写在指定的方框内,不得用铅笔填写;草稿纸在最后一页;不得持有任何其他纸张;姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处;允许使用非编程计算器以及直尺等文具;第1题12分通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成;SiOH41-1已知反应分两步进行,试用化学方程式表示上述溶解过程;+的存在,人们曾提出该离子结构的多种早在上世纪50年代就发现了CH5假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H键的键长相等;1-2该离子的结构能否用经典的共价键理论说明简述理由;1-3该离子是 ;A.质子酸B.路易斯酸C.自由基D.亲核试剂2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板;该分子的结构简图如下:1-4该分子的分子式为;1-5该分子有无对称中心1-6该分子有几种不同级的碳原子1-7该分子有无手性碳原子1-8该分子有无手性第2题5分羟胺和用同位素标记氮原子N﹡的亚硝酸在不同介质中发生反应,方程式如下:NH2OH+HN﹡O2→ A+H2ONH2OH+HN﹡O2→ B+H2OA、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O;请分别写出A和B的路易斯结构式;第3题8分X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积ccp,镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下;该晶体的六方晶胞的参数:a=,c=;p=·cm-3;3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式;2计算一个六方晶胞中“MgCl2”的单元数;3假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型第4题7分化合物A是一种热稳定性较差的无水的弱酸钠盐;用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失%,结果列于下表:利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程;第5题10分甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取样品,与25 mL 4mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用·L-1硝酸银水溶液处理,再用·L-1NH4SCN 水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了 mL;5-1 写出分析过程的反应方程式;5-2 计算样品中氯化苄的质量分数%;5-3 通常,上述测定结果高于样品中氯化苄的实际含量,指出原因;5-4 上述分析方法是否适用于氯苯的纯度分析请说明理由;第6题12分在给定实验条件下,一元弱酸HA在苯B和水W的分配系数KD =HAB/HAW=;已知水相和苯相中HA的分析浓度分别为×10-3和×10-3mol·L-1;在水中,HA按HA H++A-解离,Ka=×10-4;在苯中,HA发生二聚:2HA HA2;6-1 计算水相中各物种的浓度及pH;6-2 计算化合物HA在苯相中的二聚平衡常数;6-3 已知HA中有苯环,含×1021个分子,给出HA的化学名称;6-4 解释HA在苯中发生二聚的原因,画出二聚体的结构;第7题8分KClO3热分解是实验室制取氧气的一种方法;KClO3在不同的条件下热分解结果如下:实验反应体系第一放热温度/℃第二放热温度/℃A KClO3400 480B KClO3+Fe2O3360 390C KClO3+MnO2350已知⑴Ks+1/2Cl2g=KCls △H1=-437 kJ·mol-1⑵Ks+1/2Cl2+3/2O2g= KClO3s △H2=-398 kJ·mol-1⑶Ks+1/2Cl2+2O2g= KClO4s △H3=-433 kJ·mol-17-1 根据以上数据,写出上述三个体系对应的分解过程的热化学方程式;7-2 用写MnO2催化KClO3分解制得的氧气有轻微的刺激性气味,推测这种气体是什么,并提出确认这种气体的实验方法;第8题4分用下列路线合成化合物C:反应结束后,产物中仍含有未反应的A和B;8-1 请给出从混合物中分离出C的操作步骤;简述操作步骤的理论依据; 8-2 生成C的反应属于哪类基本有机反应类型;第9题10分根据文献报道,醛基可和双氧水发生如下反应:为了合成一类新药,选择了下列合成路线:9-1 请写出A的化学式,画出B、C、D和缩醛G的结构式;9-2 由E生成F和F生成G的反应分别属于哪类基本有机反应类型;9-3 请画出化合物G的所有光活异构体;第10题12分尿素受热生成的主要产物与NaOH反应,得到化合物A三钠盐;A与氯气反应,得到化合物B,分子式C3N3O3Cl3;B是一种大规模生产的化工产品,全球年产达40万吨以上,我国年生产能力达5万吨以上;B在水中能持续不断地产生次氯酸和化合物C,因此广泛用于游泳池消毒等;10-1 画出化合物A的阴离子的结构式;10-2 画出化合物B的结构式并写出它与水反应的化学方程式;10-3 化合物C有一个互变异构体,给出C及其互变异构体的结构式;10-4 写出上述尿素受热发生反应的配平方程式;第11题12分石竹烯Caryophyllene,C15H24是一种含双键的天然产物,其中一个双键的构型是反式的,丁香花气味主要是由它引起的,可从下面的反应推断石竹烯及其相关化合物的结构;反应1:反应2:反应3:反应4:石竹烯异构体—异石竹烯在反应1和反应2中也分别得到产物A和B,而在经过反应3后却得到了产物C的异构体,此异构体在经过反应4后仍得到了产物D;11-1 在不考虑反应生成手性中心的前提下,画出化合物A、C以及C的异构体的结构式;11-2 画出石竹烯和异石竹烯的结构式;11-3 指出石竹烯和异石竹烯的结构差别;第1题12分1-1 Si + 4OH = SiO44 + 2 H21分 SiO44 + 4H2O = SiOH4+ 4OH1分若写成 Si + 2OH + H2O = SiO32+ 2 H2SiO32+ 3H2O = SiOH4+ 2OH,也得同样的分;但写成 Si + 4H2O = SiOH4+ 2H2不得分; 写不写↓ 沉淀和↑气体不影响得分;1-2 不能; 1分经典共价键理论认为原子之间通过共享电子对而成键;C 为第二周期元素,只有 4 个价层轨道,最多形成 4 个共价键; 1分理由部分:答“C 原子无 2d 轨道,不能形成 sp3d 杂化轨道”,得 1 分;只答“C 原子没有 2d 轨道”,得分;只答“C 原子有 4 个价电子”,得分;答CH5+中有一个三中心二电子键,不得分因按三中心二电子键模型,CH5+离子的 C-H键不等长;1-3 A 或质子酸多选或错选均不得分; 2分1-4 C26H30分子式不全对不得分2分1-5 有1分1-6 3 种答错不得分1分1-7 有1分1-8 无1分第2题6分每式3分对每一式,只写对原子之间的连接顺序,但未标对价电子分布,只得 1 分;未给出立体结构特征不扣分;未标出同位素符号不扣分,但 B 中将星号标错位置扣分;第3题10分3-1 ··· AcB CbA BaC A ···5分大写字母要体现出 Cl-层作立方最密堆积的次序,镁离子与空层的交替排列必须正确,镁离子层与氯离子层之间的相对位置关系大写字母与小写字母的相对关系不要求;必须表示出层型结构的完整周期,即至少写出包含 6 个大写字母、3个小写字母、3 个空层的排列;若只写对含 4 个大写字母的排列,如“··· AcB CbA ···”,得分;3-2 3分Z的表达式对,计算过程修约合理,结果正确Z=—,指出单元数为整数 3,得 3 分;Z的表达式对,但结果错,只得 1 分;3-3 NaCl 型或岩盐型2分第4题7分根据所给数据,作图如下:由图可见,样品的质量损失与其中 A 的质量分数呈线性关系,由直线外推至A 的质量分数为 100% ,即样品为纯 A,可得其质量损失为 %;作图正确,外推得纯 A 质量损失为±%,得 4 分;作图正确,得出线性关系,用比例法求出合理结果,也得4分;仅作图正确,只得 2 分;样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3 = Na2CO3+ H2O↑ + CO2↑该反应质量损失分数为+/2 ×= %,与上述外推所得数据吻合;化合物 A 的化学式是 NaHCO 3;根据所给条件并通过计算质量损失,答对 NaHCO 3得 3 分;答出 NaHCO 3但未给出计算过程,只得 1 分;其他弱酸钠盐通过计算可排除,例如 Na 2CO 3质量损失分数为 %,等等; 第 5 题10 分5-14 分C 6H 5CH 2Cl +NaOH =C 6H 5CH 2OH +NaClNaOH +HNO 3=NaNO 3+H 2O 此式不计分 AgNO 3+NaCl =AgCl↓+NaNO 3NH 4SCN +AgNO 3=AgSCN↓+NH 4NO 3 Fe 3++SCN -=FeSCN 2+每式 1 分;写出正确的离子方程式也得满分;最后一个反应式写成 Fe 3++3SCN -=FeSCN 3也可;5-22 分样品中氯化苄的摩尔数等于 AgNO 3溶液中 Ag +的摩尔数与滴定所消耗的 NH 4SCN 的摩尔数的差值,因而,样品中氯化苄的质量分数为M C 6H 5CH 2Cl×× × 100% = 91%算式和结果各 1 分; 若答案为 %,得 分91%相当于三位有效数字,%相当于四位有效数字;5-32 分测定结果偏高的原因是在甲苯与 Cl 2反应生成氯化苄的过程中,可能生成少量的多氯代物 C 6H 5CHCl 2和C 6H 5CCl 3,反应物 Cl 2及另一个产物 HCl 在氯化苄中也有一定的溶解,这些杂质在与 NaOH 反应中均可以产生氯离子,从而导致测定结果偏高;凡答出由以下情况导致测定结果偏高的均得满分:1多氯代物、Cl 2和HCl ;2多氯代物和 Cl2;3多氯代物和 HCl;4多氯代物;凡答出以上任何一种情况,但又提到甲苯的,只得 1 分;若只答 Cl2和/或 HCl 的,只得 1 分;5-42分不适用;1分氯苯中,Cl 原子与苯环共轭,结合紧密,难以被 OH交换下来;1分氯苯与碱性水溶液的反应须在非常苛刻的条件下进行,而且氯苯的水解也是非定量的;第6题12分6-14分HA 在水中存在如下电离平衡:HA = H++A K a =×10-4据题意,得如下 3 个关系式:HA+A=×10-3mol·L-1 ①H+ A/HA=×10-4② H+=AH+=×10-4mol·L-1③三式联立,解得:A=H+=×10-4mol·L-1, HA=×10-3mol·L-1, OH-=×10-11mol·L-1, pH=logH+= =计算过程合理得分;每个物种的浓度分;pH 分;6-24分HA 的二聚反应为: 2HA = HA2平衡常数K dim=HA2/ HA2苯相中,HA 的分析浓度为 2HA2+HAB=×10-3mol·L-1根据苯-水分配常数K D=HA B/HA W=得HAB =HAW=×10-3mol·L-1HA2=×10-4mol·L-1K dim=HA2/ HA2=×10-4/×10-32=×102计算过程合理得 2 分;单体及二聚体浓度正确各得分;平衡常数正确得 1 分带不带单位不影响得分;6-32分HA 的摩尔质量为××1023/×1021=156 g/mol,根据所给信息,推断 HA 是氯代苯甲酸;156-77C6H5-45羧基=34,苯环上可能有氯,于是有 156-76C6H4-45羧基=35,因此 HA 是氯代苯甲酸;推算合理和结论各 1 分;6-42分在苯中,氯代苯甲酸相互作用形成分子间氢键;二聚体结构如下:原因与结构各 1 分;第7题8分7-1 6分A 第一次放热:4KClO3s = 3 KClO4s+ KCls ΔHθ= -144 kJ/mol第二次放热:KClO4 s = KCls + 2O2g ΔHθ= -4 kJ/mol每个方程式 1 分;方程式写错,不得分;未标或标错物态,扣分;未给出ΔHθ或算错,扣分;第一次放热过程,在上述要求的方程式外,还写出 2KClO3s =2KCls + 3O2g,不扣分;B 第一次放热、第二次放热反应的热化学方程式均与 A 相同;给出此说明,得分同 A若写方程式,评分标准同 A;C 2KClO3s = 2KCls + 3O2g ΔHθ= -78 kJ/mol方程式 2 分;方程式写错,不得分;未标或标错物态,扣分;未给出ΔHθ或算错,扣分;7-2 2分具有轻微刺激性气味的气体可能是 Cl2; 1分实验方案:1 将气体通入 HNO3酸化的 AgNO3溶液,有白色沉淀生成;分2 使气体接触湿润的 KI-淀粉试纸,试纸变蓝色;分若答气体为 O3和/或 ClO2,得 1 分;给出合理的确认方案,得 1 分;第8题 4分8-13分操作步骤:第一步:将反应混合物倾入冰水中,搅拌均匀,分离水相和有机相;分第二步:水相用乙酸乙酯等极性有机溶剂萃取 2-3 次后,取水相;分第三步:浓缩水相,得到C的粗产品;1 分理论依据:C是季铵盐离子性化合物,易溶于水,而A和B都是脂溶性化合物,不溶于水;1 分未答出水相用有机溶剂萃取,不得第二步分;未答浓缩水相步骤,不得第三步分;未答出C是季铵盐离子性化合物或未答出A和B都是脂溶性化合物,扣分;8-21分A 含叔胺官能团,B 为仲卤代烷,生成C 的反应是胺对卤代烷的亲核取代反应;1 分只要答出取代反应即可得 1 分;第9题10分9-15 分A KMnO4或K2Cr2O7或其他合理的氧化剂;MnO2、PCC、PDC、Jones 试剂等不行;A、B、C、D、和G 每式 1 分;化合物 B 只能是酸酐,画成其他结构均不得分;化合物 C 画成也得1分化合物 D 只能是二醇,画成其他结构均不得分;化合物 G 画成或只得分9-22 分由E生成F的反应属于加成反应;由F生成G的反应属于缩合反应;各 1 分由E生成F的反应答为其他反应的不得分;由F生成G的反应答为“分子间消除反应”也得满分,答其他反应的不得分;9-33 分G的所有光活异构体 3 分应有三个结构式,其中前两个为内消旋体,结构相同,应写等号或只写一式;三个结构式每式 1 分;如果将结构写成 4 个,而没有在内消旋体之间写等号的,或认为此内消旋体是二个化合物的扣分;如果用如下结构式画G的异构体,4 个全对,得满分;每错 1 个扣 1 分,最多共扣 3 分;第10题12分10-12 分画成其他结构均不得分;10-25 分画成其他结构均不得分; B2分化合物B与水反应的化学方程式:或C3N3O3Cl3+ 3 H2O = C3N3O3H3+ 3 HClO3分方程式未配平得分;产物错不得分;10-32 分2 分,每个结构式 1 分10-43 分或 3 CONH22= C3N3O3H3+ 3 NH3方程式未配平只得分;产物错不得分;第11题9分11-13 分A的结构式:1 分A 的结构,必须画出四元环并九元环的并环结构形式;未画出并环结构不得分;甲基位置错误不得分;C的结构式: 1 分C的结构,必须画出四元环并九元环的结构形式;未画出并环结构不得分;环内双键的构型画成顺式不得分,取代基位置错误不得分;C的异构体的结构式:1 分C异构体的结构,必须画出四元环并九元环的结构形式;未画出并环结构不得分;环内双键的构型画成反式不得分;取代基位置错误不得分;11-24 分石竹烯的结构式:2 分石竹烯的结构式,必须画出四元环并九元环的结构形式;未画出并环结构不得分;结构中有二个双键,一个在环内,一个在环外;九元环内的双键的构型必须是反式的;双键位置正确得满分;双键位置错误不得分;甲基位置错误不得分;异石竹烯的结构式:2 分异石竹烯的结构式,必须画出四元环并九元环的结构形式;未画出并环结构不得分;结构中有二个双键,一个在环内,一个在环外;九元环内的双键的构型必须是顺式的;双键位置正确得满分;双键位置错误不得分;甲基位置错误不得分; 11-32 分环内双键构型不同,石竹烯九元环中的双键构型为反式的,异石竹烯九元环中的双键构型为顺式的;石竹烯和异石竹烯的结构差别:必须指出石竹烯九元环中的双键构型为反式的,异石竹烯九元环中的双键构型为顺式的;主要差别在于环内双键构型的顺反异构;只要指出双键构型的顺反异构就得满分,否则不得分;注:红色字体为答案,蓝色字体为评分说明;中国化学会第22届全国高中学生化学竞赛省级赛区试题、标准答案及评分细则题号 1 2 3 4 5 6 7 8 9 10 11 总分满分14 5 4 10 5 11 14 9 7 11 10 100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分;2有效数字错误,扣分,但每大题只扣1次;3单位不写或表达错误,扣分,但每大题只扣1次;4只要求1个答案、而给出多个答案,其中有错误的,不得分;5方程式不配平不得分;6不包括在此标准答案的分的题,可由评分组讨论决定是否给分;第1题 14分1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐; 1画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式;C H 2N C H 2H 2CN H 2C CH 2H 2CCOO -COO --OOC-OOCH H2分答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2HH或CH 2NH(CH 2COO -)22得2分,质子必须在氮原子上;2 CaEDTA 2溶液可用于静脉点滴以排除体内的铅;写出这个排铅反应的化学方程式用Pb 2+ 表示铅;Pb 2+ + CaEDTA 2 = Ca 2+ + Pb EDTA 2 1分 3能否用EDTA 二钠盐溶液代替CaEDTA 2溶液排铅为什么不能;若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失; 答案和原因各分,共 1分1-2 氨和三氧化硫反应得到一种晶体,熔点205oC,不含结晶水;晶体中的分子有一个三重旋转轴,有极性;画出这种分子的结构式,标出正负极;2分硫氧键画成双键或画成S →O,氮硫键画成N →S,均不影响得分;结构式1分,正负号1分;答H 3NSO 3、H 3N-SO 3等不得分;正确标出了正负号,如+H 3NSO 3、+H 3N-SO 3得1分;其他符合题设条件有三重轴,有极性的结构,未正确标出正负极,得1分,正确标出正负极,得2分;1-3 Na 2FeCN 5NO 的磁矩为零,给出铁原子的氧化态;Na 2FeCN 5NO 是鉴定S 2的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式;FeII 答II 或+2也可 2分FeCN 5NO 2+S 2= FeCN 5NOS 4配合物电荷错误不得分 1分1-4 CaSO 4 2H 2O 微溶于水,但在HNO 3 1 mol L 1、HClO 4 1 mol L 1中可溶;写出能够解释CaSO 4在酸中溶解的反应方程式;CaSO 4 + H + = Ca 2+ + HSO 4 1分 写成 2CaSO 4 + 2HNO 3 = CaNO 32 + CaHSO 42 也得分;高氯酸同; 答案若生成H 2SO 4 不得分;1-5 取质量相等的2份PbSO 4 难溶物粉末,分别加入HNO 3 3 mol L 1 和HClO 4 3 mol L 1,充分混合,PbSO 4在HNO 3 能全溶,而在HClO 4中不能全溶;简要解释PbSO 4在HNO 3中溶解的原因;Pb 2+与NO 3形成络离子配离子或配合物; 1分 写方程式也可,如PbSO 4 + H + + NO 3- = HSO 4- + PbNO 3+;若将络离子配离子或配合物写成PbNO 32或PbNO 33也得分,但方程式须配平;1-6 X 和Y 在周期表中相邻;CaCO 3与X 的单质高温反应,生成化合物B 和一种气态氧化物;B 与Y 的单质反应生成化合物C 和X 的单质;B 水解生成D ;C 水解生成E ,E 水解生成尿素;确定B 、C 、D 、E 、X 和Y ; B: CaC 2 C: CaCN 2 D: C 2H 2 或CaOH 2 E: NH 2CN CNH 2也可X: C Y: N各分,共3分 第2题 5分 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等;年产量达300万吨的氯酸钠是生产X 的原料,92%用于生产X —在酸性水溶液中用盐酸、二氧化硫或草酸还原;此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X ;X 有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应;2-1 写出X 的分子式和共轭π键mn π;ClO 2 53π 各1分,共2分2-2 分别写出上述用草酸还原和用氯气氧化生产X 的反应方程式;2ClO 3+ H 2C 2O 4 + 2H + = 2ClO 2 + 2CO 2 + 2H 2O 1分或 2NaClO 3 + H 2C 2O 4 + H 2SO 4 = 2ClO 2 + 2CO 2 + Na 2SO 4 + 2H 2O2NaClO 2 + Cl 2 = 2ClO 2 + 2NaCl 1分NaClO 2是固体,写成ClO 2,不得分; 2-3 写出上述X 歧化反应的化学方程式;2ClO 2 + 2NaOH = NaClO 2 + NaClO 3 + H 2O 1分或 2ClO 2 + 2OH = ClO 2+ ClO 3+ H 2O第3题 4分 甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:CH 32Og + H 2g mr H ∆= kJ mol -11 向体系中通入空气,通过以下反应提供反应1 所需热量:H 2g + O 2g H 2Og mr H ∆=– kJ mol -1 2要使反应温度维持在700C,计算进料中甲醇与空气的摩尔数之比;已知空气中氧气的体积分数为;要使反应维持在一定温度持续进行,应保证反应2放出的热量恰好被反应1 全部利用,则:甲醇与氧气的摩尔比为:n CH3OH : n O2 = 2 / = 2分甲醇与空气的摩尔比为:n CH3OH : n空气 = / 5 = 2分答成或得分;答写成1 : 也得2分;考虑到实际情况,将上式的等号写成小于或小于等于,得2分;算式合理,结果错误,只得1分;只有结果没有计算过程不得分;第4题10分 CN2被称为拟卤素,它的阴离子CN作为配体形成的配合物有重要用途;4-1 HgCl2和HgCN2反应可制得 CN2, 写出反应方程式;HgCl2+ HgCN2= Hg2Cl2+ CN21分4-2 画出CN、CN2的路易斯结构式;[]N C C各1分,共2分短线画成电子对同样得分;不画孤对电子不得分;4-3 写出CN2 g 在O2g 中燃烧的反应方程式;CN2g + 2O2g = 2CO2g + N2g 1分不标物态也可;4-4 298 K下,CN2 g 的标准摩尔燃烧热为 1095 kJ mol1,C2H2g 的标准摩尔燃烧热为 1300 kJ mol1,C2H2g 的标准摩尔生成焓为227 kJ mol1,H2O l 的标准摩尔生成焓为 286 kJ mol1,计算 CN2g 的标准摩尔生成焓;CN2g + 2O2g = 2CO2g + N2g2Δf H m CO2ΔfH m CN2 = 1095 kJ mol12Δf H m CO 2 = 1095 kJ mol 1 +Δf H m CN 2 C 2H 2g + g = 2CO 2g + H 2Ol2Δf H m CO 2 +Δf H m H 2O Δf H m C 2H 2 =1300 kJ mol -12Δf H m CO 2 =1300 kJ mol 1+ 286kJ mol 1+ 227 kJ mol 1Δf H m CN 2 = 1095 kJ mol 1 1300 kJ mol 1 + 286kJ mol 1 + 227 kJ mol 1= 308 kJ mol 1 2分计算过程正确计算结果错误只得1分;没有计算过程不得分; Δf H m CN 2 = 1095 1300 + 286 + 227 = 308kJ mol 1也可以; 但不加括号只得分;4-5 CN 2在300~500 o C 形成具有一维双链结构的聚合物,画出该聚合物的结构;CC NN n或 CC NCC N N CC NN N2分画成NN NN NN也得2分; 但画成N NN NNN只得1分;4-6 电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN,写出化学方程式漂白粉用ClO 表示;2CN + 5ClO + H 2O = 2HCO 3 + N 2 + 5Cl 2分产物中写成CO 32只要配平,也得分;第5题 5分 1963年在格陵兰Ika 峡湾发现一种水合碳酸钙矿物ikaite;它形成于冷的海水中,温度达到8o C 即分解为方解石和水;1994年的文献指出:该矿物晶体中的Ca 2+ 离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子;它的单斜晶胞的参数为:a = 887 pm, b = 823 pm, c = 1102 pm, β = °,密度d = g cm 3,Z = 4;5-1 通过计算得出这种晶体的化学式; ikaite 晶胞体积:V = abc sin β = 10-24 cm 3 ° = 10-22 cm 3 分设晶胞中含有n 个水分子,晶胞的质量:m = 4 100 + 18 n / N A g 分 晶体密度:d = m /V = 4 100 + 18 n / 102310-22g cm 3= g cm -3100+18n = 208 n = 6分该晶体的化学式为CaCO 36H 2O分算出6个水分子,未写化学式,得分;5-2 研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体gypsum 作了对比,结果如下图所示纵坐标为相对体积:为什么选取冰和二水合石膏作对比实验结果说明什么Ikaite 在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能gypsuikaice与冰的结构有相似性,故选取冰作参比物; 分 石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是8,可能与ikaite 结构相似,故选取石膏作参比物; 分实验结果说明ikaite 的结构跟冰相似; 1分 实验结果,说明含水的摩尔分数越大膨胀越大, 可以得分; 5-3 这种晶体属于哪种类型的晶体简述理由;分子晶体; 分 答混合型晶体不得分;晶体分解温度接近冰的熔点,体积随温度的变化趋势也接近冰,可认为晶体中的化学微粒是CaCO 3 6H 2O,它们以分子间作用力氢键和范德华力构成晶体;分第6题 11分 在900o C 的空气中合成出一种含镧、钙和锰 摩尔比2 : 2 : 1 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在;为确定该复合氧化物的化学式,进行如下分析:6-1 准确移取 mL mol L 1的草酸钠水溶液,放入锥形瓶中,加入25 mL 蒸馏水和5mL 6 mol L 1的HNO 3溶液,微热至60~70o C,用KMnO 4溶液滴定,消耗 mL;写出滴定过程发生的反应的方程式;计算KMnO 4溶液的浓度;2MnO 4 + 5C 2O 42 + 16H + = 2Mn 2+ + 10CO 2 + 8H 2O 1分 KMnO 4溶液浓度:2/5 / = mol L 1 1分 反应方程式反应物C 2O 42-写H 2C 2O 4,只要配平,也得1分;下同;6-2 准确称取 g 复合氧化物样品,放入锥形瓶中,加 mL 上述草酸钠溶液和30 mL 6mol L 1 的HNO 3溶液,在60~70o C 下充分摇动,约半小时后得到无色透明溶液;用上述KMnO 4溶液滴定,消耗 mL;根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式;已知La 的原子量为;根据:化合物中金属离子摩尔比为 La : Ca : Mn = 2 : 2 : 1,镧和钙的氧化态分别为+3和+2,锰的氧化态为 +2 ~ +4,初步判断复合氧化物的化学式为La 2Ca 2MnO 6+x , 其中 x = 0~1; 1分 滴定情况:加入C 2O 42总量: mL mol L 1 = mmol 分 样品溶解后,滴定消耗高锰酸钾: mL mol L 1 = mmol 分 样品溶解后剩余C 2O 42量: mmol 5/2 = mmol 分 样品溶解过程所消耗的C 2O 42量: mmol mmol = mmol 分 若将以上过程合并,推论合理,结果正确,也得2分; 在溶样过程中,C 2O 42变为CO 2给出电子:2 mmol = mmol 分 有两种求解x 的方法: 1方程法:复合氧化物La 2Ca 2MnO 6+x 样品的物质的量为:g / + x g mol 1 分 La 2Ca 2MnO 6+x 中,锰的价态为: 2 6+x 2 3 22 = 2+2x 1分溶样过程中锰的价态变化为: 2+2 x 2 = 2 x 分锰得电子数与C2O42给电子数相等:2 x g / + x g mol1= 2 103 mol 1分x = 1 分如果将以上步骤合并,推导合理,结果正确,也得分;如果将以上步骤合并,推导合理但结果错误,得2分;推导错误,即便结果吻合,也不得分;2尝试法因为溶样过程消耗了相当量的C2O42,可见锰的价态肯定不会是+2价;若设锰的价态为+3价,相应氧化物的化学式为, 此化学式式量为 g mol-1, 称取样品的物质的量为:g / g mol-1 = 104 mol 分在溶样过程中锰的价态变化为103 mol / 8. 628 104 mol = 0. 5分锰在复合氧化物中的价态为: 2 + = 0. 5分与3差别很大,+3价假设不成立;分而结果提示Mn更接近于+4价; 分若设Mn为+4价, 相应氧化物的化学式为La2Ca2MnO7, 此化学式式量为 gmol-1;锰在复合氧化物中的价态为:2 + 2 103 / / =4 分假设与结果吻合,可见在复合氧化物中,Mn为+4价; 分如果将以上步骤合并,推导合理,结果正确,也得分;如果将以上步骤合并,推导合理但结果错误,得2分;推导错误,即便结果吻合,也不得分;该复合氧化物的化学式为La 2Ca 2MnO 7 1分溶样过程的反应方程式为:La 2Ca 2MnO 7 + C 2O 42 + 14H + = 2La 3+ + 2Ca 2+ + Mn 2+ + 2CO 2 + 7H 2O 1分未经计算得出La 2Ca 2MnO 7,方程式正确,只得方程式的1分;第7题 14分 AX 4四面体 A 为中心原子,如硅、锗;X 为配位原子,如氧、硫 在无机化合物中很常见;四面体T 1按下图所示方式相连可形成一系列“超四面体”T 2、T 3···:7-1 上图中T 1、T 2和T 3的化学式分别为AX 4、A 4X 10和A 10X 20,推出超四面体T 4的化学式;T 4超四面体的化学式为A 20X 35 1分7-2 分别指出超四面体T 3、T 4中各有几种环境不同的X 原子,每种X 原子各连接几个A 原子在上述两种超四面体中每种X 原子的数目各是多少T 1 T 3T 2。
21---30届全国物理竞赛力学部分复赛试题

(第20届全国中学生物理竞赛复赛题)有人提出了一种不用火箭发射人造地球卫星的设想.其设想如下:沿地球的一条弦挖一通道,如图所示.在通道的两个出口处A和B,分别将质量为M的物体和质量为m的待发射卫星同时自由释放,只要M比m足够大,碰撞后,质量为m的物体,即待发射的卫星就会从通道口B冲出通道;设待发卫星上有一种装置,在待发卫星刚离开出口B时,立即把待发卫星的速度方向变为沿该处地球切线的方向,但不改变速度的大小.这样待发卫星便有可能绕地心运动,成为一个人造卫星.若人造卫星正好沿地球表面绕地心做圆周运动,则地心到该通道的距离为多少?己知M=20m,地球半径0R =6400 km.假定地球是质量均匀分布的球体,通道是光滑的,两物体间的碰撞是弹性的.(第20届全国中学生物理竞赛复赛题)有一半径为R的圆柱A,静止在水平地面上,并与竖直墙面相接触.现有另一质量与A相同,半径为r的较细圆柱B,用手扶着圆柱A,将B 放在A的上面,并使之与墙面相接触,如图所示,然后放手.己知圆柱A与地面的静摩擦系数为0.20,两圆柱之间的静摩擦系数为0.30.若放手后,两圆柱体能保持图示的平衡,问圆柱B与墙面间的静摩擦系数和圆柱B的半径r的值各应满足什么条件?(第20届全国中学生物理竞赛复赛题)如图所示,将一铁饼状小物块在离地面高为h 处沿水平方向以初速v 抛出.己知物块碰地弹起时沿竖直方向的分速度的大小与碰前沿竖直方向的分速度的大小之比为e (<1).又知沿水平方向物块与地面之间的滑动摩擦系数为μ(≠0):每次碰撞过程的时间都非常短,而且都是“饼面”着地.求物块沿水平方向运动的最远距离.(第21届全国中学生物理竞赛复赛题)二、(20分) 两颗人造卫星绕地球沿同一椭圆轨道同向运动,它们通过轨道上同一点的时间相差半个周期.已知轨道近地点离地心的距离是地球半径R 的2倍,卫星通过近地点时的速度RGM 43=v ,式中M 为地球质量,G 为引力常量.卫星上装有同样的角度测量仪,可测出卫星与任意两点的两条连线之间的夹角.试设计一种测量方案,利用这两个测量仪测定太空中某星体与地心在某时刻的距离.(最后结果要求用测得量和地球半径R 表示)(第21届全国中学生物理竞赛复赛题)如图所示,三个质量都是m 的刚性小球A 、B 、C 位于光滑的水平桌面上(图中纸面),A 、B 之间,B 、C 之间分别用刚性轻杆相连,杆与A 、B 、C 的各连接处皆为“铰链式”的(不能对小球产生垂直于杆方向的作用力).已知杆AB 与BC 的夹角为 ,< /2.DE 为固定在桌面上一块挡板,它与AB 连线方向垂直.现令A 、B 、C 一起以共同的速度v 沿平行于AB 连线方向向DE 运动,已知在C 与挡板碰撞过程中C 与挡板之间无摩擦力作用,求碰撞时当C 沿垂直于DE 方向的速度由v 变为0这一极短时间内挡板对C 的冲量的大小.(第22届全国中学生物理竞赛复赛题)图中的AOB 是游乐场中的滑道模型,它位于竖直平面内,由两个半径都是R 的1/4圆周连接而成,它们的圆心1O 、2O 与两圆弧的连接点O 在同一竖直线上.B O 2沿水池的水面.一小滑块可由弧AO 的任意点从静止开始下滑. 1.若小滑块从开始下滑到脱离滑道过程中,在两个圆弧上滑过的弧长相等,则小滑块开始下滑时应在圆弧AO 上的何处?(用该处到1O 的连线与竖直线的夹角表示).2.凡能在O 点脱离滑道的小滑块,其落水点到2O 的距离如何?O 1O 2O ABABCπ-αDE(第22届全国中学生物理竞赛复赛题) 如图所示,在一个劲度系数为 k 的轻质弹簧两端分别拴着一个质量为 m 的小球A 和质量为 2m 的小球B .A 用细线拴住悬挂起来,系统处于静止状态,此时弹簧长度为l .现将细线烧断,并以此时为计时零点,取一相对地面静止的、竖直向下为正方向的坐标轴Ox ,原点O 与此时A 球的位置重合如图.试求任意时刻两球的坐标.(第23届全国中学生物理竞赛复赛题)有一竖直放置、两端封闭的长玻璃管,管内为真空,管内有一小球自某处自由下落(初速度为零),落到玻璃管底部时与底部发生弹性碰撞.以后小球将在玻璃管内不停地上下跳动。
第22届全国高中生化学竞赛(省级赛区)试题及答案

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (14分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
(1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
C H 2NC H 2H 2C N H 2C CH 2H 2CCOO -COO --OOC-OOC H H (2分)答(-OOCCH 2)2NCH 2CH 2N(CH 2COO -)2H H或CH 2NH(CH 2COO -)22 得2分,质子必须在氮原子上。
(2) Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb 2+ 表示铅)。
Pb 2+ + Ca(EDTA)2- = Ca 2+ + Pb (EDTA)2-(1分)(3)能否用EDTA 二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。
若直接用EDTA 二钠盐溶液,EDTA 阴离子不仅和Pb 2+反应, 也和体内的Ca 2+结合造成钙的流失。
(答案和原因各0.5分,共 1分)1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
(2分)硫氧键画成双键或画成S →O ,氮硫键画成N →S ,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N-SO 3等不得分。
正确标出了正负号,如+H 3NSO 3-、+H 3N-SO 3-得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
大学生综合知识竞赛试题

大学生综合知识竞赛试题大学生综合知识竞赛试题抢答题1、新文化运动的基本口号是什么?答案:民主和科学2、在京汉铁路工人大罢工中牺牲的京汉铁路总工会江岸分会委员长是谁?答案:施洋3、延安整风运动的方针是什么?答案:惩前毖后,治病救人4、中国人民解放军解放大陆的最后一战是什么战役?答案:昌都战役5、中华人民共和国首次以五大国之一的身份参加讨论国际问题的会议是什么会议?答案:日内瓦会议6、中华人民共和国的最高权力机关是什么?答案:全国人民代表大会7、从1960年开始,用了3年时间基本建成的我国最大的石油基地是什么油田?答案:大庆油田8、1961年,党中央做出以研制“两弹”为中心,加速国防科研和工业发展的重大决策。
我国国防尖端科学技术取得了突破性进展。
请问“两弹”指的是什么?答案:原子弹导弹9、1965年,我国科研工作者在基础科学研究方面取得一项重大成果,这在世界上也处于领先地位。
请问这项成果是什么?答案:人工合成牛胰岛素结晶10、全国第一个进行经济体制改革综合试点的城市是哪个城市?答案:湖北省沙市11、1982年,邓小平同志提出:“把马克思主义的普遍真理同我国的具体实际结合起来,走自己的道路,建设有中国特色的社会主义。
”这是在什么会议上提出的?答案:党的十二大12、1983年11月21日,由中国人民解放军国防科技大学研制成功的中国第一台亿次巨型计算机在长沙通过国家鉴定,这标志着我国进入世界巨型计算机研制的行列。
请问这台计算机的名称是什么?答案:“银河-I”计算机13、1985年,《中共中央关于教育体制改革的决定(草案)》提出,要有步骤实行义务教育的年限是几年?答案:9年14、1985年10月,邓小平在会见美国高级企业家代表团时说,对于改革中出现的一些消极现象,我们主要通过两个手段来解决,一个是教育,一个是什么?答案:法律15、1987年,中共中央作出《关于改进和加强高等学校思想政治工作的决定》,指出建设具有中国特色的社会主义,需要培养一代又一代“四有”的知识分子队伍。
2021年宁波市第22届程序设计竞赛初中组试题

2021年宁波市第22届程序设计竞赛初中组试题宁波市第22届中小学生计算机程序设计竞赛决赛试题(初中组)2021年4月宁波市第22届中小学生计算机程序设计竞赛决赛试题(初中组)考生须知:1、考试时间为150分钟,满分400分。
2、考生不得携带任何存储设备。
3、考试开始前,请先确定D盘内容不会被还原,如有问题请监考老师解决。
4、上机考试时要随时注意保存程序。
5.每题都必须提交源程序和编译后的可执行程序(程序的命名办法见每题中的规定),II必须存放到指定的文件夹内(放错位置的视为无效)。
测试时,以源程序为准。
6、考试结束后,不得关机,否则后果自负。
题号1 2 3 4题目名称分解数字提交的源程序factor, pas/c/cpp提交的可执行程序factor.exe每个测试点时限2秒1秒1秒1秒允许内存61MB 64MB 64MB 64MB测试点每个测试数目点分值10 10 10 10 10 10 10 10 最大约数和maxsum. pas/c/cpp max sum. exe 单閒背诵let ter. pas/c/cpp let ter. exe 关路灯power,pas/c/cpp power, exe 试题一:分解数字(100分)(源程序名:factor, pas或factor, c或factor, cpp,编译后可执彳亍程序名:factor, exe)【问题描述】【样例输入】【样例输出】输入口然数n和m,输出n的所有分解和式,7 1:7=1+1+1+1+1+1+1分解后的每一项都不大于m。
组成和式的数字自左42:7二1+1+1+1+1+2至右构成一个不降的序列,不能重复。
如以下三个3:7=1+1+1+1+3 分解式4二1+1+2; 4二1+2+1;4二2+1+1 中只有第一个4:7二1+1+1+2+2符合要求。
各组方案之间按照字典顺序输出。
5:7二1+1+1+4【输入】输入文件factor, in中有两行,每行只有一6:7二1+1+2+3个正整数。
第22届国际生物学奥林匹克竞赛试题理论B—l·细胞生物学和植物科学

Q . 蛋 白质
S . 脂 类 T . 核 酸
A. 巨 噬 细 胞 可 以通 过 t o l l 样 受 体 识 别 大 肠 杆
菌
B 3 . 某些病原体会产生外毒素 , 导致 人 生 病 。 某 种
外 毒 素 由 2个 多 肽 组 成 , 亚 基 A 和 B。亚 基 B可
B. 巨 噬 细 胞 对 大 肠 杆 菌 的 吞 噬 被 抑 制
1 ) mR N A一 核糖体复合体转到 a 继续 2 ) 合 成 的 酶 进入 e 和 3 ) 修饰后的酶储存在 e 。
b 。
d 来 进行修饰。
C . 裸 子 植 物 的管 胞
D. 人输 卵 管 上 皮 细胞
E. 人 气 管 上 皮 细 胞 F . 人 小 肠 上 皮 细胞
1 3 4 . 根据 下表 给 出的信息 . 完 成 吞 噬 作 用 过 程 中 消 化 酶 的合 成 途 径 :
①复制
②翻 译
⑤ 内质 网
⑥ 囊泡
③转 录
I 1 1 1
⑦ 溶酶 体
⑧ 高尔 基体
④线粒 体
B 1 . 拥有上述结构 的有 : A. 草 履 虫 B . 大肠 杆 菌
生
物
学
通
Hale Waihona Puke 报 2 0 1 4年 第 4 9卷 第 3期
第2 2 届国际生物学奥林匹克竞赛试题
理论 B — l ・ 细 胞 生 物 学 和植 物 科 学
范 六 民 佟 向 军 许 崇任 t 刘恩山
( 1 北 京 大 学 生 命 科 学 学 院 北 京 1 0 0 8 7 1 2北 京 师 范 大 学 生 命 科 学 学 院 北 京 1 0 0 8 7 5)
全国高中化学竞赛初赛备用试题答案
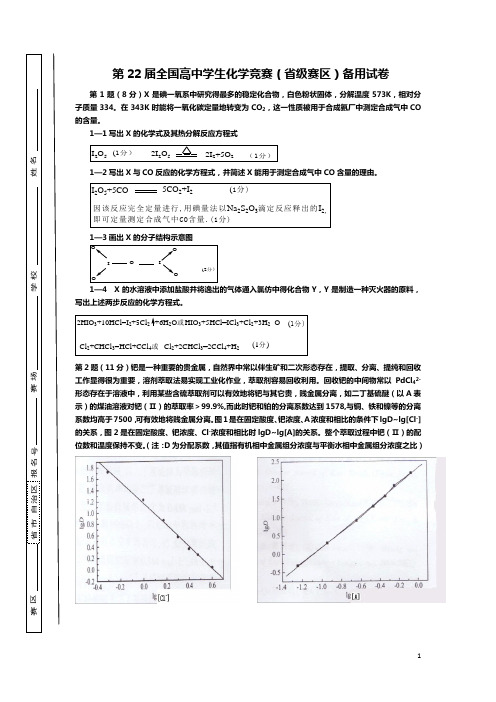
第22届全国高中学生化学竞赛(省级赛区)备用试卷第1题(8分)X 是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K ,相对分子质量334。
在343K 时能将一氧化碳定量地转变为CO 2,这一性质被用于合成氨厂中测定合成气中CO 的含量。
1—1写出X 的化学式及其热分解反应方程式I 2O 5 2I 2O 52I 2+5O 2(1分)(1分)1—2写出X 与CO 反应的化学方程式,并简述X 能用于测定合成气中CO 含量的理由。
I 2O 5+5CO5CO 2+I 2 (1分)因该反应完全定量进行,用碘量法以Na 2S 2O 3滴定反应释出的I 2,即可定量测定合成气中CO 含量.(1分)1—3画出X 的分子结构示意图IOIOOOO (2分)1—4 X 的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y ,Y 是制造一种灭火器的原料,写出上述两步反应的化学方程式。
2HIO 3+10HCl=I 2+5Cl 2+6H 2O 或HIO 3+5HCl=ICl 3+Cl 2+3H 2(1分)Cl 2+CHCl 3=HCl+CCl 4或Cl 2+2CHCl 3=2CCl 4+H 2(1分)O第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。
回收钯的中间物常以PdCl 42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A 表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。
图1是在固定酸度、钯浓度、A 浓度和相比的条件下lgD~lg[Cl -]的关系,图2是在固定酸度、钯浓度、Cl -浓度和相比时lgD~lg[A]的关系。
整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无机试题(22)氨和三氧化硫反应得到一种晶体,熔点205℃,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN)5(NO)]是鉴定S2−的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
(4)CaSO4·2H2O微溶于水,但在HNO3(1mol/L)、HClO4(1mol/L)中可溶。
写出能够解释CaSO4在酸中溶解的反应方程式。
取质量相等的2份PbSO4(难溶物)粉末,分别加入HNO3(3mol/L)和HClO4(3mol/L),充分混合,PbSO4在HNO3能全溶,而在HClO4中不能全溶。
简要解释PbSO4在HNO3中溶解的原因。
X和Y在周期表中相邻。
CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。
确定B、C、D、E、X和Y。
2. (5分)化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X——在酸性水溶液中用盐酸、二氧化硫或草酸还原。
此外,将亚氯酸钠固体装柱,通入空气稀释的氯气氧化,也可产生X。
X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。
(1)写出X的分子式和共轭π键(πn m)。
分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。
写出上述X歧化反应的化学方程式。
3. (4分)甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:CH3OH(g)催化剂, 700℃CH2O(g)+H2(g),Δr H m标态=84.2kJ/mol (1)向体系中通入空气,通过以下反应提供反应(1)所需热量:H2(g)+½O2(g)H2O(g),Δr H m标态=−241.8kJ/mol (2) 要使反应温度维持在700℃,计算进料中甲醇与空气的摩尔数之比。
已知空气中氧气的体积分数为0.20。
4. (10分)(CN)2被称为拟卤素,它的阴离子CN−作为配位体形成的配合物有重要用途。
(1)HgCl2和Hg(CN)2反应可制得(CN)2,写出反应方程式。
画出CN−、(CN)2的路易斯结构式。
写出(CN)2(g)在O2(g)中燃烧的反应方程式。
(4)298K下,(CN)2(g)的标准摩尔燃烧热为−1095kJ/mol,C2H2(g)的标准摩尔燃烧热为−1300kJ/mol,C2H2(g)的标准摩尔生成焓为227kJ/mol,H2O(l)的标准摩尔生成焓为286kJ/mol,计算(CN)2(g)的标准摩尔生成焓。
(CN)2在300~500℃形成具有一维双链结构的聚合物,画出该聚合物的结构。
电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN−,写出化学反应式(漂白粉用ClO−表示)。
5. (5分)1963年在格陵兰Ika峡湾发现一种水合碳酸钙矿物ikaite。
它形成于冷的海水中,温度达到8℃即分解为方解石和水。
1994年的文献指出:该矿物晶体中的Ca2+离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。
它的单斜晶胞的参数为:a=887pm,b=823pm,c=1102pm,β=110.2°,密度d=1.83g/cm3,Z=4。
(1)通过计算得出这种晶体的化学式。
(2)研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体(gypsum为什么选取冰和二水合石膏作对比?实验结果说明了什么?这种晶体属于哪种类型的晶体?简述理由。
6. (11分)在900℃的空气中合成出一种镧、钙和锰(摩尔比2:2:1)的复合氧化物,其中锰可能以+2、+3、+4或者混合价态存在。
为确定该复合氧化物的化学式,进行如下分析:(1)准确移取25.00mL 0.05301mol/L的草酸钠水溶液,放入锥形瓶中,加入25mL蒸馏水和5mL 6mol/L的HNO3溶液,微热至60~70℃,用KMnO4溶液滴定,消耗27.75mL。
写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。
准确称取0.4460g复合氧化物样品,放入锥形瓶中,加25.00mL上述草酸钠溶液和30mL 6mol/L的HNO3溶液,在60~70℃下充分摇动,约半小时后得到无色透明溶液。
用上述KMnO4溶液滴定,消耗10.02mL。
根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。
已知La的原子量为138.9。
7. (14分)AX4四面体(A为中心原子,如硅、锗;X为配位原子,如氧、硫)在无机化合物中很常见。
四面体T1按下图所示方式相连可形成一系列“超四面体”(T2、T3、…);T1T2T3 上图中T1、T2和T3的化学式分别为AX4、A4X10和A10X20,推算超四面体T4的化学式。
分别指出超四面体T3、T4中各有几种环境不同的X原子,每种X原子各连接几个A 原子?在上述两种超四面体中每种X原子的数目各是多少?若分别以T1、T2、T3、T4为结构单元共顶点相连(顶点X原子只连接两个A原子),形成无限三维结构,分别写出所的三维骨架的化学式。
欲使上述T3超四面体连接所得三维骨架的化学式所带电荷分别为+4、0和−4,A选Zn2+、In3+或Ge4+,X取S2−,给出三种不同电荷的骨架的化学式(各给出一种,结构单元中的离子数成简单整数比)。
8. (9分)由烷基镁热分解制得镁的氢化物。
实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101g/cm3,镁和氢的核间距为194.8pm。
已知氢原子的共价半径为37pm,Mg2+的离子半径为72pm。
(1)写出该氢化物中氢的存在形式,并简述理由。
将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。
X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。
推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。
实验测定,上述Mg2NiH4晶体的晶胞参数为646.5pm,计算该晶体中镁和镍的核间距。
已知镁和镍的原子半径分别为159.9pm和124.6pm。
若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg 2NiH 4的储氢能力(假设氢可全部放出;液氢的密度为0.0708g/cm 3)。
答案及评分标准(2)如右图(2分)[硫氧键画成双键或画成S→O,氮硫键画成N→S,均不影响得分。
结构式1分,正负号1分。
答H 3NSO 3、H 3N −SO 3等不得分。
正确标出了正负号,如+H 3NSO 3−、+H 3N −SO 3−得1分。
其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。
] (3)Fe(II) [答II 或+2也可](2分)[Fe(CN)5(NO)]2−+S 2−=[Fe(CN)5(NOS)]4−[配合物电荷错误不得分](1分) (4)CaSO 4+H +=Ca 2++HSO 4−(1分)[写成2CaSO 4+2HNO 3=Ca(NO 3)2+Ca(HSO 4)2也得分。
高氯酸同。
答案若生成H 2SO 4不得分。
](5)Pb 2+与NO 3−形成络离子(配离子或配合物)。
(1分)[写方程式也可,如PbSO 4+H ++NO 3−=HSO 4−+Pb(NO 3)+。
若将络离子(配离子或配合物)写成Pb(NO 3)2或Pb(NO 3)3−也得分,但方程式须配平。
](6)B :CaC 2 C :CaCN 2 D :C 2H 2或Ca(OH)2 E :NH 2CN [C(NH)2也可] X :C Y :N (各0.5分,共3分) 2. (5分)(1)ClO 2,π35(各1分,共2分)(2)2ClO 3−+H 2C 2O 4+2H +=2ClO 2+2CO 2+2H 2O (1分) [或2NaClO 3+H 2C 2O 4+H 2SO 4=2ClO 2+2CO 2+Na 2SO 4+2H 2O]2NaClO 2+Cl 2=2ClO 2+2NaCl (1分)[NaClO 2是固体,写成ClO 2−,不得分。
](3)2ClO 2+2NaOH=NaClO 2+NaClO 3+H 2O (1分)[或2ClO 2+2OH −=ClO 2−+ClO 3−+H 2O]3. (4分)[要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1)全部利用,则:][甲醇与氧气的摩尔比为:]n (CH 3OH):n (O 2)=(2×241.8)/84.2=5.74(2分) [甲醇与空气的摩尔比为:]n (CH 3OH):n (空气)=5.74/5=1.1(2分)[答成1.15或1.148得1.5分。
答(写)成1:0.87也得2分。
考虑到实际情况,将上式的等号写成小于或小于等于,得2分。
算式合理,结果错误,只得1分。
只有结果没有计算过程不得分。
] 4. (10分)(1)HgCl 2+Hg(CN)2=Hg 2Cl 2+(CN)2(1分)(2)[:C≡N :]−,:N ≡C −C≡N :(各1分,共2分)[短线画成电子对同样得分;不画孤对电子不得分。
](3)(CN)2(g)+2O 2(g)=2CO 2(g)+N 2(g)(1分)[不标物态也可。
](4)[ (CN)2(g)+2O 2(g)=2CO 2(g)+N 2(g),2Δf H m 标态(CO 2)−Δf H m 标态[(CN)2]=−1095kJ/mol ,2Δf H m 标态(CO 2)=−1095kJ/mol+Δf H m 标态[(CN)2] ][ C 2H 2(g)+2.5O 2(g)=2CO 2(g)+H 2O(l),2Δf H m 标态(CO 2)+Δf H m 标态(H 2O)−Δf H m 标态(C 2H 2)=−1300kJ/mol ,2Δf H m 标态(CO 2)=−1300kJ/mol+286kJ/mol+227kJ/mol ]Δf H m 标态[(CN)2]=1095kJ/mol −1300kJ/mol+286kJ/mol+227kJ/mol=308kJ/mol (2分) [计算过程正确计算结果错误只得1分。
没有计算过程不得分。
][Δf H m 标态[(CN)2]=1095−1300+286+227=308(kJ/mol)也可以。
但不加括号只得1.5分。
]N(5)NN C C n[或…NC CNCC N C CN…](2分)[画成NNN NNN也得2分。
