2014年药品审评周报第13期
2014年第3期药讯

药讯(总第42期)药剂科主办2014年第3期2014年7月医药信息欧盟不推荐肾素-血管紧张素系统药物的联合使用 (1)FDA批准首款吸入式胰岛素Afrezza上市 (2)不良反应静脉应用胺碘酮致急性严重肝损伤一例 (3)婴儿静脉输注头孢曲松钠相关结石2例 (5)合理用药预防血栓,华法林与阿司匹林的区别 (8)孕妇抗过敏药的选用 (10)中西药联合应用的注意事项 (11)抗菌药物从皮试误区浅谈头孢菌素类抗生素的规范化应用 (13)2014版《中国泌尿外科疾病诊断治疗指南》精选 (15)新药介绍 (17)药学质量2014年4月处方点评分析与评价 (20)2014年5月处方点评分析与评价 (23)欧盟不推荐肾素-血管紧张素系统药物的联合使用欧洲药品管理局(EMA)的药物警戒风险评估委员会(PRAC)评估了作用于肾素-血管紧张素系统(RAS)、控制身体血压和体液的激素系统的不同类别药物联合使用的风险。
这些药物(称为作用于RAS的药物)包括三大类:ARB类药物(含活性物质阿齐沙坦、坎地沙坦、依普罗沙坦、厄贝沙坦、氯沙坦、奥美沙坦、替米沙坦或缬沙坦)阻断血管紧张素Ⅱ受体,阻断血管紧张素Ⅱ受体后会引起血管扩张,有助于减少肾脏对水的再吸收,从而降低血压;ACE抑制剂(贝那普利、卡托普利、西拉普利、地拉普利、依那普利、福辛普利、咪达普利、赖诺普利、莫昔普利、培哚普利、喹那普利、雷米普利、螺普利、群多普利或佐芬普利)和直接肾素抑制剂(阿利吉仑)阻断参与体内产生血管紧张素II的特定酶的作用(ACE抑制剂阻断血管紧张素转换酶,而肾素抑制剂阻断被称为肾素的酶)。
RAS参与维持身体的水盐(电解质)平衡,从而控制血压。
作用于RAS的药物用于治疗高血压(血压高)和充血性心力衰竭(一种心脏疾病,患者的心脏不能泵出足够的血液供全身使用),而有些也用于治疗某些肾脏疾病,以降低尿中蛋白质丢失。
为了达到更好的控制效果,可联合用药,但由于与单独使用一种药物相比,作用于RAS的多种药物联合使用会增加高钾血症(血钾水平高)、低血压和肾功恶化的风险,而且可能不会获得预期获益,因此,出于这种考虑,EMA对此类药物的联合使用进行了评估。
2014年5月CDE药品审评报告— 丁香园

2014年5月CDE药品审评报告——INSIGHT-China Pharma Data 数据库根据丁香园INSIGHT-China Pharma Data 数据库统计,2014年5月,CDE共承办新的药品注册申请802个(以受理号计,下同),与过去两年同期相比,增幅较大。
从过去的5个月来看,今年CDE的受理量在明显增加。
从图1可以看出,过去两年CDE每个月的受理量一直在500至700个之间浮动,只有个别月份超出这个范围。
然而今年,除了2月份的受理量与过去同期持平,其他月份受理量均超出700个,1月和5月甚至突破800。
而增加的受理量主要集中在化药部分,具体情况,如下图所示:以下,主要分析2014年5月份化药和生物制品的受理和审评情况。
(一)化药受理和审评情况1. 新药受理情况5月份,CDE共承办化药新药申请以受理号计有187个,与上月(231个)相比有所减少。
(1)1.1类新药化药新药申请中,1.1类新药申请有19个,涉及7个品种,且这7个品种均已被CDE纳入特殊审批品种列表。
表1. 2014年5月CDE受理的化药1.1类新药申请其中,天津红日药业股份有限公司的对甲苯磺酰胺注射液(PTS)为新药上市申请,其余品种均为新药临床申请。
对甲苯磺酰胺是国内外第一个通过肿瘤体内注射给药的高效、广谱、低毒、特异识别染色的抗癌药物,此次红日药业申报的适应症为严重气道阻塞的中央型肺癌。
从INSIGHT-China Pharma Data数据库中查询对甲苯磺酰胺注射液(受理号:CXHS1400080)的审评情况,如图4所示,我们能清晰地看到它到目前为止在CFDA和CDE的所有事件记录,5月29日已被CDE按特殊审批品种纳入NDA(新药生产上市申请)审评任务序列,目前处于排队待审评状态。
作为特殊审批品种,该药的审评将可以走绿色通道,或许能在未来两到三年取得上市许可。
另外,红日药业在去年4月份申报的用于治疗脓毒症的1.1类化药新药注射用甲磺酸苦柯胺B已被批准临床,即将拿到临床批件。
INSIGHT 数据分析:2014 年 4 月 CDE 药品审评报告

INSIGHT 数据分析:2014 年4 月CDE 药品审评报告近日丁香园INSIGHT 药学数据库整理分析了 2014 年4 月CDE 受理药品注册申请,申请总数共774 个(以受理号计,下同)。
其中,受理的化药申请为687 个,约占总受理量的89%;中药申请33 个;生物制品申请47 个;药用辅料申请7 个。
具体受理情况见表1:表1. 2014 年4 月CDE 药品受理情况以下,分别为2014 年4 月份化药、中药和生物制品的受理和审评数据。
(一)化药受理和审评情况4 月份的化药受理情况如图1 所示:图1. 2014 年4 月CDE 化药受理情况1. 新药受理情况:4 月份,CDE 共受理化学药品新药申请231 个。
其中,注册分类为1 类的有21 个,涉及11 个品种。
这11 个品种中,银谷制药有限责任公司的苯环喹溴铵鼻用喷雾剂为新药上市(生产)申请,其余品种均为新药临床申请。
苯环喹溴铵用于治疗变应性鼻炎,是我国首次合成的一种新型M 胆碱受体拮抗剂。
此上市申请若获批,有望成为全球首次上市品种。
图2. 2014 年4 月化药新药各个注册分类的受理情况申报受理的1 类化药新药中,1.1 类新药相关数据:表2. 2014 年4 月CDE 受理的化药1.1 类新药值得关注的是,4 月份共有双替尼他和伯瑞替尼两个替尼类1.1 类新药申报。
从INSIGHT-China Pharma Data 数据库查询得知,2014 年1 月1 日至5 月底,抗肿瘤药替尼类药物的申报以受理号计已多达106 个,其中1.1 类新药有12 个,涉及4 个品种,均为临床申请。
而从2011 年1 月1 日至5 月底,已先后有15 个替尼类1.1 类新药获得临床批准,但目前国内已上市的只有浙江贝达药业的埃克替尼。
替尼类药物的研发依然呈现出火热的态势。
4 月份,申报的2 类化药新药(改变给药途径且尚未在国内外上市销售的制剂)只有1 个,是丽珠集团丽珠制药厂申报的注射用甲磺酸吉米沙星。
2014年生产批文和临床批件回顾

2014年生产批文和临床批件回顾2015-01-04白小空咸达数据导读:谈及2014年对CDE的看法,坊间大多数就一个字,“慢”。
审评速度慢造就了不少段子。
此处抄袭某段子献给已经到来的2015年和CDE2015年审评计划:“对于CDE来说,2015的审评目标就是搞定2014年那些原定于2013年完成的安排,不为别的,只为兑现CDE2012年时要完成的2011年审评计划的诺言。
”在2015年的第一天,一起回顾与梳理药监局2014年的生产批文与临床批件实时数据,以献给相信“新的一年,新的自己”的各位童鞋们。
若本文数据与此前本人文章数据冲突的,以本文数据为准。
根据咸达数据V3.0的最新统计(截止2014年12月31日),国家局更新最新的生产批文所对应的获批时间是2014年12月25日。
2014年新批生产批文共478件(按受理号记,删除再注册相关批文,其中国产418,进口60)。
化学药品以438件占整体批文数93%的份额,中药以18件排名第二,生物制药13件生产批文排第三(见图1)。
化学药品中,国内厂家的批文数为383件,进口55件。
图1 2014年新批生产批文数以药品通用名计算(不包含辅料、原料药、中间体剂型),氨溴索的获批数最多,共10件生产批文,其次是兰索拉唑的7件,第三是泮托拉唑的6件。
氨溴索和兰索拉唑都在药监局公布的过度重复申报注册的药品品种目录之中。
替尼类产品有三个通用名产品获批,分别是甲磺酸阿帕替尼和伊马替尼。
甲磺酸阿帕替尼片恒瑞以1.1类新药申报,原料药甲磺酸阿帕替尼批文由江苏盛迪医药公司获得。
石药集团欧意药业有限公司的甲磺酸伊马替尼片是国内第二家上市的。
格列卫江苏豪森在2013年国内第一家仿制上市。
糖尿病新获批药品和DDP-4相关的是诺华的二甲双胍维格列汀片(Ⅱ)和二甲双胍维格列汀片(Ⅲ),于2014年12月新上市。
消化系统用药中,江苏奥赛康药业股份有限公司的注射用雷贝拉唑钠抢在本年12月获批,南京长澳制药有限公司享受了半年多的独家剂型期结束。
2014年批准重要治疗领域药品

2014年批准重要治疗领域药品情况一览医药来源:新康界时间:2015/3/16责任编辑:chengpeng评论繁体2014年批准重要治疗领域药品情况2014年,经过药审中心的审评,提出建议批准以下多个重要治疗领域的药品上市,为患者获得最新治疗手段提供了可能性,也为患者用药可及性提供了重要保障。
(一)抗肿瘤用药1.甲磺酸阿帕替尼片我国自主研发的首个血管内皮细胞生长因子受体(VEGFR)抑制剂,也是全球首个批准用于治疗晚期胃癌的小分子靶向产品。
胃癌是我国高发肿瘤,晚期胃癌二线化疗失败后目前尚无公认的有效治疗选择,存在迫切临床需求。
该产品的上市,对胃癌患者的治疗提供了新的用药选择。
2.西达本胺片我国自主研发的首个组蛋白去乙酰化酶抑制剂,也是国内首个批准用于治疗复发难治的外周T细胞淋巴瘤的药物。
复发难治的外周T细胞淋巴瘤缺乏有效治疗,预后差,该产品上市对复发难治外周T细胞淋巴瘤治疗提供了新的治疗机会。
3.多西他赛注射液紫杉醇类化疗药,微管解聚抑制剂,已在我国批准用于乳腺癌、非小细胞肺癌,以及非激素依赖的前列腺癌的患者。
现国内批准增加晚期胃癌的新适应症,为胃癌患者的治疗提供了新的用药选择。
4.盐酸帕洛诺司琼注射液5-羟色胺3(5-HT3)受体的竞争性拮抗剂,已在我国批准用于预防肿瘤患者因化疗引起的恶心和呕吐。
现国内批准增加用于预防术后24小时恶心呕吐的新适应症,为外科手术患者提供了预防术后恶心呕吐的新治疗手段。
(二)疫苗领域5.Sabin株脊髓灰质炎灭活疫苗(sIPV)我国自主研发的全球首个Sabin株脊髓灰质炎灭活疫苗(单苗),填补了我国在脊髓灰质炎灭活疫苗生产领域的空白,消除了目前计划免疫规划中数千万剂使用的口服脊髓灰质炎减毒活疫苗潜在的致病危险(疫苗株或衍生株引发的相关病例),安全性更好。
药审中心按特殊审批程序完成了该疫苗上市注册申请的审评,有效配合了WHO全球根除脊髓灰质炎病毒的行动计划。
同时,该疫苗的批准上市,对我国乃至全球,特别是发展中国家消灭脊髓灰质炎都会产生积极的影响。
2015.01.04 2014年度药品监管回顾-蒲公英

2014年11月4 日至5日
祝大家在新的一年里健康、快乐、幸福!
2015-01-01
三、2014年部分省市专项整治情况
检查 责令整 改 立案 移送司 法 约谈 严重警 告 停产整 顿 收回 GMP证 书 3
湖南
68
54
26
2
8
四川
78
8
2
2
山东
19
16
1
4
9
广东
19
祝大家在新的一年里健康、快乐、幸福!
二、2014年国家局飞行检查情况
时间 企业名称 检查原因 存在问题
生产冠心丹参胶囊时 存在涉嫌未按处方投 料、使用三七粉代替 三七、丹参药材未经 提取即投料以及药材 供应商审计不全等违 法违规行为。
处理结果
长春远大 2014年8月23 国奥制药 日至24日 有限公司
收回GMP证 书,立案查处, 涉嫌犯罪移交 公安机关。
征求 意见 稿
2014.05.12
2014.06.17 2014.11.02 2014.12.17
国家食品药品监督管理总局关于《食品药品投诉举报管理 办法﹙征求意见稿﹚》公开征求意见的通知
2015-01-01
祝大家在新的一年里健康、快乐、幸福!
一、2014年国家局发布的关键法规
分类 时间 内容 实施时间 2014.06.01 《食品药品行政处罚程序规定》(国食药监督总 2014.04.28 局令第3号) 食品药品监管总局关于印发药品生产现场检查风 2014.05.13 险评定指导原则的通知 已颁 2014.07.09 国家药品计划抽验质量分析指导原则 布法 规规 2014.07.10 重大食品药品安全违法案件督办办法 章 食品药品监管总局关于加强中药生产中提取和提 2014.07.29 取物监督管理的通知 食品药品监管总局关于贯彻实施药品委托生产监 2014.08.14 督管理规定的通知
2014年药讯第1期(网)

★药事管理★2014年一季度全院药品安全性监测通报药品不良反应监测1.指标情况本季度药品不良反应上报例数52例,其中严重不良反应8例,占比15.4%;新的不良反应1例,占比1.9%;医生上报31例,占比59.6%;出院病人15338人,总的不良反应上报率为出院患者的0.3%。
引起不良反应的前5位药物分布及发生例数:其他药物不良反应尚有:莫西沙星注射液(拜复乐)、注射用阿莫西林舒巴坦(舒萨林)、氟尿嘧啶注射液、注射用吉西他滨(泽菲)、注射用奈达铂(捷佰舒)、依托泊苷注射液、顺铂注射液(诺欣)、注射用炎琥宁各2例;氨茶碱注射液、丹参川芎嗪、注射用甘露聚糖肽(力尔凡)等25个药品各1例。
2.与上季度比较图1 不良反应上报情况对比图2 本季度上报趋势图如图1、图2所示,本季度上报例数较上季度减少,不良反应上报率从上季度的0.4%下降到0.3%。
新的不良反应上报例数及严重不良反应上报例数均减少,医生上报数量占比增加。
2月份ADR上报数量与其他月份差异明显,可能与春节期间住院人数较少,医护人员上报意识不高有关。
3.提示临床警惕新的药品不良反应序号药品名称不良反应提醒1)ADR上报系统嵌入医生、护士工作站后,方便了医护人员上报,但仍应加强对医护人员的宣传和教育,强化不良反应上报意识;病区药品不良反应监测员应切实履行不良反应监测责任,避免药品不良反应漏报,提高上报率;2)对于不良反应上报数量较少的月份,及时分析原因,避免漏报;3)加强对药品不良反应的分析、总结,及时发布预警信息,加强用药安全;4)对于新出现的和严重的ADR,药学人员做好后期宣传工作,提醒其他专科;需要时可以配合医护人员做好解释、沟通工作。
用药错误监测1.指标情况本季度全院共发生用药错误5例,具体结果见下表。
2014年第一季度用药错误汇总数据序号事件时间错误等级类型2 给需要补充氯化钠的患者补充了氯化钾输液2014.1.24 2级给药错误3 多给患者输注了胰岛素注射液2014.1.28 2级多给药本季度共发生5例用药错误。
「2014年我国批准上市药品情况分析」

2014年我国批准上市药品情况分析根据咸达数据对已公开数据的统计,2014年获批上市的药品共507个,相比2013年的602个和2012年的593个,为近3年最低。
一、化药2014年获批上市的化药为466个,其中仿制药220个,新药127个,进口药63个。
相比前两年有所减少:2013年批准上市的化药为506个,2012年则为494个。
1、1.1类2014年获批上市的1.1类新药有10个,涉及3个品种,分别是江苏恒瑞医药股份有限公司的重磅胃癌靶向药物阿帕替尼(原料和片剂),江苏豪森药业股份有限公司的抗菌药物吗啉硝唑(原料药和注射剂),湖南方盛制药股份有限公司、万特制药(海南)有限公司和苏州二叶制药有限公司的阿德福韦酯(原料),以及湖南华纳大药厂有限公司的阿德福韦酯(片剂)。
这3个药物中最值得关注的应该是恒瑞公司的阿帕替尼片。
其商品名为艾坦,是全球第一个在晚期胃癌中被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,疗效最好的单药。
同时,该药还是胃癌靶向治疗药物中惟一的口服药物,可有效提高患者的依从性,并能减少治疗费用。
2014年6月,该药的临床研究被美国临床肿瘤学会(ASCO)选作大会报告。
这是我国创新药物研究第一次在全球顶级学术会议亮相,第一次入选ASCO的优秀研究。
豪森公司的吗啉硝唑氯化钠注射液,商品名为迈灵达,规格为100毫升∶0.5克,即由100毫升0.9%的氯化钠溶液与0.5克吗啉硝唑组成。
该药属于临床急需的新型第三代硝基咪唑类抗菌药,适用于对吗啉硝唑敏感的厌氧菌所引起的外科感染和妇科感染。
临床研究表明,该药具有良好的安全性和有效性,其成功上市将为临床提供新的抗感染治疗方案。
豪森公司于2002年对吗啉硝唑进行立项研究,研发历时12年,费用高达3000多万元人民币。
阿德福韦酯片目前已经有多家上市。
值得说明的是,2013年我国批准上市的1.1类新药为4个,涉及两个品种;2012年则没有1.1类新药获批上市。
国家药品不良反应监测年度报告(2014年)

国家药品不良反应监测年度报告(2014年)为全面反映2014年我国药品不良反应监测情况,促进临床合理用药,保障公众用药安全,依据《药品不良反应报告和监测管理办法》,国家食品药品监督管理总局组织编撰国家药品不良反应监测年度报告(2014年)。
一、药品不良反应监测工作情况2014年,全国药品不良反应监测工作取得新进展:监测网络覆盖面进一步拓宽,报告数量进一步增长。
2014年,全国已有24万余个医疗机构、药品生产经营企业注册为药品不良反应监测网络用户,并通过该网络报送药品不良反应报告,其中医疗机构仍是报告的主要来源。
全国94.4%的县有药品不良反应报告,全国每百万人口平均报告数量达到991份,较 2013年有一定增长,表明我国发现和收集药品不良反应信息的能力进一步增强。
深入开展数据评价分析,提高风险信号挖掘能力。
2014年通过日监测、周汇总、季度分析等方法加强对国家药品不良反应监测数据库数据的评价分析,深入挖掘药品风险信号,对阿德福韦酯、胞磷胆碱钠、苯溴马隆等近50个(类)品种进行了安全性评价,并采取了相应的风险管理和沟通措施。
建立全国联动工作机制,发挥监测预警能力。
进一步完善药品聚集性事件预警平台,建立预警信息全国共享、事发地和生产企业所在地食品药品监管部门协同调查处置联动工作机制,保证药品质量风险的早发现、早评价、早控制。
全年重点分析评价137条预警信息,及时发现并处置了湖北同济奔达鄂北制药有限公司核黄素磷酸钠注射液、安徽联谊药业股份有限公司胞磷胆碱钠注射液、吉林省集安益盛药业有限公司生脉注射液等多起因药品质量问题引发的不良事件,有效保障公众用药安全。
推动企业落实责任,提高风险管理水平。
2014年积极推进药品定期安全性更新报告工作,加强对企业撰写报告质量的培训,严格开展对报告的审核,促进企业落实风险管理意识;完善药品不良反应数据共享平台,及时将监测数据和风险信号反馈药品生产企业,指导企业进行数据分析评价与利用,督促企业落实安全风险主体责任,持续提高药品安全保障水平。
2014年10月CDE药品审评报告(INSIGHT)
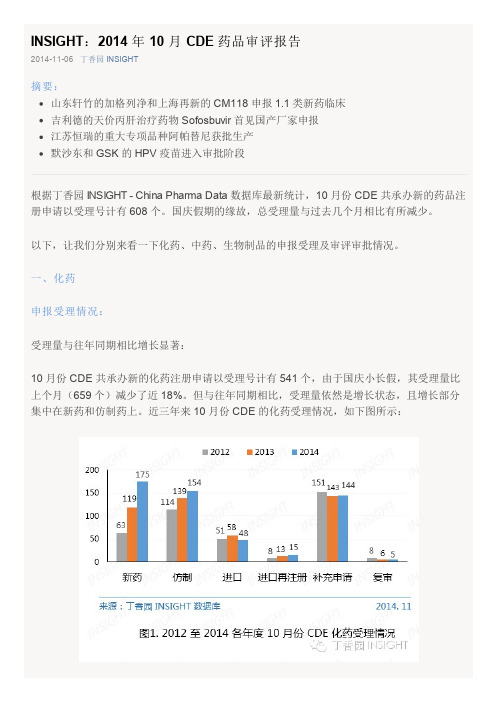
INSIGHT:2014 年 10 月 CDE 药品审评报告2014-11-06丁香园 INSIGHT摘要:山东轩竹的加格列净和上海再新的 CM118 申报 1.1 类新药临床吉利德的天价丙肝治疗药物 Sofosbuvir 首见国产厂家申报江苏恒瑞的重大专项品种阿帕替尼获批生产默沙东和 GSK 的 HPV 疫苗进入审批阶段根据丁香园 INSIGHT - China Pharma Data 数据库最新统计,10 月份 CDE 共承办新的药品注册申请以受理号计有 608 个。
国庆假期的缘故,总受理量与过去几个月相比有所减少。
以下,让我们分别来看一下化药、中药、生物制品的申报受理及审评审批情况。
一、化药申报受理情况:受理量与往年同期相比增长显著:10 月份 CDE 共承办新的化药注册申请以受理号计有 541 个,由于国庆小长假,其受理量比上个月(659 个)减少了近 18%。
但与往年同期相比,受理量依然是增长状态,且增长部分集中在新药和仿制药上。
近三年来 10 月份 CDE 的化药受理情况,如下图所示:1. 新药10 月份,CDE 共承办新的化药新药申请以受理号计有 175 个。
其中,1.1 类新药有 5 个,涉及 2 个品种;3.1 类新药有 129 个,涉及 55 个品种。
(1)1.1 类新药山东轩竹的加格列净和上海再新的 CM118 申报临床:丁香园 INSIGHT - China Pharma Data 数据库显示,10 月份共有 2 个化药 1.1 类新药品种进入 CDE,分别是山东轩竹的抗糖尿病药物加格列净和上海再新的抗肿瘤药物 CM118,均为临床申请。
详细数据如下所示:加格列净,是四环医药子公司山东轩竹继 DPP-4 抑制剂依格列汀之后申报的又一个用于治疗2 型糖尿病的 1.1 类新药,相关专利见 WO 2013000275 A1。
该药为钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,通过阻断肾脏对大部分葡萄糖的重吸收,促进葡萄糖从尿液中排出,从而有效降低糖尿病患者的血糖水平。
2014年度中国药品审评榜单

2014 年度中国药品审评榜单2015-01-19 18:07 来源:丁香园作者:丁香园Insight字体大小- | +导读:2014年已经翻过去。
这一年,最具有人气话题的药品是丙肝药Sofosbuvir,其热度贯穿年首到年终;最具人气话题的政策是药品审评的时限,审评过慢的问题还在,但挡不住国内企业的申报热情。
替尼类肿瘤药的申报蜂拥而至,国内恒瑞首先冲出重围拿下了阿帕替尼。
全球糖尿病药物DPP-4抑制剂、SGLT2 抑制剂和GLP-1受体激动剂的上市浪潮此起彼伏,国内多家企业陆续争相申报。
「冰桶挑战」唤醒了大众对罕见病的关注,孤儿药申报也应声而上。
全球专利药大面积到期,首仿药的春天随之来到,白云山金戈抢先上市。
仿制药仍大量重复申报,但重复不过人们对中国药品市场的希望。
丁香园Insight – China Pharma Data 数据库倾情打造2014年度中国药品审评榜单,为这一年的中国药品审评盘点,记录医药行业这一年走过的路径。
「药品品种篇」最佳“原创”药品奖甲磺酸阿帕替尼:明显延长晚期胃癌生存期的单药江苏恒瑞的甲磺酸阿帕替尼片(商品名:艾坦)是第一个安全有效的晚期胃癌小分子抗血管生成靶向药物,可明显延长晚期胃癌标准化疗失败后的生存期。
「阿帕替尼」这一年赚足了人气,也为江苏恒瑞赚足了股票,荣获「2014 年度最佳“原创”药品奖」。
吗啉硝唑氯化钠注射液是江苏豪森第一个自主研发的新药,2014 年 3 月获批上市(见表1)。
另一个获批上市的新药是阿德福韦酯,该药并非首次上市,市场上已有 7 家企业生产获批1.1 类阿德福韦酯(原料药和片剂),同时12 月CFDA 通报了阿德福韦酯的低磷血症及骨软化不良反应,使得阿德福韦酯的市场并不乐观。
3.1 类药品最具人气奖阿齐沙坦:申报企业数量25阿齐沙坦是用于高血压的血管紧张素II 受体拮抗剂,原研厂家为武田制药。
3.1 类的阿齐沙坦在2014 年新增了25 家申报企业后,其申报企业总数达到了49 家,获得「2014 年度 3.1 类药品申报最具人气奖」。
2014上半年中国药品申报受理情况回顾

2014上半年中国药品申报受理情况回顾2014已年过半载,回顾上半年药品的申报受理情况现在,我们以权威的数据为支撑,对2014上半年药品申报受理情况进行系统地分析,呈现给大家。
根据INSIGHT-China Pharma data 数据库统计,2014上半年CDE共承办新的药品注册申请4551个(以受理号计,下同),成为历史新高,较往年同期相比,增幅较大。
图1显示,往年CDE上半年的药品总体受理量在3500个左右波动,而今年上半年竟已超过4500个,与去年同期相比,增幅高达22%。
其中,增加的部分主要集中在化药部分,而中药和生物制品的受理量较往年相比略有减少。
具体情况,如下图所示:以下,分别分析2014上半年化药、中药、生物制品的申报受理情况。
一、化药的申报受理情况化药申报数量大幅增加,新药申请、仿制药申请均创下历史新高:1. 新药受理情况新药申请大幅攀升,主要体现在3.1类:今年上半年,新申报的化药新药注册申请以受理号计多达1129个,创下历史新高,较去年同期相比增幅达43%,其中增长部分主要集中在3.1类新药申请上。
具体情况,如图3所示。
近两年,化药新药的受理量逐年攀升,这也与国家鼓励药物创新有关。
以下,让我们着重来回顾一下今年上半年化药1.1类和3.1类新药的申报受理情况。
(1)1.1类新药:上半年共有2个1.1类新药品种申报上市,37个1.1类新药品种申报临床:上半年,新申报的化药1.1类新药注册申请有101个,涉及39个品种。
其中,只有银谷制药的鼻炎用药苯环喹溴铵鼻用喷雾剂和天津红日药业的抗肿瘤药物对甲苯磺酰胺注射液这两个品种为上市申请,其余37个品种均为临床申请。
申报临床的1.1类新药数据,如下所示:表1. 2014上半年新申报的化药1.1类新药临床申请其中,江苏恒瑞有3个化药1.1类新药品种申报临床,位居榜首;广东东阳光药业和中国科学院上海药物研究所分别有两个1.1类新药品种申报。
稳定性研究

2014 年11 月CDE 药品审评报告INSIGHT - China Pharma Data2014 年12 月2014 年11 月CDE 药品审评报告——丁香园Insight 数据库要点:∙东阳光14年新报1.1类抗丙肝药依米他韦已获批临床∙军科院申报拟抗埃博拉药物法匹拉韦∙吉利德天价丙肝治疗药物 Sofosbuvir 国内又增三家企业申报∙南京华威的安眠药雷美替胺获批临床,未来或成首仿_____________________________________________________________________________________________根据丁香园Insight 数据库最新统计,11 月份CDE 共承办新的药品注册申请以受理号计有673 个,与上个月(608 个)相比有所增加。
总体来看,今年各个月份CDE 的药品受理总量保持在相对稳定状态。
以下,让我们分别来看一下化药、中药和生物制品的申报受理及审评审批情况。
INSIGHT 系列报告一、化药申报受理情况:11 月CDE 共承办新的化药注册申请以受理号计有594 个,与上个月(541 个)相比略有增加。
其中各个申请类型的具体数据如下所示:1. 新药11 月份CDE 共承办新的化药新药申请206 个,其中临床申请194个,上市申请12个。
(1)1.1类新药11 月份仅有1 个化药1.1类新药品种申报临床:根据丁香园Insight 数据库显示,11 月份仅有 1 个化药 1.1 类新药品种申报临床,与往月相比有所减少,是华润医药集团旗下的中国医药研究开发中心有限公司申报的紫杉醇(聚双谷氨酸钠偶合型)原料药及注射剂。
紫杉醇是临床上广泛应用的抗肿瘤药物,可以促进微管聚合和稳定已聚合微管,以阻止癌细胞的分裂与增殖,从而达到抗癌作用。
紫杉醇已上市多年,可与其他抗肿瘤药物联用,主要用于治疗卵巢癌、乳腺癌等,近年来又不断被批准用于其他适应症,如胰腺癌、宫颈癌、非小细胞肺癌等。
2014年的药品通告

2014年的药品通告【篇一:2014年第3期《药品质量公告》中不合格药品明细】2014年第3期《药品质量公告》中不合格药品明细【篇二:(0-目录)2014年cfda法规-工作文件-公告-通告-通知(含链接)】? 行政法规《医疗器械监督管理条例》(国务院令第650号)(2014-3-7) ? 部门规章? 医疗器械分类关于征求《医疗器械命名规则(试行)》(征求意见稿)意见的通知 (2014-08-05)关于征求《医疗器械分类规则》(修订草案征求意见稿)意见的通知 (2013-12-24)国家食品药品监督管理总局关于发布需进行临床试验审批的第三类医疗器械目录的通告(2014年第14号) (2014-08-25)国家食品药品监督管理总局关于发布免于进行临床试验的第三类医疗器械目录的通告(2014年第13号) (2014-08-21)国家食品药品监督管理总局关于发布免于进行临床试验的第二类医疗器械目录的通告(2014年第12号) (2014-08-21) 国家食品药品监督管理总局关于发布第一类医疗器械产品目录的通告(第8号)(2014-05-30)食品药品监管总局关于印发体外诊断试剂分类子目录的通知 (2013-11-26)? 分类界定通知:食品药品监管总局办公厅关于恒温核酸扩增检测仪等22个产品分类界定的通知 (2015-06-11)食品药品监管总局办公厅关于人工血管接环等172个产品分类界定的通知 (2015-05-18)食品药品监管总局办公厅关于乳腺摄影立体定位装置等153个产品分类界定的通知 (2015-03-31) 食品药品监管总局办公厅关于腹腔镜手术用内窥镜自动调控定位装置等61个产品分类界定的通知 (2014-11-24) 食品药品监管总局办公厅关于交联胺化聚乙烯醇泡沫封堵肺减容系统等34个产品分类界定的通知 (2014-09-22)食品药品监管总局办公厅关于电子宫腔观察镜等30个产品分类界定的通知 (2014-08-01)食品药品监管总局办公厅关于角膜治疗仪等12个产品分类界定的通知(2014-05-22)? 医疗器械通告:通告(2014年第11号)通告(2014年第10号)见注册技术审查指导原则国家食品药品监督管理总局关于发布医疗器械产品技术要求编写指导原则的通告(第9号) (2014-05-30)国家食品药品监督管理总局关于发布第一类医疗器械产品目录的通告(第8号) (2014-05-30)通告(2014年第7号)见注册技术审查指导原则通告(2014年第6号)见注册技术审查指导原则通告(2014年第5号)见注册技术审查指导原则通告(2014年第4号)????国家食品药品监督管理总局关于发布软性亲水接触镜等两个说明书编写指导原则的通告(第3号) (2014-04-17) 通告(2014年第2号)见注册技术审查指导原则通告(2014年第1号)????? 医疗器械公告:国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告(2014年第64号) (2014-12-29)国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告(2014年第58号) (2014-12-12)关于医疗器械(含体外诊断试剂)注册申报有关问题的公告(第129号) (2014-11-25)【篇三:最近sfda药物临床试验机构资格公告清单(2014-10-20)】国家食品药品监督管理局药物临床试验机构资格认定公告(第1号)国食药监安[2005]50号 2005年02月03日发布根据《中华人民共和国药品管理法》的有关规定,依据《药物临床试验机构资格认定办法(试行)》,经资料审查和现场检查,中国人民解放军第三○二医院等17家医疗机构基本具备承担药物临床试验的条件,同意认定其具有药物临床试验机构资格并颁发证书,现予以公告。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
八年辛苦谁人知,一朝上市天下晓,欲知详情且看“审评周报第13期”
编者:这周进入审批的药物比上周少,但是审批完毕的药物非常多,有一些结论已经出来了,批准的不多,发补的很多,各位,看看有你关心的吗?
导读:根据咸达数据库本周最新信息(2014.10.27-2014.11.2),进入国家局审批阶段的药物共30个(按受理号计,下同),其中18个化药,2个中药,9个治疗用生物制品,1个体外诊断试剂;审批完毕的药物共97个,其中88个化药,3个中药,5个治疗用生物制品,1个预防用生物制品;制证完毕的药物共33个,其中32个化药,1个治疗用生物制品。
具体信息如下(仅介绍化学药物):
在审批
18个在审批化药中,3个进口再注册(辉瑞的托西酸舒他西林片-JYHZ1300088以及Chiesi Farmaceutici S.p.A.的猪肺磷脂注射液-JYHZ1300090和JXHL1300484),6个进口,3个3.1类,1个3.2类,5个6类,具体如下:
表1:在审批的进口药物
数据来源:咸达数据黄金版2014.11
替格瑞洛片目前已在国内进口上市,用于急性冠脉综合征(不稳定性心绞痛、非ST段抬高心肌梗死或ST段抬高心肌梗死)患者,包括接受药物治疗和经皮冠状动脉介入(PCI)治疗的患者,降低血栓性心血管事件的发生率。
与氯吡格雷相比,本品可以降低心血管死亡、心
肌梗死或卒中复合终点的发生率,两治疗组之间的差异来源于心血管死亡和心肌梗死,而在卒中方面无差异。
尽管是氯吡格雷的下一代,但是其销售额却远远不如氯吡格雷啊。
维格列汀是一种DPP-4(二肽基肽酶4)抑制剂,可单独或和二甲双胍、噻唑烷酮类联用于治疗2型糖尿病,2007年最先被欧盟EMA批准,由于安全性问题暂时未被美国FDA批准,2011年在中国进口获批。
维格列汀与二甲双胍的复方制剂目前也已在欧盟上市,共有两个规格维格列汀/二甲双胍:50mg/850mg或50mg/1000mg。
雷米普利是一个前体药物,经胃肠道吸收后在肝脏水解生成雷米普利拉-具有活性的、强效和长效的血管紧张素转化酶(ACE)抑制剂。
目前国内进口和国产均有上市。
利福布汀为一个含有螺哌嗪基的利福霉素衍生物,具广谱抗菌活性。
其作用机制与利福平一样,可与微生物的DNA依赖性RNA多聚酶β亚基形成稳定的结合,抑制该酶活性,从而抑制细菌RNA的合成。
在国外已被批准用于预防和治疗HIV感染者鸟分枝杆菌-胞内分枝杆菌复合体(MAC)的广泛播散性感染,也用于多重耐药结核病的治疗。
目前国内仅有四川明欣药业有限责任公司被批准原料药和胶囊剂。
表2:在审批的国产药品
数据来源:咸达数据黄金版2014.11
盐酸甲哌卡因是一种氨基类局部麻醉剂,用于口腔及牙科治疗中的局部浸润麻醉(神经传导阻滞型)。
在麻醉剂中加入肾上腺素可减缓盐酸甲哌卡因在人体内的运行速度,以确保麻醉时间和效果,并在一定程度上减小了用量。
目前本品在国内由辰欣药业股份有限公司上市,进口由法国SEPTODONT公司上市,此外,该公司还上市了盐酸甲哌卡因/肾上腺素注射液。
审批完毕
88个审批完毕的化药中,3个复审(南京海纳医药科技有限公司的硝酸芬替康唑及其凝胶,鲁南贝特制药有限公司的阿莫西林克拉维酸钾分散片(8:1)),1个进口再注册(韩美精密化学株式会社的注射用头孢他啶),17个进口,4个1.1类,27个3.1类,6个3.2类,1个3.3类,2个5类,27个6类,具体如下:
表3:审批完毕的进口药品
表4:审批完毕的1类新药
表5:审批完毕的3类新药
四川百利药业有限责任公司的注射用盐酸尼非卡兰已经批准生产,不出意外应该是首家在国内上市。
本品是由德国和日本共同开发的新型Ⅲ类抗心律失常药物。
该药属非选择性钾通道拮抗剂,能有效控制折返引起的快速室性心律失常,对缺血性心律失常有较好的疗效。
江苏笃诚医药科技有限公司的米诺膦酸片与四川方向药业有限责任公司的布洛芬注射液也获准生产。
北京福瑞康正医药技术研究所的阿维莫泮胶囊、北京科莱博医药开发有限责任公司的溴甲纳曲酮注射液、成都恒瑞制药有限公司的拉呋替丁片、北京汇诚瑞祥医药技术有限公司的复方奥美拉唑胶囊、河北武罗药业有限公司的复方奥美拉唑干混悬剂、长春富春制药有限公司的奥美拉唑碳酸氢钠胶囊、迪沙药业集团有限公司的普卢利沙星片、苏州致君万庆药业有限公司的注射用头孢拉宗钠、湖北广济药业股份有限公司的阿德福韦酯片、开封制药(集团)有限公司的硝酸芬替康唑乳膏、重庆医药工业研究院有限责任公司的伊潘立酮片,以及济南百诺医药科技开发有限公司的布南色林片均书面发补,各大药企们还得加把劲啊。
表6:审批完毕的5类和6类药物(除去一个氧)
数据来源:咸达数据黄金版2014.11
辽宁绿丹药业有限公司的磷霉素钙分散片书面发补。
制证完毕
32个制证完毕的化药中,2个进口再注册(礼来的注射用培美曲塞二钠和德国保时佳大药厂的硝酸甘油喷雾剂),9个进口,4个1.1类,10个3.1类,1个5类,6个6类,具体如下:
表7:制证完毕的进口药品
美国华生制药股份有限公司的奥昔布宁透皮贴剂书面发补。
本品是由默沙东公司研发的全球首个可用于治疗女性膀胱过动症的非处方药。
表8:制证完毕的新药
数据来源:咸达数据黄金版2014.11
甲磺酸阿帕替尼片上市了,本品是江苏恒瑞医药股份有限公司自主研发的1.1类抗肿瘤新药,临床拟用于治疗二线化疗失败的晚期胃癌。
本品2006年4月申报临床,2007年4月批准临床,2011年8月才申报生产,2014年批准生产,8年半的时间,不知会得到多少的回报,期待有个好的销售额。
吉林省西点药业科技发展股份有限公司的草酸艾司西酞普兰片目前正在进行生产现场核查,目测也要获批了。
而四川科瑞德制药有限公司的盐酸替扎尼定口腔崩解片书面发补。
表9:制证完毕的仿制药
数据来源:咸达数据黄金版2014.11
四川美大康佳乐药业有限公司的酮咯酸氨丁三醇注射液书面发补。
科林盛泰医药科技开发有限公司整理
北京科林盛泰医药在注册申报,临床试验,第三方稽查,医药资料撰写和翻译等技术领域为您提供优质服务。
