2011年药品审评中心CDE-审评人员完整名单及联系方式
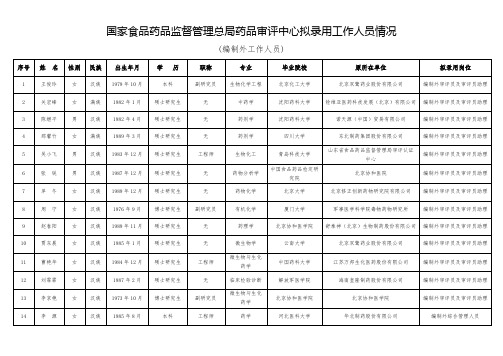
国家食品药品监督管理总局药品审评中心拟录用工作人员情况
11
曹艳华
女
汉族
1984年12月
硕士研究生
工程师
微生物与生化药学
中国药科大学
江苏万邦生化医药股份有限公司
编制外审评员及审评员助理
12
刘霏霏
女
汉族
1987年2月
硕士研究生
无
临床检验诊断
解放军医学院
海南皇隆制药股份有限公司
编制外审评员及审评员助理
13
李京艳
女
汉族
1973年10月
博士研究生
工程师
生物化工
青岛科技大学
山东省食品药品监督管理局审评认证中心
编制外审评员及审评员助理
6
张锐
男
汉族
1987年12月
硕士研究生
无
药物分析学
中国食品药品检定研究院
北京协和医院
编制外审评员及审评员助理
7
单冬
女
汉族
1989年12月
硕士研究生
无
药物化学
北京大学
北京修正创新药物研究院有限公司
编制外审评员及审评员助理
国家食品药品监督管理总局药品审评中心拟录用工作人员情况
(编制外工作人员)
序号
姓名
性别
民族
出生年月
学历
职称
专业
毕ห้องสมุดไป่ตู้院校
原所在单位
拟录用岗位
1
王俊玲
女
汉族
1979年10月
本科
副研究员
生物化学工程
北京化工大学
北京双鹭药业股份有限公司
编制外审评员及审评员助理
2
关宏峰
女
满族
药品注册审评CDE组织机构人员信息

药品注册审评CDE最新组织机构、审评流程和人员信息一、CDE组织机构:原管协部二、不同类别的注册申请在不同申报阶段对应的审评部门:按照药品注册分类,不同类别临床试验申请和注册申请的审评部门不同,具体划分如下:注:1、所有的药品申请在各阶段的审评都有业务管理部的参与,表中略;2、表中的“临床”指的是化药临床一部或者二部,具体按品种适应症分。
三、化药相关审评部门人员如下:※:表示主持工作的负责人四、CDE 简易审评流程图:注意事项: (1)药品审评中心自2010年4月6日起在具体注册申请的技术审评过程中同步完成质量标准、说明书、包装标签等文件的修订审核工作,请注册申请人在注册申请到达我中心后及时通过CDE 网站电子提交系统提交相关电子文件。
(2)技术审评阶段如存在以下情况,有可能会影响审评进度,请您关注:请务必在我中心专业审评阶段结束前登陆我中心网站电子提交系统提交相关电子文档(注意根据注册申请的具体事项确定提交的具体内容)。
电子提交工作将有助于提高审评工作的效率。
(3)关注检验报告提示:注册申请如要求提交检验报告,请务必关注检验报告的寄交情况。
如专业审评时仍未收到检验报告,将暂停审评,同时暂停审评计时。
(4)业务管理部接收申报资料后,将对申报资料进行立卷审查:确认电子任务与物理资料是否同步到达、是否缴纳审评费、是否提交研制现场核查报告、仿制药是否提交生产现场检查报告及动态检验报告。
上述条件均满足后,将正式启动审评。
五、CDE 发布的《药品技术审评原则和程序》及审评流程图:详见:/regulat.do?method=view&id=2133专业审评中综合评价技术审核文件制作与中心审核签发业务管理部接受资料业务管理部分配任务审评部安排审评计划呈送SFDA等待执行其它业务药品技术审评简化程序示意图主审人部长部长分配任务主审人部长部长分配任务部长中心主任参审人参参审人单专业审评程序平行审评程序序贯审评程序。
【免费下载】国家药品审评中心审评人员公示名单04

药品审评中心审评人员公示名单 (2015年4月)部门姓名 所负责工作分机中心主任许嘉齐611中心副主任尹红章602中心副主任侯仁萍603中心领导中心主任助理胡 军协助分管主任负责中药药品审评的技术管理工作604负责审评技术资料管理、审评任务分发调度及相关督查协调工作。
承担相关审评报告综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。
负责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作。
承担中心交办的其他工作。
副部长温宝书303副部长王 敏172 何燕萍101张晓东102王 鹏104黄清竹105业务管理部协调员刘 璐106负责中药、民族药及天然药物临床试验申请和注册申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责中药、民族药及天然药物7~8类临床试验申请、7~9类注册申请、各类注射剂注册申请、相关补充申请以及进口再注册申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
部长胡 军604 副部长周跃华486阳长明401张永文402曲建博406金 芳407李计萍408周 刚409韩 炜412中药民族药药学部成员马秀璟413负责化学药物1~3类临床试验申请和注册申请、国际多中心临床试验申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责化学药物3类临床试验申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
副部长马玉楠577王 旸502任连杰505康建磊506王亚敏507于 红508王宏亮511马 磊512张 宁513霍秀敏514化药药学一部成员刘宗英515 负责化学药物4~5类临床试验申请、进口药注册申请、进口再注册申请、相关补充申请及其他申请的药学研究资料及生物等效性试验资料的技术审评工作,提出药学专业和相应生物等效性资料的审评意见并形成药学专业审评报告。
参加培训的药品GMP检查员名单

参加培训的药品GMP检查员名单一、药品GMP检查员组长暨师资培训人员名单(共114人):1、北京:孔力、李卫华、俞坚净、宋然然、张娟、张凤梅2、天津:刘树春、马竹波、王守斌3、河北:马琳、赵立新、段春改、李利佳、许海鹰、杜增辉4、山西:王玉军、赵运江、于如海、朴晋华5、内蒙古:魏荣保、田甸丰6、辽宁:朱延峰、佟宝光、刘智勇、刘知音、赵红菊、董英、宋敏7、吉林:王琳、武永蜂、李忠山、王喜民8、黑龙江:敖淑芬、谭宏宇、张利平9、河南:王智明、秦战勇、张伟琦、张伟东、张文英、关蕾10、山东:曹森、韩莹、冉大强、高卫胜、刘学起周鹏程、许红、储德全、杨士友、丁家碧12、上海:张华、李建平、颛孙燕、柳涛、沈晴13、江苏:焦灵利、王敦岚、李明先、王立新、李国亮、陈伟14、浙江:胡飞凤、陈玉清、吴相勇、胡淼、洪盈盈、戴其昌、李会林15、湖南:杨清、李文、曾三平16、湖北:李亚武、李国庆、曹秀荣17、江西:王栋、徐群志、张军平、徐飞18、广东:刘珍、吴生齐、罗穗、黄坤斌、江映珠、谢正福19、广西:童志华、罗远秀、韦莹莹20、福建:许婉锌、史晓燕、黄荔红21、海南:陈海峰欧阳楠、范兵、陈祖芬、徐彤皓、周玲23、贵州:黄铭铸、高良美24、重庆:杨成钢、操复川、邓开英25、四川:骆国军、郑晓、高向军26、陕西:林毅、王四清、王力27、甘肃:王兰霞、寇冀虹、欧阳晓玫28、宁夏:海学武、黑生虎29、青海:姜世贤、刘海青30、新疆:李金凤、张丽二、药品GMP检查员骨干培训人员名单(共163人):1、北京:毕元、刘明华、魏锡庚、周宏、郭宏静、龚庆华、赵志远、王谨、周长明、张如坤、郭宝萍2、天津:李俊杰、牛东斌、吴妍汶、刘言3、河北:宫晓平4、山西:库晓娟、贾敏、李晶晶5、内蒙古:李征6、辽宁:孙东、孟彬、祖延雷、赵双春、李妮、王怡君7、吉林:吴晓东、郭长才、全菊花、于文静、战峰、吴晶、孙文、魏旭、管恩杰、高笑天8、黑龙江:张丁丁、杨东旭、陈雷、王德胜、王国强、王宇、战丹、崔淑艳、母凯9、河南:冯占林、郑霄昙、李学鑫、陶建伟、程相林、左崇杰、杨敬鹏、丰世勤、许效枫、陈章胜、罗峰、党明安、戴世俊10、山东:张亚萍、李玉基、何慧、周一鸿、赵恒、华丽萍、周勇、曹云波、丁艳、高宇源、翟向銮、国明11、安徽:祁雷、宫文武、胡士高12、上海:俞佳宁、沈建华、王乐菲、吴利红、陈燕平、蔡佳13、江苏:胡勇、许杰、唐媛、范青峰、朱颖、王惠明、刘海燕、葛芝红、姜莉、范瑞泉、衡萍、王闻珠、王金伟14、浙江:钟钰、翁晓明、梅源、夏芸15、湖南:李再新、汪灿16、湖北:徐小玲、聂希霖17、江西:李平、李萍、叶久之、杨国华、章光文、万东根、段定忠18、广东:陈佩毅、李薇、林盛文、钟向红、李志伟、肖奕阳、王利峰、丁波、彭继峰、邹毅、招伟汉19、广西:覃忠于、黄成勇20、福建:张书宇、肖容英、陈文钦、郑泉英、李天扬、张江清、陈文钦、庄江兴21、海南:陈叶兰、张辉、杨静、符哲伟22、云南:刘荣、王丹、何道慧23、贵州:杨永东、王萍、仝亚楠、宋勤、马晓红、王萍、张谆24、重庆:张小松、李霞25、四川:黄玉兰、张金兰、冯凌、张良君、廖小虎、王叔桥26、陕西:唐小波、王少峰、翁吉安27、甘肃:王巍、梁春御、朱晓红28、新疆:马晓峰、马小华、古丽斯坦、焦保辉、张训鹰、李晨29、西藏李建存。
国家药品GMP检查员名单

黑龙江省鸡西市食品药品监督管理局
李忠义
黑龙江省大庆市食品药品监督管理局
王德胜
黑龙江省黑河市食品药品监督管理局
王国强
黑龙江省佳木斯市食品药品监督管理局
王树岩
黑龙江省鸡西市食品药品监督管理局
李奎平
黑龙江省伊春市药品检验所
4期
王清华
黑龙江省药品检验所
崔淑艳
黑龙江省七台河食品药品监督管理局
乔振宽
黑龙江省食品药品稽查局
薛东升
河北省保定市食品药品监督管理局
4期
李汛
河北省食品药品监督管理局
陈爱华
河北省张家口市食品药品监督管理局
宫晓平
河北省张家口市药品检验所
翟遵兰
河北省沧州市食品药品监督管理局
李瑞平
河北省保定市药品检验所
3期
李利佳
石家庄市食品药品监督管理局
蒋灵君
河北省衡水市食品药品监督管理局
2期
许海鹰、赵立新、鞠捷频、杜增辉
李军
吉林省食品药品认证和培训中心
王晶波
吉林省吉林市食品药品监督管理局
3期
魏旭
吉林市食品药品监督管理局
姜国明
吉林省食品药品认证和培训中心
2期
高笑天、于秀丽、李忠山、管恩杰、于文静
1期
武永峰、王琳、王喜民、李雪东
黑龙江省
5期
高峰
黑龙江省食品药品稽查局
张景春
黑龙江省绥化市食品药品监督管理局
姜连阁
黑龙江省食品药品检验检测所
上海市食品药品监督管理局认证审评中心
吕群良
上海市食品药品监督管理局青浦分局
秋文毅
上海市食品药品监督管理局松江分局
药品技术审评原则和程序

国家食品药品监督管理局药品审评中心公布《药品技术审评原则和程序》2011年3月23日,《药品技术审评原则和程序》围绕技术审评科学、法制、伦理和公开、公平、公正的原则,按照审评任务分类和风险等级,分别针对新药临床试验申请(IND)、新药生产上市注册申请(NDA)、仿制药注册申请(ANDA)等,建立了相应的审评决策程序。
原则和程序还明确了主审报告部在任务管理中的作用,加大了公开透明力度,并把沟通和交流作为新药审评中的一项重要工作措施,以提高审评和决策效率。
同时,原则和程序还就建立中心审评质量管控机制(GRP)提出了要求。
药品技术审评原则和程序第一章总则第一条为保证公众用药安全、促进公众健康,不断完善药品技术审评科学化、规范化和法制化建设,根据国家有关法规和规范性文件的规定,制定本原则和程序。
第二条药品技术审评遵循科学、法制、伦理和公开、公平、公正的原则。
第三条国家食品药品监督管理局药品审评中心(以下简称中心),在药品技术审评过程中实行主审集体负责制、审评人员公示制和回避制、以及责任追究制。
中心主任主持中心的全面工作,对国家食品药品监督管理局负责,并按照民主集中制的原则,对中心的决策和管理实行集体领导和个人分工相结合的工作制度。
中心网站()为发布审评人员公示、审评任务公开、进度查询、审评结论等与审评工作相关公开信息的官方网站。
第四条中心及其工作人员对药品注册申请人(以下简称申请人)提交的技术秘密及不披露信息负有保密义务。
第五条中心各职能部门和全体工作人员均应执行本原则和程序。
药品技术审评工作应主动接受药品监督管理部门、申请人及社会公众的监督。
第二章注册申请的技术审评第一节审评任务管理第六条业务管理部按照有关规定,负责接收相关部门正式受理的注册申请,并按照本原则和程序的规定、分发审评任务至相应的审评部门。
审评任务根据其申请事项主要分为新药临床试验申请、新药生产上市注册申请、仿制药注册申请、补充申请等。
根据药物研发一般规律,不同类型审评任务采用相应的审评程序。
药物临床试验登记与信息公示平台介绍及常见问题分析_黄钦

《赫尔 辛 基 宣 言 》是 人 体 医 学 研 究 的 国 际 伦 理 准则,其要求临床试验信息必须在首例受试者入组 前对公众公示,还要求不论阳性或阴性的试验结果 均须公示[1]。通过对试验研究信息的公示,有助于 药物研发人员了解整个行业的研发动态,了解和借 鉴他人的研发理念和技术方法。此外,对临床试验 进行登记和信息公示也是研究人员和监管部门对社
[关键词] 药物; 临床试验; 登记; 公示 [中图分类号] R95 [文献标志码] C [文章编号] 1003 - 3734( 2014) 23 - 2721 - 04
Introducing the platform for registry and publicity of drug clinical trials and analyzing the common questions in trial registry
2721 中国新药杂志 2014 年第 23 卷第 23 期
Chinese Journal of New Drugs 2014,23( 23)
这项工作开展以来,我们发现登记人在平台登 记和信息填写的具体操作中,存在一些常见的共性 问题,为此有必要对平台的设计思路和搭建过程予 以介绍,同时针对广大登记人遇到的常见问题进行 答复说明,希望帮助相关人员更好地理解和做好这 项工作。 1 平台搭建的设计思路和简要过程
子账户对其下创建试验的管理功能与主账户的 相同。但是,子账户只能对其下创建的试验进行管 理,不能查看主账户中的其他信息,包括主账户的企 业信息、联系人信息以及其他试验信息等。另外,每 个子账户只能单独管理,不能合并。 2. 1. 4 转让方进行变更试验申办者操作时找不到 该功能键以及转让方能否看到受让方填写的试验信 息 登记表中的“申办者名称”系来源于 CDE 数据 库“申请表 ”中 的 申 请 人 名 称,由 系 统 自 动 关 联,且 登记人不可修改。若发生批件转让,会导致自动关 联的申办者名称与实际批件持有人不符。为解决该 问题,系统设置了“变更试验申办者”功能。发生批 件转让时,可 以 通 过 该 功 能 将 登 记 表 内 的“申 办 者 名称”项变更为受让方名称。
国家药品审评中心审评人员公示名单2015.04.doc

(2015年4月)
部门
姓名
所负责工作
分机
中心领导
中心主任
许嘉齐
611
中心副主任
尹红章
602
中心副主任
侯仁萍
603
中心主任助理
胡 军
协助分管主任负责中药药品审评的技术管理工作
604
业务管理部
负责审评技术资料管理、审评任务分发调度及相关督查协调工作。承担相关审评报告综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。负责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作。承担中心交办的其他工作。
副部长(主持工作)
杨建红
607
副部长
黄晓龙
576
9
李 丽
520
田 洁
524
宁黎丽
525
张玉琥
526
张 震
527
李晓峰
529
许真玉
530
李志万
531
何 伍
532
蒋 煜
533
张星一
536
成海平
537
李雪梅
539
生物制品药学部
负责生物制品临床试验申请、注册申请及相关补充申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。负责生物制品临床试验申请及注册申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
部长
胡 军
2013年4月国家药品审评中心审评人员名单

生物统计学部 黄 钦Fra bibliotek副部长(主持工作) 杨志敏
304
副部长
高晨燕
579
成员
张杰
543
王宏宇
544
赵德恒
548
杨焕
549
张虹
553
陈晓媛
554
负责神经系统药物、循环系统药物、肾脏/泌尿系统药物、生殖系统药物、消化系统药物、抗感染药物、电解质 酸碱平衡及营养药、扩容药、皮肤科及五官科药物、器官移植、外科和其他化学药物以及治疗和预防用生物制品 临床试验申请(包括国际多中心临床试验申请)、注册申请的临床研究资料的技术审评工作,提出临床专业审评 意见并形成临床专业审评报告。负责对上述治疗领域化学药品 1~4 类及进口药注册申请、国际多中心临床试验 申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其 他工作。
2013 年 4 月国家药品审评中心审评人员名单 (2013 年 04 月)
部门
姓名
所负责工作
分机
中心领导
中心主任
张培培
601
中心副主任
尹红章
602
中心副主任
侯仁萍
603
中心主任助理
冯毅
协助分管主任负责化学药品审评的技术管理工作
610
中心主任助理
胡军
协助分管主任负责中药药品审评的技术管理工作
604
业务部
副部长
李攻戍
487
成员
周贝
419
程龙
420
王停
423
化药临床一部 化药临床二部 生物统计学部
裴小静
425
刘炳林
426
CDE审评人员
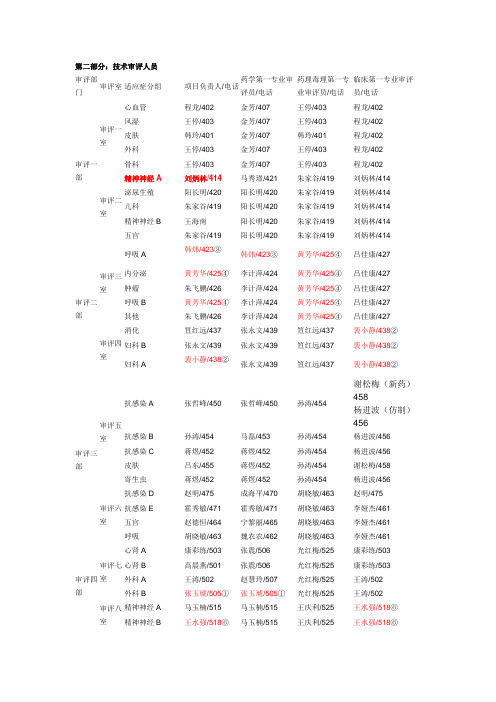
第二部分:技术审评人员审评部门审评室适应症分组项目负责人/电话药学第一专业审评员/电话药理毒理第一专业审评员/电话临床第一专业审评员/电话审评一部审评一室心血管程龙/402 金芳/407 王停/403 程龙/402风湿王停/403 金芳/407 王停/403 程龙/402皮肤韩玲/401 金芳/407 韩玲/401 程龙/402外科王停/403 金芳/407 王停/403 程龙/402骨科王停/403 金芳/407 王停/403 程龙/402审评二室精神神经A 刘炳林/414 马秀璟/421 朱家谷/419 刘炳林/414 泌尿生殖阳长明/420 阳长明/420 朱家谷/419 刘炳林/414 儿科朱家谷/419 阳长明/420 朱家谷/419 刘炳林/414 精神神经B 王海南阳长明/420 朱家谷/419 刘炳林/414 五官朱家谷/419 阳长明/420 朱家谷/419 刘炳林/414审评二部审评三室呼吸A韩炜/423③韩炜/423③黄芳华/425④吕佳康/427 内分泌黄芳华/425④李计萍/424 黄芳华/425④吕佳康/427肿瘤朱飞鹏/426 李计萍/424 黄芳华/425④吕佳康/427呼吸B 黄芳华/425④李计萍/424 黄芳华/425④吕佳康/427其他朱飞鹏/426 李计萍/424 黄芳华/425④吕佳康/427审评四室消化笪红远/437 张永文/439 笪红远/437 裴小静/438②妇科B 张永文/439 张永文/439 笪红远/437 裴小静/438②妇科A裴小静/438②张永文/439 笪红远/437 裴小静/438②审评三部审评五室抗感染A 张哲峰/450 张哲峰/450 孙涛/454谢松梅(新药)458杨进波(仿制)456抗感染B 孙涛/454 马磊/453 孙涛/454 杨进波/456抗感染C 蒋煜/452 蒋煜/452 孙涛/454 杨进波/456皮肤吕东/455 蒋煜/452 孙涛/454 谢松梅/458寄生虫蒋煜/452 蒋煜/452 孙涛/454 杨进波/456审评六室抗感染D 赵明/475 成海平/470 胡晓敏/463 赵明/475抗感染E 霍秀敏/471 霍秀敏/471 胡晓敏/463 李娅杰/461五官赵德恒/464 宁黎丽/465 胡晓敏/463 李娅杰/461呼吸胡晓敏/463 魏农农/462 胡晓敏/463 李娅杰/461审评四部审评七室心肾A 康彩练/503 张震/506 光红梅/525 康彩练/503心肾B 高晨燕/501 张震/506 光红梅/525 康彩练/503外科A 王涛/502 赵慧玲/507 光红梅/525 王涛/502外科B 张玉琥/505①张玉琥/505①光红梅/525 王涛/502审评八室精神神经A 马玉楠/515 马玉楠/515 王庆利/525 王水强/518⑥精神神经B 王水强/518⑥马玉楠/515 王庆利/525 王水强/518⑥精神神经C 许真玉/514 许真玉/514 王庆利/525 赵建中/519 其他陈海峰/513 许真玉/514 王庆利/525 赵建中/519审评五部审评九室肿瘤A 陈晓媛/526⑤何伍/533 王海学/530 陈晓媛/526⑤放射彭健/531 何伍/533 王海学/530 陈晓媛/526⑤肿瘤B+妇科张宁/532 张宁/532 王海学/530 陈晓媛/526⑤审评十室内分泌B 张杰/543 王亚敏/547 张若明/542 张杰/543内分泌A 王亚敏/547 王亚敏/547 张若明/542 张杰/543消化B 卓宏/548 李志万/539 张若明/542 卓宏/548消化A 张若明/542 李志万/539 张若明/542 杨焕/538审评五部生物制品室体外诊断试剂高恩明/554 张丽/558血液制品罗建辉/549 罗建辉/549 王海学/530 陈晓媛/526⑤预防用生物制品高恩明/554 高恩明/554 张若明/542 杨焕/538治疗用生物制品(妇科)常卫红/555 赵超/559 王海学/530 陈晓媛/526⑤治疗用生物制品(呼吸)常卫红/555 赵超/559 胡晓敏/463 李娅杰/461 治疗用生物制品(精神神经)常卫红/555 赵超/559 王庆利/525 王水强/518 治疗用生物制品(抗感染)常卫红/555 赵超/559 孙涛/454 谢松梅/458 治疗用生物制品(抗肿瘤、放射)罗建辉/549 罗建辉/549 王海学/530 陈晓媛/526⑤治疗用生物制品(内分泌)赵超/559 赵超/559 张若明/542 张杰/543 治疗用生物制品(皮肤)常卫红/555 赵超/559 孙涛/454 谢松梅/458 治疗用生物制品(外科)常卫红/555 赵超/559 王海学/530 王涛/502 治疗用生物制品(五官)常卫红/555 赵超/559 胡晓敏/463 李娅杰/461 治疗用生物制品(消化)赵超/559 赵超/559 张若明/542 杨焕/538 治疗用生物制品(心肾)赵超/559 赵超/559 王海学/530 康彩练/503。
药品审评中心审评人员公示名单 2015.04
唐健元
326
成员
马 坤
118
申 宁
626
药审中心主审审评员资格人员名单 (2015年4月)
审
评
部
门
中药民族药药学部
胡 军、周跃华、阳长明、张永文、李计萍、马秀璟、金 芳、韩 炜、周 刚
化药药学一部
马玉楠、王亚敏、霍秀敏、于 红、张 宁、马 磊、康建磊
化药药学二部
杨建红、黄晓龙、宁黎丽、张玉琥、成海平、许真玉、何 伍、田 洁、李志万、李雪梅、蒋 煜、张 震、张星一
副部长(主持工作)
杨建红
607
副部长
黄晓龙
576
成员
石 靖
517
章俊麟
519
李 丽
520
田 洁
524
宁黎丽
525
张玉琥
526
张 震
527
李晓峰
529
许真玉
530
李志万
531
何 伍
532
蒋 煜
533
张星一
536
成海平
537
李雪梅
539
生物制品药学部
负责生物制品临床试验申请、注册申请及相关补充申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。负责生物制品临床试验申请及注册申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
生物统计学部
黄 钦
副部长(主持工作)
王庆利
306
副部长
韩 玲
489
成员
朱家谷
438
宁可永
439
朱飞鹏
443
2011年“重大新药创制”科技重大专项答辩名单

19 2011ZX091013-034 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 2011ZX091013-036 2011ZX091013-037 2011ZX091013-039 2011ZX091013-040 2011ZX091013-041 2011ZX091013-042 2011ZX091013-043 2011ZX091013-044 2011ZX091013-045 2011ZX091013-046 2011ZX091013-047 2011ZX091013-051 2011ZX091013-052 2011ZX091013-055 2011ZX091013-058 2011ZX091013-059
2011年“重大新药创制”科技重大专项答辩名单 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 2011ZX091013-003 2011ZX091013-004 2011ZX091013-008 2011ZX091013-010 2011ZX091013-011 2011ZX091013-013 2011ZX091013-014 2011ZX091013-015 2011ZX091013-017 2011ZX091013-019 2011ZX091013-020 2011ZX091013-021 2011ZX091013-022 2011ZX091013-023 2011ZX091013-024 2011ZX091013-026 2011ZX091013-031 2011ZX091013-032 深圳市天达康基因工程有限公司 武汉人福医药集团股份有限公司 广州铭康生物工程有限公司 广州达博生物制品有限公司 山东元隆生物技术有限公司 北京华世嘉业医药技术有限公司 成都康弘生物科技有限公司 江苏豪森药业股份有限公司 苏州工业园区晨健抗体组药物开发有 限公司 江苏太平洋美诺克生物药业有限公司 泰州新生源生物医药有限公司 石药集团有限公司 厦门特宝生物工程股份有限公司 北京翔天牧生物科技有限公司 四川大学 北京诺思兰德生物技术股份有限公司 上海中信国健药业股份有限公司 上海抗体药物国家工程研究中工程股份有限公司 厦门特宝生物工程股份有限公司 北京诺维康医药科技有限公司 华北制药集团新药研究开发有限责任 公司 大连帝恩生物工程有限公司 杰华(北京)生物医药研究院 北京双鹭药业股份有限公司 百泰生物药业有限公司 北京普罗吉生物科技发展有限公司 河北贝特赛奥生物科技有限公司 百泰生物药业有限公司 重庆富进生物医药有限公司 北京精益泰翔技术发展有限公司 长春长生基因工程技术研究所 天津博发生物技术有限公司 修正药业集团长春高新制药有限公司 奚玲 于玉根 杨琴 高诗娟 王郡甫 鞠利雅 吴荃 孙长安 许国贞 陈涛 贾宝庆 邹卫 周卫东 翁林 罗锋 杨宗伟 马英 李先平 严军 邹平 王润华 曹相林 姚家琳 张卫华 刘龙斌 陈献华 蒋国梁 雷清新 沈振亚 潘建基 罗华 王刚 李世军 董佳里 马吉胜
CFDA药品审评中心(CDE)对“变更与验证”问题解答

CFDA 药品审评中心(CDE )对“变更与验证”问题解答1、对于变更的I、II 、III 类,是不是I 类和II 类变更只要在省局备案或审评,III 类变更才报国家局审批?答】《药品注册管理办法》将补充申请根据事项进行分层申报、审批管理,分为国家局审批事项、省局审批事项和省局备案事项;SFDA 发布的《已上市化学药品变更研究的技术指导原则(一)》按照变更程度将这些事项又分为I、II、III 类变更,按照各种变更对产品质量、安全性、有效性可能产生的影响程度分类,指导申报单位按照变更程度大小进行相应的研究验证。
进行补充申请申报时是在分类的研究基础上按照事项确定执行哪种申报程序,目前不是按照I、II 、III 类变更程度确定申报程序。
2、确定可信度高的有效期应采取科学的统计方法,具体的指导原则是哪个?答】由于长期稳定性试验采用多批样品,需要考察多个项目,每一个考察项目都会有多个试验数据,一般地,制定有效期时需要对这些大量的试验数据进行统计分析处理。
SFDA 发布的化学药品稳定性研究技术指导原则中规定:由于试验数据的分散性,一般应按95%可信限进行统计分析,得出合理的有效期。
如三批统计分析结果差别较小,则取其平均值为有效期,如差别较大则取其最短的为有效期。
若数据表明测定结果变化很小,提示药品是很稳定的,则可以不在ICH Q1E 中,对稳定性数据的评价方法和有效期货架期)的确定进行了更为系统和详细的阐述,针对不同的贮藏条件、长期试验和加速试验是否明显变化、数据是否具有随时间变化的特性、数据能否进行统计分析等不同层面进行了详细讨论。
3、变更工艺中都要求与原产品稳定性研究进行比较,但由于历史原因,工艺从大生产开始就做了变更,现在作补充申请,不作原产品比较是否可行?答】在变更工艺、变更处方、变更规格等补充申请中,般都需要对变更后的1-3 批样品进行3-6个月的加速试验及长期留样稳定性考察,并与变更前产品的稳定性情况进行比较,以说明变更对药品稳定性是否产生影响。
药品审评中心审评人员公示名单[1][1]
![药品审评中心审评人员公示名单[1][1]](https://img.taocdn.com/s3/m/b3b608f29e314332396893ce.png)
治疗用生物制品(呼吸)
常卫红/555
赵超/559
胡晓敏/463
李娅杰/461
治疗用生物制品(精神神经)
常卫红/555
赵超/559
王庆利/525
王水强/518⑤
治疗用生物制品(抗感染)
常卫红/555
赵超/559
孙涛/454
谢松梅/458
治疗用生物制品(抗肿瘤、放射)
罗建辉/549
罗建辉/549
吕佳康/427
呼吸B
黄芳华/425
李计萍/424
黄芳华/425
吕佳康/427
其他
朱飞鹏/426
李计萍/424
黄芳华/425
吕佳康/427
审评四室
消化
笪红远/437
张永文/439
笪红远/437
裴小静/438
妇科B
张永文/439
张永文/439
笪红远/437
裴小静/438
妇科A
裴小静/438
张永文/439
室主任
吕东
复核审评五室所承担品种的综合审评报告
455
审评六室
室主任
赵德恒
复核审评六室所承担品种的综合审评报告
464
审评四部
部长
左晓春
审核审评四部所承担品种的综合审评报告
607
副部长
黄晓龙
协助部长负责审评四部工作
576
审评七室
室主任
高晨燕
复核审评七室所承担品种的综合审评报告
501
审评八室
室主任
陈海峰
复核审评八室所承担品种的综合审评报告
③朱家谷同志负责的五官项目负责人工作暂由马秀璟同志负责。朱家谷同志负责的药理毒理第一专业审评员工作暂由宁可永同志负责(分机号码:419)。
CDE办事指南

1、技术资料接收
1.4非书面补充资料的接收 现有申报资料还不能充分满足综合评价的需要,且补充 资料仅为无需进行试验性研究工作的说明性资料;或需 要补充的资料仅是为了注册管理的需要而要求提供的必 要的证明性的文件;该补充资料的内容应在自通知日起 20个工作日内完成。 该通知由“项目负责人”电话通知注册申请人,并详细 告知注册申请人应注意的事项,其后将本人签名的《补 充资料非书面通知单》传真至注册申请人。注册申请人 据此提交非书面补充资料。 1.4.1提交方式和提交时间:同书面补资料的接收。 1.4.2接收人2.3提交资料的要求 (1)需提交二套资料,分别装入文件袋,资料应一律使用A4型 纸。其中至少有一套原件,须申报单位和试验完成单位加盖有 效印章。 (2)文件袋的正面应注明:初次受理号、品名、申报单位,并 标注原件、复印件。 (3)文件袋中资料的顺序为:资料目录、技术资料。 1.2.4注意事项 (1)对于邮寄者,为保证邮寄资料安全、及时送达中心,请尽 可能采取特快专递的方式邮寄,并注明资料组收。 (2)为便于及时反馈受理情况,请在邮件中准确注明以下信息: 单位名称、联系人、联系电话、传真等。CDE在正式受理上述资 料后,会以挂号信的方式邮寄回执单,含新的申请编号。请注 意查收。
2、电子资料的提交
2.2.2申请临床研究的品种(中药、化药、生物制品),需进行电子提 交的资料内容为: (1)立题目的与依据 (2)对主要研究结果的总结与评价 (3)药学研究资料综述 (4)药理毒理研究资料综述 (5)临床试验研究资料综述 对于补充申请:可根据申请的实际情况提供上述相关文件,如:相关 补充申请的背景文件,修改质量标准或药品使用说明书的补充申请需 提交质量标准或药品使用说明书的电子文件。 对于补充资料:若涉及质量标准、药品使用说明书、包装标签和工艺 资料等变更的注册申请,在补充资料提交药审中心后需同时将上述资 料进行电子提交。 电子提交以CDE模板为准 关于临床试验数据库和人体药代动力学图谱的电子提交:请按照《关 于提交临床试验统计数据库和人体药代动力学全部图谱的通知》 (2009年2月16日)的要求进行提交。
CDE联系电话

马玉楠
1502
成员
王 旸
1516
任连杰
1519
康建磊
1518
王亚敏
1517
于 红
1522
王宏亮
1525
马 磊
1524
张 宁
1523
霍秀敏
1528
刘宗英
1527
化药药学二部
负责化学药物4~5类临床试验申请、进口药注册申请、进口再注册申请、相关补充申请及其他申请的药学研究资料及生物等效性试验资料的技术审评工作,提出药学专业和相应生物等效性资料的审评意见并形成药学专业审评报告。负责化学药物4~5类临床试验申请以及5~6类注册申请、进口药临床试验申请、进口再注册申请、相关补充申请及其他申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
副部长
温宝书
1303
副部长
王 敏
1200
协调员
何燕萍
1326
张晓东
1327
王 鹏
1328
黄清竹
1329
中药民族药药学部
负责中药、民族药及天然药物临床试验申请和注册申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。负责中药、民族药及天然药物7~8类临床试验申请、7~9类注册申请、各类注射剂注册申请、相关补充申请以及进口再注册申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。承担中心交办的其他工作。
副部长(主持工作)
黄 钦
1302
成员
王玉珠
1485
王 骏
1484
研究与评价部
负责制定并组织实施中心业务发展规划;组织开展业务规范的制定和修订工作;负责监督和评价审评业务工作;组织开展复审工作;负责跟踪、研究国外药品审评信息并提供信息服务;承担中心出版物编印工作;组织开展学术交流活动,承担科研课题、技术委员会的日常管理及相关工作。承担中心交办的其他工作。
国家食品药品监督管理局关于公布第五批重新聘任的国家药品GMP检查员名单的通知

国家食品药品监督管理局关于公布第五批重新聘任的国家药品GMP检查员名单的通知
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2011.02.09
•【文号】国食药监安[2011]64号
•【施行日期】2011.02.09
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局关于公布第五批重新聘任的国家药
品GMP检查员名单的通知
(国食药监安[2011]64号)
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为加强对药品GMP检查员的管理,规范检查员队伍建设,按照国家局开展药品GMP检查员重新聘任工作计划,经各省(区、市)食品药品监管部门推荐,国家局综合考评,刘明华等167人为第五批重新聘任的国家药品GMP检查员,现予公布并核发《国家药品GMP检查员证》。
附件:第五批重新聘任的国家药品GMP检查员名单
国家食品药品监督管理局
二○一一年二月九日附件:第五批重新聘任的国家药品GMP检查员名单。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品审评中心审评人员公示名单20110131
关于国家食品药品监督管理局药品审评中心调整主要职责和内设机构的批复
国食药监人函[2010]219号
(一)业务管理部
负责审评技术资料管理、审评任务分发调度及相关督查协调工作。
承担相关审评报告综合以及审评文件管理,组织开展与新药审评相关的核查、验证工作;承担主动撤回申请和超过规定时限未按要求提交补充资料等品种的相关处理工作;负责与国家食品药品监督管理局相关部门协调技术审评工作;承担业务咨询及业务信息管理工作。
负责中心文电、会务、档案等日常运转工作以及安全保密、印章管理、外部联络等工作。
承担中心交办的其他工作。
(二)中药民族药药学部
负责中药、民族药及天然药物临床试验申请和注册申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责中药、民族药及天然药物7~8类临床试验申请、7~9类注册申请、各类注射剂注册申请、相关补充申请以及进口再注册申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(三)化药药学一部
负责化学药物1~3类临床试验申请和注册申请、国际多中心临床试验申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责化学药物3类临床试验申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(四)化药药学二部
负责化学药物4~5类临床试验申请、进口药注册申请、进口再注册申请、相关补充申请及其他申请的药学研究资料及生物等效性试验资料的技术审评工作,提出药学专业和相应生物等效性资料的审评意见并形成药学专业审评报告。
负责化学药物4~5类临床试验申请以及5~6类注册申请、进口药临床试验申请、进口再注册申请、相关补充申请及其他申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(五)生物制品药学部
负责生物制品临床试验申请、注册申请及相关补充申请的药学研究资料的技术审评工作,提出药学专业审评意见并形成药学专业审评报告。
负责生物制品临床试验申请及注册申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(六)药理毒理学部
负责中药、民族药、天然药物、化学药物、生物制品临床试验申请、注册申请及相关补充申请的药理毒理学研究资料的技术审评工作,提出药理毒理学专业审评意见并形成药理毒理学专业审评报告。
负责化学药物1~2类以及中药、民族药、天然药物1~5类临床试验申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(七)中药民族药临床部
负责中药、民族药及天然药物临床试验申请(包括国际多中心临床试验申请)的技术审评工作,提出临床专业审评意见并形成临床专业审评报告。
负责中药、民族药及天然药物6类临床试验申请、1~6类注册申请以及相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(八)化药临床一部
负责精神障碍疾病药物、镇痛药及麻醉科药物、内分泌用药、抗风湿及免疫药物、呼吸系统及抗过敏药物、抗肿瘤药物、血液病药物、医学影像学等化学药物以及治疗和预防用生物制品临床试验申请(包括国际多中心临床试验申请)、注册申请的临床研究资料的技术审评工作,提出临床专业审评意见并形成临床专业审评报告。
负责上述治疗领域化学药品1~4类及进口药注册申请、国际多中心临床试验申请、相关补充申请的评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(九)化药临床二部
负责神经系统药物、循环系统药物、肾脏/泌尿系统药物、生殖系统药物、消化系统药物、抗感染药物、电解质酸碱平衡及营养药、扩容药、皮肤科及五官科药物、器官移植、外科和其他化学药物以及治疗和预防用生物制品临床试验申请(包括国际多中心临床试验申请)、注册申请的临床研究资料的技术审评工作,提出临床专业审评意见并形成临床专业审评报告。
负责对上述治疗领域化学药品1~4类及进口药注册申请、国际多中心临床试验申请、相关补充申请的综合评价工作,形成技术审评报告,并提出明确结论意见及处理建议。
承担中心交办的其他工作。
(十)生物统计学部
负责各类药品的生物统计学专业审评工作,并为相关专业技术审评提供生物统计学专业技术支持。
参与临床试验申请的审评,协助临床审评部门进行临床试验数据库审查,提出生物统计学专业审评意见并形成专业审评报告。
承担中心交办的其他工作。
(十一)研究与评价部
负责制定并组织实施中心业务发展规划;组织开展业务规范的制定和修订工作;负责监督和评价审评业务工作;组织开展复审工作;负责跟踪、研究国外药品审评信息并提供信息服务;承担中心出版物编印工作;组织开展学术交流活动,承担科研课题、技术委员会的日常管理及相关工作。
承担中心交办的其他工作。
(十二)人力资源与信息部(党总支办公室)
负责制定并组织实施中心人才发展规划;负责中心人事、外事、工青团妇及统战工作。
负责中心党总支日常工作,承担中心党的建设、精神文明建设以及纪检监察、党风廉政建设工作。
负责中心信息系统的基础建设及维护管理工作;承担技术审评相关数据库的建设与维护,开展相关专业信息的整合、利用工作。
承担中心交办的其他工作。
(十三)保障部
承担中心基建、设施场所、工作环境、车辆管理及安全保卫等后勤保障工作。
负责制订中心财务和资产管理制度并监督执行;负责中心年度预算、决算的编制及日常财务管理工作;负责中心国有资产的核算与监管;负责中心经济类合同的审核。
承担中心交办的其他工作。
化学药品启动审评任务情况公示信息表
一、药理毒理学部:
序号 受理号 申请类型
1 CXHL0600817-1* 新药临床1.1
2 CXHL0600818-1* 新药临床化药1.1
3 CXHL0900560-0* 新药临床化药1.1
4 CXHL0900593-0* 新药临床化药1.1
5 CXHL0900594-0* 新药临床化药1.1
6 CXHL1000140-0* 新药临床化药1.1
7 CXHL1000180-0* 新药临床化药1.1
8 CXHL1000181-0* 新药临床化药1.1
9 CXHL1000186-0* 新药临床化药1.1
10 CXHL1000187-0* 新药临床化药1.1
11 CXHL1000188-0* 新药临床化药1.1
12 CXHL1000234-0* 新药临床化药1.1
13 CXHL1000235-0* 新药临床化药1.1
14 CXHL1000237-0* 新药临床化药1.1
15 CXHL1000238-0* 新药临床化药1.1
16 CXHL1000239-0* 新药临床化药1.1
17 CXHL0900561-0* 新药临床化药1.2
18 CXHL0800163-1* 新药临床化药1.5
19 CXHL0800164-1* 新药临床化药1.5
20 CXHL0800165-1* 新药临床化药1.5
21 CXHL1000030-0* 新药临床化药1.5
22 CXHL0900515-1* 新药临床化药2
23 CXHL1000141-0* 新药临床化药2
24 CXHL1000185-0* 新药临床化药2
25 CXHL1000196-0* 新药临床化药2
26 CXHL1000247-0* 新药临床化药2
27 CXHL1000248-0* 新药临床化药2
28 CXHL1000249-0* 新药临床化药2
注:受理号后标*品种需要其它相关审评部门参加审评。
