第七章专题十五考点1乙醇、乙酸的组成、主要性质及其重要应用
乙醇、乙酸的组成、主要性质及其重要应用

2.(2009 年 6 月· 广东学考)烹鱼时加入少量食醋和料 酒可以使烹制的鱼具有特殊的香味,这种香味来自于 ( ) A.食盐 B.食醋中的乙酸 C.料酒中的乙醇 D. 料酒中的乙醇与食醋中的乙酸反应生成的乙酸乙 酯
解析: 本题考查酯化反应和酯的性质。 料酒中的乙醇 与食醋中的乙酸反应生成的乙酸乙酯具有芳香味。 答案:D
【例 2】
(2015 年 1 月· 广东学考· 多选)乙醇是很重 )
要的化工原料。下列说法正确的有( A.乙醇催化氧化可制备乙醛 B.乙醇与 H2 反应制备乙烷
C.乙醇与金属钠反应可制备乙醇钠 D.乙醇与乙酸反应可制备乙酸乙酯
解析: 本题考查了乙醇的基本性质。 乙醇能够发生氧 化反应生成乙醛,由于它有—OH,还能够和金属钠反应 生成乙醇钠,和乙酸反应生成乙酸乙酯,ACD 三项说法 正确。乙醇不能与 H2 反应,故 B 项说法不正确。 答案:ACD
第七章
有机化合物
专题十五
[备考导航]
乙醇、乙酸、基本营养物质
1.了解乙醇、乙酸的组成和主要性质及重要应用。 2.了解取代反应、加成反应和酯化反应。 3.了解糖类、油脂、蛋白质的组成和主要性质及重 要应用。
考点Biblioteka 乙醇、乙酸的组成、主要性质及其重要应用
一、乙醇、乙酸的组成、结构
二、乙醇、乙酸的物理性质
方法分离,而不是分液。 2.乙醇中的羟基氢比水中的羟基氢活泼。(×) [分析] 乙醇与钠反应比水与钠反应平缓,说明乙醇
分子中的羟基氢不如水中的氢活泼。
3.可以用水鉴别苯、乙醇和乙酸。(×) [分析] 苯不溶于水,液体分层,但乙醇和乙酸都易
溶于水液体不分层。 4.在酯化反应中,加入过量的乙醇可以使乙酸完全 转化为乙酸乙酯。(×) [分析] 到 100%。 酯化反应是可逆反应,反应物的转化率达不
乙醇乙酸和浓硫酸
化学
练后归纳 乙酸、水、乙醇、碳酸的性质及分子中羟基氢的活泼性比较
乙酸 水 乙醇
碳酸
结构简式
CH3COO H
H—OH
C2H5OH
遇石蕊试液 变红 不变红 不变红 变浅红
与Na
反应 反应 反应
反应
与NaOH溶液 反应 不反应 不反应
反应
与Na2CO3溶液 与NaHCO3溶液 羟基氢的活泼性
反应 水解 不反应
反应
反应 水解 不反应 不反应
CH3COOH>H2CO3>H2O>CH3CH2OH
化学
4.如图所示是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子, 灰色的是氧原子,该物质不具有的性质是( B ) A.与氢氧化钠反应 B.与稀硫酸反应 C.发生酯化反应 D.使紫色石蕊试液变红
解析:观察图示比例模型可知,该物质是乙酸(
),显酸性能使
紫色石蕊试液变红色,能与NaOH发生中和反应,也能发生酯化反应,但不
解析:同质量的乙醇中羟基的物质的量比乙二醇少,放出的氢气也少,A 错误;由于乙醇与水互溶,所以乙醇不能从碘水中萃取单质碘,C错误; 乙醇与乙酸的酯化反应只能证明乙醇中有羟基,不能说明乙醇有碱性, D错误。
化学
练后归纳
乙醇的化学性质与羟基的关系 (1)与钠反应时,只断裂a处键。 (2)乙醇和乙酸发生酯化反应时只断裂a处键。 (3)乙醇催化氧化时,断裂a和c两处键,形成碳氧双键。乙醇催化氧化 时,与羟基相连的碳原子上含有两个氢原子时,生成醛;与羟基相连的 碳原子上含有一个氢原子时,生成酮;不含有氢原子时,不能发生催化 氧化反应。
(整理)乙醇和乙酸.

有机化学基础专题讲解(乙醇和乙酸)一、 乙醇的物理性质和重要用途: 物理性质:1、乙醇俗称酒精,是酒的主要成分。
它是无色透明,具有特殊香味的液体,密度比水小,沸点为78.5度,易挥发,能与水任意比互溶。
重要用途:作燃料、有机溶剂、消毒剂、酿酒、化工原料。
甲醇CH 3 CH 3OH ,医用乙醇浓度为75%。
二、乙醇的分子结构: 分子式C 2H 6O结构简式CH 3 CH 2 OH 三、乙醇的化学性质:1、 取代反应: 2CH 3CH 2OH +2Na 2CH 3CH 2ONa + H 2↑CH 3CH 2OH + HBr CH 3CH 2Br + H 2O2CH 3CH 2OHCH3CH 2OCH 2CH 3 +H 2O (分子间脱水) CH 3COOH +CH 3CH 2OHH 2O + CH 3COOC 2H 5 (酯化反应)2、 消去反应(脱水)的反应条件: —邻碳有氢,浓硫酸,170℃CH 3CH 2OH H 2O + CH 2=CH 2 ↑3、氧化反应(脱氢重键式)的反应条件: —邻碳有氢,Cu 、Ag 催化,加热2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O三、乙醇的工业制法:发酵法:C 6H 12O 6 2CH 3CH 2OH+2CO 2↑乙烯水化法: CH 2=CH 2+H 2O CH 3CH 2OH浓硫酸△△浓H 2SO 4 140℃浓H 2SO 4 170℃Cu △醇的分类(1)根据醇分子里羟基的数目,醇可分为:(2)根据与羟基连接的烃基种类分:题1乙醇分子结构中各化学键如图所示。
关于乙醇在各种反应中断键的说法不正确的是()A. 和金属钠反应时①键断裂B. 乙醇燃烧时断裂②和⑤键C.在银催化条件下与O 2反应时断裂①和③键 D. 和浓H 2SO 4、乙酸共热时断裂①键,其他键不变化题2 用分液漏斗可以分离的一组混合物是 ( )A. 乙醇和水B. 乙酸和水C. 溴苯和水D. 乙酸和乙醇题3. 下列物质不能从溴水中萃取溴的是( ) A. 乙醇 B. 苯 C. 四氯化碳 D. 戊烷题4. 下列物质,都能与Na 反应放出H 2,其产生H 2的速率由快到慢的顺序是( ) ①C 2H 5OH ②CH 3COOH (aq ) ③NaOH (aq )A. ①>②>③B. ②>①>③C. ③>①>②D. ②>③>① 醇一元醇:如 CH 3OH (甲醇)、CH 3CH 2OH (乙醇) 二元醇:如 CH 2―CH 2 (乙二醇) OH OH三元醇:如 CH 2―CH ―CH 2 (丙三醇)醇 脂肪醇:烃基为链烃基,如 CH 3CH 2CH 2OH 脂环醇:烃基为脂环烃基,如 芳香醇:烃基中含苯环,如 OHCH 2OH题5. 某有机物的结构简式为:,下列关于该有机物的叙述不正确的是()A. 能与金属钠发生反应并放出氢气B. 能在催化剂作用下与H2发生加成反应C. 能发生银镜发应D. 在浓H2SO4催化下能与乙酸发生酯化反应题6、甲醇、乙二醇、丙三醇中分别加入足量的金属钠产生等体积的氢气(相同条件),则上述三种醇的物质的量之比是( )A.2∶3∶6B.3∶2∶1C.4∶3∶1D.6∶3∶2题7.酒后驾车是引发交通事故的重要原因。
课件7:乙醇和乙酸 基本营养物质

题组三 官能团与物质的性质 5.下表为某有机物与各种试剂的反应现象,则这种有机物可能是( C )
试剂 现象
钠 放出气体
A.CH2 CH—CH2—OH
溴水 褪色
【多维思考】 1.试剂加入的顺序是怎样的?加入碎瓷片的作用是什么? 提示:先加入乙醇,再慢慢加入浓硫酸,最后再加入乙酸;加入碎瓷片的作用是 防止暴沸。 2.长导管的作用是什么?导管末端能否插入液面以下?为什么? 提示:长导管起冷凝回流和导气作用;不能,会发生倒吸。 3.为什么开始小火加热,一段时间后大火加热? 提示:开始要用小火均匀加热,防止液体剧烈沸腾,乙醇和乙酸大量挥发。后 来要大火加热把产物乙酸乙酯蒸出。
(3)萃取、分液
分液时下层液体从分液漏斗下口放出,上层液体从分液漏斗上口倒出。 (4)冷凝回流 当需要使被汽化的物质重新流回到反应容器中时,可通过在反应容器
的上方添加一个长导管达到此目的(此时空气是冷凝剂),若需要冷凝的 试剂沸点较低,则需要在容器的上方安装冷凝管,常选用球形冷凝管,此 时冷凝剂的方向是下进上出。
(3)2CH3COOH+Na2CO3 2CH3COONa+CO2↑+H2O
练后归纳
有机实验中应注意的问题
(1)加热 ①用酒精灯加热:火焰温度一般在400~500 ℃,教材中的实验需要用酒 精灯加热的有乙烯的制备、乙酸乙酯的制备、蒸馏石油的实验、石
蜡的催化裂化实验。
②水浴加热:银镜反应(温水浴)、乙酸乙酯的水解(70~80 ℃水浴)、蔗 糖的水解(热水浴)。 (2)蒸馏 温度计的水银球位于蒸馏烧瓶的支管口处;烧瓶中加碎瓷片防暴沸;冷 凝管一般选用直形冷凝管,冷凝剂的流动方向与被冷凝的液体的流动 方向应相反。
2019届高考化学一轮复习 专题 乙醇和乙酸 基本营养物质课件 新人教版

⑤CH3CH(OH)CH2OH
A.②
B.②③④
C.只有④ D.①
解析 解答本题时注意以下两点: (1)1 mol —OH 与金属钠反应放出 0.5 mol H2; (2) 醇 羟 基 不 与 NaHCO3 反 应, 1 mol —COOH 与 NaHCO3 反应放出 1 mol CO2。
题组二 乙酸乙酯的制取实验原理 3.如图为实验室制取少量乙酸乙酯的装置图。下列关 于该实验的叙述中,不正确的是( )
微溶于
溶于水和 溶于水和
溶解性
水,溶于
有机溶剂 有机溶剂
有机溶剂
与水混溶
A.相对价廉的乙酸与 1-丁醇的物质的量之比应大于 1∶1
B.不用水浴加热是因为乙酸丁酯的沸点高于 100 ℃ C.从反应后混合物分离出粗品的方法:用 Na2CO3 溶 液洗涤后分液 D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏
板块一 主干层级突破
考点 1 乙醇和乙酸的结构与性质 1.组成和结构
2.物理性质
名称 颜色 气味
状态
密度 溶解性
乙醇 无色 特殊香味
液体
与水 比水 任意比 小
互溶
液体,低于 16.6 ℃ 凝
易溶
乙酸 无色 刺激性气味
- 于水和乙
结成固体,又
醇
称冰醋酸
3.化学性质 (1)
(2)
4.乙酸乙酯的制备实验 (1)实验原理(用化学方程式表示) CH3COOH+C2H5OH浓H△2SO4CH3COOC2H5+H2O 。
题组一 乙醇、乙酸的结构与性质
1.巴豆酸的结构简式为 CH3—CH===CH—COOH。 现有下列说法,试根据巴豆酸的结构特点,判断在一定条件
下,能与巴豆酸反应的物质是( )
高考化学复习---乙醇与乙酸、基本营养物质PPT课件

2.糖类、油脂、蛋白质的性质 (1)糖类的性质 ①葡萄糖(五羟基醛)
②双糖(蔗糖、麦芽糖)
在稀酸催化下发生水解反应,如 1 mol 蔗糖水解生成 1 mol
葡萄糖和 1 mol 果糖,1 mol 麦芽糖水解生成 2 mol 葡萄糖。
C12H22O11 蔗糖
⑤饱和 Na2CO3 溶液的作用:降低乙酸乙酯的溶解度、 反应乙酸、溶解乙醇。
⑥实验现象:在饱和 Na2CO3 溶液上方有透明的、具有 香味的油状液体生成。
[名师点拨] 在有机制备实验中利用平衡移动原理,提高产 品产率常用的方法:①及时蒸出或分离出产品;②用吸收剂吸 收其他产物(如水);③利用回流装置,提高反应物的转化率。
高考化学复习---乙醇与乙酸、 基本营养物质PPT课件
考纲要求★靶向明确
1.了解乙醇、乙酸的结构和主要性质及重要应用。 2.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
目
1 知识点一
2 知识点二
录
3 课时跟踪检测
知识点一 乙醇、乙酸的 结构与性质
【考必备·清单】
1.烃的衍生物 (1)烃的衍生物:烃分子中的氢原子被其他原子或原子团所 取代而生成的一系列化合物。如溴乙烷、乙醇等。
CH3COONa+C2H5OH (进行彻底)。
(5)乙酸乙酯的制取 ①制备原理
②实验装置
③反应特点
④反应条件及其意义 a.加热,主要目的是提高反应速率,其次是使生成的乙酸 乙酯挥发而收集,使平衡向正反应方向移动,提高乙醇、乙酸 的转化率。 b.以浓硫酸作催化剂,提高反应速率。 c.以浓硫酸作吸水剂,提高乙醇、乙酸的转化率。 d.适当增加乙醇的量,可提高乙酸的转化率,并有冷凝回 流装置,可提高产率。
2022年高考化学总复习:乙醇和乙酸 基本营养物质

2022年高考化学总复习:乙醇和乙酸基本营养物质复习目标1.了解乙醇、乙酸的结构和主要性质及重要应用。
2.了解糖类、油脂、蛋白质的组成和主要性质及重要应用。
考点一乙醇和乙酸的结构与性质1.乙醇、乙酸的结构和性质的比较2.羟基氢的活动性顺序>>H—OH >C 2H 5—OH3.乙酸乙酯的制取(1)实验原理(2)实验装置(3)反应特点(4)反应条件及其意义①加热,主要目的是提高反应速率,其次是使生成的乙酸乙酯挥发而收集,使平衡向正反应方向移动,提高乙醇、乙酸的转化率。
②浓硫酸的作用:作催化剂,提高反应速率;作吸水剂,提高乙醇、乙酸的转化率。
③可适当增加乙醇的量,提高乙酸的转化率。
④有冷凝回流装置,可提高产率。
(5)饱和Na 2CO 3溶液的作用:降低乙酸乙酯的溶解度、中和乙酸、溶解乙醇。
(6)实验现象:在饱和Na 2CO 3溶液上方有透明的、具有香味的油状液体。
4.乙酸乙酯的水解反应在酸性或碱性条件下均可发生水解反应。
CH 3COOC 2H 5+H 2O稀硫酸△CH 3COOH +C 2H 5OH(可逆)CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH(完全)(1)用95%的酒精杀灭新冠病毒效果最好(×)错因:75%的医用酒精杀灭细菌、病毒的效果最好。
(2)乙醇、乙酸与Na 2CO 3溶液反应均产生CO 2(×)错因:乙醇没有酸性,不能与Na 2CO 3溶液反应。
(3)乙醇能与金属钠反应,说明在反应中乙醇分子断裂C—O 键而失去羟基(×)错因:乙醇与金属钠的反应是—OH 上的活泼氢原子被置换,C—O 键未发生变化。
(4)可用饱和Na 2CO 3溶液除去乙酸乙酯中的少量乙酸(√)完成下列各步转化的化学方程式,并指出反应类型。
①_________________________________________________;_______________________。
《乙醇、乙酸的主要性质》 说课稿

《乙醇、乙酸的主要性质》说课稿尊敬的各位评委、老师:大家好!今天我说课的内容是《乙醇、乙酸的主要性质》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析“乙醇、乙酸的主要性质”是高中化学必修第二册第七章第三节的内容。
这部分知识不仅是有机化学中的重要组成部分,也是日常生活和工业生产中经常接触到的物质。
通过对乙醇和乙酸性质的学习,学生可以进一步了解有机化合物的结构与性质之间的关系,为后续学习更复杂的有机化合物奠定基础。
在教材的编排上,先介绍乙醇的结构和性质,然后引入乙酸,通过实验探究和对比分析,让学生深入理解它们的性质差异。
同时,教材注重将化学知识与生活实际相联系,培养学生学以致用的能力。
二、学情分析学生在之前的学习中已经掌握了一些简单的有机化合物的知识,如甲烷、乙烯等,对有机物的结构和性质有了一定的认识。
但对于醇和酸的性质还比较陌生,需要通过实验和理论分析来加深理解。
此外,高中生具备一定的观察能力、实验操作能力和逻辑思维能力,但在知识的综合运用和自主探究方面还有待提高。
三、教学目标1、知识与技能目标(1)了解乙醇和乙酸的物理性质,掌握它们的化学性质。
(2)理解乙醇和乙酸的结构与性质的关系。
(3)学会乙醇和乙酸的检验方法。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、实验操作能力和分析解决问题的能力。
(2)通过对比分析,培养学生的逻辑思维能力和归纳总结能力。
3、情感态度与价值观目标(1)让学生感受化学与生活的密切联系,激发学生学习化学的兴趣。
(2)培养学生严谨的科学态度和合作精神。
四、教学重难点1、教学重点(1)乙醇和乙酸的化学性质。
(2)乙醇和乙酸的结构与性质的关系。
2、教学难点(1)乙醇的催化氧化和酯化反应的机理。
(2)乙酸酯化反应的实验操作和现象分析。
五、教法与学法1、教法(1)实验探究法:通过实验让学生直观地感受乙醇和乙酸的性质,激发学生的学习兴趣。
《乙醇、乙酸的主要性质》 说课稿

《乙醇、乙酸的主要性质》说课稿尊敬的各位评委老师:大家好!今天我说课的内容是“乙醇、乙酸的主要性质”。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析“乙醇、乙酸的主要性质”是高中化学必修第二册第七章第三节的内容。
这部分知识不仅是有机化学中的重要组成部分,也是后续学习其他有机化合物的基础。
乙醇和乙酸是生活中常见的有机化合物,学生在日常生活中已经对它们有了一定的感性认识。
教材通过实验探究、结构分析等方式,引导学生深入了解乙醇和乙酸的主要性质,将感性认识上升为理性认识,培养学生的观察能力、实验探究能力和逻辑思维能力。
二、学情分析学生在之前的学习中已经掌握了有机物的基本概念和一些简单有机物的性质,具备了一定的化学基础知识和实验技能。
但对于有机化合物的结构与性质之间的关系,学生的理解还不够深入,需要在本节课中进一步强化。
同时,高中生具备较强的好奇心和求知欲,喜欢通过实验探究来获取知识,但在实验设计和数据分析方面还需要进一步引导和培养。
三、教学目标1、知识与技能目标(1)了解乙醇的物理性质、分子结构和化学性质,尤其是乙醇的催化氧化和乙醇与钠的反应。
(2)掌握乙酸的物理性质、分子结构和化学性质,重点掌握乙酸的酸性和酯化反应。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、实验操作能力和分析问题、解决问题的能力。
(2)通过对乙醇和乙酸结构的分析,培养学生的逻辑思维能力和空间想象能力。
3、情感态度与价值观目标(1)让学生感受有机化学与生活的密切联系,激发学生学习化学的兴趣。
(2)培养学生的科学态度和创新精神,提高学生的环保意识。
四、教学重难点1、教学重点(1)乙醇的催化氧化和乙醇与钠的反应。
(2)乙酸的酸性和酯化反应。
2、教学难点(1)乙醇催化氧化的反应机理。
(2)酯化反应的反应机理和实验操作。
五、教法与学法1、教法(1)实验探究法:通过实验让学生直观地感受乙醇和乙酸的性质,激发学生的学习兴趣。
高中化学必修二 学习笔记 第7章 实验活动9 乙醇、乙酸的主要性质
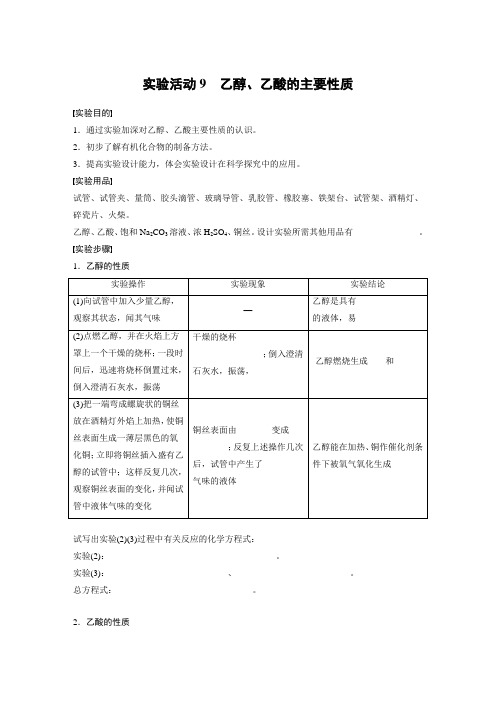
实验活动9乙醇、乙酸的主要性质实验目的1.通过实验加深对乙醇、乙酸主要性质的认识。
2.初步了解有机化合物的制备方法。
3.提高实验设计能力,体会实验设计在科学探究中的应用。
实验用品试管、试管夹、量筒、胶头滴管、玻璃导管、乳胶管、橡胶塞、铁架台、试管架、酒精灯、碎瓷片、火柴。
乙醇、乙酸、饱和Na2CO3溶液、浓H2SO4、铜丝。
设计实验所需其他用品有_______________。
实验步骤1.乙醇的性质实验操作实验现象实验结论(1)向试管中加入少量乙醇,观察其状态,闻其气味—乙醇是具有______________的液体,易________(2)点燃乙醇,并在火焰上方罩上一个干燥的烧杯;一段时间后,迅速将烧杯倒置过来,倒入澄清石灰水,振荡干燥的烧杯________________;倒入澄清石灰水,振荡,________________乙醇燃烧生成____和______(3)把一端弯成螺旋状的铜丝放在酒精灯外焰上加热,使铜丝表面生成一薄层黑色的氧化铜;立即将铜丝插入盛有乙醇的试管中;这样反复几次,观察铜丝表面的变化,并闻试管中液体气味的变化铜丝表面由________变成________;反复上述操作几次后,试管中产生了________气味的液体乙醇能在加热、铜作催化剂条件下被氧气氧化生成____试写出实验(2)(3)过程中有关反应的化学方程式:实验(2):______________________________________。
实验(3):___________________________、__________________________。
总方程式:_______________________________。
2.乙酸的性质实验操作(装置) 实验现象实验结论(1)向试管中加入少量乙酸,观察其状态,小心地闻其气味—乙酸是具有__________的液体,易________(2)①向一支试管中加入少量乙酸,将一小段镁条放入试管,观察现象②向一盛有少量饱和Na2CO3溶液的试管里,加入约3 mL 乙酸溶液,观察现象①镁条表面有____产生②试管里有______生成乙酸具有______,且比________酸性强(3)装有饱和Na2CO3溶液的试管内,有不溶于水的_________生成乙酸与乙醇在有浓硫酸存在并加热的条件下可以发生反应生成________________写出实验(2)(3)反应过程中相关反应的化学方程式:实验(2):________________________________、__________________________。
备战近年年高考化学高频考点解密15乙醇、乙酸及基本营养物质(含解析)(最新整理)
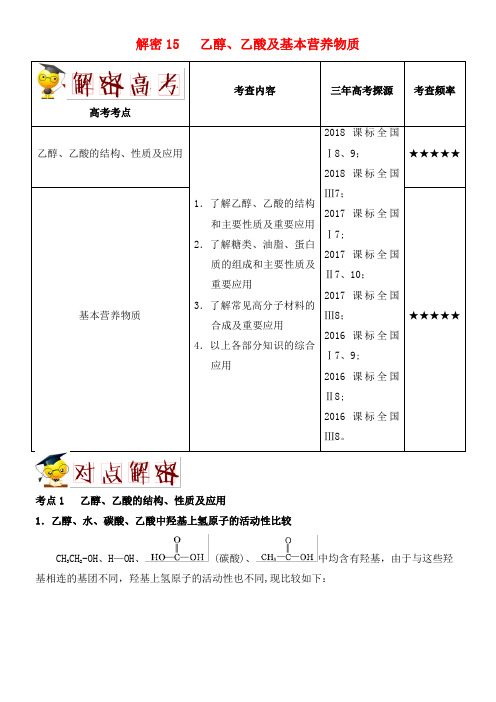
解密15 乙醇、乙酸及基本营养物质高考考点考点1 乙醇、乙酸的结构、性质及应用1.乙醇、水、碳酸、乙酸中羟基上氢原子的活动性比较CH3CH2-OH、H—OH、 (碳酸)、中均含有羟基,由于与这些羟基相连的基团不同,羟基上氢原子的活动性也不同,现比较如下:部分电离部分电离结论:羟基氢的活动性关系:羧酸中羧基氢(—OH)>水中羟基氢(-OH)〉醇中羟基氢(—OH).2.酯化反应在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2+H—O—C2H5(1)浓硫酸溶于乙醇或乙酸时会放出大量的热,因此,将乙醇、乙酸、浓硫酸混合时,一般先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后加入冰醋酸。
(2)浓硫酸的作用:催化剂、吸水剂.(3)为防止试管中液体在实验时暴沸,加热前应采取的措施:在试管中加入几块碎瓷片或沸石。
(4)玻璃导管的末端不要插入饱和Na2CO3溶液中,以防液体倒吸.(5)开始时要用小火均匀加热,加快反应速率,减少乙醇和乙酸的挥发;待有大量产物生成时,可大火加热,以便将产物蒸出。
(6)装置中的长导管起导气兼冷凝作用。
(7)欲提高乙酸的转化率,可采取的措施:①用浓H2SO4吸水,使平衡向正反应方向移动;②加热将酯蒸出;③可适当增加乙醇的量,并加装冷凝回流装置。
3.根据有机物结构推测有机物性质的方法第一步:确定官能团的种类,要注意碳碳双键等也属于官能团第二步:根据典型物质的性质,通过官能团判断该物质可能具有的化学性质.常见官能团及性质如下表所示。
1.1 mol醛基消耗2 mol Ag(NH3)2OH生成2 mol Ag单质、1 mol H2O、3 mol NH3;1 mol 甲醛消耗4 mol Ag(NH3)2OH.2.1 mol醛基消耗2 mol Cu(OH)2生成1 mol Cu2O沉淀、2 mol H2O。
3.和NaHCO3反应生成气体:1 mol —COOH生成1 mol CO2气体.4.和Na反应生成气体:1 mol -COOH生成0.5 mol H2;1 mol -OH生成0.5 mol H2.5.和NaOH反应:1 mol -COOH(或酚—OH,或-X)消耗1 mol NaOH;1 mol(R为链烃基)消耗1 mol NaOH;1 mol消耗2 mol NaOH。
乙醇和乙酸带详细解析

乙醇、乙酸的性质适用学科 化学 适用年级 初三 适用区域 华南地区课时时长(分钟)120知识点 1.乙醇的物理化学性质 2.乙酸的物理化学性质 教学目标1.掌握乙醇、乙酸的组成。
2.掌握乙醇、乙酸的主要性质和重要应用。
3.掌握酯化反应。
教学重点 乙醇、乙酸的主要性质和重要应用 教学难点酯化反应教学过程一、知识讲解考点一、乙醇1、物理性质乙醇是一种没有颜色、透明、有特殊香味的液体,密度比水小。
沸点为78℃。
乙醇易挥发,能够溶解多种无机物和有机物,能跟水任意比互溶。
2、乙醇的结构乙醇的分子式是:C 2H 6O ,结构式是:,结构简式:CH 3CH 2OH 或C 2H 5OH3、化学性质⑴乙醇与钠的反应:2CH 3CH 2OH+2Na →2CH 3CH 2ONa+H 2↑ ⑵乙醇的氧化反应①燃烧:CH 3CH 2OH+3O 2−−→−点燃2CO 2+3H 2O 乙醇在空气中燃烧时,发出淡蓝色的火焰,同时放出大量的热,是一种重要的液体燃料。
②催化氧化:2CH 3CH 2OH+O 22CH 3CHO+2H 2O③其他强氧化剂氧化:能被酸性高锰酸钾溶液或酸性重铬酸钾溶液所氧化,被直接氧化成乙酸(使酸性高锰酸钾的紫色褪去)。
考点二、乙酸1、乙酸的结构乙酸的分子式为C2H4O2,结构式是:,结构简式:CH3COOH2、物理性质乙酸俗称醋酸,是有强烈刺激性气味的无色液体,醋酸易溶于水和乙醇。
3、化学性质⑴乙酸具有明显的酸性,在水溶液里能部分电离,电离方程式CH3COOH CH3COO-+H+。
乙酸是一种弱酸,但比碳酸的酸性强,它具有酸的一切通性。
⑵酯化反应:制备乙酸乙酯的化学方程式:注意:酯化反应的机理一般是:羧酸分子中羧基上的羟基跟醇分子的羟基中的氢原子结合成水,其余部分互相结合成酯(酸脱羟基,醇脱氢)。
二、例题精析类型一、乙醇的结构与性质【典例1】比较乙烷和乙醇的分子结构,下列说法中错误的是()A.两个碳原子均以单键相连B.分子里都含6个相同的氢原子C.乙基与一个氢原子相连就是乙烷分子D.乙基与一个羟基相连就是乙醇分子【解题指南】解答本题应注意以下两点:(1)乙烷属于烃,而乙醇是乙烷的一个H原子被“—OH”取代后的烃的衍生物。
